一种NK细胞的培养基及培养方法与流程
一种nk细胞的培养基及培养方法
技术领域
1.本发明涉及细胞培养技术领域,尤其涉及一种nk细胞的培养基及培养方法。
背景技术:
2.nk细胞是目前已知的杀死发生肿瘤免疫编辑的肿瘤细胞的最主要的免疫细胞,是临床上进行肿瘤细胞免疫治疗的重要手段之一,临床研究表明,异体和自体的nk细胞免疫治疗是安全的。2009年卫生部就曾发布《自体免疫细胞(t细胞、nk细胞)治疗技术管理规范(征求意见稿)》,把nk细胞免疫治疗技术作为第三类医疗新技术列入了临床治疗的应用范围。但十年来,nk细胞治疗技术并没有在医院得到广泛的应用,在前期的一些临床试验中,自体nk细胞疗法临床应用的疗效并不明显,其中根本原因是,无法得到足够数量和活性的nk免疫细胞影响了nk细胞的治疗效果,可以想象,在肿瘤负荷较大的患者,如果回输的nk细胞90%的以上处于沉默状态,而不是激活状态,那它对肿瘤细胞肯定不能有很好的杀伤作用,另外根据体外试验证明当nk细胞与肿瘤细胞在效靶比为10:1时,杀伤效率可达到80%以上,但是如果回输的nk细胞量远远小于体内的肿瘤细胞量,这个治疗效果就会减弱。因此,如何在体外实现nk细胞大规模扩增培养是目前nk细胞治疗的关键问题。
3.目前,体外大规模扩增nk细胞的两种常用方法:
4.1、滋养细胞(k562细胞)刺激法
5.以基因工程手段构建滋养细胞,如cd8α-cd137-k562、4-1bbl-k562等,利用这种方法得到nk细胞纯度较高、倍数也较大,但是由于(1)涉及基因转染,成本和步骤较为复杂;(2)需要用到k562细胞(一种肿瘤细胞),使用者对其安全有一定的顾虑;(3)在nk细胞或者car-nk细胞进行药品注册的时候,需要对其进行安全性评价,滋养细胞为一个完整的细胞,涉及到的评价内容会非常复杂,极大的增加了安评的难度和支出。
6.2、因子刺激方法
7.传统的nk细胞体外扩增方法,利用一些细胞因子或者因子组合在体外刺激pbmc或者纯化的nk细胞,利用该方法得到的nk细胞一般纯度不高(nk细胞纯度不高意味着,其它杂细胞的含量高,比如t细胞,而t细胞为特异性细胞,如果回输进入人体,容易产生gvhd反应),倍数也不高(倍数不高意味着终产品中nk细胞的数量少,而数量少就不能达到治疗或者杀伤靶细胞的目的),也有极端一些的可以得到极高纯度的效应细胞,但是扩增倍数极低,即便延长培养时间也无法达到临床所需的数量。
技术实现要素:
8.有鉴于此,本发明提供了一种nk细胞的培养基及培养方法,利用该培养基可以在13天内可获得80%以上的nk细胞,平均扩增达4000倍以上,且杀伤活性不降低。
9.为了实现上述发明目的,本发明提供以下技术方案:
10.一种培养基,其特征在于,包括水、组分1和组分2;
11.所述组分1由氨基酸和细胞因子组成;
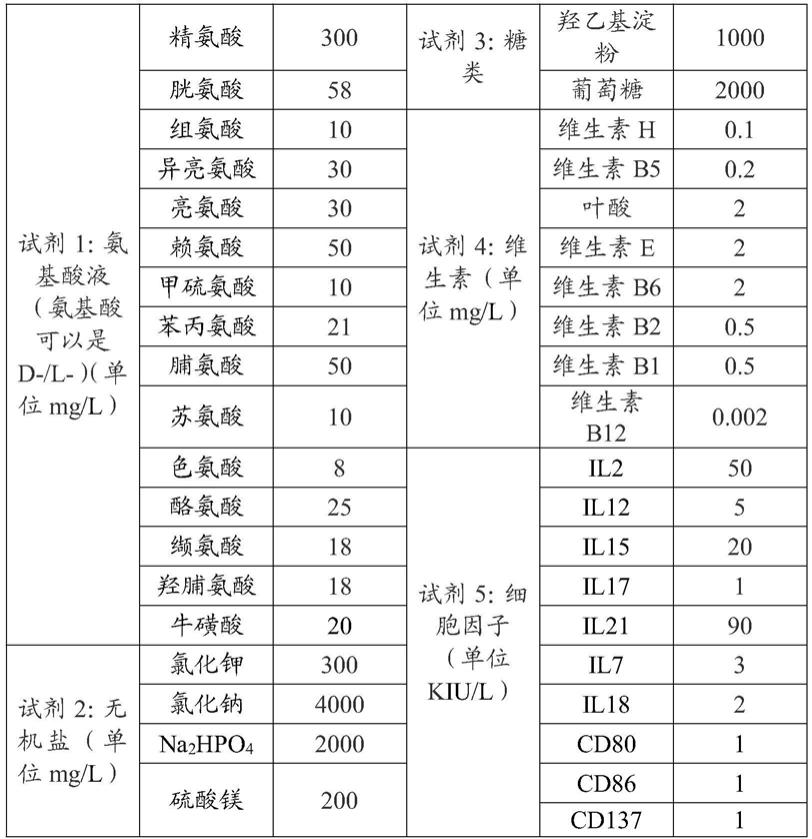
12.所述氨基酸由精氨酸、胱氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、苏氨酸、色氨酸、酪氨酸、缬氨酸、羟脯氨酸和牛磺酸组成;
13.所述细胞因子由il2、il12、il15、il17、il21、il7、il18、cd80、cd86和cd137组成;
14.所述组分2由无机盐、糖类和维生素中的至少两种组成。
15.一些实施方案中,所述组分1中各组分浓度如下:
16.所述氨基酸由精氨酸250~350mg/l、胱氨酸56~60mg/l、组氨酸8~12mg/l、异亮氨酸25~35mg/l、亮氨酸25~35mg/l、赖氨酸45~55mg/l、甲硫氨酸8~12mg/l、苯丙氨酸18~24mg/l、脯氨酸45~55mg/l、苏氨酸8~12mg/l、色氨酸6~10mg/l、酪氨酸22~28mg/l、缬氨酸16~20mg/l、羟脯氨酸10~18mg/l和牛磺酸18~22mg/l组成;
17.所述细胞因子由il2 40~60kiu/l、il12 4~6kiu/l、il15 15~25kiu/l、il17 0.8~1.2kiu/l、il21 85~95kiu/l、il7 2~4kiu/l、il18 1.5~2.5kiu/l、cd80 0.8~1.2kiu/l、cd86 0.8~1.2kiu/l和cd137 0.8~1.2kiu/l组成。
18.一些具体实施例中,所述组分1中各组分浓度如下:
19.所述氨基酸由精氨酸300mg/l、胱氨酸58mg/l、组氨酸10mg/l、异亮氨酸30mg/l、亮氨酸30mg/l、赖氨酸50mg/l、甲硫氨酸10mg/l、苯丙氨酸21mg/l、脯氨酸50mg/l、苏氨酸10mg/l、色氨酸8mg/l、酪氨酸25mg/l、缬氨酸18mg/l、羟脯氨酸18mg/l和牛磺酸20mg/l组成;
20.所述细胞因子由il2 50kiu/l、il12 5kiu/l、il15 20kiu/l、il17 1kiu/l、il21 90kiu/l、il7 3kiu/l、il18 2kiu/l、cd80 1kiu/l、cd86 1kiu/l和cd1371 kiu/l组成。
21.一些实施方案中,所述组分2中,所述糖类由羟乙基淀粉100~1000mg/l和葡萄糖200~2000mg/l组成;
22.所述维生素由维生素h 0.05~0.15mg/l、维生素b5 0.1~0.3mg/l、叶酸1.5~2.5mg/l、维生素e 1.5~2.5mg/l、维生素b6 1.5~2.5mg/l、维生素b2 0.4~0.6mg/l、维生素b1 0.4~0.6mg/l、维生素b12 0.001~0.03mg/l组成;
23.所述无机盐由氯化钾250~350mg/l、氯化钠3500~4500mg/l、na2hpo
4 1500~2500mg/l和硫酸镁150~250mg/l组成。
24.一些具体实施例中,所述组分2中,所述糖类由羟乙基淀粉1000mg/l和葡萄糖2000mg/l组成;
25.所述维生素由维生素h 0.1mg/l、维生素b5 0.2mg/l、叶酸2mg/l、维生素e 2mg/l、维生素b6 2mg/l、维生素b2 0.5mg/l、维生素b1 0.5mg/l、维生素b12 0.002mg/l组成;
26.所述无机盐由氯化钾300mg/l、氯化钠4000mg/l、na2hpo42000mg/l和硫酸镁200mg/l组成。
27.本发明还提供给了所述的培养基在pbmc或nk细胞的分离和/或培养中的应用。
28.本发明还提供一种nk细胞的培养方法,将pbmc或nk细胞接种至本发明所述的培养基中进行培养。
29.一些实施方案中,所述培养方法具体包括如下步骤:
30.将pbmc或nk细胞接种至所述的培养基中,培养3-7天待细胞颜色微黄时,离心;
31.取细胞沉淀加入所述培养基37℃温浴30min,然后转移至细胞培养袋中,加入所述培养基培养5~9天。
32.一些实施方案中,所述离心为400g离心,3~15min。一些具体实施例中,离心的时间具体可为3min/5min、10min或15min。
33.一些实施方案中,所述接种的密度为(1~10)
×
105cell/ml;一些具体实施例中,所述接种的密度具体可为1
×
105cell/ml、5
×
105cell/ml、6
×
105cell/ml或1
×
106cell/ml
34.一些实施方案中,所述培养的条件为37℃、co2浓度5~25%;一些具体实施例中,所述co2浓度为5%、10%、15%、20%或25%。
35.采用本发明提供的培养基培养nk细胞13天,获得的nk细胞(cd3-cd56+)平均纯度达到80%以上,平均扩增倍数达到4000倍以上(按照nk细胞占比pbmc7.5%计),细胞杀伤活性(效靶比为20:1)5小时杀伤80%以上。
附图说明
36.图1示实施例1培养基培养pbmc后获得的nk细胞的纯度;
37.图2示对照组7培养基培养pbmc后获得的nk细胞的纯度;
38.图3示实施例4培养基培养pbmc后获得的nk细胞的纯度。
具体实施方式
39.本发明提供了一种nk细胞的培养基及培养方法。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
40.本发明采用的试材皆为普通市售品,皆可于市场购得。
41.如无特殊说明,本发明采用的试材皆为普通市售品,皆可于市场购得。
42.下面结合实施例,进一步阐述本发明:
43.实施例1
44.培养基由水和表1组分组成:
45.表1
[0046][0047]
将试剂1~试剂4分别用去离子水溶解,混匀,使用前加入试剂5,表1中为培养基中各组分的终浓度。
[0048]
按照常规方法分离提取pbmc细胞进行培养,实验设置对照组和实验组:
[0049]
实验组:将pbmc细胞以6
×
105cell/ml的密度接种至实施例1的培养基,37℃培养3-7天(具体时间根据细胞悬液颜色确定),当细胞颜色微黄时,离心换液(400g),在细胞沉淀中加入适量所述培养基,37℃温浴30min,转移至细胞培养袋中,加入足够的培养基,继续培养到13天,收集nk细胞。
[0050]
对照组1:培养基为:rpmi-1640培养基+本发明实施例1中试剂5的细胞因子。
[0051]
对照组1的培养方法:将pbmc细胞以6
×
105cell/ml的密度接种至对照组培养基,37℃培养3-7天,离心换液(400g),在细胞沉淀中加入适量所述培养基,37℃温浴30min,转移至细胞培养袋中,加入足够的培养基,继续培养到13天,收集nk细胞。
[0052]
用自动细胞计数仪对扩增的nk细胞进行计数,并绘制曲线。利用多色流式细胞分析仪检测nk细胞的纯度,结果见表2和表3,其中,细胞数量和纯度均为30批次试验的平均值。某一实验批次的纯度检测结果见图1。
[0053]
表2
[0054][0055]
表3对照组1的培养结果
[0056][0057]
由表2和表3可以看出,采用本发明的培养基培养pbmc细胞,13天可获得90%以上的nk细胞,平均扩增达5457倍;且杀伤活性不降低,效靶比为20:1,5小时杀伤80%以上。对照组1的培养基13天获得40%左右的nk细胞,平均扩增为140倍。
[0058]
实施例2~4
[0059]
本实施例考察了培养基中不同成分对nk细胞培养的影响,实验设置实验组和对照组,其中:
[0060]
实验组:实施例2~4培养基;
[0061]
对照组:对照组2~12培养基;
[0062]
各培养基组成见表4,其中,试剂1~5的具体组成同实施例1。
[0063]
培养方法:将pbmc细胞以6
×
105/ml的密度接种至培养基,37℃培养3-7天,离心换液(400g),在细胞沉淀中加入适量所述培养基,37℃温浴30min,转移至细胞培养袋中,加入足够的培养基,继续培养到13天,收集nk细胞。
[0064]
按照以上培养基组成及培养方法培养pbmc细胞,起始培养的pbmc细胞同实施例1,培养到13天,收集nk细胞,用自动细胞计数仪对扩增的nk细胞进行计数,利用多色流式细胞分析仪检测nk细胞的纯度,结果见表4。其中,对照组7的纯度(nk细胞纯度为41.02%)检测结果见图2,实施例4的纯度检测结果见图3(nk细胞纯度为83.01%)。
[0065]
表4
[0066][0067]
注:“/”表示nk细胞数量无明显变化,无扩增效果。
[0068]
以上结果显示,对照组nk细胞的扩增倍数和纯度均显著低于实验组(实施例2~4),其中,实验组(实施例2~4)的nk细胞(cd3-cd56+)平均纯度达到80%以上,平均扩增倍数达到2695倍;而对照组(对照组2~12)的平均纯度在38~40%之间,平均扩增倍数为115倍。
[0069]
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1