一种创制早熟玉米种质的方法及其应用
1.本发明涉及植物基因工程领域,具体涉及一种创制早熟玉米种质的方法及其应用。
背景技术:
2.基因组编辑是一种对基因组进行定向精确修饰的技术,主要包括锌指核酸酶(zinc-finger nucleases,zfns),类转录激活因子效应物核酸酶(transcription activator-like effector nucleases,talens)和规律成簇的间隔短回文重复系统(clustered regularly interspaced short palindromic repeats/crispr-associated nuclease,crispr/cas)。crispr/cas系统大致分为ⅰ型、ⅱ型和ⅲ型3类,其中ii型系统的组成比较简单,只需要cas9蛋白、tracrrna和crrna 3种成分即可发挥作用,且具有高效性和易操作性,成为目前应用最广泛的基因组编辑系统。ii型crispr/cas系统的特征蛋白为cas9,cas9蛋白具有ruvc和hnh两个核酸酶结构域,该结构域负责切割靶dna的两条链,从而造成靶dna双链断裂。其中hnh结构域负责切割与crrna互补的dna链,切割位点位于原型间隔序列毗邻基序(protospacer adjacent motif,pam)上游3bp处,ruvc结构域则负责切割非互补链,切割位点位于pam上游3
–
8bp处。cas9蛋白同时具有加工产生crrna以及切割外源核酸的功能。crrna通过碱基配对与tracrrna结合形成tracrrna/crrna复合物,研究者可以将tracrrna和crrna作为两种向导rna(grna)或者将两者融合在一起形成单向导rna(single guide rna,sgrna)。sgrna能够与cas9核酸内切酶结合并将cas9引导至基因组上对靶位点进行切割。crispr/cas9系统使目标基因dna产生双链断裂,激活细胞内的dna损伤修复机制,进而产生缺失、敲入等变异。目前,crispr/cas9系统已被迅速地用于拟南芥、烟草、高粱、水稻、小麦、玉米等不同植物基因组的定向编辑研究中,并且获得了较高的诱导突变率和可稳定遗传的基因组编辑植株。
3.玉米(zea mays l.)是重要的粮食和饲料作物,也是现代食品和化学工业的原料。其正常花序由雌穗和雄穗两部分组成,发育阶段大致分为两步:开花期的转换以及花的发育,具体发育可分为三个阶段开花诱导(the floral induction phase)、花原基形成(the floral primodia phase)和花器官发育(the floral organs development phase),相对应的调控基因包括:开花时间基因(flowering time genes)、分生组织特征基因(metristem identity genes)和花器官特征基因(organ identity genes)。其中开花诱导至关重要,开花时间对玉米成熟的早晚以及种质的发育具有显著的影响作用。玉米基因组感受光周期的constans like基因
‑‑
zmcct家族成员众多,其中数个zmcct家族成员,如zmcct10、zmcct9、以及zmcol3等被分别证明为感受光周期信号传导的constans like基因,具有较强光周期反应生物学效应的主效基因。
4.此外,cn104869808a公开了控制玉蜀黍和高粱的光周期敏感性的基因以及所述基因的用途,并提到了zmcct10多肽包含constans、constans-like、toc1(cct)结构域,通过下调编码上述结构域的多肽的内源性基因的表达,可以降低植物的光周期敏感性。不过,上述
的结构域主要指zmcct10基因的启动子区域。
技术实现要素:
5.本发明利用基因编辑技术,提供了用于创制早熟玉米种质的基因敲除载体及方法,其能够敲除玉米基因zmcct10(zm00001d024909)的编码区域,改良zmcct10基因的结构,快速创制早熟玉米种质。
6.具体而言,用于创制早熟玉米种质的sgrna,包括:
7.序列如seq id no.1所示的特异性靶向玉米基因zmcct10的sgrna。
8.本发明进一步提供含有所述的sgrna的crispr/cas9基因敲除载体。
9.作为优选,所述crispr/cas9基因敲除载体为连接有所述的sgrna的cpb-ubi-hspcas9载体。
10.本发明进一步提供用于创制早熟玉米种质的试剂盒,包括如下任一种:
11.1)所述的sgrna;
12.2)所述sgrna的编码dna分子;
13.3)所述的crispr/cas9基因敲除载体。
14.本发明进一步提供所述的sgrna或所述的crispr/cas9基因敲除载体或所述的试剂盒在敲除玉米基因zmcct10中的应用。
15.本发明进一步提供所述的sgrna或所述的crispr/cas9基因敲除载体或所述的试剂盒在创制早熟玉米种质中的应用。
16.本发明进一步提供所述的sgrna或所述的crispr/cas9基因敲除载体或所述的试剂盒在降低玉米光周期敏感性中的应用。
17.本发明进一步提供所述的sgrna或所述的crispr/cas9基因敲除载体或所述的试剂盒在提早玉米的开花时间中的应用。
18.本发明还提供一种创制早熟玉米种质的方法,包括:
19.将所述的crispr/cas9基因敲除载体导入bmeha105农杆菌感受态细胞,得到重组农杆菌;用所述重组农杆菌侵染玉米的愈伤组织;而后将得到的阳性愈伤组织诱导培养获得再生植株。
20.本发明进一步提供用于检测与早熟玉米种质相关的基因的突变效果的引物组合,包括:序列如seq id no.2-3所示的引物。
21.基于上述技术方案,本发明的有益效果如下:
22.本发明所提供的sgrna和crispr/cas9敲除载体可以显著提高对玉米基因zmcct10的打靶效率,有效降低玉米的光周期敏感性,并提早玉米的开花时间,从而能够快速创制早熟玉米种质。
附图说明
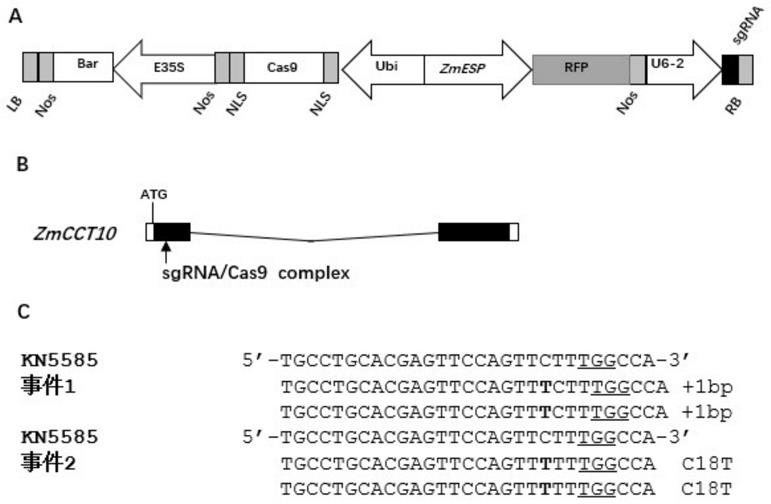
23.图1为本发明实施例的基因编辑载体及突变鉴定;其中,a图和b图为基因编辑载体;c图为sgrna结合的区域所发生的突变。
24.图2为zmcct10基因突变前后的花期比较;各时期结果图中,最左侧为野生型的结果,其他为实施例中所获得的两个突变事件的结果;图中,*表示p<0.05,差异显著;**表示
p<0.01,差异极显著。
具体实施方式
25.以下实施例用于说明本发明,但不用来限制本发明的范围。
26.实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购买得到的常规产品。
27.实施例
28.1材料与方法
29.1.1受体材料
30.遗传转化受体为玉米自交系kn5585。
31.1.2载体、菌株和主要试剂
32.基因编辑基础载体为cpb-ubi-hspcas9。-bluntsimple cloning vector,大肠杆菌菌株trans1-t1等购自北京全式金生物技术有限公司。hind iii限制性内切酶(neb)、kod plus和kod fx高保真pcr扩增酶等主要购自北京百灵克生物科技有限责任公司,北京六合通经贸有限公司等公司。
33.1.3 crispr/cas9敲除载体的构建
34.crispr/cas9敲除载体如图1中a图。玉米内源性u6-2启动子用于启动sgrna表达。参考基因组序列b73_refgen_v4中zmcct10(zm00001d024909)基因设计grna,其序列为5
’‑
ctgcacgagttccagttctt-3’(seq id no.1)。grna序列在kn5585受体中经sanger测序验证。
35.1.4玉米遗传转化
36.(1)构建crispr/cas9敲除载体并导入bmeha105农杆菌感受态细胞(北京博迈德基因技术有限公司,货号:bc303-01),得到重组菌。
37.(2)采用n6液体培养基培养步骤1得到的重组农杆菌,得到菌液od
600nm
为0.8的重组农杆菌菌液,5000r/min离心10min,收集菌体,用配好的侵染buffer(1l侵染buffer是将4g含n6 vitamin的n6盐,2mg 2,4-d,100mg肌醇,0.7gl-脯氨酸,68.4g蔗糖,36g葡萄糖,1ml agno3(10mg/ml),1ml as(100mol/l)和水混匀得到的,ph 5.2)悬浮菌体,使od
600nm
值为0.5左右,然后28℃、150r/min震荡0.5h,得到侵染液。
38.(3)将玉米自交系kn5585长势良好的愈伤组织在侵染buffer中浸泡1h,然后转移至步骤2制备的侵染液中浸泡15min,晾干。
39.(4)将步骤3侵染后的愈伤组织放至共培养基(1l共培养基是将4g含n6vitamin的n6盐,2mg2,4-d,30g蔗糖,8g琼脂,1ml agno3(10mg/ml),1ml as(100mol/l),3ml l-半胱氨酸(100mg/ml)和水混匀得到的,ph5.8),20℃培养3天,转至恢复培养基(1l恢复培养基是将4g n6盐,1mln6 vitamin1000
×
,1.5mg 2,4-d,0.7gl-脯氨酸,30g蔗糖,5μm agno3,0.5g mes,100mg头孢噻肟,100mg万古霉素,8g琼脂和水混匀得到的,ph5.8),28℃培养10天,然后转至含有1.5mg/l草铵膦的恢复培养基,28℃暗培养7天,筛选阳性愈伤组织。
40.(5)将步骤4得到的阳性愈伤组织转至诱导胚状体培养基(1l诱导胚状体培养基是将4.43g含ms vitamin(含肌醇)的ms盐,0.25mg2,4-d,30g蔗糖,5mg6-ba,4g植物凝胶,1mlcefo(250mg/ml)和水混匀得到的,ph5.8),暗培养2周,然后转至分化培养基(1l分化培
养基是将4.43g含ms vitamin(含肌醇)的ms盐,30g蔗糖,4g植物凝胶,1ml cefo(250mg/ml)和水混匀得到的,ph5.8)待长出绿苗后转移至生根培养基(1l生根培养基是将2.215g1/2ms,30g蔗糖,51.55mg msvitamin,4g植物凝胶和水混匀得到的,ph5.8)生根,长到一定高度,暴露在空气中培养3天,移苗。
41.(6)取植株叶片3厘米左右,放入管中研磨充分,加入500μl的buffer(来自bar基因检测试纸条),插入bar基因检测试纸条(北京奥创金标生物技术有限公司,货号:a07-13-413),出现阳性条带的植株就为t0代阳性植株。
42.1.5转基因成分验证
43.利用植物基因组dna提取试剂盒(tiangen,china)提取和纯化dna。通过bar试纸条(agdia,cat.#stx14200/0012,us)和spcas9基因的pcr检测t-dna。spcas9 pcr扩增使用5'-caaccggaaagtgaccgtga-3'(seq id no.4)的正向引物和5'-caccaccttcactgtctgca-3'(seq id no.5)的反向引物。pcr程序包括94℃3min;95℃30s,58℃30s,68℃20s的35个循环;最后68℃延伸10min。
44.1.6突变检测
45.根据敲除载体的靶标位置设计引物,通过pcr对相应的植株进行靶基因扩增,测序后用dsdecode软件分析突变类型。pcr反应体系及反应程序同转基因成分验证。其中,zmcct10(zm00001d024909)基因靶位点序列特异pcr引物为5
’‑
ctctatcgatcaacagcggc-3’(seq id no.2)和5
’‑
cgggagcaatacttacgatg-3’(seq id no.3)。
46.2结果与分析
47.2.1 crispr/cas9敲除载体构建及遗传转化
48.本发明成功构建了敲除玉米zmcct10基因的敲除载体(图1中a图,b图)。通过农杆菌介导的遗传转化,获得了阳性转化事件。通过pcr扩增和sanger测序,发现在sgrna区域发生了突变,并且获得了移码突变(图1中c图),突变的类型包括zmcct10基因增加1个碱基和替换c-t。
49.2.2玉米植株开花期测定
50.通过田间种植并观察开花期发现,zmcct10基因突变后,在北京开花期提前1-2天(图2)。
51.虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1