用于实现手术导航和微小转移瘤成像的小分子化学发光探针及其制备方法和用途
1.本发明涉及小分子探针及其制备方法和用途,特别涉及用于实现手术导航和微小转移瘤成像的小分子化学发光探针及其制备方法和用途。
背景技术:
2.肿瘤因其较高的死亡率严重威胁到人类健康。为了对肿瘤进行有效治疗,许多临床治疗方案被相继开发出来,例如:化学疗法、光热疗法(ptt)、光动力疗法(pdt)以及手术疗法等。其中,手术切除仍是目前治疗恶性肿瘤的首选。然而,由于微小的肿瘤病灶在手术中很容易被忽略,导致肿瘤手术切除后的病人有很高的恶性转移率。因此,开发能够有效区分肿瘤病变和正常组织的技术对于防止手术后癌症复发至关重要。
3.手术导航(igs)是外科医生在手术中追踪肿瘤病灶的一种补充性成像技术,可以有效的辅助外科医生对不易观察的肿瘤组织进行精准定位和有效清除,进而大幅降低肿瘤的复发。迄今为止,许多成像技术,包括磁共振成像(mri)、计算机断层扫描(ct)、正电子发射断层扫描(pet)、超声波(us)、单光子计算机断层扫描(spect)和光学成像已被成功应用到了手术导航的临床中。其中光学成像技术因其具有高灵敏度、高时空分辨率以及相对较低的成本而成为临床实践中最具前景的工具之一。但是,目前被用于手术导航的光学成像大多局限于荧光探针,该类探针需要外界激光光源的激发才可产生信号,而人体的组织在激光的照射下往往也会产生自发光的现象,因而大大降低荧光探针的分辨率。于此同时,在一些复杂的手术中,长时间的激光照射又不可避免的引起正常组织的光毒性和光热效应诱发的组织灼伤,进而给病人带来不必要的痛苦。
4.与传统的荧光成像相比,化学发光(cl)成像可以通过化学刺激引发的分子能级变化自发产生信号,而不需要外界光源激发。因此,其可有效避免上述荧光探针在手术导航中产生的自发光现象,提高对肿瘤病灶的分辨率。于此同时,化学发光产生的能量较低,长时间的成像也不会因光毒性和光热效应对正常组织产生危害。但目前为止,尚无用于手术导航的化学发光探针的报道。
技术实现要素:
5.发明目的:本发明的目的是提供用于实现手术导航和微小转移瘤成像的小分子化学发光探针。
6.本发明的目的是提供所述用于实现手术导航和微小转移瘤成像的小分子化学发光探针的制备方法和用途。
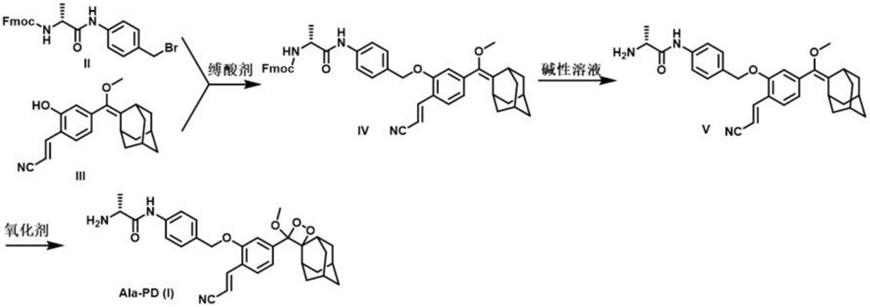
7.技术方案:本发明所述的用于实现手术导航和微小转移瘤成像的小分子化学发光探针(ala-pd),结构如(i)式:
[0008][0009]
所述的用于实现手术导航和微小转移瘤成像的小分子化学发光探针的制备方法,工艺如下:
[0010][0011]
(1)化合物(ii)和化合物(iii)在缚酸剂的作用下,在有机溶剂中反应得到化合物(iv);
[0012]
(2)化合物(iv)于碱性溶液中水解得到化合物(v);
[0013]
(3)化合物(v)在氧化剂的作用下于有机溶液中氧化得到式(i)所示的小分子化学发光探针(ala-pd)。
[0014]
进一步地,所述合成步骤中的缚酸剂可独立选自:无水碳酸钾、无水碳酸钠、碳酸氢钾、碳酸氢钠、三乙胺、n,n-二异丙基乙胺、氢氧化钾、氢氧化钠、哌啶、吡啶、哌嗪、咪唑、碳酸铯、dbu、氢化钠,其中优选:无水碳酸钾、无水碳酸钠、三乙胺;其所述合成步骤中的有机溶剂可独立选自:甲醇、乙醇、异丙醇、丙酮、乙酸乙酯、二氯甲烷、dmf、dmso、四氢呋喃、氯仿、乙醚、甲基叔丁醚,其中优选:dmf、dmso、四氢呋喃;所述合成步骤中的反应温度可独立选自0-100℃下任意反应温度,其中优选10-50℃;
[0015][0016]
所述的合成步骤中所述的碱性溶液可独立选自:哌啶/甲醇(5-10%v/v)、哌啶/乙醇(5-10%v/v)、哌啶/四氢呋喃(5-10%w/w)、吡啶/乙醇(5-10%w/w)、吡啶/甲醇(5-10%w/w)、哌嗪/四氢呋喃(5-10%w/w)、哌嗪/乙醇(5-10%w/w),其中优选:哌啶/dmf(5-10%v/v)、哌啶/甲醇(5-10%w/w);所述的合成步骤中的反应温度可独立选自-78-50℃下任意反应温度,其中优选-10-30℃;
[0017][0018]
所述的氧化剂可独立选自亚甲基蓝、fremy’s盐、过氧化氢溶液、重铬酸钾、三氧化铬、过氧苯甲酸、间氯过氧苯甲酸,其中优选亚甲基蓝、间氯过氧苯甲酸;所述的合成步骤中的反应溶剂可独立选自:甲醇、乙醇、异丙醇、丙酮、乙酸乙酯、二氯甲烷、dmf、dmso、四氢呋喃、氯仿、乙醚、甲基叔丁醚;其中优选二氯甲烷、四氢呋喃;所述的合成步骤中的反应温度可独立选自-30-100℃下任意反应温度,其中优选0-30℃;
[0019][0020]
所述的用于实现手术导航和微小转移瘤成像的小分子化学发光探针(ala-pd)在实体瘤高选择性、高分辨率成像中的应用。
[0021]
所述的用于实现手术导航和微小转移瘤成像的小分子化学发光探针(ala-pd)在实体瘤检测及手术导航中的应用。
[0022]
所述的用于实现手术导航和微小转移瘤成像的小分子化学发光探针(ala-pd)在微小转移瘤组织检测中的应用。
[0023]
所述的用于实现手术导航和微小转移瘤成像的小分子化学发光探针(ala-pd)通过对肿瘤及周围组织直接喷洒的给药方式进行给药。
[0024]
有益效果:本发明与现有技术相比,具有如下优势:
[0025]
1)本发明的化学发光小分子探针ala-pd与现有的用于手术导航的荧光探针相比,不会产生生物自发光的现象,进而对肿瘤组织具有更高的分辨率;
[0026]
2)本发明的化学发光小分子探针ala-pd与现有的用于手术导航的荧光探针相比,不会产生光毒性,因而具有更好的使用安全性;
[0027]
3)本发明的化学发光小分子探针ala-pd与现有的用于手术导航的荧光探针相比,不会因光热效应导致正常组织的灼伤,从而具有更好的适用性;
[0028]
4)本发明的化学发光小分子探针ala-pd与现有的用于手术导航的荧光探针相比简单易得,仅通过缩合反应、水解反应以及氧化反应等三步常规合成步骤就可制备得到。
附图说明
[0029]
图1探针ala-pd(i)的发光机理;
[0030]
图2化合物iv的核磁氢谱图;
[0031]
图3化合物iv的核磁碳谱图;
[0032]
图4探针ala-pd(i)的核磁氢谱图;
[0033]
图5探针ala-pd(i)的核磁碳谱图;
[0034]
图6本发明中化学发光探针ala-pd(i)和cd13/氨基肽酶(apn)孵育前(虚线)以及在37℃下孵育6小时后(实线)的紫外(黑色)和荧光(红色)图谱;
[0035]
图7本发明中化学发光探针ala-pd(i)和cd13/氨基肽酶(apn)孵育前以及在37℃
下孵育6小时后的hplc图谱;
[0036]
图8本发明中化学发光探针ala-pd(i)和cd13/氨基肽酶(apn)孵育前(左侧图)以及在37℃下孵育6小时后(右侧图)的质谱图;
[0037]
图9本发明中化学发光探针ala-pd(i)在无cd13/氨基肽酶(apn)(黑色)以及有cd13/氨基肽酶(apn)(红色)存在下的培养液中孵育300min的化学发光图谱;
[0038]
图10a)借助ivis lumia xr iii system,对不同浓度cd13/氨基肽酶(apn)(0,0.78,1.56,3.12,6.25,12.5,25,50,100and 200ng/ml)与探针ala-pd(10μm)在37℃下孵育30min后的化学发光图;b)针对a)图中apn溶液浓度与荧光强度的线性拟合曲线图.
[0039]
图11本发明中化学发光探针ala-pd(i)的选择性实验统计图;
[0040]
图12a)用乌苯美司(ube)对apn活性的抑制检测;b)对a)图所示的平均化学发光强度的定量分析,***p<0.001;
[0041]
图13a)hepg-2细胞和b)l02细胞用不同浓度(0、10、20、30、40和50μm)的ala-pd处理24小时后的细胞活力;
[0042]
图14在不同的ph值(ph=4-10)下,ala-pd在tris缓冲液中与或不与apn孵化60分钟后的化学发光强度变化。数值为平均值
±
sd(n=3)(图谱是在ivis lumia xr iii系统上获得的);
[0043]
图15a)借助ivis lumia xr iii system,对不同hepg-2细胞数量(0,200,500,1000,2000,5000,10000,20000,40000)与探针ala-pd(10μm)在37℃下孵育30min后的化学发光图;b)针对a)图中hepg-2细胞数量与荧光强度的线性拟合曲线图;
[0044]
图16a)apn在hepg-2细胞和l02细胞中的表达水平的westernblot检测结果;b)图a)中apn的表达水平的统计图;
[0045]
图17a)含有或不含抑制剂的hepg-2细胞和lo2细胞在37℃下与ala-pd(10μm)孵育30分钟后,cl强度的归一化图像,图像是在ivis lumia xr iii系统上获得的;b)定量分析a)中所示细胞的平均化学发光强度;
[0046]
图18a)向hepg-2肿瘤裸鼠的肿瘤组织、uber(10mm,50μl)预处理的肿瘤组织、以及正常小鼠的正常组织,通过喷洒ala-pd(100μm,200μl)的方式实施体内化学发光成像;b)用ala-pd或ala-pd加ube(10mm)处理后小鼠肿瘤的平均cl强度。数值为平均值
±
sd(n=3);
[0047]
图19通过对hepg-2肿瘤裸鼠进行喷洒ala-pd的方式实施皮下瘤的手术导航;
[0048]
图20a)向4t1肿瘤白鼠的原位瘤组织、正常组织以及uber(10mm,50μl)预处理的原位瘤组织,通过喷洒ala-pd(100μm,200μl)的方式实施体内化学发光成像;b)用ala-pd或ala-pd加ube(10mm)处理后小鼠肿瘤的平均cl强度,数值为平均值
±
sd(n=3);
[0049]
图21通过对4t1肿瘤白鼠进行喷洒ala-pd的方式实施原位瘤手术导航;
[0050]
图22a)ala-pd对转移瘤成像示意图;b)明场下小鼠不同器官(肝、脾、心、肾、肺、肿瘤,插图:肺部细节)图像;c)图b)的化学发光成像;d)统计荧光强度。
具体实施方式
[0051]
实施例1:中间体(iv)的制备:
[0052]
于100ml单口瓶中加入化合物(ii)(2.0g,4.2mmol)、化合物(iii)(0.7,2.1mmol)、无水碳酸钾(0.6,4.2mmol)以及dmf 30ml。加毕,氩气保护下室温反应1h,tlc监测。反应毕,
将反应液倒入水中,所得水溶液用乙酸乙酯萃取三次,合并有机相。所得有机相用饱和食盐水洗一次,无水硫酸钠干燥,旋去溶剂的黄色油状物粗品,所得粗品经制备液相纯化得无色透明油状化合物(iv)2.6g,收率为87%。1h nmr(500mhz,cdcl3)δ7.79(d,2h,j=7.4hz,ar-h),7.63-7.60(m,3h,ar-h and ch=chcn),7.43-7.36(m,4h,ar-h),7.32-7.31(m,2h,ar-h),8.03(s,1h,ar-h),6.98(d,1h,j=7.8hz,ar-h),6.07(d,1h,j=hz,ch=chcn),4.47(d,2h,j=6.7hz,ch2o),4.24(t,1h,j=6.8hz,phchph),4.17(q,1h,j=7.0hz,nhchch3),3.33(s,3h,och3),2.03-1.82(m,14h,adamantane-h),1.53(d,j=6.2hz,ch3ch),;
13
c nmr(125mhz,cdcl3)δ170.68,157.14,146.06,143.61,142.70,141.27,139.95,134.08,131.82,128.44,127.75,127.07,124.97,122.24,121.85,120.17,119.99,119.09,113.24,96.63,70.17,60.38,57.99,47.07,39.19,39.03,32.41,30.43,30.31,28.19,14.06.ms(esi):m/z 720.3[m+h]
+
.
[0053]
实施例2:中间体(v)的制备:
[0054]
于100ml单口瓶中加入中间体(iv)(1.0g,1.4mmol)和5%的哌啶dmf溶液20ml,加毕,室温下搅拌1h。反应毕,将反应液倒入水中,用5%的稀盐酸调ph至5-6,再用乙酸乙酯萃取三次,合并有机相。所得有机相用饱和碳酸氢钠洗涤一次,饱和食盐水洗一次,无水硫酸钠干燥。旋干溶剂后,得中间体(v)0.6g,收率为91%。所得化合物无需纯化直接进行下一步反应。ms(esi):m/z 498.1[m+h]
+
.
[0055]
实施例3.化学发光探针ala-pd的制备:
[0056]
于100ml单口瓶中加入中间体(v)(0.5g,1.0mmol),亚甲基蓝(20mg),二氯甲烷。在氧气环境中室温下黄光照射过夜。反应毕,将反应液倒入水中,乙酸乙酯萃取三次。合并有机相,所得有机相用饱和食盐水洗涤一次,无水硫酸钠干燥。减压旋去溶剂,得蓝色油状物。所得粗品经制备液相纯化得无色透明状探针ala-pd 0.3g,收率为57%。1h nmr(500mhz,cdcl3)δ7.66-7.56(m,4h,ar-h and ch=chcn),7.41(d,1h,j=hz,ar-h),7.33(d,3h,j=8.0hz,ar-h),6.07(d,j=16.8hz,ch=chcn),5.16-5.08(m,2h,ch2ph),3.77-3.72(nhch),3.16(s,och3),1.98-1.53(m,14h,adamantane-h),1.43(d,3h,j=6.8hz,chch3);
13
c nmr(125mhz,cdcl3)δ172.93,162.58,156.94,145.61,139.12,137.99,131.19,128.76,128.41,123.63,119.75,118.64,111.51,98.11,95.54,70.42,50.93,49.90,39.19,36.42,36.23,34.70,33.13,32.16,31.63,31.44,31.37,25.91,25.75,20.73.;ms(esi):552.2[m+h]
+
.
[0057]
实施例4.将适量的ala-pd溶解在缓冲液(含1
‰
dmso的tris缓冲液,ph 7.0)中,制备得到反应液。将溶解ala-pd的反应液(10μm,200μl)与apn(100ng/ml)在37℃下孵育30分钟。通过紫外分光光度计(uv-2600,日本岛津)和分光荧光光度计(duetta,日本horiba)分别检测ala-pd与apn孵育前和孵育后的反应液,获得紫外吸收光谱和荧光光谱。再用hplc和esi-ms分别检测上述孵育前后的反应液,获得液相图谱和质谱图;
[0058]
图6的结果表明,ala-pd和apn作用后的紫外和荧光均发生显著的变化,说明apn可以有效作用于探针ala-pd;图7的hplc图谱进一步验证了图6的结果;图8的质谱结果发现ala-pd和apn作用后主要生成了产物4-(2-氰基乙烯基)-3-羟基苯甲酸甲酯,这一结果证实了图1中展示的ala-pd的发光机理。
[0059]
实施例5.用酶标仪实时监测ala-pd的反应液(10μm,200μl)与apn(100ng/ml)在37
℃下孵育240min的化学发光强度变化;再将ala-pd与pbs溶液以上述相同条件于37℃下共孵育240min,并用酶标仪实时监测其化学发光强度的变化,作为空白对照数据。
[0060]
图9的结果表明,在apn的作用下,探针ala-pd可以被有效激活,其化学发光强度显著增加约26倍左右。
[0061]
实施例6.将ala-pd的反应液(10μm,200μl)分别与不同浓度的apn溶液(0,0.78,1.56,3.12,6.25,12.5,25,50,100以及200ng/ml)37℃下共孵育30min,再通过小动物成像仪(ivis lumia xr iii system)对孵育液进行成像,并根据所得apn的浓度和荧光强度拟合线性曲线。
[0062]
从图10a的成像结果表明,随着apn浓度的增加,探针ala-pd的荧光强度显著增强;于此同时,从拟合曲线图10b的结果可以看出,探针ala-pd对的荧光强度和apn的浓度成较好的线性关系,且ala-pd针对apn表现出较低的检测限(lod=0.531ng/ml),进而说明探针ala-pd在进行化学发光成像时具有较高的灵敏度。
[0063]
实施例7.将ala-pd的反应液(10μm,200μl)分别与500μm的常见生理活性物质(1:blank.2:only ala-pd.3:nh
4+
.4:k
+
.5:na
+
.6:ca
2+
.7:mg
2+
.8:co
32-.9:hco
3-.10:so
42-.11:hpo
42-.12:ch3coo-.13:l-ile(100μm).14:l-met(100μm).15:l-cys(100μm).16:l-glu(100μm).17:trypsin.18:ach(100μm).19:buche(100ng/ml).20:cath c(100ng/ml).21:alp(100ng/ml).22:lap(100ng/ml).23:sec(100ng/ml).24:ces1(100ng/ml).25:ces2(100ng/ml).26:apn(100ng/ml).(ache:acetyl cholinesterasec,buche:butyrylcholinesterase,cath c:cathepsin,alp:alkaline phosphat ase,lap:leucine aminopeptidase,sec:selenocysteine,ces:carboxylesterase))37℃下共孵育30min,再通过酶标仪记录不同孵育液的化学发光强度。
[0064]
图11的结果表明,探针ala-pd经和apn作用表现出强烈的化学发光,而与其他生理物质作用时其荧光强度几乎无任何变化,这一结果说明探针ala-pd对apn有着较好的选择性。
[0065]
实施例8.将ala-pd的反应液(10μm,200μl)分别与apn(1000ng/ml,1μl)溶液、apn(1000ng/ml,1μl)和apn酶抑制剂乌苯美斯(ube,10μm,10μl)的混合溶液、pbs缓冲液于37℃下共孵育30min,通过小动物成像仪(ivis lumia xr iii system)对孵育液进行成像。
[0066]
图12a,b结果表明,apn抑制剂乌苯美斯(ube)可以通过抑制apn酶的活性进而抑制apn与探针ala-pd的相互作用,导致荧光强度显著降低。这一结果进一步说明了apn对探针ala-pd的高选择性。
[0067]
实施例9.首先,将肿瘤细胞hepg-2以及正常肝脏细胞l02分别播种在96孔微孔板中,密度为5000个细胞/毫升。当细胞附着24小时后,用100μl/孔的pbs洗涤。再将细胞于0、10、20、30、40和50μm的ala-pd共孵育24小时。然后在每个孔中加入10μl的mtt(5mg/ml),并在37℃的5%二氧化碳加湿培养箱中再培养4小时。最后除去培养基,用150μl dmso裂解紫色晶体。溶液的光密度在微孔板阅读器(thermo fisher scientific)上测定,波长为570nm。细胞存活率以对照培养值的百分比表示,用以下公式计算。细胞存活率(%)=(od染料od空白)/(od对照od空白)
×
100
[0068]
图13的结果表明,探针ala-pd无论对肿瘤细胞hepg-2还是正常细胞l02均未表现出显著的抑制作用,进而说明探针ala-pd具有较好的生物相容性。
[0069]
实施例10.取两组不同ph(4-10)值的tris缓冲液,向其中一组中分别加入ala-pd的反应液(10μm,200μl),再分别加入apn(1000ng/ml,1μl)溶液;另一组tris缓冲液仅加入探针ala-pd(10μm,200μl)。加毕,两组反应液于37℃下共孵育30min。所得反应液通过酶标仪检测不同ph条件下反应液的化学发光强度。
[0070]
图14结果表明,探针ala-pd在正常生理条件下(ph=6.5-7.4)具有较好的稳定性。
[0071]
实施例11.将ala-pd的反应液(10μm,200μl)分别与不同细胞个数(0,200,500,1000,2000,5000,10000,20000以及40000)的hepg-2细胞37℃下共孵育30min,再通过小动物成像仪(ivis lumia xr iii system)对孵育液进行成像,并根据所得apn的浓度和荧光强度拟合线性曲线。
[0072]
图15a结果表明,探针ala-pd与不同数量的hepg-2细胞共孵育,其化学发光强度会随着细胞个数的增加而增加;图15b的结果表明,其化学发光强度和细胞个数成较好的线性关系。
[0073]
实施例12.将ala-pd的反应液(10μm,200μl)分别与hepg-2细胞、l02细胞、ube预处理的hepg-2细胞以及dmem 37℃下共孵育30min,再通过再通过小动物成像仪(ivis lumia xr iii system)对孵育的细胞进行成像。
[0074]
图17a,b结果表明,hepg-2细胞相比于l02细胞与探针ala-pd共孵育后表现出显著的荧光增强,这一结果与图16中的weston blot实验结果一致;于此同时,ube预处理的hepg-2细胞和空白对照dmem的孵育液表现出可忽略不计的化学发光强度,这一现象进一步证实了在活细胞中,探针ala-pd对apn也表现出较高的选择性。
[0075]
实施例13.所有的动物研究都是按照东南大学动物研究中心批准的动物使用和护理条例进行。将6只6-8周大的balb/c小鼠右肢皮下注射hepg-2细胞(1x107),建立皮下肿瘤模型。肿瘤形成后,将小鼠被安乐死,用解剖器械暴露肿瘤。选择其中三只作为阳性组,于肿瘤部位直接喷洒200μl的ala-pd(50μm);另外三只hepg-2肿瘤裸鼠作为阴性组,先在其肿瘤部位瘤内预注射100μl的ube(50μm),再向肿瘤部位喷洒200μl的ala-pd(50μm);再另选三只健康裸鼠作为空白对照组;最后在ivis lumina xr iii成像系统上记录上述三组裸鼠于0-120分钟的化学成像,间隔时间为10分钟。
[0076]
图18a,b的结果表明,通过喷洒的方式,探针ala-pd仅在实体瘤组织表现出强烈的化学发光而正常组织几乎无化学发光被检测到,这一结果表明探针可以对实体瘤实现超高分辨率成像(肿瘤/正常组织比(t/n)=1.5
×
106);于此同时,被ube预处理的实体瘤也没有显著的荧光发出,进一步证明探针ala-pd在动物体内对apn表现出较高的选择性。
[0077]
实施例14.将6-8周大的balb/c小鼠右肢皮下注射hepg-2细胞(1x107),建立皮下肿瘤模型。肿瘤形成后,将小鼠被安乐死,用解剖器械暴露肿瘤。向肿瘤部位喷洒ala-pd(50μm),5min后,利用小动物成像仪(ivis lumina xr iii成像系统)对上述裸鼠进行化学发光成像以确定肿瘤病灶位置。确定肿瘤部位后通过手术对移除皮下瘤,并对移除后的裸鼠再次喷洒探针ala-pd(50μm),并通过小动物成像仪(ivis lumina xr iii成像系统)进行化学发光成像,以判断小鼠肿瘤病灶组织是否切除完全。
[0078]
从图19的结果中可以看出,喷洒探针ala-pd后,该探针可以通过小动物成像仪(ivis lumina xr iii成像系统)显著的区分hepg-2皮下实体瘤组织和正常组织。进而可以直接指导对肿瘤的手术切除。切除肿瘤后,再次喷洒探针ala-pd,发现正常组织无显著化学
发光,因此该探针也可以用于检测术中是否有肿瘤组织残留。
[0079]
实施例15.向6只6-8周大的小白鼠乳房组织注射4t1细胞(1x107),建立原位瘤肿瘤模型。约4周后,将小鼠安乐死,再用解剖器械暴露肿瘤。选择其中三只作为阳性组,于肿瘤部位直接喷洒200μl的ala-pd(50μm);另外三只4t1肿瘤小鼠作为阴性组,并在其肿瘤部位瘤内预注射100μl的ube(50μm),再向肿瘤部位喷洒200μl的ala-pd(50μm);最后在ivis lumina xr iii成像系统上记录两组4t1原位瘤白鼠0-120分钟内的化学成像,间隔时间为20分钟。
[0080]
从图20a,b的结果可以看出探针ala-pd对4t1的原位瘤组织也表现出强烈的化学发光。于此同时,其肿瘤/正常组织成像比(t/n)可以达到1.8
×
106。
[0081]
实施例16.取接种4t1细胞的原位瘤白鼠,安乐死后将肿瘤组织暴露出来。向其中三只小鼠直接喷洒ala-pd(50μm)并通过ivis lumina xr iii成像系统观察肿瘤组织。参照成像效果对小鼠的原位瘤进行手术切除,再向暴露部位喷洒ala-pd(50μm)并通过成像系统观察残留的肿瘤。继续切除残留肿瘤病灶,再次喷洒成像,观察肿瘤是否被切除干净。
[0082]
从图21结果可以看出,ala-pd可以有效用于原位瘤的手术导航。
[0083]
实施例17.取上述实施例16中的4t1肿瘤裸鼠,取出小鼠体内的脏器(心、肝、脾、肺、肾)。向取出的脏器上喷洒ala-pd(50μm)并通过ivis lumina xr iii成像系统进行成像。
[0084]
从图22a,b的结果可以看出,ala-pd可以对肺部转移病灶进行成像,利用ala-pd成像可以显著区分肉眼不易察觉的肿瘤病灶和正常组织。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1