聚吡咯修饰的牛血清蛋白的制备方法、蛋白质导电水凝胶及其制备方法和用途
1.本发明涉及高分子材料技术领域,更具体的涉及一种聚吡咯修饰的牛血清蛋白的制备方法、蛋白质导电水凝胶及其制备方法和用途。
背景技术:
2.水凝胶是一种三维立体结构的高分子聚合物新型材料,其交联网络具有亲水性,因此可在水环境中吸收并保持相当大比例的水,发生溶胀而不溶解;同时具有良好的柔韧性和生物相容性,使得水凝胶在生物传感器、再生医学、致动器、软体机器人、组织工程、药物和基因输送,伤口敷料等领域有着广泛的应用前景。在柔性可穿戴电子设备应用中,柔性传感器不仅需要良好的生物相容性,而且同时具备优异的机械性能、快速的恢复性和出色的导电性,以便其能长久的使用。目前基于蛋白质的水凝胶,因其可设计和可调节的生化和力学特性以及良好的生物相容性而受到研究者的特别关注,然而合成的蛋白质水凝胶往往力学强度较差,远远超出组织工程、生物传感器和伤口敷料等领域的要求。例如,中国发明专利申请cn 110272523 a公开了一种将酪蛋白引入到聚丙烯酰胺水凝胶中,利用表面带负电的酪蛋白胶束在金属离子加入后破坏其空间稳定性而允许其聚集形成蛋白质交联网络,其表现出良好的粘附性和导电性,但是其力学性能较差,拉伸应力仅达到168kpa。这种机械性能差和不具备恢复性能的水凝胶对于其应用到柔性传感器领域是远不能满足目前的需求的。
3.因此,寻找一种巧妙特殊的方法将蛋白质引入到水凝胶体系中,赋予水凝胶优异的机械强度和快速的自恢复能力,仍然是目前蛋白质水凝胶面临的一个巨大挑战。
技术实现要素:
4.为了克服现有技术缺陷,本发明提供了一种聚吡咯修饰的牛血清蛋白的制备方法,通过该方法能够制得聚吡咯修饰的牛血清蛋白,该聚吡咯修饰的牛血清蛋白能够使得牛血清蛋白能通过聚吡咯分子上的氮原子与金属离子形成金属络合作用,从而形成双网络水凝胶中第一物理交联网络。
5.为实现上述目的,一种聚吡咯修饰的牛血清蛋白的制备方法,步骤包括:
6.s1.以牛血清蛋白为原料,用烯基化试剂与牛血清蛋白分子上活泼的氨基进行酰胺化反应,得到烯基化的牛血清蛋白;
7.s2.以步骤s1得到的烯基化的牛血清蛋白与吡咯单体通过自由基聚合反应制备得到聚吡咯修饰的牛血清蛋白。
8.较佳地,步骤s1中,将牛血清蛋白溶解于co
32-/hco
3-缓冲溶液后,再滴加烯基化试剂,经过透析和冻干后制得烯基化的牛血清蛋白。
9.较佳地,将烯基化的牛血清蛋白溶解于pbs缓冲溶液中,再滴加吡咯单体,然后加入引发剂,再经过透析和冻干后,得到聚吡咯修饰的牛血清蛋白。
10.较佳地,所述烯基化试剂选自甲基丙烯酸酐、甲基丙烯酰氯、甲基丙烯酸缩水甘油酯中的任意一种。
11.对应地,本发明还提供一种蛋白质导电水凝胶的制备方法,步骤包括:
12.制备双网络水凝胶,其中,采用上述聚吡咯修饰的牛血清蛋白的制备方法制得的聚吡咯修饰的牛血清蛋白作为第一网络。
13.较佳地,采用丙烯酸和丙烯酰胺单体的共聚物作为第二网络。
14.本发明的蛋白质导电水凝胶的制备方法,将修饰聚吡咯的牛血清蛋白作为第一网络,再与带有羧基基团的丙烯酸和丙烯酰胺单体共聚形成第二网络,制备了高强韧、快速恢复和高灵敏度的蛋白质导电水凝胶。具体地,利用聚吡咯修饰的牛血清蛋白分子中吡咯氮与金属离子形成络合作用构建了第一网络,同时由于第二网络的大量羧基能与金属离子溶液作用,加强了两个网络的相互作用,大大提升了蛋白水凝胶的机械强度,而且赋予了水凝胶良好的自恢复性能和优异的导电性。需要指出的是,第二网络单体若仅使用丙烯酰胺,双网络水凝胶在浸泡金属离子溶液溶液时会发生溶胀现象,浸泡后的水凝胶机械性能极差。若第二网络单体只使用丙烯酸单体,会由于溶液酸性过大使得牛血清蛋白分子发生变性。因此使用丙烯酸和丙烯酰胺单体的共聚物作为第二网络,不仅能使牛血清蛋白分子加入不会变性,而且能使水凝胶浸泡过程不会发生溶胀。
15.较佳地,将聚吡咯修饰的牛血清蛋白、丙烯酸、丙烯酰胺单体、热引发剂、氢氧化钠和去离子水充分混合形成水凝胶前驱体,然后热引发单体聚合形成复合水凝胶;将复合水凝胶浸泡在金属离子溶液中,得到蛋白质导电水凝胶。
16.较佳地,首先将氢氧化钠溶解在去离子水中,加入丙烯酸搅拌使其充分反应;然后加入聚吡咯修饰的牛血清蛋白,充分搅拌,然后再依次加入丙烯酰胺类单体和热引发剂,最后通过热引发自由基聚合形成复合水凝胶。
17.较佳地,所述金属离子溶液选自铁离子溶液、铝离子溶液、钙离子溶液、银离子溶液、钠离子溶液中的至少一种。进一步,铁离子溶液选自三价铁离子溶液。
18.相应地,本发明还提供一种蛋白质导电水凝胶,采用上述制备方法制得。
19.本发明还提供一种蛋白质导电水凝胶在监测人体运动或生理信号上的应用。
20.本发明的有益效果有:
21.(1)本发明的聚吡咯修饰的牛血清蛋白的制备方法中,聚吡咯是一种导电聚合物,同时吡咯上的氮原子存在孤对电子,因此修饰聚吡咯一方面可以提高聚合物的导电性,同时使得牛血清蛋白能通过聚吡咯分子上的氮原子与金属离子形成金属络合作用,从而形成双网络水凝胶中第一物理交联网络。
22.(2)本发明的蛋白质导电水凝胶的制备方法中,将修饰聚吡咯的牛血清蛋白作为第一网络,带有羧基基团的丙烯酸和丙烯酰胺单体的共聚物作为第二网络,制备出高强韧、快速恢复的蛋白质导电水凝胶。利用聚吡咯修饰的牛血清蛋白分子中吡咯氮与三价铁离子的金属络合作用构建第一网络,同时由于第二网络的大量羧基能与铁离子形成金属络合作用,加强两个网络的相互作用,也大大提升蛋白水凝胶的机械强度。得到的蛋白质导电水凝胶具有优异力学性能、良好恢复性、导电性和应变灵敏性,同时也具有良好的生物相容性。
23.(3)本发明采用双物理交联方式制备高强韧、快速恢复和高灵敏度的蛋白质导电水凝胶,解决目前蛋白质水凝胶机械性能差的问题,而且由于物理交联方式的可逆性使得
水凝胶具有极好的恢复性,另外,蛋白质水凝胶还具有良好的生物相容性、导电性和应变灵敏性。
24.(4)本发明的蛋白质导电水凝胶具有优异的应变灵敏性,其电阻变化信号能随着水凝胶的应变而产生规律稳定的信号,其可以用来监测人体运动和人体的生理信号,并且其在柔性可穿戴设备、柔性机器人和智能人工皮肤等方面有着广阔的应用前景。
附图说明
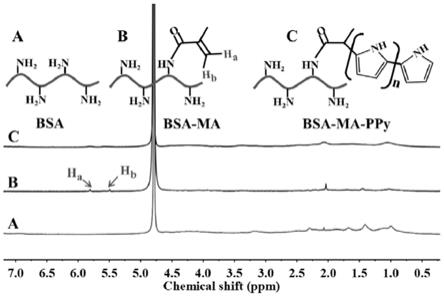
25.图1为实施例1中烯基化牛血清蛋白、聚吡咯修饰的牛血清蛋白以及牛血清蛋白的1h nmr,其中a代表牛血清蛋白,b代表烯基化牛血清蛋白,c代表聚吡咯修饰的牛血清蛋白。
26.图2为实施例1中蛋白质导电水凝胶在外力作用下的拉伸图。
27.图3为实施例1中复合水凝胶和蛋白质导电水凝胶的电导率。
28.图4为实施例1中蛋白质导电水凝胶的恢复曲线(a)和恢复率的柱状图(b)。
29.图5为实施例1中制备的蛋白质导电水凝胶传感器实时监测手指(a)和手腕(b)关节运动的电阻变化图。
具体实施方式
30.以下结合实例对本发明的具体实施作进一步说明,但本发明的实施和保护不限于此。需指出的是,以下若有未特别详细说明之过程,均是本领域技术人员可参照现有技术实现或理解的。所用试剂或仪器未注明生产厂商者,视为可以通过市售购买得到的常规产品。
31.下面结合附图和实施例,对本发明进行详细描述。
32.实施例1
33.一种蛋白质导电水凝胶的制备方法,步骤包括:
34.(1)制备聚吡咯修饰的牛血清蛋白
35.称取10g牛血清蛋白溶液于100ml(0.25mol/l,ph=9)的co
32-/hco
3-缓冲溶液中,在冰浴条件下充分磁力搅拌,形成均匀溶液;然后,向烧瓶中逐滴加入2ml的甲基丙烯酸酐,继续在冰浴条件下搅拌反应1h,将所得的溶液先用分子水透析48h,然后通过冷冻干燥得到烯基化的牛血清蛋白;
36.称取烯基化的牛血清蛋白2g溶解于100ml(0.2mol/l,ph=7.4)pbs缓冲溶液中,充分搅拌完全溶解后,逐滴加入1.2ml单体吡咯,在室温条件下搅拌2h后,向混合溶液中缓慢加入0.4g引发剂过硫酸铵,继续搅拌24h,反应结束后,使用分子水透析72h,再经过冷冻干燥后得到聚吡咯修饰的牛血清蛋白。
37.(2)制备复合水凝胶:
38.称取0.0724g氢氧化钠溶解于3ml分子水,搅拌使其完全溶解;再称取0.1304g丙烯酸于上述溶液中,继续搅拌使其充分反应;然后称取聚吡咯修饰的牛血清蛋白0.09g加入溶液中,通过搅拌和超声使其充分溶解。接下来依次称取0.8696g丙烯酰胺和0.01g引发剂过硫酸铵加入溶液中,经过充分的搅拌和超声去除气泡后,使用注射器将前驱体溶液注入玻璃模具中,然后在热环境下引发自由基聚合形成复合水凝胶。
39.(3)制备蛋白质导电水凝胶:
40.将复合水凝胶浸泡在0.1mol/l三价铁离子溶液3h,聚吡咯修饰的牛血清蛋白通过吡咯氮与铁离子的金属络合作用形成第一网络,同时通过金属络合作用来促进两个网络之间相互作用,以此来加强水凝胶的机械性能,浸泡结束得到高强韧、快速恢复和高灵敏度的蛋白质导电水凝胶。
41.对本实施例所制备的烯基化牛血清蛋白和聚吡咯修饰的牛血清蛋白进行了核磁共振氢谱分析,也对蛋白质导电水凝胶进行拉伸曲线、循环拉伸应力~应变恢复曲线和电导率测试。具体说明如下:
42.图1是牛血清蛋白(bsa)及实施例1中制备的烯基化牛血清蛋白(bsa-ma)、制备的聚吡咯修饰的牛血清蛋白(bsa-ma-ppy)的1h nmr。通过三种物质的1h nmr对比可知,烯基化的牛血清蛋白的1h nmr谱中在5.81ppm和5.49ppm出现了两个新峰,分别对应甲基丙烯酰胺的乙烯基共轭质子(ha)和(hb),表明甲基丙烯酸酐已经成功与牛血清蛋白分子中的氨基反应接枝到蛋白质分子上。而在聚吡咯接枝的牛血清蛋白的1h nmr谱上,5.81ppm和5.49ppm的相关峰消失,说明双键与吡咯单体发生了自由基聚合反应,表明聚吡咯已通过与双键反应接枝到牛血清蛋白分子上。
43.图2是实施例1中制备的蛋白质导电水凝胶在外力作用下的拉伸应力-应变图。由图2可知,所制备的蛋白质导电水凝胶的断裂应力为5.4mpa,断裂伸长率为570%。
44.图3是实施例1中制备的蛋白质导电水凝胶和复合水凝胶的电导率柱状图。由图2可知,所制备的蛋白质导电水凝胶的电导率远远高于复合水凝胶,电导率达到0.99s/m。
45.图4是实施例1中制备的蛋白质导电水凝胶的恢复曲线(a)和恢复率的柱状图(b)。可见,随着蛋白质导电水凝胶休整时间的增长,水凝胶的加载-卸载曲线围成的曲线逐渐靠近初始的曲线,说明水凝胶的恢复情况越来越好。静置10min后,水凝胶最大应力的恢复率达到了99.25%,耗散能量的恢复率达到了97.43%,弹性模量的恢复达到了98.16%。
46.请参考图5,将蛋白质导电水凝胶黏附在皮肤上,连接到电化学工作站。当身体手指(a)和手腕(b)发生动作时,会引起导电水凝胶的形变,从而水凝胶电阻增大;当身体手指(a)和手腕(b)状态恢复原来状态时,其电阻值又相应恢复至原来数值。通过比较相对电阻变化的大小,可以区分不同关节的运动。
47.实施例2-6
48.实施例2-6提供蛋白质导电水凝胶的制备方法,基本与实施例1相同,与实施例1不同之处在于聚吡咯修饰的牛血清蛋白的用量不同,具体请参考表1。
49.表1不同聚吡咯修饰的牛血清蛋白的用量的试验结果
50.试验组聚吡咯修饰的牛血清蛋白断裂应力断裂伸长率实施例202.52mpa640%实施例30.03g3.77mpa632%实施例40.06g4.81mpa604%实施例10.09g5.4mpa570%实施例50.12g5.29mpa504%实施例60.15g4.64mpa380%
51.由表1的数据可知,随着聚吡咯修饰的牛血清蛋白含量从0增加0.09g,断裂应力逐渐增加,断裂伸长率逐渐减小;继续增加聚吡咯修饰的牛血清蛋白到0.15g,断裂应力减小,
断裂伸长率也减小。
52.实施例7-9
53.实施例7-9提供蛋白质导电水凝胶的制备方法,基本与实施例1相同,与实施例1不同之处在于三价铁离子的浓度不同,具体请参考表2。
54.表2不同三价铁离子的浓度的试验结果
55.试验组三价铁离子的浓度断裂应力断裂伸长率实施例70.06mol/l3.45mpa650%实施例80.08mol/l4.57mpa603%实施例10.1mol/l5.4mpa570%实施例90.12g mol/l4.90mpa500%
56.由表2的数据可知,随着浸泡三价铁离子的浓度从0.06mol/l增加0.1mol/l,断裂应力增加,断裂伸长率减小;继续增加铁离子的浓度到0.12mol/l,断裂应力减小,断裂伸长率也减小。
57.实施例10-13
58.实施例10-13提供蛋白质导电水凝胶的制备方法,基本与实施例1相同,与实施例1不同之处在于第二网络单体丙烯酸与丙烯酰胺的摩尔比例不同,具体请参考表3。
59.表3不同丙烯酸与丙烯酰胺的摩尔比例的试验结果
60.试验组丙烯酸与丙烯酰胺的摩尔比例断裂应力断裂伸长率实施例106%2.61mpa720%实施例119%3.66mpa680%实施例1212%4.38mpa617%实施例115%5.4mpa570%实施例1318%4.87mpa450%
61.由表3的数据可知,随着丙烯酸与丙烯酰胺的摩尔比从6%增加15%,断裂应力逐渐增加,断裂伸长率逐渐减小;继续增加摩尔比例到18%,断裂应力减小,断裂伸长率也减小。
62.以上仅是本发明的较佳实施例而已,并非对本发明做任何形式上的限制,虽然本发明已以较佳实施例揭露如上,然而并非用以限定本发明,任何所属技术领域中具有通常知识者,在不脱离本发明技术方案的范围内,当可利用上述揭示的技术内容作出些许更动或修饰为等同变化的等效实施例,但凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本发明技术方案的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1