高效催化没食子酸甲酯生物合成的基因及其应用
id no.3和seq id no.4所示。
13.本发明还提供了一种表达盒,包含上述高效催化没食子酸甲酯生物合成的基因。
14.本发明还提供了一种重组植物表达载体,所述载体包含将上述高效催化没食子酸甲酯生物合成的基因重组至prsfduet-1载体上所获得的重组载体prsfduet-1-csta、或prsfduet-1-mrta、或两者的组合。
15.本发明还提供了一种工程菌,其特征在于,所述工程菌为包含上述重组载体prsfduet-1-csta或prsfduet-1-mrta的大肠杆菌bl21(de3)菌株。
16.本发明还提供了一种上述基因在催化没食子酸甲酯生物合成中的应用。
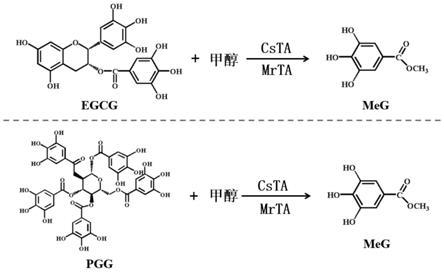
17.本发明还提供了一种没食子酸甲酯的生物合成方法,其特征在于,向含有egcg或pgg,且添加甲醇作为底物的反应体系中,加入上述基因组合的共表达重组蛋白,或者上述工程菌组合中分离纯化的任一重组蛋白csta或mrta,通过酶催化反应,生物合成没食子酸甲酯。
18.本发明的有益效果是:
19.本发明提供了两种高效催化没食子酸甲酯生物合成的基因csta与mrta及其编码蛋白和应用,从茶树的杨梅中克隆并验证了催化没食子酸甲酯生物合成的csta与mrta基因,本发明还提供了分别含有csta与mrta基因的重组质粒、转基因工程菌和重组蛋白。本发明提供了两种高效安全的没食子酸甲酯生物合成技术,利用生物工程方法优化了酶反应的底物最适添加量及酶的最适反应条件,为实现没食子酸甲酯的商品化生产提供了基础。没食子酸甲酯作为一种重要的次生代谢物质,具有抗真菌、抗hiv-1、抗炎、抗氧化,增强植物防御等特性,该类化合物已在各个科研领域得到了广泛的认可和利用,为药用化合物的生物合成奠定了坚实的基础。
附图说明
20.图1为本发明实施例中csta和mrta重组蛋白的sds-page蛋白电泳分析图;其中,m为蛋白marker;两个条带分别为纯化后的csta和mrta重组蛋白。
21.图2为本发明实施例中hplc分析csta和mrta重组蛋白以egcg为底物时催化的酶活产物结果图。
22.图3为本发明实施例中hplc分析csta和mrta重组蛋白以pgg为底物时催化的酶活产物结果图。
23.图4为本发明实施例中重组蛋白csta和mrta各自在不同缓冲液条件下的最适反应ph梯度曲线图。
24.图5为本发明实施例中重组蛋白csta和mrta各自在最适ph条件下的最适反应温度梯度曲线图。
25.图6为本发明实施例中重组蛋白csta和mrta各自以egcg为底物时反应时间梯度曲线图。
26.图7为本发明实施例中重组蛋白csta和mrta各自以pgg为底物时反应时间梯度曲线图。
27.图8为本发明实施例中重组蛋白csta和mrta在体外通过酶反应催化egcg或pgg和甲醇反应生成没食子酸甲酯的流程图。
28.图9为本发明实施例中重组表达载体prsfduet-1的结构图谱。
具体实施方式
29.为了使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,下面结合具体图示,进一步阐述本发明。
30.1、材料
31.(1)植物材料:舒茶早(camelliasinensis(l.)o.kuntze.var.sinensiscultivarshuchazao),杨梅(myricarubra(lour.)s.etzucc.)采集茶树鲜叶和杨梅鲜叶,立即用液氮冷冻,存于-80℃冰箱保存备用。
32.(2)克隆感受态大肠杆菌细胞dh5α,表达宿主菌bl21(de3)。
33.(3)lb培养基:称取酵母提取物5g,胰蛋白胨10g,氯化钠10g,加950ml纯水,超声至充分溶解后,用1mol/lnaoh溶液调节ph至7.0,加水定容至1l高压灭菌后即为液体培养基;lb固体培养基,按照每200mllb液体培养基加3g琼脂粉混匀,121℃高压蒸汽灭菌15min。
34.(4)卡那霉素母液(50mg/ml):称取0.5g卡那霉素,溶于10ml灭菌水,过滤除菌,分装小管,-20℃保存。
35.(5)异丙基硫代-β-d-半乳糖苷(iptg,1mol/l):称取2.383g粉末溶于10ml灭菌水,过滤除菌,分装小管,-20℃保存。
36.(6)蛋白纯化缓冲液(0.1mol/l磷酸盐缓冲液):称取17.907gna2hpo4·
12h2o和2.925gnacl,用纯水定容至500ml,此为溶液i,称取3.1202gnah2po4·
2h2o和1.17gnacl,用纯水定容至200ml,此为溶液ii,以ii调i至ph为7.4,最终得到的溶液为上样缓冲液,每100ml上样缓冲液添加1.02g咪唑,得到的溶液即为洗脱缓冲液。
37.若未特别指明,实施例均按照常规实验条件或按照制造厂商说明书建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
38.2、方法
39.2.1协同催化没食子酸甲酯生物合成的基因组合的克隆及表达
40.2.1.1 csta和mrta基因的克隆
41.(1)根据两个基因csta和mrta的开放阅读框序列,设计带有表达载体prsfduet-1的多克隆位点bamh i和pst i特异引物。
42.引物序列如下所示:
43.csta正向引物:
[0044]5’‑
catcaccatcatcaccacagccaggatccgatggattcaatagccc-3’;
[0045]
csta反向引物:
[0046]5’‑
gccgcaagcttgtcgacctgcagtcaattttcatttacg-3’;
[0047]
mrta正向引物:
[0048]5’‑
catcaccatcatcaccacagccaggatccgatggcgtcaagcactgg-3’;
[0049]
mrta反向引物:
[0050]5’‑
gccgcaagcttgtcgacctgcagtcaagttatg-3’;
[0051]
(2)按照多糖多酚总rna提取试剂盒说明书,分别从舒茶早鲜叶和杨梅鲜叶中提取出总rna,利用反转录酶对总rna进行反转录,获得茶树cdna模板和杨梅cdna模板。
[0052]
(3)分别以茶树cdna和杨梅cdna为模板,用csta的引物以及mrta的引物分别进行扩增,扩增程序为:98℃变性10s,62℃退火15s,72℃延伸30s,30个循环,再72℃继续延伸6min,得到pcr产物。
[0053]
(4)利用dna纯化回收试剂盒纯化pcr产物,通过一步克隆法将产物最终连接到表达质粒prsfduet-1上,获得prsfduet-1-csta和prsfduet-1-mrta重组质粒,其结构图谱如图9所示。
[0054]
2.1.2基因csta和mrta的原核表达及蛋白纯化
[0055]
本实施例中所用到的原核表达及功能验证技术手段为本领域的普通技术人员常用或完全可以理解的技术手段。
[0056]
(1)将prsfduet-1-csta和prsfduet-1-mrta重组质粒分别转化到大肠杆菌bl21(de3)表达宿主菌中,加入200μl的lb液体培养基,37℃,180r/min下培养60min后将菌液涂布于含50μg/ml kan+的lb平板上,37℃倒置培养;
[0057]
(2)pcr验证后选择阳性菌落,接种至100ml的灭菌的lb液体培养基中扩大培养,至od600≈0.6;
[0058]
(3)在上述扩大成功的菌液中加入90ul iptg,16℃培养24h,收集菌体,加入10-15ml上样缓冲溶液,充分悬浮菌体,置于超声破碎仪中以25%功率超声破碎30min,12000rpm离心收集上清液;利用带有his标签的直链淀粉树脂亲和柱纯化重组蛋白(affinity chromatography on an amylase resin,new england biolabs,ma,usa),利用本领域常用的sds-page方法检测蛋白表达和纯化效果,结果如图1所示。两个较纯的蛋白条带分别是mrta和csta,纯化出的蛋白被用于进一步的酶学分析。
[0059]
2.2 csta和mrta共表达重组蛋白的酶活功能验证
[0060]
2.2.1 csta和mrta蛋白的酶活性检测和最适条件范围确定
[0061]
(1)酶活反应体系50μl:包括50mm的磷酸盐缓冲液(ph 7.0),1-3μg csta或1-3μg mrta纯化蛋白,0.8mm egcg或0.4mm pgg和2m甲醇,40-45℃水浴反应5min,加等体积甲醇后振荡混匀,使酶充分变性,13000g离心20min,用超高效液相色谱仪和质谱进行检测。其中,egcg合成过程如图8中上图所示,pgg合成过程如图8中下图所示。
[0062]
检测酶反应产物方法:安捷伦hplc系统,流动相:a相1%乙酸水,b相纯乙腈,流速0.4ml/min,柱子型号poroshellhph-c18column(2.7μm,4.6
×
100mm),检测器波长280nm,进样量5μl,梯度洗脱方法:从0min到5min,b相从1%升至10%;从5min到20min,b相由10%升至35%;从20min到21min,b相从35%降至10%,从21min到23min,b相从10%降至1%,从23min到25min,维持b相1%用于平衡柱子。根据标准品出峰时间和最大紫外吸收峰确定酶反应产物。
[0063]
质谱方法与上相同,质谱条件:电喷雾,负离子模式,采集质荷比在100-1700的化合物。根据标准品和特征离子碎片对产物峰进行鉴定分析,结果如图2和图3所示,分别用egcg和甲醇或pgg和甲醇作为底物时,反应体系中添加煮沸的蛋白后没有任何产物产生,而当添加csta蛋白或mrta蛋白后底物egcg几乎被消耗完全产生产物没食子酸甲酯、没食子酸ga和表没食子儿茶素egc或四没食子酰葡萄糖tegg,所得产物没食子酸甲酯与标准品出峰时间与质谱信息完全一致证实此物质为没食子酸甲酯。
[0064]
(2)最适反应ph范围确定:为了排除因缓冲液不同而对酶活性产生的影响,分别选
择4种具有不同缓冲区间的缓冲液来摸索两种蛋白各自最适的缓冲液及ph范围。分别为柠檬酸钠盐缓冲液(ph4.0-6.0)、磷酸盐缓冲液(ph6.0-8.0)、tris-盐酸缓冲液(ph7.0-10.5)和甘氨酸-naoh缓冲液(ph 9.0-11.0),1-3μg csta或1-3μg mrta纯化蛋白,0.8mm egcg或0.4mm pgg和2m甲醇,40-45℃水浴反应3-5min,加等体积甲醇后振荡混匀,使酶充分变性,13000g离心20min,用超高效液相色谱仪进行峰面积检测,结果如图4所示,两种蛋白的最适ph范围均在8.0-9.0。
[0065]
(3)最适反应温度范围确定:为了使酶反应达到最大效率,分别选择10、20、30、35、40、45、50、60、70℃对酶反应进行检测,结果如图5所示,两种蛋白的最适温度范围均在45-50℃。
[0066]
2.2.2 csta和mrta重组蛋白的底物转化率检测
[0067]
在最适条件下,通过对体外酶活实验设置不同反应时间梯度,来判断两种蛋白对底物的转化率。从图6的酶反应体系中底物和产物的变化曲线可以看出:以egcg为底物时,在csta的反应体系中,1μg蛋白,反应8min时底物转化率就能达到90%以上;mrta的反应体系中,1μg蛋白,反应5min内转化率就能达到90%以上。
[0068]
从图7的酶反应体系中底物和产物的变化曲线可以看出:以pgg为底物时,在csta的反应体系中,3μg蛋白,反应15min时底物转化率就能达到200%以上;mrta的反应体系中,3μg蛋白,反应15min时转化率就能达到300%以上。这为后续利用酶工程生产没食子酸甲酯提供了基础条件。
[0069]
上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1