人卵巢鳞癌细胞系及其应用的制作方法
1.本发明属于微生物动物细胞领域,具体涉及人卵巢鳞癌细胞系及其应用。
背景技术:
2.原发性卵巢鳞癌是一种发生于卵巢部位的鳞状细胞癌,是一种罕见的恶性肿瘤,发病率只占卵巢癌的0.5%。原发性卵巢鳞癌是由卵巢表面上皮细胞癌变形成,不伴有前提病变也排除其它器官转移。该病发病率低、进展快、预后差。其发病机制、病因仍不明确,临床表现无特异性,该疾病早期诊断困难,多数患者主诉腹痛、腹胀、便秘、尿频等晚期肿瘤压迫症状。术前无有效的辅助诊断方法,肿瘤组织病理学诊断是确诊的金标准。可误诊为良性肿瘤而延误治疗或未得到有效的手术治疗,放射治疗不敏感,药物治疗效果差,目前尚缺乏规范的诊疗。因此,迫切需要加强对卵巢鳞癌的发病机理和药物及其他治疗方法的研究。
3.人恶性肿瘤细胞系的建立,为了解肿瘤的生物学特征、研究其癌变、分子遗传以及转移演变机制等提供丰富的实验材料,从而为建立标准治疗模式提供帮助。原发性卵巢鳞癌发病率低、死亡率高,进行大样本的随机对照研究较困难,因此,建立和丰富原发性卵巢鳞癌细胞库尤为重要,建立可靠的卵巢鳞癌细胞系和动物模型是卵巢鳞癌研究的当务之急。
4.由于原发性卵巢鳞癌非常罕见,而鳞癌细胞建系成功率很低(例如,在肺癌中,非小细胞肺癌建系成功率2.6~36%,其中鳞状细胞癌仅有1.0~14%),这些因素导致目前尚无商业化卵巢鳞癌细胞系。中国科学院细胞库、中国典型培养物保藏中心以及atcc(american type culture collection)中保藏的多以腹水收集的卵巢腺癌细胞系为主,如sk-ov-3、coc1、ovcar3。由于不同病理类型的卵巢癌在发病机制、分子特征和药物疗效方面存在很大差异,卵巢鳞癌细胞系的缺乏,一定程度制约了卵巢鳞癌的相关临床前研究。
技术实现要素:
5.有鉴于此,本发明提供了一种人卵巢鳞癌细胞系及其应用。该人卵巢鳞癌细胞系性状稳定,可长期体外传代,具有较强的增殖活性,组织学分类为鳞癌,同源重组修复缺陷(hrd)阳性、肿瘤突变负荷高(tmb-h),并存在靶向治疗相关突变,具有致瘤性。该人卵巢鳞癌细胞系可作为有效的细胞模型且可以建立异种移植动物模型,可为深入研究卵巢鳞癌的发生、发展和转移机制,及耐药机理、药物筛选和药效评估等提供新的实验模型。
6.为了实现上述目的,本发明采用了以下技术方案:
7.人卵巢鳞癌细胞系,命名为人卵巢鳞癌细胞株zoc254,于2021年11月3日保藏在中国典型培养物保藏中心(cctcc),保藏编号为cctcc no:c202159。
8.本发明还提供如上所述的人卵巢鳞癌细胞系的子代细胞系。
9.本发明的一些实施例中,如上所述人卵巢鳞癌细胞系或其子代细胞系中,p53表达阳性,er表达阴性,pr表达阴性,wt-1表达阳性,p40表达阳性,p63表达阳性,pax-8表达阴性。
10.本发明的一些实施例中,如上所述人卵巢鳞癌细胞系或其子代细胞系中,同源重组修复缺陷(homologous recombination deficiency,hrd)状态检测呈阳性。
11.本发明的一些实施例中,如上所述人卵巢鳞癌细胞系或其子代细胞系中,存在以下突变:pik3ca:p.e542k。
12.本发明的一些实施例中,如上所述人卵巢鳞癌细胞系或其子代细胞系中,肿瘤突变负荷(tmb):tmb-h、421muts。
13.此外,本发明还提供了如上所述人卵巢鳞癌细胞系或其子代细胞系的建立方法:获取卵巢鳞癌患者的癌组织标本进行酶消化原代培养,原代培养2~4周后,进行消化传代。
14.本发明还提供了如上所述人卵巢鳞癌细胞系或其子代细胞系在作为人卵巢鳞癌细胞系的细胞模型中的应用。
15.本发明还提供了如上所述人卵巢鳞癌细胞系或其子代细胞系在作为人卵巢鳞癌发生、人卵巢鳞癌发展、人卵巢鳞癌转移的细胞模型中的应用。
16.本发明还提供了如上所述人卵巢鳞癌细胞系或其子代细胞系在研究人卵巢鳞癌的耐药机理、筛选治疗人卵巢鳞癌药物、预测对于人卵巢鳞癌的药物敏感性中的应用。
17.本发明还提供了如上所述人卵巢鳞癌细胞系或其子代细胞系在建立人卵巢鳞癌动物模型中的应用。
18.本发明中,通过光学形态观察发现该人卵巢鳞癌细胞株zoc254贴壁细胞多边形、卵圆形,且细胞性状稳定,可稳定多次传代。通过对该人卵巢鳞癌细胞株zoc254进行遗传物质str分析,并在数据库中进行细胞株dna分型检索,未发现与该细胞匹配的细胞系,鉴定其为新的单一细胞株,无其他细胞污染。通过细胞增殖实验,发现该人卵巢鳞癌细胞株zoc254能大量扩增,具有较强的增殖活性。病理学鉴定表明zoc254细胞系与人卵巢鳞癌标本组织形态相同,为癌组织来源细胞;免疫组化分析结果也进一步证明其为原发性卵巢鳞癌细胞株。免疫组化分析结果显示:该人卵巢鳞癌细胞株zoc254的p53表达阳性,er表达阴性,pr表达阴性,wt-1表达阳性,p40表达阳性,p63表达阳性,pax-8阴性。
19.同时,靶向药物指标检测结果显示:该人卵巢鳞癌细胞株zoc254的同源重组修复缺陷(hrd)状态检测呈阳性,并存在以下突变:pik3ca:p.e542k。免疫药物指标检测结果显示:tmb-h、421muts。
20.此外,该人卵巢鳞癌细胞株zoc254能在裸鼠体内形成肿瘤,具有致瘤性。
21.因此,该人卵巢鳞癌zoc254细胞系可作为有效的细胞模型且可以建立异种移植动物模型,可为深入研究卵巢鳞癌的发生、发展和转移机制,以及研究耐药机理、药物筛选和药效评估等提供新的实验模型。
22.相比于现有技术,本发明的有益效果如下:
23.(1)本发明的人卵巢鳞癌细胞株zoc254为新的单一细胞株,无其他细胞污染;细胞性状稳定,可多次传代;具有较强的增殖活性,能大量扩增和长期在体外传代培养;可作为有效的细胞模型。
24.(2)本发明的人卵巢鳞癌细胞株zoc254为卵巢鳞癌细胞株,丰富了人卵巢鳞癌细胞系库。
25.(3)本发明的人卵巢鳞癌细胞株zoc254,能在裸鼠体内形成肿瘤,具有致瘤性,可建立体外移植动物模型。
26.(4)本发明的人卵巢鳞癌细胞株zoc254,p53表达阳性,er表达阴性,pr表达阴性,wt-1表达阳性,p40表达阳性,p63表达阳性,pax-8阴性。该人卵巢鳞癌细胞株zoc254的同源重组修复缺陷(hrd)状态检测呈阳性,并存在以下靶向治疗相关突变:pik3ca:p.e542k。并且,对于该人卵巢鳞癌细胞株zoc254,肿瘤突变负荷为tmb-h、421muts。该人卵巢鳞癌细胞株zoc254可为深入研究卵巢鳞癌的发生、发展和转移机制,以及研究耐药机理、药物筛选和药效评估等提供新的实验模型。
27.生物材料的保藏
28.本发明的人卵巢鳞癌细胞系,命名为人卵巢鳞癌细胞株zoc254,于2021年11月3日保藏在中国典型培养物保藏中心(简称cctcc,地址为:中国.武汉.武汉大学,邮编:430072),保藏编号为cctcc no:c202159。
附图说明
29.图1a~图1c依次分别为实施例1得到的zoc254细胞系p10、p20、p30代细胞的光学形态图片,放大倍数为40倍。
30.图2为实施例1通过艾森实时无细胞标记细胞功能分析仪电极检测到的zoc254细胞系的细胞生长曲线图。
31.图3a和图3b分别为实施例1中zoc254细胞系与原组织(临床卵巢鳞癌细胞组织标本)的he染色图片,放大倍数为40倍。
32.图4a1、图4a2分别为zoc254细胞、患者卵巢鳞癌细胞组织的p53检测结果。
33.图4b1、图4b2分别为zoc254细胞、患者卵巢鳞癌细胞组织的pr检测结果。
34.图4c1、图4c2分别为zoc254细胞、患者卵巢鳞癌细胞组织的er检测结果。
35.图4d1、图4d2分别为zoc254细胞、患者卵巢鳞癌细胞组织的wt-1检测结果。
36.图4e1、图4e2分别为zoc254细胞、患者卵巢鳞癌细胞组织的p40检测结果。
37.图4f1、图4f2分别为zoc254细胞、患者卵巢鳞癌细胞组织的p63检测结果。
38.图4g1、图4g2分别为zoc254细胞、患者卵巢鳞癌细胞组织的pax-8检测结果。
39.图5为zoc254细胞克隆形成实验的检测结果。
40.图6为zoc254细胞划痕愈合实验的检测结果。
41.图7为zoc254细胞加入parp抑制剂olaparib后的细胞抑制杀伤曲线。
42.图8为zoc254细胞接种裸鼠成瘤的瘤体生长记录曲线。
具体实施方式
43.下面结合附图和具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。在下列实施例中列出的所使用的具体材料及其来源,仅仅是示例性的,并不意图限制本发明。
44.下列实施例中未注明具体条件的实验方法,可采用本领域中的常规方法,例如参考《分子克隆实验指南》(第三版,纽约,冷泉港实验室出版社,new york:cold spring harbor laboratory press,1989)或按照供应商所建议的条件。
45.下列实施例中未特别说明的各种仪器、原料和试剂均为本领域熟知的市售产品,可通过商业途径获得。
46.实施例1:zoc254细胞系的建立
47.1.1标本的来源:
48.2017年8月8日,取自我院一名64岁卵巢鳞癌患者手术后标本,患者主诉1月前无明显诱因下出现尿频(夜间明显)、尿不尽,大便困难,伴乏力,无腹痛腹胀,查ca125:100.3u/ml;cea:54.2ng/ml;ca199:375u/ml;查腹部、盆腔ct:腹盆腔囊实性肿块(16.5
×
9.2cm),术前签署患者知情同意书。
49.1.2标本处理:
50.取手术切除取得的新鲜卵巢鳞癌组织标本,生理盐水冲洗3次,剪除出血坏死组织,4℃下pbs(含青霉素500iu/ml,链霉素500μg/ml)浸泡10min,生理盐水反复漂洗标本共计3次。
51.原代细胞获得:无菌条件下将卵巢鳞癌组织标本浸泡于dmem/f12培养基(购自gibco)中,剪成1mm
×
1mm左右大小的组织块;组织剪切后,将组织置于15ml无菌离心管,加入5ml终浓度0.1%(w/v)胶原酶(购自sigma,美国),0.125%(w/v)胰蛋白酶-edta(trypsin-edta solution,购自gibco,美国),37℃振荡消化4h,加5ml含10%(v/v)胎牛血清的dmem/f12(购自gibco)终止消化,混匀静置15min;采用70μm无菌过滤膜收集过滤液,1000r/min离心5min弃上清;pbs清洗1次,离心收集原代细胞;
52.原代培养:向收集有原代细胞的离心管中加入10ml原代细胞培养基(含dmem/f12培养基、10%(v/v)fbs、100u/ml青霉素和100μg/ml链霉素),轻柔吹打混匀得到悬液,将悬液转移至10cm培养皿中,于37℃、5%co2培养箱中培养,2~3天后更换新鲜的原代细胞培养基(含dmem/f12培养基、10%(v/v)fbs、100u/ml青霉素和100μg/ml链霉素)。
53.传代培养:待细胞汇合度至70-80%后,吸弃旧培养液,加入5ml pbs清洗1次,弃去pbs缓冲液,加入1~2ml 0.25%(w/v)胰蛋白酶-edta消化液(购自solarbio,中国),当细胞变圆且大量脱落时,加入3倍体积的原代细胞培养基(含dmem/f12培养基、10%(v/v)fbs、100u/ml青霉素和100μg/ml链霉素)终止消化。将混合液体转移至15ml离心管中,离心去掉上清液,收集细胞;向收集有细胞的离心管中加入适量原代细胞培养基(含dmem/f12培养基、10%(v/v)fbs、100u/ml青霉素和100μg/ml链霉素),1:2传代至新的10cm培养皿中,并补充原代细胞培养基(含dmem/f12培养基、10%(v/v)fbs、100u/ml青霉素和100μg/ml链霉素)至10ml。于37℃、5%co2培养箱中培养,2~3天后更换新鲜的原代细胞培养基(含dmem/f12培养基、10%(v/v)fbs、100u/ml青霉素和100μg/ml链霉素)继续培养。重复消化传代过程,每次待细胞汇合度至70-80%则行传代培养,每皿细胞在进行传代培养时将该代肿瘤细胞沉淀,加入适量原代细胞培养基重选,取1/2体积加入到新的培养皿,补足原代细胞培养液至10ml,并十字摇匀继续培养,每更换一次培养皿则相当于传代培养一次。利用成纤维细胞与肿瘤细胞的消化能力存在差异,不断去除成纤维细胞,直至培养皿中已无法到肉眼可见的成纤维细胞,并能持续传代生长。
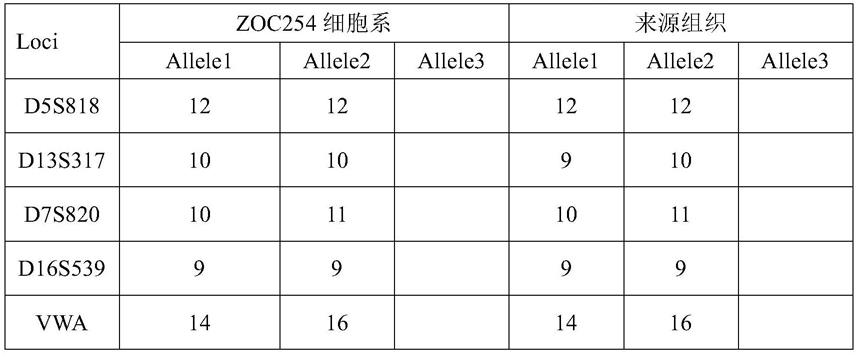
54.细胞前6代长得比较慢,2-4周传1次代,10代之后性状稳定了,3-4天传代1次,目前细胞生长良好,形态较为均一。传代至30代以上。
55.在本发明中,将来源于肿瘤组织的原代细胞传代培养10代后,得到人卵巢鳞癌细胞系,命名为人卵巢鳞癌细胞株zoc254,于2021年11月3日保藏在中国典型培养物保藏中心(cctcc),保藏编号为cctcc no:c202159。
56.实施例2:zoc254细胞系的生物学特性及应用
57.(一)zoc254细胞系的形态学观察
58.取传代培养的zoc254细胞,在光学显微镜下(日本olympus bx43生物显微镜)观察活细胞生长情况(100
×
)。结果见图1a~图1c。
59.图1a~图1c依次分别为zoc254细胞系p10、p20、p30代细胞的光学形态图片。由图1a~图1c可见,细胞经多次传代性状稳定,p10、p20、p30代细胞形态相同,呈现为:细胞单层贴壁生长,呈扁平状,多边形、卵圆形,符合上皮样细胞特点;细胞核仁明显,少数呈多核,核浆比例大。
60.(二)zoc254细胞系的遗传物质str分析及同源性鉴定
61.短串联重复序列(short tandem repeat,str)又称为微卫星dna,是指染色体上,由数个碱基对作为核心单位(2-6个碱基对),串联重复形成的一类dna序列(重复次数为10~60多次,基因片段在400碱基对以下);每个核心单位重复的次数会出现个体差异,从而形成片段长度不同的等位基因。因此,一组str序列的重复次数在不同个体中几乎是唯一的,是个体的基因身份特征,也是细胞生物学对细胞身份和来源进行鉴定的主要方法。
62.检测方法:用axygen的基因组抽提试剂盒提取dna,采用21-str扩增方案扩增,在abi 3730xl型遗传分析仪上对str位点和性别基因amelogenin进行检测。由上海翼和应用生物应用技术有限公司提供检测服务。str位点及amelogenin位点包括:d5s818、d13s317、d7s820、d16s539、vwa、th01、amel、tpox、csf1po、d12s391、fga、d2s1338、d21s11、d18s51、d8s1179、d3s1358、d6s1043、pentae、d19s433、pentad、d1s1656。
63.zoc254细胞系及其来源组织遗传物质str分析如表1所示。
64.表1:zoc254细胞系及其来源组织str位点及amelogenin位点的基因分型结果
65.[0066][0067]
在德国微生物菌种保藏中心dsmz数据库(deutsche sammlung von mikroorganismen und zellkulturen)进行str序列检索,未发现相同str检测结果。即,在数据库未找到与该细胞匹配的位点,表明此细胞株为新细胞株;未发现多等位位点,表明此细胞株为单一细胞,无其他细胞污染。此可以证明其独一无二性,且在培养过程中未发生和其他细胞的交叉污染。
[0068]
zoc254细胞系与其组织的str基因型匹配度为90%,根据atcc标准委员会鉴定标准(ansi/atcc asn-0002-2011),匹配度≥80%认为样本是同一来源,表明zoc254细胞系来源于人卵巢鳞癌组织,很好地保留了卵巢鳞癌患者的特征,有很高的临床指导价值。
[0069]
(三)zoc254细胞系的生长动力学研究:细胞增殖实验
[0070]
在e-plate96的孔中加入50μl培养基(培养基组成:dmem/f12+10%(v/v)fbs+100u/ml青霉素+100μg/ml链霉素),将e-plate96放到rtca station(实时无标记细胞功能分析仪,艾森)上,检测基线。取出e-plate96,在孔中加入50μl混合均匀的细胞悬液(向消化后的对数生长期细胞中加入含10%(v/v)fbs、100u/ml青霉素和100μg/ml链霉素的dmem/f12培养基,轻柔吹打混匀,得到细胞悬液),使每孔中细胞数目为2
×
103个,超净台内静置30min,再放到培养箱中的rtca station上,系统自动定时检测细胞指数。绘制的zoc254细
胞系生长曲线如图2所示。
[0071]
由图2可知,zoc254细胞系第2、3、4、5天进入倍增状态,第6天进入平台期稳定期,具有较强增殖能力。
[0072]
(四)zoc254细胞系的病理学鉴定
[0073]
将实施例1的zoc254细胞和临床卵巢鳞癌手术组织标本按以下步骤进行石蜡包埋切片和he染色。
[0074]
4.1zoc254细胞系蜡块处理程序
[0075]
胰蛋白酶-edta消化液消化zoc254细胞培养标本,用低速自动平衡离心机(ld-25-2北京)1000转/分,离心3分钟;弃除上清,滴加1ml 4%多聚甲醛通用型组织固定液固定5小时后,将底部沉淀标本以茶叶滤纸包裹;采用75%、80%、95%、95%、100%、100%乙醇依次脱水2小时;采用二甲苯透明30分钟,操作2次;入60℃石蜡,浸蜡2小时;采用德国徕卡jung包埋机包埋;采用德国徕卡2135石蜡切片机切片,厚度4μm;60℃烤箱,烤片1小时;采用德国徕卡st5020染色机染色;采用德国徕卡cv5030封片机封片。
[0076]
4.2临床卵巢鳞癌标本组织蜡块处理程序
[0077]
将组织切为1cm
×
1cm
×
0.3cm大小,置于组织包埋盒中,采用4%多聚甲醛通用型组织固定液固定;采用75%、80%、95%、95%、100%、100%乙醇依次脱水2小时;采用二甲苯透明30分钟,操作2次;入60℃石蜡,浸蜡2小时;采用德国徕卡jung包埋机包埋;采用德国徕卡2135石蜡切片机切片,厚度4μm;60℃烤箱,烤片1小时;采用德国徕卡st5020染色机染色;采用德国徕卡cv5030封片机封片。
[0078]
在光学显微镜下(日本olympus bx43生物显微镜)进行显微拍照,对比观察zoc254细胞与卵巢鳞癌标本组织的he染色图片(放大倍数为200倍),结果分别如图3a和图3b所示。由病理科三位诊断医生分别判读,对它们的病理诊断结果为:zoc254细胞系形态与卵巢鳞癌标本组织形态相同,细胞呈圆形、卵圆形,形状不规则,核浆比增高,胞浆嗜伊红,核不规则,核膜增厚,染色质粗糙,核分裂像可见,确定为癌组织来源细胞。zoc254细胞和临床卵巢鳞癌手术组织标本的he染色结果一致,表明zoc254细胞保留了原始肿瘤细胞的形态特征。
[0079]
(五)zoc254细胞系和患者组织的免疫组化分析
[0080]
按照上述步骤(四)中制作的zoc254细胞系细胞蜡块和临床卵巢鳞癌标本组织蜡块,4μm切片;60℃烤箱,烤片1小时;立即放入二甲苯两次溶解脱蜡,逐步放入100%、100%、95%、70%乙醇水化,pbs缓冲液清洗;加入抗原修复液,高压锅蒸煮90s,待冷却后pbs缓冲液清洗;油性笔圈选抗体孵育区域,3%双氧水封闭过氧化物10分钟,pbs缓冲液清洗后置于pbst中10分钟;分别滴加一抗(p53、er、pr、wt-1、p40、p63、pax-8)保湿盒孵育过夜;pbs缓冲液清洗后,分别滴加相应的二抗,室温孵育30分钟,pbs缓冲液清洗;加入二氨基联苯胺(dab)溶液,显色5-10分钟;pbs缓冲液冲洗后,苏木素复染,常规脱水,透明,封片。
[0081]
zoc254细胞系和临床患者卵巢鳞癌标本组织的p53、er(雌激素受体)、pr(孕激素受体)、wt-1、p40、p63、pax-8(配对盒基因8)免疫组化分析结果如图4a1~图4g2所示。
[0082]
其中,图4a1、图4a2分别为zoc254细胞、患者卵巢鳞癌组织的p53检测,表达均为阳性(+)。图4b1、图4b2分别为zoc254细胞、患者卵巢鳞癌组织的pr检测,表达均为阴性(-)。图4c1、图4c2分别为zoc254细胞、患者卵巢鳞癌组织的er检测,表达均为阴性(-)。图4d1、图4d2分别为zoc254细胞、患者卵巢鳞癌组织的wt-1检测,表达均为阳性(+)。图4e1、图4e2
分别为zoc254细胞、患者卵巢鳞癌组织的p40检测,表达均为阳性(+)。图4f1、图4f2分别为zoc254细胞、患者卵巢鳞癌组织的p63检测,表达均为阳性(+)。图4g1、图4g2分别为zoc254细胞、患者卵巢鳞癌组织的pax-8检测,表达均为阴性(-)。上述结果由病理科三位诊断医生分别判读得出。
[0083]
p53表达阳性,说明癌细胞的增殖活性强,分化程度差,恶性程度越高,预后不良;er(雌激素受体)、pr(孕激素受体)是内分泌治疗的预测生物标志物。er、pr未表达(表达阴性),表明患者不会从内分泌治疗中获益;wt-1(wilms tumor protein,wilms肿瘤蛋白)其在细胞内可与p53结合从而发挥其抑癌作用,胞质着色,可见于子宫内膜和脉管肿瘤以及肺腺癌等某些瘤种,可用于核阳性的间皮源性良性及恶性肿瘤、输卵管上皮及输卵管/卵巢浆液性腺癌鉴别,以及阴性的子宫内膜样癌、透明细胞癌、移行细胞癌、黏液癌鉴别。wt-1(wilms肿瘤蛋白)为阳性,这可能有助于排除原发性内膜浆液性卵巢癌;p40和p63是常规的鳞癌标志物,p40和p63表达阳性,说明zoc254组织及细胞系为卵巢鳞癌细胞;pax-8是一种转录因子,其高表达于苗勒源性腺上皮及肾小管、上尿路系统,因此,pax-8在苗勒源性的子宫、宫颈管、卵巢肿瘤(具体如浆液性癌、透明细胞癌、子宫内膜样癌等)中高表达。在zoc254细胞系及其组织中pax-8不表达(表达阴性),这可能意味着卵巢鳞癌细胞与一般的卵巢癌细胞显著不同。在原发性卵巢鳞状细胞癌的其他报道中,pax-8也未表达。
[0084]
上述结果表明,该zoc254细胞系为鳞状细胞癌,高度增生,分化差,恶性程度高,预后差。该细胞系具有较高的增殖能力。细胞he下,zoc254细胞与临床患者卵巢鳞癌标本组织的形态一致,且免疫组化表达结果也较为一致,说明无其他细胞污染。结合上述的标本组织和细胞株的免疫组化结果,可以得出以下结论:该zoc254细胞系保留了原发卵巢鳞癌的组织学特征,特别是p40和p63的强阳性以及p53核积聚证实了这一点。换言之,he染色及免疫组化结果表明,zoc254细胞系为原发性的卵巢鳞癌细胞。
[0085]
(六)zoc254细胞系克隆形成实验
[0086]
取对数生长期的zoc254细胞系,分别按照500个细胞/孔、1500个细胞/孔、4500个细胞/孔的细胞浓度,将细胞接种到6孔板上,加入培养基(含dmem/f12培养基、10%(v/v)fbs、100u/ml青霉素和100μg/ml链霉素),于37℃、5%co2培养箱中孵育2周后,用pbs洗涤2次,4%多聚甲醛通用型组织固定液固定20min,并用0.1%结晶紫染色15min,使用pbs洗涤》3次。拍照并计数大于50个细胞的每孔中的细胞克隆数,作为克隆形成结果,如图5所示。由图5可见:zoc254细胞系具有稳定的克隆形成和增殖能力,且与接种细胞密度成正比:细胞密度越高,克隆形成能力越强。
[0087]
(七)zoc254细胞系体外划痕实验:
[0088]
收集对数生长期的zoc254细胞,以5
×
104/ml浓度接种70μl细胞至two well ibidi silicone culture inserts(划痕试验/伤口愈合实验专用培养插件,ibidi,马丁斯雷德,德国)提供的两个独立小室中,小室置于直径6cm的平皿中,待贴壁生长24h后,移除小室,pbs缓冲溶液清洗一边,加入3ml无血清dmem/f12培养基。显微镜下观察,有一明显宽度一致的间隙,拍摄记录0小时细胞生长状态,24小时、48小时、72小时后分别再次观察记录细胞生长状态。
[0089]
显微镜下观察的不同时间划痕修复进程的结果如图6所示。图6中,4张图片分别为zoc254细胞在0小时、24小时、48小时、72小时的细胞生长状态,放大倍数为100倍(相差
×
100)。
[0090]
由图6可见,24小时zoc254细胞就出现运动迁移能力强的细胞向中间划痕间隙区生长,72小时后划痕间隙基本消失。说明zoc254细胞系具有一定的划痕愈合能力和迁移能力。
[0091]
(八)zoc254细胞系的wes检测
[0092]
wes检测,是指全外显子组测序(whole exome sequencing,wes),是一种识别和研究与疾病、种群进化相关的的编码区及调控区域(untranslated regions,utr)相关遗传突变的技术手段。结合公共数据库提供的大量外显子组数据,有助于更好地解释变异与疾病发病机制的相关性。
[0093]
通过检测患者外周血白细胞和zoc254细胞系的细胞沉淀样本dna,一次性检测人类19396个编码基因的全部外显子及毗邻剪接区的点突变及小片段插入缺失、141个基因的拷贝数变异、46个基因的融合基因和77个基因的胚系突变,共检测到体细胞突变509个。根据检测结果,建立了体细胞拷贝数变异分布和全景显示。
[0094]
靶向药物指标检测结果显示:同源重组修复缺陷(hrd)状态检测呈阳性,意味着该细胞可能对parp抑制剂如奥拉帕尼(olaparib)的使用或许有效;存在靶向相关突变:pik3ca:p.e542k,意味着靶向治疗相关突变的阿培利司(alpelisib)或依维莫司(everolimus)的使用或许有效。
[0095]
免疫药物指标检测结果显示:tmb(肿瘤突变负荷):tmb-h、421muts,表示肿瘤突变高负荷。
[0096]
根据以上分子特征,可将zoc254细胞系建立的细胞模型用于药物敏感性预测、药物疗效评估、或者治疗卵巢鳞癌药物(尤其是靶向药物)的筛选中。
[0097]
(九)zoc254细胞系药物敏感实验
[0098]
临床中,针对卵巢鳞癌的治疗尚无明确的指南,大多以手术为主,结合化疗。通过wes检测,我们发现这株zoc254细胞存在同源重组修复缺陷,这提示我们或许可用parp抑制剂,例如奥拉帕尼。奥拉帕尼是一种靶向抑制parp酶的抗肿瘤药物,同源重组修复缺陷(hrd)的患者对该类药物的敏感性增高。
[0099]
为了探究同源重组修复缺陷能否作为卵巢鳞癌的治疗靶点,我们进行了以下的药敏实验:
[0100]
收集对数生长期的zoc254细胞,每孔(100μl)接种8
×
105细胞于96孔板(costar,corning incorporated,usa),24小时后分别加入不同浓度的奥拉帕尼(hy-10162,购自昊鑫生物,杭州,中国)药物处理细胞72h。每隔24h,细胞与cck-8(cell counting kit-8,细胞计数试剂盒-8,apexbio)试剂每孔混合1~4h,在37℃下孵育1~4h,测量450nm处的吸光度。使用prism 8.02(graphpad software,san diego,ca,usa)计算ic50值,绘制细胞杀伤抑制曲线,如图7所示。其中,奥拉帕尼的浓度分别为:2μmol/l、4μmol/l、6μmol/l、8μmol/l、10μmol/l、12μmol/l、14μmol/l、16μmol/l、18μmol/l。
[0101]
结果显示:奥拉帕尼能够抑制该细胞系的增殖,并具有浓度和时间依赖性。在相同作用时间下,随着奥拉帕尼浓度的增加,细胞的抑制率升高,具有明显的浓度依赖性;在相同浓度条件下,随着作用时间的延长,奥拉帕尼对细胞的抑制率升高,具有时间依赖性;24h、48h和72h的中位抑制浓度(ic50)分别为35.48μmol/l、8.494μmol/l、7.393μmol/l。以
上结果提示,zoc254细胞对奥拉帕尼敏感。
[0102]
(十)zoc254细胞系的动物体内实验
[0103]
收集对数生长期的zoc254细胞,基质胶重悬,以1
×
106个/200μl皮下接种4周龄spf级balb/c雌性裸鼠(购于上海斯莱克实验动物有限公司,实验动物许可证证号scxk2012-0002),观察。实验动物均置于spf级无菌层流室饲养。
[0104]
接种24天后,在裸鼠上观察到绿豆大小的异体移植瘤形成,随后,每间隔3-4天记录一次瘤体生长情况。如图8所示。可见该zoc254细胞能在裸鼠体内形成肿瘤,具有致瘤性。表明该zoc254细胞系可用于构建动物模型,动物模型可用于药物筛选和疗效评价。
[0105]
综合以上实验观察与验证,上述人卵巢鳞癌zoc254细胞系贴壁细胞多边形、卵圆形,且细胞性状稳定,可稳定多次传代。遗传物质str鉴定该zoc254细胞系为新的单一细胞株,没有其他细胞污染。该人卵巢鳞癌zoc254细胞系能大量扩增,具有较强的增殖活性。免疫组化分析和病理学鉴定表明zoc254细胞系与人卵巢鳞癌标本组织形态相同,为原发性卵巢鳞癌细胞株。
[0106]
该人卵巢鳞癌zoc254细胞系的p53表达阳性,pr和er表达均为阴性,wt-1表达阳性,p40和p63表达均为阳性,pax-8表达阴性。该人卵巢鳞癌zoc254细胞系的hrd呈阳性,pik3ca:p.e542k,tmb-h。该人卵巢鳞癌细胞株zoc254能在裸鼠体内形成肿瘤,具有致瘤性。
[0107]
该人卵巢鳞癌zoc254细胞系可作为有效的细胞模型且可以建立异种移植动物模型,可为深入研究卵巢鳞癌的发生、发展和转移机制,以及研究耐药机理、药物筛选和药效评估等提供新的实验模型。
[0108]
由此可见,本发明的目的已经完成并有效的予以实现。本发明的方法及原理已在实施例中予以展示和说明,在不背离所述原理的情况下,实施方式可作任意修改。所以,本发明包括了基于权利要求精神及权利要求范围的所有变形实施方式。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1