减少来自重组蛋白生产过程中的杂质的方法与流程
1.本发明涉及减少单克隆抗体(mab)的溶液中产物相关杂质(napri)量的方法。特别是,本发明的方法涉及使用深度过滤器以减少非聚集体产物相关杂质(napri)的量。
背景技术:
2.单克隆抗体(mabs)(例如双特异性抗体(bsabs))是重要的治疗方式(1)。它们的高分子大小和复杂的折叠结构使得哺乳动物细胞培养物成为表达这些蛋白质的一种理想手段(2)。
3.哺乳动物细胞培养物的表达会导致产物和工艺相关的杂质,在纯化mab分子时,必须将其去除。用于除去这些杂质的纯化步骤可包括离心、深度过滤、蛋白a色谱、病毒灭活、阳离子交换色谱、阴离子交换色谱、多峰(混合模式)色谱、病毒过滤和超滤。
4.深度过滤器广泛用于从液体介质中去除与工艺相关的杂质,从而“澄清”介质,并防止后续纯化步骤中出现膜结垢。例如,经细胞培养物中收获的含抗体的介质,通常会通过深度过滤器以去除细胞培养工艺相关的固体,不溶性组分,例如宿主细胞蛋白(hcp)和dna污染物(3),以及外源和内源病毒(4),在最终过滤前通过微滤膜(5)或柱色谱法。
5.深度过滤器包含多孔材料,例如纤维素纸浆、硅藻土、聚丙烯纤维和二氧化硅,且一些深度过滤器包含一层以上的多孔材料(6)。
6.在蛋白a纯化和病毒灭活之后,还观察到深度过滤器通过静电或疏水相互作用去除产物相关复合种(7)。
7.在蛋白质生产过程中,产物相关杂质包括高阶复合种,其为包含产物聚集体的复合物。这些产物相关聚集体和杂质可能包括hcp和dna(4)。其他非聚集体产物相关杂质包括未反应的(未配对的)半抗体、非共价或共价连接的同二聚体及非共价连接的异二聚体,其与目标产物密切相关且难以通过标准工艺(如蛋白a纯化(8))去除。
8.可以通过偏向特定异二聚体的形成的“knobs-into-holes(突出物入孔)”策略(9),以较高的产率来生产包含来自不同单特异性单克隆抗体的重链和轻链的双特异性异二聚体抗体。其是基于以下原理:“突出物(knobs)”(一个抗体链的区域中以大氨基酸取代小氨基酸)优先咬合“孔(holes)”(另一个抗体链的对应区域中以小氨基酸取代大氨基酸),以促进特定链之间的选择性异二聚作用。然而,该方法可能会产生另外的非聚集体副产物,例如,由错误配对的“突出物
─
突出物(knob-knob)”和“孔
─
孔(hole-hole)”产生的副产物。
9.对于提供减少非聚集体产物相关杂量的方法仍存有需求。
技术实现要素:
10.本发明提供了新颖的方法和用途,其通过使用包含二氧化硅和聚丙烯纤维的深度过滤器,来减少单克隆抗体(mab)的缓冲溶液中的非聚集体产物相关杂质的量。发明人发现,使用这种深度过滤器使得非聚集体产物相关杂质减少。
11.如本文所讨论的,在重组蛋白生产过程中,深度过滤器已知会减少某些工艺相关杂质,例如hcp和dna,以及聚集产物相关杂质。然而,发明人没有预期深度过滤器会减少非聚集体产物相关杂质。从最广泛的意义上来说,本发明涉及这个意料之外的发现。
12.由此,本发明的一个方面提供一种减少单克隆抗体(mab)的缓冲溶液中的非聚集体产物相关杂质(napri)的量的方法,其中该方法包含将单克隆抗体(mab)的缓冲溶液通过包含二氧化硅和聚丙烯纤维的深度过滤器,以移除来自缓冲溶液的一部分napri。通过将mabs的缓冲溶液通过深度过滤器,来减少napri量。
13.在另一方面,本发明提供一种生产具有经减少的非聚集体产物相关杂质(napri)量的单克隆抗体(mab)的缓冲溶液的方法,其中该方法包含将单克隆抗体(mab)的缓冲溶液通过包含二氧化硅和聚丙烯纤维的深度过滤器,以生产具有经减少的非聚集体产物相关杂质(napri)量的单克隆抗体(mab)的缓冲溶液。通过将mabs的缓冲溶液通过深度过滤器,来减少napri量。
14.在另一方面,本发明提供一种包含二氧化硅和聚丙烯纤维的深度过滤器用于减少单克隆抗体(mab)的缓冲溶液中的非聚集体产物相关杂质(napri)量的用途。
15.在另一方面,本发明提供一种单克隆抗体(mab)的缓冲溶液,其中非聚集体产物相关杂质(napri)量相对于该mab量已经减少,该单克隆抗体的缓冲溶液是通过执行本发明的任一方法或通过本发明的任一用途而生产的。
16.在另一方面,本发明提供一种生产mab的方法,该方法包含下列步骤:
17.(a)培养包含编码mab的核酸的宿主细胞,使得该mab与napri一起被生产;
18.(b)形成该mab和napri的缓冲溶液;
19.(c)通过执行本发明的任一方法或通过本发明的任一用途,减少napri的量;以及可选择地
20.(d)将该mab自该缓冲溶液分离。
21.以下实施例是本发明的方面的实施例。
22.在一些实施例中,mab的缓冲溶液是mab的浓缩缓冲溶液。在一些实施例中,mab的浓缩缓冲溶液的浓度介于2mg/ml与20mg/ml之间、5mg/ml至15mg/ml之间或5mg/ml至10mg/ml之间。
23.在一些实施例中,mab是多特异性抗体。在一个实施例中,mab是双特异性抗体。在一些实施例中,mab是抗体片段。在一些实施例中,mab是包含抗体或抗体片段和另一生物活性多肽的抗体融合蛋白。
24.在一些实施例中,单克隆抗体的缓冲溶液在低于环境温度的温度下通过深度过滤器。例如,该温度可介于约4℃至约22℃之间。该温度可介于约10℃至约21℃之间。该温度可介于约15℃至约20℃之间。
25.本发明允许大规模的抗体纯化。可以将大量抗体装载到二氧化硅和聚丙烯纤维深度过滤器上。例如,质量负载可以超过100g/m2、超过200g/m2、超过300g/m2、超过500g/m2或超过700g/m2。质量负载可以高达1500g/m2、2000g/m22500g/m2。流速可以在约1l/min*m2至约10l/min*m2的范围内,例如1.5l/min*m2至约8l/min*m2。在优选的实例中,流速在约3l/min*m2至约6l/min*m2的范围内或约4.3l/min*m2。单位“l/min*m
2”表示每分钟每单位面积(m2)流过过滤器的体积(升)。
26.甚至在通过深度过滤器之前,napri都以相对较低的浓度存在于初始缓冲的mab溶液中,例如低于mab的浓度至少1.5倍、至少2倍、至少5倍、至少10倍、至少20倍、至少50倍、至少100倍、至少1000倍或至少10,000倍。相对于mab的浓度,本发明允许进一步降低napri浓度。
27.类似地,减少相对于mab绝对量的napri绝对量(例如以摩尔计)(并且在通过深度过滤器之后,溶液中napri的绝对量减少)。此外,相对于溶液通过深度过滤器之前的napri浓度,在溶液通过深度过滤器后,napri的浓度可降低(尽管不一定总是这样,例如,如果洗脱溶液中包括洗涤级分,其体积会因此而增加)。
28.napri浓度相对于mab浓度的降低可以表示为以下比率的降低;[mab]:[napri]。在溶液通过深度过滤器后,该比率会增加。
[0029]
通常来说,非聚集体产物相关杂质(napri)是由mab的不完全或不正确组装的多肽链所组成的多肽。在一些实施例中,napri是缺少mab的一个或多个多肽链的多肽。在一些实施例中,napri是包含与mab不同的多肽链排列的多肽。在一些实施例中,非聚集体产物相关杂质(napri)包含具有与mab不同的氨基酸序列和/或不同的抗体链构型的多肽。
[0030]
在一个实施例中,mab是由四个不同多肽链所组成的多特异性抗体,而napri是具有以下情况的多肽:(a)缺少该四个多肽链中的一个或多个;或(b)包含两个或多个多肽链且与该四个不同多肽链相同。在一个实施例中,mab是包含两条彼此缔合的重链的多特异性抗体,其中一条重链包含突出物突变(knob mutation),另一条重链包含孔突变(hole mutation),且napri是包含两条重链的多肽,该两条重链包含彼此缔合的突出物突变或包含彼此缔合的孔突变。在一个实施例中,mab是包含两个fab片段的多特异性抗体,其中第一fab片段包含在n末端至c末端方向中包含vl结构域和cl结构域的第一轻链,以及在n末端至c末端方向中包含vh结构域和ch1结构域的第一重链;以及,其中第二fab片段包含(a)在n末端至c末端方向中包含vl结构域和ch1结构域的第二轻链,以及在n末端至c末端方向中包含vh结构域和cl结构域的第二重链,(b)在n末端至c末端方向中包含vh结构域和ch1结构域的第二轻链,以及在n末端至c末端方向中包含vl结构域和cl域的第二重链,或(c)在n末端至c末端方向中包含vh结构域和l结构域的第二轻链,以及在n末端至c末端方向中包含vl结构域和ch1结构域的第二重链;以及,其中napri是多肽,其中(a)第一轻链和第二重链缔合,(b)第二轻链和第一重链缔合,(c)两条第一重链缔合,(d)两条第二重链缔合,或(e)该多肽缺少第一轻链、第一重链、第二轻链和第二重链中的至少一个。
[0031]
在一些实施例中,napri包含两条彼此相同的重链。在一些实施例中,napri包含两条具有相同氨基酸序列的重链。在一些实施例中,napris包含两条彼此相同的重链和/或两条彼此相同的轻链。例如,在产物是已经工程改造成经由“突出物-孔(knob-hole)”相互作用配对的双特异性单克隆抗体的情况下,napri可包含“突出物
─
突出物(knob-knob)”和/或“孔
─
孔(hole-hole)”错误配对的链。在一些实施例中,非聚集体产物相关杂质(a)具有假链构型;(b)具有部分缺少,任选地缺掉轻链;(c)具有部分附加,任选地其中杂质是具有轻链的单体;(d)是3/4抗体;(e)是轻链错误配对;(f)是突出物/突出物抗体;或(g)是孔/孔抗体。在一些实施例中,napri可以是轻链二聚体、游离轻链、其中一条重链被截短的重链二聚体、重链单体或1+1剪切二聚体。
[0032]
在一些实施例中,缓冲溶液具有约4.0至约7.5的ph值。在一些实施例中,缓冲溶液
具有约4.0至约7.2的ph值。在一些实施例中,缓冲溶液具有约4.0的ph值至约5.5的ph值。缓冲溶液可包含醋酸钠或柠檬酸钠。缓冲溶液可包含醋酸钠。在一些实施例中,缓冲溶液可包含150mm的醋酸钠。在一些实施例中,缓冲溶液可包含10mm或50mm的柠檬酸钠。在一些实施例中,缓冲溶液可包含组氨酸。在一些实施例中,缓冲溶液可包含乙酸。在一些实施例中,溶液的ph用tris缓冲。
[0033]
在一些实施例中,在根据本发明的方法减少napri的量之后,已测量非聚集体产物相关杂质(napri)的浓度。
[0034]
在一些实施例中,可能已经对mabs的缓冲溶液(或mab的缓冲溶液)进行色谱分析(在使用深度过滤器之前)。在一些实施例中,可能已经对mabs的缓冲溶液进行过亲和层析、阴离子交换色谱、阳离子交换色谱或多峰(混合模式)色谱。在一些实施例中,可能已经对mabs的缓冲溶液进行过亲和层析,例如使用蛋白a树脂、蛋白l树脂、fc选择性树脂、κ轻链选择性树脂、或λ轻链选择性树脂。作为先前色谱(例如亲和层析)的补充或替代,在一些实施例中,可能已经对mabs的缓冲溶液进行过离子交换色谱,例如阴离子交换管柱、阳离子交换管柱、或多峰(混合模式)色谱。可以通过进行亲和层析来浓缩缓冲溶液mabs。
[0035]
深度过滤器可以是包含多级的深度过滤介质的多级深度过滤器。优选地,深度过滤器是双层深度过滤器。优选地,深度过滤器不包含硅藻土。在一些实施例中,深度过滤器可以是hc pro合成深度过滤器x0sp。
[0036]
本发明的方法和用途可进一步包括在溶液已通过深度过滤器之后,鉴定mabs的缓冲溶液中napri是否存在或测量napri浓度的步骤。可测量其余的napri量。类似地,可以在溶液通过深度过滤器后测量mab的量。在一些实施例中,可以通过毛细管电泳sds page或尺寸排阻色谱来测量其余的napri量。在一些实施例中,napri是其中一条重链被截短的重链二聚体;重链;或产物轻链,且其量可以在减少的环境中以毛细管电泳sds page进行测量。在一些实施例中,napri是lmw;1+1二聚体(已被截短的重链);1+1剪切二聚体(重链在铰链区被截短并被剪切);“孔
─
孔”错误配对;“孔
─
孔”错误配对;半孔(half-hole);轻炼或轻链二聚体,且其量可以在非减少的环境中以尺寸排阻色谱和/或毛细管电泳sds page进行测量。在一些实施例中,napri是hmw,且其量可以在非减少的环境中以疏水相互作用色谱和/或以毛细管电泳sds page进行测量。在一些实施例中,hmw napri是“突出物
─
突出物”错误配对。在一些实施例中,napri是重链突出物或重链孔。
[0037]
在一些实施例中,非聚集体产物相关杂质(napri)的总浓度或量,或非聚集体产物相关杂质(napri)小于40%、小于35%、小于30%、小于25%、小于20%、小于15%、小于14%、小于13%、小于12%、小于11%、小于10%、小于8%、小于6%、小于5%、小于4%、小于3%、小于2%或小于1%。
[0038]
在一些实施例中,非聚集体产物相关杂质(napri)的浓度以尺寸排阻色谱(sec)法进行测量,可选地其中使用高效液相色谱法进行测量。
[0039]
在一些实施例中,非聚集体产物相关杂质(napri)的浓度以毛细管电泳sds page(ce-sds)进行测量,任选地,其中使用labchip装置或labchip gxii装置进行测量。
附图说明
[0040]
图1a示出在经深度过滤(灰线)以及未经深度过滤(黑色虚线)的情况下,对第一三
价双特异性抗体的纯化进行尺寸排阻色谱(sec)的记录曲线,该第一三价双特异性抗体包含两个重链多肽和三个轻链多肽。深度过滤所致的杂质量减少于实例1中讨论。
[0041]
图1b示出在经深度过滤(灰线)以及未经深度过滤(黑色虚线)的情况下,对第一三价双特异性抗体的纯化进行labchip(等同sds-page)的记录曲线。深度过滤所致的杂质量减少于实例1中讨论。所标记波峰下方的区域显示在表2中。
[0042]
图2示出深度过滤后对第一三价双特异性抗体的纯化执行进一步尺寸排阻色谱(sec)的记录曲线。这些波峰用可能对应的napri(hmw 1、lmw b和lmw 3)和其他杂质(hmw 2、hmw 3)进行标记,这些于实例1中讨论。
[0043]
图3a示出在经深度过滤(灰线)以及未经深度过滤(黑色虚线)的情况下,对第二三价双特异性抗体的纯化进行尺寸排阻色谱(sec)的记录曲线。深度过滤所致的杂质量减少于实例2中讨论。
[0044]
图3b示出在经深度过滤(灰色)以及未经深度过滤(黑色)的情况下,对第二三价双特异性抗体的纯化进行labchip(等同sds-page)的记录曲线。深度过滤所致的杂质量减少于实例2中讨论。所标记波峰下方的区域显示在表4中。
[0045]
图4示出在经深度过滤(黑色)以及未经深度过滤(灰线)的情况下,对第一抗体融合蛋白的纯化进行尺寸排阻色谱(sec)的记录曲线。深度过滤所致的杂质量减少于实例3中讨论。
具体实施方式
[0046]
抗体生产及纯化
[0047]
深度过滤器可用于单克隆抗体生产/纯化的各个阶段。工艺可包含下列步骤:
[0048]
收获:从含有蛋白质的上清液中分离细胞和细胞碎片。收获步骤通常采用离心和/或过滤方法来进行;
[0049]
fc结合/蛋白a亲和层析:此步骤可通过在ph为中性的情况下优先结合至fc区来捕获mab分子,并允许去除其余收获的上清液。然后在低ph值下洗脱mab分子。
[0050]
λ轻链结合/蛋白l亲和层析:此步骤可通过在ph为中性的情况下优先结合至fab区中λ轻链来捕获mab分子,并允许去除其余收获的上清液。然后在低ph值下洗脱mab分子。
[0051]
κ轻链结合/蛋白l亲和层析:此步骤可通过在ph为中性的情况下优先结合至fab区中κ轻链来捕获mab分子,并允许去除其余收获的上清液。然后在低ph值下洗脱mab分子。
[0052]
病毒灭活:在低ph下孵育蛋白a/l洗脱池,可以使外源病毒灭活;
[0053]
阳离子交换色谱:此步骤可以去除hcp、mab聚集体和抗体片段,并可包含“结合
─
洗脱(bind-elute)”或“流通(flow-through)”步骤;
[0054]
阴离子交换色谱:此步骤可以去除dna、浸出的蛋白a/l(leached protein a/l)和其他痕量污染物,并可在“流通(flow-through)”步骤中进行;
[0055]
病毒过滤:设计用于去除病毒的膜的单道式(截流式,dead-end)过滤;以及
[0056]
超滤:在此步骤中,通过使样品通过半透膜(孔径范围在0.1-0.01μm之间),可以进一步浓缩mab分子。如果这是最终的纯化步骤,则可以将洗脱缓冲液交换为最终的制剂缓冲液。
[0057]
例如,可以在病毒灭活、阳离子交换色谱、病毒过滤和超滤之前使用深度过滤,以
去除如本文所公开的不溶的产物相关杂质和工艺相关杂质。深度过滤可用于减少单克隆抗体(mabs)缓冲溶液中的非聚集体产物相关杂质。在一些实施例中,深度过滤可用于减少非聚集体产物相关杂质,其是具有与mab不同的氨基酸序列和/或不同的抗体链构型的多肽。在一些实施例中,深度过滤可用于减少包含两个彼此相同的重链的非聚集体产物相关杂质。
[0058]
深度过滤也可用于纯化过程的更下游的阶段,以进行二次澄清和除雾,并进一步去除如本文所公开的产物相关杂质。在一些实施例中,深度过滤可用于减少单克隆抗体(mabs)的缓冲溶液中非聚集体产物相关杂质。在一些实施例中,深度过滤可用于减少非聚集体产物相关杂质,其是具有与mab不同的氨基酸序列和/或不同的抗体链构型的多肽。在一些实施例中,深度过滤可用于减少包含两个彼此相同的重链的非聚集体产物相关杂质。
[0059]
除非本文另外指出或与上下文明显矛盾,否则本文公开的所有方法可依任何合适的顺序执行。
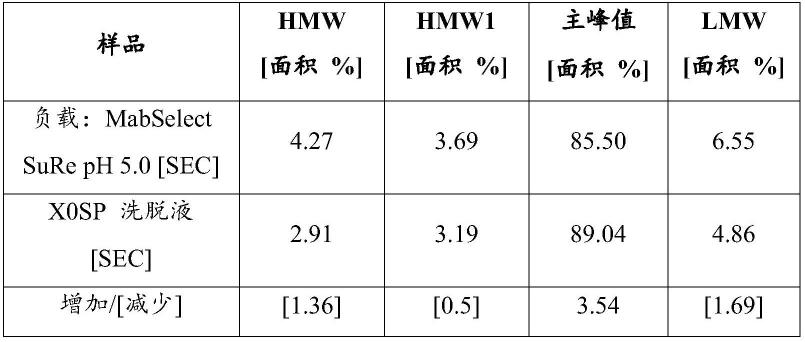
[0060]
其他定义
[0061]
就本说明书及所附的权利要求书的目的而言,除另有说明,否则在任何情况下,无论是否明确指出,在说明书和权利要求书中所使用的所有表示成分数量、材料的百分比或比例、反应条件和其他数值的数字均应理解为被术语“约”修饰。术语“约”通常是指人们认为等同于所列数值的数字范围(即具有相同的作用或结果)。在许多情况下,术语“约”可以包括四舍五入到最接近的有效数字的数字。
[0062]
因此,除非另有相反的说明,否则以下说明书和所附权利要求书中列出的数值参数是近似值,其可以根据本发明试图获得的所期望的特性而变化。至少,并且不意图将等同原则的适用限制于权利要求书的范畴,每个数字参数至少应依据所报告的有效位数的数字并通过应用通常的舍入法来解释。
[0063]
尽管阐明本发明的广泛范畴的数字范围和参数是近似值,但是在具体实例中所列的数值被尽可能精确地报告。然而,任何数值都固有地包含一定误差,这些误差必然是由它们各自的测试测量中的标准偏差所引起的。此外,本文所公开的所有范围均应理解为涵盖其中所包含的所有子范围。例如,范围“1到10”包括最小值1和最大值10之间(并包括两者)的任何及所有子范围,即,具有最小值大于等于1且最大值小于等于10的任何以及所有子范围,例如5.5到10。
[0064]
在进一步详细描述本发明之前,首先定义一些术语。这些术语的使用并不限制本发明的范围,而仅用于促进本发明的描述。
[0065]
如本文所使用,“多肽链排列”是指mab内的多肽链的缔合。常规igg抗体包含两条相同的重链和两条相同的轻链,其中为了形成igg分子,多肽链的排列方式如下:两条重链彼此缔合,且每一条轻链与其中一条重链缔合。
[0066]
如本文所使用,短语“细胞培养物”包括细胞、细胞碎片和胶体粒子、目标生物分子、hcp和dna。
[0067]
如本文所使用,术语“色谱”是指将目标分析物(例如单克隆抗体(mab))与混合物中存在的其他分子(例如非聚集体产物相关杂质)分离的任何类型的技术。通常来说,在流动相的影响下,或在结合及洗脱过程中,混合物的各个分子通过固定介质迁移的速率有差异,因而,目标分析物会与其他分子分离。
[0068]
如本文所互换使用,术语“色谱树脂”或“色谱介质”是指将目标分析物(例如单克隆抗体(mab))与混合物中存在的其他分子(例如非聚集体产物相关杂质)分离的任何类型的相(例如固相)。通常来说,在流动相的影响下,或在结合及洗脱过程中,混合物的各个分子通过固定固相迁移的速率有差异,因而,目标分析物会与其他分子分离。例如,各种色谱介质的实例包括阳离子交换树脂、亲和树脂、阴离子交换树脂、多峰(混合模式)树脂(例如,已被能够进行多种模式的相互作用(例如离子交换、羟基磷灰石、亲和力、尺寸排阻和疏水相互作用)的配体官能化的树脂)、离子交换膜、疏水相互作用树脂和离子交换整料。
[0069]
如本文所互换使用,术语“澄清步骤”或“澄清”通常是指生物分子纯化过程中最初使用的一个或多个步骤。澄清步骤通常包含细胞和/或细胞碎片的去除,其使用一个或多个包括以下任何单独或其各种组合的步骤。例如离心和深度过滤、沉淀、絮凝和沉降。澄清步骤通常涉及一种或多种不期望的实体的去除,并且通常在涉及捕获期望的靶分子的步骤之前进行。澄清的另一个方面是去除样品中可溶性和不溶性组分,其随后可能导致纯化过程中无菌过滤器的污染,从而使整个纯化过程更有经济效用。
[0070]
在一些实施例中,纯化过程另外采用一个或多个“色谱步骤”。一般来说,如果需要,则在使用根据本发明的刺激响应性聚合物(stimulus responsive polymer),将靶分子与一种或多种不期望的实体分离后,可以执行这些步骤。在一些实施例中,色谱步骤包括亲和层析。在一些实施例中,亲和层析是fc结合/蛋白a亲和层析。在一些实施例中,亲和层析是λ轻链结合/蛋白l亲和层析。在一些实施例中,亲和层析是κ轻链结合/蛋白l亲和层析。在一些实施例中,可能已经对mabs的缓冲溶液进行过亲和层析,例如使用蛋白a树脂、蛋白l树脂、fc选择性树脂、κ轻链选择性树脂、或λ轻链选择性树脂。在一些实施例中,使用柱进行亲和层析,使抗体结合的靶标在该柱上固定不动,从而通过对其靶标的亲和力来纯化抗体。如本文所使用,术语“组合物”、“溶液”或“样品”是指本文所述的靶分子或期望的产物(例如单克隆抗体(mab))连同一种或多种不期望的实体或杂质(例如非聚集体产物相关杂质)的混合物。在一些实施例中,样品包含原料或细胞培养基,靶分子或期望的产物分泌到其中。在一些实施例中,样品包含靶分子与一种或多种杂质(例如宿主细胞蛋白、dna、rna、脂质、细胞培养添加剂、细胞和细胞碎片)。在一些实施例中,样品包含靶分子(例如单克隆抗体(mab))与非聚集体产物相关杂质。
[0071]
如本文所互换使用,术语“中国仓鼠卵巢细胞蛋白”及“chop”是指源自中国仓鼠卵巢(“cho”)细胞培养物的宿主细胞蛋白(“hcp”)的混合物hcp或chop通常作为杂质而存在于细胞培养基或裂解物(例如,收获的含有目标蛋白或多肽的细胞培养液(例如,在cho细胞中表达的抗体或免疫粘附素))之中。通常来说,通过包含目标蛋白的混合物中存在的chop量,可测量目标蛋白的纯度。一般来说,蛋白混合物中chop的量以相对于混合物中目标蛋白的量的百万分点表示。其可以量化,例如通过使用elisa或cobas免疫测定法进行测量。
[0072]
如本文所互换使用,术语“污染物”、“杂质”和“碎片”是指任何外来或不良物质,包括生物大分子,例如非聚集体产物相关杂质、dna、rna、一种或多种宿主细胞蛋白(hcp或chop)、内毒素、病毒、脂质及一种或多种添加剂,其可能存在于含有目标蛋白或多肽(例如抗体)的样品中,该目标蛋白或多肽使用本文所述的方法从一种或多种外来或不良物质中分离出来。
[0073]
应当理解的是,在宿主细胞是另一种哺乳动物细胞类型、大肠杆菌、酵母细胞、昆
虫细胞或植物细胞的情况下,hcp是指在宿主细胞的裂解物中发现的除靶蛋白以外的蛋白。
[0074]
如本文所使用,术语“深度过滤器”在过滤器材料的深层内完成过滤。这种过滤器的常见类别是那些包含纤维粘合(或以其他方式固定)随机而成的基质,以形成复杂、曲折的流道迷宫的过滤器。这些过滤器中的颗粒分离通常是由纤维基质的截留或吸附作用所致。最常使用于细胞培养液和其他原料的生物加工的深度过滤介质包括纤维素纤维、助滤剂(例如硅藻土(de))和带正电的树脂粘合剂。在本发明的上下文中使用的深度过滤器是包含二氧化硅和聚丙烯纤维的深度过滤器。在一些实施例中,深度过滤器是合成过滤器。在一些实施例中,深度过滤器包含二氧化硅助滤剂和/或聚丙烯纤维。在一些实施例中,深度过滤器包含二氧化硅助滤剂、和/或聚丙烯纤维、和/或非织造材料。纺织在一些实施例中,深度过滤器包含二氧化硅和聚丙烯纤维作为非织造材料。深度过滤器可以包含尼龙。在一些实施例中,深度过滤器不包含硅藻土。在一些实施例中,深度过滤器不包含纤维素。深度过滤介质与绝对过滤器不同,前者在整个多孔介质中保留颗粒,从而截留大于和小于孔径的颗粒。颗粒保留被认为既涉及尺寸排阻,也涉及通过疏水、离子和其他交互作用的吸附。结垢机制可包括孔堵塞、滤饼形成和/或孔收缩。深度过滤器之所以具有优势,是因为它们去除了污染物并且是一次性的,从而消除了验证问题。深度过滤器可以是多层深度过滤器,其包含串联层叠的多级深度过滤器介质。优选地,深度过滤器是双层深度过滤器。采用多个深度过滤器可确保更多的滤液流有效地与深度过滤器介质接触,从而实现更好的杂质吸附特性(3)。
[0075]
在一些实施例中,深度过滤器具有23cm2或更大、0.11m2或更大,0.55m2或更大,或者1.1m2或更大的表面积。在一些实施例中,如权利要求书中所定义的缓冲溶液具有100-1000ml、50-500l、250-2500l或500-5000l的体积。
[0076]
在一些实施例中,深度过滤器具有23cm2或更大的表面积,且如权利要求书中所定义的缓冲溶液具有100-1000ml的体积。在一些实施例中,深度过滤器具有0.11m2或更大的表面积,且如权利要求书中所定义的缓冲溶液具有50-500l的体积。在一些实施例中,深度过滤器具有0.55m2或更大的表面积,且如权利要求书中所定义的缓冲溶液具有250-2500l的体积。在一些实施例中,深度过滤器具有1.1m2或更大的表面积,且如权利要求书中所定义的缓冲溶液具有500-5000l的体积。
[0077]
在一些实施例中,在每平方米的深度过滤器表面积以10-1000l、20-800l、30-600l、40-440l或50-200l的缓冲溶液进行深度过滤。
[0078]
如本文所使用,在“合成深度过滤器”的上下文中的术语“合成”是指在使用之前,该深度过滤器不包含或包含很少的源自于天然的材料(例如硅藻土、纤维素等)。换句话说,深度过滤器是由或基本上是由合成材料(例如二氧化硅、聚丙烯酸、尼龙等)所组成。
[0079]
在使用所本文公开的方法将靶分子(例如单克隆抗体(mab))从包含靶分子和一种或多种杂质(例如非聚集体产物相关杂质)的组合物或样品中纯化的上下文中,术语“分离”、“纯化”和“分离”在本文可互换使用。在一些实施例中,通过使用本文所描述的方法,从样品中(完全或部分地)去除一种或多种杂质来增加样品中靶分子的纯度。
[0080]
如本文所使用,术语“单克隆抗体”或“mab”是指来自基本上同质的抗体群体的抗体,即包含该群体的所有的单个抗体是相同的和/或彼此结合相同的表位,除了可能存在的产物相关杂质,像是变异抗体(例如,抗体含有天然存在的或于单克隆抗体制备过程中产生
fab片段”或“xfab片段”或“交叉fab片段”是指其中重链和轻链的可变区或恒定区发生交换的fab片段。cross-fab片段包含由轻链可变区(vl)和重链恒定区1(ch1)构成的多肽链以及由重链可变区(vh)和轻链恒定区(cl)构成的多肽链。还可通过将带电荷或不带电荷的氨基酸突变引入结构域界面指导正确fab配对,从而设计不对称的fab臂。参见例如wo 2016/172485。
[0085]
用于多特异性抗体的各种其他分子形式为本技术领域中已知的并且包括在本文中(参见例如spiess等人,mol immunol 67(2015)95-106)。术语“双特异性抗体”是指可以特异性结合至两种不同的表位(靶标)的抗体。
[0086]
如本文所使用,“非聚集体产物相关杂质”或“napri”是期望的“mab”的副产物,其可以由期望的mab的不完全或不正确组装的多肽链所组成。在一些实施例中,napri是缺少mab的一个或多个多肽链的多肽。在一些实施例中,napri是包含与mab不同的多肽链排列的多肽。在一些实施例中,napri的分子量低于期望的mab的分子量。在一个实例中,期望的mab是双特异性抗体,其包含衍生自与第一抗原特异性结合的抗体的第一重链和第一轻链,以及衍生自与第二抗原特异性结合的抗体的第二重链和第二轻链,其中第一和第二轻链的ch3结构域通过“突出物入孔”(knob-in-hole)技术而改变(merchant am等人,nat biotechnol.1998jul;16(7):677-81)。在该实例中,具有不完全组装的多肽链的napri是例如缺少一条或多条轻链的抗体。同样在该实例中,可能产生具有不正确组装的多肽链的napri,如相同重链的二聚体(“突出物
─
突出物(knob-knob)”二聚体或“孔
─
孔(hole-hole)”二聚体)或完整的双特异性抗体,其中轻链与错误的重链配对导致形成非功能性结合位点。mab的napri可以区分为高分子量(“hmw”)和低分子量(“lmw”)多肽。lmw多肽具有低于mab的分子量。hmw多肽具有高于等于mab的分子量(例如图2中的hmw 1)。然而,对于本发明且根据定义,napri明确不包括聚集体。聚集体定义为由多于一个期望的mab(例如与轻链缔合的期望的mab)的拷贝所组成。因此,聚集体包括具有两个或多个期望的mab的拷贝的物质,例如目标产物的二聚体或多聚体。在一个实施例中,napri为lmw多肽。在一个实施例中,napri是hmw多肽。
[0087]
如本文所互换使用,术语“百万分之”或“ppm”是指使用本文所公开的方法所纯化的期望靶分子(例如单克隆抗体(mab))的纯度的度量单位。因此,此度量单位可用于评估纯化过程后存在的靶分子的量,或用于评估不期望的实体的量。在一些实施例中,单位“ppm”在本文中用来指以毫克/毫升为单位的目标蛋白溶液(例如hcp或chop)中,以毫克/毫升为单位的杂质的量(即chop ppm=(chop ng/ml)/(目标蛋白mg/ml)。当蛋白质干燥时(例如通过冻干),ppm是指(chop ng)/(目标蛋白mg)。
[0088]
如本文所互换使用,多肽的术语“pi”或“等电点”是指多肽的正电荷平衡其负电荷的ph值。可以通过多肽的附着的碳水化合物的氨基酸残基或唾液酸残基的净电荷来计算出pi,或者可以通过等电聚焦来确定。
[0089]
如本文所使用,术语“孔径”或“标称孔径”是指在额定孔径的60-98%的范围内截留大部分微粒的孔径。
[0090]
在一些实施例中,使用本文所公开的方法以分离、分离或纯化期望的靶分子(例如单克隆抗体(mab))的“纯化步骤”,可以是造成“同质的”或“纯的”组合物或样品的整个纯化过程的一部分,本文所使用的术语“同质的”或“纯的”是指在包含期望的靶分子的组合物
中,包含小于100ppm hcp的组合物或样品,或者,小于90ppm、小于80ppm、小于70ppm、小于60ppm、小于50ppm、小于40ppm、小于30ppm、小于20ppm、小于10ppm、小于5ppm或小于3ppm的hcp。
[0091]
如本文所使用,术语“盐”是指通过酸和碱的相互作用所形成的化合物。可用于本文所述方法中的各种缓冲液中的各种盐包括但不限于醋酸盐(例如醋酸钠)、柠檬酸盐(例如柠檬酸钠)、氯化物(例如氯化钠)、硫酸盐(例如硫酸钠)或钾盐。如本文所使用,术语“溶剂”通常是指能够溶解或分散一种或多种其他物质以提供溶液的液体物质。溶剂包括水性溶剂和有机溶剂,其中有用的有机溶剂包括非极性溶剂、乙醇、甲醇、异丙醇、乙腈、己二醇、丙二醇和2,2-硫二甘醇。
[0092]
如本文所互换使用,术语“靶分子”、“靶生物分子”、“期望的靶分子”及“期望的靶生物分子”通常是指期望从一种或多种不期望的实体中(例如一种或多种杂质)纯化或分离出来的单克隆抗体(mab)分子,该不期望的实体可能存在于含有目标多肽或产物的样品中。
[0093]
实例
[0094]
以下实例旨在向本发明本领域普通技术人员提供有关如何制备本发明的组合物及如何实施本发明的方法的完整公开和描述,而不为了限制发明人所认为其发明所涵盖的范围。关于所用数字(例如数量、温度等)的准确性已被尽力确保,但是应考虑一些实验误差和偏差。除另有说明,否则温度以摄氏度为单位,如所示,化学反应是在大气压力或跨膜压力下进行,术语“环境温度”是指大约25℃,而“环境压力”是指大气压力。通过以下实例进一步阐明本发明,这些实例旨在举例说明本发明。
[0095]
实例1:在纯化包含两条重链多肽和三条轻链多肽的第一种三价双特异性抗体时,napri减少
[0096]
在本实例中,当使用深度过滤纯化第一种三价双特异性抗体时,观察到napri减少。
[0097]
材料
[0098]
millistak pod 1.1m2:mx0sp10fs1
[0099]
millistak pod pilotholder:mp0dpil0t;
[0100]
millistak+hc podhc pro x0sp 1.1m
2 flat seal;
[0101]
mp0dadptf adapterkit
[0102]
150
[0103]
蠕动泵
[0104]
分馏容器
[0105]
乙酸
[0106]
醋酸钠*3h2o
[0107]
150mm醋酸钠ph 5.0-6.0过滤缓冲液(用tris调节ph)
[0108]
方法
[0109]
将1.1m2深度过滤器放入millistak+hc pod(工艺尺架)支架中。连接一次性适配器(3x流通式和3x盲塞适配器),并将pod连接到色谱系统。将液压阀设置为开启,液压增加到1000psi,此后再次关闭液压阀。实验在+15℃至+20℃的温度范围内进行。
[0110]
连接用于压力和流量的连接器,并通过打开进气阀和排气阀冲洗过滤器,再关闭
排气阀。当液体通过排气阀流出时,关闭排气阀并打开出口阀。
[0111]
以过滤器滞留体积3倍的缓冲液(150mm醋酸钠,ph 5.0-6.0)来冲洗系统,直到ph和导电率恒定。
[0112]
使用tris将含有第一种三价双特异性抗体(在150mm醋酸钠中,ph2.8)的蛋白a池调节至ph 5.0-6.0,然后将其应用于深度过滤器。质量负载设置为887g/m2,且负载流量为4.3l/min*m2。
[0113]
收集全部的流通液,并使用适当的分析技术(例如尺寸排阻色谱(sec)、微流控毛细管电泳(labchip)、质谱分析和cobas e 411(cobas)或elisa免疫测定)对hcp含量、宿主细胞dna含量、产物相关杂质进行分析。
[0114]
结果
[0115]
利用上述方法,使用x0sp mx0sp10fs1 1.1m2深度过滤器纯化第一种三价双特异性抗体;与未进行深度过滤(mabselect sure ph 5.0)的纯化相比,napri和其他杂质的减少量是通过尺寸排阻色谱(图1a和下表1)和labchip(等同于sds-page)(图1b和下表2),经由工艺中控制来测定。
[0116][0117]
表1
–
通过sec测定的napri和纯化的第一种三价双特异性抗体的波峰面积。
[0118]
波峰有/无深度过滤的波峰面积7(主产物)91.43/86.346n/a/1.5650.97/1.494n/a/0.1734.86/7.7921.59/1.5711.15/1.08
[0119]
表2
–
通过labchip测定的napri和纯化的第一种三价双特异性抗体的波峰面积
[0120]
如表1和表2所示,通过sec和labchip记录曲线中波峰面积的百分比的测量,观察到产物质量提高,而napri(hmw1和lmw)量减少。
[0121]
图2显示另一个sec记录曲线,其中确认表1的hmw1是主产物加轻链,并且确认表1的hmw是二聚体和多聚体(非napri)。也确认表1中的lmw是lmw b(孔
─
孔napri)和lmw 3(解聚单体,其失去了一种组分的一部分)。
[0122]
实例2:在纯化包含两条重链多肽和三条轻链多肽的第二种三价双特异性抗体时,napri减少
[0123]
在本实例中,当使用深度过滤纯化第二种三价双特异性抗体时,观察到napri减少。
[0124]
材料
[0125]
millistak pod 1.1m2:mx0sp10fs1
[0126]
millistak pod pilotholder:mp0dpil0t;
[0127]
millistak+hc podhc pro x0sp 1.1m2flat seal;
[0128]
mp0dadptf adapterkit
[0129]
150
[0130]
蠕动泵
[0131]
分馏容器
[0132]
乙酸
[0133]
醋酸钠*3h2o
[0134]
150mm醋酸钠ph 5.0-6.0过滤缓冲液(用tris调节ph)
[0135]
方法
[0136]
将1.1m2深度过滤器放入millistak+hc pod(工艺尺架)支架中。连接一次性适配器(3x流通式和3x盲塞适配器),并将pod连接到色谱系统。将液压阀设置为开启,液压增加到1000psi,此后再次关闭液压阀。实验在+15℃至最高+20℃的温度范围内进行。质量负载设置为897.6g/m2且负载流量为4.3l/min*m2。
[0137]
连接用于压力和流量的连接器,并通过打开进气阀和排气阀冲洗过滤器,再关闭排气阀。当液体通过排气阀流出时,关闭排气阀并打开出口阀。
[0138]
以过滤器滞留体积3倍的缓冲液(150mm醋酸钠,ph 5.0-6.0)来冲洗系统,直到ph和导电率恒定。
[0139]
使用tris将含有第二种三价双特异性抗体(在150mm醋酸钠中,ph 2.8)的蛋白a池调节至ph 5.0-6.0,然后将其应用于深度过滤器。
[0140]
收集全部的流通液,并使用适当的分析技术(例如尺寸排阻色谱(sec)、微流控毛细管电泳(labchip)、质谱分析和cobas e 411或elisa免疫测定)对hcp含量、宿主细胞dna含量、产物相关杂质进行分析。
[0141]
结果
[0142]
利用上述方法,使用x0sp mx0sp10fs1 1.1m2深度过滤器纯化第二种三价双特异性抗体;与未进行深度过滤(mabselect sure ph 5.5)的纯化相比,napri和其他杂质的减少量是通过尺寸排阻色谱(图3a和下表3)和labchip(等同于sds-page)(图3b和下表4),经由工艺中控制来测定。
[0143][0144]
表3
–
通过sec测定的napris和纯化的第二种三价双特异性抗体的波峰面积。整体而言,hmw显示总面积减少4.59%。整体而言,lmw显示总面积减少10.59%。
[0145]
波峰有/无深度过滤的波峰面积8(主产物)70.79/53.79610.78/10.855n/a/0.35413.51/16.713n/a/0.5421.72/2.6513.20/2.65
[0146]
表4
–
通过labchip测定的napri和纯化的第二种三价双特异性抗体的波峰面积。
[0147]
确认hmw1是突出物/突出物napri,确认hmw2为非napri二聚体,确认hmw3主要为非napri聚集体,确认lmw1是孔/孔napri,确认lmw2是孔(hole)napri,确认lmw3是轻链napri。
[0148]
如表3和表4所示,通过sec和labchip记录曲线中波峰面积的百分比的测量,观察到产物质量提高,而napri(hmw1和lmw1/2/3)量减少。与第一种三价双特异性抗体相比,产物质量可以进一步提高。
[0149]
实例3:在纯化包含抗原结合位点和经工程改造的细胞因子变异体的第一抗体融合蛋白时,napri减少
[0150]
在本实施例中,当使用深度过滤纯化第一抗体融合蛋白时,观察到napri减少。
[0151]
材料
[0152]
hc pro x0 seriesμpod 23cm2:mx0sp23cl3
[0153]
150
[0154]
蠕动泵
[0155]
分馏容器
[0156]
乙酸
[0157]
醋酸钠*3h2o
[0158]
150mm醋酸钠ph 5.0-6.0过滤缓冲液(用tris调节ph)
[0159]
方法
[0160]
将23cm2深度过滤器以4.4l/min*m2的流速,用30ml的150mm醋酸钠ph 5.0-6.0缓冲液预冲洗。使用tris将含有第一抗体融合蛋白(在150mm醋酸钠中,ph 2.8)的蛋白a池调节至ph 5.0-6.0,然后以4,4l/min*m2的流速将其应用于深度过滤器。实验在+15℃至最高+20
℃的温度范围内进行。质量负载设置为2173g/m2且负载流量为1,9l/min*m2。
[0161]
在以下时间点,以4.4l/min*m2的流速使用适当的分馏法进行馏分流通:2、4、6、8、10、15、20、30和40分钟。
[0162]
使用适当的分析技术(例如尺寸排阻色谱(sec)、微流控毛细管电泳(labchip)、质谱分析和cobas e 411或elisa免疫测定)对hcp含量、宿主细胞dna含量、产物相关杂质进行分析。
[0163]
结果
[0164]
利用上述方法,使用x0sp mx0sp23cl3 23cm2深度过滤器纯化第一抗体融合蛋白;与未进行深度过滤(mabselect sure ph 5.5)的纯化相比,napri和其他杂质的减少量是通过尺寸排阻色谱和labchip(sds-page当量)(图4和下表5),经由工艺中控制来测定。
[0165][0166]
表5
–
通过sec和labchip测定的napri和纯化的第一抗体融合蛋白的波峰面积
[0167]
如表5所示,通过sec和labchip记录曲线中波峰面积的百分比的测量,观察到产物质量提高,而napri(hmw和lmw)量减少。lmw是错误配对的“孔
─
孔(hole-hole)”。hmw是错误配对的“突出物
─
突出物(knob-knob)”。
[0168]
通过labchip和sec测量到napri减少量的差异,可能是因为labchip(取决于条件)具有较差的分辨率。这是因为在样品制备过程中,如主产物+轻链的聚集体大部分被溶解了。与sec中完全减少的条件相比,样品制备是在非常温和的还原条件下进行的,在这种条件下可以更轻易地区分轻炼和重链比率。
[0169]
实例4:在多峰色谱后纯化第一种三价双特异性抗体时,napri减少
[0170]
在本实例中,当使用深度过滤纯化第一种三价双特异性抗体时,观察到napri减少,其中该抗体业经使用多峰色谱予以纯化。
[0171]
材料
[0172]
hc pro x0 seriesμpod 23cm2:mx0sp23cl3
[0173]
capto adhere impres色谱柱
[0174]
150
[0175]
蠕动泵
[0176]
分馏容器
[0177]
乙酸
[0178]
醋酸钠*3h2o
[0179]
50mm柠檬酸钠ph 4.0过滤缓冲液
[0180]
方法
[0181]
将23cm2深度过滤器以10ml/min*m2(即4.3l/min*m2)的流速,用30ml的150mm醋酸钠ph 5.0-6.0缓冲液预冲洗。该方法在+15℃至最高+20℃的温度范围内进行。质量负载设置为759g/m2且负载流量为4.3l/min*m2。
[0182]
随后执行两个不同的纯化方法步骤:
[0183]
(i)接着将包含第一种三价双特异性抗体的蛋白a池以10ml/min的流速(过滤缓冲液50mm柠檬酸钠ph 4.0)应用于深度过滤器。然后将洗脱液通过capto adhere impres多峰阴离子交换柱(洗脱缓冲液50mm柠檬酸钠ph 6.0
–
50mm柠檬酸钠ph 3.0;梯度25cv),随后将洗脱液以10ml/min的流速应用于深度过滤器(过滤缓冲液50mm柠檬酸钠ph 4.0);或
[0184]
(ii)将包含第一种三价双特异性抗体的蛋白a池通过capto adhere impres多峰阴离子交换管柱(洗脱缓冲液50mm柠檬酸钠ph 6.0
–
50mm柠檬酸钠ph 3.0;梯度25cv),随后将洗脱液以10ml/min的流速应用于深度过滤器(过滤缓冲液50mm柠檬酸钠ph 4.0)。
[0185]
按照这两种方法之一,在以下时间点,以10ml/min的流速使用适当的分馏法进行流份流通:2、4、6、8、10、15、20、30和40分钟。
[0186]
使用适当的分析技术(例如尺寸排阻色谱(sec)、微流控毛细管电泳(labchip)、质谱分析和cobas e 411或elisa免疫测定)对hcp含量、宿主细胞dna含量、产物相关杂质进行分析。
[0187]
结果
[0188]
使用x0sp mx0sp23cl3 23cm2深度过滤器纯化第一种三价双特异性抗体,从而在蛋白a色谱后进行多峰阴离子交换色谱(capto adhere impres)步骤,并在每个步骤之后或在多峰阴离子交换色谱步骤后进行过滤。
[0189]
napri和其他杂质的减少量是通过尺寸排阻色谱(下表6),经由工艺中控制来测定。
[0190][0191]
表6
–
通过sec测定的napri和纯化的第一种三价双特异性抗体(以百分比测量)的波峰面积变化(lmw是错误配对的“孔
─
孔(hole-hole)”。hmw是错误配对的“突出物
─
突出物(knob-knob)”)
[0192]
如表6所示,通过sec记录曲线中波峰面积的百分比的测量,观察到产物质量提高,而napri(hmw和lmw)量减少。因此,在进行蛋白a色谱、多峰色谱或两者结合之前,加上深度过滤似乎会减少napri。
[0193]
实例5:在纯化包含两条重链多肽和三条轻链多肽的第三种三价双特异性抗体时,napri减少
[0194]
在本实例中,考虑了两个具有不同ph值的样品。使用ph 5.5和ph 7.2深度过滤来纯化第三种三价双特异性抗体时,观察到napri减少。
[0195]
材料
[0196]
hc pro x0 seriesμpod 23cm2:mx0sp23cl3
[0197]
150
[0198]
蠕动泵
[0199]
分馏容器
[0200]
乙酸
[0201]
醋酸钠*3h2o
[0202]
150mm醋酸钠ph 5.0-6.0过滤缓冲液(用tris调节ph)
[0203]
25mm tris/tris-hcl,25mm氯化钠,ph 7.2
[0204]
方法
[0205]
将23cm2的深度过滤器以10ml/min的流速,用30ml的150mm醋酸钠ph 5.0-6.0缓冲液预冲洗。
[0206]
该方法在+15℃至最高+20℃的温度范围内进行。质量负载设置为822g/m2@ph 5.5和853g/m2@ph 7.2,且负载流量为4.3l/min*m2。
[0207]
使用tris将含有第三种三价抗体蛋白(在150mm醋酸钠中,ph 2.8)的蛋白a池调节至ph 5.5或ph 7.2,然后以10ml/min的流速将其应用于深度过滤器。
[0208]
在以下时间点,以10ml/min的流速使用适当的分馏法进行流份流通:2、4、6、8、10、15、20、30和40分钟。
[0209]
使用适当的分析技术(例如尺寸排阻色谱(sec))对hcp含量、宿主细胞dna含量、产物相关杂质进行分析。
[0210]
结果
[0211]
利用上述方法,使用x0sp mx0sp23cl3 23cm2深度过滤器纯化第三种三价抗体蛋白;与未进行未进行深度过滤(mabselect sure ph)的纯化相比,napri和其他杂质的减少量是通过尺寸排阻色谱(表6),经由工艺中控制来测定。
[0212][0213]
表6
–
通过sec测定的napri和纯化的第三种三价抗体蛋白的波峰面积。
[0214]
如表6所示,通过sec记录曲线中波峰面积的百分比的测量,观察到产物质量提高,而napri(hmw和lmw)量减少。确认hmw napri是非共价“突出物
─
突出物(knob-knob)”物质。确认lmw napri是轻链二聚体和游离轻链。
[0215]
实例6:在纯化包含两条重链多肽和三条轻链多肽的第四种三价双特异性抗体时,napri减少
[0216]
在本实例中,考虑了两个具有不同ph值的样品。使用ph 5.5和7.2深度过滤来纯化第四种三价双特异性抗体时,观察到napri减少。
[0217]
材料
[0218]
hc pro x0 seriesμpod 23cm2:mx0sp23cl3
[0219]
150
[0220]
蠕动泵
[0221]
分馏容器
[0222]
乙酸
[0223]
醋酸钠*3h2o
[0224]
150mm醋酸钠ph 5.0-6.0过滤缓冲液(用tris调节ph)
[0225]
25mm tris/tris-hcl,25mm氯化钠,ph 7.2
[0226]
方法
[0227]
将23cm2的深度过滤器以10ml/min的流速,用30ml的150mm醋酸钠ph 5.0-6.0缓冲液预冲洗。
[0228]
该实验在+15℃至最高+20℃的温度范围内进行。质量负载设置为848g/m
2 ph 5.5和838g/m2@ph 7.2,且负载流量为4.3l/min*m2。
[0229]
使用tris将含有第四种三价抗体蛋白(在150mm醋酸钠中,ph 2.8)的蛋白a池调节至ph 5.5或7.2,然后以10ml/min的流速将其应用于深度过滤器。
[0230]
在以下时间点,以10ml/min的流速使用适当的分馏法进行流份流通:2、4、6、8、10、15、20、30和40分钟。
[0231]
使用适当的分析技术(例如尺寸排阻色谱(sec))对hcp含量、宿主细胞dna含量、产物相关杂质进行分析。
[0232]
结果
[0233]
利用上述方法,使用x0sp mx0sp23cl3 23cm2深度过滤器纯化第四种三价抗体蛋白;与未进行深度过滤(mabselect sure ph)的纯化相比,napri和其他杂质的减少量是通过尺寸排阻色谱(表7),经由工艺中控制来测定。
[0234]
[0235][0236]
表7
–
通过sec测定的napri和纯化的第四种三价抗体蛋白的波峰面积。
[0237]
如表7所示,通过sec记录曲线中波峰面积的百分比的测量,观察到产物质量提高,而napri(hmw和lmw)量减少。确认hmw napri是“突出物
─
突出物(knob-knob)”物质。确认lmw napri是轻链二聚体和游离轻链种类。
[0238]
***
[0239]
编号的段落:
[0240]
1.一种减少单克隆抗体(mab)的缓冲溶液中的非聚集体产物相关杂质(napri)量的方法,其中该方法包含将该单克隆抗体(mab)的缓冲溶液通过包含二氧化硅和聚丙烯纤维的合成深度过滤器,以移除来自该缓冲溶液中的一部分napri。
[0241]
2.一种生产具有经减少的非聚集体产物相关杂质(napri)量的单克隆抗体(mab)的缓冲溶液的方法,其中该方法包含将单克隆抗体(mab)的缓冲溶液通过包含二氧化硅和聚丙烯纤维的合成深度过滤器,以生产该具有经减少的非聚集体产物相关杂质(napri)量的单克隆抗体(mab)的缓冲溶液。
[0242]
3.一种包含二氧化硅和聚丙烯纤维的合成深度过滤器减少单克隆抗体(mab)t的缓冲溶液中的非聚集体产物相关杂质(napri)量的用途。
[0243]
4.根据前述段落中任一项所述的方法、或根据段落3所述的用途,其中该mab是多特异性抗体。
[0244]
5.根据前述段落中任一项所述的方法、或根据前述段落中任一项所述的用途,其中该mab是包含抗体或抗体片段和另一生物活性多肽的抗体融合蛋白。
[0245]
6.根据前述段落中任一项所述的方法、或根据前述段落中任一项所述的用途,其中该napri是包含不完全或不正确组装的mab多肽链的多肽。
[0246]
7.根据前述段落中任一项所述的方法、或根据前述段落中任一项所述的用途,其中该napri是缺少该mab的一或多个多肽链的多肽。
[0247]
8.根据前述段落中任一项所述的方法、或根据前述段落中任一项所述的用途,其中该napri是包含与该mab不同的多肽链排列的多肽。
[0248]
9.根据段落1至6中任一项所述的方法、或根据段落3至6中任一项所述的用途,其中该napri包含两条具有相同氨基酸序列的重链。
[0249]
10.根据前述段落中任一项所述的方法、或根据前述段落中任一项所述的用途,其中该mab的缓冲溶液已经受亲和层析。
[0250]
11.根据前述段落中任一项所述的方法、或根据前述段落中任一项所述的用途,其中所述深度过滤器是包含多级深度过滤介质的多层深度过滤器。
[0251]
12.根据前述段落中任一项所述的方法、或根据前述段落中任一项所述的用途,其中该深度过滤器不含有硅藻土。
[0252]
13.根据前述段落中任一项所述的方法、或根据前述段落中任一项所述的用途,其进一步包含在通过该深度过滤器后测量该mab的缓冲溶液中的该napri的浓度。
[0253]
14.一种单克隆抗体(mab)的缓冲溶液,其中非聚集体产物相关杂质(napri)量相对于该mab的量已经减少,该单克隆抗体的缓冲溶液是通过进行根据前述段落中任一项所述的方法、或通过根据前述段落中任一项所述的用途所生产。
[0254]
15.一种生产mab的方法,该方法包含下列步骤:
[0255]
(a)培养包含编码mab的核酸的宿主细胞,使得该mab与napri一起被生产;
[0256]
(b)形成该mab和napri的缓冲溶液;
[0257]
(c)通过对该mab和napri的缓冲溶液进行根据前述段落中任一项所述的方法、或通过根据前述段落中任一项所述的用途,减少该napri的量;以及
[0258]
(d)将该mab自该缓冲溶液分离。
[0259]
参考文献
[0260]
1.van dijk,m.a.;van de winkel,j.g.human antibodies as next generation therapeutics.curr.opin.chem.biol.2001,5(4),368-74.
[0261]
2.chadd,h.e.;chamow,s.m.therapeutic antibody expression technology.curr.opin.biotechnol.2001,12,188-194.
[0262]
3.yigzaw等人,exploitation of the adsorptive properties of depth filters for host cell protein removal during monoclonal antibody purification.biotechnol.prog.2006,22,288-296.
[0263]
4.singh等人,development of adsorptive hybrid filters to enable two-step purification of biologics.mabs 2017,vol.9,no.2,350
–
364.
[0264]
5.badmington,f.prefiltration technology.in filtration in the biopharmaceutical industry;meltzer,t.h.,jornitz,m.w.,eds.;marcel dekker:new york,1998;pp783-817.
[0265]
6.onur等人,multi-layer filters:adsorption and filtration mechanisms for improved separation.frontiers in chemistry 2018volume 6article 417.
[0266]
7.nguyen等人,improved hcp reduction using a new,all-synthetic depth filtration media within an antibody purification process.biotechnol.j.2018,1700771.
[0267]
8.giese等人,bispecific antibody process development:assembly and purification of knob and hole bispecific antibodies.biotechnol.prog.,34:397
–
404,2018.
[0268]
9.ridgway等人,'knobs-into-holes'engineering of antibody ch3 domains for heavy chain heterodimerization.protein engineering vol.9no.7pp.617-621,1996.
[0269]
10.klein等人,the use of crossmab technology for the generation of bi-and multispecific antibodies.mabs.2016,vol.8,no.6,1010-1020.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1