硫代甲基苯酚衍生物的制备方法与流程
1.本发明涉及一种硫代甲基苯酚衍生物的制备方法。
背景技术:
2.硫代甲基苯酚衍生物在塑料、橡胶和油中用作抗氧化剂。
3.这些硫代甲基苯酚衍生物是通过在催化剂的存在下使苯酚衍生物与多聚甲醛和硫醇衍生物产生反应来制备的,但反应温度过高或反应时间过长,因此已尝试用于改善这些问题的各种方法。
4.例如,提出了在碱的存在下进行反应或使用还原剂等的方法,但存在纯化时间过长、在反应和纯化过程中发生变色的问题。
5.韩国授权专利第813173号、第813174号、第926796号、第963311号等中提出了通过在碱和酸同时存在的条件下进行反应,用酸纯化来减少变色的方法。
技术实现要素:
6.技术问题
7.本发明旨在提供进一步减少最终产品的变色,改善稳定性,提高纯化工艺的环保性和整个工艺的能源效率的硫代甲基苯酚衍生物的制备方法。
8.技术方案
9.根据一个方面,提供一种硫代甲基苯酚衍生物的制备方法,该硫代甲基苯酚衍生物的制备方法包括:步骤(a),在具有3至10个碳原子的杂环碱(base)和酸(acid)同时存在的条件下,在反应温度t1下使由下述化学式2表示的苯酚衍生物、由r4sh表示的硫醇衍生物及多聚甲醛进行一次反应;及步骤(b),在反应温度t2下进行二次反应,从而制备由下述化学式1表示的硫代甲基苯酚衍生物,其中,上述硫代甲基苯酚衍生物的制备方法满足t1《t2。
10.[化学式1]
[0011][0012]
[化学式2]
[0013][0014]
在式中,r1和r2各自独立地选自氢、氘、c1~c
16
直链或支链烷基、c5~c
16
环烷基或含芳烷基及-ch2sr3中,r3和r4各自选自c1~c
16
直链或支链烷基、c5~c
16
环烷基或含芳烷基中,r
11
和r
22
各自独立地选自氢、氘、c1~c
16
直链或支链烷基、c5~c
16
环烷基或含芳烷基中,n为0或1。
[0015]
在一实施例中,上述硫代甲基苯酚衍生物的制备方法可以满足95℃《t1+5℃≤t2《120℃。
[0016]
在一实施例中,上述步骤(a)和步骤(b)可以分别执行1小时至5小时。
[0017]
在一实施例中,可以相对于1当量的上述苯酚衍生物,在0.5当量至50.0当量的溶剂的存在下进行上述步骤(a)。
[0018]
在一实施例中,上述溶剂可以为水或醇。
[0019]
在一实施例中,在上述步骤(a)中,相对于1当量的上述苯酚衍生物,可以使用0.01当量至0.50当量的碱。
[0020]
在一实施例中,上述步骤(a)的碱可以为选自由吡咯、吡咯烷、咪唑、吡啶、哌啶、哌嗪及吡嗪组成的组中的至少一种。
[0021]
在一实施例中,在上述步骤(a)中,相对于1当量的上述苯酚衍生物,可以使用0.01当量至0.90当量的酸。
[0022]
在一实施例中,上述步骤(a)的酸可以为选自由亚氯酸、磷酸、砷酸、氯醋酸、氢氟酸、亚硝酸、甲酸、苯甲酸、叠氮酸、醋酸、丙酸及碳酸组成的组中的至少一种。
[0023]
在一实施例中,在上述步骤(a)中,相对于1当量的上述苯酚衍生物,可以使用2.0当量至6.0当量的硫醇衍生物。
[0024]
在一实施例中,在上述步骤(a)中,相对于1当量的上述苯酚衍生物,可以使用2.0当量至6.0当量的多聚甲醛。
[0025]
在一实施例中,在上述步骤(b)之后,还可包括用酸清洗上述步骤(b)的产物中的有机层的纯化步骤(c)。
[0026]
在一实施例中,上述步骤(c)的酸的pka可以为2.0以上。
[0027]
在一实施例中,上述步骤(c)的酸可以为选自由亚氯酸、磷酸、砷酸、氯醋酸、氢氟酸、亚硝酸、甲酸、苯甲酸、叠氮酸、醋酸、丙酸及碳酸组成的组中的至少一种。
[0028]
在一实施例中,在上述步骤(c)之后,还可包括用碱或水进行清洗的步骤(d)。
[0029]
在一实施例中,上述碱可以为选自由无水碳酸钠、过碳酸钠及碳酸氢钠组成的组中的至少一种。
[0030]
在一实施例中,在上述步骤(d)之后,还可包括在90℃至120℃温度下进行减压浓缩1小时至5小时,分离出由化学式1表示的硫代甲基苯酚衍生物的步骤(e)。
[0031]
在一实施例中,分离出的上述硫代甲基苯酚衍生物在120℃温度条件下放置72小时后的apha值可以小于75。
[0032]
技术效果
[0033]
根据一个方面,可以提供最终产品的稳定性得到改善,使工艺上的变色最小化,制备工艺的能源效率和纯化工艺的经济性提高的硫代甲基苯酚衍生物的制备方法。
[0034]
本说明书的一个方面的效果并非限定于所述效果,应当理解,包括从本说明书的详细说明或申请专利范围中记载的发明的结构中推论出的所有效果。
附图说明
[0035]
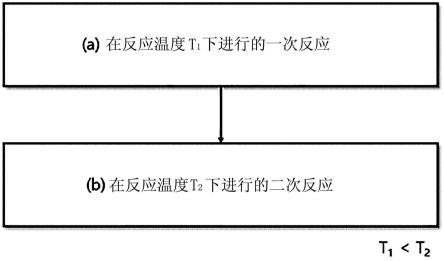
图1示出根据本说明书的一实施例的硫代甲基苯酚衍生物的制备方法的示意图。
[0036]
发明实施形态
[0037]
下面将参照附图描述本说明书的一个方面。然而,本说明书的记载事项可以以许多不同的形式来实现,并且不应被解释为限于在此所阐述的实施例。在附图中,为了明确说明本说明书的一个方面,与描述无关的部分被省略,并且相同的标号始终指示相同的组件。
[0038]
在说明书全文中,当表示某个部分与其他部分“连接”时,这不仅包括“直接连接”的情况,还包括在中间设置其他部件的“间接连接”情况。并且,当表示某个部分“包括”某个结构要素时,只要没有特别相反的记载,则这意味着并不排除其他结构要素,而是还可包括其他结构要素。
[0039]
在本说明书中,在描述一系列数值范围时,除非另有其具体说明,否则这些值具有根据对于有效数字的化学中的标准规则提供的有效数字的精度。例如,10包括5.0至14.9的范围,而数字10.0包括9.50至10.49的范围。
[0040]
下面,将参照附图详细说明本说明书的一实施例。
[0041]
硫代甲基苯酚衍生物的制备方法
[0042]
根据一个方面的硫代甲基苯酚衍生物的制备方法可以包括:步骤(a),在具有3至10个碳原子的杂环碱(base)和酸(acid)同时存在的条件下,在反应温度t1下使由下述化学式2表示的苯酚衍生物、由r4sh表示的硫醇衍生物及多聚甲醛进行一次反应;及步骤(b),在反应温度t2下进行二次反应,从而制备由下述化学式1表示的硫代甲基苯酚衍生物,其中,上述硫代甲基苯酚衍生物的制备方法可以满足t1《t2。
[0043]
[化学式1]
[0044][0045]
[化学式2]
[0046][0047]
在式中,r1和r2各自独立地选自氢、氘、c1~c
16
直链或支链烷基、c5~c
16
环烷基或含芳烷基及-ch2sr3中,r3和r4各自选自c1~c
16
直链或支链烷基、c5~c
16
环烷基或含芳烷基中,r
11
和r
22
各自独立地选自氢、氘、c1~c
16
直链或支链烷基、c5~c
16
环烷基或含芳烷基中,n为0或1。
[0048]
参照图1,上述硫代甲基苯酚衍生物的制备方法包括在反应温度t1下进行的一次反应和在反应温度比上述一次反应的温度更高的t2下进行的二次反应,从而可以提高最终产品的纯度,且能够通过使可部分包含的副产物的组成变化来显著改善热稳定性。
[0049]
上述硫代甲基苯酚衍生物的制备方法可以满足95℃《t1+5℃≤t2《120℃。当上述t1的温度为90℃以下时,可能反应进行不充分,当上述t2的温度为120℃以上时,与所使用的能量相比效率可能不充分。当上述t1和t2之间的温度差为5℃以上时,可以有效地实现上述纯度提高和热稳定性改善。
[0050]
上述步骤(a)和步骤(b)可以分别执行1小时至5小时,例如,1小时、1.5小时、2小时、2.5小时、3小时、3.5小时、4小时、4.5小时、5小时或这些值中任意两个值之间的范围内的时间。
[0051]
上述苯酚衍生物可以为选自由邻甲酚、对甲酚、4-丁基苯酚及双酚组成的组中的至少一种。
[0052]
上述步骤(a)可以相对于1当量的上述苯酚衍生物,在0.5当量至50.0当量的溶剂的存在下进行,例如,相对于1当量的上述苯酚衍生物,在0.5当量、1.0当量、1.5当量、2.0当量、2.5当量、3.0当量、3.5当量、4.0当量、4.5当量、5.0当量、5.5当量、6.0当量、6.5当量、7.0当量、7.5当量、8.0当量、8.5当量、9.0当量、9.5当量、10.0当量、10.5当量、11.0当量、11.5当量、12.0当量、12.5当量、13.0当量、13.5当量、14.0当量、14.5当量、15.0当量、15.5当量、16.0当量、16.5当量、17.0当量、17.5当量、18.0当量、18.5当量、19.0当量、19.5当量、20.0当量、20.5当量、21.0当量、21.5当量、22.0当量、22.5当量、23.0当量、23.5当量、24.0当量、24.5当量、25.0当量、25.5当量、26.0当量、26.5当量、27.0当量、27.5当量、28.0当量、28.5当量、29.0当量、29.5当量、30.0当量、30.5当量、31.0当量、31.5当量、32.0当量、32.5当量、33.0当量、33.5当量、34.0当量、34.5当量、35.0当量、35.5当量、36.0当量、36.5当量、37.0当量、37.5当量、38.0当量、38.5当量、39.0当量、39.5当量、40.0当量、40.5当量、41.0当量、41.5当量、42.0当量、42.5当量、43.0当量、43.5当量、44.0当量、44.5当量、45.0当量、45.5当量、46.0当量、46.5当量、47.0当量、47.5当量、48.0当量、48.5当量、49.0当量、49.5当量、50.0当量或这些值中任意两个值之间的范围内的溶剂的存在下进行。当溶剂的含量超出上述范围时,反应性可能会降低。
[0053]
上述溶剂可以为水或醇。例如,上述醇可以为选自由甲醇、乙醇、丙醇、异丙醇和丁
醇组成的组中的至少一种。
[0054]
在上述步骤(a)中,相对于1当量的上述苯酚衍生物,可以使用0.01当量至0.50当量的碱,例如,相对于1当量的上述苯酚衍生物,可以使用0.01当量、0.05当量、0.10当量、0.15当量、0.20当量、0.25当量、0.30当量、0.35当量、0.40当量、0.45当量、0.50当量或这些值中任意两个值之间的范围内的碱。当上述碱的使用量过少时,反应时间不必要地变长,当上述碱的使用量过多时,可能由于副产物而导致产品特性变质。
[0055]
上述杂环碱是环状烷烃(cyclic alkane)、环状烯烃(cyclic alkene)、环状炔烃(cyclic alkyne)或芳族烃(aromatic hydrocarbon)的组成碳原子中的至少一个变成杂原子的,作为一例,上述步骤(a)的杂环碱可以为选自由吡咯、吡咯烷、咪唑、吡啶、哌啶、哌嗪及吡嗪组成的组中的至少一种。
[0056]
在上述步骤(a)中,相对于1当量的上述苯酚衍生物,可以使用0.01当量至0.90当量的酸,例如,相对于1当量的上述苯酚衍生物,可以使用0.01当量、0.05当量、0.10当量、0.15当量、0.20当量、0.25当量、0.30当量、0.35当量、0.40当量、0.45当量、0.50当量、0.55当量、0.60当量、0.65当量、0.70当量、0.75当量、0.80当量、0.85当量、0.90当量或这些值中任意两个值之间的范围内的酸。在上述步骤(a)中的酸的使用量满足上述范围时,反应温度和时间条件可能更有利。
[0057]
上述步骤(a)的酸可以为选自由亚氯酸、磷酸、砷酸、氯醋酸、氢氟酸、亚硝酸、甲酸、苯甲酸、叠氮酸、醋酸、丙酸及碳酸组成的组中的至少一种。
[0058]
作为一例,在杂环碱和酸同时存在的条件下进行上述步骤(a)时,作为反应物的碱和多聚甲醛形成氨甲醇中间体,通过酸转换为反应性较大的亚胺,从而与苯酚之间的反应性最大化,且可以防止碱的氧化。此外,与直链碱相比,杂环碱对用于分子间反应的空间的干扰最小化,从而可以提高反应速率。
[0059]
在上述步骤(a)中,相对于1当量的上述苯酚衍生物,可以使用2.0当量至6.0当量的硫醇衍生物,例如,相对于1当量的上述苯酚衍生物,可以使用2.0当量、2.5当量、3.0当量、3.5当量、4.0当量、4.5当量、5.0当量、5.5当量、6.0当量或这些值中任意两个值之间的范围内的硫醇衍生物。当上述硫醇衍生物的使用量过少时,由于未反应而可能产生例如单硫代甲基苯酚和二硫代甲基苯酚的混合物,当上述硫醇衍生物的使用量过多时,副产物会增加,且纯化时间可能不必要地变长。
[0060]
上述硫醇衍生物可以为选自由辛烷硫醇、癸烷硫醇、十二烷硫醇、苄硫醇和苯硫酚组成的组中的至少一种。
[0061]
在上述步骤(a)中,相对于1当量的上述苯酚衍生物,可以使用2.0当量至6.0当量的多聚甲醛,例如,2.0当量、2.5当量、3.0当量、3.5当量、4.0当量、4.5当量、5.0当量、5.5当量、6.0当量或这些值中任意两个值之间的范围内的多聚甲醛。当上述多聚甲醛的使用量过少时,由于未反应而可能产生例如单硫代甲基苯酚和二硫代甲基苯酚的混合物,当上述多聚甲醛的使用量过多时,纯化时间可能不必要地变长。
[0062]
在上述步骤(b)之后,还可包括用酸清洗上述步骤(b)的产物中的有机层的纯化步骤(c)。在上述有机层中,除了硫代甲基苯酚衍生物之外,作为反应中间体的氨甲醇等残留,导致最终产品变色。因此,除了上述两步反应之外,还可以通过用一定量的酸分解或除去氨甲醇进行纯化来使变色最少化。
[0063]
上述步骤(c)的酸的pka可以为2.0以上,例如,可以为选自由亚氯酸、磷酸、砷酸、氯醋酸、氢氟酸、亚硝酸、甲酸、苯甲酸、叠氮酸、醋酸、丙酸及碳酸组成的组中的至少一种。
[0064]
当上述酸为磷酸时,浓度可以为15%以上,当上述酸为醋酸时,浓度可以大于5%。
[0065]
在上述步骤(c)之后,还可包括用碱或水进行清洗的步骤(d)。
[0066]
上述碱可以为选自由无水碳酸钠、过碳酸钠及碳酸氢钠组成的组中的至少一种。
[0067]
上述步骤(d)可以是中和并去除上述步骤(c)中使用的酸的步骤,但若上述步骤(c)中的酸是浓度大于5%的醋酸,则省略中和工艺,而仅用水清洗即可充分去除副产物,因此在经济上可以是有利的。
[0068]
在上述步骤(d)之后,还可包括在90℃至120℃温度下进行减压浓缩1小时至5小时,分离出由化学式1表示的硫代甲基苯酚衍生物的步骤(e)。上述减压浓缩可以在90℃、95℃、100℃、105℃、110℃、115℃、120℃或这些值中任意两个值之间的范围内的温度下进行1小时、1.5小时、2小时、2.5小时、3小时、3.5小时、4小时、4.5小时、5小时或这些值中任意两个值之间的范围内的时间。
[0069]
在减压浓缩时的温度满足上述范围时,最终产品中的硫醇衍生物残余量可以小于0.1重量%,尤其,当温度为110℃以上时,可以将硫醇衍生物残余量进一步减少至小于0.01重量%。
[0070]
分离出的上述硫代甲基苯酚衍生物在120℃温度条件下放置72小时后的apha值可以小于75、小于70、小于65、小于60、小于55或小于50。
[0071]
下面,将对本说明书的实施例进行更详细说明。但是,下面的实验结果是仅记载上述实施例中具代表性的实验结果的,不能因实施例等而将本说明书的范围和内容缩小或限制性解释。下面未明确示出的本说明书的各种实施例中的每个效果将在相应部分中具体描述。
[0072]
实施例1
[0073]
在100重量份的邻甲酚、3当量的多聚甲醛、2当量的正辛硫醇和0.3当量的哌啶的混合液中添加作为溶剂的1.0当量的水、0.01当量的磷酸及0.1当量的醋酸,然后在100℃下进行反应2小时,升温至115℃,进行反应3小时,获得反应产物。从反应产物中除去水层,将有机层用8.5%醋酸清洗,用水清洗,然后在115℃下减压浓缩3小时,获得作为无色液体的2,4-双(正辛基硫亚甲基)-6-甲基苯酚(2,4-bis(n-octylthiomethyl)-6-methylphenol)。上述获得的2,4-双(正辛基硫亚甲基)-6-甲基苯酚的转化率为100%,纯度为98.0%。确认到残余正辛硫醇含量为0.005%。
[0074]
实施例2
[0075]
在100重量份的邻甲酚、2当量的正辛硫醇、3当量的多聚甲醛和0.3当量的哌啶的混合液中添加作为溶剂的1.0当量的水、0.01当量的磷酸及0.1当量的醋酸,然后在100℃下进行反应2小时,升温至115℃,进行反应3小时,获得反应产物。从反应产物中除去水层,将有机层用8.5%醋酸清洗,用水清洗,然后在100℃下减压浓缩3小时,获得作为无色液体的2,4-双(正辛基硫亚甲基)-6-甲基苯酚。上述获得的2,4-双(正辛基硫亚甲基)-6-甲基苯酚的转化率为100%,纯度为98.1%。确认到残余正辛硫醇含量为0.02%。
[0076]
实施例3
[0077]
在100重量份的邻甲酚、3当量的多聚甲醛、2当量的正辛硫醇和0.3当量的哌啶的
混合液中添加作为溶剂的1.0当量的水、0.01当量的磷酸及0.1当量的醋酸,然后在100℃下进行反应2小时,升温至115℃,进行反应3小时,获得反应产物。从反应产物中除去水层,将有机层用17%磷酸清洗,用10%碳酸钠水溶液清洗,然后在100℃下减压浓缩3小时,获得作为无色液体的2,4-双(正辛基硫亚甲基)-6-甲基苯酚。上述获得的2,4-双(正辛基硫亚甲基)-6-甲基苯酚的转化率为100%,纯度为97.8%。确认到残余正辛硫醇含量为0.03%。
[0078]
实施例4
[0079]
在100重量份的邻甲酚、2当量的正辛硫醇、3当量的多聚甲醛和0.3当量的哌啶的混合液中添加作为溶剂的1.0当量的水、0.01当量的磷酸及0.1当量的醋酸,然后在105℃下进行反应2小时,升温至110℃,进行反应3小时,获得反应产物。从反应产物中除去水层,将有机层用17%磷酸清洗,用10%碳酸钠水溶液清洗,然后在115℃下减压浓缩3小时,获得作为无色液体的2,4-双(正辛基硫亚甲基)-6-甲基苯酚。上述获得的2,4-双(正辛基硫亚甲基)-6-甲基苯酚的转化率为100%,纯度为97.9%。确认到残余正辛硫醇含量为0.006%。
[0080]
实施例5
[0081]
将2当量的正辛硫醇、3当量的多聚甲醛、1.0当量的水、0.01当量的磷酸、0.1当量的醋酸、0.3当量的哌啶及100重量份的邻甲酚在95℃下进行反应2小时,然后在105℃下进行反应3小时,获得反应产物。从反应产物中除去水层,将有机层用8.5%醋酸清洗,用水清洗,然后在115℃下减压浓缩3小时,获得作为无色液体的2,4-双(正辛基硫亚甲基)-6-甲基苯酚。上述获得的2,4-双(正辛基硫亚甲基)-6-甲基苯酚的转化率为100%,纯度为97.1%。确认到残余正辛硫醇含量为0.005%。
[0082]
比较例1
[0083]
在100重量份的邻甲酚、3当量的多聚甲醛、2当量的正辛硫醇和0.2当量的二甲胺的混合液中添加作为溶剂的1.0当量的水和0.15当量的醋酸,然后在120℃下进行反应5小时,获得反应产物。从反应产物中除去水层,将有机层用8.5%醋酸清洗,用水清洗,然后减压浓缩3小时,获得作为无色液体的2,4-双(正辛基硫亚甲基)-6-甲基苯酚。上述获得的2,4-双(正辛基硫亚甲基)-6-甲基苯酚的转化率为100%,纯度为97.0%。
[0084]
比较例2
[0085]
在100重量份的邻甲酚、3当量的多聚甲醛、2当量的正辛硫醇和0.3当量的哌啶的混合液中添加作为溶剂的1.0当量的水、0.01当量的磷酸及0.1当量的醋酸,然后在100℃下进行反应5小时,获得反应产物。从反应产物中除去水层,将有机层用17%磷酸清洗,用10%碳酸钠水溶液清洗,然后减压浓缩3小时,获得作为无色液体的2,4-双(正辛基硫亚甲基)-6-甲基苯酚。上述获得的2,4-双(正辛基硫亚甲基)-6-甲基苯酚的转化率为100%,纯度为96.3%。
[0086]
比较例3
[0087]
除了在清洗有机层时用7%硫酸处理后,用10%碳酸钠水溶液进行后处理之外,其余以与上述比较例2相同的方法获得作为无色液体的2,4-双(正辛基硫亚甲基)-6-甲基苯酚。上述获得的2,4-双(正辛基硫亚甲基)-6-甲基苯酚的转化率为100%,纯度为97.5%。
[0088]
比较例4
[0089]
除了在清洗有机层时用5%硫酸处理后,用10%碳酸钠水溶液进行后处理之外,其余以与上述比较例2相同的方法获得作为无色液体的2,4-双(正辛基硫亚甲基)-6-甲基苯
酚。上述获得的2,4-双(正辛基硫亚甲基)-6-甲基苯酚的转化率为100%,纯度为97.4%。
[0090]
比较例5
[0091]
除了在清洗有机层时用3%硫酸处理后,用10%碳酸钠水溶液进行后处理之外,其余以与上述比较例2相同的方法获得作为无色液体的2,4-双(正辛基硫亚甲基)-6-甲基苯酚。上述获得的2,4-双(正辛基硫亚甲基)-6-甲基苯酚的转化率为100%,纯度为97.9%。
[0092]
比较例6
[0093]
除了在清洗有机层时用1%硫酸处理后,用10%碳酸钠水溶液进行后处理之外,其余以与上述比较例2相同的方法获得作为无色液体的2,4-双(正辛基硫亚甲基)-6-甲基苯酚。上述获得的2,4-双(正辛基硫亚甲基)-6-甲基苯酚的转化率为100%,纯度为97.5%,存在副产物。
[0094]
比较例7
[0095]
除了在清洗有机层时用10%醋酸处理后,用水进行后处理之外,其余以与上述比较例2相同的方法获得作为无色液体的2,4-双(正辛基硫亚甲基)-6-甲基苯酚。上述获得的2,4-双(正辛基硫亚甲基)-6-甲基苯酚的转化率为100%,纯度为97.7%。
[0096]
比较例8
[0097]
除了在清洗有机层时用8.5%醋酸处理后,用10%碳酸钠进行后处理之外,其余以与上述比较例2相同的方法获得作为无色液体的2,4-双(正辛基硫亚甲基)-6-甲基苯酚。上述获得的2,4-双(正辛基硫亚甲基)-6-甲基苯酚的转化率为100%,纯度为97.7%。
[0098]
比较例9
[0099]
除了在清洗有机层时用8.5%醋酸处理后,用水进行后处理之外,其余以与上述比较例2相同的方法获得作为无色液体的2,4-双(正辛基硫亚甲基)-6-甲基苯酚。上述获得的2,4-双(正辛基硫亚甲基)-6-甲基苯酚的转化率为100%,纯度为97.5%。
[0100]
比较例10
[0101]
除了在清洗有机层时用5%醋酸处理后,用10%碳酸钠进行后处理之外,其余以与上述比较例2相同的方法获得作为无色液体的2,4-双(正辛基硫亚甲基)-6-甲基苯酚。上述获得的2,4-双(正辛基硫亚甲基)-6-甲基苯酚的转化率为100%,纯度为97.5%,存在副产物。
[0102]
比较例11
[0103]
除了在清洗有机层时用5%醋酸处理后,用水进行后处理之外,其余以与上述比较例2相同的方法获得作为无色液体的2,4-双(正辛基硫亚甲基)-6-甲基苯酚。上述获得的2,4-双(正辛基硫亚甲基)-6-甲基苯酚的转化率为100%,纯度为97.6%,存在副产物。
[0104]
比较例12
[0105]
将100重量份的邻甲酚、3当量的多聚甲醛、1.0当量的水、0.01当量的磷酸、0.1当量的醋酸、0.3当量的哌啶及2当量的正辛硫醇在105℃下进行反应2小时,然后在95℃下进行反应3小时,获得反应产物。从反应产物中除去水层,将有机层用醋酸和水清洗,然后在115℃下减压浓缩3小时,获得作为无色液体的2,4-双(正辛基硫亚甲基)-6-甲基苯酚,但纯度为70.6%,存在副产物,未反应正辛硫醇的含量为7.16%。
[0106]
比较例13
[0107]
除了在80℃下进行一次反应,在90℃下进行二次反应之外,其余以与实施例5相同
的方式进行工艺,但反应没有充分进行。
[0108]
上述比较例6、10、11和12的副产物是由以下化学式3表示的n-羟甲基哌啶(nhp),通过气相色谱分析确认是否存在该副产物。
[0109]
[化学式3]
[0110][0111]
参照上述实施例至比较例,在一次反应后升高温度来进行二次反应的实施例1至实施例5中,可以制备高纯度的硫代甲基苯酚衍生物。尤其,上述实施例1至5可以实现与在相对较高的120℃下进行反应的比较例1的纯度类似的纯度,或者可以实现更高的纯度。
[0112]
另外,在将有机层用pka为-2的硫酸清洗后用碳酸钠进行后处理时,若硫酸浓度为3%以上,则可以去除副产物,但存在可能发生反应器腐蚀的问题(比较例3至比较例6)。作为气相色谱分析的结果,当使用pka大于2.0的17%磷酸水溶液时,可以去除副产物而没有反应器腐蚀问题(比较例2)。此外,当用浓度大于5%的醋酸清洗有机层时,仅用水后处理也可得到相同纯度的产品,而无需用碳酸钠中和,还不产生副产物(比较例7至比较例11)。
[0113]
此外,可以看出在酸处理和后处理后进行的减压浓缩的温度越高,残余正辛硫醇的含量越显着降低(实施例1至实施例5)。
[0114]
实验例
[0115]
将在上述实施例至比较例中制备的2,4-双(正辛基硫亚甲基)-6-甲基苯酚20g装在小瓶中,放入烘箱中,在120℃条件下测定颜色变化3天。通过测定颜色(apha)确认是否变色。若样品的apha值低,则变色小,若apha值高,则变色严重。热稳定性越低,发生的变色越严重。
[0116]
表1
[0117][0118][0119]
参照表1,即使在实施例1、比较例1、实施例3及比较例2中进行相同的清洗工艺,变色程度也存在差异,因此可以确认热稳定性相对优异。
[0120]
虽然造成这种差异的原因尚不清楚,但这可能是因为通过反应温度不同的两段反
应提高产物的纯度,且杂质组成存在差异。
[0121]
参考上述实例,与通过在t2温度下反应5小时来制备的产品相比,通过在t1温度下反应2小时且在t2温度下反应3小时来制备的产品可以在纯度和热稳定性方面更优异,也可以使能源消耗最小化。
[0122]
上述的本说明书的说明只是例示性的,只要是本说明书的一个方面所属技术领域的普通技术人员,就能理解在不变更本说明书中记载的技术思想或必要特征的情况下,也能轻易变形为其他具体形态。因此,以上所述的实施例在各方面仅是例示性的,但并不局限于此。例如,作为单一型进行说明的各结构部件也能分散进行实施,同样,使用分散的进行说明的结构部件也能以结合的形态进行实施。
[0123]
本说明书的范围是通过所附申请专利范围来表示,而由申请专利范围的意义、范围及其均等概念导出的所有变更或变形的形态应解释为包括在本说明书的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1