用于治疗亨特综合征的方法与流程
用于治疗亨特综合征的方法
1.相关申请的交叉引用
2.本技术要求2020年2月7日提交的美国临时申请序列号 62/971,758、2020年10月14日提交的美国临时申请序列号 63/091,704、2020年11月9日提交的美国临时申请序列号63/111,586 以及2021年1月11日提交的美国临时申请序列号63/135,974的优先权。以上引用的申请的全部内容在此以本文引用的方式并入。
背景技术:
3.亨特综合征(hunter syndrome)或mps ii是一种由ids遗传突变引起的罕见x连锁隐性病症。艾杜糖醛酸2-硫酸酯酶(ids)活性不足会引起糖胺聚糖(gag)硫酸乙酰肝素(hs)和硫酸皮肤素(ds)积聚,并导致多种器官和组织中发生溶酶体功能障碍。大约三分之二的患者显示神经病变表型(nmps ii)。已经批准ids的重组形式治疗亨特综合征,但它对大脑影响甚微,因为难以跨越血脑屏障(bbb)递送重组酶。因此,需要更有效的疗法来治疗亨特综合征的外周和中枢神经系统 (cns)症状。此外,还需要新的方法和生物标志物来评价疾病活动性和对这类新开发的治疗剂的治疗响应。
技术实现要素:
4.因此,本文所述的某些实施方案提供了一种治疗有需要的受试者的亨特综合征的方法,所述方法包括向所述受试者施用治疗有效剂量的本文所述的包含etv:ids蛋白的药物组合物。
5.某些实施方案还提供了一种治疗有需要的受试者的亨特综合征的方法,所述方法包括向所述受试者施用治疗有效剂量的本文所述的包含etv:ids蛋白的药物组合物,其中所述药物组合物的施用使所述受试者的csf中的糖胺聚糖(gag)的水平降低到在健康的受试者或未患亨特综合征的受试者中测量的基线水平。
6.在某些实施方案中,蛋白质包含:
7.a.第一fc多肽,其连接于艾杜糖醛酸2-硫酸酯酶(ids)氨基酸序列、ids变体氨基酸序列或其催化活性片段;和
8.b.第二fc多肽,其包含根据eu编号的以下氨基酸残基:在位置380处的trp、leu或glu;在位置384处的tyr;在位置386处的 thr;在位置387处的glu;在位置388处的trp;在位置389处的 ser或ala;在位置390处的ser或asn;在位置413处的thr;在位置415处的glu;在位置416处的glu;以及在位置421处的phe。
9.在某些实施方案中,药物组合物还包含药学上可接受的赋形剂 (例如,药学上可接受的载体)。
10.在某些实施方案中,药物组合物每周施用一次。
11.在某些实施方案中,向受试者静脉内施用药物组合物。
12.在某些实施方案中,治疗有效剂量(例如,安全且治疗有效的剂量)通过在治疗后使用一种或多种选自由以下组成的组的评估检查受试者来评估:生物标志物评估、安全性
评估、神经认知评估、临床评估、功能评估和生活质量评估。
13.在某些实施方案中,药物组合物的施用治疗受试者中的亨特综合征的一种或多种症状(例如,神经行为缺陷、听觉缺陷和/或肌肉骨骼异常)。因此,在某些实施方案中,药物组合物的施用改变受试者的一个或多个疾病相关参数。在某些实施方案中,参数是本文所述的参数。在某些实施方案中,参数使用生物标志物评估、安全性评估、神经认知评估、临床评估、功能评估或生活质量评估来评估。在某些实施方案中,参数使用本文所述的评估来评估。
14.在某些实施方案中,与参数改变相关的响应持续时间为至少约2 周、4周、6周、8周、10周、12周、14周、16周、18周、20周、 24周、26周、28周、30周、32周、36周或更长时间。在某些实施方案中,响应持续时间为至少约24周。
15.在某些实施方案中,方法还包括基于本文所述的参数调整药物组合物的剂量。
16.某些实施方案还提供了治疗有需要的受试者的亨特综合征的方法,所述方法包括以约3mg/kg的每周剂量向所述受试者施用蛋白质,并且其中所述蛋白质包含:(a)第一fc多肽,其连接于艾杜糖醛酸2
‑ꢀ
硫酸酯酶(ids)氨基酸序列、ids变体氨基酸序列或其催化活性片段;和(b)第二fc多肽,其包含根据eu编号的以下氨基酸残基:在位置 380处的trp、leu或glu;在位置384处的tyr;在位置386处的thr;在位置387处的glu;在位置388处的trp;在位置389处的ser或 ala;在位置390处的ser或asn;在位置413处的thr;在位置415 处的glu;在位置416处的glu;以及在位置421处的phe。
17.某些实施方案提供了一种治疗有需要的受试者的亨特综合征的方法,所述方法包括以约7.5mg/kg的每周剂量向所述受试者施用蛋白质,并且其中所述蛋白质包含:(a)第一fc多肽,其连接于艾杜糖醛酸2-硫酸酯酶(ids)氨基酸序列、ids变体氨基酸序列或其催化活性片段;和(b)第二fc多肽,其包含根据eu编号的以下氨基酸残基:在位置380处的trp、leu或glu;在位置384处的tyr;在位置386 处的thr;在位置387处的glu;在位置388处的trp;在位置389 处的ser或ala;在位置390处的ser或asn;在位置413处的thr;在位置415处的glu;在位置416处的glu;以及在位置421处的phe。
18.某些实施方案提供了一种治疗有需要的受试者的亨特综合征的方法,所述方法包括以约15mg/kg的每周剂量向所述受试者施用蛋白质,并且其中所述蛋白质包含:(a)第一fc多肽,其连接于艾杜糖醛酸2-硫酸酯酶(ids)氨基酸序列、ids变体氨基酸序列或其催化活性片段;和(b)第二fc多肽,其包含根据eu编号的以下氨基酸残基:在位置380处的trp、leu或glu;在位置384处的tyr;在位置386 处的thr;在位置387处的glu;在位置388处的trp;在位置389 处的ser或ala;在位置390处的ser或asn;在位置413处的thr;在位置415处的glu;在位置416处的glu;以及在位置421处的phe。
19.某些实施方案提供了一种治疗有需要的受试者的亨特综合征的方法,所述方法包括以约30mg/kg的每周剂量向所述受试者施用蛋白质蛋白质,并且其中所述蛋白质包含:(a)第一fc多肽,其连接于艾杜糖醛酸2-硫酸酯酶(ids)氨基酸序列、ids变体氨基酸序列或其催化活性片段;和(b)第二fc多肽,其包含根据eu编号的以下氨基酸残基:在位置380处的trp、leu或glu;在位置384处的tyr;在位置386处的thr;在位置387处的glu;在位置388处的trp;在位置389处的ser或ala;在位置390处的ser或asn;在位置413处的thr;在位置415处的glu;在位置416处的glu;以及在位置421 处的phe。
20.在某些实施方案中,第二fc多肽特异性结合于转铁蛋白受体。
21.在某些实施方案中,ids氨基酸序列与seq id no:70具有至少 90%同一性。
22.在某些实施方案中,ids氨基酸序列与seq id no:90具有至少 90%同一性。
23.在某些实施方案中,ids氨基酸序列包含选自由seq id no:70、 90、170和174组成的组的序列。
24.在某些实施方案中,ids氨基酸序列包含选自由seq id no:70、170和174组成的组的序列。
25.在某些实施方案中,ids氨基酸序列包含选自由seq id no:90、 170和174组成的组的序列。
26.在某些实施方案中,连接于ids氨基酸序列的第一fc多肽包含 seq id no:91、171、175、213、215或217的氨基酸序列。在某些实施方案中,连接于ids氨基酸序列的第一fc多肽包含seq id no: 91、171或175的氨基酸序列。在某些实施方案中,连接于ids氨基酸序列的第一fc多肽包含seq id no:213、215或217的氨基酸序列。
27.在某些实施方案中,ids氨基酸序列连接于第一fc多肽的n端。
28.在某些实施方案中,第二fc多肽包含在位置380处的leu;在位置389处的ala;以及在位置390处的ser。在某些实施方案中,第二fc多肽包含在位置380处的glu;在位置389处的ala;以及在位置390处的asn。在某些实施方案中,第二fc多肽包含在位置380 处的trp;在位置389处的ser;以及
29.在位置390处的ser。在某些实施方案中,第二fc多肽包含在位置380处的leu;在位置389处的ser;以及在位置390处的ser。
30.在某些实施方案中,连接于ids氨基酸序列的第一fc多肽包含 seq id no:175;并且第二fc多肽包含seq id no:92。
31.在某些实施方案中,连接于ids氨基酸序列的第一fc多肽包含 seq id no:217;并且第二fc多肽包含seq id no:189。
32.在某些实施方案中,连接于ids氨基酸序列的第一fc多肽包含 seq id no:175;并且第二fc多肽包含seq id no:95。在某些实施方案中,第二fc多肽还包含seq id no:89,其中seq id no:89 连接于seq id no:95的n端。
33.在某些实施方案中,连接于ids氨基酸序列的第一fc多肽包含 seq id no:217;并且第二fc多肽包含seq id no:191。在某些实施方案中,第二fc多肽还包含seq id no:89,其中seq id no:89 连接于seq id no:191的n端。
34.在某些实施方案中,连接于ids氨基酸序列的第一fc多肽包含 seq id no:175;并且第二fc多肽包含seq id no:168。
35.在某些实施方案中,连接于ids氨基酸序列的第一fc多肽包含 seq id no:217;并且第二fc多肽包含seq id no:207。
36.在某些实施方案中,连接于ids氨基酸序列的第一fc多肽包含 seq id no:175;并且第二fc多肽包含seq id no:169。
37.在某些实施方案中,连接于ids氨基酸序列的第一fc多肽包含 seq id no:217;并且第二fc多肽包含seq id no:199。
38.某些实施方案还提供了一种包含蛋白质的药物组合物,所述药物组合物用于治疗
亨特综合征的方法中,所述方法包括向有需要的受试者施用治疗有效剂量的所述药物组合物,其中所述蛋白质包含:
39.a.第一fc多肽,其连接于艾杜糖醛酸2-硫酸酯酶(ids)氨基酸序列、ids变体氨基酸序列或其催化活性片段;和
40.b.第二fc多肽,其包含根据eu编号的以下氨基酸残基:在位置380处的trp、leu或glu;在位置384处的tyr;在位置386处的thr;在位置387处的glu;在位置388处的trp;在位置389处的ser或ala;在位置390处的ser或asn;在位置413处的thr;在位置415处的glu;在位置416处的glu;以及在位置421处的phe。
41.某些实施方案还提供了蛋白质用于制备供治疗亨特综合征的药物的用途,所述治疗通过向有需要的受试者施用治疗有效剂量的所述药物进行,其中所述蛋白质包含:
42.a.第一fc多肽,其连接于艾杜糖醛酸2-硫酸酯酶(ids)氨基酸序列、ids变体氨基酸序列或其催化活性片段;和
43.b.第二fc多肽,其包含根据eu编号的以下氨基酸残基:在位置380处的trp、leu或glu;在位置384处的tyr;在位置386处的thr;在位置387处的glu;在位置388处的trp;在位置389处的ser或ala;在位置390处的ser或asn;在位置413处的thr;在位置415处的glu;在位置416处的glu;以及在位置421处的phe。
44.附图简述
45.图1.idsko小鼠中相对于年龄匹配的对照的脑hs/ds(gag)积聚。对于每个年龄分组,野生型(wt)展示在左侧并且idsko展示在右侧。
46.图2a-2d.相对于年龄匹配的对照,溶酶体脂质(gm2、gm3、bmp和glccer)积聚在idsko小鼠的脑中。在图2b-2d中,对于每个年龄分组,代表wt的条展示在左侧并且代表idsko的条展示在右侧。
47.图3.相对于年龄匹配的对照,在idsko小鼠的血清中观察到bmp的水平升高。对于每个年龄分组,代表野生型(wt)的条展示在左侧并且代表idsko的条展示在右侧。
48.图4.相对于年龄匹配的对照,在idsko小鼠的csf中观察到溶酶体脂质(gd1a/b、gm3、bmp和glccer)的水平升高。对于每个年龄分组,代表野生型(wt)的条展示在左侧,并且代表idsko的条展示在右侧。
49.图5a-5b.etv:ids的外周施用(4周处理)校正了idsko小鼠中的(图5a)脑和(图5b)csfgag积聚。图表显示平均值
±
sem和p值:单向anova与邓尼特多重比较检验(dunnettmultiplecomparisontest);*p≤0.05,**p≤0.01,***p≤0.001,且****p≤0.0001。
50.图6.etv:ids的外周施用(4周处理)校正了idsko脑中的溶酶体脂质(神经节苷脂)积聚。图表显示平均值
±
sem和p值:单向anova与邓尼特多重比较检验(dunnettmultiplecomparisontest);*p≤0.05,**p≤0.01,***p≤0.001,且****p≤0.0001。
51.图7a-7b.etv:ids的外周施用(4周处理)校正了idsko脑中的溶酶体脂质(glccer)积聚。图表显示平均值
±
sem和p值:单向anova与邓尼特多重比较检验(dunnettmultiplecomparisontest);*p≤0.05,**p≤0.01,***p≤0.001,且****p≤0.0001。
52.图8.etv:ids的外周施用(4周处理)校正了idsko脑中的溶酶体脂质(bmp)积聚。图表显示平均值
±
sem和p值:单向anova与邓尼特多重比较检验;*p≤0.05,**p≤0.01,***p≤0.001,且****p≤0.0001。
53.图9.示出用媒介物、etv:ids或elaprase(艾杜硫酸酯酶 (idursulfase))处理的ids ko小鼠的脑中的脂质水平的热图。变化倍数是与wt相比。
54.图10.etv:ids的外周施用校正了ids ko脑中的trem2积聚。图表显示平均值
±
sem和p值:单向anova与邓尼特多重比较检验; ****p 0.0001。
55.图11.etv:ids的外周施用减少ids ko;tfr
mu/hu ki小鼠中csf 可溶性trem2(strem2)水平的积聚。
56.图12a-12c.用媒介物或3、10、20或40mg/kg etv:ids处理的 ids ko小鼠中的血清(图12a)、脑(图12b)和csf(图12c)hs/ds (gag)积聚。
57.图13a-13c.与用媒介物处理的ids ko小鼠相比,etv:ids的外周施用校正了用3、10、20或40mg/kg etv:ids处理的ids ko 小鼠脑中的gm3(图13a)、glccer(图13b)和bmp(图13c)积聚。图表显示平均值
±
sem和p值:单向anova与邓尼特多重比较检验; *p≤0.05,**p≤0.01,***p≤0.001,且****p≤0.0001。
58.图14a-14b.与用媒介物处理的ids ko小鼠相比,etv:ids的施用减少来自ids ko小鼠的脑(图14a)和csf(图14b)中的单独 gag物质(d0s0、d0a0和d0a4)的水平。图表显示平均值
±
sem和p 值:单向anova与邓尼特多重比较检验;**p≤0.01,***p≤0.001,且****p≤0.0001。
59.图15a.相对于tfr
mu/hu ki对照,从ids ko;tfr
mu/hu ki小鼠分离的小胶质细胞、星形胶质细胞和神经元中的gag水平(每组n=3-5 只小鼠)。所有数据都显示为平均值
±
sem;未配对学生t检验(student’st-test)p≤0.05*,0.001***。
60.图15b.在媒介物处理的tfr
mu/hu ki和etv:ids(40mg/kg)处理的ids ko;tfr
mu/hu ki小鼠中给药后2小时通过facs富集的神经元、星形胶质细胞和小胶质细胞细胞群体中etv:ids的分布;每组n=4 只小鼠。图表显示平均值
±
sem;双向anova与斯达克检验(sidak’stest);**p≤0.01,***p≤0.001,且****p≤0.0001。
61.图16.来自ids ko;tfr
mu/hu ki小鼠的神经元、星形胶质细胞和小胶质细胞中的gag积聚减少,小鼠静脉内给予40mg/kg etv:ids,一周一次,持续四周。数据显示为平均值
±
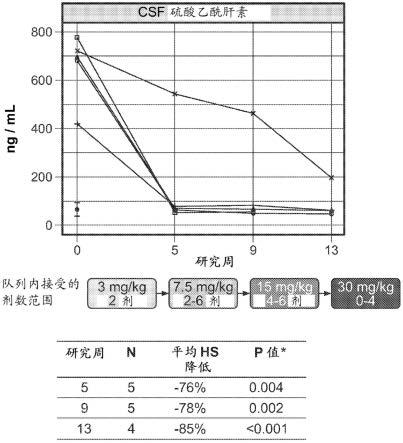
sem;单向anova与图基多重比较检验(tukey
′
s multiple comparison test);*p≤0.05,**p≤ 0.01,****p≤0.0001。
62.图17.来自ids ko;tfr
mu/hu ki小鼠的神经元、星形胶质细胞和小胶质细胞中的神经节苷脂积聚减少,小鼠静脉内给予40mg/kgetv:ids,一周一次,持续四周。数据显示为平均值
±
sem;单向 anova与图基多重比较检验;*p≤0.05,**p≤0.01,****p≤0.0001。
63.图18.来自ids ko;tfr
mu/hu ki小鼠的神经元、星形胶质细胞和小胶质细胞中的葡萄糖基神经酰胺积聚减少,小鼠静脉内给予40 mg/kg etv:ids,一周一次,持续四周。数据显示为平均值
±
sem;单向anova与图基多重比较检验;*p≤0.05,**p≤0.01,****p≤ 0.0001。
64.图19.来自ids ko;tfr
mu/hu ki小鼠的神经元、星形胶质细胞和小胶质细胞中的bmp改变被拯救,小鼠静脉内给予40mg/kgetv:ids,一周一次,持续四周。数据显示为平均值
±
sem;单向 anova与图基多重比较检验;*p≤0.05,**p≤0.01,****p≤0.0001。
65.图20.在四次每周剂量的媒介物、艾杜硫酸酯酶或etv:ids之后,野生型和ids ko;tfr
mu/hu ki小鼠的冠状脑切片的h&e染色(顶图)和maldi ms图像(中间和底图)。中间图示出
etv:ids共13次每周剂量进行处理的小鼠的肝(图28a)和尿液(图28b)中的gag水平并与媒介物处理和tfr
mu/hu
ki小鼠进行比较。尿液gag水平归一化至肌酐。计算的值包括相对于tfr
mu/hu
ki的倍数、治疗效率百分比和相对于媒介物处理的idsko;tfr
mu/hu
ki小鼠的减少百分比(****p《0.0001;误差条=sem)。
74.图29.在etv:ids处理之后脑溶酶体脂质积聚的减少。评估用1mg/kg或3mg/kgetv:ids共13次每周剂量进行处理的小鼠的脑中的溶酶体脂质葡萄糖基神经酰胺(左图)、gm3(中图)和bmp(右图)并与媒介物处理和tfr
mu/hu
ki小鼠进行比较。计算的值包括相对于tfr
mu/hu
ki的倍数、治疗效率百分比和相对于媒介物处理的idsko;tfr
mu/hu
ki小鼠的减少百分比(****p《0.0001;误差条=sem)。
75.图30.在etv:ids处理之后csf溶酶体脂质积聚的减少。评估用1mg/kg或3mg/kgetv:ids共13次每周剂量进行处理的小鼠的csf中的溶酶体脂质葡萄糖基神经酰胺(左图)、gm3(中图)和bmp(右图)并与媒介物处理和tfr
mu/hu
小鼠进行比较。计算的值包括相对的倍数tfr
mu/hu
、治疗效率百分比和相对于的减少百分比媒介物处理的idsko;tfr
mu/hu
小鼠(*p《0.05;***p《0.001;****p《0.0001;误差条=sem)。
76.图31a-31c.3月龄、6月龄和9月龄的野生型和ids敲除小鼠中的nf-l浓度的散布图。图31a和31b中分别示出了9月龄小鼠的血清和csf中的nf-l水平。图31c中示出了不同年龄的小鼠队列的csf中的nf-l水平。数据显示为平均值+/-sem,p值通过未配对t检验分析来获得。
77.图32.csf神经丝轻链(nf-l)在施用etv:ids之后减少。评估用1mg/kg或3mg/kgetv:ids共13次每周剂量进行处理的小鼠的csf中的神经丝轻链(nf-l)水平并与媒介物处理和tfr
mu/hu
ki小鼠进行比较。计算的值包括相对于tfr
mu/hu
ki的倍数、治疗效率百分比和相对于媒介物处理的idsko;tfr
mu/hu
ki小鼠的减少百分比。如通过格拉布斯检验(grubbstest)或rout方法测定,从tfr
mu/hu
媒介物处理和3mg/kgetv:ids处理的组中去除一个离群值(*p《0.05;***p《0.001;误差条=sem)。
78.图33.etv:ids减少外周和cnsgag。评估idsko;tfr
mu/hu
小鼠的肝、脑和csf中的gag水平并与媒介物处理和未患病的tfr
mu/hu
小鼠进行比较。图表显示平均值
±
sem:单向anova与图基多重比较检验;*p《0.05,**p《0.01,***p《0.001,且****p《0.0001。
79.图34.etv:ids减少血清和csf的nf-l水平。评估idsko;tfr
mu/hu
小鼠的血清(左图)和csf(右图)中的nf-l水平并与媒介物处理和未患病的tfr
mu/hu
小鼠进行比较。图表显示平均值
±
sem:单向anova与图基多重比较检验;*p《0.05,**p《0.01,***p《0.001,且****p《0.0001。
80.图35.etv:ids改善idsko;tfr
mu/hu
小鼠中的某些神经行为缺陷。在加速踏车上成功完成奔跑试验的小鼠的比例(费希尔精确检验(fisherexacttest)或卡方检验(chi-squaretest))。媒介物处理的tfr
mu/hu
小鼠与idsko;tfr
mu/hu
小鼠进行比较,或如括号所指示;*p《0.05,**p《0.001,***p《0.0005,且****p《0.0001。
81.图36.etv:ids改善idsko;tfr
mu/hu
小鼠中的某些神经行为缺陷。将3个试验中的顺着杆下降的等待时间求平均值(线性混合效应模型)。图表显示平均值
±
sem。媒介物处理的tfr
mu/hu
小鼠与idsko;tfr
mu/hu
小鼠进行比较,或如括号所指示;*p《0.05,**p《0.001,***p《0.0005,且****p《0.0001。
82.图37.etv:ids改善ids ko;tfr
mu/hu
小鼠中的某些神经行为缺陷。在前脉冲抑制测定法中计算(线性模型)惊吓抑制水平。图表显示平均值
±
sem。媒介物处理的tfr
mu/hu
小鼠与ids ko;tfr
mu/hu
小鼠进行比较,或如括号所指示;*p《0.05,**p《0.001,***p《0.0005,且 ****p《0.0001。
83.图38.etv:ids使ids ko;tfr
mu/hu
小鼠中的某些神经行为缺陷正常化。在主动位置回避测定法中,训练小鼠回避未标记的厌恶区(橙色),其中一旦进行该区域,就施以轻微的足底电击。在每个测试阶段期间测量进入厌恶区的次数(线性混合效应模型,评估idsko;tfr
mu/hu
小鼠中的处理作用)。图表显示平均值
±
sem。媒介物处理的tfr
mu/hu
小鼠与ids ko;tfr
mu/hu
小鼠进行比较,或如括号所指示; *p《0.05,**p《0.001,***p《0.0005,且****p《0.0001。
84.图39.etv:ids使ids ko;tfr
mu/hu
小鼠中的某些神经行为缺陷正常化。第三试验和恢复试验中进入厌恶区的次数(威尔科克森秩和检验(wilcoxon sum rank test))。图表显示平均值
±
sem除外。媒介物处理的tfr
mu/hu
小鼠与ids ko;tfr
mu/hu
小鼠进行比较,或如括号所指示; *p《0.05,**p《0.001,***p《0.0005,且****p《0.0001。
85.图40.etv:ids使ids ko;tfr
mu/hu
小鼠中的某些神经行为缺陷正常化。基于恢复试验期间进入厌恶区的次数的表现分类;差(》1),好 (1),最好(0)。费希尔精确检验。媒介物处理的tfr
mu/hu
小鼠与idsko;tfr
mu/hu
小鼠进行比较,或如括号所指示;*p《0.05,**p《0.001, ***p《0.0005,且****p《0.0001。
86.图41.观察到三个小鼠处理队列在热板测定中具有类似的疼痛响应并在视觉悬崖测定中对厌恶位置适当避开。在热板测试中测量后爪退缩以评估脊椎上的伤害性感受(威尔科克森秩和检验(wilcoxonrank sum test),ns)(左图)。小鼠的视觉功能通过在视觉悬崖测试中评估相比于深的区域它们对浅的区域的偏好来评估(卡方检验,ns)(右图)。图表显示平均值
±
sem。媒介物处理的tfr
mu/hu
小鼠与idsko;tfr
mu/hu
小鼠进行比较,或如括号所指示;*p《0.05,**p《0.001, ***p《0.0005,且****p《0.0001。
87.图42.etv:ids改善ids ko;tfr
mu/hu
小鼠的听觉异常。来自媒介物处理的tfr
mu/hu
、媒介物处理的ids ko;tfr
mu/hu
小鼠和经过etv:ids 处理的ids ko;tfr
mu/hu
小鼠的耳道的代表性h&e显微照片。检验的 ids ko;tfr
mu/hu
小鼠中的鼓泡(tb)具有流出物和/或慢性中耳炎,如细胞碎片和渗出物的存在(黑色箭头)和炎性细胞浸润使鼓膜(tm)扩大所证明(图a中的放大率更高)。tb内层的更高放大率(图b)显示水肿或致密结缔组织(纤维化)使tb上皮细胞(ep)的粘膜下层(sm)扩大; eam=外听道;bm=骨髓细胞。纤维性息肉也是明显的(黄色箭头)。
88.图43.etv:ids改善ids ko;tfr
mu/hu
小鼠的面部形态学。动物缩短、加宽的鼻子的严重性的定性评估(箭头)。每个面部评分的代表性图像展示在左图上。图表显示每个种类内的小鼠数目:费希尔精确检验;****p《0.0001。
89.图44.etv:ids改善ids ko;tfr
mu/hu
小鼠中的骨骼异常。界定感兴趣区域的股骨的代表性图像,用于分析皮质和小梁骨;来自媒介物处理的tfr
mu/hu
(n=5)、媒介物处理的ids ko;tfr
mu/hu
小鼠(n=5)和经过etv:ids处理的ids ko;tfr
mu/hu
小鼠(n=5)的代表性横截面图像。
90.图45.etv:ids改善ids ko;tfr
mu/hu
小鼠中的骨骼异常。股骨小梁的微型-ct扫描的
定量分析。图表显示平均值
±
sem:单向anova 与图基多重比较检验;*p≤0.05,***p≤0.001,且****p≤0.0001。
91.图46.etv:ids改善ids ko;tfr
mu/hu
小鼠中的骨骼异常。(股骨皮质骨的微型-ct扫描的定量分析。图表显示平均值
±
sem:单向 anova与图基多重比较检验;*p≤0.05,***p≤0.001,且****p≤ 0.0001。
92.图47.展示对经诊断患有mps ii的患者的非随机、多中心、前瞻性、观察性研究的评估的方案。
93.图48.展示经诊断患有mps ii的患者的1/2期研究的剂量递增和评估的方案。待定1(tbd1):子队列b1和b2内的受试者可以基于队列a和队列b安全性和生物标志物结果进行剂量递增;然而,给药将不超过30mg/kg。tbd2:队列c的给药将基于队列a和队列b 安全性和生物标志物的结果来决定。
94.图49.在四次每周剂量之后etv:ids在统计上减少mps ii患者中的csf gag(硫酸乙酰肝素、硫酸皮肤素)水平。p值通过相对于基线的平均变化百分比的t检验比较来确定。
95.图50a-50b.在12次每周剂量etv:ids之后mps ii患者的csf 中的硫酸乙酰肝素(图50a)和硫酸皮肤素(图50b)水平。使用30个成人csf样品确定正常范围(黑色圆圈)(范围10-90百分位数);成人和儿童csf gag水平是类似的(hendriksz等人,mol.genet.metab.rep., 5:103-106(2015))。p值通过相对于基线的平均变化百分比的t检验比较来确定。
96.图51a-51b.在8次每周剂量etv:ids之后mps ii患者的尿液中的硫酸乙酰肝素(图51a)和硫酸皮肤素(图51b)水平。p值通过相对于基线的平均变化百分比的t检验比较来确定。
97.图52a-52b.在8次每周剂量etv:ids之后mps ii患者的csf 中的gm3(图52a)和bmp(图52b)水平。各个患者数据展示在上左边,并且相对于基线的组平均变化%(δbl)展示在右边。p值通过相对于基线的平均变化百分比的t检验比较来确定。
具体实施方式
98.亨特综合征,具体来说神经认知表型,仍然有着巨大的未满足的医疗需求。本文描述了对称为etv:ids的特定酶替代疗法的评估,该疗法能够跨越bbb并治疗外周和cns亨特综合征表现,包括神经行为缺陷、听觉缺陷和肌肉骨骼异常。本文描述了示例性etv:ids 蛋白,并且可使用一系列评估(例如,一项或多项评估),包括生物标志物、安全性、神经认知、临床、功能和生活质量评估来评估疾病活动性和对etv:ids的治疗响应。举例来说,对本文所述的csf、血清和尿液的生物标志物,包括糖胺聚糖(gag)物质、cns溶酶体脂质积聚指示物(鞘脂、神经节苷脂和双(单酰基甘油)磷酸酯(bmp)物质)、小胶质细胞激活和神经炎症(strem2;细胞因子)和神经轴神经丝轻链(nf-l)的探测可用于鉴定和评估etv:ids的安全和治疗有效剂量。在一些实施方案中,在从静脉内艾杜硫酸酯酶治疗(例如elaprase)转变成用etv:ids治疗后本文所述的csf、血清和尿液的生物标志物可发生变化。
99.本文还描述了对etv:ids或包括etv:ids的药物组合物的治疗有效剂量的探测,其显著降低亨特综合征患者中的csf gag水平。
100.在一些实施方案中,施用的etv:ids的剂量使得csf gag水平正常化。此外,如本文
所述,施用的剂量对患者中的csf溶酶体脂质水平以及尿液gag水平可具有有益的影响。
101.生物标志物评估
102.可使用一系列本文所述的生物标志物评估疾病活动性和对 etv:ids的治疗响应。具体地说,这些生物标志物包括患有亨特综合征的受试者中糖胺聚糖(gag)和特定脂质(即,鞘脂、神经节苷脂和 bmp)的积聚,以及nf-l和trem2(可基于strem2水平测量)的积聚。另外,增加浓度的细胞因子也可以用作神经炎症的生物标志物。因此,可评估这些分子/脂质/蛋白质中的一者或多者的浓度并相对于基线水平或对照(例如,如本文所述的基线治疗前水平)进行比较。在某些实施方案中,评估例如在开始治疗之后6个月、12个月和/或18 个月进行。
103.在某些实施方案中,包含etv:ids的药物组合物的施用使来自受试者的样品中的一种或多种分析物的水平与对照相比降低,其中所述一种或多种分析物选自由以下组成的组:gag、nf-l、strem2、细胞因子、bmp、神经节苷脂和鞘脂。在某些实施方案中,包含 etv:ids的药物组合物的施用使来自受试者的样品中的一种或多种分析物的水平与对照相比降低了至少约10%、15%、20%、25%或30%,其中所述一种或多种分析物选自由以下组成的组:gag、nf-l、 strem2、细胞因子、bmp、神经节苷脂和鞘脂。在某些实施方案中,对照是没有施用药物组合物的亨特综合征患者。在某些实施方案中,对照是治疗之前的受试者。
104.在某些实施方案中,药物组合物的施用使来自受试者的样品中的一种或多种分析物的水平降低到基线水平,其中所述一种或多种分析物选自由以下组成的组:gag、nf-l、strem2、细胞因子、bmp、神经节苷脂和鞘脂。在某些实施方案中,在来自健康个体的样品中测量基线水平。在某些实施方案中,在来自未患亨特综合征的受试者的样品中测量基线水平。
105.如本文所用,短语“样品”或“生理样品”意指从含有所关注的分析物,例如多糖、蛋白质和/或脂质的受试者获得的生物样品。因此,可以在例如分子、脂质或蛋白质水平下评估样品。在某些实施方案中,生理样品包含组织、脑脊髓液(csf)、尿、血液、血清或血浆。在某些实施方案中,样品包含组织,例如脑、肝、肾、肺或脾。样品可包括流体。在某些实施方案中,样品包含csf。在某些实施方案中,样品包含血液和/或血浆。在某些实施方案中,样品包含血清。在某些实施方案中,样品包含cns组织(例如脑组织)。
106.在某些实施方案中,药物组合物的施用使受试者的器官、组织或流体(例如,血液、血浆、血清、csf或尿液)中的一种或多种分析物的水平与对照相比降低,其中所述一种或多种分析物选自由以下组成的组:gag、nf-l、strem2、细胞因子、bmp、神经节苷脂和鞘脂。在某些实施方案中,药物组合物的施用使受试者的器官、组织或流体 (例如,血液、血浆、血清、csf或尿液)中的一种或多种分析物的水平与对照相比降低了至少约10%、15%、20%、25%或30%,其中所述一种或多种分析物选自由以下组成的组:gag、nf-l、strem2、细胞因子、bmp、神经节苷脂和鞘脂。在某些实施方案中,对照是没有施用药物组合物的亨特综合征患者。在某些实施方案中,对照是治疗之前的受试者。举例来说,在某些实施方案中,药物组合物的施用使受试者的csf中的一种或多种分析物的水平降低了至少约10%、 15%、20%、25%或30%,其中所述降低是相对于在施用之前受试者中的相应一种或多种分析物的水平,其中所述一种或多种分析物选自由以下组成的组:gag、nf-l、strem2、细胞因子、bmp、神经节苷脂和鞘脂。
107.在某些实施方案中,药物组合物的施用使受试者的器官、组织或流体(例如,csf、血液、血浆、血清或尿液)中的一种或多种分析物的水平降低到基线水平,其中所述一种或多种分析物选自由以下组成的组:gag、nf-l、strem2、细胞因子、bmp、神经节苷脂和鞘脂。在某些实施方案中,在健康个体中测量基线水平。在某些实施方案中,在未患亨特综合征的受试者中测量基线水平。
108.糖胺聚糖(gag)
109.ids酶活性不足或缺乏会导致cns和外周中的糖胺聚糖(gag) 硫酸乙酰肝素(hs;d0a0和d0s0)和硫酸皮肤素(ds;d0a4)积聚,以及多个器官和组织中的溶酶体功能障碍。因此,可评估患有亨特综合征的受试者中(例如,来自施用etv:ids的受试者的治疗后样品中) 的总gag的浓度或一种或多种gag物质的浓度。可使用本领域已知的方法,例如使用液相色谱质谱(lcms)测定法(参见例如,实施例) 定量gag浓度水平。
110.在某些实施方案中,药物组合物的施用使受试者的器官、组织或流体中的gag的水平与对照相比降低。在某些实施方案中,受试者的器官、组织或流体中的gag的水平与对照相比降低了至少约30%、 40%、50%、60%、70%、80%、90%、95%或更多。在某些实施方案中,药物组合物的施用使受试者的器官、组织或流体中的gag的水平降低到基线水平(例如在健康的受试者或未患亨特综合征的受试者中测量的水平)。
111.在某些实施方案中,药物组合物的施用使受试者的cns中的 gag的水平与对照相比降低。在某些实施方案中,受试者的cns中的gag的水平与对照相比降低了至少约30%、40%、50%、60%、 70%、80%、90%、95%或更多。在某些实施方案中,药物组合物的施用使受试者的cns中的gag的水平降低到基线水平(例如在健康的受试者或未患亨特综合征的受试者中测量的水平)。
112.在某些实施方案中,药物组合物的施用使受试者的csf中的 gag的水平与对照相比降低。在某些实施方案中,受试者的csf中的gag的水平与对照相比降低了至少约30%、40%、50%、60%、 70%、80%、90%、95%或更多。在某些实施方案中,在至少1、2、3、 4、5、6、7、8、9、10、15、20次或更多次每周剂量之后受试者的 csf中的gag的水平与对照相比降低了至少约30%、40%、50%、 60%、70%、80%、90%、95%或更多。在某些实施方案中,受试者的 csf中的gag的降低是相对于在施用之前受试者中gag的csf水平。举例来说,在某些实施方案中,在至少4次每周剂量后药物组合物的施用使受试者的csf中的gag的水平降低了至少50%、60%、 70%、75%、80%、85%或90%,其中所述降低是相对于在施用之前受试者中gag的csf水平。举例来说,在某些实施方案中,在至少 4次每周剂量后药物组合物的施用使受试者的csf中的硫酸乙酰肝素的水平降低了至少80%,其中所述降低是相对于在施用之前所述受试者中的csf硫酸乙酰肝素水平。在某些实施方案中,在4次每周剂量后药物组合物的施用使受试者的csf中的糖胺聚糖(gag)的水平降低了至少50%、60%、70%、75%、80%、85%或90%。在某些实施方案中,在至少8次每周剂量后药物组合物的施用使受试者的csf 中的糖胺聚糖(gag)的水平降低了至少50%、60%、70%、75%、80%、 85%或90%,其中所述降低是相对于在施用之前受试者中gag的csf 水平。在某些实施方案中,在8次每周剂量后药物组合物的施用使受试者的csf中的糖胺聚糖(gag)的水平降低了至少50%、60%、70%、 75%、80%、85%或90%。在某些实施方案中,在至少12次每周剂量后药物组合物的施用使受试者的csf中的gag的水平降低了至少约 50%、60%、70%、75%、80%、85%
或90%,其中所述降低是相对于在施用之前受试者中gag的csf水平。举例来说,在某些实施方案中,在至少12次每周剂量后药物组合物的施用使受试者的csf中的硫酸乙酰肝素的水平降低了至少70%,其中所述降低是相对于在施用之前受试者中的csf硫酸乙酰肝素水平。在某些实施方案中,在12 次每周剂量后药物组合物的施用使受试者的csf中的gag的水平降低了至少约50%、60%、70%、75%、80%、85%或90%。在某些实施方案中,药物组合物的施用使受试者的csf中的gag水平正常化,即使受试者的csf中的gag的水平降低到在健康的受试者或未患亨特综合征的受试者中测量的基线水平。在某些实施方案中,在将受试者的施用疗法从静脉内艾杜硫酸酯酶(例如elaprase)转变成包含 etv:ids的药物组合物之后受试者的csf中的gag可降低或正常化。
113.在某些实施方案中,药物组合物的施用使受试者的血清中的 gag的水平与对照相比降低。在某些实施方案中,受试者的血清中的gag的水平与对照相比降低了至少约30%、40%、50%、60%、 70%、80%、90%、95%或更多。在某些实施方案中,受试者的血清中的gag的降低是相对于在施用之前受试者中的血清的gag水平。在某些实施方案中,药物组合物的施用使受试者的血清中的gag的水平降低到基线水平(例如在健康的受试者或未患亨特综合征的受试者中测量的水平)。
114.在某些实施方案中,药物组合物的施用使受试者的尿液中的 gag的水平与对照相比降低。在某些实施方案中,受试者的尿液中的gag的水平与对照相比降低了至少约30%、40%、50%、60%、 70%、80%、90%、95%或更多。在某些实施方案中,在至少1、2、3、 4、5、6、7、8、9、10、15、20次或更多次每周剂量之后受试者的尿液中的gag的水平与对照相比降低了至少约30%、40%、50%、 60%、70%、80%、90%、95%或更多。在某些实施方案中,受试者的尿液中的gag的降低是相对于在施用之前受试者中的尿液的gag 水平。举例来说,在某些实施方案中,在至少4次每周剂量后药物组合物的施用使受试者的尿液中的gag的水平降低了至少约50%、 60%、70%、75%、80%、85%或90%,其中所述降低是相对于在施用之前受试者中的尿液的gag水平。在某些实施方案中,在4次每周剂量后药物组合物的施用使受试者的尿液中的gag的水平降低了至少约50%、60%、70%、75%、80%、85%或90%。在某些实施方案中,在至少8次每周剂量后药物组合物的施用使受试者的尿液中的 gag的水平降低了至少约50%、60%、70%、75%、80%、85%或90%,其中所述降低是相对于在施用之前受试者中的尿液的gag水平。在某些实施方案中,在8次每周剂量后药物组合物的施用使受试者的尿液中的gag的水平降低了至少约50%、60%、70%、75%、80%、85%或90%。在某些实施方案中,药物组合物的施用使受试者的尿液中的 gag的水平降低到在健康的受试者或未患亨特综合征的受试者中测量的基线水平。在某些实施方案中,在将受试者的施用疗法从静脉内艾杜硫酸酯酶(例如elaprase)转变成包含etv:ids的药物组合物之后受试者的尿液中的gag降低。
115.在某些实施方案中,总gag水平降低。在某些实施方案中,硫酸乙酰肝素水平降低(例如,d0a0和/或d0s0水平降低)。在某些实施方案中,硫酸皮肤素水平降低(例如,d0a4水平降低)。
116.神经丝轻链(nf-l)
117.如本文所用,术语“nf-l”是指由基因nefl编码的神经丝轻链(又称为神经丝轻链多肽、神经丝轻多肽和神经丝轻蛋白)。如本文所用,“nf-l蛋白”是指天然(即野生型)nf-l
蛋白。在一些实施方案中,nf-l 蛋白是具有uniprotkb登录号p07196中鉴定的序列的人nf-l蛋白。
118.如本文所述,nf-l的水平增加指示患有亨特综合征的受试者中的下游病理学。因此,可在患有亨特综合征的受试者中(例如,来自施用etv:ids的受试者的治疗后样品中)评估nf-l的浓度。可以使用本领域中已知的或本文所述的测定法测量nf-l水平。举例来说,用于检测和测量蛋白质表达水平的测定法包括例如蛋白质印迹分析、免疫荧光、免疫组织化学(例如组织阵列)、mesoscale discovery(msd) 方法等。
119.在某些实施方案中,药物组合物的施用使受试者的器官、组织或流体中的nf-l的水平与对照相比降低。在某些实施方案中,受试者的器官、组织或流体中的nf-l的水平与对照相比降低了至少约10%、 15%、20%、25%、30%、40%、50%、60%、70%、80%、90%、95%或更多。在某些实施方案中,药物组合物的施用使受试者的器官、组织或流体中的nf-l的水平降低到基线水平(例如在健康的受试者或未患亨特综合征的受试者中测量的水平)。
120.在某些实施方案中,药物组合物的施用使受试者的cns中的 nf-l的水平与对照相比降低。在某些实施方案中,受试者的cns中的nf-l的水平与对照相比降低了至少约10%、15%、20%、25%、30%、 40%、50%、60%、70%、80%、90%、95%或更多。在某些实施方案中,药物组合物的施用使受试者的cns中的nf-l的水平降低到基线水平(例如在健康的受试者或未患亨特综合征的受试者中测量的水平)。
121.在某些实施方案中,药物组合物的施用使受试者的csf中的nf-l 的水平与对照相比降低。在某些实施方案中,受试者的csf中的nf-l 的水平与对照相比降低了至少约10%、15%、20%、25%、30%、40%、 50%、60%、70%、80%、90%、95%或更多。在某些实施方案中,在至少1、2、3、4、5、6、7、8、9、10、15、20次或更多次每周剂量之后受试者的csf中的nf-l的水平与对照相比降低了至少约30%、 40%、50%、60%、70%、80%、90%、95%或更多。在某些实施方案中,受试者的csf中的nf-l的降低是相对于在施用之前受试者中的 csf的nf-l水平。在某些实施方案中,药物组合物的施用使受试者的csf中的nf-l的水平降低到基线水平(例如在健康的受试者或未患亨特综合征的受试者中测量的水平)。
122.在某些实施方案中,药物组合物的施用使受试者的血清中的nf-l 的水平与对照相比降低。在某些实施方案中,受试者的血清中的nf-l 的水平与对照相比降低了至少约10%、15%、20%、25%、30%、40%、 50%、60%、70%、80%、90%、95%或更多。在某些实施方案中,在至少1、2、3、4、5、6、7、8、9、10、15、20次或更多次每周剂量之后受试者的血清中的nf-l的水平与对照相比降低了至少约30%、 40%、50%、60%、70%、80%、90%、95%或更多。在某些实施方案中,受试者的血清中的nf-l的降低是相对于在施用之前受试者中的血清的nf-l水平。在某些实施方案中,药物组合物的施用使受试者的血清中的nf-l的水平降低到基线水平(例如在健康的受试者或未患亨特综合征的受试者中测量的水平)。
123.trem2
124.如本文所用,术语“trem2蛋白”是指在髓样细胞上表达的触发受体2蛋白,由基因trem2编码。如本文所用,“trem2蛋白”是指天然(即野生型)trem2蛋白。在一些实施方案中,trem2蛋白是具有在uniprotkb登录号q9nzc2中鉴定的序列的人trem2蛋白。
125.trem2基因编码230个氨基酸长度的蛋白质,所述蛋白质包括胞外结构域、跨膜区和短胞质尾(参见uniprotkb q9nzc2;ncbi参考序列:np_061838.1)。由外显子2编码的胞外
区由单一类型的vig-sf结构域构成,含有三个潜在的n-糖基化位点。假定的跨膜区含有带电的赖氨酸残基。trem2的胞质尾缺乏信号传导基序,并且认为其通过信号传导衔接分子dap12/tyrobp和通过dap10传导信号。在破骨细胞、不成熟的树突状细胞和巨噬细胞的表面上发现了 trem2。在中枢神经系统中,trem2只在小胶质细胞中表达。
126.trem2可以由去整合素和金属蛋白酶(adam)蛋白酶(例如 adam10和adam17)裂解,从而将可溶性trem2(strem2)释放至细胞外环境中。如本文所述,trem2的水平增加指示患有亨特综合征的受试者中的下游病变(例如小胶质细胞激活和神经炎症)。因此,可以在患有亨特综合征的受试者中(例如,来自施用etv:ids的受试者的治疗后样品中)评估trem2/strem2的浓度。可以使用本领域中已知的或本文所述的测定法测量trem2或strem2水平。举例来说,用于检测和测量蛋白质表达水平的测定法包括例如蛋白质印迹分析、免疫荧光、免疫组织化学(例如组织阵列)、mesoscale discovery(msd) 方法等。
127.在某些实施方案中,药物组合物的施用使受试者的器官、组织或流体中的trem2或strem2的水平与对照相比降低。在某些实施方案中,受试者的器官、组织或流体中的trem2或strem2的水平与对照相比降低了至少约10%、15%、20%、25%、30%、40%、50%、 60%、70%、80%、90%、95%或更多。在某些实施方案中,药物组合物的施用使受试者的器官、组织或流体中的trem2或strem2的水平降低到基线水平(例如在健康的受试者或未患亨特综合征的受试者中测量的水平)。
128.在某些实施方案中,药物组合物的施用使受试者的csf中的 trem2或strem2的水平与对照相比降低。在某些实施方案中,受试者的csf中的trem2或strem2的水平与对照相比降低了至少约10%、15%、20%、25%、30%、40%、50%、60%、70%、80%、 90%、95%或更多。在某些实施方案中,受试者的csf中的trem2 或strem2的降低是相对于在施用之前受试者中的csf的trem2 或strem2水平。在某些实施方案中,药物组合物的施用使受试者的 csf中的trem2或strem2的水平降低到基线水平(例如在健康的受试者或未患亨特综合征的受试者中测量的水平)。
129.溶酶体脂质
130.如本文所述,bmp、鞘脂(例如,glccer)和神经节苷脂(例如, gd3、gd1a/b、gm2和gm3)的水平增加表明患有亨特综合征的受试者中的下游病理学。因此,可在患有亨特综合征的受试者中(例如,来自施用etv:ids的受试者的治疗后样品中)评估这些溶酶体脂质中的一者或多者的浓度。可以使用本领域中已知的或本文所述的测定法 (例如通过质谱法)测量这些脂质的浓度。
131.在某些实施方案中,药物组合物的施用使受试者的器官、组织或流体中bmp、鞘脂或神经节苷脂中的一者或多者的水平与对照相比降低。在某些实施方案中,受试者的器官、组织或流体中的bmp、鞘脂或神经节苷脂中的一者或多者的水平与对照相比降低了至少约 10%、15%、20%、25%、30%、40%、50%、60%、70%、80%、90%、 95%或更多。在某些实施方案中,药物组合物的施用使受试者的器官、组织或流体中的bmp、鞘脂或神经节苷脂中的一者或多者的水平降低到基线水平(例如在健康的受试者或未患亨特综合征的受试者中测量的水平)。
132.bmp
133.双(单酰基甘油)磷酸酯(bmp)是指一类阴离子磷脂。bmp富集在多囊泡内体和溶酶
体的内膜,并且认为其在鞘糖脂降解和胆固醇转运中起作用(参见kobayashi等人,nat.cell biol.1(1999)113-118)。本文描述了具体的bmp物质,并且包括但不限于bmp(44:12)、bmp (36:2)、bmp(di20:4)、bmp(di22:6)和bmp(di18:1)(又参见例如实施例和图)。
134.在某些实施方案中,药物组合物的施用使受试者的器官、组织或流体中的bmp的水平与对照相比降低。在某些实施方案中,受试者的器官、组织或流体中的bmp的水平与对照相比降低了至少约10%、 15%、20%、25%、30%、40%、50%、60%、70%、80%、90%、95%或更多。在某些实施方案中,药物组合物的施用使受试者的器官、组织或流体中的bmp的水平降低到基线水平(例如在健康的受试者或未患亨特综合征的受试者中测量的水平)。
135.在某些实施方案中,药物组合物的施用使受试者的csf中的 bmp的水平与对照相比降低。在某些实施方案中,受试者的csf中的bmp的水平与对照相比降低了至少约10%、15%、20%、25%、 30%、40%、50%、60%、70%、80%、90%、95%或更多。在某些实施方案中,在至少1、2、3、4、5、6、7、8、9、10、15、20次或更多次每周剂量之后受试者的csf中的bmp的水平与对照相比降低了至少约30%、40%、50%、60%、70%、80%、90%、95%或更多。在某些实施方案中,在施用之前受试者的csf中的bmp的降低是相对于受试者中的csf的bmp水平。举例来说,在某些实施方案中,在至少8次每周剂量后药物组合物的施用使受试者的csf中的bmp的水平降低了至少约10%、15%、20%、25%、30%、40%、50%、60%、 70%、80%或90%,其中所述降低是相对于在施用之前受试者中的csf 的bmp的水平。在某些实施方案中,在8次每周剂量后药物组合物的施用使受试者的csf中的bmp的水平降低了至少约10%、15%、 20%、25%、30%、40%、50%、60%、70%、80%或90%。在某些实施方案中,药物组合物的施用使受试者的csf中的bmp的水平降低到基线水平(例如在健康的受试者或未患亨特综合征的受试者中测量的水平)。在某些实施方案中,在将受试者的施用疗法从静脉内艾杜硫酸酯酶(例如elaprase)转变成包含etv:ids的药物组合物之后受试者的csf中的bmp降低。在某些实施方案中,bmp是bmp di 18:1 物质。
136.鞘脂
137.如本文所述,某些鞘脂,例如葡萄糖基神经酰胺(glccer)的水平增加表明患有亨特综合征的受试者中的下游病理学。glccer是在糖链上连接有一个或多个唾液酸的鞘糖脂(神经酰胺和寡糖)或寡糖基神经酰胺。具体的glccer物质包括但不限于glccer(d34:0)、glccer (d34:1)、glccer(d36:1)、glccer(d42:1)、glccer(d18:1、16:0)、glccer (d18:1、18:0)、glccer(d18:2、18:0)、glccer(d18:1、20:0)、glccer (d18:2、20:0)、glccer(d18:1、22:0)、glccer(d18:1、22:1)、glccer (d18:2、22:0)、glccer(d18:1、24:1)或glccer(d18:1、24:0)(又参见例如实施例和图)。
138.在某些实施方案中,药物组合物的施用使受试者的器官、组织或流体中的鞘脂(例如,glccer)的水平与对照相比降低。在某些实施方案中,受试者的器官、组织或流体中的鞘脂(例如,glccer)的水平与对照相比降低了至少约10%、15%、20%、25%、30%、40%、50%、 60%、70%、80%、90%、95%或更多。在某些实施方案中,药物组合物的施用使受试者的器官、组织或流体中的鞘脂(例如,glccer)的水平降低到基线水平(例如在健康的受试者或未患亨特综合征的受试者中测量的水平)。
139.在某些实施方案中,药物组合物的施用使受试者的csf中的鞘脂(例如,glccer)的水平与对照相比降低。在某些实施方案中,受试者的csf中的鞘脂(例如,glccer)的水平与
对照相比降低了至少约 10%、15%、20%、25%、30%、40%、50%、60%、70%、80%、90%、 95%或更多。在某些实施方案中,在至少1、2、3、4、5、6、7、8、 9、10、15、20次或更多次每周剂量之后受试者的csf中的鞘脂(例如,glccer)的水平与对照相比降低了至少约30%、40%、50%、60%、70%、80%、90%、95%或更多。在某些实施方案中,的降低鞘脂(例如glccer)受试者的csf中的是相对于在施用之前受试者中的csf的鞘脂水平。在某些实施方案中,药物组合物的施用使受试者的csf 中的鞘脂(例如,glccer)的水平降低到基线水平(例如在健康的受试者或未患亨特综合征的受试者中测量的水平)。
140.神经节苷脂
141.神经节苷脂是一类鞘糖脂。如本文所述,某些神经节苷脂,例如 (gd3、gd1a/b、gm2和gm3)的水平增加表明患有亨特综合征的受试者中的下游病理学。
142.在某些实施方案中,药物组合物的施用使受试者的器官、组织或流体中的神经节苷脂(例如,gd3、gd1a/b、gm2或gm3物质)的水平与对照相比降低。在某些实施方案中,受试者的器官、组织或流体中的神经节苷脂的水平与对照相比降低了至少约10%、15%、20%、 25%、30%、40%、50%、60%、70%、80%、90%、95%或更多。在某些实施方案中,药物组合物的施用使受试者的器官、组织或流体中的神经节苷脂的水平降低到基线水平(例如在健康的受试者或未患亨特综合征的受试者中测量的水平)。
143.在某些实施方案中,药物组合物的施用使受试者的csf中的神经节苷脂(例如,gd3、gd1a/b、gm2或gm3物质)的水平与对照相比降低。在某些实施方案中,受试者的csf中的神经节苷脂的水平与对照相比降低了至少约10%、15%、20%、25%、30%、40%、50%、 60%、70%、80%、90%、95%或更多。在某些实施方案中,在至少1、 2、3、4、5、6、7、8、9、10、15、20次或更多次每周剂量之后受试者的csf中的神经节苷脂(例如,gd3、gd1a/b、gm2或gm3物质)的水平与对照相比降低了至少约30%、40%、50%、60%、70%、 80%、90%、95%或更多。在某些实施方案中,受试者的csf中的神经节苷脂的降低是相对于在施用之前受试者中的csf的神经节苷脂水平。举例来说,在某些实施方案中,在至少8次每周剂量后药物组合物的施用使受试者的csf中的神经节苷脂的水平降低了至少约 10%、15%、20%、25%、30%、40%、50%、60%、70%、80%或90%,其中所述降低是相对于在施用之前受试者中的csf的神经节苷脂水平。在某些实施方案中,在8次每周剂量后药物组合物的施用使受试者的csf中的神经节苷脂的水平降低了至少约10%、15%、20%、25%、 30%、40%、50%、60%、70%、80%或90%。在某些实施方案中,药物组合物的施用使受试者的csf中的神经节苷脂的水平降低到基线水平(例如在健康的受试者或未患亨特综合征的受试者中测量的水平)。在某些实施方案中,在将受试者的施用疗法从静脉内艾杜硫酸酯酶(例如elaprase)转变成包含etv:ids的药物组合物之后受试者的csf中的神经节苷脂降低。
144.在某些实施方案中,药物组合物的施用使gd3物质的水平降低。具体的gd3物质包括但不限于例如gd3(d34:1)、gd3(d36:1)、gd3 (d38:1)、gd3(d39:1)、gd3(d40:1)、gd3(d42:2)或gd3(d42:1)。(又参见例如实施例和图)。
145.在某些实施方案中,药物组合物的施用使受试者的器官、组织或流体中的gd3物质的水平与对照相比降低。在某些实施方案中,受试者的器官、组织或流体中的gd3物质的水平与对照相比降低了至少约10%、15%、20%、25%、30%、40%、50%、60%、70%、80%、 90%、95%或更多。在某些实施方案中,药物组合物的施用使受试者的器官、组织或流体中
的gd3物质的水平降低到基线水平(例如在健康的受试者或未患亨特综合征的受试者中测量的水平)。
146.在某些实施方案中,药物组合物的施用使受试者的csf中的gd3 物质的水平与对照相比降低。在某些实施方案中,受试者的csf中的gd3物质的水平与对照相比降低了至少约10%、15%、20%、25%、 30%、40%、50%、60%、70%、80%、90%、95%或更多。在某些实施方案中,在至少1、2、3、4、5、6、7、8、9、10、15、20次或更多次每周剂量之后受试者的csf中的gd3物质的水平与对照相比降低了至少约30%、40%、50%、60%、70%、80%、90%、95%或更多。在某些实施方案中,受试者的csf中的gd3的降低是相对于在施用之前受试者中的csf的gd3水平。在某些实施方案中,药物组合物的施用使受试者的csf中的gd3物质的水平降低到基线水平(例如在健康的受试者或未患亨特综合征的受试者中测量的水平)。
147.神经节苷脂gd1a和gd1b是鞘糖脂。本文描述了具体的gd1a/b 物质,例如gd1a/b(d36:1)和gd1a/b(d38:1)(又参见例如实施例和图)。
148.在某些实施方案中,药物组合物的施用使受试者的器官、组织或流体中的gd1a/b物质的水平与对照相比降低。在某些实施方案中,受试者的器官、组织或流体中的gd1a/b物质的水平与对照相比降低了至少约10%、15%、20%、25%、30%、40%、50%、60%、70%、 80%、90%、95%或更多。在某些实施方案中,药物组合物的施用使受试者的器官、组织或流体中的gd1a/b物质的水平降低到基线水平(例如在健康的受试者或未患亨特综合征的受试者中测量的水平)。
149.在某些实施方案中,药物组合物的施用使受试者的csf中的 gd1a/b物质的水平与对照相比降低。在某些实施方案中,受试者的 csf中的gd1a/b物质的水平与对照相比降低了至少约10%、15%、 20%、25%、30%、40%、50%、60%、70%、80%、90%、95%或更多。在某些实施方案中,在至少1、2、3、4、5、6、7、8、9、10、 15、20次或更多次每周剂量之后受试者的csf中的gd1a/b物质的水平与对照相比降低了至少约30%、40%、50%、60%、70%、80%、 90%、95%或更多。在某些实施方案中,受试者的csf中的gd1a/b 的降低是相对于在施用之前受试者中的csf的gd1a/b水平。在某些实施方案中,药物组合物的施用使受试者的csf中的gd1a/b物质的水平降低到基线水平(例如在健康的受试者或未患亨特综合征的受试者中测量的水平)。
150.单唾液酸神经节苷脂2(gm2)是一种鞘糖脂。本文描述了具体的 gm2物质,例如gm2(d38:1)或gm2(d36:1)(又参见例如实施例和图)。
151.在某些实施方案中,药物组合物的施用使受试者的器官、组织或流体中的gm2物质的水平与对照相比降低。在某些实施方案中,受试者的器官、组织或流体中的gm2物质的水平与对照相比降低了至少约10%、15%、20%、25%、30%、40%、50%、60%、70%、80%、 90%、95%或更多。在某些实施方案中,药物组合物的施用使受试者的器官、组织或流体中的gm2物质的水平降低到基线水平(例如在健康的受试者或未患亨特综合征的受试者中测量的水平)。
152.在某些实施方案中,药物组合物的施用使受试者的csf中的 gm2物质的水平与对照相比降低。在某些实施方案中,受试者的csf 中的gm2物质的水平与对照相比降低了至少约10%、15%、20%、 25%、30%、40%、50%、60%、70%、80%、90%、95%或更多。在某些实施方案中,在至少1、2、3、4、5、6、7、8、9、10、15、20 次或更多次每周剂量之后受试者的csf中
的gm2物质的水平与对照相比降低了至少约30%、40%、50%、60%、70%、80%、90%、95%或更多。在某些实施方案中,受试者的csf中的gm2的降低是相对于在施用之前受试者中的csf的gm2水平。在某些实施方案中,药物组合物的施用使受试者的csf中的gm2物质的水平降低到基线水平(例如在健康的受试者或未患亨特综合征的受试者中测量的水平)。
153.类似于gm2,单唾液酸神经节苷脂3(gm3)也是一类鞘糖脂。具体的gm3物质包括但不限于(d34:1)、gm3(d36:1)、gm3(d38:1)、 gm3(d40:1)、gm3(d41:1)、gm3(d42:2)、gm3(d42:1)、gm3(d43:0)、 gm3(d44:1)或gm3(d44:2)(又参见例如实施例和图)。
154.在某些实施方案中,药物组合物的施用使受试者的器官、组织或流体中的gm3物质的水平与对照相比降低。在某些实施方案中,受试者的器官、组织或流体中的gm3物质的水平与对照相比降低了至少约10%、15%、20%、25%、30%、40%、50%、60%、70%、80%、 90%、95%或更多。在某些实施方案中,药物组合物的施用使受试者的器官、组织或流体中的gm3物质的水平降低到基线水平(例如在健康的受试者或未患亨特综合征的受试者中测量的水平)。
155.在某些实施方案中,药物组合物的施用使受试者的csf中的 gm3物质的水平与对照相比降低。在某些实施方案中,受试者的csf 中的gm3物质的水平与对照相比降低了至少约10%、15%、20%、 25%、30%、40%、50%、60%、70%、80%、90%、95%或更多。在某些实施方案中,在至少1、2、3、4、5、6、7、8、9、10、15、20 次或更多次每周剂量之后受试者的csf中的gm3物质的水平与对照相比降低了至少约30%、40%、50%、60%、70%、80%、90%、95%或更多。在某些实施方案中,受试者的csf中的gm3的降低是相对于在施用之前受试者中的csf的gm3水平。举例来说,在某些实施方案中,在至少8次每周剂量后药物组合物的施用使受试者的csf 中的gm3物质的水平降低了至少约10%、15%、20%、25%、30%、 40%、50%、60%、70%、80%或90%,其中所述降低是相对于在施用之前受试者中的csf的gm3物质水平。在某些实施方案中,在8 次每周剂量后药物组合物的施用使受试者的csf中的gm3物质的水平降低了至少约10%、15%、20%、25%、30%、40%、50%、60%、 70%、80%或90%。在某些实施方案中,药物组合物的施用使受试者的csf中的gm3物质的水平降低到基线水平(例如在健康的受试者或未患亨特综合征的受试者中测量的水平)。在某些实施方案中,在将受试者的施用疗法从静脉内艾杜硫酸酯酶(例如elaprase)转变成包含etv:ids的药物组合物之后受试者的csf中的gm3物质降低。
156.细胞因子
157.如本文所述,某些细胞因子的水平增加表明神经炎症。因此,可在患有亨特综合征的受试者中(例如,来自施用etv:ids的受试者的治疗后样品中)评估这些细胞因子中的一者或多者的浓度。举例来说,可评估细胞因子,例如白细胞介素(il)1-b、肿瘤坏死因子α(tnf-α)、单核细胞趋化蛋白1(mcp-1)、基质细胞衍生因子1α(sdf-1α)、il-ra、巨噬细胞炎症蛋白1β(mip-1β)、il-8和血管内皮生长因子(vegf)。可以使用本领域中已知的或本文所述的测定法测量这些细胞因子的浓度。
158.在某些实施方案中,药物组合物的施用使受试者的器官、组织或流体中的细胞因子的水平与对照相比降低。在某些实施方案中,受试者的器官、组织或流体中的细胞因子的水平与对照相比降低了至少约 10%、15%、20%、25%、30%、40%、50%、60%、70%、80%、90%、 95%或更多。在某些实施方案中,药物组合物的施用使受试者的器官、组织或流体中
的细胞因子的水平降低到基线水平(例如在健康的受试者或未患亨特综合征的受试者中测量的水平)。
159.在某些实施方案中,药物组合物的施用使受试者的csf中的细胞因子的水平与对照相比降低。在某些实施方案中,受试者的csf 中的细胞因子的水平与对照相比降低了至少约10%、15%、20%、25%、 30%、40%、50%、60%、70%、80%、90%、95%或更多。在某些实施方案中,受试者的csf中的细胞因子的降低是相对于在施用之前受试者中的csf的细胞因子水平。在某些实施方案中,药物组合物的施用使受试者的csf中的细胞因子的水平降低到基线水平(例如在健康的受试者或未患亨特综合征的受试者中测量的水平)。
160.在某些实施方案中,药物组合物的施用使受试者的血清中的细胞因子的水平与对照相比降低。在某些实施方案中,受试者的血清中的细胞因子的水平与对照相比降低了至少约10%、15%、20%、25%、 30%、40%、50%、60%、70%、80%、90%、95%或更多。在某些实施方案中,受试者的血清中的细胞因子的降低是相对于在施用之前受试者中的血清的细胞因子水平。在某些实施方案中,药物组合物的施用使受试者的血清中的细胞因子的水平降低到基线水平(例如在健康的受试者或未患亨特综合征的受试者中测量的水平)。
161.在某些实施方案中,药物组合物的施用使受试者的尿液中的细胞因子的水平与对照相比降低。在某些实施方案中,受试者的尿液中的细胞因子的水平与对照相比降低了至少约10%、15%、20%、25%、 30%、40%、50%、60%、70%、80%、90%、95%或更多。在某些实施方案中,受试者的尿液中的细胞因子的降低是相对于在施用之前受试者中的尿液的细胞因子水平。在某些实施方案中,药物组合物的施用使受试者的尿液中的细胞因子的水平降低到基线水平(例如在健康的受试者或未患亨特综合征的受试者中测量的水平)。
162.某些疾病表现
163.除了校正某些生物标志物外,治疗有效剂量的本文所述的药物组合物也可以用于治疗亨特综合征的具体表现,包括与该疾病相关的神经行为缺陷、听觉缺陷和/或肌肉骨骼异常(参见例如,实施例9)。
164.因此,本发明的某些实施方案提供了一种治疗患有亨特综合征的受试者中的神经行为缺陷、听觉缺陷和/或肌肉骨骼异常的方法,所述方法包括向所述受试者施用治疗有效剂量的包含蛋白质的药物组合物,其中所述蛋白质包含:(a)第一fc多肽,其连接于艾杜糖醛酸 2-硫酸酯酶(ids)氨基酸序列、ids变体氨基酸序列或其催化活性片段;和(b)第二fc多肽,其包含根据eu编号的以下氨基酸残基:在位置380处的trp、leu或glu;在位置384处的tyr;在位置386处的thr;在位置387处的glu;在位置388处的trp;在位置389处的 ser或ala;在位置390处的ser或asn;在位置413处的thr;在位置415处的glu;在位置416处的glu;以及在位置421处的phe。
165.亨特综合征的表现(例如,神经行为缺陷、听觉缺陷和/或肌肉骨骼异常)的变化或稳定也可能用于评估疾病活动性和对etv:ids的治疗响应。举例来说,一项或多项评估,例如本文所述的一项或多项评估,可以用于评估与给定表现相关的参数。在某些实施方案中,参数是相对于基线水平测量的。在某些实施方案中,参数的基线水平是受试者在药物组合物的施用之前的参数水平。
166.神经行为缺陷
167.大约三分之二的亨特综合征患者显示该疾病的神经病变形式,除了更早呈现出躯
体疾病以外,特征在于进展性的衰竭性神经行为缺陷,包括但不限于运动技能缺陷、认知缺陷(例如,学习和记忆缺陷) 和感觉运动门控缺陷(例如,注意力和抑制功能缺陷)。
168.在某些实施方案中,治疗有效剂量的包含etv:ids的药物组合物可用于治疗患有亨特综合征的受试者中的神经行为缺陷。在某些实施方案中,例如,如通过本文所述的评估所测量,相对于基线水平,药物组合物的施用改变受试者的神经行为能力。在某些实施方案中,相对于基线水平(例如,如本文所述的评估所测量),药物组合物的施用预防受试者的神经行为能力进一步退化。
169.在某些实施方案中,神经行为缺陷是运动技能缺陷,例如粗大和 /或精细运动技能缺陷。因此,在某些实施方案中,治疗有效剂量的包含etv:ids的药物组合物可用于治疗粗大和/或精细运动缺陷患有亨特综合征的受试者中。在某些实施方案中,例如,如通过本文所述的评估所测量,相对于基线水平,药物组合物的施用改变受试者的粗大和/或精细运动能力。在某些实施方案中,相对于基线水平(例如,如本文所述的评估所测量),药物组合物的施用预防受试者的粗大和/ 或精细运动能力进一步退化。
170.在某些实施方案中,神经行为缺陷是敏捷性缺陷。因此,在某些实施方案中,治疗有效剂量的包含etv:ids的药物组合物可用于治疗患有亨特综合征的受试者中的敏捷性缺陷。在某些实施方案中,例如,如通过本文所述的评估所测量,相对于基线水平,药物组合物的施用改变受试者的敏捷性能力。在某些实施方案中,相对于基线水平 (例如,如本文所述的评估所测量),药物组合物的施用预防受试者的敏捷性能力进一步退化。
171.在某些实施方案中,神经行为缺陷是认知缺陷,例如学习缺陷(例如,空间学习缺陷)或记忆缺陷。因此,在某些实施方案中,治疗有效剂量的包含etv:ids的药物组合物可用于治疗患有亨特综合征的受试者中的认知缺陷。在某些实施方案中,例如,如通过本文所述的评估所测量,相对于基线水平,药物组合物的施用改变受试者的认知能力。在某些实施方案中,相对于基线水平(例如,如本文所述的评估所测量),药物组合物的施用预防受试者的认知能力进一步退化。
172.在某些实施方案中,神经行为缺陷是感觉运动门控缺陷,其与受试者中的注意力和抑制功能相关。因此,在某些实施方案中,治疗有效剂量的包含etv:ids的药物组合物可用于治疗患有亨特综合征的受试者中的感觉运动门控缺陷。在某些实施方案中,例如,如通过本文所述的评估所测量,相对于基线水平,药物组合物的施用改变受试者的感觉运动门控能力。在某些实施方案中,相对于基线水平(例如,如本文所述的评估所测量),药物组合物的施用预防受试者的感觉运动门控能力进一步退化。
173.听觉缺陷
174.进展性传导性和感觉神经性听力损失在亨特综合征患者中时常见的,是由中耳中的gag积聚和复发性中耳炎引起的。
175.在某些实施方案中,治疗有效剂量的包含etv:ids的药物组合物可用于治疗患有亨特综合征的受试者中的听觉缺陷,例如传导性或感觉神经性听力损失。在某些实施方案中,例如,如通过本文所述的评估所测量,相对于基线水平,药物组合物的施用改变受试者的听觉能力。在某些实施方案中,相对于基线水平(例如,如本文所述的评估所测量),药物组合物的施用预防受试者的听觉能力进一步退化。
176.在某些实施方案中,治疗有效剂量的包含etv:ids的药物组合物可用于减少患有
亨特综合征的受试者中的中耳积液和/或中耳炎。在某些实施方案中,例如,如通过本文所述的评估所测量,相对于基线水平,药物组合物的施用改变受试者中的中耳积液和/或中耳炎的量。
177.在某些实施方案中,治疗有效剂量的包含etv:ids的药物组合物可用于治疗患有亨特综合征的受试者中的听觉异常。在某些实施方案中,例如,如通过本文所述的评估所测量,相对于基线水平,药物组合物的施用改变受试者的听觉特征。在某些实施方案中,相对于基线水平(例如,如本文所述的评估所测量),药物组合物的施用预防受试者的听觉特征进一步退化。
178.肌肉骨骼异常
179.一系列肌肉骨骼异常是亨特综合征患者中常见的,包括身材矮小不成比例、关节僵硬/挛缩、胸腰椎后凸、髋关节发育异常和多发性成骨不全。
180.在某些实施方案中,治疗有效剂量的包含etv:ids的药物组合物可用于治疗患有亨特综合征的受试者中的肌肉骨骼异常(例如,骨骼异常)。在某些实施方案中,例如,如通过本文所述的评估所测量,相对于基线水平,药物组合物的施用改变受试者中的肌肉骨骼特征。在某些实施方案中,相对于基线水平(例如,如本文所述的评估所测量),药物组合物的施用预防受试者的肌肉骨骼异常进一步退化。
181.神经认知评估
182.疾病活动性和对etv:ids的治疗响应可使用一种或多种神经认知评估,例如文兰适应行为量表(vinelandadaptivebehaviorscale)第二版(文兰-ii)、贝利婴幼儿发展量表(bayleyscalesofinfantandtoddlerdevelopment)第三版(bsid-iii)和考夫曼儿童成套评估(kaufmanassessmentbatteryforchildren)第二版(kabc-ii)来评估。
183.在某些实施方案中,神经认知评估的变化是相对于基线(例如,相对于还没有进行治疗的受试者;相对于治疗之前的受试者;或相对于年龄匹配的未患亨特综合征的对照受试者)。在某些实施方案中,基线来自治疗之前的受试者并且评估例如在开始治疗之后2个月、6个月、12个月和/或18个月进行。
184.文兰-ii是一种用于帮助对个体的智力和发育障碍和其他病症进行诊断和分类的标准化评估工具(sparrow等人,文兰适应行为量表:访问版,调查表手册circlepines,mn:americanguidanceservice;1984;sparrow等人,文兰适应行为量表:第二版(文兰ii),调查访问表/护理者评分表.livonia,mn:pearsonassessments;2005)。文兰-ii内容和量表在3结构域结构内组织:沟通、日常生活和社会化。另外,文兰-ii提供了运动技能领域。在该评估内,护理者报告的量表可用于测量与典型发展相关的领域中的行为,例如沟通和日常生活、社会化和运动技能。
185.在某些实施方案中,如通过文兰-ii所测量,相对于基线水平,药物组合物的施用改变受试者的智力和/或发育障碍/病症。在某些实施方案中,如通过文兰-ii所测量,药物组合物的施用预防受试者的智力和/或发育障碍/病症相对于基线水平恶化。
186.bsid-iii是一系列用以评估1至42月龄婴幼儿的发展的标准测量(bayley,贝利婴幼儿发展量表:管理手册.sanantonio,tx:harcourtassessment;2006)。测量可包括3项主要子测试:认知量表、语言量表和运动量表。原始年龄常模和年龄当量评分可用于计算dq。在某些实施方案中,对基于文兰-ii发育年龄为42个月或更小的患者进行bsid-iii。
187.在某些实施方案中,如通过bsid-iii所测量,相对于基线水平,药物组合物的施用改变受试者的dq。在某些实施方案中,如通过 bsid-iii所测量,药物组合物的施用预防受试者的dq相对于基线水平退化。
188.kabc-ii是对年龄在3至18岁的儿童和青少年的认知加工能力的单独施用的测量。原始年龄常模和年龄当量评分(例如,非言语能力评分)可用于计算dq。在某些实施方案中,对基于文兰-ii发育年龄》42个月的患者进行kabc-ii。
189.在某些实施方案中,如通过kabc-ii所测量,相对于基线水平,药物组合物的施用改变受试者的dq。在某些实施方案中,如通过 kabc-ii所测量,药物组合物的施用预防受试者的dq相对于基线水平退化。
190.临床评估
191.疾病活动性和对etv:ids的治疗响应还可以使用患者日记和/或本文所述的一种或多种临床评估来评估。另外,如下所述,这些工具也可以用于评估治疗剂的安全性和耐受性(例如,以鉴定不良事件(ae) 与相关etv:ids施用)。在某些实施方案中,基线来自例如治疗之前的受试者,来自还没有进行治疗的受试者;或来自年龄匹配的未患亨特综合征的对照受试者。在某些实施方案中,评估例如在开始治疗之后2周、3周、1个月、2个月、4个月、6个月、12个月、18个月和/或24个月或更长时间进行。
192.病史和患者日记
193.可对病史进行回顾以鉴定和收集信息关于受试者的表现、诊断、共病、疾病相关的医疗事件和症状和用以管理症状的药物。举例来说,病史可包括但不限于急性、慢性和传染性疾病的历史;手术和肿瘤史;生殖状况;影响主体系统的任何疾患;任何认知或行为评估或干预;以及人口数据,包括出生年份、性别、种族和族群。该信息可结合患者日记来考虑。
194.身体检查
195.还可以进行身体检查,包括适合年龄的神经系统检查,以评估疾病活动性和对etv:ids的治疗响应,以及对组合物的安全性/耐受性。举例来说,可进行症状导向的身体/神经系统检查(例如,以评估患者症状或安全性实验室异常)。身体检查还可以包括生命体征(例如,血压、脉率、呼吸速率和体温)、体重和身高以及肝脏和脾脏体积的测量。
196.在某些实施方案中,身体和/或神经系统检查不鉴定与受试者中的治疗前症状相比受试者中治疗后的新症状。在某些实施方案中,身体和/或神经系统检查鉴定与受试者中的治疗前症状相比受试者中治疗后的症状数目减少。
197.在某些实施方案中,相对于基线水平,药物组合物的施用不改变受试者的生命体征。在某些实施方案中,相对于基线水平,药物组合物的施用改善受试者的生命体征。在某些实施方案中,受试者的治疗后生命体征在正常范围内(例如,相对于未患亨特综合征的健康受试者)。
198.在某些实施方案中,如通过mri或超声波所评估,相对于基线水平,药物组合物的施用改变受试者的肝脏体积。在某些实施方案中,如通过mri或超声波所评估,药物组合物的施用使受试者的肝脏体积相对于基线水平减少了至少约10%、15%、20%、25%、30%、40%、 50%、60%、70%、80%、90%、95%或更多。
199.在某些实施方案中,如通过mri或超声波所评估,相对于基线水平,药物组合物的施用改变受试者的脾脏体积。在某些实施方案中,如通过mri或超声波所评估,药物组合物
的施用使受试者的脾脏体积相对于基线水平减少了至少约10%、15%、20%、25%、30%、40%、 50%、60%、70%、80%、90%、95%或更多。
200.实验室测试
201.可在基线和/或在开始治疗之后的变化时间点进行标准实验室测试(化学、血液学和尿分析)。举例来说,可进行血液凝固操作盘 (coagulation panel);全血计数(血小板计数);来自csf样品的csf细胞计数、蛋白质和葡萄糖;以及尿分析。
202.在某些实施方案中,相对于基线水平,药物组合物的施用不改变受试者的这些标准测试中的一者或多者的结果。在某些实施方案中,受试者的这些标准测试中的一者或多者的治疗后结果在正常范围(例如,相对于未患亨特综合征的健康受试者)内。
203.功能评估
204.疾病活动性和对etv:ids的治疗响应还可以使用本文所述的一种或多种功能评估来评估。举例来说,可在基线和/或在开始治疗之后的变化时间点进行个性化教育计划(iep)和/或个别化家庭服务计划 (ifsps)。还可以在基线和/或在治疗之后的变化时间点进行听力学评估(例如,听性脑干响应(abr)评估或标准听力测试)。另外,还可以在基线和/或在治疗之后的变化时间点评估受试者的如厕能力百分比 (tap)。在某些实施方案中,基线来自例如治疗之前的受试者,来自还没有进行治疗的受试者;或来自年龄匹配的未患亨特综合征的对照受试者。在某些实施方案中,评估例如在开始治疗之后2个月、6个月、12个月和/或18个月进行。
205.在某些实施方案中,相对于基线水平,药物组合物的施用提高或维持受试者在认知类别或行为类别中的定性iep轨迹。在某些实施方案中,相对于基线水平,药物组合物的施用提高或维持受试者在认知类别或行为类别中的定性ifsps轨迹。
206.在某些实施方案中,在用药物组合物治疗后,相对于基线水平,受试者在认知类别或行为类别中的定性iep轨迹未显著变差。在某些实施方案中,在用药物组合物治疗后,药物组合物的施用未使受试者在认知类别或行为类别中的定性ifsps轨迹相对于基线水平显著变差,未显著变差。
207.在某些实施方案中,相对于基线水平,药物组合物的施用提高或维持受试者的如厕能力百分比(tap)。在某些实施方案中,在用药物组合物治疗后,相对于基线水平,受试者的tap未显著变差。
208.在某些实施方案中,如通过abr或标准听力测试所评估,相对于基线水平,药物组合物的施用提高或维持受试者的听力。在某些实施方案中,如通过abr或标准听力测试所评估,在用药物组合物治疗后,受试者的听力相对于基线水平未显著变差。
209.生活质量评估
210.疾病活动性和对etv:ids的治疗响应还可以使用本文所述的一种或多种生活质量评估来评估。举例来说,儿童健康问卷家长表28 (chq-pf28)、婴幼儿生活质量
tm
(itqol)和/或儿童生活质量量表
tm
家庭影响模块(pedsql
tm-fim)可在基线和/或在开始治疗之后的变化时间点进行评估。在某些实施方案中,基线来自例如治疗之前的受试者,来自还没有进行治疗的受试者;或来自年龄匹配的未患亨特综合征的对照受试者。在某些实施方案中,评估例如在开始治疗之后2个月、 6个月、12个月和/或18个月进行。
211.chq-pf28是一种通用的个人报告结局测量,它可以用于评估5 至18岁儿童和青少
年的健康相关生活质量。itqol是一种通用的个人报告结局测量,用于评估2月龄至5岁儿童的健康相关生活质量 (raat等人reliability and validity of the infant and toddler quality oflife questionnaire(itqol)in a general population and respiratorydisease sample.qual life res.2007;16(3):445-60)。该工具是chq-pf28 延伸到更幼龄的患者上。itqol可以用于5岁以下的患者。 pedsql-fim是一种多维的工具,它被设计用于测量儿童长期健康状况对家长和家庭的影响。pedsql-fim测量家长自报的身体、情绪、社交和认知功能、沟通和烦恼。该模块还测量家长报告的家庭日常活动和家庭关系。
212.在某些实施方案中,如通过chq-pf28、itqol和/或pedsql-fim 所评估,相对于基线水平,药物组合物的施用提高或维持受试者的生活质量。在某些实施方案中,如通过chq-pf28、itqol和/或 pedsql-fim所评估,在用药物组合物治疗后,受试者的生活质量相对于基线水平未显著变差。
213.安全性和耐受性评估
214.在给定剂量下etv:ids的安全性和耐受性可使用本文所述的某些评估来评估。举例来说,某些生物标志物和临床评估可以用于评估已经施用了包含etv:ids的药物组合物的受试者。另外,还可以监测不良事件(ae)的频率和严重性。
215.举例来说,在某些实施方案中,可使用临床评估的组合来评估施用药物组合物的受试者,所述临床评估包括但不限于生命体征测量、身体检查(包括神经系统检查)、诊断测试、实验室评估(例如,血液学、血清临床化学、尿分析和凝固)和蛋白质在血清中的免疫原性的表征 (通过抗药物抗体(ada)相对于基线的发生率测量)。另外,还可以将尿液中的总gag浓度(归一化至肌酐)作为安全性参数进行监测。
216.在某些实施方案中,评估etv:ids的药代动力学(pk)。举例来说,pk参数可包括但不限于以下:cmax;谷浓度(cmin);tmax;时间零至最后可定量的浓度的时间的浓度-时间曲线下面积(auc0–
最后
);给药间隔内的浓度-时间曲线下面积(auc0–
t
);表观终末消除速率常数 (λz);表观终末消除t1/2;以及积聚率。
217.在某些实施方案中,在药物组合物的施用之后尿液总gag浓度 (归一化至肌酐)相对于基线水平没有增加(例如,尿液总gag浓度相对于受试者中治疗之前的水平没有增加)。在某些实施方案中,在药物组合物的施用之后尿液总gag浓度(归一化至肌酐)相对于基线水平增加不到约20%、19%、18%、17%、16%、15%、14%、13%、12%、 11%、10%、9%、8%、7%、6%、5%、4%、3%、2%或1%。在某些实施方案中,在药物组合物的施用之后尿液总gag浓度(归一化至肌酐)相对于基线水平降低。在某些实施方案中,受试者中的尿液总gag 浓度的稳定或降低证实了所施用的剂量的安全性。
218.在某些实施方案中,在药物组合物的施用之前,受试者已经接受了重组艾杜硫酸酯酶酶替代疗法。在某些实施方案中,受试者在药物组合物的施用之前具有预先存在的针对ids的ada。在某些实施方案中,受试者预先存在的针对ids的抗药物抗体的滴度超过100、150、 200、300、400、500、1,000、5,000、25,000、50,000、75,000、100,000、 500,000、1,000,000、10,000,000或更多。在某些实施方案中,受试者预先存在的针对ids的抗药物抗体的滴度在189至超过11,000,000 范围内。在某些实施方案中,受试者预先存在的针对ids的抗药物抗体的滴度超过11,000,000。
219.在某些实施方案中,在药物组合物的施用之后ada的发生率相对于基线水平没有增加(例如,ada的发生率相对于受试者中治疗之前的水平没有增加)。在某些实施方案中,在药物组合物的施用之后 ada的发生率相对于基线水平增加不到约10%、9%、8%、7%、6%、 5%、4%、3%、2%或1%。在某些实施方案中,相对于基线水平,新的ada的形成或已经存在的ada的增加不显著降低药物组合物的治疗效率。
220.如本文所用,不良事件是指与使用药物组合物相关的任何不良医学事件,并包括例如任何不利和无意的迹象、症状或疾病;任何新的疾病或已经存在的疾病加重;在基线时不存在的间歇性医学疾患复发;以及与症状相关或引起联合治疗改变的实验值或其他临床测试的任何恶化。举例来说,ae包括输注相关反应(irr),例如过敏反应和过敏症。
221.如本文所用,“严重不良事件(sae)”是符合任何以下准则的任何 ae:致命;威胁生命;需要或延长患者住院治疗;导致持久的或显著的残疾/无能(即,ae导致患者进行正常生活功能的能力基本上被破坏);或是重大医疗事件(例如,可能危害患者或可能需要医学/手术干预以防上文列出的一种或多种结果)。
222.ae还可以通过严重性(即,ae的强度)来分类。举例来说,ae 可设为:轻度(即,容易忍受,引起最小不适,和不干扰日常活动);中度(即,引起的不适足以干扰正常日常活动;或重度(即,引起日常活动显著受限制或无法进行日常活动的重大医疗事件)。
223.在某些实施方案中,施用药物组合物的受试者没有经历不良事件 (例如,与施用或组合物相关的ae)。在某些实施方案中,施用药物组合物的受试者中的不良事件(ae)不常见。在某些实施方案中,施用药物组合物的受试者中的ae是罕见的或非常罕见的。举例来说,在某些实施方案中,施用药物组合物的受试者中的ae的频率小于约 1/100,或小于约1/1,000,或小于约1/10,000。
224.在某些实施方案中,施用药物组合物的受试者没有经历严重不良事件(sae),例如,例如导致死亡,威胁生命,需要住院病人住院治疗或延长现有的住院治疗,或导致显著的残疾或无能的不良医学事件。在某些实施方案中,施用药物组合物的受试者中的严重不良事件 (sae)不常见。在某些实施方案中,施用药物组合物的受试者中的严重不良事件(sae)是罕见的或非常罕见的。举例来说,在某些实施方案中,施用药物组合物的受试者中的sae的频率小于约1/100,或小于约1/1,000,或小于约1/10,000。
225.在某些实施方案中,施用药物组合物的受试者没有经历严重ae。在某些实施方案中,施用药物组合物的受试者中的严重ae不常见。
226.在某些实施方案中,施用药物组合物的受试者中的严重ae是罕见的或非常罕见的。举例来说,在某些实施方案中,施用药物组合物的受试者中的严重ae的频率小于约1/100,或小于约1/1,000,或小于约 1/10,000。
227.在某些实施方案中,在药物组合物的施用后,受试者没有经历 irr,例如过敏反应或过敏症。在某些实施方案中,受试者没有经历过敏反应。在某些实施方案中,受试者没有经历过敏症。在某些实施方案中,施用药物组合物的受试者中的irr不常见。在某些实施方案中,施用药物组合物的受试者中的irr是罕见的或非常罕见的。举例来说,在某些实施方案中,施用药物组合物的受试者中的irr的频率小于约1/100,或小于约1/1,000,或小于约1/10,000。
228.在某些实施方案中,在没有预处理或共同施用用于输注相关反应 (irr)的药物下
向受试者施用药物组合物。这类药物包括但不限于抗组胺、退热药和皮质类固醇。
229.在某些实施方案中,在药物组合物的施用后,受试者经历irr。在某些实施方案中,在进行预处理或共同施用用于输注相关反应(irr) 的药物下,向受试者施用药物组合物。在某些实施方案中,在药物组合物的治疗后向受试者施用针对irr的药物。
230.某些实施方案还提供了一种使接受针对亨特综合征的治疗的受试者中的输注相关反应(irr)消退的方法,所述方法包括施用一种或多种可用于治疗irr的剂(例如,选自由以下组成的组:抗组胺、退热药和皮质类固醇),其中所述受试者正在施用或施用了治疗有效剂量的药物组合物(例如,至少约7.5mg/kg)。在某些实施方案中,irr 是发热。在某些实施方案中,使irr消退的方法包括向受试者施用扑热息痛和苯海拉明。
231.受试者
232.如本文中可互换使用的术语“受试者”、“个体”和“患者”是指哺乳动物,包括但不限于人、非人灵长类动物、啮齿动物(例如,大鼠、小鼠和豚鼠)、兔、牛、猪、马和其他哺乳动物物种。在本文所述的某些实施方案中,受试者是人受试者。
233.在某些实施方案中,受试者是男性受试者。
234.在某些实施方案中,受试者是约1个月至30岁。在某些实施方案中,受试者是约6个月至30岁。在某些实施方案中,受试者是约 1至30岁。在某些实施方案中,受试者是约1至25岁。在某些实施方案中,受试者是约1至18岁。在某些实施方案中,受试者是约2 至18岁。在某些实施方案中,受试者是约2至15岁。在某些实施方案中,受试者是约2至10岁。在某些实施方案中,受试者是约5至 10岁。在某些实施方案中,受试者小于4岁。在某些实施方案中,受试者小于2岁。在某些实施方案中,受试者小于1岁。在某些实施方案中,受试者超过1岁。在某些实施方案中,受试者是约1岁、2 岁、3岁、4岁、5岁、6岁、7岁、8岁、9岁、10岁、11岁、12岁、 13岁、14岁、15岁、16岁、17岁或18岁。
235.在某些实施方案中,受试者的体重≥5kg。在某些实施方案中,受试者的体重≥9kg。在某些实施方案中,受试者的体重≥15kg。在某些实施方案中,受试者的体重≥19kg。在某些实施方案中,受试者的体重≥23kg。在某些实施方案中,受试者的体重≥27kg。在某些实施方案中,受试者的体重≥32kg。在某些实施方案中,受试者的体重≥36kg。在某些实施方案中,受试者的体重≥41kg。在某些实施方案中,受试者的体重≥45kg。在某些实施方案中,受试者的体重≥50kg。
236.在某些实施方案中,受试者患有神经病变型亨特综合征,又称为神经病变型mpsii(nmpsii)。在某些实施方案中,受试者患有非神经病变型亨特综合征。在某些实施方案中,受试者患有具有未知的神经病变表型的亨特综合征。
237.在某些实施方案中,在药物组合物的施用之前,受试者已经接受了重组艾杜硫酸酯酶酶替代疗法(例如,超过4个月、超过6个月、超过1年、超过18个月、超过2年或更长时间)。
238.在某些实施方案中,受试者具有神经行为缺陷。在某些实施方案中,受试者具有运动技能缺陷。在某些实施方案中,受试者具有认知缺陷。在某些实施方案中,受试者具有感觉运动缺陷。
239.在某些实施方案中,受试者的发育受阻或延迟(例如,心智或身体发育)。在某些实施方案中,受试者的发育商(dq)《85。在某些实施方案中,受试者的dq《80。在某些实施方案
蛋白质。在某些实施方案中,治疗有效剂量为约1mg/kg至约30mg/kg 蛋白质。在某些实施方案中,治疗有效剂量为约1mg/kg蛋白质。在某些实施方案中,治疗有效剂量为约3mg/kg蛋白质。在某些实施方案中,治疗有效剂量为约7.5mg/kg蛋白质。在某些实施方案中,治疗有效剂量为约10mg/kg蛋白质。在某些实施方案中,治疗有效剂量为约15mg/kg蛋白质。在某些实施方案中,治疗有效剂量为约20 mg/kg蛋白质。在某些实施方案中,治疗有效剂量为约30mg/kg蛋白质。在某些实施方案中,治疗有效剂量为约40mg/kg蛋白质。
251.在某些实施方案中,本文描述的这类剂量是安全且治疗有效的剂量(例如,如使用本文所述的评估来确定,例如受试者中的尿液总gag 浓度的稳定或降低)。
252.在某些实施方案中,药物组合物每周施用一次。
253.在一些实施方案中,本文所述的蛋白质分子具有至少约500单位 (u)/mg、约1,000u/mg或至少约1,500、2,000、2,500、3,000、3,500、 4,000、4,500、5,000、6,000、7,000、8,000、9,000或10,000u/mg的酶活性。在一些实施方案中,酶活性为至少约11,000u/mg,或至少约12,000、13,000、14,000、15,000、16,000、17,000、18,000、19,000、 20,000、25,000、30,000、35,000、40,000、45000或50,000u/mg;或在约500u/mg至约50,000u/mg范围内的任何值。
254.剂量可根据几个因素变化,所述因素包括所选的施用途径、组合物的配制、患者响应、疾患的严重性、受试者的体重、受试者的年龄、受试者的头围和/或头围与身高比,以及处方医生的判断。剂量可以随着时间的推移增加或减少,视个别患者需要。在一些实施方案中,最初向患者给予低剂量,接着增加至患者可耐受的有效剂量。有效量的确定完全在本领域的能力范围内。
255.在各种实施方案中,本文所述的药物组合物在肠胃外施用。在一些实施方案中,药物组合物在静脉内施用。静脉内施用可以通过例如在约10至约30分钟的时间段内,或在至少1小时、2小时、3小时、 4小时、6小时、8小时或10小时的时间段内输注。在一些实施方案中,药物组合物在约20分钟至6小时或约30分钟至4小时的时间段内静脉内施用。在一些实施方案中,药物组合物以静脉推注施用。还可以使用输注与推注施用的组合。
256.etv:ids蛋白质分子
257.本文所述的某些方法提供了一种治疗有需要的受试者的亨特综合征的方法,所述方法包括向所述受试者施用治疗有效剂量的包含本文所述的融合蛋白的药物组合物。这些融合蛋白可称为与艾杜糖醛酸 2-硫酸酯酶(ids)酶结合的酶转运载体(etv),或etv:ids。以下论述了可以在本文所述的方法中使用的etv:ids蛋白并且在wo2019/070577(以引用的方式并入本文中以达成所有目的)中描述。
258.包含ids酶的某些融合蛋白
259.以下描述了融合蛋白的某些实施方案,所述融合蛋白包括连接于 fc多肽的ids酶或野生型ids(例如野生型人ids)的催化活性变体或片段;这些融合蛋白可以包括在本文所述的药物组合物中,用于治疗亨特综合征。在一些情况下,蛋白质包括二聚fc多肽,其中fc多肽单体中的一种连接于ids酶。fc多肽可以增加酶半衰期,并且在一些情况下,可以被修饰以赋予蛋白质另外的功能性。本文还描述了促进ids酶跨越血脑屏障(bbb)递送的融合蛋白。这些蛋白质包含形成二聚体的fc多肽和经修饰的fc多肽,和连接于fc区和/或经修饰的 fc区的ids酶。经修饰的fc区可以特异性结合于bbb受体,例如转铁蛋白受体(tfr)。
260.在一些方面,本文所述的融合蛋白包含:(i)可以含有修饰(例如一种或多种促进异二聚的修饰)或者可以是野生型fc多肽的fc多肽,和ids酶;以及(ii)可以含有修饰(例如一种或多种促进异二聚的修饰) 或者可以是野生型fc多肽的fc多肽,和任选地ids酶。在一些实施方案中,一种或两种fc多肽可以含有引起结合于血脑屏障(bbb)受体如tfr的修饰。掺入融合蛋白中的ids酶是催化活性的,即,其保留在亨特综合征中缺乏的ids。
261.在一些实施方案中,包含ids酶并且任选地包含结合于bbb受体的经修饰的fc多肽(例如结合tfr的fc多肽)的融合蛋白包含野生型ids的催化活性片段或变体。在一些实施方案中,ids酶是包含 seq id no:69、70、90、170及174中的任一者的氨基酸序列的ids 蛋白的变体或催化活性片段。在一些实施方案中,ids酶的催化活性变体或片段具有野生型ids酶的活性的至少50%、至少55%、至少 60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或更高。
262.在一些实施方案中,本文所述的融合蛋白中存在的ids酶或其催化活性变体或片段与它不连结于fc多肽或结合tfr的fc多肽时的活性相比保留它的活性的至少25%。在一些实施方案中,ids酶或其催化活性变体或片段与它不连结于fc多肽或结合tfr的fc多肽时的活性相比保留它的活性的至少10%,或至少15%、20%、25%、30%、 35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、 90%或95%。在一些实施方案中,ids酶或其催化活性变体或片段与它不连结于fc多肽或结合tfr的fc多肽时的活性相比保留它的活性的至少80%、85%、90%或95%。在一些实施方案中,与fc多肽融合不降低ids酶或其催化活性变体或片段的活性。在一些实施方案中,与结合tfr的fc多肽融合不降低ids酶的活性。
263.i.用于结合血脑屏障(bbb)受体的fc多肽修饰
264.在一些方面,融合蛋白能够跨越血脑屏障(bbb)转运。这样的蛋白质包含结合bbb受体的经修饰的fc多肽。bbb受体在bbb内皮以及其他细胞和组织类型上表达。在一些实施方案中,bbb受体是转铁蛋白受体(tfr)。
265.本文中使用eu索引编号对多种fc修饰,包括在结合于bbb受体如tfr的经修饰的fc多肽中引入的修饰中表示的氨基酸残基进行编号。任何fc多肽,例如igg1、igg2、igg3或igg4 fc多肽,可以在如本文所述的一个或多个位置处具有修饰,例如氨基酸取代。
266.本文所述的融合蛋白中存在的经修饰(例如增强异二聚和/或 bbb受体结合)的fc多肽可以与天然fc区序列或其片段,例如至少 50个氨基酸或至少100个氨基酸或更长的片段具有至少70%同一性、至少75%同一性、至少80%同一性、至少85%同一性、至少90%同一性、至少95%同一性、至少96%同一性、至少97%同一性、至少 98%同一性或至少99%同一性。在一些实施方案中,天然fc氨基酸序列是seq id no:1的fc区序列。在一些实施方案中,天然fc氨基酸序列是seq id no:183的fc区序列。在一些实施方案中,经修饰的fc多肽与以下具有至少70%同一性、至少75%同一性、至少80%同一性、至少85%同一性、至少90%同一性、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性:seq id no:1的氨基酸1-110;seq id no:183的氨基酸1-110; seq id no:1的氨基酸111-217;seq id no:183的氨基酸111-216;或其片段,例如长度为至少50个氨基酸或至少100个氨基酸或更长的片段。
267.在一些实施方案中,经修饰(例如增强异二聚和/或bbb受体结合) 的fc多肽包含与天然fc区氨基酸序列对应的至少50个氨基酸,或至少60个、65个、70个、75个、80个、85个、
90个或95个或更多个或至少100个氨基酸或更多个。在一些实施方案中,经修饰的 fc多肽包含与例如seq id no:1或183的天然fc区氨基酸序列对应的至少25个相连氨基酸,或至少30个、35个、40个或45个相连氨基酸,或50个相连氨基酸,或至少60个、65个、70个、75个、80 个、85个、90个或95个或更多个相连氨基酸,或100个或更多个相连氨基酸。
268.在一些实施方案中,针对bbb受体结合活性进行修饰的结构域是人ig ch3结构域,例如igg1 ch3结构域。ch3结构域可以属于任何igg亚型,即igg1、igg2、igg3或igg4。在igg1抗体的上下文中,ch3结构域是指如根据eu编号方案编号,从约位置341至约位置447的氨基酸区段。
269.在一些实施方案中,本文所述的融合蛋白中存在的经修饰(例如 bbb受体结合)的fc多肽在根据eu编号方案的氨基酸位置384、386、 387、388、389、390、413、416和421处包含至少一个、两个或三个取代;和在一些实施方案中,至少四个、五个、六个、七个、八个或九个取代。
270.fcrn结合位点
271.在某些方面,修饰(例如bbb受体结合)fc多肽或本文所述的融合蛋白中存在的不特异性结合于bbb受体的fc多肽还可以包含 fcrn结合位点。在一些实施方案中,fcrn结合位点在fc多肽或其片段内。
272.在一些实施方案中,fcrn结合位点包含天然fcrn结合位点。在一些实施方案中,fcrn结合位点不包含相对于天然fcrn结合位点的氨基酸序列的氨基酸变化。在一些实施方案中,天然fcrn结合位点是igg结合位点,例如人igg结合位点。在一些实施方案中,fcrn 结合位点包含改变fcrn结合的修饰。
273.在一些实施方案中,fcrn结合位点具有被突变(例如被取代)的一个或多个氨基酸残基,其中所述一个或多个突变增加血清半衰期或基本上不减少血清半衰期(即,当在相同条件下测定时,与在突变位置处具有野生型残基的对应经修饰的fc多肽相比血清半衰期减少不超过25%)。在一些实施方案中,根据eu编号方案,fcrn结合位点具有在位置250-256、307、380、428和433-436处的一个或多个被取代的氨基酸残基。
274.在一些实施方案中,相对于天然人igg序列,fcrn结合位点处或附近的一个或多个残基被突变,以延长修饰多肽的血清半衰期。在一些实施方案中,突变引入位置252、254和256的一个、两个或三个中。在一些实施方案中,突变是m252y、s254t和t256e。在一些实施方案中,经修饰的fc多肽还包含突变m252y、s254t和t256e。在一些实施方案中,根据eu编号方案,经修饰的fc多肽包含在位置t307、e380和n434中的一个、两个或全部三个处的取代。在一些实施方案中,突变是t307q和n434a。在一些实施方案中,经修饰的fc多肽包含突变t307a、e380a和n434a。在一些实施方案中,根据eu编号方案,经修饰的fc多肽包含在位置t250和m428处的取代。在一些实施方案中,经修饰的fc多肽包含突变t250q和/或 m428l。在一些实施方案中,根据eu编号方案,经修饰的fc多肽包含在位置m428和n434处的取代。在一些实施方案中,经修饰的 fc多肽包含突变m428l和n434s。在一些实施方案中,经修饰的fc 多肽包含n434s或n434a突变。
275.ii.结合转铁蛋白受体的fc多肽
276.本部分描述了结合于转铁蛋白受体(tfr)并能够跨越血脑屏障 (bbb)转运的本文所述的经修饰的fc多肽的产生。
277.包含在ch3结构域中的突变的结合tfr的fc多肽
278.在一些实施方案中,特异性结合于tfr的经修饰的fc多肽包含在ch3结构域中的取代。在一些实施方案中,经修饰的fc多肽包含针对tfr结合活性进行修饰的人ig ch3结构域,例如igg ch3结构域。ch3结构域可以属于任何igg亚型,即igg1、igg2、igg3或igg4。在igg抗体的上下文中,ch3结构域是指如根据eu编号方案编号,从约位置341至约位置447的氨基酸区段。
279.在一些实施方案中,特异性结合于tfr的经修饰的fc多肽结合于tfr的顶端结构域并且可以在不阻断或以其他方式抑制转铁蛋白与tfr的结合的情况下结合于tfr。在一些实施方案中,转铁蛋白与 tfr的结合基本上不受到抑制。在一些实施方案中,转铁蛋白与tfr 的结合被抑制了不到约50%(例如不到约45%、40%、35%、30%、 25%、20%、15%、10%或5%)。在一些实施方案中,转铁蛋白与tfr 的结合被抑制了不到约20%(例如不到约19%、18%、17%、16%、 15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、 3%、2%或1%)。
280.在一些实施方案中,根据eu编号方案,特异性结合于tfr的经修饰的fc多肽包含在氨基酸位置384、386、387、388、389、390、 413、416和421处的至少两个、三个、四个、五个、六个、七个、八个或九个取代。可以在这些位置处引入的例示性取代在表4和5中示出。在一些实施方案中,在位置388和/或421处的氨基酸是芳香族氨基酸,例如trp、phe或tyr。在一些实施方案中,在位置388 处的氨基酸是trp。在一些实施方案中,在位置421处的芳香族氨基酸是trp或phe。
281.在一些实施方案中,如下的至少一个位置被取代:在位置384处的leu、tyr、met或val;在位置386处的leu、thr、his或pro;在位置387处的val、pro或酸性氨基酸;在位置388处的芳香族氨基酸,例如trp;在位置389处的val、ser或ala;在位置413处的酸性氨基酸、ala、ser、leu、thr或pro;在位置416处的thr或酸性氨基酸;或在位置421处的trp、tyr、his或phe。在一些实施方案中,经修饰的fc多肽可以包含保守取代,例如该集合中的一个或多个位置处的指定氨基酸的相同电荷分组、疏水性分组、侧链环结构分组(例如芳族氨基酸)或大小分组和/或极性或非极性分组中的氨基酸。因此,举例来说,ile可以存在于位置384、386和/或位置413 处。在一些实施方案中,在位置387、413和416中的一个、两个或每个位置处的酸性氨基酸是glu。在其他实施方案中,在位置387、 413和416中的一个、两个或每个位置处的酸性氨基酸是asp。在一些实施方案中,位置384、386、387、388、389、413、416和421中的两个、三个、四个、五个、六个、七个或全部八个位置具有如本段中说明的氨基酸取代。
282.在一些实施方案中,如前两段中所述进行修饰的fc多肽在位置 390处包含天然asn。在一些实施方案中,经修饰的fc多肽在位置 390处包含gly、his、gln、leu、lys、val、phe、ser、ala或asp。在一些实施方案中,根据eu编号方案,经修饰的fc多肽还在包含 380、391、392和415的位置处包含一个、两个、三个或四个取代。
283.在一些实施方案中,在位置380处可以存在trp、tyr、leu或gln。
284.在一些实施方案中,在位置391处可以存在ser、thr、gln或phe。
285.在一些实施方案中,在位置392处可以存在gln、phe或his。在一些实施方案中,在位置415处可以存在glu。
286.在某些实施方案中,经修饰的fc多肽包含选自以下的两个、三个、四个、五个、六
76、81-84、95-167、184-198和200-206(例如,seq idno:12-16、36、38-68、184、190、192和200)中的任一者的eu索引位置384-390和/或413-421处的氨基酸。在一些实施方案中,经修饰的fc多肽包含seq id no:4-68、73-76、81-84、95-167、184-198和 200-206(例如,seq id no:12-16、36、38-68、184、190、192和200) 中的任一者的eu索引位置380-390和/或413-421处的氨基酸。在一些实施方案中,经修饰的fc多肽包含seq id no:4-68、73-76、81-84、 95-167、184-198和200-206(例如,seq id no:12-16、36、38-68、 184、190、192和200)中的任一者的eu索引位置380-392和/或413-426 处的氨基酸。
292.在一些实施方案中,经修饰的fc多肽与seq id no:4-68、73-76、 81-84、95-167、184-198和200-206(例如,seq id no:12-16、36、 38-68、184、190、192和200)中的任一者具有至少75%同一性、至少80%同一性、至少85%同一性、至少90%同一性、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性,并且还包含根据eu索引编号的如下位置中的至少五个、六个、七个、八个、九个、十个、十一个、十二个、十三个、十四个、十五个或十六个:在位置380处的trp、tyr、leu、gln或glu;在位置384处的leu、tyr、met或val;在位置386处的leu、thr、 his或pro;在位置387处的val、pro或酸性氨基酸;在位置388处的芳香族氨基酸,例如trp;在位置389处的val、ser或ala;在位置390处的ser或asn;在位置391处的ser、thr、gln或phe;在位置392处的gln、phe或his;在位置413处的酸性氨基酸、ala、 ser、leu、thr或pro;在位置414处的lys、arg、gly或pro;在位置415处的glu或ser;在位置416处的thr或酸性氨基酸;在位置 421处的trp、tyr、his或phe;在位置424处的ser、thr、glu或 lys;以及在位置426处的ser、trp或gly。
293.在一些实施方案中,经修饰的fc多肽包含seq id no:12-16、 36、38-68、184、190、192和200中的任一者的氨基酸序列。在其他实施方案中,经修饰的fc多肽包含seq id no:12-16、36、38-68、 184、190、192和200中的任一者的氨基酸序列,但其中一个、两个或三个氨基酸被取代。
294.在一些实施方案中,经修饰的fc多肽包含另外的突变,例如以下描述的突变,包括(但不限于)杵突变(例如,如参考eu编号进行编号的t366w)、臼突变(例如,如参考eu编号进行编号的t366s、l368a 和y407v)、调节效应功能的突变(例如,如参考eu编号进行编号的 l234a、l235a和/或p329g(例如l234a和l235a))和/或增加血清稳定性或血清半衰期的突变(例如,(i)如参考eu编号进行编号的 m252y、s254t和t256e,或(ii)如参考eu编号进行编号的n434s,有或者没有m428l)。作为说明,seq id no:73-76、81-84、92、95-169、 185-189、191、193-199和201-207提供包含这些另外的突变中的一个或多个的在ch3结构域中具有突变(例如克隆ch3c.35.20.1、 ch3c.35.23.2、ch3c.35.23.3、ch3c.35.23.4、ch3c.35.21.17.2和 ch3c.35.23)的经修饰的fc多肽的非限制性实例。
295.在一些实施方案中,经修饰的fc多肽包含杵突变(例如,如参考 eu编号进行编号的t366w)并且与seq id no:73、96、108、120、 132、144、156、185、193、201中的任一者的序列具有至少85%同一性、至少90%同一性、至少95%同一性、至少96%同一性、至少 97%同一性、至少98%同一性或至少99%同一性。在一些实施方案中,经修饰的fc多肽包含seq id no:73、96、108、120、132、144、156、 185、193和201中的任一者的序列。
296.在一些实施方案中,经修饰的fc多肽包含杵突变(例如,如参考 eu编号进行编号的t366w)和调节效应功能的突变(例如,如参考eu 编号进行编号的l234a、l235a和/或
p329g(例如l234a和l235a)),并且与seqidno:74、92、97、98、109、110、121、122、133、134、145、146、157、158、168、169、186、191、194、195、199、202、203和207中的任一者的序列具有至少85%同一性、至少90%同一性、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性。在一些实施方案中,经修饰的fc多肽包含seqidno:74、92、97、98、109、110、121、122、133、134、145、146、157、158、168、169、186、191、194、195、199、202、203和207中的任一者的序列。
297.在一些实施方案中,经修饰的fc多肽包含杵突变(例如,如参考eu编号进行编号的t366w)和增加血清稳定性或血清半衰期的突变(例如,(i)如参考eu编号进行编号的m252y、s254t和t256e,或(ii)如参考eu编号进行编号的n434s,有或者没有m428l),并且与seqidno:75、99、111、123、135、147、159、187、196和204中的任一者的序列具有至少85%同一性、至少90%同一性、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性。在一些实施方案中,经修饰的fc多肽包含seqidno:75、99、111、123、135、147、159、187、196和204中的任一者的序列。
298.在一些实施方案中,经修饰的fc多肽包含杵突变(例如,如参考eu编号进行编号的t366w)、调节效应功能的突变(例如,如参考eu编号进行编号的l234a、l235a和/或p329g(例如l234a和l235a))和增加血清稳定性或血清半衰期的突变(例如,(i)如参考eu编号进行编号的m252y、s254t和t256e,或(ii)如参考eu编号进行编号的n434s,有或者没有m428l),并且与seqidno:76、100、101、112、113、124、125、136、137、148、149、160、161、188、197、198、205和206中的任一者的序列具有至少85%同一性、至少90%同一性、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性。在一些实施方案中,经修饰的fc多肽包含seqidno:76、100、101、112、113、124、125、136、137、148、149、160、161、188、197、198、205和206中的任一者的序列。
299.在一些实施方案中,经修饰的fc多肽包含臼突变(例如,如参考eu编号进行编号的t366s、l368a和y407v)并且与seqidno:81、102、114、126、138、150和162中的任一者的序列具有至少85%同一性、至少90%同一性、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性。在一些实施方案中,经修饰的fc多肽包含seqidno:81、102、114、126、138、150和162中的任一者的序列。
300.在一些实施方案中,经修饰的fc多肽包含臼突变(例如,如参考eu编号进行编号的t366s、l368a和y407v)和调节效应功能的突变(例如,如参考eu编号进行编号的l234a、l235a和/或p329g(例如l234a和l235a)),并且与seqidno:82、103、104、115、116、127、128、139、140、151、152、163和164中的任一者的序列具有至少85%同一性、至少90%同一性、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性。在一些实施方案中,经修饰的fc多肽包含seqidno:82、103、104、115、116、127、128、139、140、151、152、163和164中的任一者的序列。
301.在一些实施方案中,经修饰的fc多肽包含臼突变(例如,如参考eu编号进行编号的t366s、l368a和y407v)和增加血清稳定性或血清半衰期的突变(例如,(i)如参考eu编号进行编号的m252y、s254t和t256e,或(ii)如参考eu编号进行编号的n434s,有或者没有m428l),并且与seqidno:83、105、117、129、141、153和165中的任一者的序列具有至少85%同一性、至少90%同一性、至少95%同一性、至少96%同一性、至少97%同一性、至少
98%同一性或至少99%同一性。在一些实施方案中,经修饰的fc多肽包含seq idno:83、105、117、129、141、153和165中的任一者的序列。
302.在一些实施方案中,经修饰的fc多肽包含臼突变(例如,如参考 eu编号进行编号的t366s、l368a和y407v)、调节效应功能的突变 (例如,如参考eu编号进行编号的l234a、l235a和/或p329g(例如l234a和l235a))和增加血清稳定性或血清半衰期的突变(例如, (i)如参考eu编号进行编号的m252y、s254t和t256e,或(ii)如参考eu编号进行编号的n434s,有或者没有m428l),并且与seq idno:84、106、107、118、119、130、131、142、143、154、155、166 和167中的任一者的序列具有至少85%同一性、至少90%同一性、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性。在一些实施方案中,经修饰的fc多肽包含seqid no:84、106、107、118、119、130、131、142、143、154、155、 166和167中的任一者的序列。
303.在一些实施方案中,根据eu编号方案,特异性结合于tfr的经修饰的fc多肽包含在位置345、346、347、349、437、438、439和 440处的至少两个、三个、四个、五个、六个、七个或八个取代。在一些实施方案中,经修饰的fc多肽包含在位置437处的gly;在位置438处的phe;和/或在位置440处的asp。在一些实施方案中,glu 存在于位置440处。在某些实施方案中,经修饰的fc多肽包含在如下位置处的至少一个取代:在位置345处的phe或ile;在位置346 处的asp、glu、gly、ala或lys;在位置347处的tyr、met、leu、ile或asp;在位置349处的thr或ala;在位置437处的gly;在位置438处的phe;在位置439处的his tyr、ser或phe;或在位置440 处的asp。在一些实施方案中,位置345、346、347、349、437、438、 439和440中的两个、三个、四个、五个、六个、七个或全部八个具有如在本段中所指出的取代。在一些实施方案中,经修饰的fc多肽可包含保守取代,例如该集合中的一个或多个位置处的指定氨基酸的相同电荷分组、疏水性分组、侧链环结构分组(例如,芳族氨基酸),或大小分组,和/或极性或非极性分组中的氨基酸。
304.iii.另外的fc多肽突变
305.在一些方面,本文所述的融合蛋白包含两种fc多肽,所述fc多肽可以各自包含独立选择的修饰,或可以是野生型fc多肽,例如人 igg1 fc多肽。在一些实施方案中,一种或两种fc多肽含有赋予结合于血脑屏障(bbb)受体、例如转铁蛋白受体(tfr)的一个或多个修饰。可以引入一种或两种fc多肽中的其他突变的非限制性实例包括例如增加血清稳定性或血清半衰期、调节效应功能、影响糖基化、降低人中的免疫原性和/或提供fc多肽的杵臼异二聚的突变。
306.在一些实施方案中,融合蛋白中存在的fc多肽独立地与对应野生型fc多肽(例如人igg1、igg2、igg3或igg4 fc多肽)具有至少约 75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、 86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、 97%、98%或99%的氨基酸序列同一性。
307.在一些实施方案中,融合蛋白中存在的fc多肽包括杵和臼突变以促进异二聚体形成并阻碍同二聚体形成。一般地,所述修饰在第一多肽的界面处引入突起(“杵”)并且在第二多肽的界面中引入对应腔 (“臼”),使得突起可以位于腔中以便促进异二聚体形成并因此阻碍同二聚体形成。突起是通过用较大侧链(例如酪氨酸或色氨酸)替换来自第一多肽的界面的小氨基酸侧链来构建。通过用较小氨基酸侧链(例如丙氨酸或苏氨酸)替换大的氨基
酸侧链,在第二多肽的界面中产生与突起相同或类似尺寸的补偿腔。在一些实施方案中,这种另外的突变处于fc多肽中对多肽与bbb受体如tfr的结合无副作用的位置。
308.在用于二聚的杵臼方法的一个示意性实施方案中,融合蛋白中存在的fc多肽中的一种的位置366(根据eu编号方案编号)包含色氨酸,代替天然苏氨酸。二聚体中的另一种fc多肽在位置407处(根据 eu编号方案编号)具有缬氨酸,代替天然酪氨酸。另一种fc多肽还可以包含取代,其中在位置366处(根据eu编号方案编号)的天然苏氨酸经丝氨酸取代并且在位置368处(根据eu编号方案编号)的天然亮氨酸经丙氨酸取代。因此,本文所述的融合蛋白的一种fc多肽具有t366w杵突变并且另一种fc多肽具有y407v突变,其典型地伴有t366s和l368a臼突变。
309.在一些实施方案中,可以引入增强血清半衰期的修饰。举例来说,在一些实施方案中,如根据eu编号方案编号,本文所述的融合蛋白中存在的一种或两种fc多肽可以包含在位置252处的酪氨酸、在位置254处的苏氨酸和在位置256处的谷氨酸。因此,一种或两种fc 多肽可具有m252y、s254t和t256e取代。可替代地,如根据eu 编号方案编号,一种或两种fc多肽可具有m428l和n434s取代。可替代地,一种或两种fc多肽可具有n434s或n434a取代。
310.在一些实施方案中,本文所述的融合蛋白中存在的一种或两种 fc多肽可以包含减少效应功能的修饰,即在结合于在介导效应功能的效应细胞上表达的fc受体后诱导某些生物功能的能力减少。抗体效应功能的实例包括(但不限于)c1q结合和补体依赖性细胞毒性 (cdc)、fc受体结合、抗体依赖性细胞介导的细胞毒性(adcc)、抗体依赖性细胞介导的吞噬作用(adcp)、下调细胞表面受体(例如b细胞受体)和b细胞活化。效应功能可以随抗体类别而变。举例来说,在结合于在免疫系统细胞上存在的适当fc受体后,天然人igg1和 igg3抗体可以引起adcc和cdc活性,并且在结合于在免疫细胞上存在的适当fc受体后,天然人igg1、igg2、igg3和igg4可以引起 adcp功能。
311.在一些实施方案中,本文所述的融合蛋白中存在的一种或两种 fc多肽还可以被工程化成含有用于异二聚的其他修饰,例如 ch3-ch3界面内接触残基的静电工程化,所述修饰为天然带电或疏水性补丁修饰。
312.在一些实施方案中,本文所述的融合蛋白中存在的一种或两种 fc多肽可以包括调节效应功能的另外的修饰。
313.在一些实施方案中,本文所述的融合蛋白中存在的一种或两种 fc多肽可以包含减少或消除效应功能的修饰。根据eu编号方案,减少效应功能的例示性fc多肽突变包括(但不限于)ch2结构域中例如在位置234和235处的取代。举例来说,在一些实施方案中,一种或两种fc多肽可以在位置234和235处包含丙氨酸残基。因此,一种或两种fc多肽可具有l234a和l235a(lala)取代。
314.调节效应功能的另外的fc多肽突变包括(但不限于)以下:位置 329可以具有如下突变,其中脯氨酸经甘氨酸或精氨酸或足够大以破坏在fc的脯氨酸329与fcγriii的色氨酸残基trp 87和trp 110之间形成的fc/fcγ受体界面的氨基酸残基取代。另外的例示性取代包括根据eu编号方案的s228p、e233p、l235e、n297a、n297d和p331s。还可以存在多个取代,例如根据eu编号方案的人igg1 fc区的l234a 和l235a;人igg1 fc区的l234a、l235a和p329g;人igg4 fc区的s228p和l235e;人igg1 fc区的l234a和g237a;人igg1 fc 区的l234a、l235a和g237a;人igg2 fc区的v234a和g237a;人igg4 fc区的l235a、g237a和e318a;
以及人igg4 fc区的s228p 和l236e。在一些实施方案中,一种或两种fc多肽可以具有一个或多个调节adcc的氨基酸取代,例如在根据eu编号方案的位置298、 333和/或334处的取代。
315.在一些实施方案中,c端lys残基被去除或不存在于本文所述的 fc多肽(即,根据eu编号方案,在位置447处的lys残基)。
316.包含另外的突变的例示性fc多肽
317.借助于非限制性实例,本文所述的融合蛋白中存在的一种或两种 fc多肽可以包含另外的突变,包括杵突变(例如,如根据eu编号方案编号的t366w)、臼突变(例如,如根据eu编号方案编号的t366s、 l368a和y407v)、调节效应功能的突变(例如,如根据eu编号方案编号的l234a、l235a和/或p329g(例如l234a和l235a))和/或增加血清稳定性或血清半衰期的突变(例如,(i)如参考eu编号进行编号的m252y、s254t和t256e,或(ii)如参考eu编号进行编号的n434s,有或者没有m428l)。
318.在一些实施方案中,fc多肽可以具有杵突变(例如,如根据eu 编号方案编号的t366w)并且与seq id no:1、4-68、183、184、190、 192和200中的任一者的序列具有至少85%同一性、至少90%同一性、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性。在一些实施方案中,具有seq id no:1、4-68、 183、184、190、192和200中的任一者的序列的fc多肽可以被修饰成具有杵突变。
319.在一些实施方案中,fc多肽可以具有杵突变(例如,如根据eu 编号方案编号的t366w)、调节效应功能的突变(例如,如根据eu编号方案编号的l234a、l235a和/或p329g(例如l234a和l235a)),并且与seq id no:1、4-68、183、184、190、192和200中的任一者的序列具有至少85%同一性、至少90%同一性、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性。在一些实施方案中,具有seq id no:1、4-68、183、184、190、 192和200中的任一者的序列的fc多肽可以被修饰成具有杵突变和调节效应功能的突变。
320.在一些实施方案中,fc多肽可以具有杵突变(例如,如根据eu 编号方案编号的t366w)、增加血清稳定性或血清半衰期的突变(例如,(i)如参考eu编号进行编号的m252y、s254t和t256e,或(ii) 如参考eu编号进行编号的n434s,有或者没有m428l),并且与seqid no:1、4-68、183、184、190、192和200中的任一者的序列具有至少85%同一性、至少90%同一性、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性。在一些实施方案中,具有seq id no:1、4-68、183、184、190、192和 200中的任一者的序列的fc多肽可以被修饰成具有杵突变和增加血清稳定性或血清半衰期的突变。
321.在一些实施方案中,fc多肽可以具有杵突变(例如,如根据eu 编号方案编号的t366w)、调节效应功能的突变(例如,如根据eu编号方案编号的l234a、l235a和/或p329g(例如l234a和l235a))、增加血清稳定性或血清半衰期的突变(例如,(i)如参考eu编号进行编号的m252y、s254t和t256e,或(ii)如参考eu编号进行编号的n434s,有或者没有m428l),并且与seq id no:1、4-68、183、184、 190、192和200中的任一者的序列具有至少85%同一性、至少90%同一性、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性。在一些实施方案中,具有seq idno:1、4-68、183、184、190、192和200中的任一者的序列的fc多肽可以被修饰成具有杵突变、调节效应功能的突变和增加血清稳定性
或血清半衰期的突变。
322.在一些实施方案中,fc多肽可以具有臼突变(例如,如根据eu 编号方案编号的t366s、l368a和y407v)并且与seq id no:1、4-68、 183、184、190、192和200中的任一者的序列具有至少85%同一性、至少90%同一性、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性。在一些实施方案中,具有 seq id no:1、4-68、183、184、190、192和200中的任一者的序列的fc多肽可以被修饰成具有臼突变。
323.在一些实施方案中,fc多肽可以具有臼突变(例如,如根据eu 编号方案编号的t366s、l368a和y407v)、调节效应功能的突变(例如,如根据eu编号方案编号的l234a、l235a和/或p329g(例如 l234a和l235a)),并且与seq id no:1、4-68、183、184、190、 192和200中的任一者的序列具有至少85%同一性、至少90%同一性、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性。在一些实施方案中,具有seq id no:1、 4-68、183、184、190、192和200中的任一者的序列的fc多肽可以被修饰成具有臼突变和调节效应功能的突变。
324.在一些实施方案中,fc多肽可以具有臼突变(例如,如根据eu 编号方案编号的t366s、l368a和y407v)、增加血清稳定性或血清半衰期的突变(例如,(i)如参考eu编号方案编号的m252y、s254t 和t256e,或(ii)如参考eu编号方案编号的n434s,有或者没有 m428l),并且与seq id no:1、4-68、183、184、190、192和200 中的任一者的序列具有至少85%同一性、至少90%同一性、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性。在一些实施方案中,具有seq id no:1、4-68、183、 184、190、192和200中的任一者的序列的fc多肽可以被修饰成具有臼突变和增加血清稳定性或血清半衰期的突变。
325.在一些实施方案中,fc多肽可以具有臼突变(例如,如根据eu 编号方案编号的t366s、l368a和y407v)、调节效应功能的突变(例如,如根据eu编号方案编号的l234a、l235a和/或p329g(例如 l234a和l235a))、增加血清稳定性或血清半衰期的突变(例如,(i) 如参考eu编号进行编号的m252y、s254t和t256e,或(ii)如参考 eu编号进行编号的n434s,有或者没有m428l),并且与seq id no: 1、4-68、183、184、190、192和200中的任一者的序列具有至少85%同一性、至少90%同一性、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性。在一些实施方案中,具有seq id no:1、4-68、183、184、190、192和200中的任一者的序列的fc多肽可以被修饰成具有臼突变、调节效应功能的突变和增加血清稳定性或血清半衰期的突变。
326.iv.包含ids酶的例示性融合蛋白
327.在一些方面,本文所述的融合蛋白包含第一fc多肽,所述第一 fc多肽连接于ids酶、ids酶变体或其催化活性片段;和第二fc多肽,所述第二fc多肽与第一fc多肽形成fc二聚体。在一些实施方案中,第一fc多肽和/或第二fc多肽不包括免疫球蛋白重链和/或轻链可变区序列或其抗原结合部分。在一些实施方案中,第一fc多肽是经修饰的fc多肽和/或第二fc多肽是经修饰的fc多肽。在一些实施方案中,第二fc多肽是经修饰的fc多肽。在一些实施方案中,经修饰的fc多肽含有一个或多个促进其与另一种fc多肽的异二聚的修饰。在一些实施方案中,经修饰的fc多肽含有一个或多个减少效应功能的修饰。在一些实施方案中,经修饰的fc多肽含有一个或多个延长血清半衰期的修饰。在一些实施方案中,经修饰的fc
多肽含有一个或多个赋予结合于血脑屏障(bbb)受体、例如转铁蛋白受体(tfr) 的修饰。
328.在其他方面,本文所述的融合蛋白包含第一多肽链,所述第一多肽链包含特异性结合于bbb受体如tfr的经修饰的fc多肽;和第二多肽链,所述第二多肽链包含与经修饰的fc多肽二聚形成fc二聚体的fc多肽。ids酶可以连接于第一或第二多肽链。在一些实施方案中,ids酶连接于第二多肽链。在一些实施方案中,蛋白质包含两种 ids酶,每一种连接于多肽链中的一种。在一些实施方案中,fc多肽可以是结合bbb受体的多肽,其特异性结合于与第一多肽链中的经修饰的fc多肽相同的bbb受体。在一些实施方案中,fc多肽不特异性结合于bbb受体。
329.在一些实施方案中,本文所述的融合蛋白包含第一多肽链,所述第一多肽链包含特异性结合于tfr的经修饰的fc多肽;和第二多肽链,所述第二多肽链包含fc多肽,其中所述经修饰的fc多肽与所述 fc多肽二聚,形成fc二聚体。在一些实施方案中,ids酶连接于第一多肽链。在一些实施方案中,ids酶连接于第二多肽链。在一些实施方案中,fc多肽不特异性结合于bbb受体,例如tfr。
330.在一些实施方案中,本文所述的融合蛋白包含第一多肽链,所述第一多肽链包含结合于tfr并且包含t366w(杵)取代的经修饰的fc 多肽;和第二多肽链,所述第二多肽链包含包括t366s、l368a和 y407v(臼)取代的fc多肽。在一些实施方案中,经修饰的fc多肽和 /或fc多肽还包含l234a和l235a(lala)取代。在一些实施方案中,经修饰的fc多肽和/或fc多肽还包含m252y、s254t和t256e(yte) 取代。在一些实施方案中,经修饰的fc多肽和/或fc多肽还包含 l234a和l235a(lala)取代和m252y、s254t和t256e(yte)取代。在一些实施方案中,经修饰的fc多肽和/或fc多肽在位置234、235、 252、254、256和366处包含人igg1野生型残基。
331.在一些实施方案中,经修饰的fc多肽包含如针对seq idno:73-76、95-101、108-113、120-125、132-137、144-149、156-161、 185-188、191、193-198和201-206中的任一者所说明的杵、lala和 /或yte突变,并且与相应序列具有至少85%同一性、至少90%同一性、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性;或包含seq id no:73-76、95-101、 108-113、120-125、132-137、144-149、156-161、185-188、191、193-198 和201-206中的任一者的序列。在一些实施方案中,fc多肽包含如针对seq id no:77-80和208-211中的任一者所说明的臼、lala和/ 或yte突变并且与相应序列具有至少85%同一性、至少90%同一性、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性;或包含seq id no:77-80和208-211中的任一者的序列。在一些实施方案中,经修饰的fc多肽包含seq idno:73-76、95-101、108-113、120-125、132-137、144-149和156-161 中的任一者,并且fc多肽包含seq id no:77-80中的任一者。在一些实施方案中,经修饰的fc多肽包含seq id no:185-188、191、 193-198和201-206中的任一者,并且fc多肽包含seq id no:208-211 中的任一者。在一些实施方案中,经修饰的fc多肽和/或fc多肽的n 端包括igg1铰链区的一部分(例如dkthtcppcp;seq id no:89)。在一些实施方案中,经修饰的fc多肽与seq id no:92、168和169 中的任一者具有至少85%、至少90%、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性,或包含seq id no:92、168和169中的任一者的序列。在一些实施方案中,经修饰的fc多肽与seq id no:189、199和207中的任一者具有至少85%、至少90%、至少95%同一性、至
少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性,或包含seq id no:189、 199和207中的任一者的序列。
332.在一些实施方案中,本文所述的融合蛋白包含第一多肽链,所述第一多肽链包含结合于tfr并且包含t366s、l368a和y407v(臼) 取代的经修饰的fc多肽;和第二多肽链,所述第二多肽链包含包括 t366w(杵)取代的fc多肽。在一些实施方案中,经修饰的fc多肽和 /或fc多肽还包含l234a和l235a(lala)取代。在一些实施方案中,经修饰的fc多肽和/或fc多肽还包含m252y、s254t和t256e(yte) 取代。在一些实施方案中,经修饰的fc多肽和/或fc多肽还包含 l234a和l235a(lala)取代和m252y、s254t和t256e(yte)取代。在一些实施方案中,经修饰的fc多肽和/或fc多肽在位置234、235、 252、254、256和366处包含人igg1野生型残基。
333.在一些实施方案中,经修饰的fc多肽包含如针对seq idno:81-84、102-107、114-119、126-131、138-143、150-155和162-167 中的任一者所说明的臼、lala和yte突变,并且与相应序列具有至少85%同一性、至少90%同一性、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性;或包含seq id no:81-84、102-107、114-119、126-131、138-143、150-155 和162-167中的任一者的序列。在一些实施方案中,fc多肽包含如针对seq id no:85-88中的任一者所说明的杵、lala和yte突变并且与相应序列具有至少85%同一性、至少90%同一性、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少 99%同一性;或包含seq id no:85-88中的任一者的序列。在一些实施方案中,经修饰的fc多肽包含seq id no:81-84、102-107、 114-119、126-131、138-143、150-155和162-167中的任一者,并且 fc多肽包含seq id no:85-88中的任一者。在一些实施方案中,经修饰的fc多肽和/或fc多肽的n端包括igg1铰链区的一部分(例如 dkthtcppcp;seq id no:89)。
334.在一些实施方案中,本文所述的融合蛋白中存在的ids酶连接于多肽链,所述多肽链包含与seq id no:77-80和208-211中的任一者具有至少85%、至少90%、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性的fc多肽,或包含seq id no:77-80和208-211中的任一者的序列(例如,呈融合多肽形式)。在一些实施方案中,ids酶通过接头(例如柔性接头)和/或铰链区或其部分(例如dkthtcppcp;seq id no:89)连接于fc多肽。在一些实施方案中,ids酶包含与seq id no:90、170和174中的任一者具有至少85%、至少90%、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性的序列,或包含seq id no:90、170和174中的任一者的序列。在一些实施方案中,连接于fc多肽的ids序列与seq id no:91、93、171、172、175、 176和212-217中的任一者具有至少85%、至少90%、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性,或包含seq id no:91、93、171、172、175、176和212-217 中的任一者的序列。在一些实施方案中,融合蛋白包含与seq id no: 73-76、95-101、108-113、120-125、132-137、144-149、156-161、185-188、 191、193-198和201-206中的任一者具有至少85%、至少90%、至少 95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性的经修饰的fc多肽,或包含seq id no:73-76、95-101、108-113、120-125、132-137、144-149、156-161、185-188、 191、193-198和201-206中的任一者的序列。在一些实施方案中,fc 多肽和/或经修饰的fc多肽的n端包括igg1铰链区的一部分(例
如dkthtcppcp;seqidno:89)。在一些实施方案中,经修饰的fc多肽与seqidno:92、168和169中的任一者具有至少85%、至少90%或至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性,或包含seqidno:92、168和169中的任一者的序列。在一些实施方案中,经修饰的fc多肽与seqidno:189、199和207中的任一者具有至少85%、至少90%或至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性,或包含seqidno:189、199和207中的任一者的序列。
335.在一些实施方案中,融合蛋白包括包含seqidno:91的序列的ids-fc融合多肽,和包含seqidno:145和168(例如,seqidno:168)中任一者的序列的经修饰的fc多肽。在其他实施方案中,融合蛋白包括包含seqidno:91的序列的ids-fc融合多肽,和包含seqidno:109和169(例如,seqidno:169)中任一者的序列的经修饰的fc多肽。
336.在一些实施方案中,融合蛋白包括包含seqidno:215的序列的ids-fc融合多肽,和包含seqidno:202和207(例如,seqidno:207)中任一者的序列的经修饰的fc多肽。在其他实施方案中,融合蛋白包括包含seqidno:215的序列的ids-fc融合多肽,和包含seqidno:194和199(例如,seqidno:199)中任一者的序列的经修饰的fc多肽。
337.在一些实施方案中,融合蛋白包括包含seqidno:171的序列的ids-fc融合多肽,和包含seqidno:145和168(例如,seqidno:168)中任一者的序列的经修饰的fc多肽。在其他实施方案中,融合蛋白包括包含seqidno:171的序列的ids-fc融合多肽,和包含seqidno:109和169(例如,seqidno:169)中任一者的序列的经修饰的fc多肽。
338.在一些实施方案中,融合蛋白包括包含seqidno:213的序列的ids-fc融合多肽,和包含seqidno:202和207(例如,seqidno:207)中任一者的序列的经修饰的fc多肽。在其他实施方案中,融合蛋白包括包含seqidno:213的序列的ids-fc融合多肽,和包含seqidno:194和199(例如,seqidno:199)中任一者的序列的经修饰的fc多肽。
339.在一些实施方案中,融合蛋白包括包含seqidno:175的序列的ids-fc融合多肽,和包含seqidno:145和168(例如,seqidno:168)中任一者的序列的经修饰的fc多肽。在其他实施方案中,融合蛋白包括包含seqidno:175的序列的ids-fc融合多肽,和包含seqidno:109和169(例如,seqidno:169)中任一者的序列的经修饰的fc多肽。
340.在一些实施方案中,融合蛋白包括包含seqidno:217的序列的ids-fc融合多肽,和包含seqidno:202和207(例如,seqidno:207)中任一者的序列的经修饰的fc多肽。在其他实施方案中,融合蛋白包括包含seqidno:217的序列的ids-fc融合多肽,和包含seqidno:194和199(例如,seqidno:199)中任一者的序列的经修饰的fc多肽。
341.在一些实施方案中,本文所述的融合蛋白中存在的ids酶连接于包含与seqidno:85-88中的任一者具有至少85%、至少90%、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性的fc多肽,或包含seqidno:85-88中的任一者的序列的多肽链(例如,呈融合多肽形式)。在一些实施方案中,ids酶通过接头(例如柔性接头)和/或铰链区或其部分(例如,dkthtcppcp;seqidno:89)连接于fc多肽。在一些实施方案中,ids酶包含与seqidno:90、170和174中的任一者具有至少85%、至少90%、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性的序列,或包含seqidno:90、170和174中的任一者的序列。在一些实施方案中,连接于fc多肽的ids序列与seqidno:94、173和177中的任一者具有至少85%、至少90%、至少95%同
一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性,或包含seqidno:94、173和177中的任一者的序列。在一些实施方案中,融合蛋白包含与seqidno:81-84、102-107、114-119、126-131、138-143、150-155和162-167中的任一者具有至少85%、至少90%、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性的经修饰的fc多肽,或包含seqidno:81-84、102-107、114-119、126-131、138-143、150-155和162-167中的任一者的序列。在一些实施方案中,fc多肽和/或经修饰的fc多肽的n端包括igg1铰链区的一部分(例如,dkthtcppcp;seqidno:89)。
342.在一些实施方案中,本文所述的融合蛋白中存在的ids酶连接于包含与seqidno:73-76、95-101、108-113、120-125、132-137、144-149、156-161、185-188、191、193-198和201-206中的任一者具有至少85%、至少90%、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性的经修饰的fc多肽,或包含seqidno:73-76、95-101、108-113、120-125、132-137、144-149、156-161、185-188、191、193-198和201-206中的任一者的序列的多肽链(例如,呈融合多肽形式)。在一些实施方案中,ids酶通过接头(例如柔性接头)和/或铰链区或其部分(例如,dkthtcppcp;seqidno:89)连接于经修饰的fc多肽。在一些实施方案中,ids酶包含与seqidno:90、170和174中的任一者具有至少85%、至少90%、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性的序列,或包含seqidno:90、170和174中的任一者的序列。在一些实施方案中,融合蛋白包含与seqidno:77-80中的任一者具有至少85%、至少90%、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性的fc多肽,或包含seqidno:77-80中的任一者的序列。在一些实施方案中,融合蛋白包含与seqidno:208-211中的任一者具有至少85%、至少90%、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性的fc多肽,或包含seqidno:208-211中的任一者的序列。在一些实施方案中,经修饰的fc多肽和/或fc多肽的n端包括igg1铰链区一部分(例如,dkthtcppcp;seqidno:89)。
343.在一些实施方案中,本文所述的融合蛋白中存在的ids酶连接于包含与seqidno:81-84、102-107、114-119、126-131、138-143、150-155和162-167中的任一者具有至少85%、至少90%、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性的经修饰的fc多肽,或包含seqidno:81-84、102-107、114-119、126-131、138-143、150-155和162-167中的任一者的序列的多肽链(例如,呈融合多肽形式)。在一些实施方案中,ids酶通过接头(例如柔性接头)和/或铰链区或其部分(例如,dkthtcppcp;seqidno:89)连接于经修饰的fc多肽。在一些实施方案中,ids酶包含与seqidno:90、170和174中的任一者具有至少85%、至少90%、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性的序列,或包含seqidno:90、170和174中的任一者的序列。在一些实施方案中,融合蛋白包含与seqidno:85-88中的任一者具有至少85%、至少90%、至少95%同一性、至少96%同一性、至少97%同一性、至少98%同一性或至少99%同一性的fc多肽,或包含seqidno:85-88中的任一者的序列。在一些实施方案中,经修饰的fc多肽和/或fc多肽的n端包括igg1铰链区的一部分(例如,dkthtcppcp;seqidno:89)。
344.v.连接于fc多肽的ids酶
345.在一些实施方案中,本文所述的融合蛋白包含两种如本文所述的 fc多肽并且所述fc多肽中的一种或两种还可以包含部分或完全铰链区。铰链区可以来自于任何免疫球蛋白亚类或同型。一种例示性免疫球蛋白铰链是igg铰链区,例如igg1铰链区,例如人igg1铰链氨基酸序列epkscdkthtcppcp(seq id no:71)或其一部分(例如 dkthtcppcp;seq id no:89)。在一些实施方案中,铰链区在fc 多肽的n端区。
346.在一些实施方案中,fc多肽通过接头,例如肽接头连结于ids 酶。在一些实施方案中,fc多肽通过肽键或通过肽接头连结于ids 酶,例如是融合多肽。肽接头可以被配置成允许ids酶相对于其连结的fc多肽旋转;和/或抵抗蛋白酶消化。肽接头可以含有天然氨基酸、非天然氨基酸或它们的组合。在一些实施方案中,肽接头可以是柔性接头,例如含有氨基酸,例如gly、asn、ser、thr、ala等。这种接头使用已知参数设计并且可以是任何长度并含有任何数目的任何长度的重复单元(例如gly和ser残基的重复单元)。举例来说,接头可以具有重复单元,例如两个、三个、四个、五个或更多个gly4-ser(seqid no:179)重复单元或单个gly4-ser(seq id no:179)。在一些实施方案中,肽接头可以包括蛋白酶裂解位点,例如可由中枢神经系统中存在的酶裂解。
347.在一些实施方案中,ids酶例如通过gly
4-ser接头(seq idno:179)或(gly
4-ser)2接头(seq id no:180)连结于fc多肽的n端。在一些实施方案中,fc多肽可以在n端包含连结于接头或直接连结于ids酶的铰链序列或部分铰链序列。
348.在一些实施方案中,ids酶例如通过gly
4-ser接头(seq idno:179)或(gly
4-ser)2接头(seq id no:180)连结于fc多肽的c端。在一些实施方案中,fc多肽的c端直接连结于ids酶。
349.在一些实施方案中,ids酶通过化学交联剂连结于fc多肽。这种缀合物可以使用众所周知的化学交联试剂和方案产生。举例来说,存在本领域的技术人员已知并且可用于使多肽与所关注剂交联的大量化学交联剂。举例来说,交联剂是杂双官能交联剂,其可以用于以逐步方式连接分子。杂双官能交联剂能够针对缀合蛋白质设计更特定的偶合方法,从而减少如同型蛋白质聚合物的不必要的副反应的发生。多种杂双官能交联剂是本领域已知的,包括n-羟基琥珀酰亚胺 (nhs)或其水溶性类似物n-羟基磺基琥珀酰亚胺(磺基-nhs)、琥珀酰亚胺基4-(n-马来酰亚胺基甲基)环己烷-1-甲酸酯(smcc)、间马来酰亚胺基苯甲酰基-n-羟基琥珀酰亚胺酯(mbs);n-琥珀酰亚胺基(4-碘乙酰基)氨基苯甲酸酯(siab)、琥珀酰亚胺基4-(对马来酰亚胺基苯基) 丁酸酯(smpb)、1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc); 4-琥珀酰亚胺基氧基羰基-α-甲基-α-(2-吡啶基二硫代)-甲苯(smpt)、 n-琥珀酰亚胺基3-(2-吡啶基二硫基)丙酸酯(spdp)和琥珀酰亚胺基 6-[3-(2-吡啶基二硫基)丙酸酯]己酸酯(lc-spdp)。那些具有n-羟基琥珀酰亚胺部分的交联剂可以作为n-羟基磺基琥珀酰亚胺类似物获得,其通常具有更大的水溶性。另外,那些在连接链内具有二硫键的交联剂可以作为烷基衍生物替代地合成,以减少体内接头裂解的量。除了杂双官能交联剂外,还存在许多其他交联剂,包括同双官能交联剂和光反应性交联剂。辛二酸二琥珀酰亚胺基酯(dss)、双马来酰亚胺基己烷(bmh)和庚二亚氨酸二甲酯.2hcl(dmp)是有用的同双官能交联剂的实例,并且双-[b-(4-叠氮基水杨酰胺基)乙基]二硫化物(based) 和n-琥珀酰亚胺基-6(4'-叠氮基2'-硝基苯基氨基)己酸酯(sanpah)是有用的光反应性交联剂的实例。
[0350]
某些实施方案
[0351]
实施方案1.一种治疗有需要的受试者的亨特综合征的方法,所述方法包括向所述受试者施用治疗有效剂量的包含蛋白质的药物组合物,其中所述蛋白质包含:
[0352]
a.第一fc多肽,其连接于艾杜糖醛酸2-硫酸酯酶(ids)氨基酸序列、ids变体氨基酸序列或其催化活性片段;和
[0353]
b.第二fc多肽,其包含根据eu编号的以下氨基酸残基:在位置380处的trp、leu或glu;在位置384处的tyr;在位置386处的 thr;在位置387处的glu;在位置388处的trp;在位置389处的 ser或ala;在位置390处的ser或asn;在位置413处的thr;在位置415处的glu;在位置416处的glu;以及在位置421处的phe。
[0354]
实施方案2.一种治疗有需要的受试者的亨特综合征的方法,所述方法包括向所述受试者施用治疗有效剂量(例如,安全且治疗有效的剂量)的包含蛋白质的药物组合物,其中所述药物组合物的施用使受试者的csf中的糖胺聚糖(gag)的水平降低到在健康的受试者或未患亨特综合征的受试者中测量的基线水平,并且其中所述蛋白质包含:
[0355]
a.第一fc多肽,其连接于艾杜糖醛酸2-硫酸酯酶(ids)氨基酸序列、ids变体氨基酸序列或其催化活性片段;和
[0356]
b.第二fc多肽,其包含根据eu编号的以下氨基酸残基:在位置380处的trp、leu或glu;在位置384处的tyr;在位置386处的 thr;在位置387处的glu;在位置388处的trp;在位置389处的ser或ala;在位置390处的ser或asn;在位置413处的thr;在位置415处的glu;在位置416处的glu;以及在位置421处的phe。
[0357]
实施方案3.实施方案1-2中任一项的方法,其中所述治疗有效剂量(例如,安全且治疗有效的剂量)是约3mg/kg至约30mg/kg蛋白质。
[0358]
实施方案4.实施方案3或115的方法,其中所述治疗有效剂量 (例如,安全且治疗有效的剂量)是约3mg/kg蛋白质。
[0359]
实施方案5.实施方案3或115的方法,其中所述治疗有效剂量 (例如,安全且治疗有效的剂量)是约7.5mg/kg蛋白质。
[0360]
实施方案6.实施方案3或115的方法,其中所述治疗有效剂量 (例如,安全且治疗有效的剂量)是约15mg/kg蛋白质。
[0361]
实施方案7.实施方案3或115的方法,其中所述治疗有效剂量 (例如,安全且治疗有效的剂量)是约30mg/kg蛋白质。
[0362]
实施方案8.实施方案1-7或112-150中任一项的方法,其中所述药物组合物每周施用一次。
[0363]
实施方案9.实施方案1-8中任一项的方法,其中所述药物组合物还包含药学上可接受的赋形剂(例如,药学上可接受的载体)。
[0364]
实施方案10.实施方案1-9中任一项的方法,其中所述第二fc 多肽特异性结合于转铁蛋白受体。
[0365]
实施方案11.实施方案1-10中任一项的方法,其中所述ids氨基酸序列包含与seq id no:70具有至少90%同一性的氨基酸序列。
[0366]
实施方案12.实施方案11的方法,其中所述ids氨基酸序列包含选自由seq id no:70、170和174组成的组的序列。
[0367]
实施方案13.实施方案11的方法,其中所述ids氨基酸序列包含选自由seq id no:
70、90、170和174组成的组的序列。
[0368]
实施方案14.实施方案1-13中任一项的方法,其中连接于所述 ids氨基酸序列的所述第一fc多肽包含seq id no:91、171或175 的氨基酸序列。
[0369]
实施方案15.实施方案1-13中任一项的方法,其中连接于所述 ids氨基酸序列的所述第一fc多肽包含seq id no:213、215或217 的氨基酸序列。
[0370]
实施方案16.实施方案1-15中任一项的方法,其中所述ids氨基酸序列连接于所述第一fc多肽的n端。
[0371]
实施方案17.实施方案1-16中任一项的方法,其中所述第二fc 多肽包含:
[0372]
a.在位置380处的leu;
[0373]
b.在位置389处的ala;以及
[0374]
c.在位置390处的ser。
[0375]
实施方案18.实施方案1-16中任一项的方法,其中所述第二fc 多肽包含:
[0376]
a.在位置380处的glu;
[0377]
b.在位置389处的ala;以及
[0378]
c.在位置390处的asn。
[0379]
实施方案19.实施方案1-16中任一项的方法,其中所述第二fc 多肽包含:
[0380]
a.在位置380处的trp;
[0381]
b.在位置389处的ser;以及
[0382]
c.在位置390处的ser。
[0383]
实施方案20.实施方案1-16中任一项的方法,其中所述第二fc 多肽包含:
[0384]
a.在位置380处的leu;
[0385]
b.在位置389处的ser;以及
[0386]
c.在位置390处的ser。
[0387]
实施方案21.实施方案1-10中任一项的方法,其中连接于所述 ids氨基酸序列的所述第一fc多肽包含seq id no:175;并且所述第二fc多肽包含seq id no:92。
[0388]
实施方案22.实施方案1-10中任一项的方法,其中连接于所述 ids氨基酸序列的所述第一fc多肽包含seq id no:217;并且所述第二fc多肽包含seq id no:189。
[0389]
实施方案23.实施方案1-10中任一项的方法,其中连接于所述 ids氨基酸序列的所述第一fc多肽包含seq id no:175;并且所述第二fc多肽包含seq id no:95。
[0390]
实施方案24.实施方案23的方法,其中所述第二fc多肽还包含 seq id no:89,其中seq id no:89连接于seq id no:95的n端。
[0391]
实施方案25.实施方案1-10中任一项的方法,其中连接于所述 ids氨基酸序列的所述第一fc多肽包含seq id no:217;并且所述第二fc多肽包含seq id no:191。
[0392]
实施方案26.实施方案25的方法,其中所述第二fc多肽还包含 seq id no:89,其中seq id no:89连接于seq id no:191的n端。
[0393]
实施方案27.实施方案1-10中任一项的方法,其中连接于所述 ids氨基酸序列的所述第一fc多肽包含seq id no:175;并且所述第二fc多肽包含seq id no:168。
[0394]
实施方案28.实施方案1-10中任一项的方法,其中连接于所述 ids氨基酸序列的所述第一fc多肽包含seq id no:217;并且所述第二fc多肽包含seq id no:207。
[0395]
实施方案29.实施方案1-10中任一项的方法,其中连接于所述 ids氨基酸序列的所述第一fc多肽包含seq id no:175;并且所述第二fc多肽包含seq id no:169。
[0396]
实施方案30.实施方案1-10中任一项的方法,其中连接于所述 ids氨基酸序列的所述第一fc多肽包含seq id no:217;并且所述第二fc多肽包含seq id no:199。
[0397]
实施方案31.实施方案1-30或112-150中任一项的方法,其中所述药物组合物的所述施用使受试者的csf中的一种或多种分析物的水平降低到在健康的受试者中或在未患亨特综合征的受试者中测量的基线水平,其中所述一种或多种分析物选自由以下组成的组:糖胺聚糖(gag)、神经丝轻链(nf-l)、在髓样细胞上表达的可溶性触发受体2(strem2)、双(单酰基甘油)磷酸酯(bmp)、神经节苷脂和鞘脂。
[0398]
实施方案32.实施方案31的方法,其中所述药物组合物的所述施用使受试者的csf中的gag的水平降低到基线水平。
[0399]
实施方案33.实施方案31或32的方法,其中所述药物组合物的所述施用使受试者的csf中的nf-l的水平降低到基线水平。
[0400]
实施方案34.实施方案31-33中任一项的方法,其中所述药物组合物的所述施用使受试者的csf中的strem2的水平降低到基线水平。
[0401]
实施方案35.实施方案31-34中任一项的方法,其中所述药物组合物的所述施用使受试者的csf中的bmp的水平降低到基线水平。
[0402]
实施方案36.实施方案31-35中任一项的方法,其中所述药物组合物的所述施用使受试者的csf中的神经节苷脂的水平降低到基线水平。
[0403]
实施方案37.实施方案31-36中任一项的方法,其中所述药物组合物的所述施用使受试者的csf中的鞘脂的水平降低到基线水平。
[0404]
实施方案38.实施方案1-30或112-150中任一项的方法,其中所述药物组合物的所述施用使受试者的csf中的一种或多种分析物的水平降低了至少约10%、15%、20%、25%或30%,其中所述降低是相对于在施用之前所述受试者中的相应一种或多种分析物的水平,其中所述一种或多种分析物选自由以下组成的组:神经丝轻链(nf-l)、在髓样细胞上表达的可溶性触发受体2(strem2)、双(单酰基甘油) 磷酸酯(bmp)、神经节苷脂和鞘脂。
[0405]
实施方案39.实施方案38的方法,其中所述药物组合物的所述施用使受试者的csf中的所述一种或多种分析物的水平降低到在健康的受试者中或在未患亨特综合征的受试者中测量的基线水平。
[0406]
实施方案40.实施方案1-39或112-150中任一项的方法,其中所述药物组合物的所述施用使受试者的血清中的一种或多种分析物的水平相对于在施用之前受试者的血清中的相应一种或多种分析物的水平降低了至少约30%、40%、50%、60%或70%,其中所述一种或多种分析物选自由以下组成的组:gag和nf-l。
[0407]
实施方案41.实施方案40的方法,其中所述药物组合物的所述施用使受试者的血清中的gag的水平降低到基线水平(例如,如在健康的受试者中或在未患亨特综合征的受试者中测量)。
[0408]
实施方案42.实施方案40或41的方法,其中所述药物组合物的所述施用使受试者的血清中的nf-l的水平降低到基线水平(例如,如在健康的受试者中或在未患亨特综合征的受试者中测量)。
[0409]
实施方案43.实施方案1-42或112-150中任一项的方法,其中所述药物组合物的所述施用使所述受试者的尿液中的gag的水平相对于在施用之前所述受试者的尿液中的所述gag的水平降低了至少约 30%、40%、50%、60%或70%。
[0410]
实施方案44.实施方案43的方法,其中所述药物组合物的所述施用使所述受试者的尿液中的gag的水平降低到基线水平。
[0411]
实施方案45.实施方案1-44或112-150中任一项的方法,其中相对于在所述药物组合物的施用之前针对所述受试者测量的基线水平,所述药物组合物的所述施用提高或维持所述受试者的如厕能力百分比(tap)。
[0412]
实施方案46.实施方案1-45或112-150中任一项的方法,其中相对于在所述药物组合物的施用之前针对所述受试者测量的基线水平,所述药物组合物的所述施用提高或维持所述受试者在认知类别或行为类别中的定性个别化教育计划(iep)轨迹。
[0413]
实施方案47.实施方案1-46或112-150中任一项的方法,其中如通过听性脑干响应(abr)评估或标准听力测试所评估,相对于在所述药物组合物的施用之前针对所述受试者测量的基线水平,所述药物组合物的所述施用提高或维持所述受试者的听力。
[0414]
实施方案48.实施方案1-47或112-150中任一项的方法,其中如通过mri或超声波所评估,相对于在所述药物组合物的施用之前针对所述受试者测量的基线水平,所述药物组合物的所述施用改变所述受试者的肝脏体积。
[0415]
实施方案49.实施方案1-48或112-150中任一项的方法,其中如通过mri或超声波所评估,相对于在所述药物组合物的施用之前针对所述受试者测量的基线水平,所述药物组合物的所述施用改变所述受试者的脾脏体积。
[0416]
实施方案50.实施方案1-49或112-150中任一项的方法,其中所述受试者是男性受试者。
[0417]
实施方案51.实施方案1-50或112-150中任一项的方法,其中所述受试者是约2至18岁。
[0418]
实施方案52.实施方案1-50或112-150中任一项的方法,其中所述受试者是约2至10岁。
[0419]
实施方案53.实施方案1-50或112-150中任一项的方法,其中所述受试者是约5至10岁。
[0420]
实施方案54.实施方案1-50或112-150中任一项的方法,其中所述受试者小于4岁。
[0421]
实施方案55.实施方案1-54或112-150中任一项的方法,其中所述受试者的体重≥15kg。
[0422]
实施方案56.实施方案1-54或112-150中任一项的方法,其中所述受试者的体重≥19kg。
[0423]
实施方案57.实施方案1-56或112-150中任一项的方法,其中所述受试者的发育商(dq)《85。
[0424]
实施方案58.实施方案1-57或112-150中任一项的方法,其中所述受试者的发育商(dq)在约6个月或更长的时间段内下降至少10个点。
[0425]
实施方案59.实施方案1-58或112-150中任一项的方法,其中所述受试者与已确认患有神经病变型亨特综合征(nmps ii)的血亲具有相同的ids基因的遗传突变。
[0426]
实施方案60.实施方案1-58或112-150中任一项的方法,其中所述受试者患有神经病变型亨特综合征(nmps ii)或与已确认患有神经病变型亨特综合征(nmps ii)的血亲具有相同的ids基因的遗传突变。
[0427]
实施方案61.实施方案1-60或112-150中任一项的方法,其中向所述受试者静脉内施用所述药物组合物。
[0428]
实施方案62.实施方案61的方法,其中所述受试者在所述药物组合物的施用后没有经历输注相关反应(irr)。
[0429]
实施方案63.实施方案62的方法,其中irr是过敏反应。
[0430]
实施方案64.实施方案62的方法,其中irr是过敏症。
[0431]
实施方案65.实施方案62-64中任一项的方法,其中在没有预处理或共同施用用于输注相关反应(irr)的药物下向所述受试者施用所述药物组合物。
[0432]
实施方案66.实施方案61的方法,其中在进行预处理或共同施用用于输注相关反应(irr)的药物下向所述受试者施用所述药物组合物。
[0433]
实施方案67.实施方案65或66的方法,其中所述用于输注相关反应的药物是选自由以下组成的组的一者或多者:抗组胺、退热药和皮质类固醇。
[0434]
实施方案68.实施方案1-67或112-150中任一项的方法,其中在药物组合物的施用之后尿液总gag浓度(归一化至肌酐)相对于基线水平增加不到20%,其中所述基线水平是在所述药物组合物的施用之前针对所述受试者测量的。
[0435]
实施方案69.实施方案1-67或112-150中任一项的方法,其中在药物组合物的施用之后尿液总gag浓度(归一化至肌酐)相对于基线水平没有增加,其中所述基线水平是在所述药物组合物的施用之前针对所述受试者测量的。
[0436]
实施方案70.实施方案1-67或112-150中任一项的方法,其中在药物组合物的施用之后尿液总gag浓度(归一化至肌酐)相对于基线水平降低,其中所述基线水平是在所述药物组合物的施用之前针对所述受试者测量的。
[0437]
实施方案71.实施方案69或70中任一项的方法,其中所述受试者中的尿液总gag浓度的稳定或降低证实了所施用的剂量的安全性。
[0438]
实施方案72.实施方案1-71或112-150中任一项的方法,其中在药物组合物的施用之后抗药物抗体(ada)的发生率相对于基线水平没有增加,其中所述基线水平是在所述药物组合物的施用之前针对所述受试者测量的。
[0439]
实施方案73.实施方案1-71或112-150中任一项的方法,其中在药物组合物的施用之后抗药物抗体(ada)的发生率相对于基线水平增加不到10%,其中所述基线水平是在所述药物组合物的施用之前针对所述受试者测量的。
[0440]
实施方案74.实施方案1-73或112-150中任一项的方法,其中严重不良事件(sae)的频率小于约1/1000。
[0441]
实施方案75.实施方案1-73或112-150中任一项的方法,其中严重sae的发生率小于约1/1000。
[0442]
实施方案76.实施方案1-75或112-150中任一项的方法,其中所述治疗有效剂量包含活性与重组艾杜硫酸酯酶的标准护理剂量同等的所述蛋白质的量。
[0443]
实施方案77.实施方案1-75或112-150中任一项的方法,其中所述治疗有效剂量包
含活性与重组艾杜硫酸酯酶-β的标准护理剂量同等的所述蛋白质的量。
[0444]
实施方案78.实施方案1-77或112-150中任一项的方法,其中在至少4次每周剂量后所述药物组合物的所述施用使受试者的csf中的糖胺聚糖(gag)的水平降低了至少50%、60%、70%、75%、80%、 85%或90%,其中所述降低是相对于在施用之前所述受试者中gag 的csf水平。
[0445]
实施方案79.实施方案78的方法,其中在4次每周剂量后所述药物组合物的所述施用使受试者的csf中的所述糖胺聚糖(gag)的水平降低了至少50%、60%、70%、75%、80%、85%或90%。
[0446]
实施方案80.实施方案1-77或112-150中任一项的方法,其中在至少8次每周剂量后所述药物组合物的所述施用使受试者的csf中的糖胺聚糖(gag)的水平降低了至少50%、60%、70%、75%、80%、 85%或90%,其中所述降低是相对于在施用之前所述受试者中gag 的csf水平。
[0447]
实施方案81.实施方案80的方法,其中在8次每周剂量后所述药物组合物的所述施用使受试者的csf中的所述糖胺聚糖(gag)的水平降低了至少50%、60%、70%、75%、80%、85%或90%。
[0448]
实施方案82.实施方案1-77或112-150中任一项的方法,其中在至少12次每周剂量后所述药物组合物的所述施用使受试者的csf中的糖胺聚糖(gag)的水平降低了至少50%、60%、70%、75%、80%、 85%或90%,其中所述降低是相对于在施用之前所述受试者中gag 的csf水平。
[0449]
实施方案83.实施方案82的方法,其中在12次每周剂量后所述药物组合物的所述施用使受试者的csf中的所述糖胺聚糖(gag)的水平降低了至少50%、60%、70%、75%、80%、85%或90%。
[0450]
实施方案84.实施方案78-83中任一项的方法,其中所述药物组合物的施用使受试者的csf中的所述糖胺聚糖(gag)的水平降低到在健康的受试者或未患亨特综合征的受试者中测量的基线水平。
[0451]
实施方案85.实施方案1-84或112-150中任一项的方法,其中在至少4次每周剂量后所述药物组合物的所述施用使所述受试者的尿液中的糖胺聚糖(gag)的水平降低了至少50%、60%、70%、75%、 80%、85%或90%,其中所述降低是相对于在施用之前所述受试者中 gag的尿液水平。
[0452]
实施方案86.实施方案85的方法,其中在4次每周剂量后所述药物组合物的所述施用使所述受试者的尿液中的糖胺聚糖(gag)的水平降低了至少50%、60%、70%、75%、80%、85%或90%。
[0453]
实施方案87.实施方案1-84或112-150中任一项的方法,其中在至少8次每周剂量后所述药物组合物的所述施用使所述受试者的尿液中的糖胺聚糖(gag)的水平降低了至少50%、60%、70%、75%、 80%、85%或90%,其中所述降低是相对于在施用之前所述受试者中 gag的尿液水平。
[0454]
实施方案88.实施方案87的方法,其中在8次每周剂量后所述药物组合物的所述施用使所述受试者的尿液中的糖胺聚糖(gag)的水平降低了至少50%、60%、70%、75%、80%、85%或90%。
[0455]
实施方案89.实施方案85-88中任一项的方法,其中所述药物组合物的施用使所述受试者的尿液中的糖胺聚糖(gag)的水平降低到在健康的受试者或未患亨特综合征的受试者中测量的基线水平。
[0456]
实施方案90.实施方案78-89中任一项的方法,其中所述gag 是硫酸乙酰肝素。
[0457]
实施方案91.实施方案90的方法,其中在至少4次每周剂量后所述药物组合物的施用使受试者的csf中的硫酸乙酰肝素的水平降低了至少80%,其中所述降低是相对于在施用之前所述受试者中的 csf硫酸乙酰肝素水平。
[0458]
实施方案92.实施方案90的方法,其中在至少12次每周剂量后所述药物组合物的施用使受试者的csf中的硫酸乙酰肝素的水平降低了至少70%,其中所述降低是相对于在施用之前所述受试者中的 csf硫酸乙酰肝素水平。
[0459]
实施方案93.实施方案78-89中任一项的方法,其中所述gag 是硫酸皮肤素。
[0460]
实施方案94.实施方案1-93或112-150中任一项的方法,其中在至少8次每周剂量后所述药物组合物的所述施用使受试者的csf中的神经节苷脂的水平降低了至少10%、15%、20%、25%、30%、40%、 50%、60%、70%、80%或90%,其中所述降低是相对于在施用之前所述受试者中的神经节苷脂的csf水平。
[0461]
实施方案95.实施方案94的方法,其中在8次每周剂量后所述药物组合物的所述施用使受试者的csf中的所述神经节苷脂的水平降低了至少10%、15%、20%、25%、30%、40%、50%、60%、70%、 80%或90%。
[0462]
实施方案96.实施方案94或95的方法,其中所述神经节苷脂是 gm3。
[0463]
实施方案97.实施方案1-96或112-150中任一项的方法,其中在至少8次每周剂量后所述药物组合物的所述施用使受试者的csf中的bmp的水平降低了至少10%、15%、20%、25%、30%、40%、50%、 60%、70%、80%或90%,其中所述降低是相对于在施用之前所述受试者中的csf的所述bmp的水平。
[0464]
实施方案98.实施方案97的方法,其中在8次每周剂量后所述药物组合物的所述施用使受试者的csf中的所述bmp的水平降低了至少10%、15%、20%、25%、30%、40%、50%、60%、70%、80%或90%。
[0465]
实施方案99.实施方案97或98的方法,其中所述bmp是bmpdi 18:1物质。
[0466]
实施方案100.实施方案1-99或112-150中任一项的方法,其中在所述药物组合物的所述施用之前,所述受试者已经接受了重组艾杜硫酸酯酶酶替代疗法。
[0467]
实施方案101.实施方案1-100或112-150中任一项的方法,其中所述受试者在所述药物组合物的施用之前具有预先存在的针对ids 的抗药物抗体。
[0468]
实施方案102.实施方案101的方法,其中所述受试者的针对ids 的抗药物抗体的滴度在189至超过11,000,000范围内。
[0469]
实施方案103.实施方案102的方法,其中所述受试者的针对ids 的抗药物抗体的滴度超过11,000,000。
[0470]
实施方案104.一种治疗有需要的受试者的亨特综合征的方法,所述方法包括以约3mg/kg的每周剂量向所述受试者施用蛋白质,并且其中所述蛋白质包含:
[0471]
a.第一fc多肽,其连接于艾杜糖醛酸2-硫酸酯酶(ids)氨基酸序列、ids变体氨基酸序列或其催化活性片段;和
[0472]
b.第二fc多肽,其包含根据eu编号的以下氨基酸残基:在位置380处的trp、leu或glu;在位置384处的tyr;在位置386处的 thr;在位置387处的glu;在位置388处的trp;在位置389处的 ser或ala;在位置390处的ser或asn;在位置413处的thr;在位置415处的glu;在位置416处的glu;以及在位置421处的phe。
[0473]
实施方案105.一种治疗有需要的受试者的亨特综合征的方法,所述方法包括以约7.5mg/kg的每周剂量向所述受试者施用蛋白质,并且其中所述蛋白质包含:
[0474]
a.第一fc多肽,其连接于艾杜糖醛酸2-硫酸酯酶(ids)氨基酸序列、ids变体氨基酸序列或其催化活性片段;和
[0475]
b.第二fc多肽,其包含根据eu编号的以下氨基酸残基:在位置380处的trp、leu或glu;在位置384处的tyr;在位置386处的 thr;在位置387处的glu;在位置388处的trp;在位置389处的 ser或ala;在位置390处的ser或asn;在位置413处的thr;在位置415处的glu;在位置416处的glu;以及在位置421处的phe。
[0476]
实施方案106.一种治疗有需要的受试者的亨特综合征的方法,所述方法包括以约15mg/kg的每周剂量向所述受试者施用蛋白质,并且其中所述蛋白质包含:
[0477]
a.第一fc多肽,其连接于艾杜糖醛酸2-硫酸酯酶(ids)氨基酸序列、ids变体氨基酸序列或其催化活性片段;和
[0478]
b.第二fc多肽,其包含根据eu编号的以下氨基酸残基:在位置380处的trp、leu或glu;在位置384处的tyr;在位置386处的 thr;在位置387处的glu;在位置388处的trp;在位置389处的 ser或ala;在位置390处的ser或asn;在位置413处的thr;在位置415处的glu;在位置416处的glu;以及在位置421处的phe。
[0479]
实施方案107.一种治疗有需要的受试者的亨特综合征的方法,所述方法包括以约30mg/kg的每周剂量向所述受试者施用蛋白质,并且其中所述蛋白质包含:
[0480]
a.第一fc多肽,其连接于艾杜糖醛酸2-硫酸酯酶(ids)氨基酸序列、ids变体氨基酸序列或其催化活性片段;和
[0481]
b.第二fc多肽,其包含根据eu编号的以下氨基酸残基:在位置380处的trp、leu或glu;在位置384处的tyr;在位置386处的 thr;在位置387处的glu;在位置388处的trp;在位置389处的 ser或ala;在位置390处的ser或asn;在位置413处的thr;在位置415处的glu;在位置416处的glu;以及在位置421处的phe。
[0482]
实施方案108.实施方案104-107中任一项的方法,其中所述蛋白质包含在还包含药学上可接受的赋形剂的药物组合物中。
[0483]
实施方案109.一种使接受针对亨特综合征的治疗的受试者中的输注相关反应(irr)消退的方法,所述方法包括施用选自由抗组胺、退热药和皮质类固醇组成的组的一种或多种剂,其中所述受试者正在施用或施用过至少约7.5mg/kg蛋白质的剂量的包含蛋白质的药物组合物,并且其中所述蛋白质包含:
[0484]
a.第一fc多肽,其连接于艾杜糖醛酸2-硫酸酯酶(ids)氨基酸序列、ids变体氨基酸序列或其催化活性片段;和
[0485]
b.第二fc多肽,其包含根据eu编号的以下氨基酸残基:在位置380处的trp、leu或glu;在位置384处的tyr;在位置386处的 thr;在位置387处的glu;在位置388处的trp;在位置389处的 ser或ala;在位置390处的ser或asn;在位置413处的thr;在位置415处的glu;在
位置416处的glu;以及在位置421处的phe。
[0486]
实施方案110.实施方案109的方法,其中所述irr是发热。
[0487]
实施方案111.实施方案109或110的方法,其中使所述irr消退的方法包括向所述受试者施用扑热息痛和苯海拉明。
[0488]
实施方案112.一种治疗患有亨特综合征的受试者中的神经行为缺陷、听觉缺陷和/或肌肉骨骼异常的方法,所述方法包括向所述受试者施用治疗有效剂量的包含蛋白质的药物组合物,其中所述蛋白质包含:
[0489]
a.第一fc多肽,其连接于艾杜糖醛酸2-硫酸酯酶(ids)氨基酸序列、ids变体氨基酸序列或其催化活性片段;和
[0490]
b.第二fc多肽,其包含根据eu编号的以下氨基酸残基:在位置380处的trp、leu或glu;在位置384处的tyr;在位置386处的 thr;在位置387处的glu;在位置388处的trp;在位置389处的 ser或ala;在位置390处的ser或asn;在位置413处的thr;在位置415处的glu;在位置416处的glu;以及在位置421处的phe。
[0491]
实施方案113.实施方案112的方法,其中所述治疗有效剂量包含活性与重组艾杜硫酸酯酶的标准护理剂量同等的所述蛋白质的量。
[0492]
实施方案114.实施方案112的方法,其中所述治疗有效剂量包含活性与重组艾杜硫酸酯酶-β的标准护理剂量同等的所述蛋白质的量。
[0493]
实施方案115.实施方案112或113的方法,其中所述治疗有效剂量为约3mg/kg至约30mg/kg蛋白质。
[0494]
实施方案116.实施方案112-115中任一项的方法,其中所述药物组合物还包含药学上可接受的赋形剂(药学上可接受的载体)。
[0495]
实施方案117.实施方案112-116中任一项的方法,其中所述第二fc多肽特异性结合于转铁蛋白受体。
[0496]
实施方案118.实施方案112-117中任一项的方法,其中所述ids 氨基酸序列包含与seq id no:70具有至少90%同一性的氨基酸序列。
[0497]
实施方案119.实施方案118的方法,其中所述ids氨基酸序列包含选自由seq id no:70、90、170和174组成的组的序列。
[0498]
实施方案120.实施方案112-119中任一项的方法,其中连接于所述ids氨基酸序列的所述第一fc多肽包含seq id no:91、171或 175的氨基酸序列。
[0499]
实施方案121.实施方案112-119中任一项的方法,其中连接于所述ids氨基酸序列的所述第一fc多肽包含seq id no:213、215 或217的氨基酸序列。
[0500]
实施方案122.实施方案112-121中任一项的方法,其中所述ids 氨基酸序列连接于所述第一fc多肽的n端。
[0501]
实施方案123.实施方案112-122中任一项的方法,其中所述第二fc多肽包含:
[0502]
d.在位置380处的leu;
[0503]
e.在位置389处的ala;以及
[0504]
f.在位置390处的ser。
[0505]
实施方案124.实施方案112-122中任一项的方法,其中所述第二fc多肽包含:
[0506]
d.在位置380处的glu;
[0507]
e.在位置389处的ala;以及
[0508]
f.在位置390处的asn。
[0509]
实施方案125.实施方案112-122中任一项的方法,其中所述第二fc多肽包含:
[0510]
d.在位置380处的trp;
[0511]
e.在位置389处的ser;以及
[0512]
f.在位置390处的ser。
[0513]
实施方案126.实施方案112-122中任一项的方法,其中所述第二fc多肽包含:
[0514]
d.在位置380处的leu;
[0515]
e.在位置389处的ser;以及
[0516]
f.在位置390处的ser。
[0517]
实施方案127.实施方案112-117中任一项的方法,其中连接于所述ids氨基酸序列的所述第一fc多肽包含seq id no:175;并且所述第二fc多肽包含seq id no:92。
[0518]
实施方案128.实施方案112-117中任一项的方法,其中连接于所述ids氨基酸序列的所述第一fc多肽包含seq id no:217;并且所述第二fc多肽包含seq id no:189。
[0519]
实施方案129.实施方案112-117中任一项的方法,其中连接于所述ids氨基酸序列的所述第一fc多肽包含seq id no:175;并且所述第二fc多肽包含seq id no:95。
[0520]
实施方案130.实施方案129的方法,其中所述第二fc多肽还包含seq id no:89,其中seq id no:89连接于seq id no:95的n 端。
[0521]
实施方案131.实施方案112-117中任一项的方法,其中连接于所述ids氨基酸序列的所述第一fc多肽包含seq id no:217;并且所述第二fc多肽包含seq id no:191。
[0522]
实施方案132.实施方案131的方法,其中所述第二fc多肽还包含seq id no:89,其中seq id no:89连接于seq id no:191的n 端。
[0523]
实施方案133.实施方案112-117中任一项的方法,其中连接于所述ids氨基酸序列的所述第一fc多肽包含seq id no:175;并且所述第二fc多肽包含seq id no:168。
[0524]
实施方案134.实施方案112-117中任一项的方法,其中连接于所述ids氨基酸序列的所述第一fc多肽包含seq id no:217;并且所述第二fc多肽包含seq id no:207。
[0525]
实施方案135.实施方案112-117中任一项的方法,其中连接于所述ids氨基酸序列的所述第一fc多肽包含seq id no:175;并且所述第二fc多肽包含seq id no:169。
[0526]
实施方案136.实施方案112-117中任一项的方法,其中连接于所述ids氨基酸序列的所述第一fc多肽包含seq id no:217;并且所述第二fc多肽包含seq id no:199。
[0527]
实施方案137.实施方案112-136中任一项的方法,所述方法是治疗神经行为缺陷的方法。
[0528]
实施方案138.实施方案137的方法,其中所述神经行为缺陷是运动技能缺陷。
[0529]
实施方案139.实施方案138的方法,其中所述运动技能缺陷是精细运动技能缺陷。
[0530]
实施方案140.实施方案138的方法,其中所述运动技能缺陷是粗大运动技能缺陷。
[0531]
实施方案141.实施方案137的方法,其中所述神经行为缺陷是敏捷性缺陷。
[0532]
实施方案142.实施方案137的方法,其中所述神经行为缺陷是认知缺陷。
[0533]
实施方案143.实施方案142的方法,其中所述认知缺陷是学习或记忆缺陷。
[0534]
实施方案144.实施方案137的方法,其中所述神经行为缺陷是感觉运动门控缺陷。
[0535]
实施方案145.实施方案112-136中任一项的方法,所述方法是治疗听觉缺陷的方法。
[0536]
实施方案146.实施方案145的方法,其中相对于基线水平,所述药物组合物的施用减少所述受试者中的中耳积液和/或中耳炎。
[0537]
实施方案147.实施方案146的方法,其中参数的所述基线水平是所述受试者在所述药物组合物的施用之前的参数水平。
[0538]
实施方案148.实施方案112-136中任一项的方法,所述方法是治疗肌肉骨骼异常的方法。
[0539]
实施方案149.实施方案148的方法,其中所述肌肉骨骼异常是骨骼异常。
[0540]
实施方案150.实施方案112-149中任一项的方法,其中所述药物组合物的所述施用使受试者的csf中的一种或多种分析物的水平降低了至少约10%、15%、20%、25%或30%,其中所述降低是相对于在施用之前所述受试者中的相应一种或多种分析物的水平,其中所述一种或多种分析物选自由以下组成的组:糖胺聚糖(gag)、神经丝轻链(nf-l)、在髓样细胞上表达的可溶性触发受体2(strem2)、双(单酰基甘油)磷酸酯(bmp)、神经节苷脂和鞘脂。
[0541]
实施方案151.一种用于使输注相关反应(irr)消退的剂,所述方法包括向有需要的受试者施用所述剂,其中所述剂选自由抗组胺、退热药和皮质类固醇组成的组,其中所述受试者正在施用或施用过至少约7.5mg/kg蛋白质的剂量的包含蛋白质的药物组合物,并且其中所述蛋白质包含:
[0542]
a.第一fc多肽,其连接于艾杜糖醛酸2-硫酸酯酶(ids)氨基酸序列、ids变体氨基酸序列或其催化活性片段;和
[0543]
b.第二fc多肽,其包含根据eu编号的以下氨基酸残基:在位置380处的trp、leu或glu;在位置384处的tyr;在位置386处的 thr;在位置387处的glu;在位置388处的trp;在位置389处的 ser或ala;在位置390处的ser或asn;在位置413处的thr;在位置415处的glu;在位置416处的glu;以及在位置421处的phe。
[0544]
实施方案152.剂用于制备使输注相关反应(irr)消退的药剂的用途,所述消退通过向有需要的受试者施用所述药物进行,其中所述剂选自由组成的组抗组胺、退热药和皮质类固醇,其中所述受试者正在施用或施用过至少约7.5mg/kg蛋白质的剂量的包含蛋白质的药物组合物,并且其中所述蛋白质包含:
[0545]
a.第一fc多肽,其连接于艾杜糖醛酸2-硫酸酯酶(ids)氨基酸序列、ids变体氨基酸序列或其催化活性片段;和
[0546]
b.第二fc多肽,其包含根据eu编号的以下氨基酸残基:在位置380处的trp、leu或glu;在位置384处的tyr;在位置386处的 thr;在位置387处的glu;在位置388处的trp;在位置389处的 ser或ala;在位置390处的ser或asn;在位置413处的thr;在位置415处的glu;在位置416处的glu;以及在位置421处的phe。
[0547]
实施方案153.一种治疗有效剂量的包含蛋白质的药物组合物,所述药物组合物用于治疗有需要的受试者的亨特综合征,其中所述蛋白质包含:
[0548]
a.第一fc多肽,其连接于艾杜糖醛酸2-硫酸酯酶(ids)氨基酸序列、ids变体氨基酸序列或其催化活性片段;和
[0549]
b.第二fc多肽,其包含根据eu编号的以下氨基酸残基:在位置380处的trp、leu或glu;在位置384处的tyr;在位置386处的 thr;在位置387处的glu;在位置388处的trp;在位置389处的 ser或ala;在位置390处的ser或asn;在位置413处的thr;在位置415处的glu;在位置416处的glu;以及在位置421处的phe。
[0550]
实施方案154.治疗有效剂量的包含蛋白质的药物组合物用于制备供治疗亨特综合征的药物的用途,其中所述蛋白质包含:
[0551]
a.第一fc多肽,其连接于艾杜糖醛酸2-硫酸酯酶(ids)氨基酸序列、ids变体氨基酸序列或其催化活性片段;和
[0552]
b.第二fc多肽,其包含根据eu编号的以下氨基酸残基:在位置380处的trp、leu或glu;在位置384处的tyr;在位置386处的 thr;在位置387处的glu;在位置388处的trp;在位置389处的 ser或ala;在位置390处的ser或asn;在位置413处的thr;在位置415处的glu;在位置416处的glu;以及在位置421处的phe。
[0553]
实施方案155.一种治疗有效剂量的包含蛋白质的药物组合物,所述药物组合物用于治疗患有亨特综合征的受试者中的神经行为缺陷、听觉缺陷和/或肌肉骨骼缺陷,其中所述蛋白质包含:
[0554]
a.第一fc多肽,其连接于艾杜糖醛酸2-硫酸酯酶(ids)氨基酸序列、ids变体氨基酸序列或其催化活性片段;和
[0555]
b.第二fc多肽,其包含根据eu编号的以下氨基酸残基:在位置380处的trp、leu或glu;在位置384处的tyr;在位置386处的 thr;在位置387处的glu;在位置388处的trp;在位置389处的 ser或ala;在位置390处的ser或asn;在位置413处的thr;在位置415处的glu;在位置416处的glu;以及在位置421处的phe。
[0556]
实施方案156.治疗有效剂量的包含蛋白质的药物组合物用于制备供治疗患有亨特综合征的受试者中的神经行为缺陷、听觉缺陷和/ 或肌肉骨骼缺陷的药物的用途,其中所述蛋白质包含:
[0557]
a.第一fc多肽,其连接于艾杜糖醛酸2-硫酸酯酶(ids)氨基酸序列、ids变体氨基酸序列或其催化活性片段;和
[0558]
b.第二fc多肽,其包含根据eu编号的以下氨基酸残基:在位置380处的trp、leu或glu;在位置384处的tyr;在位置386处的thr;在位置387处的glu;在位置388处的trp;在位置389处的 ser或ala;在位置390处的ser或asn;在位置413处的thr;在位置415处的glu;在位置416处的glu;以及在位置421处的phe。
[0559]
实施方案157.一种包含蛋白质的药物组合物,所述药物组合物用于治疗亨特综合征的方法中,所述方法包括向有需要的受试者施用治疗有效剂量的所述药物组合物,其中所述药物组合物的施用使受试者的csf中的糖胺聚糖(gag)的水平降低到在健康的受试者或未患亨特综合征的受试者中测量的基线水平,并且其中所述蛋白质包含:
[0560]
a.第一fc多肽,其连接于艾杜糖醛酸2-硫酸酯酶(ids)氨基酸序列、ids变体氨基酸序列或其催化活性片段;和
[0561]
b.第二fc多肽,其包含根据eu编号的以下氨基酸残基:在位置380处的trp、leu或glu;在位置384处的tyr;在位置386处的 thr;在位置387处的glu;在位置388处的trp;在位置389处的 ser或ala;在位置390处的ser或asn;在位置413处的thr;在位置415处的glu;在
位置416处的glu;以及在位置421处的phe。
[0562]
实施方案158.蛋白质用于制备供治疗亨特综合征的药物的用途,所述治疗通过向有需要的受试者施用治疗有效剂量的所述药物进行,其中所述药物组合物的施用使受试者的csf中的糖胺聚糖(gag) 的水平降低到在健康的受试者或未患亨特综合征的受试者中测量的基线水平,并且其中所述蛋白质包含:
[0563]
a.第一fc多肽,其连接于艾杜糖醛酸2-硫酸酯酶(ids)氨基酸序列、ids变体氨基酸序列或其催化活性片段;和
[0564]
b.第二fc多肽,其包含根据eu编号的以下氨基酸残基:在位置380处的trp、leu或glu;在位置384处的tyr;在位置386处的 thr;在位置387处的glu;在位置388处的trp;在位置389处的 ser或ala;在位置390处的ser或asn;在位置413处的thr;在位置415处的glu;在位置416处的glu;以及在位置421处的phe。
[0565]
实施方案159.实施方案157的药物组合物或实施方案158的用途,其中所述治疗有效剂量为约3mg/kg至约30mg/kg蛋白质。
[0566]
实施方案160.一种包含蛋白质的药物组合物,所述药物组合物用于治疗与亨特综合征相关的神经行为缺陷、听觉缺陷和/或肌肉骨骼缺陷的方法中,所述方法包括向所述受试者施用治疗有效剂量的所述药物组合物,其中所述蛋白质包含:
[0567]
a.第一fc多肽,其连接于艾杜糖醛酸2-硫酸酯酶(ids)氨基酸序列、ids变体氨基酸序列或其催化活性片段;和
[0568]
b.第二fc多肽,其包含根据eu编号的以下氨基酸残基:在位置380处的trp、leu或glu;在位置384处的tyr;在位置386处的 thr;在位置387处的glu;在位置388处的trp;在位置389处的 ser或ala;在位置390处的ser或asn;在位置413处的thr;在位置415处的glu;在位置416处的glu;以及在位置421处的phe。
[0569]
实施方案161.蛋白质用于制备供治疗与亨特综合征相关的神经行为缺陷、听觉缺陷和/或肌肉骨骼缺陷的药物的用途,所述治疗通过向有需要的受试者施用治疗有效剂量的所述药物进行,其中所述蛋白质包含:
[0570]
a.第一fc多肽,其连接于艾杜糖醛酸2-硫酸酯酶(ids)氨基酸序列、ids变体氨基酸序列或其催化活性片段;和
[0571]
b.第二fc多肽,其包含根据eu编号的以下氨基酸残基:在位置380处的trp、leu或glu;在位置384处的tyr;在位置386处的 thr;在位置387处的glu;在位置388处的trp;在位置389处的 ser或ala;在位置390处的ser或asn;在位置413处的thr;在位置415处的glu;在位置416处的glu;以及在位置421处的phe。
[0572]
实施方案162.实施方案160的药物组合物或实施方案161的用途,其中所述治疗有效剂量为约3mg/kg至约30mg/kg蛋白质。
[0573]
某些定义
[0574]
术语“对照”或“对照样品”是指适合于所采用的检测技术的任何样品。对照样品可以含有所采用的检测技术的产品或要测试的材料。此外,对照可以是阳性或阴性对照。
[0575]
如本文中可互换使用的术语“受试者”、“个体”和“患者”是指哺乳动物,包括但不限于人、非人灵长类动物、啮齿动物(例如大鼠、小鼠和豚鼠)、兔子、母牛、猪、马和其他哺乳动物物种。在一个实施方案中,受试者是人。
[0576]
术语“药学上可接受的赋形剂”是指在生物学或药理学上适宜用于人或动物的非活性药物成分,例如但不限于缓冲剂、载体或防腐剂。
[0577]
术语“施用”是指将剂(例如lsd治疗剂,例如本文所述的etv疗法)、化合物或组合物(例如药物组合物)递送至所需的生物作用部位的方法。这些方法包括但不限于口服、局部递送、肠胃外递送、静脉内递送、皮内递送、肌内递送、鞘内递送、结肠递送、直肠递送或腹膜内递送。在一个实施方案中,本文所述的多肽是静脉内施用的。
[0578]
如本文所用的“治疗(treatment)”(和其语法变形如“治疗(treat)”或“治疗(治疗)”)是指改变被治疗的个体的自然进程的临床干预,并且可以为了预防或在临床病理学过程期间进行。理想的治疗效果包括但不限于:防止疾病的发生或复发、缓解症状、减小疾病的任何直接或间接的病理学后果、降低疾病进展的速率、改善或减轻疾病状态以及缓解或改善预后。
[0579]
短语“有效量”意指本文所述的化合物实现以下的量:(i)治疗或预防特定的疾病、疾患或病症;(ii)减轻、改善或消除特定的疾病、疾患或病症的一种或多种症状;或(iii)预防或延迟本文所述的特定的疾病、疾患或病症的一种或多种症状的发作。
[0580]
本文所公开的物质/分子的“治疗有效量”可能会根据各种因素而变化,例如疾病状态、个体的年龄、性别和体重以及该物质/分子在个体中引起期望的响应的能力。治疗有效量涵盖使治疗有益作用远远超过物质/分子的任何毒性或有害作用的量。“预防有效量”是指在必需的剂量下和必需的时间段内能有效获得所需的预防结果的量。通常但不一定,因为预防剂量是在疾病之前或疾病的较早阶段在受试者中使用,所以预防有效量将小于治疗有效量。
[0581]
术语“从患者获得样品”、“从患者获得”和类似的措词用于指直接从患者获得样品,以及通过中间人间接从患者获得样品(例如,从快递员那里获取样品,而快递员是从护士那里获取样品的,护士则是从患者那里获取样品的)。
[0582]
如本文所用的“艾杜糖醛酸硫酸酯酶”、“艾杜糖醛酸-2-硫酸酯酶”或“ids”是指艾杜糖醛酸2-硫酸酯酶(ec 3.1.6.13),它是参与糖胺聚糖硫酸乙酰肝素和硫酸皮肤素的溶酶体降解的酶。ids的缺乏与粘多糖贮积病ii(也称为亨特综合征)有关。如本文所用的作为包含fc多肽的蛋白质的组分的术语“ids”具有催化活性,并且涵盖野生型ids或其片段的功能性变体,包括等位基因和剪接变体。人ids同工型i的序列,即被指定为规范序列的人序列,可在uniprot条目p22304下获得,并由位于xq28的人ids基因编码。全长序列作为seq id no:69 提供。如本文所用,“成熟的”ids序列是指缺少天然存在的全长多肽链的信号和前肽序列的多肽链形式。成熟的人ids多肽的氨基酸序列作为seq id no:70提供,其对应于全长人序列的氨基酸34-550。如本文所用,“截短的”ids序列是指天然存在的全长多肽链的催化活性片段。示例性的截短的人ids多肽的氨基酸序列作为seq id no:90 提供,其对应于全长人序列的氨基酸26-550。人ids的结构已被很好地表征。例示性结构可在pdb登录号5fql下获得。该结构也描述在nat.comm.8:15786doi:10.1038/ncomms15786,2017中。还描述了非人灵长类动物ids序列,包括黑猩猩(uniprot条目k7bkv4) 和恒河猴(uniprot条目h9ftx2)。小鼠ids序列可在uniprot条目 q08890下获得。例如在相同条件下测定时,ids变体具有相应野生型ids或其片段的活性的至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%或至少95%。例如在相同条件下测定时,催
化活性ids片段具有相应全长ids或其变体的活性的至少50%、至少55%、至少60%、至少65%、至少 70%、至少75%、至少80%、至少85%、至少90%或至少95%。
[0583]“ids酶变体”是指野生型ids酶或其片段的功能变体,包括等位基因和剪接变体,其中例如在相同条件下测定时,ids酶变体具有对应野生型ids酶或其片段的活性的至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%或至少95%。
[0584]
如本文所用的“转铁蛋白受体”或“tfr”是指转铁蛋白受体蛋白1。人转铁蛋白受体1多肽序列如seq id no:72中所示。来自其他物种的转铁蛋白受体蛋白1序列也是已知的(例如黑猩猩,登录号 xp_003310238.1;恒河猴,np_001244232.1;狗,np_001003111.1;牛,np_001193506.1;小鼠,np_035768.1;大鼠,np_073203.1;和鸡np_990587.1)。术语“转铁蛋白受体”还涵盖示例性参考序列,例如人序列的等位基因变体,其由在转铁蛋白受体蛋白1的染色体位点处的基因编码。全长转铁蛋白受体蛋白包括短的n端胞内区、跨膜区和大的胞外结构域。胞外结构域的特征在于三个结构域:蛋白酶样结构域、螺旋结构域和顶端结构域。人转铁蛋白受体1的顶端结构域序列如seq id no:178所示。
[0585]
如本文所用的“融合蛋白”或“[ids酶]-fc融合蛋白”是指一种二聚蛋白,它包含与ids酶、ids酶变体或其催化活性片段连接(例如融合)的第一fc多肽(即,“[ids]-fc融合多肽”);及与第一fc多肽形成 fc二聚体的第二fc多肽。第二fc多肽也可以与ids酶、ids酶变体或其催化活性片段连接(例如融合)。第一fc多肽和/或第二fc多肽可以通过肽键或通过多肽接头与ids酶、ids酶变体或其催化活性片段连接。第一fc多肽和/或第二fc多肽可以是经修饰的fc多肽,其含有一个或多个促进其与其他fc多肽异二聚化的修饰。第一fc多肽和/或第二fc多肽可以是经修饰的fc多肽,其含有一个或多个赋予与转铁蛋白受体结合的修饰。第一fc多肽和/或第二fc多肽可以是含有一个或多个降低效应功能的修饰的经修饰的fc多肽。第一fc多肽和/或第二fc多肽可以是含有一个或多个延长血清半衰期的修饰的经修饰的fc多肽。
[0586]
如本文所用的“融合多肽”或“[ids酶]-fc融合多肽”是指与ids 酶、ids酶变体或其催化活性片段连接(例如融合)的fc多肽。fc多肽可以通过肽键或通过多肽接头与ids酶、ids酶变体或其催化活性片段连接。fc多肽可以是经修饰的fc多肽,其含有一个或多个促进其与另一fc多肽异二聚化的修饰。fc多肽可以是经修饰的fc多肽,其含有一个或多个赋予与转铁蛋白受体结合的修饰。fc多肽可以是含有一个或多个降低效应功能的修饰的经修饰的fc多肽。fc多肽可以是含有一个或多个延长血清半衰期的修饰的经修饰的fc多肽。
[0587]
如本文所用,术语“fc多肽”是指天然存在的免疫球蛋白重链多肽的c端区域,其特征为结构域形式的ig折叠。fc多肽含有至少包括 ch2结构域和/或ch3结构域的恒定区序列,并且可以含有铰链区的至少一部分。通常,fc多肽不含可变区。
[0588]“经修饰的fc多肽”是指与野生型免疫球蛋白重链fc多肽序列相比具有至少一个突变(例如取代、缺失或插入),但保留天然fc多肽的总ig折叠或结构的fc多肽。
[0589]
术语“fcrn”是指新生儿fc受体。fc多肽与fcrn的结合降低fc 多肽的清除率并增加其血清半衰期。人fcrn蛋白是一种异二聚体,由大小约为50kda的类似于主要组织相容性(mhc)i类蛋白的蛋白质和大小约为15kda的β2-微球蛋白构成。
[0590]
如本文所用,“fcrn结合位点”是指fc多肽的与fcrn结合的区域。在人igg中,如使
cys)、d-天冬氨酸(d-asp)、d-谷氨酸(d-glu)、d-苯丙氨酸(d-phe)、d-组氨酸(d-his)、d-异亮氨酸(d-ile)、d-精氨酸(d-arg)、 d-赖氨酸(d-lys)、d-亮氨酸(d-leu)、d-蛋氨酸(d-met)、d-天冬酰胺 (d-asn)、d-脯氨酸(d-pro)、d-谷氨酰胺(d-gln)、d-丝氨酸(d-ser)、 d-苏氨酸(d-thr)、d-缬氨酸(d-val)、d-色氨酸(d-trp)、d-酪氨酸 (d-tyr)和它们的组合。
[0599]
氨基酸在本文中可以由其通常已知的三字母符号或由 iupac-iub生物化学命名委员会推荐的单字母符号来表示。
[0600]
术语“多肽”和“肽”在本文中可互换使用,是指呈单链的氨基酸残基的聚合物。所述术语适用于其中一个或多个氨基酸残基是相应天然存在的氨基酸的人工化学模拟物的氨基酸聚合物,以及适用于天然存在的氨基酸聚合物和非天然存在的氨基酸聚合物。氨基酸聚合物可包含完全l-氨基酸、完全d-氨基酸或l与d氨基酸的混合物。
[0601]
如本文所用的术语“蛋白质”是指多肽或单链多肽的二聚体(即,两个)或多聚体(即,三个或更多个)。蛋白质的单链多肽可以通过共价键,例如二硫键或非共价相互作用连结。
[0602]
术语“保守取代”、“保守突变”或“保守修饰的变体”是指导致氨基酸被另一种可以被分类为具有相似的特征的氨基酸取代的改变。以这种方式定义的保守氨基酸组的类别的实例可以包括:“带电荷/极性组”,包括glu(谷氨酸或e)、asp(天冬氨酸或d)、asn(天冬酰胺或 n)、gln(谷氨酰胺或q)、lys(赖氨酸或k)、arg(精氨酸或r)和his (组氨酸或h);“芳香族组”,包括phe(苯丙氨酸或f)、tyr(酪氨酸或 y)、trp(色氨酸或w)和(组氨酸或h);和“脂肪族组”,包括gly(甘氨酸或g)、ala(丙氨酸或a)、val(缬氨酸或v)、leu(亮氨酸或l)、ile(异亮氨酸或i)、met(蛋氨酸或m)、ser(丝氨酸或s)、thr(苏氨酸或t)和cys(半胱氨酸或c)。在每个组中,也可以标识亚组。例如,带电荷或极性氨基酸的组可以细分为亚组,包括:包含lys、arg和 his的“带正电荷的亚组”;包含glu和asp的“带负电荷的亚组”;以及包含asn和gln的“极性亚组”。在另一个实例中,芳香族或环状组可以细分为亚组,包括:包含pro、his和trp的“氮环亚组”;以及包含phe和tyr的“苯基亚组”。在另一个实例中,脂肪族组可以细分为亚组,例如包含val、leu、gly和ala的“脂肪族非极性亚组”;以及包含met、ser、thr和cys的“脂肪族弱极性亚组”。保守突变的类别的实例包括上述亚组内的氨基酸的氨基酸取代,例如但不限于:lys 取代arg,反之亦然,因此可以保持正电荷;glu取代asp,反之亦然,因此可以保持负电荷;ser取代thr,反之亦然,因此可以保持游离的-oh;以及gln取代asn,反之亦然,因此可以保持游离的-nh2。在一些实施方案中,疏水性氨基酸取代例如在活性位点中的天然存在的疏水性氨基酸,以保持疏水性。
[0603]
在两个或更多个多肽序列的上下文中,术语“同一性”或“同一性百分比”是指如使用序列比较算法或通过手工比对和目测所测量,两个或更多个序列或子序列在比较窗口或指定区域上为了最大对应性进行比较和比对时在特定区域上是相同的或具有特定百分比的相同氨基酸残基(例如,至少60%同一性、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%或至少95%或更大)。
[0604]
为了进行多肽的序列比较,通常一个氨基酸序列用作参考序列,候选序列与之进行比较。比对可以使用本领域的技术人员可利用的各种方法,例如视觉比对或使用公开可用的软件使用已知算法来进行以实现最大比对。这样的程序包括blast程序、align、align-2 (genentech,south san francisco,calif.)或megalign(dnastar)。用于比对以实现最
大比对的参数可以由本领域的技术人员来确定。出于本技术的目的,为了进行多肽序列的序列比较,使用blastp算法标准蛋白blast以默认参数,将两个蛋白质序列进行比对。
[0605]
当在鉴定多肽序列中所给定的氨基酸残基的上下文中使用时,术语“对应于”、“参考
……
确定”或“参考...编号”是指当将所给定的氨基酸序列与参考序列最大程度地比对和比较时,指定参考序列的残基的位置。因此,例如,当与seq id no:1最佳比对时在经修饰的fc多肽中的氨基酸残基与seq id no:1中的氨基酸比对时,该残基“对应于”seq id no:1中的氨基酸。与参考序列比对的多肽不必是与参考序列长度相同。
[0606]
术语“多核苷酸”和“核酸”可互换,是指任何长度的核苷酸链,并且包括dna和rna。核苷酸可以是脱氧核糖核苷酸、核糖核苷酸、修饰核苷酸或碱基和/或它们的类似物,或可以通过dna或rna聚合酶掺入链中的任何底物。多核苷酸可以包含修饰核苷酸,例如甲基化核苷酸和其类似物。本文考虑的多核苷酸的实例包括单链和双链 dna、单链和双链rna、以及具有单链和双链dna与rna的混合物的杂混分子。
[0607]
如本文所用的“结合亲和力”是指两个分子之间的非共价相互作用的强度,例如,多肽上的单个结合位点与其结合的靶标,例如转铁蛋白受体。因此,例如,除非另有指示或从上下文中清楚,否则该术语可以指多肽与其靶标之间的1:1相互作用。结合亲和力可以通过测量平衡解离常数(kd)来定量,kd是指解离速率常数(kd,时间-1
)除以缔合速率常数(ka,时间-1
m-1
)。kd可以通过例如使用以下测量复合物形成和解离动力学来确定:表面等离子体共振(spr)法,例如biacore
tm
系统;动力学排除测定,例如和生物膜层干涉(例如使用平台)。如本文所用,“结合亲和力”不仅包括形式上的结合亲和力,例如反映多肽与其靶标之间的1:1相互作用的结合亲和力,还包括计算kd的可反映亲合结合(avid binding)的表观亲和力。
[0608]
如本文所用的术语“特异性结合”或“选择性结合”于靶标如tfr在提及如本文所述的工程化的tfr结合多肽、tfr结合肽或tfr结合抗体时是指一种结合反应,其中工程化的tfr结合多肽、tfr结合肽或 tfr结合抗体以比其与结构不同的靶标结合更大的亲和力、更大的亲合力和/或更长的持续时间与靶标结合。在典型的实施方案中,当在相同的亲和力测定条件下进行测定时,工程化的tfr结合多肽、tfr 结合肽或tfr结合抗体对特定靶标(如tfr)的亲和力比不相关的靶标大至少5倍、10倍、50倍、100倍、1,000倍、10,000倍或更大。如本文所用的术语“特异性结合”、“特异性结合于”特定靶标(如tfr)或“对特定靶标(如tfr)具有特异性”可以例如由对所结合的靶标的平衡解离常数kd例如为10-4
m或更小,例如10-5
m、10-6
m、10-7
m、10-8 m、10-9
m、10-10
m、10-11
m或10-12
m的分子来展示。在一些实施方案中,工程化的tfr结合多肽、tfr结合肽或tfr结合抗体特异性结合于tfr上在物种间保守(例如在物种之间结构上保守),例如在非人灵长类动物和人类物种之间保守(例如,在非人灵长类动物与人类物种之间结构上保守)的表位。在一些实施方案中,工程化的tfr结合多肽、tfr结合肽或tfr结合抗体可以仅与人tfr结合。
[0609]
术语“可变区”或“可变结构域”是指抗体重链或轻链中衍生自种系可变(v)基因、多样性(d)基因或连接(j)基因(而非衍生自恒定(cμ和 cδ)基因区段),并赋予抗体与抗原结合的特异性的结构域。通常,抗体可变区包括四个保守的“构架”区,其间散布着三个高变的“互补决定区”。
[0610]
术语“抗原结合部分”和“抗原结合片段”在本文可互换使用,并且是指抗体的一个
或多个片段,其保留通过其可变区特异性结合抗原的能力。抗原结合片段的实例包括但不限于fab片段(由vl、vh、cl 和ch1域组成的单价片段)、f(ab')2片段(包含通过铰链区的二硫桥连接的两个fab片段的二价片段)、单链fv(scfv)、二硫键连接的fv (dsfv)、互补决定区(cdr)、vl(轻链可变区)和vh(重链可变区)。
[0611]
以下实施例旨在是非限制性的。
[0612]
实施例1:外周施用etv:ids对ids ko
×
tfr
muhu
小鼠中的脑gag 和溶酶体脂质的影响
[0613]
如下所述,研究外周施用etv:ids对ids ko
×
tfr
muhu
小鼠中的脑gag和溶酶体脂质的影响。
[0614]
材料和方法
[0615]
动物护理
[0616]
将小鼠圈养在12小时亮/暗循环下并随意取用水和标准啮齿动物饮食(#25502,辐照)。
[0617]
小鼠品系
[0618]
从the jackson laboratories(jax品系024744)获得先前描述的b6n背景的ids ko小鼠。先前已经描述了带有敲入小鼠受体中的人 tfr顶端结构域的tfr
mu/hu ki小鼠系的开发和表征(美国专利号 10,143,187)。将tfr
mu/hu
雄性小鼠与雌性ids杂合小鼠进行交配,以生成ids ko
×
tfr
mu/hu
小鼠。本研究中使用的所有小鼠均为雄性。
[0619]
施用和组织收集
[0620]
向2月龄的ids ko
×
tfr
mu/hu
小鼠静脉内注射艾杜硫酸酯酶(14.2 mg/kg体重),或etv:ids(40mg/kg体重),每周一次,持续4周(n=8) (对于etv:ids参见实施例6)。向2月龄的同窝仔tfr
mu/hu
小鼠静脉内注射盐水,每周一次,持续4周(n=5),其用作对照。对于7天的队列,在第一次后7天处死动物。对于28天的队列,在第四次每周剂量后7天处死动物。
[0621]
为了最终样品收集,通过腹膜内(i.p.)注射2.5%的avertin对动物进行深度麻醉。为了csf收集,在动物头骨的后部做矢状切开,分离皮下组织和肌肉以暴露枕大池,并使用预拉的玻璃毛细管刺穿枕大池以收集csf。将csf转移至低蛋白lobind eppendorf管中,并在 4℃下以12,700rpm离心10分钟。将csf转移至新的管中,并在干冰上速冻。通过测量样品在420nm下的吸光度,确认小鼠csf中没有血液污染。通过心脏穿刺收集血液以用于血清收集。为了血清收集,使血液在室温下凝结至少30分钟。然后将管在4℃下以12,700rpm 离心7分钟。将血清转移至新的管中,并在干冰上速冻。使用蠕动泵 (gilson inc.minipuls evolution)用冰冷的pbs对动物经心灌注。解剖脑和肝脏,并在干冰上速冻。
[0622]
组织制备:gag提取和加工
[0623]
如上所述收集脑和肝组织样品以及csf。使用来自qiagen的 tissuelyser将脑和肝组织均质化。然后将组织匀浆转移至96孔深板中,并使用96尖端超声波仪(q sonica)进行超声处理。进行bca蛋白测定以定量总蛋白,并且使每个样品20μg肝脏和100μg脑进行lc-ms/ms样品制备。对于csf,每个样品使用3μl。简单地说,硫酸乙酰肝素和硫酸皮肤素衍生的二糖是通过使用肝素酶i、ii、iii 和软骨素酶b的组合消化组织匀浆而产生的。将消化液与乙腈混合,并进行如下所述的lc-ms/ms。
[0624]
gag的lcms测定
[0625]
通过将液相色谱法(shimadzu nexera x2系统,shimadzu scientificinstrument,columbia,md,usa)与电喷雾质谱法(sciex qtrap 6500+, sciex,framingham,ma,usa)相耦合来执行gag定量。对于每次分析,使用0.55毫升/分钟的流速将样品注入acquity uplc behamide 1.7mm 2.1
×
150mm柱(waters corporation),柱温为55℃。流动相a和b分别由含10mm甲酸铵和0.1%甲酸的水和含0.1%甲酸的乙腈组成。梯度编程如下:0.0-0.5分钟,80%b;0.5-3.5分钟,80% b至50%b;3.5-4.0分钟,50%b至80%b;保持在80%b下4.0-4.5 分钟。采用以下设定,以负离子模式进行电喷雾电离:25的帘气;碰撞气体设定为中等;离子喷雾电压为-4500;温度在600℃下;离子源气体1为50下;离子源气体2为60。使用analyst 1.6.3(sciex)以多反应监测模式(mrm)进行数据采集,每种物质的停留时间为 50(msec)。碰撞能量(ce)设定为-30;去簇电位(dp)为-80;进入电位(ep) 为-10;碰撞池出口电位(cxp)为-10。使用以下mrm转换将gag检测为[m-h]-:d0a0在m/z 378.1》87.0下;d0s0在m/z 416.1》138.0 下;d0a4在m/z 458.1》300.0下;d4ua-2s-glcncoet-6s(iduron ltd, manchester,uk)在m/z 472.0(呈源片段离子)》97.0下用作内标。各个二糖物质基于它们的保留时间和mrm转变使用市售参考标准物 (iduron ltd)来鉴定。使用multiquant 3.0.2(sciex)通过d0a0、d0s0 和d0a4与内标的峰面积比对gag进行定量。将报告的gag量归一化至总蛋白水平,如通过bca测定法(pierce)测得。
[0626]
组织制备:从脑组织中进行脂质提取
[0627]
将冷冻的脑组织(20
±
2mg)转移至干冰2ml的safe-lockeppendorf管(eppendorf目录号022600044)中并放在装有5mm不锈钢珠(qiagen目录号69989)和含有内标的400μl ms级甲醇的干冰中。将组织用tissuelyser在25hz下(在冷室中)均质化30秒。然后将样品在4℃下以21,000
×
g离心20分钟。将甲醇上清液转移至新的eppendorf 小瓶中,并在-20℃下放置1小时以允许蛋白质进一步沉淀。然后将样品在4℃下以21,000
×
g离心10分钟。将200ul的甲醇上清液转移至lcms 96孔板中,并在氮气下干燥,然后重悬于100ul的具有5 mm甲酸铵和0.5%甲酸的acn/ipa/h2o(92.5/5/2.5)中以用于glccer 分析。在不干扰团粒的情况下将其余的上清液转移至单独的lcms 96 孔板中,以分析bmp和神经节苷脂物质。样品直接在lcms上运行,或储存在-80℃下。
[0628]
bmp和神经节苷脂的lcms测定
[0629]
通过将液相色谱法(shimadzu nexera x2系统,shimadzu scientificinstrument,columbia,md,usa)与电喷雾质谱法(sciex qtrap 6500+, sciex,framingham,ma,usa)相耦合来执行bmp和神经节苷脂分析。对于每次分析,在55℃下使用0.25ml/min的流速将5μl样品注入 beh c18 1.7μm 2.1
×
100mm柱(waters corporation,milford, massachusetts,usa)上。流动相a由60:40乙腈/水(v/v)(含10mm醋酸铵)组成,流动相b由90:10异丙醇/乙腈(v/v)(含10mm醋酸铵)组成。梯度编程如下:0.0-0.01分钟,45%b至99%b;0.1-3.0分钟, 99%b;3.0-3.01分钟,至45%b;以及3.01-3.50分钟,45%b。采用以下设定,以负离子模式执行电喷雾电离:帘气为30;碰撞气体设定为中等;离子喷雾电压为-4500;温度为600℃;离子源气体1 为50;离子源气体2为60。使用analyst 1.6.3(sciex)以多反应监测模式(mrm)进行数据采集,参数如下:表a中报告的每种物质的停留时间(毫秒),碰撞能量(ce)为-50,去簇电位(dp)为-80;进入电位(ep) 为-10;以及碰撞池出口(cxp)电位为-15。使用非内源性内标bmpdi14:0和gm3(d36:1(d5))对bmp和神经节苷脂物
质进行定量。使用multiquant 3.02(sciex)执行定量。将bmp和神经节苷脂浓度归一化至总蛋白量、组织重量或体积。使用二辛可宁酸(bca)测定法(pierce, rockford,il,usa)测量蛋白质浓度。
[0630]
表a.bmp和神经节苷脂测定的采集参数信息.
[0631]
[0632][0633]
glccer和galcer的lcms测定
[0634]
通过将液相色谱法(shimadzu nexera x2系统,shimadzu scientific
instrument,columbia,md,usa)与电喷雾质谱法(sciex qtrap 6500+ sciex,framingham,ma,usa)相耦合来执行葡萄糖基神经酰胺和半乳糖基神经酰胺分析。对于每次分析,在45℃下使用0.45ml/min的流速将10μl样品注入halo hilic 2.0μm 3.0
×
150mm柱 (advanced materials technology,pn 91813-701)上。流动相a由含5 mm甲酸铵和0.5%甲酸的92.5/5/2.5acn/ipa/h2o组成。流动相b 由含5mm甲酸铵和0.5%甲酸的92.5/5/2.5h2o/ipa/acn组成。梯度编程如下:0.0-3.1分钟,100%b;3.2分钟,95%b;5.7分钟,85% b;保持至7.1分钟,85%b;在7.25分钟降至0%b并保持至8.75 分钟;10.65分钟升回至100%并保持至11分钟。采用以下设定,以正离子模式执行电喷雾电离:帘气为25;碰撞气体设定为中等;离子喷雾电压为5500;温度为350℃;离子源气体1为55;离子源气体2为60。使用analyst 1.6(sciex)以多反应监测模式(mrm)进行数据采集,参数如下:表b中报告的每种物质的停留时间(毫秒)和碰撞能量(ce);去簇电位(dp)为45;进入电位(ep)为10;以及碰撞池出口电位(cxp)为12.5。使用如表b中报告的同位素标记的内标的混合物对脂质进行定量。葡萄糖基神经酰胺和半乳糖基神经酰胺根据其保留时间和市售参考标准品(avanti polar lipids,birmingham,al,usa) 的mrm特性鉴定。使用multiquant 3.02(sciex)执行定量。将代谢物归一化至总蛋白量、组织重量或体积。
[0635]
表b:glccer和galcer测定的采集参数信息.
[0636]
[0637]
[0638][0639]
类花生酸的质谱分析
[0640]
通过将液相色谱法(shimadzu nexera x2系统,shimadzu scientificinstrument,columbia,md,usa)与电喷雾质谱法(sciex qtrap 6500+, sciex,framingham,ma,usa)相耦合来执行类花生酸分析。对于每次分析,在40℃下使用0.6ml/min的流速将5μl样品注入beh c18 1.7 μm 2.1
×
100mm柱(waters公司,milford,massachusetts,usa)上。流动相如下构成:a=水+0.1%乙酸,和b=90:10乙腈/异丙醇(v/v)。梯度编程如下:0.0-1.0分钟,25%b;1.0-8.5分钟至95%b;8.50-8.51 分钟,95%b;8.51-10.00分钟,25%b。采用以下设定,以负离子模式执行电喷雾电离:帘气为30;碰撞气体设定为中等;离子喷雾电压为-4500;温度为600℃;离子源气体1为50;离子源气体2为60。使用analyst 1.6.3(sciex)以多反应监测模式(mrm)进行数据采集,参数如下:表c中报告的每种物质的停留时间(毫秒)、碰撞能量(ce)和去簇电位(dp);进入电位(ep)为-10;以及碰撞池出口电位(cxp)为-12。使用如表c中报告的非内源性氘化内标的混合物对类花生酸进行定量。根据类花生酸的保留时间和市售参考标准品(avanti polar lipids, birmingham,al,usa)的mrm特性鉴定类花生酸。使用multiquant3.02(sciex)和skyline执行定量。将代谢物归一化至总蛋白量、组织重量或体积。使用二辛可宁酸(bca)测定法(pierce,rockford,il,usa) 测量蛋白质浓度。
[0641]
表c.类花生酸测定的采集参数信息.
[0642]
[0643]
[0644][0645]
脂质组学分析
[0646]
通过将液相色谱法(shimadzunexerax2系统,shimadzuscientificinstrument,columbia,md,usa)与电喷雾质谱法(qtrap6500+,sciex,framingham,ma,usa)相耦合来执行脂质分析。对于每次分析,在55℃下使用0.25ml/min的流速将5μl样品注入behc181.7μm2.1
×
100mm柱(waterscorporation,milford,massachusetts,usa)上。对于正电离模式,流动相a由含10mm甲酸铵+0.1%甲酸的60:40乙腈/水(v/v)组成;流动相b由含10mm甲酸铵+0.1%甲酸的90:10异丙醇/乙腈(v/v)组成。对于负电离模式,流动相a由含10mm醋酸铵的60:40乙腈/水(v/v)组成;流动相b由含10mm醋酸铵的90:10异丙醇/乙腈(v/v)组成。梯度编程如下:0.0-8.0分钟,45%b至99%b;8.0-9.0分钟,99%b;9.0-9.1分钟,至45%b;以及9.1-10.0分钟,45%b。采用以下设定,以正离子或负离子模式执行电喷雾电离:帘气为30;碰撞气体设定为中等;离子喷雾电压为5500(正模式)或4500(负模式);温度为250℃(正模式)或600℃(负模式);离子源气体1为50;离子源气体2为60。使用analyst1.6.3(sciex)以多反应监测模式(mrm)进行数据采集,参数如下:表d(负模式)或表e(正模式)中报告的每种物质的停留时间(毫秒)和碰撞能量(ce);去簇电位(dp)为80(正模式)和-80(负模式);进入电位(ep)为10(正模式)或-10(负模式);以及碰撞池出口电位(cxp)为12.5(正模式)或-12.5(负模式)。使用如表d和e中报告的非内源性内标的混合物对脂质进行定量。根据脂质的保留时间和市售参考标准品(avantipolarlipids,birmingham,al,usa)的mrm特性鉴定脂质。使用multiquant3.02(sciex)执行定量。将代谢物归一化至总蛋白量或细胞数目。
[0647]
表d.负模式下脂质组学测定的采集参数信息.
[0648]
[0649]
[0650]
[0651][0652]
表e.正模式下脂质组学测定的采集参数信息.
[0653]
[0654]
[0655]
[0656]
[0657]
[0658]
[0659]
[0660][0661]
etv:ids脑组织的均质化以及etv:ids脑组织和csf的trem2分析
[0662]
使用qiagentissuelyzerii(目录号/id:85300)将50mg组织在500μl用完全蛋白酶抑制剂(roche#04693132001)和phosstop(roche04906837001)制成的1xcst缓冲液(cellsignalingtechnology9803s)中在30hz下均质化,进行2轮3分钟。将匀浆在冰上孵育20分钟,并在4℃下以21,100g旋转30分钟。随后将裂解物转移至干净的96孔深板中,并进行bca以定量总蛋白量。然后将样品储存在-80℃直至测定使用。
[0663]
为了在脑组织中进行trem2分析并在csf中进行可溶性trem2(strem2)分析,通过在4℃下用1ug/ml生物素化绵羊抗小鼠抗体(r&dsystemsbaf1729)包被过夜,制备msdgold96w小斑点链霉亲和素板(msdl45sa)用于trem2测定。次日,将msd板用含triton的tris缓冲盐水(tbst)冲洗,并使用含3%牛血清白蛋白的tbst封闭两小时,同时以600rpm震荡。再次用tbst冲洗msd板,并将脑裂解物在封闭溶液中稀释5倍,并加入到msd板中,以600rpm孵育1小时。在下一次tbst冲洗之后,将磺基标记的绵羊抗小鼠抗体(r&dsystemsaf1729)加入到板中,并再次以600rpm孵育1小时,并进行最后冲洗,然后加入在水中稀释的2xmsd读取缓冲液。然后使用msdmesosectors600读取板。将trem2信号归一化至蛋白质
浓度,并用graphpadprism作图。
[0664]
缩写
[0665]
bmp=双(单酰基甘油)磷酸酯;etv:ids=酶转运载体:艾杜糖醛酸2-硫酸酯酶;glccer=葡萄糖基神经酰胺;galcer=半乳糖基神经酰胺;ids=艾杜糖醛酸2-硫酸酯酶;ki=敲入;ko=敲除;tfr
mu/hu
=嵌合人/小鼠转铁蛋白受体。
[0666]
结果
[0667]
要确定在脑中观察到的稳健的gag降低是否转化为对下游疾病相关病理的校正,评估etv:ids校正次级溶酶体贮积的能力。向idsko;tfr
mu/hu
ki小鼠静脉内施用四次每周一次的活性等效剂量的etv:ids或艾杜硫酸酯酶,并且使用液相色谱法-串联质谱法(lcms)测量一组溶酶体脂质的水平,包括神经节苷脂、葡萄糖基神经酰胺和双(单酰基甘油)磷酸酯。与野生型对照相比,在idsko;tfr
mu/hu
ki小鼠的脑中观察到溶酶体脂质的大量积累。在四次40mg/kg每周剂量之后,etv:ids在降低脑中的溶酶体脂质方面非常有效,将这些脂质的水平完全降低至野生型小鼠中所见到的水平。然而,用活性等效剂量的艾杜硫酸酯酶治疗不能降低脑中这些溶酶体脂质的水平。这些数据一起证明了etv:ids除了其对gag积聚的近端影响之外,还可以有效地校正次级溶酶体贮积。
[0668]
具体地说,图5a-5b显示了etv:ids的外周施用(4周处理)校正了idsko小鼠中的(图5a)脑和(图5b)csfgag积聚。与活性等效剂量的elaprase下降低14%相比,用外周施用etv:ids,观察到脑gag降低了58%。此外,与活性等效剂量的elaprase下降低27%相比,用外周施用etv:ids,观察到csfgag降低了66%(etv:ids组的一个离群值略去)。图14a-14b示出了脑和csf中单个gag物质(d00s0、d00a0、d00a4)的降低。在一项后续研究中,etv:ids剂量为40mg/kg时,csfgag较wt减少了三倍。
[0669]
图6显示了etv:ids的外周施用(4周处理)校正了idsko脑中的溶酶体脂质(神经节苷脂)积聚。
[0670]
图7a-7b显示了etv:ids的外周施用(4周处理)校正了idsko脑中的溶酶体脂质(glccer)积聚。在外周施用etv:ids下观察到对脑glccer积聚的校正,而未观察到半乳糖基神经酰胺(galcer)的变化。
[0671]
图8显示了etv:ids的外周施用(4周处理)校正了idsko脑中的溶酶体脂质(bmp)积聚。
[0672]
图9显示了示出用媒介物、etv:ids或elaprase(艾杜硫酸酯酶)处理的idsko小鼠的脑中的脂质水平的热图。此热图是使用来自表2的修改后的数据生成的。具体来说,使用截止值对表2中的数据进行了修改,将0.9与1.1之间的值转换为1,以显示大于10%的差异。
[0673]
图10显示了外周施用etv:ids校正了idsko脑中的trem2积聚。
[0674]
图11示出了在idsko;tfr
mu/hu
ki小鼠中观察到csfstrem2水平相对于tfr
mu/hu
ki小鼠队列增加。用etv:ids处理降低idsko;tfr
mu/hu
ki小鼠中csfstrem2水平的积聚。
[0675]
表1总结了所分析的glccer物质,其水平表示为wt的倍数。
[0676]
表2提供了用媒介物、etv:ids或elaprase处理的idsko小鼠的脑中的脂质水平的数据(相对于wt的变化倍数)。
[0677]
实施例2.测量3月龄、6月龄和9月龄的idsko小鼠中的脑gag、溶酶体脂质和神经
丝轻链(nf-l)
[0678]
如下所述,在3月龄、6月龄和9月龄的wt和ids ko小鼠中研究脑gag、溶酶体脂质和神经丝轻链(nf-l)水平。
[0679]
材料和方法
[0680]
如本文所述(实施例1),对用于本研究的动物进行护理。对组织进行采样,并使用本文所述的方法(实施例1)测量脂质和gag水平。如下所述测量nf-l水平。
[0681]
nf-l的csf和血清分析的方法
[0682]
使用quanterix simoa神经丝轻链(nf-l)样品稀释液(quanterix102252),将脑脊髓液(csf)稀释100倍,并将血清稀释4倍,然后加入到simoa 96孔微板(quanterix 101457)中。根据simoa nf-lightadvantage试剂盒(quanterix 1031086)说明书,使用simoa检测剂试剂和珠粒试剂(分别为quanterix 103159和102246)进行nf-light测定。将样品与检测剂和珠粒试剂在30℃、800rpm下孵育30分钟后,根据quanterix两步方案,在simoa微孔板洗涤器上用simoa洗涤缓冲液a(quanterix 103078)洗涤样品板。随后加入sbg试剂(quanterix102250),并将样品在30℃、800rpm下孵育10分钟。继续进行2步洗涤器方案,将样品珠粒两次重悬在simoa洗涤缓冲液b(quanterix103079)中,然后最终吸出缓冲液。在quanterix sr-x仪器上使用 nf-light分析方案测量样品nf-l水平,并根据quanterix测定试剂盒提供的校准曲线进行内推。
[0683]
结果
[0684]
测量ids ko小鼠中相对于年龄匹配的wt对照在3月龄、6月龄和9月龄时脑hs/ds(gag)的积聚(图1)。在所有测试年龄的idsko小鼠中,gag积聚均显著较高。
[0685]
还测量了相对于年龄匹配的wt对照,ids ko小鼠脑中的溶酶体脂质积聚(gm1、gm2、gm3、bmp、glccer和gd3)(图2a-2d)。 gm1(d36:1)在ids ko和wt小鼠中显示相似的水平(图2a和2b),而gm2(36:1)、gm3(36:1)、bmp(36:2)、glccer(34:1)和gd(39:1) 的水平与wt动物相比,均显示出1.7至5.5倍的增加(图2a-2d)。类似于gd3(39:1),ids ko中gd3(36:1)也增加(平均2倍)。
[0686]
还观察到相对于其年龄匹配的对照,ids ko小鼠血清中的bmp 水平升高。具体地说,在ids ko小鼠中采集的9月龄血清样品中,与wt对照相比,bmp(36:2)和bmp(44:12)尤其增加(图3)。
[0687]
观察到相对于wt年龄匹配的对照,9月龄的ids ko小鼠的csf 中溶酶体脂质水平升高(gd1a/b、gm3、bmp和glccer)(图4)。
[0688]
nf-l是一种神经变性的有用标志物(norgren等人2003.brainresearch 987(1):25-31),但以前没有与亨特综合征/mpsii相关联。相对于同龄的野生型小鼠队列,9月龄的ids ko小鼠的血清和csf中的nf-l浓度升高(图31a、31b)。csf中nf-l水平的相对差异随小鼠队列的年龄而增加,其中在9月龄的小鼠队列组中观察到nf-l水平的最大差异(图31c)。这些结果表明,nf-l还可以在亨特综合征小鼠模型中用作疾病相关和治疗响应性生物标志物。
[0689]
实施例3.外周施用etv:ids对ids ko
×
tfr
muhu
小鼠中的gag 和溶酶体脂质的影响
[0690]
检查变化剂量的etv:ids对ids ko
×
tfr
muhu
小鼠中gag和溶酶体脂质的影响。
[0691]
材料和方法
[0692]
动物护理
[0693]
将小鼠圈养在12小时亮/暗循环下并随意取用水和标准啮齿动物饮食(#25502,辐照)。
[0694]
小鼠品系
[0695]
在上面的实施例1中描述了用于本研究的ids ko
×
tfr
mu/hu
小鼠。本研究中使用的所有小鼠均为雄性。
[0696]
施用和样品收集
[0697]
向2-3月龄的ids ko
×
tfr
mu/hu
小鼠静脉内注射盐水、艾杜硫酸酯酶(14.2mg/kg体重)或etv:ids(3、10、20或40mg/kg体重),每周一次,持续4周(n=5-8)(对于etv:ids参见实施例6)。向2-3月龄的同窝仔tfr
mu/hu
小鼠静脉内注射盐水,每周一次,持续4周(n=5),其用作对照。在最后4周剂量后7天处死动物。
[0698]
为了最终样品收集,通过腹膜内(i.p.)注射2.5%的avertin对动物进行深度麻醉。为了csf收集,在动物头骨的后部做矢状切开,分离皮下组织和肌肉以暴露枕大池,并使用预拉的玻璃毛细管刺穿枕大池以收集csf。将csf转移至低蛋白lobind eppendorf管中,并在 4℃下以12,700rpm离心10分钟。将csf转移至新的管中,并在干冰上速冻。通过测量样品在420nm下的吸光度,确认了小鼠csf中没有血液污染。通过心脏穿刺收集血液以用于血清收集。为了血清收集,使血液在室温下凝结至少30分钟。然后将管在4℃下以12,700rpm 离心7分钟。将血清转移至新的管中,并在干冰上速冻。使用蠕动泵 (gilson inc.minipuls evolution)用冰冷的pbs对动物经心灌注。解剖脑,并在干冰上速冻。
[0699]
组织制备和lcms测定
[0700]
使用类似于实施例1中所述的那些的方法进行组织制备和lcms 测定。
[0701]
结果
[0702]
对于接受etv:ids的小鼠,观察到血清脑和csf gag呈剂量依赖性降低(图12a-12c)。值得注意的是,血清gag已校正至野生型水平。
[0703]
重要的是,即使在测试的最低etv:ids剂量(3mg/kg)时,脑溶酶体脂质(gm3、glccer和bmp)也显著降低(图13a-13c)。因为ids 缺乏小鼠中的脂质积聚被认为是gag积聚的功能性结果,所以这些结果可能表明,即使相对于wt小鼠gag水平升高,也可以实现脑中溶酶体功能的功能性恢复。
[0704]
实施例4.外周施用etv:ids对ids ko
×
tfr
muhu
小鼠的特定 cns细胞类型中的gag和溶酶体脂质的影响
[0705]
开发出一项方案,从脑组织中分离出富集的神经元、星形胶质细胞和小胶质细胞群体。然后将从ids ko
×
tfr
muh
u小鼠富集的群体用于研究施用变化剂量的etv:ids对gag和溶酶体的影响。
[0706]
材料和方法
[0707]
动物护理
[0708]
将小鼠圈养在12小时亮/暗循环下并随意取用水和标准啮齿动物饮食(#25502,辐照)。
[0709]
小鼠品系
[0710]
在上面的实施例1中描述了用于本研究的tfr
mu/hu
小鼠和ids ko
ꢀ×
tfr
mu/hu
小鼠。
本研究中使用的所有小鼠均为雄性。
[0711]
施用和样品收集
[0712]
向2-3月龄的ids ko
×
tfr
mu/hu
小鼠静脉内注射盐水或etv:ids (40mg/kg体重),每周一次,持续4周(每次处理n=4-6)(对于etv:ids 参见实施例6)。向2-3月龄的同窝仔tfr
mu/hu
小鼠静脉内注射盐水,每周一次,持续4周(n=4-6),其用作对照。在最后4周剂量后7天处死动物。
[0713]
为了最终样品收集,通过腹膜内(i.p.)注射2.5%的avertin对动物进行深度麻醉。为了csf收集,在动物头骨的后部做矢状切开,分离皮下组织和肌肉以暴露枕大池,并使用预拉的玻璃毛细管刺穿枕大池以收集csf。将csf转移至低蛋白lobind eppendorf管中,并在 4℃下以12,700rpm离心10分钟。将csf转移至新的管中,并在干冰上速冻。通过测量样品在420nm下的吸光度,确认小鼠csf中没有血液污染。通过心脏穿刺收集血液以用于血清收集。为了血清收集,使血液在室温下凝结至少30分钟。然后将管在4℃下以12,700rpm 离心7分钟。将血清转移至新的管中,并在干冰上速冻。使用蠕动泵 (gilson inc.minipuls evolution)用冰冷的pbs对动物经心灌注。解剖脑,并在干冰上速冻。
[0714]
cns细胞类型分离
[0715]
为了制备用于分选cns细胞的单细胞悬浮液,给小鼠灌注pbs,将脑解剖,并根据制造商的方案使用成体脑解离试剂盒(miltenyibiotec 130-107-677)加工成单细胞悬浮液。将细胞进行fc封闭 (biolegend#101320,1:100)并用固定型活性染剂bv510(bdbiosciences#564406,1:100)(以排除死细胞)、cd11b-bv421(bdbiosciences 562605,1:100)、cd31-percp cy5.5(bd biosciences #562861,1:100)、o1-488(thermo/ebio#14-6506-82,1:37.5)、thy1-pe (r&d#fab7335p,1:100)和eaat2-633(alomone#agc-022-fr, 1:50)染色以进行流式细胞术分析。将细胞用pbs/1%bsa洗涤并通过100μm过滤器过滤,然后在带有100μm喷嘴的facs aria iii(bdbiosciences)上对cd11b+小胶质细胞、eaat2+星形胶质细胞和 thy1+神经元进行分选。为了获得纯的星形胶质细胞、小胶质细胞和神经元群体,设置负门以去除分别主要为少突胶质细胞和内皮细胞的 o1+和cd31+细胞。将分选的细胞团粒化或直接收集到裂解缓冲液中,然后进行处理以用于下游分析,包括qrt-pcr、rnaseq或糖组学,如本文公开的相关方法中所述。细胞数目用于计算pg gag/细胞。
[0716]
使用类似于实施例1中所述的那些的方法进行细胞裂解物制备和用于测量gag、bmp、神经节苷脂、glccer和galcer的lcms 测定。
[0717]
etv:ids在整个cns细胞类型中的分布分析
[0718]
将鞘液(约1.5ml)中的活细胞直接分选至150μl 5%chaps裂解缓冲液中,chaps最终浓度为0.5%。将样品用amicon ultra 30kda 过滤器浓缩。五(5)μl样品或重组etv:ids系列稀释液使用igg(人) alphalisa检测试剂盒(perkinelmer#al205c)按照制造商的说明书进行,并在envision
tm
读板仪上读取。从使用etv:ids生成的标准曲线内推样品浓度,并相对于总细胞输入数目归一化。
[0719]
结果
[0720]
为了确认分离的细胞群体的富集和纯度,使用rna-seq和 qrt-pcr分析了每个分选群体的基因表达谱并与已知谱进行比较(数据未显示)。观察到分离的群体中相应细胞类型特异性基因的强富集,以及内皮细胞和少突胶质细胞的基因标志物减少(数据未显示)。
该集合数据表明,获得了神经元、星形胶质细胞和小胶质细胞的高纯度群体。
[0721]
随后评估etv:ids在idsko;tfr
mu/hu
ki小鼠的脑中的细胞类型特异性分布和功效。
[0722]
富集的cns细胞群体中的gag水平如所述通过lc-ms/ms进行定量。图15a示出了相对于tfr
mu/hu
ki对照,从idsko;tfr
mu/hu
ki小鼠分离的小胶质细胞、星形胶质细胞和神经元中gag水平升高,这证明当敲除ids表达时所有三种cns细胞类型的底物积聚(每组n=3-5只小鼠)。向idsko;tfr
mu/hu
ki小鼠(每组n=4只小鼠)静脉内给予40mg/kgetv:ids,并在剂量后两小时,评估整个cns细胞群体中的酶浓度。图15b示出了在神经元、星形胶质细胞和小胶质细胞中观察到etv:ids显著积聚,这证明etv:ids有效地分布至脑实质,并被关键的cns细胞类型吸收。所有数据都显示为平均值
±
sem;未配对学生t检验p≤0.05*,0.001***。
[0723]
接下来,向idsko;tfr
mu/hu
ki小鼠静脉内给予40mg/kgetv:ids,每周一次,持续四周,并且使用lc-ms/ms来评估etv:ids减少所有三种cns细胞类型中的gag积聚的能力。图16示出了重复施用后,etv:ids处理将神经元、星形胶质细胞和小胶质细胞中的gag水平降低至与野生型小鼠中所见到的相当的水平。数据显示为平均值
±
sem;单向anova与图基多重比较检验;*p≤0.05,**p≤0.01。数据证明etv:ids能够将ids通过脑内皮递送到脑细胞,并且这种递送足以在关键的cns细胞类型中发挥功效。
[0724]
etv:ids处理还减少了所关注的cns细胞类型(例如神经元、星形胶质细胞、小胶质细胞)中溶酶体脂质的次级积聚,包括神经节苷脂(图17)、葡萄糖基神经酰胺(图18)和双(单酰基甘油)磷酸酯(bmp)(图19)。这些数据说明用etv:ids处理除了在cns细胞类型中的主要gag贮积之外,还可以校正继发性溶酶体功能障碍。
[0725]
实施例5.积聚的脂质物质的空间分布和etv:ids对脂质积聚的校正
[0726]
检查变化剂量的etv:ids对idsko
×
tfr
muhu
小鼠中溶酶体脂质的空间分布和小胶质细胞活化的影响。
[0727]
小鼠品系和施用
[0728]
在上面的实施例1中描述了用于本研究的tfr
mu/hu
小鼠和idsko
×
tfr
mu/hu
小鼠。本研究中使用的所有小鼠均为雄性。向小鼠施用盐水、艾杜硫酸酯酶或etv:ids(40mg/kg体重)并处死以如实施例1所述进行组织分析(对于etv:ids参见实施例6)。
[0729]
基于质谱法的神经节苷脂水平成像
[0730]
将脑组织在铝箔上快速冷冻,然后将其缓慢降低至液氮中约10秒钟。将冷冻的脑储存在-80℃下直至准备使用。切片前,将脑置于低温恒温室中以使组织平衡至-20℃。在低温恒温器(leicabiosystems,buffalogrove,il)上将脑切成12μm厚的切片,并解冻封固到涂有氧化铟锡(ito)的载玻片(deltatechnologies,loveland,co)上。距离前囟点大约+0.72mm和-1.82mm处收集两个脑水平。将具有指定用于ims的切片的板用冷却的(约4℃)50mm甲酸铵洗涤3次,并使其在室温下干燥,然后施加基质。获得另外的切片用于h&e染色。染色后,通过载玻片扫描仪(leicabiosystems,buffalogrove,il)获得数字显微照片。对于基质施加,通过升华将板用1,5-二氨基萘(dan)maldi基质包被(hankin等人2007.journaloftheamericansocietyformassspectrometry18:1646-1652;thomas等人2012.analyticalchemistry84:2048-2054)。简单地说,将100mg重结晶的dan置于玻璃升华装置(chemglasslifesciences,vineland,nj)的底部。将装置放置在设置
为130℃的金属加热块上,并将dan在小于25毫托的压力下升华到组织表面上,历时4分钟。通过在基质施加前后称量载玻片重量来确定将大约1.8mg dan施加到每个载玻片上。然后将包被的板放在皮氏培养皿(petri dish)中,用氮气冲洗,并在ms分析之前在-80℃下储存两天(yang等人2019
[0731]
international journal of mass spectrometry 437:3-9)。
[0732]
对于质谱成像,在从密封的皮氏培养皿中取出之前,让板平衡至室温。脑切片在配备了smartbeam ii 2khz频率三重nd:yag激光 (355nm)的solarix 15t ft-icr ms(bruker daltonics,billerica,ma)上成像。在负离子模式下以100μm空间分辨率获取图像。使用较小的激光聚焦设置并在100μm像素内随机游走,每个像素是1000次激光发射的平均值。质谱仪使用一系列磷团簇进行外部校准(sl
á
dkov
á
等人2009.rapid communications in mass spectrometry 23:3114-3118)。从m/z 600-3,000收集数据,时域文件大小为1m(fid长度=1.3631 秒),从而获得了m/z 1041下153,000的分辨力。使用fleximaging 3.0 (bruker daltonics,billerica,ma)生成图像。神经节苷脂通过准确的质量鉴定,其中质量准确度通常优于1ppm。
[0733]
免疫组织化学
[0734]
使用leica低温恒温器(leica cm 1950)将新鲜冷冻的小鼠脑组织冠状切成10微米厚。将切片直接封固至fisherbrand superfrost plus 显微镜载玻片上,并储存在-80℃下直至处理用于免疫组织化学。将切片在1x pbs中冲洗3轮,每次5分钟,然后固定在4%多聚甲醛中 15分钟。然后将切片在1x pbs中冲洗3轮,每次5分钟,并在封闭溶液(1x pbs/5%普通山羊血清/0.3%triton x-100)中在室温下孵育1 小时。然后将切片在于封闭溶液中制备的一抗(biorad:大鼠抗cd68, 1:500)中在室温下孵育2小时。将切片在1x pbs/0.3%triton x-100中冲洗3轮,每次5分钟,然后在于封闭溶液中制备的二抗(invitrogen:山羊抗大鼠alexa fluor 488,1:500)和dapi(invitrogen molecularprobes d1306:从5mg/ml储备液起,1:10,000)中在室温下于黑暗中孵育1小时。然后将切片在1x pbs/0.3%triton x-100中冲洗3轮,每次5分钟,在1x pbs中快速冲洗,然后用带有dabco抗褪色剂的聚乙烯醇封固介质盖上盖玻片(sigma 10981)。使用zeiss axio scanz1以20倍的放大拍摄荧光图像。每个荧光团分别使用合适的单通道滤光片组成像,在成像的所有组织样品中每个荧光团的曝光时间相同。然后使用zeiss zen软件对单个图像进行平铺和拼接,并进行阴影校正。
[0735]
结果
[0736]
进行质谱成像(ims)来确定ids ko;tfr
mu/hu ki小鼠的脑中脂质积聚的空间分布,并评估etv:ids施用是否能够校正溶酶体脂质在整个脑中的积聚。maldi ms图像是四次每周剂量的媒介物、艾杜硫酸酯酶或etv:ids后从野生型和ids ko;tfr
mu/hu ki小鼠的冠状脑切片获得的。所选神经节苷脂物质的代表性图像如图20所示。中间图示出了信号分布在m/z 1382.816处,与gm2(d36:1)相对应,而底图示出信号分布在m/z 1179.738处,与gm3(d36:1)相对应。图像描绘了0-100%的每个信号的相对强度。
[0737]
如图20所示,观察到与野生型对照相比,ids ko;tfr
mu/hu ki小鼠的脑中几种神经节苷脂物质富集。这类似于在均质化组织的分析中观察到的结果(图6)。神经节苷脂积聚是区域特异性的,并且集中在下丘脑和杏仁核脑区域中。四次每周剂量的etv:ids减少这些神
经节苷脂物质在整个脑区域的积聚,经评估水平与野生型小鼠中所见到的相同,而在艾杜硫酸酯酶治疗下仅观察到神经节苷脂略有减少。综上所述,这些数据表明etv:ids可以校正cns中gag积聚下游的溶酶体功能障碍。
[0738]
神经炎症代表了许多神经病性lsd的共同特征,并且已经出现了一个共识,即在mps ii疾病的小鼠模型以及mps患者中普遍报告的神经胶质激活可能导致mps病症中整个脑中的进行性变性。分别通过脑组织切片的免疫组织化学分析或脑裂解物的生化分析来评估小胶质细胞活性的两种标志物,即cd68和在髓样细胞上表达的触发受体2(trem2)的水平。图21是来自用媒介物、etv:ids或艾杜硫酸酯酶处理的tfr
mu/hu ki和ids ko;tfr
mu/hu ki小鼠的脑的dapi和cd68的免疫荧光染色的代表性图像。放大倍数是20倍,并且图像代表海马体(顶图)、皮质(中间图)和纹状体(底图)。图10示出了在处理的小鼠中trem2的水平。
[0739]
与tfr
mu/hu ki对照相比,ids ko;tfr
mu/hu ki小鼠的脑中cd68 和trem2的水平均升高(图10、21)。四次40mg/kg每周剂量的 etv:ids有效减少了ids ko;tfr
mu/hu ki小鼠整个脑的cd68信号(图 18)。重复全身性施用etv:ids后,脑中trem2的水平完全降低至野生型小鼠中所见到的水平(图10)。但是,四次每周活性等效剂量的艾杜硫酸酯酶未能降低cd68和trem2的水平。施用etv:ids还减少了经处理的ids ko;tfr
mu/hu ki小鼠的csf中可溶性trem2(strem2) 的积聚(图11)。这些数据表明etv:ids除脑中的gag和次级溶酶体脂质积聚外,还可以减弱小胶质细胞的活性。
[0740]
实施例6.包含ids的融合蛋白的构建.
[0741]
设计和克隆
[0742]
设计ids-fc融合蛋白,所述融合蛋白含有(i)其中将成熟的人ids 酶与包括fc区的人igg1片段融合的融合多肽(“ids-fc融合多肽”),和(ii)经修饰的人igg1片段,其在fc区中含有赋予转铁蛋白受体(tfr) 结合的突变(“经修饰的fc多肽”)。具体地说,创建ids-fc融合多肽,其中将ids片段融合至人igg1 fc区的n端或c端。在一些情况下,将接头置于ids与igg1片段之间以减轻两个片段之间的任何空间位阻。在所有构建体中,来自κ链v-iii的信号肽,氨基酸1-20(uniprotkbid
–
p01661)插入融合体的上游以促进分泌,并且ids被截短,由氨基酸s26-p550(uniprotkb id
–
p22304)组成。所使用的人igg1 fc区的片段对应于uniprotkb id p01857中的序列的氨基酸d104-k330 (位置221-447,eu编号,包括铰链的10个氨基酸(位置221-230))。在一些实施方案中,将源自人igg1残基d104-k330但缺乏ids融合体的第二fc多肽与ids-fc融合多肽共转染,以产生具有一种ids酶的异二聚体融合蛋白(“单酶”)。在一些构建体中,igg1片段含有另外的突变,以促进两个fc区的异二聚化。类似地设计和构建缺少赋予 tfr结合的突变的对照ids-fc融合蛋白,不同之处在于这些蛋白质缺少赋予tfr结合的突变。作为一个额外的对照,生成了带有c端六组氨酸标签(seq id no:181)的ids(氨基酸s26-p550)以方便检测和纯化。
[0743]
实施例中使用的结合tfr的ids-fc融合蛋白是由ids-fc融合多肽和与tfr结合的经修饰的fc多肽形成的二聚体。对于其中ids酶连接于fc区n端的二聚体,ids-fc融合多肽可具有seq id no:91、 171和175中的任一者的序列。在这些序列中,ids序列带有下划线,并在位置59处含有修饰为甲酰基甘氨酸的半胱氨酸(双下划线)。ids 通过ggggs接头(seq id no:179)连结于fc多肽。igg1铰链区的一部分(dkthtcppcp;seq id no:89)包括在fc多肽的n端。ch2 结构域序列始于seq id no:91、171和175的位置541处。
[0744]
ids-fc融合蛋白etv:ids35.21是由具有seqidno:91、171和175中的任一者的序列的ids-fc融合多肽与具有seqidno:92的序列的与tfr结合的经修饰的fc多肽形成的二聚体。ids-fc融合蛋白etv:ids35.21还可以在细胞培养产生过程中进行进一步加工,以使得ids-fc融合多肽具有seqidno:213、215和217中的任一者的序列和/或与tfr结合的经修饰的fc多肽具有seqidno:189的序列。因此,如本文所用,术语etv:ids35.21可用于指具有未加工的序列(即,seqidno:91、171、175和92)的蛋白质分子;包含一个或多个加工序列(即,选自seqidno:213,215、217和189)的蛋白质分子;或包含加工和未加工的蛋白质分子的混合物。前10个氨基酸是igg1铰链区的一部分。ch2结构域序列分别始于seqidno:92和189的位置11处。
[0745]
ids-fc融合蛋白etv:ids35.21.17.2是由具有seqidno:91、171和175中的任一者的序列的ids-fc融合多肽与具有seqidno:168的序列的与tfr结合的经修饰的fc多肽形成的二聚体。ids-fc融合蛋白etv:ids35.21.17.2还可以在细胞培养产生过程中进行进一步加工,以使得ids-fc融合多肽具有seqidno:213、215和217中的任一者的序列和/或与tfr结合的经修饰的fc多肽具有seqidno:207的序列。因此,如本文所用,术语etv:ids35.21.17.2可用于指具有未加工的序列(即,seqidno:91、171、175和168)的蛋白质分子;包含一个或多个加工序列(即,选自seqidno:213、215、217和207)的蛋白质分子;或包含加工和未加工的蛋白质分子的混合物。前10个氨基酸是igg1铰链区的一部分。ch2结构域序列分别始于seqidno:168和207的位置11处。
[0746]
ids-fc融合蛋白etv:ids35.23.2是由具有seqidno:91、171和175中的任一者的序列的ids-fc融合多肽与具有seqidno:169的序列的与tfr结合的经修饰的fc多肽形成的二聚体。ids-fc融合蛋白etv:ids35.23.2还可以在细胞培养产生过程中进行进一步加工,以使得ids-fc融合多肽具有seqidno:213、215和217中的任一者的序列和/或与tfr结合的经修饰的fc多肽具有seqidno:199的序列。因此,如本文所用,术语etv:ids35.23.2可用于指具有未加工的序列(即,seqidno:91、171、175和169)的蛋白质分子;包含一个或多个加工序列(即,选自seqidno:213、215、217和199)的蛋白质分子;或包含加工和未加工的蛋白质分子的混合物。前10个氨基酸是igg1铰链区的一部分。ch2结构域序列分别始于seqidno:169和199的位置11处。
[0747]
ids-fc融合蛋白etv:ids35.21.17是由具有seqidno:91、171和175中的任一者的序列的ids-fc融合多肽与具有seqidno:95的序列的与tfr结合的经修饰的fc多肽形成的二聚体。ids-fc融合蛋白etv:ids35.21.17还可以在细胞培养产生过程中进行进一步加工,以使得ids-fc融合多肽具有seqidno:213、215和217中的任一者的序列和/或与tfr结合的经修饰的fc多肽具有seqidno:191的序列。因此,如本文所用,术语etv:ids35.21.17可用于指具有未加工的序列(即,seqidno:91、171、175和95)的蛋白质分子;包含一个或多个加工序列(即,选自seqidno:213、215、217和191)的蛋白质分子;或包含加工和未加工的蛋白质分子的混合物。经修饰的fc多肽的n端可包括igg1铰链区的一部分(例如seqidno:89)。
[0748]
重组蛋白的表达和纯化
[0749]
为了表达与fc区融合的重组ids酶,根据制造商的说明书(thermofisherscientific),使用expifectamine
tm
cho转染试剂盒,用相关的dna构建体转染expicho细胞
(thermo fisher scientific)。细胞在expicho
tm
表达培养基中在37℃、6%co2和120rpm下在定轨震荡器(infors ht multitron)中生长。简单地说,在每毫升培养物体积0.8μg dna质粒下,以6
×
106个细胞/毫升密度转染对数生长的 expicho
tm
细胞。转染后,使细胞恢复至37℃,并在转染后18-22 小时如所指示向转染的培养物补充进料。转染后120小时通过从20 分钟以3,500rpm离心来收获转染的细胞培养物上清液。将澄清的上清液过滤(0.22μm膜),并储存在4℃下。如上所述进行表位标记的 ids酶的表达(用作对照),并进行了较小的修改。简单地说,具有c 端六组氨酸标签(seq id no:181)的ids酶在expicho细胞中表达。
[0750]
使用蛋白a亲和色谱法从细胞培养物上清液中纯化具有(或不具有)赋予tfr结合的工程化fc区的ids-fc融合蛋白。将上清液加载到hitrap mabselect sure蛋白a亲和柱(ge healthcare life sciences,使用akta pure系统)上。然后将柱用》20柱体积(cv)的pbs洗涤。使用100mm柠檬酸盐/naoh缓冲液ph 3.0(含有150mm nacl)洗脱结合的蛋白质。洗脱后,立即使用1m精氨酸-670mm琥珀酸盐缓冲液ph 5.0(以1:5稀释)中和级分。通过还原和非还原sds-page评估洗脱的级分中ids-fc融合蛋白的均质性。
[0751]
为了纯化带有六组氨酸标签(seq id no:181)的ids酶,将转染的上清液对着15l的含100mm nacl的20mm hepes ph 7.4彻底透析过夜。将透析过的上清液结合于histrap柱(ge healthcare lifesciences,使用akta pure系统)上。结合后,将柱用20cv pbs洗涤。使用含有500mm咪唑的pbs洗脱结合的蛋白质。通过还原和非还原sds-page评估洗脱的级分中ids酶的均质性。在50mm tris ph 7.5中1:10稀释含有ids酶的汇集级分,并使用q sepharose highperformance(ge healthcare)进一步纯化。结合后,将柱用10cv的 50mm tris ph 7.5洗涤。使用线性梯度至50mm tris ph 7.5和0.5mnacl洗脱结合的蛋白质,并收集在1cv级分中。通过非还原 sds-page评估级分纯度。纯化产生均质的ids-fc融合蛋白和带有六组氨酸标签(seq id no:181)的ids酶。
[0752]
实施例7.在4周处理后外周施用etv:ids对底物积聚、溶酶体脂质贮积和神经炎症的影响。
[0753]
本研究的目标是评估与1mg/kg剂量的艾杜硫酸酯酶相比,在 ids ko;tfrmu/hu ki小鼠中在4周etv:ids处理之后脑和csf中 hs/ds积聚和疾病的下游标志物的剂量依赖性降低。
[0754]
材料和方法
[0755]
动物护理
[0756]
将小鼠圈养在12小时亮/暗循环下并随意取用水和标准啮齿动物饮食(#25502,辐照)。
[0757]
小鼠品系
[0758]
在上面的实施例1中描述了用于本研究的ids ko
×
tfr
mu/hu
小鼠。本研究中使用的所有小鼠均为雄性。
[0759]
施用和样品收集
[0760]
通过尾静脉向8周龄的ids ko;tfr
mu/hu ki小鼠施用1mg/kg的艾杜硫酸酯酶或0(媒介物)、1mg/kg、3mg/kg或10mg/kg iv的 etv:ids(对于etv:ids参见实施例6)。8周龄的注射媒介物的 tfrmu/hu ki小鼠用作对照(n=5)。在第一剂后2小时(第1天;n=4) 或在最后一剂后7天(第28天;n=5)对所有动物实施人道安乐死。
[0761]
通过下颌下出血收集鲜血样品。为了血清收集,使血液在室温下凝结至少30分钟。然后将管在4℃下以12,700rpm离心7分钟。将血清转移至新的管中,并在干冰上速冻。对于在尸检时收集的血清样品,通过ip注射2.5%的avertin对动物进行深度麻醉。通过心脏穿刺收集血液并如上所述进行加工以收集血清。将样品储存在冷冻机中,设定成保持在-60℃至-80℃。
[0762]
为了终末样品收集,通过腹膜内注射2.5%的avertin对动物进行深度麻醉。为了csf收集,在动物头骨的后部做矢状切开,分离皮下组织和肌肉以暴露枕大池,并使用预拉的玻璃毛细管刺穿枕大池以收集csf。将csf转移至低蛋白lobind eppendorf管中,并在4℃下以12,700rpm离心10分钟。将csf转移至新的管中,并在干冰上速冻。通过心脏穿刺
[0763]
收集血液以收集血清。使用蠕动泵(gilson inc.minipuls evolution) 用冰冷的pbs对动物经心灌注。
[0764]
将大约50mg脑和肝组织放入个别标记的管中(每只动物一个管),在干冰上速冻,并放在干冰上直至转移至设定成保持在-60℃至
ꢀ‑
80℃的冷冻机。将剩下的脑组织放入个别标记的管(每只动物一个管) 中,在干冰上速冻并放在干冰上直至转移至设定成保持在-60℃至
ꢀ‑
80℃的冷冻机,用于gag、脂质组学和trem2分析。
[0765]
组织制备和lcms测定
[0766]
使用类似于实施例1中所述的那些的方法进行组织制备和lcms 测定。
[0767]
组织制备和通过mesoscale discovery(msd)进行trem2分析
[0768]
使用类似于实施例1中的那些的方法,进行组织制备和trem2 分析(通过msd)。
[0769]
结果
[0770]
药效学
[0771]
脑、csf和肝gag
[0772]
gag是指硫酸乙酰肝素(d0a0、d0s0)和硫酸皮肤素(d0a4)衍生的二糖的总和。在最后一剂etv:ids或艾杜硫酸酯酶后7天测量来自ids ko;tfr
mu/hu ki小鼠的脑中的gag水平并与媒介物处理和 tfr
mu/hu ki小鼠进行比较。脑gag值随着etv:ids剂量的增加而降低,并且导致相对于媒介物处理的ids ko;tfr
mu/hu ki小鼠,1、3和 10mg/kg的治疗效率分别为56%、71%和87%,而艾杜硫酸酯酶导致在1mg/kg的剂量下的治疗效率为12%(图22)。对csf观察到相同的观察结果。csf gag值随着etv:ids剂量的增加而降低,并且导致相对于媒介物处理的ids ko;tfr
mu/hu ki小鼠,1、3和10mg/kg 的治疗效率分别为45%、67%和85%,而艾杜硫酸酯酶导致在1mg/kg 的剂量下的治疗效率为10%(图23)。脑和csf gag表现出跨越剂量的高度相关性(斯皮尔曼(spearman)r=0.8976),这证实了测量csfgag变化作为脑gag变化的替代的实用性。在etv:ids的所有剂量水平下肝gag水平均接近完全校正(相对于媒介物处理的idsko;tfrmu/hu ki小鼠,1、3和10mg/kg的治疗效率分别为97%、99%和99%)并且与1mg/kg的剂量下的艾杜硫酸酯酶(治疗效率为99%) 相当(图24)。
[0773]
脑和csf溶酶体脂质
[0774]
如通过测量积聚的溶酶体脂质的水平所评估的溶酶体功能障碍也显示在etv:ids处理之后稳健的剂量依赖性降低,一些溶酶体脂质(即,神经节苷脂)达到与tfr
mu/hu ki小鼠相当的水平。举例来说,在最后一剂etv:ids后7天在脑中观察到的gm3降低在1、3和10 mg/kg下分别引起相对于tfr
mu/hu ki 1.1倍、1.2倍和0.9倍的倍数,和在1、3和10mg/kg下分别为
90%、84%和100%的治疗效率百分比。在所有剂量水平下脑bmp水平引起76%的治疗效率。相比之下, 1mg/kg剂量的艾杜硫酸酯酶没有使溶酶体脂质积聚发生任何变化,导致治疗效率为0%(图25a-25c)。还有一个剂量依赖性趋势,显示在etv:ids处理之后csf的葡萄糖基神经酰胺、神经节苷脂和bmp 溶酶体水平降低。图25b(底图)说明csf的代表性神经节苷脂物质 (d36:1)水平的降低。
[0775]
脑trem2
[0776]
观察到脑trem2水平的剂量依赖性降低(图26),trem2是一种活化小胶质细胞和神经炎症的生物标志物。脑trem2的水平随着 etv:ids剂量的增加而降低,并在1、3和10mg/kg下相对于媒介物处理的ids ko;tfr
mu/hu ki小鼠分别引起39%、55%和74%的治疗效率,而艾杜硫酸酯酶引起仅8%的治疗效率。还观察到脑trem2与 gag水平之间有很强的相关性(斯皮尔曼r=0.8736)。
[0777]
血清、脑和肝浓度
[0778]
在第1天剂量后2小时(和第22天血清中)etv:ids血清、脑和肝浓度随着剂量增加而增加(数据未显示)。在单剂量的1、3或10 mg/kg后脑的etv:ids平均浓度比1mg/kg剂量之后脑的艾杜硫酸酯酶平均浓度大32.5-124倍(数据未显示)。
[0779]
总结
[0780]
这些数据表明,每周一次静脉内施用etv:ids共4剂引起cns 和外周的gag以及疾病的下游标志物如溶酶体脂质和神经炎症的标志物发生稳健和剂量依赖性降低。相比之下,四次每周剂量的艾杜硫酸酯酶未使脑的gag水平、溶酶体脂质或trem2发生显著变化。观察到在没有导致完全校正脑gag的剂量下疾病的一些下游标志物 (即,神经节苷脂)恢复到与ids wt类似的水平。另外,脑和csf gag 跨越剂量表现出高度相关,这证实了测量作为脑gag的变化的替代的csf gag的变化的实用性。
[0781]
实施例8.外周施用etv:ids对8周龄ids ko
×
tfr
muhu
小鼠中的gag和神经丝轻链(nf-l)的影响
[0782]
检查13次每周静脉内剂量的etv:ids(1和3mg/kg)对ids ko
×ꢀ
tfr
muhu
小鼠中的gag、溶酶体脂质和神经丝轻链(nf-l)的影响。
[0783]
材料和方法
[0784]
动物护理
[0785]
将小鼠圈养在12小时亮/暗循环下并随意取用水和标准啮齿动物饮食(#25502,辐照)。
[0786]
小鼠品系
[0787]
在上面的实施例1中描述了用于本研究的
ids ko
×
tfr
mu/hu
小鼠和tfrmu/hu ki小鼠。本研究中使用的所有小鼠均为雄性。
[0788]
施用和样品收集
[0789]
通过尾静脉向8周龄的ids ko;tfr
mu/hu ki小鼠静脉内(iv)施用0 (媒介物)、1mg/kg或3mg/kg etv:ids(对于etv:ids参见实施例6)。八(8)周龄的注射媒介物的tfr
mu/hu ki小鼠(ids wt)用作非疾病对照。每周一次施用etv:ids或媒介物,为期13周。在最后一剂后7天对所有动物实施安乐死。观察到具有剂量反应的动物正好在后续给药时刻施用etv:ids之前(腹膜内)ip接受10-20mg/kg苯海拉明 (dihyenhydramine)。
[0790]
每天观察每只动物两次(上午和下午),除了周末,在周末,上午观察动物一次。在第一剂之前,测体重并记录,之后在给药之前每周一次。
[0791]
鲜血和终末血清样品分别以与实施例7和1类似的方式收集。另外,在预定的尸检之前,还通过心脏穿刺收集大约250微升的血液用于血液学。将血液收集在edta管(sarstedtmicrovette500k3e)中并慢慢倒转10次。
[0792]
如实施例1中所述收集终末csf样品。还如实施例1中所述收集脑和肝组织样品。此外,在终止前收集尿液并立即冷却。然后将尿液样品储存在设定成保持在-60℃至-80℃的冷冻机中,以进行尿液生物标志物分析。
[0793]
gag的定量
[0794]
如实施例1所述制备脑和肝组织以定量gag(例如硫酸乙酰肝素(hs)和硫酸皮肤素(ds))。在lcms测定以定量gag之前,将蛋白质裂解物(来自组织)或csf、尿液或血清与肝素酶i、ii、iii和软骨素酶b的组合混合。将消化物与乙腈混合,并通过lcms分析。如实施例1中所述进行lcms测定以定量gag。
[0795]
nf-l的csf和血清分析的方法
[0796]
如实施例2中所述测量血清和csf中的nf-l水平。
[0797]
组织病理学
[0798]
代表性样品被包埋在石蜡中并进行苏木精和伊红(h&e)染色。用光学显微镜术评价组织。
[0799]
结果
[0800]
药效学
[0801]
脑、csf、肝和尿液gag
[0802]
gag是指硫酸乙酰肝素(d0a0、d0s0)和硫酸皮肤素(d0a4)衍生的二糖的总和。在最后一剂etv:ids后7天测量来自idsko;tfr
mu/hu
ki小鼠的脑中的gag水平并与媒介物处理和tfr
mu/hu
小鼠进行比较。脑gag值随着etv:ids剂量的增加而降低,并且导致相对于媒介物处理的idsko;tfr
mu/hu
ki小鼠,1mg/kg和3mg/kg的治疗效率分别为64%和75%(图27a)。对csf观察到相同的观察结果。csfgag值随着etv:ids剂量的增加而降低,并且导致相对于媒介物处理的idsko;tfr
mu/hu
ki小鼠,1mg/kg和3mg/kg的治疗效率分别为60%和70%(图27b)。脑和csfgag表现出跨越剂量的高度相关性,这证实了测量csfgag的变化作为脑中的变化的替代的实用性(数据未显示)。在etv:ids的所有剂量水平下肝gag水平均接近完全校正(相对于媒介物处理的idsko;tfr
mu/hu
ki小鼠,1mg/kg和3mg/kg的治疗效率分别为98%和96%)(图28a)。13次每周etv:ids处理后,尿液中的gag水平也降低了。在1mg/kg和3mg/kg下肌酐归一化的gag水平的治疗效率分别为78%和85%(图28b)。
[0803]
csf神经丝轻链
[0804]
日益多的证明表明,csf和血浆神经丝轻链(nf-l)水平可以用作临床前模型以及神经退行性疾病中神经元健康和损伤的标志物(bacioglu等人,neuron91,56-66(2016))。在亨特综合征的小鼠模型中,观察到csf和血清中的nf-l水平升高(图31a-31c;以及图32)。评价长期用etv:ids处理逆转这些变化的能力并且在用etv:ids处理的idsko;tfr
mu/hu
ki中观察到csfnf-l完全正常化。在1和3mg/kg下nf-l校正的治疗效率分别为82%和117%,使nf-l水平下降到在idswt对照中观察到的水平(图32)。
[0805]
脑和csf溶酶体脂质
[0806]
ids ko;tfr
mu/hu ki中的溶酶体功能障碍通过测量脑和csf中积聚的溶酶体脂质的水平来评估。13次每周剂量的etv:ids后,观察到溶酶体功能障碍稳健的校正,一些溶酶体脂质如神经节苷脂和 bmp达到与tfr
mu/hu ki小鼠相当的水平。举例来说,在1和3mg/kg 下在最后一剂etv:ids后7天在脑中观察到的bmp降低没有引起水平与tfr
mu/hu ki小鼠不同。在3mg/kg下神经节苷脂和bmp的治疗效率百分比》88%,并且在1和3mg/kg下葡萄糖基神经酰胺的治疗效率百分比分别为67%和84%(图29)。etv:ids处理引起csf中的溶酶体脂质水平显著降低,和bmp一样,治疗效率高达91%(图30)。脑和csf溶酶体脂质表现出跨越剂量的高度相关性,这证实了测量 csf通路生物标志物的变化作为脑中的变化的替代的实用性(数据未显示)。
[0807]
体重
[0808]
在开始给药时ids ko;tfr
mu/hu ki的体重比tfr
mu/hu ki小鼠更大,并且在研究的整个过程中ids ko;tfr
mu/hu ki媒介物处理的小鼠体重增加超过tfr
mu/hu ki媒介物处理的小鼠。用etv:ids处理的小鼠最初体重减轻,随后,体重增加较少,并且体重显著低于(第4周开始) 媒介物处理的疾病模型。与tfr
mu/hu ki组相比,在用1和3mg/kgetv:ids处理的ko小鼠之间没有观察到体重增加的显著差异。
[0809]
血液学
[0810]
用1mg/kg或3mg/kg etv:ids处理的小鼠中的红细胞参数 (hct、rbc、hgb)高于疾病模型和近似的tfr
mu/hu ki未患病的对照小鼠。观察到嗜中性粒细胞正常化的类似趋势。与疾病和未患病的媒介物对照两者相比,plt数略微升高。
[0811]
组织病理学
[0812]
在检查的组织中没有观察到etv:ids相关的组织病理学效应。观察到对神经元空泡(假定填充gag的溶酶体)的药理作用。脑的前庭和/或小脑核内的神经元空泡化一致地只存在于媒介物对照idsko;tfr
mu/hu ki动物中。在tfr
mu/hu ki动物中或在施用1或3mg/kgetv:ids的ids ko;tfr
mu/hu ki动物中没有明显的相似神经元空泡化。
[0813]
总结
[0814]
这些数据证明,小鼠中通过iv施用13个每周剂量外周给予的 etv:ids能够减轻cns疾病负担,如通过在cns和外周中主要贮积产物(gag)以及疾病的下游生物标志物的减少所证明。溶酶体功能(葡萄糖基神经酰胺、神经节苷脂和bmp)和神经元损伤(nf-l)的标志物恢复到对照水平。这些数据还显示csf与脑的gag水平之间,以及在etv:ids处理之后csf与脑的溶酶体脂质水平之间的高度相关性,因此表明了csf的生物标志物变化反映了脑中的变化。
[0815]
另外,ids ko;tfr
mu/hu ki小鼠的安全性评价证明etv:ids处理改善与疾病相关的参数。举例来说,在1和3mg/kg下每周iv剂量的etv:ids校正在ids ko;tfr
mu/hu ki小鼠中通常观察到的增加的体重和体重增加,并且使血液学参数恢复到无疾病对照水平。
[0816]
实施例9.在4.5月龄ids ko
×
tfr
muhu
小鼠中etv:ids拯救神经行为和骨骼表型
[0817]
将etv:ids施用于表达嵌合人/小鼠转铁蛋白受体的mps ii小鼠模型(“ids ko;tfr
mu/hu ki小鼠”)。如本文所述,etv:ids的施用能够减少gag积聚在脑、csf和外周组织中。在本实例中,评价idsko;tfr
mu/hu ki小鼠中etv:ids校正运动技能、感觉运动门控及学习和
记忆的能力。
[0818]
材料和方法
[0819]
动物护理和小鼠品系
[0820]
将小鼠圈养在12小时亮/暗循环下并随意取用水和标准啮齿动物饮食(#25502,辐照)。在上面的实施例1中描述了用于本研究的ids ko
×
tfr
mu/hu
小鼠和tfr
mu/hu ki小鼠。本研究中使用的所有小鼠均为雄性,并且在开始给药时大约4.5月龄且尸检时9月龄。
[0821]
施用和样品收集
[0822]
通过腹膜内注射向ids ko;tfr
mu/hu ki小鼠(每组n=21)施用17 个每周剂量的3mg/kg代表性etv:ids蛋白(etv:ids 35.23.2;参见实施例6)。媒介物处理的tfr
mu/hu
(每组n=20)和ids ko;tfr
mu/hu
小鼠 (每组n=19)分别用作无疾病和疾病比较组。在最后一剂后7天对所有动物实施安乐死。
[0823]
每天观察每只动物一次。在第一剂之前,测体重并记录,之后在给药之前每周一次。
[0824]
鲜血和终末血清样品分别以与实施例1和7中所述的方式类似的方式收集。另外,在预定的尸检之前,还通过心脏穿刺收集大约250 微升的血液用于血液学。将血液收集在edta管(sarstedt microvette 500k3e)中并慢慢倒转10次。
[0825]
如实施例1中所述收集终末csf样品。还如实施例1中所述收集脑和肝组织样品。此外,在终止前收集尿液并立即冷却。然后将尿液样品储存在设定成保持在-60℃至-80℃的冷冻机中,以进行尿液生物标志物分析。
[0826]
gag的定量
[0827]
如实施例1和如下修改中所述,对组织和流体进行加工以用于 gag分析。肝和脑使用十(10)μg总蛋白裂解物,用于后续hs/ds消化。在pcr板中进行消化,总体积为62μl(所有组织裂解物和生物流体)。将裂解物或体液(3μl小鼠csf)与肝素酶i、ii、iii和软骨素酶b混合在具有hs与ds的内标混合物的消化缓冲液中(每种样品总共20ng)。将消化液与乙腈混合并通过质谱法来分析。各个二糖物质基于它们的保留时间和mrm转变使用市售参考标准物(iduron ltd) 来鉴定。使用analyst 1.7.1或multiquant 3.0.2(sciex)通过d0a0、d0s0 和d0a4与内标的峰面积比来定量gag。报告的gag量归一化至通过bca测定法(pierce)测量的总蛋白质水平,并针对校准曲线进行内插。对于hs/ds校准曲线和qc,使d0a4(ds/cs)、d0a0(hs)和 d0s0(hs)的纯标准物溶于乙腈:水50/50(v/v)中,以产生1mg/ml原液。在5、10、20、100、1000、5000、9000至10000ng/ml下产生呈矩阵的八点稀释曲线。以15、300和7500ng/ml制备三种水平的 qc样品。校准曲线标准物和qc与生物样品一起直接进行酶促消化,但没有添加酶,并且随后通过lc-ms/ms进行的步骤和操作如实施例1中所述。另外,一批汇集的csf用作矩阵qc,并与研究样品同时消化以监测消化一致性。
[0828]
nf-l的csf和血清分析的方法
[0829]
如实施例2中所述测量血清和csf中的nf-l水平。
[0830]
行为测定
[0831]
从给药第11周至第15周,进行所有的行为测定。所有的测试和分析均由对基因型和处理不知情的实验员进行。
[0832]
运动协调和平衡.使用旋转棒测试来评估运动协调和平衡。在测试第一天,训练阶段由3项单独的试验组成,试验间的间隔在15-20分钟之间。在试验期间,将小鼠放在旋转棒设备上,该旋转棒设备设定成16转/分(rpm)的恒定速度。在测试第二天和第三天,将小鼠放在旋转棒设备上,棒以加速度旋转,从4rpm至40rpm,每30秒增加3.6rpm。小鼠各给予2期3项试验,一期在上午并且一期在下午,每天总进行6次试验。当小鼠从棒上掉下来时或当5分钟过去时试验结束。
[0833]
运动协调和敏捷性.使用爬杆测试测定法来评估敏捷性和协调。将小鼠面朝下轻轻地放在垂直亚克力杆的顶上,该亚克力杆长50cm,有一粗糙面。杆的底部固定到居住笼上并用草垫填塞。进行三项试验,每项试验最多20秒,并记录小鼠爬下的等待时间以及滑动和掉落。如果在固定放置之后小鼠从杆上掉落,那么评估出动物的等待时间是20秒。如果小鼠滑动少于杆长度的20%,那么它们的等待时间调节为1.25
×
总等待时间。如果小鼠滑动杆的20-50%,那么分配它们15秒的等待时间。将3项试验每只小鼠顺着杆下降的等待时间求平均值。
[0834]
步态分析.使用mousespecificsdigigaittreadmill(framingham,ma)评估步态分析。将小鼠放在digigait外罩内,并且踏车以15厘米/秒的起始速度开始。步态分析需要5-10秒连续运行的视频采集。每只动物可以需要多次尝试方能连续跑动,每个测试速度(15、20和30厘米/秒)下最多5分钟的采集时间。如果小鼠不能跟上踏车,那么通过用背板将小鼠轻轻地向前推,将它们轻轻引到步行隔室的前端。除了分析动物的步态之外,还记录每个处理组中能成功地完成每个速度的动物的数目。
[0835]
惊吓抑制.使用前脉冲抑制(kinderscientific,poway,ca)来评估弱听觉信号(在大的声音不久之前)是否能减弱动物的惊吓响应。在小的隔离抑制室中进行测试,该室位于隔音箱中,没有表面移动和噪声。测试当天,将小鼠放在隔音室,并在刺激呈现开始前给其5分钟来适应抑制室和64db背景噪声。然后将小鼠暴露于持续20分钟的一系列声音惊吓刺激,其中一些刺激放在较弱的声刺激之前,或前脉冲(pp),间隔随机。还包括没有听觉刺激的试验,以提供基线活性的量度。测试由总共80个试验构成,这些试验随机选自以下列表:24个120db40ms试验,和各14个试验的4dbpp120db40ms、15dbpp120db40ms、26dbpp120db40ms和没有刺激的试验。刺激间间隔(isi)是平均值为15秒并且范围在8-22秒的变量。使用下式计算前脉冲抑制百分比:100
×
((120db40ms试验的平均值—前脉冲试验类型的平均值)/(120db40ms的平均值))。
[0836]
对声刺激的响应.使用声音惊吓阈值测试来测量动物对突然的大声刺激的反射响应。在小的隔离室中进行测试,该室位于隔音箱中,没有表面移动和噪声。测试当天,将小鼠放入抑制室,并在声刺激测试开始前给其5分钟来适应抑制室和64db背景噪声。然后将小鼠暴露于强度变化的一系列声音脉冲,持续大约15分钟,间隔随机。还包括没有听觉刺激的试验,以提供基线惊吓活性的量度。测试由总共70个试验构成,这些试验随机选自以下列表:各10个试验的120db40ms、110db40ms、100db40ms、90db40ms、80db40ms、70db40ms和没有刺激的试验。isi是平均值为15秒并且范围在8-22秒的变量。
[0837]
视觉空间学习和记忆.使用主动位置回避任务来测量视觉空间学习和记忆。使用biosignal公司的位置回避系统和tracker软件(placeavoidancesystemandtrackersoftware,acton,ma)进行测试。将独特的黑白视觉线索放在设备周围的房间的墙壁上。在
试验期间网格场地以1rpm旋转,因此动物必须相对于场地的旋转主动导航,以避免进入厌恶区。第1天(适应),固定到场地的空间线索的外部构型上的固定60
°
楔形物指定为厌恶区。在10分钟适应试验期间,进入这一厌恶区不会传递震动,并在开始回避训练前使用场地内的移动来建立活性基线。第2-4天,每天给予动物单个10分钟试验,激活电源(震动)。一旦小鼠进入厌恶区,则每1.5秒传递0.2ma电源的轻度震动,持续500毫秒,直到小鼠离开该区。第5天,将10分钟试验分成两个 5分钟阶段。第一阶段是探针测试,其中关掉电源以检查动物在不存在无条件刺激下对厌恶区的纯空间记忆。5分钟过去后,只有当动物明显地已经离开厌恶区时才打开电源。该时期的剩余5分钟继续该恢复阶段,并且如果传递引发震动,那么可提供对工作记忆的量度。
[0838]
脊椎上的伤害性感受.使用热板测试来测量脊椎上的伤害性感受并在黑色阳极化铝板上进行测量。将热板表面加热到52℃的恒温。在测试期间,将小鼠放在透明的圆柱形外罩中,该圆柱形外罩置于热板的顶上。测量作出舔后爪、后爪弹开或跳跃的响应的等待时间,以先发生的为准。每只动物测试一次,并在观察到清晰的响应之后移出。为防止损伤,最大等待时间是30秒。
[0839]
视敏度.使用视觉悬崖测试来测量动物的视敏度。设备由两个区域组成,一个浅的侧面和一个深的侧面。悬崖浅的侧面在底板和墙壁上被正方形的黑色方格层叠图案覆盖,而悬崖深的侧面是悬浮在底板上方101cm处的透明区以建立悬崖的错觉。对于步测阶段(step-offphase),将小鼠放在比设备底板高2.5cm的平台上,直接跨在悬崖浅和深的侧面上。该测试由4个试验组成,最大等待时间为300秒。记录步测平台的等待时间和步测方向。
[0840]
面部评分
[0841]
在尸检时定性评估每只动物的面部特征,并基于其鼻子缩短的严重性给予动物评分。所有的分析均由对表型和处理不知情的实验员进行。
[0842]
组织学
[0843]
每组三只小鼠的含有鼓泡的颅底用于光学显微镜术评价。简单地说,在去除脑之后,将颅骨浸没式固定在4%多聚甲醛(pfa)中并且后固定在70%乙醇中。将颅骨在immunocal脱钙液中两天,在水中冲洗,然后加工并包埋在石蜡中。以100微米的间隔,穿过鼓泡切割五(5) 微米厚的切片,用苏木精和伊红(h&e)染色,并盖上盖玻片,用于光学显微镜术评价。
[0844]
离体骨骼微型-ct成像和分析
[0845]
在尸检时,将骨盆和后肢浸没式固定在含4%多聚甲醛的1 x pbs 中,然后转移到70%乙醇中,用于微型-ct成像。对于微型-ct成像,使用bruker skyscan-1176微型-ct扫描器(x射线源:90kv/25w, x射线检测器:4000
×
2672像素)。在扫描期间包括校准体模并用于校准扫描后的测量。股骨和胫骨中的选择用于小梁和皮质骨分析的感兴趣区基于american society of bone and mineral research(asbmr)公布的指南(bouxsein,2010)。使用以下扫描参数:x射线源60kv/25w,面内分辨率18um。对于图像分析,测量股骨的以下参数:小梁骨矿物密度(bmd)、小梁骨矿物含量(bmc)、小梁骨体积(bv)、小梁厚度、小梁间距、小梁数、皮质厚度、皮质骨膜周长、皮质骨内膜周长、皮质bmd、皮质bmc和皮质bv。
[0846]
统计学分析
[0847]
数据可以表示为平均值
±
sem,并在graphpad prism 8中进行统计分析或输入r统
计计算软件中。为了评估gag和nf-l水平,使用单向anova与图基多重比较检验进行分析。使用非参数斯皮尔曼相关系数进行血清和csf nf-l相关分析。当一组或多组中少于5只动物处于某种状态下时,使用费希尔精确检验分析加速踏车测定,否则使用卡方检验。将3个试验的爬杆测试中顺着杆下降的等待时间求平均值,并使用线性混合效应模型来说明在所有的受试者上进行的多个试验。使用线性模型进行前脉冲抑制分析。使用线性混合效应模型分析声音惊吓阈值测试,以说明受试者内的相关性,这种相关性是从相同受试者在不同水平的听觉刺激下进行重复测量获得的。对于主动位置回避测试,使用线性混合效应模型说明受试者内的相关性,这种相关性是从相同受试者在实验不同阶段进行重复测量获得的。使用威尔科克森秩和检验进行试验3的分析和该apa任务的恢复测试。通过费希尔精确检验分析动物在apa任务上的表现。使用非参数威尔科克森秩和检验进行热板测试分析。使用卡方检验进行视觉悬崖测试分析。使用费希尔精确检验进行面部评分分析。使用单向anova与图基多重比较检验进行微型-ct扫描的定量分析。
[0848]
结果
[0849]
1.全身施用etv:ids降低cns gag和神经丝轻链水平
[0850]
ids ko;tfr
mu/hu
通过腹膜内注射接受每周剂量的媒介物或3 mg/kg etv:ids,持续17周。年龄匹配的媒介物处理的tfr
mu/hu
小鼠用作无疾病对照组。在最后一剂后七天评估肝、脑和csf中的gag 水平。确定总gag为主要hs(d0a0、d0s0)和ds(d0a4)衍生的二糖的总和。etv:ids有效减少外周器官如肝中的gag,以及有效降低脑和csf中的底物(图33)。还发现当在csf nf-l水平显著升高(4.5 月龄)的疾病进展阶段开始治疗时(其更能代表mps ii人患者中治疗发作可能开始的时间),etv:ids有效减少ids ko;tfr
mu/hu
小鼠中的 nf-l。17周处理后,etv:ids使ids ko;tfr
mu/hu
的血清和csf中的 nf-l水平均显著降低了约30%(图34),这证明了尽管治疗开始时间晚,但etv:ids仍然可以发挥部分神经保护作用。在etv:ids处理后,血清和csf中的nf-l水平正相关(数据未显示),这表明了可以探索血清中的nf-l的评价作为cns的治疗响应性生物标志物。总的说来,这些数据证实了etv:ids能够减少底物积聚在cns和外周组织中,并有效降低神经轴退化的标志物。
[0851]
2.全身施用etv:ids拯救神经行为表型
[0852]
ids ko小鼠模型概括了mps ii的几个生物学和病理学方面,这些方面包括粗大和精细运动技能的重度损伤。先前已经在ids ko小鼠中描述了小运动表型,但在该模型中可获得的有关潜在认知功能障碍的数据有限。在4至8月龄的ids ko;tfr
mu/hu
与tfr
mu/hu
小鼠之间比较多个行为领域,并且如通过用加速踏车测定、前脉冲抑制测定和主动位置回避(apa)测定进行的评价所说明,观察到清晰的差异。4.5 月龄开始每周给予etv:ids能够减少在ids ko;tfr
mu/hu
小鼠中鉴定的行为缺陷。为了评估运动技能,测量小鼠在旋转棒测定中的表现,并且ids ko;tfr
mu/hu
小鼠没有在这一任务中显示任何缺陷,这表明协调和平衡没有发生重大变化(数据未显示)。与该观测结果一致,idsko;tfr
mu/hu
小鼠在踏车上展示正常的步态(数据未显示)。然而,在踏车更快的速度下,不是所有的ids ko;tfr
mu/hu
小鼠都能够完成任务,这可能表明身体无法快跑,或者缺乏完成更具挑战性的任务的动机 (图35)。值得注意地,etv:ids处理提高ids ko;tfr
mu/hu
小鼠的表现,如尽管踏车加速但完成奔跑任务的小鼠数却增加所证明(图35)。为了进一步探索小鼠的运动技能和敏捷性,测量它们在爬杆测试中的表现,并观察到etv:ids处理也使ids ko;tfr
mu/hu
小鼠的表现相对于无疾病对照的表现
正常化(图36)。
[0853]
除了注意力缺陷之外,神经病变型mps ii患者可能呈现持续和重复的行为,表明抑制功能有异常。在小鼠中,注意力和抑制功能都可以通过使用前脉冲抑制范式(ppi)测量感觉运动门控来评估。ppi测定测量抑制对先较弱刺激再强刺激的惊吓响应的能力。观察到idsko;tfr
mu/hu
小鼠显示与对照小鼠相比前脉冲惊吓抑制明显减少,证明了感觉运动门控的缺陷(图37)。在ppi测定中etv:ids完全拯救这一缺陷(图37)。为了证实该作用不能归因于ids ko;tfr
mu/hu
小鼠的听觉灵敏度的差异,通过声音惊吓阈值测试来测试小鼠。在这一测试中 ids ko;tfr
mu/hu
小鼠没有显示对宽带噪声的响应有任何缺陷(数据未显示),这表明了在ppi中观察到的etv:ids的有益作用反映了感觉运动门控的改善,不仅仅是听觉灵敏度。
[0854]
最终,为了确定ids ko;tfr
mu/hu
小鼠是否具有认知缺陷,在主动位置回避(apa)测定中测试它们的空间学习和记忆。apa是一项海马依赖型任务,其中小鼠学习使用远侧的视觉线索来回避与厌恶刺激(轻度电击)相关的区,同时场地不断地旋转。如在学习试验和恢复试验期间进入厌恶区(az)的次数高于对照队列所示,发现idsko;tfr
mu/hu
小鼠的空间学习减弱(图38-40)。值得注意地,在apa测定中全身施用etv:ids使这些小鼠的表现正常化,达到与对照小鼠类似的水平(图38-40)。为了证实apa中的etv:ids保护作用不是由疼痛敏感性或视觉功能引起的,测试三个实验组,并发现在热板测定中具有类似的疼痛响应,并在视觉悬崖测定中适当避开厌恶位置(图 41)。总的来说,apa测定结果证明,施用etv:ids使ids ko;tfr
mu/hu
小鼠中的空间学习和记忆缺陷正常化。
[0855]
因此,除了减少外周和cns gag积聚和nf-l(神经元损伤的标志物)之外,施用etv:ids校正mps ii小鼠模型中的多个神经行为缺陷,包括运动技能、敏捷性、感觉运动门控以及学习和记忆。
[0856]
3.全身施用etv:ids校正ids ko;tfr
mu/hu
小鼠中的耳和骨骼表型
[0857]
进展性传导性和感觉神经性听力损失是由中耳中的gag积聚和复发性耳炎引起的,在mps ii患者中是常见的。因此评价etv:ids 对mps ii小鼠模型的耳道的影响。从每组三只动物双向评价外听道和中耳(鼓膜和鼓泡)。与媒介物处理的tfr
mu/hu
对照小鼠相比,在idsko;tfr
mu/hu
小鼠的鼓泡中观察到明显的中耳积液和/或慢性中耳炎(图 42),这与先前描述的表型一致。在评估的6个耳道中5个中,粘膜下水肿和/或纤维化伴偶尔的息肉形成也是明显的(图42,图b)。用 etv:ids处理的idsko;tfr
mu/hu
小鼠显示显著改善,并且总体上展现出正常的外耳和中耳形态(图42)。另外,只在评估的6个耳道中的1 个中观察到轻度的粘膜下纤维化。这些数据表明,长期的etv:ids 处理改善了中耳积液和中耳炎,表明了提高听力功能的潜能,即使听力缺陷已经进展。
[0858]
在包括mps ii在内的多种mps病症中存在着肌肉骨胳异常。 mps ii小鼠模型显示骨骼异常与mps ii患者中观察到的骨骼异常类似,其中在病程早期出现骨骼变化并且随着动物年龄变大逐渐恶化。标准护理酶替代疗法和造血干细胞移植(hsct)疗法如果不在早期开始,则对骨骼的有益影响有限,因此在ids ko;tfr
mu/hu
小鼠中研究 etv:ids处理对骨骼表型的作用。在9月龄时,媒介物处理的idsko;tfr
mu/hu
小鼠显示与未患病的tfr
mu/hu
对照小鼠相比短的加宽鼻子。然而,用etv:ids处理的ids ko;tfr
mu/hu
小鼠的面部形态显示中间表型,并且在一些情况下看起来无法与tfr
mu/hu
对照小鼠区分(图 43)。在尸检时,基于缩短加宽鼻子的严重性的定性评估,对每只动物的面部特征盲式评分,其中评分3表示严重异常颅骨发
育。tfr
mu/hu
对照小鼠更多具有1和2的面部评分,而媒介物处理的idsko;tfr
mu/hu
的面部评分几乎都只给予了评分3。用etv:ids处理的 ids ko;tfr
mu/hu
小鼠更多具有1和2的面部评分,这表明在etv:ids 递送后动物的面部异常得到改善(图43)。
[0859]
还使用微型-ct采集股骨图像并对小梁和皮质骨进行定量图像分析来研究etv:ids对骨骼表型的作用。明显地,与对照相比,媒介物处理的ids ko;tfr
mu/hu
小鼠中的小梁密度增加并且皮质骨更厚。通过etv:ids校正了这些异常。在etv:ids处理后,ids ko;tfr
mu/hu
小鼠的小梁和皮质骨看起来与媒介物处理的tfr
mu/hu
对照类似(图 44)。还对多个皮质和小梁形态学参数进行定量分析。定量分析证明与对照相比,媒介物处理的ids ko;tfr
mu/hu
小鼠中小梁骨总量(体积) 显著增加,而平均小梁间距减少。这与小梁的数目增加一致,在 etv:ids处理之后小梁的数目显著减少,接近在tfr
mu/hu
对照小鼠中观察到的值(图45)。股骨皮质骨的测量还显示与对照相比,媒介物处理的ids ko;tfr
mu/hu
小鼠中皮质骨体积、皮质厚度以及骨内膜和骨膜直径显著增加并在etv:ids处理之后减少(图46)。与密质(皮质) 骨相比,松质骨(小梁)在ids ko;tfr
mu/hu
小鼠与对照之间以及 etv:ids处理组中观察到的变化程度更大,这与小的小梁的骨转换率相对较高一致。总的说来,这些数据表明当骨骼疾病已经进展时长期的etv:ids治疗能够校正骨骼异常。
[0860]
本文公开的全部数据证明,全身施用etv:ids有效拯救mps ii 相关的神经行为和骨骼异常。此外,在较老小鼠队列中在神经行为缺陷、听觉功能障碍、骨骼异常和广泛神经轴损伤正在发生和/或已经进展之后观察到这些作用。
[0861]
实施例10.研究患有亨特综合征(mpsii)的受试者中的潜在治疗响应性的cns-生物标志物的观察性研究
[0862]
进行一项分两部分的前瞻性的多中心观察性研究以评估mps ii 的临床和生物标志物特征,增加对生物标志物量度和它们的患者内和患者间变化性的了解,并探索它们与mps ii的临床特征和进展的关系。使用这一信息来告知未来研究临床试验的设计。
[0863]
目标
[0864]
主要目标:
[0865]
·
评估血液和尿液中的gag水平,包括患者内和患者之间的变化性。
[0866]
次要目标:
[0867]
·
评估脑脊髓液(csf)中的hs和ds水平。
[0868]
·
评估血液、尿液和/或csf样品中的潜在疾病相关或治疗响应性的生物标志物的水平。
[0869]
·
总gag、hs、ds、神经丝轻链(nf-l)、溶酶体脂质、溶酶体蛋白质、细胞因子和在髓样细胞上表达的可溶性触发受体2 (strem2)。
[0870]
·
探索疾病相关的生物标志物与疾病严重性的临床量度(神经认知、临床、功能和生活质量(qol)评估)之间的相关性。
[0871]
方法
[0872]
研究设计
[0873]
在研究第1部分中,招募大约20名2岁至10岁的mps ii患者: 10名或更多名2岁至10岁的患者;以及7名或更多名nmps ii患者。在长达18个月内,以规律的间隔,测量尿液和血液样品的生物标志物评估和疾病严重性的临床评价(参见图47)。还可以针对生物标志
物,收集一次性任选的csf样品。
[0874]
在研究第2部分中,招募大约8名2岁至30岁的mpsii患者:4名或更多名nmpsii患者;计划为了非研究相关的医疗程序进行全身麻醉的患者。进行csf、尿液和血液的单次收集,用于评估生物标志物。任选地进行疾病严重性的临床评价。
[0875]
纳入准则
[0876]
研究参与者须已经基于以下确诊了mpsii:记录的ids遗传突变;以及血浆、wbc和/或皮肤成纤维细胞中的ids活性降低(≤正常值下限的10%)。对于nmpsii子组,研究参与者须:发育商(dq)《85,和/或dq下降至少7.5个点,相隔至少6个月进行评估;或具有与已确认患有nmpsii的血亲相同的遗传突变。
[0877]
排除准则
[0878]
从研究中排除的准则包括以下条件或事件:不稳定的医学疾患;受试者在此前6个月内曾接受过任何靶向cns的mpsii研究疗法(例如鞘内ids、转铁蛋白或胰岛素受体介导的ids递送到cns、或干细胞移植);受试者在任何时候曾接受过mpsii基因疗法;或受试者具有已知与发育延迟、癫痫发作或其他重大cns病症有关的其他基因的突变。
[0879]
生物标志物、神经认知、临床、功能和生活质量评估
[0880]
如所指示的,进行以下每个类别内的评估。
[0881]
生物标志物评估:总尿液gag;血液、尿液和csf中的hs和ds水平;血液和csf中的nf-l;血液、尿液和csf中的溶酶体脂质[鞘脂、神经节苷脂和双(单酰基甘油)磷酸酯(bmp)];血液、尿液和csf中的细胞因子;以及csf中的strem2水平。
[0882]
神经认知评估:文兰适应行为量表第二版(vinelandadaptivebehaviorscales,vabs-ii);婴幼儿发育量表第三版(scalesofinfantandtoddlerdevelopment,bsid-iii)或考夫曼儿童成套评估第二版(kabc-ii),通过算法确定
[0883]
临床评估:不良事件和患者日记;病史和人口数据;身体检查;以及安全性实验室测试(化学、血液学和尿分析,以及csf细胞计数、蛋白质和葡萄糖)。
[0884]
功能评估:个性化教育计划(iep);个别化家庭服务计划(ifsps);以及听力学评估、听性脑干响应(abr)
[0885]
生活质量评估:儿童健康问卷家长表28(childhealthquestionnaireparentform28,chq-pf28)或婴幼儿生活质量(infantandtoddlerqualityoflife,itqol);以及儿童生活质量量表家庭影响模块(pediatricqualityoflifeinventoryfamilyimpactmodule,pedsql-fim)
[0886]
实施例11.在mpsii患者中etv:ids显著减少csfgag:确定etv:ids在患有亨特综合征的儿童受试者中的安全性、药代动力学和药效学的研究
[0887]
进行一项研究以评估etv:ids(etv:ids35.23.2;参见实施例6)的安全性、药代动力学(pk)和药效学(pd),etv:ids是研究性的中枢神经系统(cns)-渗透酶替代疗法(ert),被设计成治疗亨特综合征(mpsii)的外周和cns表现。
[0888]
目标
[0889]
·
评估etv:ids在患有亨特综合征的儿童受试者中的安全性和耐受性。
[0890]
·
评估etv:ids在患有亨特综合征的儿童受试者中的pk和pd。
[0891]
·
评估脑脊髓液(csf)、血清和尿液样品中etv:ids对gag水平(hs和ds水平)的作
用。
[0892]
·
评估血清和/或csf样品中etv:ids对溶酶体功能、炎症和神经元损伤(例如,nf-l)的生物标志物水平的作用。
[0893]
·
评估etv:ids对疾病严重性的临床量度(例如,使用神经认知、临床、功能和生活质量(qol)评估)的作用。
[0894]
结果
[0895]
队列a完成了五(5)名年龄在5至8岁范围内的患有神经病变性 mps ii的男性受试者的招募。受试者的种族/族群包括亚洲人、白种人、黑人和拉美人。所有的受试者在开始用etv:ids治疗前至少两年进行标准护理(soc)治疗(例如,elaprase)。五名受试者中的四名在基线时具有针对ids的抗药物抗体,滴度在189至超过11,000,000 范围内。所有的受试者均接受至少十二次(12)每周剂量的etv:ids,其中五名受试者中的至少四名递增至最高(30mg/kg)剂量水平。在测试的剂量(3至30mg/kg)下etv:ids一般耐受性良好。所有的受试者继续进行研究,并且没有中止或减少剂量。所有的治疗突发性不良事件的严重度都是轻度或中度的。最频繁观察到的不良事件是轻度或中度的输注相关反应,这与其他的酶替代疗法一致(参见wraith,j.e.. 2006.journal of inherited metabolic disease 29(2-3):442-447; tylki-szymanska和jurecka.2015.expert opinion on orphan drugs3(11):1241-1253),据报告69%的接受其他酶替代疗法的患者具有过敏性反应)。具体地说,五名受试者中的三名具有轻度或中度的输注相关反应。报告一例sae,它基于在7.5mg/kg的剂量水平下观察到中度输注相关反应(发热)的住院治疗,在施用扑热息痛和苯海拉明下不到24小时内消退。五名受试者中的两名具有贫血,被认为与研究人员血液收集相关。由于贫血,省略7.5mg/kg剂量水平下的一次每周剂量。
[0896]
受试者中的csf硫酸乙酰肝素(hs)水平计算为二糖d0a0、 d0a6、d0s0和d2s6的总和。如图49中示出,队列a中的受试者在四(4)次每周剂量的etv:ids(两次3mg/kg剂量加两次7.5mg/kg 剂量)之后实现统计上显著的csf hs水平降低,相对于基线(在施用 etv:ids之前的hs水平)平均减少76%(p《0.004)。五名受试者中的四名实现csf hs水平的正常化,相对于基线相应减少93%、91%、 90%和81%。剩余的受试者经历csf hs水平相对于基线降低25%。又如图49中示出,队列a中的受试者在四(4)次每周剂量的etv:ids 之后实现统计上显著的csf硫酸皮肤素(ds)降低,相对于基线(在施用etv:ids之前的ds水平)平均降低53%(p《0.001)。受试者实现个体csf ds相对于基线降低64%、64%、53%、41%和39%。针对所有受试者,在从soc治疗转变之后,每周监测总尿液gag。总尿液gag水平通过比色测定法来监测,在开始etv:ids之后,所有受试者中均稳定或减少,这证实了继续给药的安全性。
[0897]
在12次每周剂量的etv:ids之后,队列a中的受试者继续实现 csf hs水平的统计上显著的降低,相对于基线(在施用etv:ids之前的hs水平)平均降低85%(p《0.001),5名受试者中的4名维持csfhs的正常化(图50a;正常范围由(黑色圆圈)指示,其使用30个成人 csf样品来确定(范围10-90百分位数);成人和儿童csf gag水平类似(hendriksz等人,mol.genet.metab.rep.,5:103-106(2015)))。显示csf hs从第5周(25%)至第13周(73%)继续降低的剩余受试者具有超过11,000,000的预先存在的针对ids的ada滴度,比另外四名受试者中的滴度高10
2-106倍。
[0898]
在12次每周剂量的etv:ids之后,队列a中的受试者继续实现统计上显著的csf ds
水平降低,相对于基线(在施用etv:ids之前的ds水平)平均降低73%(p《0.001)(图50b)。
[0899]
在从soc治疗转变成用etv:ids治疗之后,总尿液hs和ds 水平降低。如图51a-51b中示出,队列a中的受试者在四(4)次每周剂量的etv:ids之后实现统计上显著的尿液hs和ds降低,相对于基线(在施用etv:ids之前的hs/ds水平)分别平均减少72%(p= 0.005)和72%(p=0.009)。在第9周观察到持续的尿液hs和ds降低 (平均hs降低76%(p《0.001)和平均ds降低82%(p《0.001))(图 51a-51b)。
[0900]
在mps ii患者的csf中某些溶酶体脂质增加,包括gm3和 bmp。为了评价etv:ids对溶酶体功能的作用,检查来自队列a受试者的csf中的gm3和bmp水平。如图52所示,5名受试者中的 4名中gm3下降,在第9周平均下降39%(p=0.012)。5名受试者中的3名中bmp下降,在第9周平均下降15%(p=0.12)(图52)。csfgm3的降低和bmp降低的趋势证明etv:ids对溶酶体功能的作用。
[0901]
这些数据支持etv:ids每周一次的施用用于治疗亨特综合征的神经认知和身体表现的用途。
[0902]
方法
[0903]
研究设计
[0904]
研究具有三个交错队列:5至10岁患有神经病变型mps ii的受试者(队列a);2至18岁患有神经病变型或非神经病变型mps ii的受试者(队列b);以及小于4岁的患有神经病变型mps ii的受试者(队列c)(参见图48)。研究包括剂量上升阶段,以评估大约24周内 etv:ids的安全性、耐受性、pk和pd。具体地说,使用剂量递增, etv:ids每周经静脉内施用于受试者。etv:ids输注的持续时间为大约3小时。对于队列a,etv:ids的剂量递增是:3mg/kg(“剂量a”, 2次每周输注)、7.5mg/kg(“剂量b”,至少2次每周输注);15mg/kg (“剂量c”,至少4次每周输注)和30mg/kg(“剂量d”,每周直到结束)。队列b包括开始剂量为3mg/kg(b1)、7.5mg/kg(b2)和15mg/kg(b3) 的三个子队列。子队列b1和b2内的受试者接受12次每周剂量的开始剂量,然后是评价的一个或多个剂量,可能是一次或多次剂量递增。评价的一个或多个剂量不超过30mg/kg,并基于队列a/队列b的安全性和生物标志物结果(例如,在队列a使用至少两周且被认为是安全且一般耐受性良好的剂量)(参见图48)。用于队列c的一个或多个剂量是在队列a和队列b中评价的剂量并基于那些队列的安全性和生物标志物结果确定。
[0905]
纳入准则
[0906]
研究参与者须已经确诊了mps ii。队列a中招募的受试者是5-10 岁的患有神经病变型mps ii的受试者。队列b中招募的受试者是2 至18岁的患有非神经病变型mps ii、神经病变型mps ii或未知表型的受试者。队列c中招募的受试者是小于4岁的患有神经病变型mpsii的受试者。对于接受静脉内艾杜糖醛酸2-硫酸酯酶(ids)ert的受试者,他们需要在临筛选前的时间段内耐受最少4个月的疗法。
[0907]
排除准则
[0908]
从研究中排除的准则包括以下条件或事件:1)可能干扰安全参与研究或研究评估的解释的一种或多种不稳定或控制不佳的医学疾患或者重大医学或心理学共病;2)对于≥5岁的受试者,在研究开始前的 3个月内,和对于《5岁的受试者,在研究开始前的6个月内,使用任何靶向cns的mps ii ert;3)任何时候使用过ids基因疗法或干细胞疗法;4)临床显著的血小板减少、其他临床显著的凝血异常或显著的活动性出血,或需要用抗凝剂或超过
两种抗血小板剂治疗;5)腰椎穿刺禁忌症;6)在筛选1年内具有中风、癫痫状态、伴有意识丧失的头部创伤或非mps ii相关的任何cns疾病的临床显著历史;7)在筛选30天内进行了脑室腹腔(vp)分流,或任何其他的脑手术,或具有临床显著的vp分流机能失调;
[0909]
或8)具有任何临床显著的cns创伤或病症,研究人员认为这些创伤或病症可能干扰研究终点的评估或使得参与研究不安全。
[0910]
csf和尿液样品收集
[0911]
在预定时间点收集csf和尿液样品。对于图49、50(a,b)和52(a,b) 中示出的结果,在第一剂前和第4剂、第8剂和/或第12剂etv:ids 之后大约1周通过腰椎穿刺收集csf样品。对于图51(a,b)中示出的结果,在第一剂前和第4剂和第8剂etv:ids之后大约1周收集尿液样品。
[0912]
gag的lcms测定法
[0913]
通过液相色谱法,使用与先前描述的类似的方法定量csf和尿液中的gag(例如,hs和ds)(pan等人2018.bioanalysis10(11):825-838;wang等人2018.biomedical chromatography32:e4294(12页))。
[0914]
bmp和神经节苷脂的lcms测定
[0915]
由合法的临床实验室进行csf的bmp分析。使用与实施例1中所述的类似的方法进行csf的神经节苷脂分析。
[0916]
药代动力学
[0917]
在预定时间点收集血液样品,用于分析etv:ids血清浓度。 etv:ids的pk参数是在数据允许的情况下,通过对血清浓度-时间数据的非房室分析得出的。pk参数可包括但不限于以下:cmax;谷浓度(cmin);tmax;时间零至最后可定量浓度的时间的浓度-时间曲线下面积(auc0–
最后
);给药间隔内的浓度-时间曲线下面积(auc0–
t
);表观终末消除速率常数(λz);表观终末消除t1/2;以及积聚比率。
[0918]
安全性评估
[0919]
使用一种或多种上述评估以及以下各项来评价安全性:不良事件(ae),包括输注相关反应(irr)(包括过敏反应和过敏症)的频率和严重性;生命体征测量;身体检查,包括神经系统检查;安全性实验室评估(包括血液学、血清临床化学、尿分析和凝固);尿液总gag浓度(归一化至肌酐);etv:ids在血清中的免疫原性的表征,如通过研究期间抗药物抗体(ada)相对于基线的发生率测量;以及伴随药物的使用。
[0920]
生物标志物、神经认知、临床、功能和生活质量评估
[0921]
进行与实施例10中所述的那些类似的评估。这些评估用于测量结果,如下所详述。
[0922]
结果量度
[0923]
主要结果量度:
[0924]
1.包括输注相关反应(irr)在内的不良事件(ae)的发生率和严重性
[0925]
2.尿液总糖胺聚糖(gag)浓度
[0926]
次要结果量度:
[0927]
3.脑脊髓液(csf)中的硫酸乙酰肝素相对于基线的变化
[0928]
4.pk参数:血清中etv:ids的最大观察浓度(cmax)
[0929]
5.pk参数:血清中etv:ids的谷浓度(cmin)
[0930]
6.pk参数:血清中etv:ids的达到最大观察浓度的时间(tmax)
[0931]
7.pk参数:血清中etv:ids的时间零至最后可定量浓度的时间的浓度-时间曲线下面积(auc[0-最后])
[0932]
8.pk参数:血清中etv:ids的给药间隔内的浓度-时间曲线下面积(auc[0-τ])
[0933]
9.pk参数:血清中etv:ids的表观终末消除速率常数(λz)
[0934]
10.pk参数:血清中etv:ids的表观终末消除t1/2
[0935]
11.pk参数:血清中etv:ids的积聚比率
[0936]
12.etv:ids在血清中的免疫原性的表征,如通过抗药物抗体 (ada)相对于基线的发生率测量
[0937]
13.尿液的硫酸乙酰肝素(hs)浓度相对于基线的变化
[0938]
其他预指定结果量度:
[0939]
14.csf中的硫酸皮肤素(ds)相对于基线的变化
[0940]
15.尿液的ds浓度相对于基线的变化
[0941]
16.血清的hs和ds浓度相对于基线的变化
[0942]
17.csf的溶酶体功能生物标志物水平相对于基线的变化
[0943]
18.通过超声评估的肝和脾脏体积
[0944]
19.临床整体印象-严重性(cgi-s)评分相对于基线的变化
[0945]
20.临床整体印象-改善(cgi-i)评分
[0946]
21.家长/护理者整体印象-严重性(pgi-s)评分相对于基线的变化
[0947]
22.家长/护理者整体印象-改善(pgi-i)评分
[0948]
23.亨特综合征日常生活活动(adl-hs)评分相对于基线的变化
[0949]
24.根据布里斯托大便量表(bristol stool scale),粪便黏稠度相对于基线的变化
[0950]
25.在基线时能够听从指示的≥6岁的受试者的6分钟步行测试 (6mwt)相对于基线的变化
[0951]
26.如通过如厕能力调查表(toileting abilities survey,tas)测量,如厕能力百分比(tap)相对于基线的变化
[0952]
27.听性脑干响应(abr)参数相对于基线的变化
[0953]
28.认知领域及语言和运动领域评分和根据贝利婴幼儿发展量表(bayley scales of infant and toddler development,bsid-iii)或考夫曼儿童成套评估非言语索引(kabc-ii)的评分相对于基线的变化
[0954]
29.综合年龄相当评分和根据vabs-ii的标准评分相对于基线的变化
[0955]
30.受试者《5岁的婴幼儿生活质量问卷(itqol)相对于基线的变化
[0956]
31.受试者≥5岁的儿童期健康问卷家长表(chq-pf28)相对于基线的变化
[0957]
32.儿童生活质量量表家庭影响模块(pedsql-fim)相对于基线的变化
[0958]
统计学分析
[0959]
使用r软件(3.6.2版)进行统计学分析。使用描述统计学总结连续变量(适用时,参与者数目、平均值、标准偏差[sd]、中值、最小值、最大值和95%置信区间[ci])。p值通过相对于基线的平均变化百分比的t检验比较来确定。
[0960]
表
[0961]
表1.用etv:ids处理的idsko小鼠脑内glccer水平的总结(相对于wt的倍数)
[0962][0963]
表2.用媒介物、etv:ids或elaprase处理的idsko小鼠脑内的脂质水平(相对于wt的倍数)
[0964]
[0965]
[0966]
[0967]
[0968]
[0969][0970]
非正式序列表
[0971]
[0972]
[0973]
[0974]
[0975]
[0976]
[0977]
[0978]
[0979]
[0980]
[0981]
[0982]
[0983]
[0984]
[0985]
[0986]
[0987]
[0988]
[0989]
[0990]
[0991]
[0992]
[0993]
[0994]
[0995]
[0996]
[0997]
[0998]
[0999]
[1000]
[1001]
[1002]
[1003]
[1004]
[1005]
[1006]
[1007]
[1008]
[1009]
[1010]
[1011][1012]
所有出版物、专利和专利文件均以引用的方式整体并入本文中,正如以引用的方式来单独地并入一般。本公开已参考各种具体和优选的实施方案和技术加以描述。然而,应理解可在保持处于本发明的精神和范围内的同时作出许多变化和修改。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1