用于检测样品中的不同分析物以及分析物的不同亚组/变异体的多重方法与流程
multiplexed error-robust fluorescence in situ hybridization,proc.natl.acad.sci.u s a.113(39),p.11046-11051。
7.以下中描述了称为
‘
intron seqfish’的技术:shah et al.(2018),dynamics and spatial genomics of the nascent transcriptome by intron seqfish,cell 117(2),p.363-376。其中,经由特异性探针组检测目的mrna,该探针组为荧光标记的寡核苷酸的后续特异性杂交提供额外的序列元件。每个探针组在每轮颜色编码中提供12种可能的序列元件(代表使用的12种
‘
伪颜色’)中的一种。每轮颜色编码由四个系列杂交组成。在这些系列杂交的每一个中,三个读出探针(每个都用不同的荧光团标记)与mrna特异性探针组的相应元件杂交。成像后,通过55%甲酰胺缓冲液剥离读出探针,并且随后进行下一次杂交。在5轮颜色编码(每轮具有4个系列杂交)之后,完成颜色编码。
8.ep 0 611 828公开了使用桥接元件将信号生成元件募集到特异性结合分析物的探针。更具体的陈述描述了经由募集桥接核酸分子的特异性探针来检测核酸。这种桥接核酸最终会募集信号生成核酸。该文件还描述了使用具有用于信号生成元件的多于一个结合位点用于信号放大的桥接元件,如分支dna。
9.player et al.(2001),single-copy gene detection using branched dna(bdna)in situ hybridization,j.histochem.cytochem.49(5),p.603-611描述了一种方法,其中经由提供额外序列元件的特异性探针组来检测目的核酸。在第二步骤中,预放大物(preamplifier)寡核苷酸与该序列元件杂交。该预放大物寡核苷酸包括用于在后续步骤中杂交的放大物(amplifier)寡核苷酸的多个结合位点。这些放大物寡核苷酸为标记的寡核苷酸提供多个序列元件。这样就建立了导致信号放大的分支的寡核苷酸树。
10.以下中描述了对这种提及的方法的进一步发展:wang et al.(2012),rnascope:a novel in situ rna analysis platform for formalin-fixed,paraffin-embedded tissues,j.mol.diagn.14(1),p.22-29,其使用mrna特异性探针的另一种设计。其中,两个mrna特异性寡核苷酸必须非常接近地杂交,以提供可以募集预放大物寡核苷酸的序列。这样,通过降低假阳性信号的数量提高了方法的特异性。
11.choi et al.(2010),programmable in situ amplification for multiplexed imaging of mrna expression,nat.biotechnol.28(11),p.1208-1212公开了称为
‘
hcr-杂交链式反应’的方法。经由提供额外序列元件的特异性探针组来检测目的mrna。额外的序列元件是启动杂交链式反应的起始序列。基本上,杂交链式反应基于亚稳态寡核苷酸发夹,在经由过起始序列打开第一个发夹后,该亚稳态寡核苷酸发夹自组装成聚合物。
12.该技术的进一步发展使用所谓的分裂起始探针,该探针必须非常接近地杂交以形成用于hcr的起始序列,类似于rnascope技术,这降低了假阳性信号的数量;参见choi et al.(2018),third-generation in situ hybridization chain reaction:multiplexed,quantitative,sensitive,versatile,robust.development 145(12)。
13.mateo et al.(2019),visualizing dna folding and rna in embryos at single-cell resolution,nature vol,568,p.49ff,公开了称为
‘
染色质结构的光学重建(orca)’的方法。该方法旨在使染色体线可见。
14.ep 2 992 115 b1描述了顺序单分子杂交的方法,并提供了通过顺序条形码化检测和/或量化细胞、组织、器官或生物中的核酸的技术。
15.然而,本领域已知的方法具有许多缺点。尤其,它们不灵活、昂贵、复杂、耗时并且经常提供不准确的结果。尤其,现有方法的编码能力较低,并且不符合现代分子生物学和医学的要求。
16.在此背景下,本公开的目的是提供方法,通过该方法可以降低或甚至避免现有技术方法的缺点。
技术实现要素:
17.本公开涉及用于平行检测样品中的不同分析物以及分析物的不同亚组/变异体的新多重方法,其通过所述分析物和/或变异体的顺序信号编码来进行。
18.尤其,本公开涉及用于检测样品中的不同分析物以及分析物的不同亚组/变异体的多重方法,其包括:
19.(a)使所述样品与用于编码至少20种不同分析物的至少二十(20)个不同的分析物特异性探针组接触,每个分析物特异性探针组与不同的分析物相互作用,其中,如果所述分析物是核酸,则每个分析物特异性探针组包括与相同分析物的不同亚结构特异性相互作用的至少五(5)种分析物特异性探针,每种分析物特异性探针包括
20.(aa)结合元件(s),与待编码的不同分析物之一特异性相互作用,以及
21.(bb)标识符元件(t),包括对于待编码的分析物唯一的核苷酸序列(唯一标识符序列),
22.其中,特定分析物特异性探针组的分析物特异性探针与另一分析物特异性探针组的分析物特异性探针在所述标识符元件(t)的核苷酸序列方面不同,
23.其中,每个分析物特异性探针组中的分析物特异性探针与相同的分析物结合并且包括对于所述分析物唯一的标识符元件(t)的相同核苷酸序列;以及
24.使所述样品与用于至少一种分析物及其变异体的至少两个不同的分析物特异性探针组接触,
25.其中,这些不同组中包括的分析物特异性探针与相同分析物相互作用,但与相同分析物的不同亚结构特异性相互作用,
26.其中,第一分析物特异性探针组的分析物特异性探针与分析物的所有变异体中包括的亚结构相互作用,
27.其中,第二分析物特异性探针组的分析物特异性探针(亚组特异性探针)与仅在所述分析物的特定变异体中包括的亚结构相互作用,
28.其中,所述第一分析物特异性探针组的分析物特异性探针包括相同的标识符元件(t),所述标识符元件包括对于所述待编码的分析物唯一的核苷酸序列(唯一标识符序列),并且
29.其中,所述第二分析物特异性探针组的分析物特异性探针包括相同的标识符元件(t),所述标识符元件包括对于所述待编码的分析物唯一的核苷酸序列(唯一标识符序列),
30.其中,所述第一分析物特异性探针组的分析物特异性探针的标识符元件(t)与所述第二分析物特异性探针组的分析物特异性探针的标识符元件(t)不同,以结合不同的解码寡核苷酸和/或非信号解码寡核苷酸。
31.(b)使所述样品与每种分析物的至少一个解码寡核苷酸组接触,其中,在用于个体
分析物的每个解码寡核苷酸组中,每个解码寡核苷酸包括:
32.(aa)标识符连接物(connector)元件(t),包括与相应分析物特异性探针组的标识符元件(t)的唯一标识符序列的至少一部分基本上互补的核苷酸序列,以及
33.(bb)翻译物(translator)元件(c),包括允许信号寡核苷酸特异性杂交的核苷酸序列;
34.其中,用于个体分析物的一组解码寡核苷酸与用于不同分析物的另一组解码寡核苷酸在第一连接元件(t)方面不同;以及
35.(c)使所述样品与至少一个信号寡核苷酸组接触,每个信号寡核苷酸包括:
36.(aa)翻译物连接物元件(c),包括与解码寡核苷酸中包括的翻译物元件(c)的核苷酸序列的至少一部分基本上互补的核苷酸序列,以及
37.(bb)信号元件。
38.(d)检测由所述信号元件引起的信号;
39.(e)从样品中选择性地除去解码寡核苷酸和信号寡核苷酸,从而基本上保持分析物特异性探针与待编码的分析物的特异性结合;
40.(f)执行包括步骤b)至e)的至少三(3)个另外的循环,以生成具有每种分析物的码字的编码方案,
41.(g)执行包括步骤b)至e)的至少一(1)个另外的循环,以鉴定亚组特异性探针,其中,尤其所述循环可以在步骤(d)处停止。
42.此外,本公开涉及使用改善的解码寡核苷酸来提高编码方案的效率。所谓的“多解码物”允许募集不止仅一种信号寡核苷酸,并且因此可以通过利用两种或更多种不同信号寡核苷酸的组合来生成新的信号类型,而不会降低信号的亮度。
43.在另外的方面,本公开的实施方式尤其涉及一种用于检测样品中的不同分析物的多重方法,所述方法通过对所述分析物进行顺序信号编码来进行,所述方法包括:
44.(a)使所述样品与用于编码至少20种不同分析物的至少二十(20)个不同的分析物特异性探针组接触,每个分析物特异性探针组与不同的分析物相互作用,其中,如果所述分析物是核酸,则每个分析物特异性探针组包括与相同分析物的不同亚结构特异性相互作用的至少五(5)种分析物特异性探针,每种分析物特异性探针包括
45.(aa)结合元件(s),与待编码的不同分析物之一特异性相互作用,以及
46.(bb)标识符元件(t),包括对于待编码的分析物唯一的核苷酸序列(唯一标识符序列),
47.其中,特定分析物特异性探针组的分析物特异性探针与另一分析物特异性探针组的分析物特异性探针在所述标识符元件(t)的核苷酸序列方面不同,
48.其中,每个分析物特异性探针组中的分析物特异性探针与相同的分析物结合并且包括对于所述分析物唯一的标识符元件(t)的相同核苷酸序列;以及
49.(b)使所述样品与每种分析物的至少一个解码寡核苷酸组接触,其中,在用于个体分析物的每个解码寡核苷酸组中,每个解码寡核苷酸包括:
50.(aa)标识符连接物元件(t),包括与相应分析物特异性探针组的标识符元件(t)的唯一标识符序列的至少一部分基本上互补的核苷酸序列,以及
51.(bb)翻译物(translator)元件(c),包括允许信号寡核苷酸特异性杂交的核苷酸
序列;
52.其中,用于个体分析物的一组解码寡核苷酸与用于不同分析物的另一组解码寡核苷酸在第一连接元件(t)方面不同;以及
53.(c)使所述样品与至少一个信号寡核苷酸组接触,每个信号寡核苷酸包括:
54.(aa)翻译物连接物元件(c),包括与解码寡核苷酸中包括的翻译物元件(c)的核苷酸序列的至少一部分基本上互补的核苷酸序列,以及
55.(bb)信号元件。
56.(d)检测由所述信号元件引起的信号;
57.(e)从所述样品中选择性地除去所述解码寡核苷酸和信号寡核苷酸,从而基本上保持所述分析物特异性探针与所述待编码的分析物的特异性结合;
58.(f)执行包括步骤b)至e)的至少三(3)个另外的循环,以生成具有每种分析物的码字的编码方案,其中,尤其最后一个循环可以在步骤(d)处停止。
59.在另一方面,本公开的实施方式涉及用于多重分析物编码的试剂盒,所述试剂盒包括:
60.(a)用于编码至少20种不同分析物的至少二十(20)个不同的分析物特异性探针组,每个分析物特异性探针组与不同的分析物相互作用,其中,如果所述分析物是核酸,则每个分析物特异性探针组包括与相同分析物的不同亚结构特异性相互作用的至少五(5)种分析物特异性探针,每种分析物特异性探针包括
61.(aa)结合元件(s),与待编码的不同分析物之一特异性相互作用,以及
62.(bb)标识符元件(t),包括对于待编码的分析物唯一的核苷酸序列(唯一标识符序列),
63.其中,特定分析物特异性探针组的分析物特异性探针与另一分析物特异性探针组的分析物特异性探针在所述标识符元件(t)的核苷酸序列方面不同,
64.其中,每个分析物特异性探针组中的分析物特异性探针与相同的分析物结合并且包括对于所述分析物唯一的标识符元件(t)的相同核苷酸序列;以及
65.(b)每种分析物的至少一个解码寡核苷酸组,其中,在用于个体分析物的每个解码寡核苷酸组中,每个解码寡核苷酸包括:
66.(aa)标识符连接物元件(t),包括与相应分析物特异性探针组的标识符元件(t)的唯一标识符序列的至少一部分基本上互补的核苷酸序列,以及
67.(bb)翻译物元件(c),包括允许信号寡核苷酸特异性杂交的核苷酸序列;
68.其中,用于个体分析物的一组解码寡核苷酸与用于不同分析物的另一组解码寡核苷酸在所述标识符连接元件(t)方面不同;以及
69.(c)信号寡核苷酸组,每个信号寡核苷酸包括:
70.(aa)翻译物连接物元件(c),包括与解码寡核苷酸中包括的翻译物元件(c)的核苷酸序列的至少一部分基本上互补的核苷酸序列,以及
71.(bb)信号元件。
72.在另一方面,本公开的实施方式涉及用于诊断疾病的体外方法,所述疾病选自包括以下项的组:癌症、神经元疾病、心血管疾病、炎性疾病、自身免疫疾病、由于病毒或细菌感染引起的疾病、皮肤疾病、骨骼肌疾病、牙齿疾病和产前疾病,所述方法包括使用根据本
公开的多重方法。
73.在另一方面,本公开的实施方式提供用于诊断植物疾病的体外方法,所述植物疾病选自包括以下项的组:由生物胁迫引起的疾病,优选由感染和/或寄生虫来源引起的疾病,或由非生物胁迫引起的疾病,优选由营养缺乏和/或不利环境引起的疾病,所述方法包括使用根据本公开的多重方法。
74.在另外的方面,本公开的一些实施方式涉及适用于根据本公开的方法的光学复用系统,至少包括:
[0075]-至少一个反应容器,所述反应容器用于容纳根据本公开的试剂盒或试剂盒的一部分;
[0076]-检测单元,所述检测单元包括显微镜、尤其是荧光显微镜
[0077]-摄像头
[0078]-液体处理装置。
[0079]
在另外的方面,本公开的一些实施方式涉及用于多重分析物编码的试剂盒,所述试剂盒包括:
[0080]
(a)用于编码至少20种不同分析物的至少二十(20)个不同的分析物特异性探针组,每个分析物特异性探针组与不同的分析物相互作用,其中,如果所述分析物是核酸,则每个分析物特异性探针组包括与相同分析物的不同亚结构特异性相互作用的至少五(5)种分析物特异性探针,每种分析物特异性探针包括
[0081]
(aa)结合元件(s),与待编码的不同分析物之一特异性相互作用,以及
[0082]
(bb)标识符元件(t),包括对于待编码的分析物唯一的核苷酸序列(唯一标识符序列),
[0083]
其中,特定分析物特异性探针组的分析物特异性探针与另一分析物特异性探针组的分析物特异性探针在所述标识符元件(t)的核苷酸序列方面不同,
[0084]
其中,每个分析物特异性探针组中的分析物特异性探针与相同的分析物结合并且包括对于所述分析物唯一的标识符元件(t)的相同核苷酸序列;以及
[0085]
(b)每种分析物的至少一个解码寡核苷酸组,其中,在用于个体分析物的每个解码寡核苷酸组中,每个解码寡核苷酸包括:
[0086]
(aa)标识符连接物元件(t),包括与相应分析物特异性探针组的标识符元件(t)的唯一标识符序列的至少一部分基本上互补的核苷酸序列,以及
[0087]
(bb)翻译物元件(c),包括允许信号寡核苷酸特异性杂交的核苷酸序列;
[0088]
其中,用于个体分析物的一组解码寡核苷酸与用于不同分析物的另一组解码寡核苷酸在所述标识符连接元件(t)方面不同;以及
[0089]
(c)信号寡核苷酸组,每个信号寡核苷酸包括:
[0090]
(aa)翻译物连接物元件(c),包括与解码寡核苷酸中包括的翻译物元件(c)的核苷酸序列的至少一部分基本上互补的核苷酸序列,以及
[0091]
(bb)信号元件,
[0092]
其中,所述试剂盒包括用于分析物的至少两个不同的分析物特异性探针组,
[0093]
其中,这些不同组中包括的分析物特异性探针与相同分析物相互作用,但与相同分析物的不同亚结构特异性相互作用,
[0094]
其中,第一分析物特异性探针组的分析物特异性探针与分析物的所有变异体中包括的亚结构相互作用,
[0095]
其中,第二分析物特异性探针组的分析物特异性探针(亚组特异性探针)与仅在所述分析物的特定变异体中包括的亚结构相互作用,
[0096]
其中,所述第一分析物特异性探针组的分析物特异性探针包括相同的标识符元件(t),所述标识符元件包括对于所述待编码的分析物唯一的核苷酸序列(唯一标识符序列),并且
[0097]
其中,所述第二分析物特异性探针组的分析物特异性探针包括相同的标识符元件(t),所述标识符元件包括对于所述待编码的分析物唯一的核苷酸序列(唯一标识符序列),
[0098]
其中,所述第一分析物特异性探针组的分析物特异性探针的标识符元件(t)与所述第二分析物特异性探针组的分析物特异性探针的标识符元件(t)不同。
[0099]
此外,一些实施方式涉及用于多重分析物编码的试剂盒,包括
[0100]
(a)任选地用于编码至少20种不同分析物的至少二十(20)个不同的分析物特异性探针组,每个分析物特异性探针组与不同的分析物相互作用,其中,如果所述分析物是核酸,则每个分析物特异性探针组包括与相同分析物的不同亚结构特异性相互作用的至少五(5)种分析物特异性探针,每种分析物特异性探针包括
[0101]
(aa)结合元件(s),与待编码的不同分析物之一特异性相互作用,以及
[0102]
(bb)标识符元件(t),包括对于待编码的分析物唯一的核苷酸序列(唯一标识符序列),
[0103]
其中,特定分析物特异性探针组的分析物特异性探针与另一分析物特异性探针组的分析物特异性探针在所述标识符元件(t)的核苷酸序列方面不同,
[0104]
其中,每个分析物特异性探针组中的分析物特异性探针与相同的分析物结合并且包括对所述分析物唯一的标识符元件(t)的相同核苷酸序列;以及
[0105]
(b)每种分析物的至少一个解码寡核苷酸组,其中,在用于个体分析物的每个解码寡核苷酸组中,每个解码寡核苷酸包括:
[0106]
(aa)标识符连接物元件(t),包括与相应分析物特异性探针组的标识符元件(t)的唯一标识符序列的至少一部分基本上互补的核苷酸序列,以及
[0107]
(bb)翻译物元件(c),包括允许信号寡核苷酸特异性杂交的核苷酸序列;
[0108]
其中,用于个体分析物的一组解码寡核苷酸与用于不同分析物的另一组解码寡核苷酸在所述标识符连接元件(t)方面不同;以及
[0109]
(c)信号寡核苷酸组,每个信号寡核苷酸包括:
[0110]
(aa)翻译物连接物元件(c),包括与解码寡核苷酸中包括的翻译物元件(c)的核苷酸序列的至少一部分基本上互补的核苷酸序列,以及
[0111]
(bb)信号元件。
[0112]
在另外的方面,一些实施方式提供了用于筛选、鉴定和/或测试物质和/或药物的体外方法,包括:
[0113]
(a)使包括样品的测试样品与物质和/或药物接触
[0114]
(b)通过使用根据本公开的方法对所述分析物进行顺序信号编码来检测样品中的不同分析物。
[0115]
在另外的方面,本公开的实施方式通过靶向样品中的靶标的亚组来扩展了用于检测不同分析物的多重方法(在第一方面中描述)。一个探针组的顺序信号编码如果如所述进行,并且添加至少一个额外的探针组以区分靶标亚组。
[0116]
主要分析物的解码(多轮)如所述进行(第一方面的a至i)。为了识别所述分析物的亚组,生成额外的信号并结合主要分析物的编码进行分析。所述方法包括:
[0117]
(a)使所述样品与用于编码至少20种不同分析物的至少二十(20)个不同的分析物特异性探针组接触,每个分析物特异性探针组与不同的分析物相互作用,其中,如果所述分析物是核酸,则每个分析物特异性探针组包括与相同分析物的不同亚结构特异性相互作用的至少五(5)种分析物特异性探针,每种分析物特异性探针包括
[0118]
(aa)结合元件(s),与待编码的不同分析物之一特异性相互作用,以及
[0119]
(bb)标识符元件(t),包括对于待编码的分析物唯一的核苷酸序列(唯一标识符序列),
[0120]
其中,特定分析物特异性探针组的分析物特异性探针与另一分析物特异性探针组的分析物特异性探针在所述标识符元件(t)的核苷酸序列方面不同,
[0121]
其中,每个分析物特异性探针组中的分析物特异性探针与相同的分析物结合并且包括对于所述分析物唯一的标识符元件(t)的相同核苷酸序列;以及,
[0122]
(a2)使至少一种分析物的亚组与至少五(5)个亚组特异性探针的组接触,所述亚组特异性探针与另一分析物特异性探针组的分析物特异性探针在所述标识符元件(t)的核苷酸序列方面不同,
[0123]
(b)使所述样品与每种分析物的至少一个解码寡核苷酸组接触,其中,在用于个体分析物的每个解码寡核苷酸组中,每个解码寡核苷酸包括:
[0124]
(aa)标识符连接物元件(t),包括与相应分析物特异性探针组的标识符元件(t)的唯一标识符序列的至少一部分基本上互补的核苷酸序列,以及
[0125]
(bb)翻译物(translator)元件(c),包括允许信号寡核苷酸特异性杂交的核苷酸序列;
[0126]
其中,用于个体分析物的一组解码寡核苷酸与用于不同分析物的另一组解码寡核苷酸在第一连接元件(t)方面不同;以及
[0127]
(c)使所述样品与至少一个信号寡核苷酸组接触,每个信号寡核苷酸包括:
[0128]
(aa)翻译物连接物元件(c),包括与解码寡核苷酸中包括的翻译物元件(c)的核苷酸序列的至少一部分基本上互补的核苷酸序列,以及
[0129]
(bb)信号元件。
[0130]
(g)检测由所述信号元件引起的信号;
[0131]
(h)从所述样品中选择性地除去所述解码寡核苷酸和信号寡核苷酸,从而基本上保持所述分析物特异性探针与所述待编码的分析物的特异性结合;
[0132]
(i)执行包括步骤b)至e)的至少三(3)个另外的循环,以生成具有每种分析物的码字的编码方案,
[0133]
(j)执行包括步骤b)至e)的至少一(1)个另外的循环,以鉴定步骤a2)中接触的亚组特异性探针,其中,尤其所述最后一个循环可以在步骤(d)处停止。
[0134]
根据本公开,每个靶标(例如一个单一基因的mrna)或靶标组使用唯一标签(标识
符)。可以形成组以指示某种身份、过程、生物功能或疾病(例如:细胞类型、炎症、信号处理、癌症)。
[0135]
出人意料地,根据本公开的方法和试剂盒导致复杂性降低。具有不同结合序列的许多不同探针共享相同的(每个靶标一个)唯一标签。这些标签降低了序列复杂性(至每个靶标一个),并且还具有预定的恒定特性(例如热力学稳定性)。
[0136]
根据本公开的方法和试剂盒的优点是:
[0137]
a)确定标签身份的过程具有完全的灵活性,例如使用更多或更少的信号和/或轮次、不同数量的荧光团、每个标签的总信号数量
→
与大量靶标(例如100,这些需要8轮才能获得相同水平的置信度)相比,可以在更少轮次(例如4轮)中以高置信度识别更少的靶标数量(例如20),即使在两种情况下都使用完全相同的唯一标签。
[0138]
b)在许多连续杂交轮次中使用(再循环)所有唯一标签,并且所有初级探针在每一轮鉴定中贡献(提供关于其身份的信息)。
[0139]
c)所有标签共享相同的预定义属性(例如,允许选择性变性的热力学稳定性)。
[0140]
d)
[0141]
在一些有利实施方式中,唯一标签设计如下:
[0142]-在过程中的所有寡核苷酸(探针、解码物(decoder)、读出(readout))之间没有交叉杂交,因此所有标签序列都可以一起使用(兼容)
[0143]-不同唯一标签的连接物元件(桥)之间没有交叉杂交
[0144]-唯一标签的杂交稳定性应在窄范围内:尽可能稳定(快速杂交,即短循环时间),但与初级探针(用于差异变性,不除去初级探针)相比显著不同(在这种情况下不太稳定)
[0145]
因此,本说明书尤其涉及使用标记的和未标记的核酸序列组用于经由特异性杂交平行地对不同分析物进行特异性定量和/或空间检测。与可用的不同检测信号相比,该技术允许区分更多不同的分析物。区分是经由分析物的顺序信号编码来实现的,这些信号编码是通过几个循环的特异性杂交、信号检测和杂交核酸序列的选择性洗脱来实现的。与其他最先进的方法相比,提供可检测信号的寡核苷酸不直接与样品特异性核酸序列相互作用,而是由所谓的“解码寡核苷酸”介导。这种机制解耦了分析物特异性寡核苷酸和信号寡核苷酸之间的依赖性。解码寡核苷酸的使用允许更高的灵活性,同时显著减少所需的不同信号寡核苷酸的数量,这反过来又增加了通过一定数量的检测轮次实现的编码能力。解码寡核苷酸的使用导致了顺序信号编码技术,例如比其他方法更灵活、更便宜、更简单、更快速和/或更准确。
[0146]
根据本公开的包括亚组特异性探针的试剂盒和方法的使用的实例是:
[0147]
1.)癌症研究中的融合转录物检测
[0148]
生成嵌合蛋白质的基因融合事件是多种癌症类型的致病因素,占全部肿瘤的大约20%(mitelman 2007)。rna融合的检测促进了各种肿瘤的分子表征和诊断(neckles 2020综述)。最近批准的靶向致癌融合转录物以降解的分子表明这些是有前途的治疗靶标。然而,需要更详细地了解致癌融合转录物的肿瘤间和肿瘤内多样性,理想地在细胞水平上,或者甚至是亚细胞分辨率。
[0149]
·
mitelman,f.,johansson,b.,&mertens,f.(2007):the impact of translocations and gene fusions on cancer causation.nature reviews.cancer,7
(4),233
–
245.
[0150]
·
neckles,c,sundara rajan,s,caplen,nj.(2020):fusion transcripts:unexploited vulnerabilities in cancer?wires rna;11:e1562.https://doi.org/10.1002/wrna.1562
[0151]
2.)rna亚组(可变剪接)
[0152]
rna剪接是基因表达的基本过程,并且可变剪接在转录物组复杂性、细胞类型分化和生物发育中起着重要作用。剪接产物的检测很重要,因为异常剪接会导致多种疾病,包括癌症和神经变性。个体细胞之间的剪接变异性是基因表达异质性的主要原因。在单个细胞水平上研究rna剪接变体将有助于破译调节回路,以及分类和理解细胞类型和亚型(walks 2011)。之前应用单分子fish(smfish)来检测rna剪接变体。vargas(2011)能够检测未剪接的前体mrna、剪接的内含子,并且在单个细胞中同时检测剪接的mrna,但这不允许任何多重化。
[0153]
·
t.maniatis,b.tasic.(2002):alternative pre-mrna splicing and proteome expansion in metazoans.nature,418,pp.236-243
[0154]
·
z.waks,a.m.klein,p.a.silver.(2011):cell-to-cell variability of alternative rna splicing.mol.syst.biol.,7,p.506
[0155]
·
d.y.vargas,k.shah,m.batish,m.levandoski,s.sinha,s.a.marras,p.schedl,s.tyagi.(2011):single-molecule imaging of transcriptionally coupled and uncoupled splicing.cell,147,pp.1054-1065
[0156]
3.)病毒转录物长度
[0157]
许多病毒基因组包含多个启动子,其可导致各种长度的mrna种类,其中一些具有一些共同部分。检测确切的长度和组成对于了解病毒感染的当前阶段至关重要。例如,hbv基因组充当了合成多个基因组和亚基因组病毒mrna转录物的模板:四个病毒启动子(core、pre s1、pre s2和x)以及两个增强子(增强子i和增强子ii)控制hbv的转录(zheng 2004)。这些亚基因组mrna转录物中每一个的量化是了解感染阶段和复制状态的关键。
[0158]
·
zheng,y.,li,j.&ou,j.(2004):regulation of hepatitis b virus core promoter by transcription factors hnf1 and hnf4 and the viral x protein regulation of hepatitis b virus core promoter by transcription factors hnf1 and hnf4 and the viral x protein.78,6908
–
6914
[0159]
在详细描述本公开之前,应当理解,本公开不限于所描述的方法的步骤的特定组成部分。还应当理解,本文使用的术语仅用于描述特定实施方式的目的,并且不旨是限制性的。必须注意,除非上下文另有明确规定,否则如在说明书和所附权利要求中使用的,单数形式“一个(a)”“一种(an)和“该/所述(the)”包括单数和/或复数引用。此外应当理解,在给出由数值界定的参数范围的情况下,该范围被认为包括这些限制值。
附图说明
[0160]
图1:其中分析物是核酸并且探针组包括与分析物特异性结合的寡核苷酸的实施方式。探针包括允许解码寡核苷酸杂交的唯一标识符序列。
[0161]
图2:其中分析物是蛋白质并且探针组包含与分析物特异性结合的蛋白质(这里:
抗体)的实施方式。探针包括允许解码寡核苷酸杂交的唯一标识符序列。
[0162]
图3:根据本公开的方法的流程图。
[0163]
图4:解码和信号寡核苷酸应用的替代选择。
[0164]
图5:通过两种不同信号类型和三轮检测对三种不同核酸序列进行信号编码的实例;在此实例中,编码方案包括错误检测。
[0165]
图6:生成的码字的数量(对数刻度)对比于检测循环的数量。
[0166]
图7:基于单步效率计算的5轮编码方案的总效率。
[0167]
图8:不同实验之间相对转录物丰度的比较。
[0168]
图9:不同实验之间相对转录物丰度的相关性。
[0169]
图10:细胞间信号分布的比较。
[0170]
图11:细胞内信号分布的比较。
[0171]
图12:不同细胞周期依赖性转录物的分布模式。
[0172]
图13:使用具有2个标签(a和b)和没有标签(-)的8轮代码检测多个靶标。表示靶标1、2、3、4、5、20和n。表示编码方案的第1、2、3和8轮。
[0173]
图14:可以通过使用可检测标志物的编码方案执行多个靶标的检测。结束方案还可以包括“0”作为标志物。这意指在特定位置未检测到转录物。因此,编码方案可以由仅使用两种基因特异性探针的以下构建体表示:
[0174]
1)具有可检测标记f:成像期间可检测
[0175]
2)具有可检测标记f和淬灭剂q:成像期间不可检测
[0176]
3)具有淬灭剂q:成像期间不可检测
[0177]
4)没有标记f:成像期间不可检测
[0178]
5)没有信号寡核苷酸:成像期间不可检测
[0179]
6)具有不能募集信号寡核苷酸的解码物寡核苷酸
[0180]
7)没有解码物寡核苷酸:成像期间不可检测
[0181]
图15:使用额外的亚组特异性探针组来检测不同靶标的亚组(第0轮)。该程序包括接触共同(共享)部分中的分析物特异性探针组,另外,还使亚组特异性探针组与亚组决定(独占)部分接触(参见第1轮;描述,a2)。使用与共享部分(第1至4轮)结合的探针组来检测分析物,使用还描述的解码方案。第5轮:在至少一个专用轮次中,仅检测到亚组特异性探针组。然后将靶标的独占部分的存在与前几轮的结果相结合,从而可以区分第1组中的亚组2’和第2组中的亚组2’。
[0182]
图16:多解码物的可能结构。数字描述了实例。(a)是唯一标识符序列,(a)是解码寡核苷酸或多解码物的相应序列,以及(c1)至(c3)是不同的序列元件,它们与不同的信号寡核苷酸特异性结合。实例2至5示出了多解码物的不同版本。不同序列元件的顺序以及信号寡核苷酸结合元件的数量是不固定的。实例1示出了正常的解码寡核苷酸,因为只有一个信号寡核苷酸结合元件(c1)。
[0183]
图17:通过使用多解码物和产生三种不同信号类型的两种不同的信号寡核苷酸和三轮检测对三种不同的核酸序列进行信号编码的实例。在该实例中,编码方案包括错误检测和纠正。
[0184]
图18:生成的码字的数量(对数刻度)对比于检测循环的数量。merfish的码字数量
不会随着检测循环的数量呈指数增长,但随着每个增加的轮次而变得不那么有效。相比之下,对于intronseqfish、不使用多解码物的本公开的方法、具有多解码物的方法,码字数量呈指数增长。使用多解码物的方法的曲线斜率远高于在先发明的曲线斜率,导致在20轮检测后可用的码字超过20 000 000倍。
具体实施方式
[0185]
本文公开了用于检测样品中不同分析物以及分析物的不同亚组/变异体的新型多重方法和试剂盒。
[0186]
本公开描述了使用标记的和未标记的核酸序列组用于经由特异性杂交来平行地对不同分析物进行特异性定量和/或空间检测。与可用的不同检测信号相比,该技术允许区分更多不同的分析物。可以经由分析物的顺序信号编码来实现区分,这些信号编码是通过几个循环的特异性杂交、信号检测和杂交核酸序列的选择性洗脱来实现的。
[0187]
与其他最先进的方法相比,提供可检测信号的寡核苷酸不直接与样品特异性核酸序列相互作用,而是由所谓的“解码寡核苷酸”介导。这种机制解耦了分析物特异性寡核苷酸和信号寡核苷酸之间的依赖性。解码寡核苷酸的使用允许更高的灵活性,同时显著减少所需的不同信号寡核苷酸的数量,这反过来又增加了通过一定数量的检测轮次实现的编码能力。
[0188]
解码寡核苷酸的使用导致了顺序信号编码技术,它比其他方法更灵活、更便宜、更简单、更快速和/或更准确。
[0189]
a.定义
[0190]
根据本公开,“分析物”是被特异性检测为存在或不存在于样品中并且在其存在的情况下对其进行编码的对象。其可以为任何种类的实体,包括目的蛋白质、多肽、蛋白质或核酸分子(例如rna、pna或dna)。分析物提供用于与分析物特异性探针特异性结合的至少一个位点。有时在本文中术语“分析物”由“靶标”代替。根据本公开的“分析物”包括对象(例如至少两个个体核酸、蛋白质或肽分子)的复合物。在本公开的实施方式中,“分析物”不包括染色体。在本公开的另一实施方式中,“分析物”不包括dna。根据本公开的术语“分析物”可以包括以下项的组:相同分析物的不同变异体/实施方式,例如分析物的剪接变体、包括不同内含子和/或外显子的变异体、包括utr的序列和/或具有不同长度的序列。尤其,基本序列和变异体具有至少50%、至少75%、至少80%、至少85%、至少90%或至少95%的序列同一性。
[0191]
在一些实施方式中,分析物可以是“编码序列(coding sequence)”、“编码序列(encoding sequence)”、“结构核苷酸序列”或“结构核酸分子”,其是指当处于适当调控序列的控制下时通常经由mrna被翻译成多肽的核苷酸序列。编码序列的边界由5'-末端的翻译起始密码子和3'-末端的翻译终止密码子决定。编码序列可以包括但不限于基因组dna、cdna、est和重组核苷酸序列。
[0192]
如本文所指的“样品”是怀疑包括待编码的分析物的呈液体或固体形式的组合物。尤其,样品是生物样品,优选包括生物组织,进一步优选包括生物细胞和/或提取物和/或细胞的部分。例如,细胞是原核细胞或真核细胞,尤其是哺乳动物细胞,尤其是人细胞。在一些实施方式中,生物组织、生物细胞、提取物和/或细胞的部分是固定的。尤其,分析物固定在
透化样品,诸如包含细胞的样品中。
[0193]
如在本公开中使用的,“细胞”、“细胞系”和“细胞培养物”可以互换使用,并且所有这些名称都包括后代。因此,词语“转化体”或“转化细胞”包括原代对象细胞和由其衍生的培养物,而不考虑转移次数。还可以理解,由于有意或无意的突变,所有后代的dna含量可能并不完全相同。包括与在最初转化的细胞中筛选的具有相同功能的突变后代。
[0194]“编码方案”可以描述与待检测的分析物相关联的码字组。每个码字涉及分析物之一,并且可以与所有其他码字区分开来。码字在此是由方法的检测循环提供的符号序列。码字内的符号是可检测的信号或不存在信号。码字不需要包括在方法中使用的所有不同信号。码字中符号的数量由检测循环的数量定义。
[0195]
如本文所用,“寡核苷酸”是指短核酸分子,诸如dna、pna、lna或rna。取决于连续序列元件的数量,寡核苷酸的长度在4-200个核苷酸(nt)、优选6-80nt、更优选8-60nt、更优选10-50nt、更优选12至35nt的范围内。核酸分子可以是完全或部分单链的。寡核苷酸可以是线性的或可以包括发夹或环结构。寡核苷酸可以包括修饰,诸如生物素、标记部分、封闭部分或其他修饰。
[0196]“分析物特异性探针”由至少两个元件组成,即与分析物之一特异性相互作用的所谓结合元件(s),以及包括
‘
唯一标识符序列’的所谓标识符元件(t)。结合元件(s)可以是核酸诸如杂交序列或适配体,或肽结构诸如抗体。
[0197]
尤其,在一些实施方式中,结合元件(s)包括以下部分,该部分是来自亲和物质的亲和部分或是亲和物质整体,该亲和物质选自由以下项组成的组:抗体、抗体片段、受体配体、酶底物、凝集素、细胞因子、淋巴因子、白介素、血管生成或毒力因子、变应原、肽变应原、重组变应原、变应原独特型抗体、自身免疫引发结构、组织排斥诱导结构、免疫球蛋白恒定区及其衍生物、突变体或其组合。在另外有利的实施方式中,抗体片段是fab、scfv;单个结构域或其片段、双scfv、fab2、fab3、微型抗体、巨型抗体、双抗体、三抗体、四抗体或tandab,尤其是单链可变区片段(scfv)。
[0198]
与其他唯一标识符相比,分析物特异性探针所包括的“唯一标识符序列”在其序列中是唯一的。在本上下文中,“唯一”意指它仅特异性识别一种分析物,诸如周期蛋白a、周期蛋白d、周期蛋白e等,或替代地,它仅特异性识别分析物组,而不依赖于分析物组是否包括基因家族。因此,待由该唯一标识符编码的分析物或分析物组可以基于标识符元件(t)的唯一标识符序列与待编码的所有其他分析物或分析物组区分开来。或者,换句话说,对于特定分析物或分析物组只有一个“唯一标识符序列”,但不超过一个,即甚至不是两个。由于唯一标识符序列的唯一性,标识符元件(t)与恰好一种类型的解码寡核苷酸杂交。唯一标识符序列的长度在8-60nt、优选12-40nt、更优选14-20nt的范围内,这取决于平行编码的分析物的数量和所需的相互作用的稳定性。唯一标识符可以是分析物特异性探针的序列元件,直接或通过接头、共价键或高亲和力结合模式来附接,例如抗体-抗原相互作用、链霉亲和素-生物素相互作用等。应当理解,术语“分析物特异性探针”包括多个探针,其可能以以下方式在其结合元件(s)方面不同:每个探针结合相同的分析物但可能结合其不同的部分,譬如待编码的核酸分子所包括的核苷酸序列的不同(例如相邻)或重叠部分。然而,多个探针中的每一个都包括相同的标识符元件(t)。
[0199]“解码寡核苷酸”由至少两个序列元件组成。可以特异性结合唯一标识符序列的一
个序列元件,称为“标识符连接物元件”(t)或“第一连接物元件”(t),以及特异性结合信号寡核苷酸的第二序列元件,称为“翻译物元件”(c)。序列元件的长度在8-60nt、优选12-40nt、更优选14-20nt的范围内,这取决于待平行编码的分析物的数量、所需相互作用的稳定性以及使用的不同信号寡核苷酸的数量。两个序列元件的长度可以相同或可以不同。
[0200]
在一些有利的实施方式中,本公开的试剂盒和/或方法中的解码寡核苷酸可以是“多解码物”。“多解码物”是由至少三个序列元件组成的解码寡核苷酸。一个序列元件(标识符连接物元件(t))可以特异性结合唯一标识符序列(标识符元件(t)),以及至少两个其他序列元件(翻译物元件(c))特异性结合不同的信号寡核苷酸(这些序列元件中的每一个特异性结合信号寡核苷酸,该信号寡核苷酸不同于由多解码物的其他元件募集的所有其他信号寡核苷酸)。序列元件的长度在8-60nt、优选12-40nt、更优选14-20nt的范围内,这取决于平行检测的分析物的数量、所需的稳定性和使用的不同信号寡核苷酸的数量。序列元件的长度可以相同或可以不同。
[0201]
因此,在一些有利的实施方式中,解码寡核苷酸是包括以下项的多解码物:
[0202]-标识符连接物元件(t),包括与相应分析物特异性探针组的标识符元件(t)的唯一标识符序列的至少一部分基本上互补的核苷酸序列,以及
[0203]-至少两个翻译物元件(c),其各自包括允许不同信号寡核苷酸特异性杂交的核苷酸序列。
[0204]
因此,第一翻译物元件与第二翻译物元件结合不同的信号寡核苷酸。尤其,信号寡核苷酸的不同之处在于信号寡核苷酸中包括的信号元件,例如荧光团的种类。
[0205]
如本文所用的“信号寡核苷酸”包括至少两个元件,即所谓的“翻译连接物元件”(c)或“第二连接物元件”(c),其具有可与解码寡核苷酸的翻译物元件(c)的核苷酸序列的至少一部分特异性杂交的核苷酸序列,以及提供可检测信号的“信号元件”。该元件可以主动生成可检测信号或经由操纵(例如荧光激发)提供这样的信号。典型的信号元件是例如催化可检测反应的酶、荧光团、放射性元素或染料。
[0206]“组”是指多个部分或对象,例如分析物特异性探针或解码寡核苷酸,无论所述多个的个体成员是否彼此相同或不同。在分析物特异性探针组中,分析物特异性探针在标识符元件(t)中是相同的,但可以包括不同的结合元件(s),用于与相同分析物特异性相互作用但用于与待编码的相同分析物的不同亚结构特异性相互作用。
[0207]“选择性变性”可以是以下项的过程:以最高效率去除结合的解码寡核苷酸和信号寡核苷酸,同时靶标特异性探针必须以最高效率保持杂交。这两个组合事件的总效率可以至少为:两个检测循环为0.22、三个检测循环为0.37、四个检测循环为0.47、五个检测循环为0.55、六个检测循环为0.61、七个检测循环为0.65、八个检测循环为0.69,九个检测循环为0.72和10个检测循环为0.74、11个检测循环为0.76、以及12个检测循环为0.78。
[0208]
在本公开的实施方式中,单组是指多个寡核苷酸
[0209]“分析物特异性探针组”是指多个部分或对象(例如分析物特异性探针),其彼此不同并与分析物的独立区域结合。单个分析物特异性探针组至少由相同的唯一标识符另外表征。
[0210]“亚组特异性探针组”可以包括与“分析物特异性探针组”相同的特性,但在编码和解码信息方面不同。“亚组特异性探针组”仅用于向已经由“分析物特异性探针组”编码的代
码添加信息(主要是存在/不存在)。
[0211]
分析物的“亚组”或也称为“变异体”是指分析物的实施方式,其中变异体包括相同分析物的所有实施方式(或变异体)中包括的共同或“共享”元件(例如,相同的核酸序列)以及将分析物(靶标)亚组/变异体彼此和/或与基本分析物区分开来的至少一个额外元件。
[0212]
在一些实施方式中,具有一组至少五(5)个的至少一种分析物的亚组/变异体与亚组特异性探针接触,该亚组特异性探针与另一分析物特异性探针组的分析物特异性探针在方面不同标识符元件(t)的核苷酸序列。
[0213]“解码寡核苷酸组”是指对独立于码字长度实现编码所需的某个特定唯一标识符特异的多个解码寡核苷酸。“解码寡核苷酸组”中包括的每个解码寡核苷酸和所有解码寡核苷酸结合分析物特异性探针的相同唯一标识符元件(t)。
[0214]
在某些实施方式中,解码寡核苷酸的这种结合或杂交模式可以转化为“码字”。例如,对于分析物,码字也可以是“101”和“110”,其中值1表示结合,以及值0表示没有结合。在其他实施方式中,码字也可以具有更长的长度(参见图13)。码字可以与分析物特异性探针的特异性唯一标识符序列直接相关。因此,不同的分析物特异性探针可以匹配某些码字,然后可以基于解码寡核苷酸的结合模式来用于识别分析物特异性探针的不同分析物。然而,如果没有明显的结合,那么在本实例中码字将是“000”。
[0215]
在一些实施方式中,每个码字中的值也可以以不同的方式分配。例如,值0可以表示结合,而值1表示没有结合。类似地,值1可以表示二级核酸探针与一种类型的信号实体的结合,而值0可以表示二级核酸探针与另一种类型的可区分的信号实体的结合。例如,可以经由荧光的不同颜色来区分这些信号实体。在一些情况下,码字中的值不必局限于0和1。这些值也可以从较大的字母中提取,诸如三元(例如,0、1和2)或四元(例如,0、1、2、和3)系统。例如,每个不同的值可以由不同的可区分信号实体来表示,包括(在某些情况下)可以由信号的缺失来表示的一个值。
[0216]
用于每种分析物的码字可以按顺序分配,也可以随机分配。例如,第一分析物可以分配至101,而第二核酸靶标可以分配至110。另外,在一些实施方式中,可以使用错误检测系统或错误纠正系统,诸如汉明系统(hamming system)、戈莱码(golay code)或扩展汉明系统(或secded系统,即单错误纠正、双错误检测)来分配码字。一般而言,这样的系统可用于识别发生错误的位置,并且在一些情况下,这样的系统还可用于纠正错误并确定正确的码字应该是什么。例如,码字诸如001可以被检测为无效并且使用这样的系统将其纠正为101,例如,如果001之前没有被分配给不同的靶序列。可以使用多种不同的错误纠正代码,其中许多以前已开发用于计算机行业;然而,这样的错误纠正系统通常没有在生物系统中使用。这样的错误纠正代码的额外实例在下文更详细讨论。
[0217]“基本上互补”意指,当提及两个核苷酸序列时,两个序列可以在严格条件下彼此特异性杂交,从而形成具有经由氢键(沃森-克里克(watson-and-crick)碱基对)相互连接的正义链和反义链的杂交核酸分子。“基本上互补”不仅包括沿整个链的完美碱基配对,即完美互补序列,还包括不完美互补序列,然而,其在严格条件下仍具有相互杂交的能力。在专家中,公知的是“基本上互补”序列与完全或完美互补序列具有至少88%的序列同一性。
[0218]“百分比序列同一性”或“百分比同一性”继而意指,在将待比较的序列(“比较序列”)与描述的或要求保护的序列(“参考序列”)比对之后,将序列与要求保护的或描述的序
列进行比较。然后根据下式确定百分比同一性:百分比同一性=100[1-(c/r)]
[0219]
其中,c是在参考序列和比较序列之间的比对长度上参考序列和比较序列之间的差异数,其中
[0220]
(i)在比较序列中没有对应的比对碱基或氨基酸的参考序列中的每个碱基或氨基酸,以及
[0221]
(ii)参考序列中的每个缺空位(gap)以及
[0222]
(iii)与比较序列中的比对碱基或氨基酸不同的参考序列中的每个比对碱基或氨基酸构成差异,以及(iiii)比对必须从比对序列的位置1开始;
[0223]
并且r是在与比较序列比对的整个长度上参考序列中碱基或氨基酸的数量,参考序列中产生的任何空位也被计为碱基或氨基酸。
[0224]
如果存在于比较序列和参考序列之间的比对如上计算的百分比同一性约等于或大于指定的最小百分比同一性,则比较序列与参考序列具有指定的最小百分比同一性,即使比对可能存在其中上面计算的同一性百分比小于指定的同一性百分比的地方。
[0225]
在如本文所理解的“温育”步骤中,在技术人员熟知的允许特异性结合或杂交反应的条件,例如ph、温度、盐条件等下,使各自部分或对象诸如探针或寡核苷酸彼此接触。因此,这些步骤可以优选在液体环境诸如本领域公知的缓冲系统中实施。
[0226]
根据本公开的“除去”步骤可以包括通过如本领域已知的某些条件,例如ph、温度、盐条件等,将待除去的部分或对象诸如探针或寡核苷酸洗去。
[0227]
应当理解,在根据本公开的方法的实施方式中,可以平行编码多种分析物。这需要在步骤(1)中使用不同的分析物特异性探针组。特定组的分析物特异性探针不同于另一组的分析物特异性探针。这意指组1的分析物特异性探针与分析物1结合,组2的分析物特异性探针与分析物2结合,组3的分析物特异性探针与分析物3结合,等等。在该实施方式中,在根据本公开的方法中还需要使用不同的解码寡核苷酸组。
[0228]
特定组的解码寡核苷酸不同于另一组的解码寡核苷酸。这意指,组1的解码寡核苷酸与上述分析物特异性探针组1的分析物特异性探针结合,组2的解码寡核苷酸与上述分析物特异性探针组2的分析物特异性探针结合,组3的解码寡核苷酸与上述分析物特异性探针组3的分析物特异性探针结合,等等。
[0229]
在其中多种分析物待平行编码的该实施方式中,不同的分析物特异性探针组可以作为不同的分析物特异性探针组的预混合物提供和/或不同的解码寡核苷酸组可以作为不同的解码寡核苷酸组的预混合提供。每种混合物可以包含在单个小瓶中。替代地,不同的分析物特异性探针组和/或不同的解码寡核苷酸组可在步骤中单独提供。
[0230]“试剂盒”是可用于实施本公开的用途和/或方法的个体元件的组合,其中这些元件优化在方法中一起使用。试剂盒还可以包含额外的试剂、化学品、缓冲液、反应小瓶等,它们可用于实施根据本公开的方法。这样的试剂盒统一了根据本公开的方法工作所需的所有基本要素,因此使错误风险最小化。因此,这样的试剂盒还允许半熟练的实验室工作人员执行根据本公开的方法。
[0231]
术语“猝灭剂”或“猝灭剂染料”或“猝灭剂分子”是指够降低荧光报告染料或供体染料的荧光的染料或等效分子,诸如核苷鸟苷(g)或2'-脱氧鸟苷(dg)。猝灭剂染料可以是荧光染料或非荧光染料。当猝灭剂是荧光染料时,其荧光波长通常与报告染料的波长显著
不同,并且在测定期间通常不监测猝灭剂荧光。本公开的一些实施方式公开了包括猝灭剂和/或猝灭剂与信号元件的组合的信号寡核苷酸(参见图14),并且因此在成像期间信号寡核苷酸不可检测。
[0232]
在本公开的实施方式中,样品是生物样品,优选包括生物组织,进一步优选包括生物细胞。生物样品可以来源于器官、类器官、细胞培养物、干细胞、细胞悬液、原代细胞、被病毒、细菌或真菌感染的样品、真核或原核样品、涂片、疾病样品、组织切片。
[0233]
该方法特别适用于编码、鉴定、检测、计数或量化生物样品中的分析物或单个分析物分子,即诸如包含核酸或蛋白质作为所述分析物的样品。应当理解,生物样品可以是其在其自然环境中的形式(即,液体、半液体、固体等),或者是经过加工的,例如,作为装置表面上的干燥薄膜,其可以在实施该方法之前重新液化。
[0234]
在本公开的另一实施方式中,在步骤(2)之前,将生物组织和/或生物细胞固定。例如,在一些实施方式中,在引入探针之前将细胞和/或组织固定,例如以保持分析物如核酸在细胞内的位置。用于固定细胞的技术是本领域普通技术人员已知的。作为非限制性实例,可以使用化学品诸如甲醛、多聚甲醛、戊二醛、乙醇、甲醇、丙酮、乙酸等来固定细胞。在一种实施方式中,可以使用hepes-谷氨酸缓冲液介导的有机溶剂(hope)来固定细胞。
[0235]
这种措施具有的优点是待编码的分析物例如核酸或蛋白质是固定的并且不能逃逸。在这样做时,分析物然后准备好通过根据本公开的方法进行更好的检测或编码。
[0236]
在分析物特异性探针组内的又另外的实施方式中,个体分析物特异性探针包括与待编码的分析物之一的不同亚结构特异性相互作用的结合元件(s1、s2、s3、s4、s5)。
[0237]
通过这种措施,该方法变得更加稳健和可靠,因为分别在方法或循环结束时获得的信号强度增加了。应当理解,一组中的个体探针在与相同分析物结合时在它们在分析物处或分析物上的结合位置或结合位点不同。第一、第二、第三、第四、第五等分析物特异性探针的结合元件s1、s2、s3、s4、s5等因此结合到或结合在不同的位置上,然而,该位置可以重叠或可以不重叠。
[0238]
在有利的实施方式中,本公开涉及用于多重分析物编码的试剂盒,其包括:
[0239]
(a)用于编码至少20种不同分析物的至少二十(20)个不同的分析物特异性探针组,每个分析物特异性探针组与不同的分析物相互作用,其中,如果分析物是核酸,则每个分析物特异性探针组包括与相同分析物的不同亚结构特异性相互作用的至少五(5)种分析物特异性探针,以及任选地,还有至少一个亚组特异性探针组以区分具有分析物的共享和独占部分的靶标(分析物/变异体),每种分析物特异性探针包括
[0240]
(aa)结合元件(s),与待编码的不同分析物之一特异性相互作用,以及
[0241]
(bb)标识符元件(t),包括对于待编码的分析物唯一的核苷酸序列(唯一标识符序列),
[0242]
其中,特定分析物特异性探针组的分析物特异性探针与另一分析物特异性探针组的分析物特异性探针在标识符元件(t)的核苷酸序列方面不同,
[0243]
其中,每个分析物特异性探针组中的分析物特异性探针与相同的分析物结合并且包括对于所述分析物唯一的标识符元件(t)的相同核苷酸序列;以及
[0244]
(b)每种分析物的至少一个解码寡核苷酸组,其中,在用于个体分析物的每个解码寡核苷酸组中,每个解码寡核苷酸包括:
[0245]
(aa)标识符连接物元件(t),包括与相应分析物特异性探针组的标识符元件(t)的唯一标识符序列的至少一部分基本上互补的核苷酸序列,以及
[0246]
(bb)翻译物元件(c),包括允许信号寡核苷酸特异性杂交的核苷酸序列;
[0247]
其中,用于个体分析物的一组解码寡核苷酸与用于不同分析物的另一组解码寡核苷酸在所述标识符连接元件(t)方面不同;以及
[0248]
(c)信号寡核苷酸组,每个信号寡核苷酸包括:
[0249]
(aa)翻译物连接物元件(c),包括与解码寡核苷酸中包括的翻译物元件(c)的核苷酸序列的至少一部分基本上互补的核苷酸序列,以及
[0250]
(bb)信号元件。
[0251]
根据本公开,多重方法或测定允许同时测量多种分析物,其可以用于确定样品中多种预定(已知)分析物(如核酸靶标序列)的存在或不存在。分析物可以是“预定”的,因为它的序列是已知的以设计成与该靶标结合的探针。
[0252]
在根据本公开的一些有利的实施方式中,平行地检测和/或量化样品中的至少20种、尤其至少25种、尤其至少30种不同的分析物。例如,可以有至少5个、至少10个、至少20个、至少50个、至少75个、至少100个、至少300个、至少1,000个、至少3,000个、至少10,000个或至少30,000个施用于样品(例如同时或依次)的可区分的分析物特异性探针。
[0253]
在用于多重化的一些有利实施方式中,需要二十(20)个或更多个不同的分析物特异性探针组用于编码至少20种或更多种不同的分析物,尤其多于50种、多于100种或多于200种。本公开的多重方法中,尤其靶向至少20个不同的分析物(例如mrna分子)(即标签)组。
[0254]
在有利的实施方式中,该试剂盒包括每种分析物至少两个不同的分析物特异性探针组,
[0255]
其中,这些不同组中包括的分析物特异性探针与相同分析物相互作用,但与相同分析物的不同亚结构特异性相互作用,
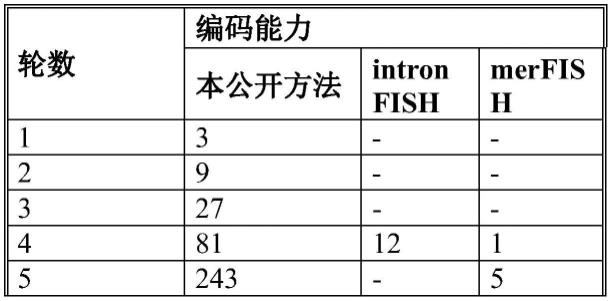
[0256]
其中,第一分析物特异性探针组的分析物特异性探针与分析物的所有变异体中包括的亚结构相互作用,
[0257]
其中,第二分析物特异性探针组的分析物特异性探针(亚组特异性探针组)与仅在该分析物的特定变异体中包括的亚结构相互作用,
[0258]
其中,第一分析物特异性探针组的分析物特异性探针包括相同的标识符元件(t),该标识符元件包括对于待编码的分析物唯一的核苷酸序列(唯一标识符序列),并且
[0259]
其中,第二分析物特异性探针组的分析物特异性探针包括相同的标识符元件(t),该标识符元件包括对于待编码的分析物唯一的核苷酸序列(唯一标识符序列),
[0260]
其中,第一分析物特异性探针组的分析物特异性探针的标识符元件(t)与第二分析物特异性探针组的分析物特异性探针的标识符元件(t)不同,以结合不同的解码寡核苷酸和/或非信号解码寡核苷酸。
[0261]
在一些有利的实施方式中,实施至少4轮来收集用于识别分析物的信息,其中,多次读出提高了识别的准确性并避免了假阳性。唯一标签可以通过各种技术来识别,包括例如利用标记的探针直接或间接杂交,或通过测序(通过合成、连接)。尤其,标签的身份可以用一个单一信号(二进制代码)、两个或更多个信号编码,其中,信号可以是荧光标记(例如
与寡核苷酸附接的)。
[0262]
在根据本公开的一些有利实施方式中,试剂盒不包括如a)项下定义的分析物特异性探针组。
[0263]
优选地,如果根据本公开的试剂盒或方法中的分析物是核酸,则每个分析物特异性探针组包括至少五(5)种分析物特异性探针,尤其至少十(10)种分析物特异性探针,尤其至少十五(15)种分析物特异性探针,尤其至少二十(20)种分析物特异性探针,其与相同分析物的不同亚结构特异性相互作用。核酸分析物包括特定的dna分子,例如基因组dna、核dna、线粒体dna、病毒dna、细菌dna、细胞外或细胞内dna等,以及特定的mrna分子,例如hnrna、mirna、病毒rna、细菌rna、细胞外或细胞内rna等。
[0264]
优选地,如果根据本公开的试剂盒或方法中的分析物是肽、多肽或蛋白质,则每个分析物特异性探针组包括至少两(2)种分析物特异性探针,尤其至少三(3)种分析物特异性探针,尤其至少四(4)种分析物特异性探针,其与相同分析物的不同亚结构特异性相互作用。
[0265]
在根据本公开的一些有利实施方式中,试剂盒包括至少两个不同的信号寡核苷酸组,其中,每组中的信号寡核苷酸包括不同的信号元件并且包括不同的连接物元件(c)。
[0266]
尤其,试剂盒可以包括每种分析物的至少两个不同的解码寡核苷酸组,其中,包括在这些不同组中的解码寡核苷酸包括相同的标识符连接物元件(t),该标识符连接物元件包括与相应分析物特异性探针组的标识符元件(t)的唯一标识符序列的至少一部分基本上互补的核苷酸序列,并且其中,每种分析物的不同组的解码寡核苷酸在翻译物元件(c)方面不同,该翻译物元件(c)包括允许信号寡核苷酸特异性杂交的核苷酸序列。
[0267]
在一些实施方式中,试剂盒可以包括每种分析物的至少两个不同的解码寡核苷酸组,其中,包括在这些不同组中的解码寡核苷酸包含相同的标识符连接物元件(t),该标识符连接物元件(t)包括与相应分析物特异性探针组的标识符元件(t)的唯一标识符序列的至少一部分基本上互补的核苷酸序列,并且其中,用于至少一种分析物的不同组的解码寡核苷酸在翻译物元件(c)方面不同,该翻译物元件(c)包括允许信号寡核苷酸特异性杂交的核苷酸序列。
[0268]
在一些有利的实施方式中,包括不同翻译物元件(c)的每种分析物的不同的解码寡核苷酸组的数量对应于包括不同连接物元件(c)的不同的信号寡核苷酸组的数量。然而,特定解码寡核苷酸组中的解码寡核苷酸与对于特定分析物唯一的相同标识符元件(t)相互作用。尤其,用于不同分析物的所有解码寡核苷酸组可以包括一种或多种相同类型的一个或多个翻译物元件(c)。
[0269]
在另一方面,本公开总体上涉及包括以下动作的方法:将样品暴露于多种分析物特异性探针;对于每种分析物特异性探针,确定样品内分析物特异性探针的结合;基于分析物特异性探针、解码寡核苷酸和信号寡核苷酸的结合产生码字;并且对于至少一些码字,将码字与有效码字匹配。在某些实施方式中,分析物特异性探针、解码寡核苷酸和信号寡核苷酸的这种结合或杂交模式可以转化为“码字”。例如,譬如,对于第一分析物和第二分析物,码字可以分别为“101”和“110”,其中值1表示以下项的结合,以及值0表示以下项没有结合:解码寡核苷酸的结合和/或信号寡核苷酸的结合,没有和/或淬灭信号元件。因此,检测轮次/循环中的分析物在成像期间是不可检测的。
[0270]
为了在个体分析物的码字中产生这样的零(0),试剂盒可以包括:
[0271]
(d)用于与分析物特异性探针的特定标识符元件(t)结合的至少一个非信号解码寡核苷酸组,其中,在相同非信号解码寡核苷酸组中的解码寡核苷酸与相同的不同标识符元件(t)相互作用,
[0272]
其中,每个非信号解码寡核苷酸包括标识符连接物元件(t),该标识符连接物元件(t)包括与唯一标识符序列的至少一部分基本上互补的核苷酸序列,并且每个非信号解码寡核苷酸不包括含有允许信号寡核苷酸特异性杂交的核苷酸序列的翻译物元件(c)。
[0273]
为了在个体分析物的码字中产生这样的零(0),试剂盒可以包括:
[0274]
(d)用于与分析物特异性探针的特定标识符元件(t)结合的至少一个非信号解码寡核苷酸组,其中,在相同非信号解码寡核苷酸组中的解码寡核苷酸与相同的不同标识符元件(t)相互作用,
[0275]
其中,每个非信号解码寡核苷酸包括标识符连接物元件(t),该标识符连接物元件包括与唯一标识符序列的至少一部分基本上互补的核苷酸序列,并且包括由于不稳定的结合序列和/或由于翻译物元件太短而不与信号寡核苷酸相互作用/结合的翻译物元件(c),该翻译物元件(c)包括允许信号寡核苷酸特异性杂交的核苷酸序列。
[0276]
在一些有利的实施方式中,试剂盒包括:
[0277]
(d)用于与分析物特异性探针的至少两个不同的标识符元件(t)结合的至少两(2)个不同的非信号解码寡核苷酸组,每个非信号解码寡核苷酸组与不同的标识符元件(t)相互作用,
[0278]
其中,每个非信号解码寡核苷酸包括标识符连接物元件(t),该标识符连接物元件(t)包括与唯一标识符序列的至少一部分基本上互补的核苷酸序列,并且每个非信号解码寡核苷酸不包括含有允许信号寡核苷酸特异性杂交的核苷酸序列的翻译物元件(c)。
[0279]
在一些有利的实施方式中,不同的非信号解码寡核苷酸组可以包括在不同的非信号解码寡核苷酸组的预混合物中或分开存在。
[0280]
此外,在一些有利的实施方式中,试剂盒可以包括:
[0281]
(e)非信号寡核苷酸组,每个非信号寡核苷酸包括:
[0282]
(aa)翻译物连接物元件(c),包括与该翻译物元件(c)的核苷酸序列的至少一部分基本上互补的核苷酸序列,以及
[0283]
(bb)猝灭剂(q),信号元件和猝灭剂(q),或不包括信号元件。
[0284]
在一些有利的实施方式中,试剂盒包括:
[0285]
(e)至少两个非信号寡核苷酸组,每个非信号寡核苷酸包括:
[0286]
(aa)翻译物连接物元件(c),包括与该翻译物元件(c)的核苷酸序列的至少一部分基本上互补的核苷酸序列,以及
[0287]
(bb)猝灭剂(q),信号元件和猝灭剂(q),或不包括信号元件。
[0288]
在一些有利的实施方式中,不同的非信号寡核苷酸组可以包括在不同的非信号寡核苷酸组的预混合物中或分开存在。
[0289]
此外,在一些实施方式中,特定解码寡核苷酸组中的解码寡核苷酸与对于特定分析物唯一的相同标识符元件(t)相互作用。
[0290]
在一些有利的实施方式中,不同的解码寡核苷酸组可以包括在不同的解码寡核苷
酸组的预混合物中或分开存在。在一些有利的实施方式中,不同的分析物特异性探针组可以包括在不同的分析物特异性探针组的预混合物中或分开存在。在一些有利的实施方式中,不同的信号寡核苷酸组可以包括在不同的信号寡核苷酸组的预混合物中或分开存在。
[0291]
在一些有利的实施方式中,提供了与探针组的唯一标识符序列特异性杂交的解码寡核苷酸和/或多解码物的混合物。在一些实施方式中,解码寡核苷酸包括至少两个序列元件,与相应探针组的唯一标识符序列互补的第一元件以及提供用于信号寡核苷酸的特异性杂交的序列的第二序列元件(翻译物元件),翻译物元件定义了募集到解码寡核苷酸的信号类型。在一些实施方式中,使用包括至少三个序列元件的多解码物,与相应探针组的唯一标识符序列互补的第一元件,以及提供用于至少两种不同信号寡核苷酸的特异性杂交的序列的至少额外的序列元件(翻译物元件)。翻译物元件定义了募集到多解码物的信号的类型。在图17中可以看到多解码物的不同可能结构。由于多解码物确实为每个翻译物元件募集了完整的信号寡核苷酸,每个通道中的信号亮度不低于解码寡核苷酸的信号亮度。
[0292]
多解码物的使用进一步提高了编码方案的效率。图17示出了使用多解码物的可能编码方案,其基于用于实例的相同条件,利用具有两个序列元件的解码寡核苷酸。可以清楚地看到,利用与图5的实例中使用的相同数量的轮次和相同数量的不同信号寡核苷酸,基于多解码物的编码方案可以产生更高的汉明距离。
[0293]
如上所述,待编码的分析物可以是核酸,优选dna、pna或rna,尤其是mrna、肽、多肽、蛋白质和/或其混合物。
[0294]
在一些有利的实施方式中,结合元件(s)包括允许与待编码的分析物特异性结合的氨基酸序列。结合元件(s)可以包括以下部分,该部分是来自亲和物质的亲和部分或是亲和物质整体,该亲和物质选自由以下项组成的组:抗体、抗体片段、anticalin蛋白质、受体配体、酶底物、凝集素、细胞因子、淋巴因子、白介素、血管生成或毒力因子、变应原、肽变应原、重组变应原、变应原独特型抗体、自身免疫引发结构、组织排斥诱导结构、免疫球蛋白恒定区及其组合。
[0295]
在一些有利的实施方式中,结合元件(s)可以包括选自由以下项组成的组的抗体或抗体片段或者是选自由以下项组成的组的抗体或抗体片段:fab、scfv;单结构域或其片段、双scfv、f(ab)2、f(ab)3、微型抗体、双抗体、三抗体、四抗体和tandab。
[0296]
本公开尤其涉及一种用于检测样品中的不同分析物的多重方法,该方法通过对所述分析物进行顺序信号编码来进行,该方法包括以下步骤:
[0297]
(a)使样品与用于编码至少20种不同分析物的至少二十(20)个不同的分析物特异性探针组接触,每个分析物特异性探针组与不同的分析物相互作用,其中,如果分析物是核酸,则每个分析物特异性探针组包括与相同分析物的不同亚结构特异性相互作用的至少五(5)种分析物特异性探针,每种分析物特异性探针包括
[0298]
(aa)结合元件(s),与待编码的不同分析物之一特异性相互作用,以及
[0299]
(bb)标识符元件(t),包括对于待编码的分析物唯一的核苷酸序列(唯一标识符序列),
[0300]
其中,特定分析物特异性探针组的分析物特异性探针与另一分析物特异性探针组的分析物特异性探针在标识符元件(t)的核苷酸序列方面不同,
[0301]
其中,每个分析物特异性探针组中的分析物特异性探针与相同的分析物结合并且
包括对于所述分析物唯一的标识符元件(t)的相同核苷酸序列;以及
[0302]
(b)使样品与每种分析物的至少一个解码寡核苷酸组接触,其中,在用于个体分析物的每个解码寡核苷酸组中,每个解码寡核苷酸包括:
[0303]
(aa)标识符连接物元件(t),包括与相应分析物特异性探针组的标识符元件(t)的唯一标识符序列的至少一部分基本上互补的核苷酸序列,以及
[0304]
(bb)翻译物元件(c),包括允许信号寡核苷酸特异性杂交的核苷酸序列;
[0305]
其中,用于个体分析物的一组解码寡核苷酸与用于不同分析物的另一组解码寡核苷酸在第一连接元件(t)方面不同;以及
[0306]
(c)使所述样品与至少一个信号寡核苷酸组接触,每个信号寡核苷酸包括:
[0307]
(aa)翻译物连接物元件(c),包括与解码寡核苷酸中包括的翻译物元件(c)的核苷酸序列的至少一部分基本上互补的核苷酸序列,以及
[0308]
(bb)信号元件。
[0309]
(d)检测由信号元件引起的信号;
[0310]
(e)从样品中选择性地除去解码寡核苷酸和信号寡核苷酸,从而基本上保持分析物特异性探针与待编码的分析物的特异性结合;
[0311]
(f)执行包括步骤b)至e)的至少三(3)个另外的循环,以生成具有每种分析物的码字的编码方案,其中尤其最后一个循环可以在步骤(d)处停止。
[0312]
如上所述,根据本公开的方法包括从样品中选择性地除去解码寡核苷酸和信号寡核苷酸,从而基本上保持分析物特异性探针与待编码的分析物的特异性结合。尤其所有步骤都按顺序进行。然而,一些步骤可以同时进行,尤其是接触步骤a)至c),尤其是b)和c)。
[0313]
通过这种措施,建立了将另外的解码寡核苷酸与相同的分析物特异性探针结合的另一轮/循环的要求,从而最终产生包括多于一个信号的代码或编码方案。该步骤通过应用技术人员熟知的条件和因素来实现,例如ph、温度、盐条件、寡核苷酸浓度、聚合物等。
[0314]
在本公开的另一个实施方式中,该方法可以包括重复步骤(b)-(e)至少三次以生成编码方案。使用这种措施,在由用户实施的四个循环/轮次的情况下,四个信号的代码,其中
‘
n’为表示轮数的整数。取决于分析物的性质和操作者的需要,根据本公开的方法的编码能力因此增加。在本公开的实施方式中,所述编码方案是预定的并且分配给待编码的分析物。
[0315]
然而,该措施能够通过提供所采用的解码和信号寡核苷酸的适当顺序实现精确的实验设置,因此,允许将特定分析物正确分配到相应的编码方案。在重复的步骤(b)-(d2)中使用的解码寡核苷酸可以包括与先前步骤(b)-(e)中使用的解码寡核苷酸的翻译物元件(c1)相同的翻译物元件(c2)。在本公开的另一实施方式中,在重复的步骤(b)-(e)中使用解码寡核苷酸包括与先前步骤(b)-(e)中使用的解码寡核苷酸的翻译物元件(c1)不同的翻译物元件(c2)。应当理解,解码元件可以或可以不逐轮(即在包括翻译物元件c2的第二轮(b)-(e)中,在包括翻译物元件c3的第三轮(b)-(e)中,在包括翻译物元件c4的第四轮(b)-(e)中等)改变等,其中
‘
n’为表示轮数的整数。
[0316]
重复步骤(b)-(e)中使用的信号寡核苷酸可包括与先前步骤(b)-(e)中使用的解码寡核苷酸的信号元件相同的信号元件。在本公开的另外实施方式中,在重复的步骤(b)-(e)中使用信号寡核苷包括与先前步骤(b)-(e)中使用的解码寡核苷酸的信号元件不同的
信号元件。在一些实施方式中,使用用于个体分析物的非信号寡核苷酸和/或非信号解码寡核苷酸,导致该循环/位置的码字中的值0。在一些实施方式中,在重复循环中,个体分析物的解码寡核苷酸不与样品接触,这也产生了该循环/位置的码字中的值0。
[0317]
通过这种措施,每一轮都提供相同或不同的信号,从而产生以由许多不同信号组成的信号序列为特征的编码方案。该措施允许产生与编码方案的所有其他码字不同的唯一代码或码字。在本公开的另一实施方式中,分析物特异性探针的结合元件(s)包括含有以下核苷酸序列的核酸,该核苷酸序列允许与待编码的分析物特异性结合、优选与待编码的分析物特异性杂交。
[0318]
在本公开的另一实施方式中,可以通过执行步骤g)来检测相同类型的分析物(变异体)的亚组以检测独占元件的存在或不存在。
[0319]
在有利的实施方式中,样品与每种分析物至少两个不同的分析物特异性探针组接触,
[0320]
其中,这些不同组中包括的分析物特异性探针与相同分析物相互作用,但与相同分析物的不同亚结构特异性相互作用,
[0321]
其中,第一分析物特异性探针组的分析物特异性探针与分析物的所有变异体中包括的亚结构相互作用,
[0322]
其中,第二分析物特异性探针组的分析物特异性探针(亚组特异性探针组)与仅在分析物的特定变异体中包括的亚结构相互作用,
[0323]
其中,第一分析物特异性探针组的分析物特异性探针包括相同的标识符元件(t),该标识符元件包括对于待编码的分析物唯一的核苷酸序列(唯一标识符序列),并且
[0324]
其中,第二分析物特异性探针组的分析物特异性探针包括相同的标识符元件(t),该标识符元件包括对于待编码的分析物唯一的核苷酸序列(唯一标识符序列),
[0325]
其中,第一分析物特异性探针组的分析物特异性探针的标识符元件(t)与第二分析物特异性探针组的分析物特异性探针的标识符元件(t)不同,以结合不同的解码寡核苷酸和/或非信号解码寡核苷酸。
[0326]
在一些有利的实施方式中,所有步骤都是自动化的,尤其其中,步骤b)至f)是自动化的,尤其是通过使用根据本公开的机器人系统和/或光学复用系统。在一些实例中,步骤可以在流体系统中执行。
[0327]
如上所述,利用根据本公开的方法,生成具有每种分析物的码字的编码方案。因此,每种分析物可以与特定码字相关联,其中,所述码字包括多个位置,并且其中,每个位置对应于一个循环,从而产生具有多个码字的多个可区分的编码方案。尤其,所述编码方案可以是预定的并分配给待编码的分析物。
[0328]
在一些有利的实施方式中,在所执行的循环中对于个体分析物获得的码字包括检测到的信号以及对应于未检测到的信号的额外至少一个元件,如0、1或0、1、2等(也参见图13和图14)。尤其,如果使用根据图14的2至4号的非信号探针或如图14的5号所示出的非信号解码寡核苷酸,或者如果在一个循环中没有解码寡核苷酸与包括在与样品中的相应分析物相互作用的分析物特异性探针中的相应标识符序列接触,则在至少一个循环内没有检测到至少一种分析物的信号。在此循环中,位置具有的值为零(0)。
[0329]
在一些有利的实施方式中,至少对于一种个体分析物,码字的位置为零(0)。尤其,
码字零(0)是通过不使用具有标识符连接物元件(t)的解码寡核苷酸生成的,该标识符连接物元件包括与个体分析物的相应分析物特异性探针的标识符元件(t)的唯一标识符序列的至少一部分基本上互补的核苷酸序列。如上所述,在一些实施方式中,如果在该循环中至少对于一种个体分析物,码字的位置为零(0),则不使用具有标识符连接物元件(t)的相应解码寡核苷酸,该标识符连接物元件包括与个体分析物的相应分析物特异性探针的标识符元件(t)的唯一标识符序列的至少一部分基本上互补的核苷酸序列。
[0330]
此外,在一些有利的实施方式中,使样品与至少两个不同的信号寡核苷酸组接触,其中,每组中的信号寡核苷酸包括不同的信号元件并且包括不同的连接物元件(c)。
[0331]
在更特定的实施方式中,使样品与每种分析物至少两个不同的解码寡核苷酸组接触,
[0332]
其中,这些不同组中包括的解码寡核苷酸包括相同的标识符连接物元件(t),该标识符连接物元件包括与相应分析物特异性探针组的标识符元件(t)的唯一标识符序列的至少一部分基本上互补的核苷酸序列,以及
[0333]
其中,每种分析物的不同组的解码寡核苷酸在翻译物元件(c)方面不同,该翻译物元件包括允许信号寡核苷酸特异性杂交的核苷酸序列。
[0334]
在更特定的实施方式中,使样品与每种分析物至少两个不同的解码寡核苷酸组接触,
[0335]
其中,这些不同组中包括的解码寡核苷酸包括相同的标识符连接物元件(t),该标识符连接物元件包括与相应分析物特异性探针组的标识符元件(t)的唯一标识符序列的至少一部分基本上互补的核苷酸序列,以及
[0336]
其中,每种分析物的不同组的解码寡核苷酸在翻译物元件(c)方面不同,该翻译物元件包括允许信号寡核苷酸特异性杂交的核苷酸序列;
[0337]
其中,每个循环仅使用每种分析物的一个解码寡核苷酸组,和/或其中,在不同循环中使用不同的解码寡核苷酸组,同一循环中使用相应信号寡核苷酸组,尤其
[0338]
其中,保留解码寡核苷酸和/或非信号解码寡核苷酸的组用于分析物亚组的可选检测。
[0339]
在一些有利的实施方式中,包括不同翻译物元件(c)的每种分析物的不同的解码寡核苷酸组的数量对应于包括不同连接物元件(c)的不同的信号寡核苷酸组的数量。用于不同分析物的所有解码寡核苷酸组可以包括一种或多种相同类型的一个或多个翻译物元件(c)。
[0340]
在根据本公开的方法的一些有利的实施方式中,样品与用于结合分析物特异性探针的特定标识符元件(t)的至少一个非信号解码寡核苷酸组接触,其中,在相同非信号解码寡核苷酸组中的解码寡核苷酸与相同的不同标识符元件(t)相互作用,其中,每个非信号解码寡核苷酸包括标识符连接物元件(t),该标识符连接物元件包括与唯一标识符序列的至少一部分基本上互补的核苷酸序列,并且每个非信号解码寡核苷酸不包括含有允许信号寡核苷酸特异性杂交的核苷酸序列的翻译物元件(c)。
[0341]
如上所述,样品可以与用于结合分析物特异性探针的至少两个不同的标识符元件(t)的至少两(2)个不同的非信号解码寡核苷酸组接触,每个非信号解码寡核苷酸组与不同标识符元件(t)相互作用,其中,每个非信号解码寡核苷酸包括标识符连接物元件(t),该标
识符连接物元件包括与唯一标识符序列的至少一部分基本上互补的核苷酸序列,并且每个非信号解码寡核苷酸不包括含有允许信号寡核苷酸特异性杂交的核苷酸序列的翻译物元件(c)。
[0342]
在根据本公开的方法的一些有利的实施方式中,不同的非信号解码寡核苷酸组可以包括在不同的非信号解码寡核苷酸组的预混合物中或分开存在。
[0343]
此外,在根据本公开的方法的一些有利实施方式中,样品与非信号寡核苷酸组接触,每个非信号寡核苷酸包括:
[0344]
(aa)翻译物连接物元件(c),其包括与翻译物元件(c)的核苷酸序列的至少一部分基本上互补的核苷酸序列,以及
[0345]
(bb)猝灭剂(q),信号元件和猝灭剂(q),或不包括信号元件。
[0346]
在另外的实施方式中,样品可以接触:
[0347]
至少两个非信号寡核苷酸组,每个非信号寡核苷酸包括:
[0348]
(aa)翻译物连接物元件(c),包括与该翻译物元件(c)的核苷酸序列的至少一部分基本上互补的核苷酸序列,以及
[0349]
(bb)猝灭剂(q),信号元件和猝灭剂(q),或不包括信号元件。
[0350]
如上所述,不同的非信号寡核苷酸组可以包括在不同的非信号寡核苷酸组的预混合物中或分开存在。
[0351]
在另外的实施方式中,特定解码寡核苷酸组中的解码寡核苷酸与对于特定分析物唯一的相同标识符元件(t)相互作用。
[0352]
如上所述,不同的解码寡核苷酸组可以包括在不同的解码寡核苷酸组的预混合物中或分开存在,以及不同的分析物特异性探针组可以包括在不同的分析物特异性探针组的预混合物中或分开存在,以及不同的信号寡核苷酸组可以包括在不同的信号寡核苷酸组的预混合物中或分开存在。
[0353]
在根据本公开的方法的一些有利实施方式中,结合元件(s)包括含有以下核苷酸序列的核酸,该核苷酸序列允许与待编码的分析物特异性结合、优选与待编码的分析物特异性杂交。
[0354]
在根据本公开的方法的一些有利的实施方式中,在步骤a)之后并且步骤b)之前,可以除去未结合的分析物特异性探针,尤其是通过洗涤,另外在步骤b)之后并且步骤c)之前,可以除去未结合的解码寡核苷酸,尤其通过洗涤,另外在步骤c)之后并且步骤d)之前,可以除去未结合的信号寡核苷酸,尤其通过洗涤。
[0355]
在根据本公开的方法的一些有利实施方式中,分析物特异性探针可以与样品一起温育,从而允许分析物特异性探针与待编码的分析物特异性结合,此外,解码寡核苷酸可以与样品一起温育,从而允许解码寡核苷酸与各自分析物特异性探针的标识符元件(t)特异性杂交,此外,信号寡核苷酸可以与样品一起温育,从而允许信号寡核苷酸与各自解码寡核苷酸的翻译物元件(t)特异性杂交。
[0356]
如上所述,待编码的分析物可以是核酸,优选dna、pna或rna,尤其mrna、肽、多肽、蛋白质或其组合。因此,结合元件(s)可以包括允许与待编码的分析物特异性结合的氨基酸序列。结合元件(s)的实例是以下部分,该部分是来自亲和物质的亲和部分或是亲和物质整体,亲和物质选自由以下项组成的组:抗体、抗体片段、anticalin蛋白质、受体配体、酶底
devices and methods)”;美国临时专利申请序列号60/214,642,于2000年6月28日提交并且标题为“样品处理装置、系统和方法(sample processing devices,systems and methods)”;美国临时专利申请序列号60/237,072,于2000年10月2日提交并且标题为“样品处理装置、系统和方法(sample processing devices,systems and methods)”;美国临时专利申请序列号60/260,063,于2001年1月6日提交并且标题为“样品处理装置、系统和方法(sample processing devices,systems and methods)”;美国临时专利申请序列号60/284,637,于2001年4月18日提交并且标题为“改进的样品处理装置、系统和方法(enhanced sample processing devices,systems and methods)”;以及美国专利申请公开号us 2002/0048533,标题为“样品处理装置和载体(sample processing devices and carriers)”。其他可能的装置构造可以在例如美国专利号6,627,159标题为“样品加工装置的离心填充(centrifugal filling of sample processing devices)”(bedingham et al.)中找到。
[0376]
根据本公开的光学复用系统可以包括多个处理室(例如反应容器),每个用于容纳相应的样品以及一个或多个探针组,如分析物特异性探针组、解码寡核苷酸/非信号寡核苷酸组和/或信号寡核苷酸/非信号寡核苷酸组。例如,处理室可以包括在可旋转的盘中或包括在可移动孔板如96孔板中;用于旋转所述盘或移动孔板的发动机,其中尤其发动机可以是机器人系统的一部分。
[0377]
根据本公开的光学复用系统可以进一步包括至少一个或多个光学模块,尤其其中,该系统包括具有适于接收光学模块的至少一个或多个位置的罩体(housing),其中,多个光学模块中的每一个都可以从罩体的位置移除。
[0378]
在一些有利的实施方式中,根据本公开的光学复用系统可以包括检测器,以及尤其与多个光学模块联接以将荧光从多个光学模块传送到检测器的光导纤维束。
[0379]
尤其,一个或多个光学模块包括光学通道,每个光学模块具有被选择用于激发不同染料中的一种的光源以及捕获发射的荧光的透镜,所述一个或多个光学模块被光学配置为在不同波长下查询荧光染料。
[0380]
在另外的实施方式中,该系统可以包括具有至少一个流通通道的微流体盒体(cartridge)(本文也称为微流体装置)。光学复用系统包括荧光成像系统。该系统的其他特征可以是温度测量和/或控制系统。在一些实施方式中,系统包括用于施加可变气动压力例如至微流体盒体的压力测量和控制系统。光学复用系统可以包括用于容纳多种试剂的存储装置,诸如孔板。此外,光学复用系统可以包括液体处理系统,尤其包括例如至少一个机器人移液器,用于吸取、混合和分配试剂混合物,例如到微流体盒体和/或到一个或多个反应容器中。此外,系统可以包括用于数据存储、处理和输出的装置;以及尤其是系统控制器以协调各种装置和功能。
[0381]
在一些实施方式中,根据本公开的方法编码核酸分析物,诸如mrna,例如编码特定蛋白质的mrna。
[0382]
在一些有利的实施方式中,本文所述的方法用于平行地特异性检测许多不同的分析物。该技术允许区分比可用的不同信号更多数量的分析物。该过程包括至少连续四轮的特异性结合、信号检测和选择性变性(如果需要下一轮),最终产生信号代码。为了解耦分析物特异性结合与提供可检测信号的寡核苷酸之间的依赖性,引入了所谓的“解码”寡核苷
酸。解码寡核苷酸将分析物特异性探针组的信息转录为信号寡核苷酸。
[0383]
在特定的实施方式中,该方法可以包括以下步骤:1.提供一个或多个分析物特异性探针组,该分析物特异性探针组由一个或多个不同的探针组成,每个探针在与分析物特异性相互作用的结合部分方面不同,单个探针组的所有探针都与序列元件(唯一标识符)相连,该序列元件对于单个探针组是唯一的并允许解码寡核苷酸的特异性杂交,2.探针组与分析物的其靶结合位点的特异性结合,3.去除未结合的探针(例如通过洗涤步骤),4.提供与探针组的唯一标识符序列特异性杂交的解码寡核苷酸的混合物,解码寡核苷酸包括至少两个序列元件,与相应探针组的唯一标识符序列互补的第一元件和提供用于信号寡核苷酸的特异性杂交的序列的第二序列元件(翻译物元件),翻译物元件定义了募集到解码寡核苷酸的信号的类型,5.解码寡核苷酸与通过结合的探针组提供的唯一标识符序列的特异性杂交,6.去除非结合的解码寡核苷酸(例如通过洗涤步骤),7.提供信号寡核苷酸的混合物,该信号寡核苷酸包括可被检测的信号以及与前一杂交步骤中使用的解码寡核苷酸之一的翻译物元件特异性杂交的核酸序列,8.信号寡核苷酸的特异性杂交,9.去除未结合的信号寡核苷酸,10.信号的检测,11.选择性释放解码寡核苷酸和信号寡核苷酸,同时特异性探针组与分析物的结合几乎或完全不受影响,12.去除释放的解码寡核苷酸和信号寡核苷酸(例如通过洗涤步骤),同时特异性探针组与分析物的结合几乎或完全不受影响,重复步骤4至12至少三次,直到检测到足够数量的信号为每种不同的目的分析物生成编码方案。
[0384]
应当理解,前述特征和以下将要提及的特征不仅可以用于各自情况中指示的组合,还可以用于其他组合或单独使用,而不脱离本公开的范围。
[0385]
现在通过导致本公开的额外特征、特性和优点的实施方式另外解释本公开。实施方式具有纯粹的说明性性质并且不限制本公开的范围或界限。特定实施方式中所提及的特征是本公开的一般特征,它们不仅适用于该特定实施方式,而且独立地适用于本公开的任何实施方式的上下文中。
[0386]
本文公开的方法用于平行地特异性检测许多不同的分析物。该技术允许区分比可用的不同信号更多数量的分析物。该过程优选包括至少连续两轮的特异性结合、信号检测和选择性变性(如果需要下一轮),最终产生信号代码。为了解耦分析物特异性结合与提供可检测信号的寡核苷酸之间的依赖性,引入了所谓的“解码”寡核苷酸。解码寡核苷酸将分析物特异性探针组的信息转录为信号寡核苷酸。
[0387]
方法和实施例
[0388]
在应用变体中,分析物或靶标是核酸,例如dna或rna,并且探针组包括与待检测的核酸序列的整个序列或子序列部分或完全互补的寡核苷酸(图1)。核酸序列特异性寡核苷酸探针组包括分析物特异性探针(1),该分析物特异性探针包括与待检测的靶核酸序列特异性杂交的结合元件(s),以及含有对于所述分析物特异性探针组来说唯一的核苷酸序列(唯一标识符序列)的标识符元件(t)。
[0389]
在本公开的有利实施方式中,分析物/靶标是核酸,例如rna,以及包括与单个核酸序列靶标的不同区域部分或完全互补的寡核苷酸的两个探针组(图15)。核酸序列特异性寡核苷酸探针组包括两个分析物特异性探针组,每组(1和1’、2和2’)均包括与待检测的靶核酸序列特异性杂交的结合元件(s),以及每组具有包括对所述分析物特异性探针组唯一的核苷酸序列(唯一标识符序列)的不同标识符元件(t)。这两组用于分析物的解码(1、2)以及
检测区分分析物亚组(1'和2')的独占元件的存在/不存在。
[0390]
在另外的应用变体中,分析物或靶标是蛋白质并且探针组包括一种或多种蛋白质,例如抗体(图2)。蛋白质特异性探针组包括分析物特异性探针(1),该分析物特异性探针包括与待检测的靶蛋白特异性相互作用的结合元件(t)诸如抗体的(高)可变区,以及标识符元件(t)。
[0391]
在另外的应用变体中,至少一种分析物是核酸并且至少第二分析物是蛋白质,并且至少第一探针组与核酸序列结合并且至少第二探针组与蛋白质分析物特异性结合。其他组合也是可能的。
[0392]
本公开的一般方法的实施方式可以是:
[0393]
步骤1:应用至少20个分析物或靶标特异性探针组。将靶核酸序列与由具有与靶核酸互补的序列的寡核苷酸组成的探针组一起温育。在该实施例中,示出了5个不同探针的探针组,每个探针包括与靶核酸序列的单个子序列互补的序列元件(s1至s5)。在此实施例中,区域不重叠。靶向相同核酸序列的寡核苷酸的每一个分别包括标识符元件或唯一标识符序列(t)。
[0394]
步骤2:探针组的杂交。在允许特异性杂交的条件下使探针组与靶核酸序列杂交。温育后,探针与其相应的靶序列杂交,并提供用于下一步骤的标识符元件(t)。
[0395]
步骤3:去除未结合探针。杂交后,去除未结合的寡核苷酸,例如通过洗涤步骤。
[0396]
步骤4:应用解码寡核苷酸。应用由至少两个序列元件(t)和(c)组成的解码寡核苷酸。虽然序列元件(t)与唯一标识符序列(t)互补,但序列元件(c)提供了用于随后的信号寡核苷酸杂交的区域(翻译物元件)。
[0397]
步骤5:解码寡核苷酸的杂交。解码寡核苷酸经由其互补的第一序列元件(t)与探针(t)的唯一标识符序列(t)杂交。温育后,解码寡核苷酸提供了用于随后的杂交步骤的翻译物序列元件(c)。
[0398]
步骤6:去除多余的解码寡核苷酸。杂交后,去除未结合的解码寡核苷酸,例如通过洗涤步骤。
[0399]
步骤7:应用信号寡核苷酸。信号寡核苷酸被应用。信号寡核苷酸包括与翻译物序列元件(c)基本上互补的至少一个第二连接物元件(c)以及提供可检测信号(f)的至少一个信号元件。
[0400]
步骤8:信号寡核苷酸的杂交。信号寡核苷酸经由互补序列连接物元件(c)与解码寡核苷酸的翻译物元件(c)杂交。温育后,信号寡核苷酸与其相应的解码寡核苷酸杂交并提供可检测的信号(f)。
[0401]
步骤9:去除多余的信号寡核苷酸。杂交后,去除未结合的信号寡核苷酸,例如通过洗涤步骤。
[0402]
步骤10:信号检测。检测由信号寡核苷酸提供的信号。
[0403]
最后一轮检测不需要以下步骤(步骤11和12)。
[0404]
步骤11:选择性变性。使唯一标识符序列(t)和解码寡核苷酸的第一序列元件(t)之间的杂交溶解。去稳定可以经由技术人员熟知的不同机制来实现,例如:升高的温度、变性剂等。靶标特异性探针或分析物特异性探针不受此步骤的影响。
[0405]
步骤12:去除变性的解码寡核苷酸。去除变性的解码寡核苷酸和信号寡核苷酸(例
如通过洗涤步骤),留下具有游离唯一标识符序列的特异性探针组,可在下一轮杂交和检测(步骤4至10)中重复使用。该检测循环(步骤4到12)重复至少四次,直到计划的编码方案完成。
[0406]
在一些有利的实施方式中,在步骤13中,执行步骤4至10的额外的循环以读取子组/变异体特异性信号。
[0407]
使用多解码物的本公开的一般方法的另一实施方式可以是(图16):
[0408]
步骤1:靶核酸:在本实施例中,必须通过仅使用两种不同类型的信号寡核苷酸来检测和区分三种不同的靶核酸(a)、(b)和(c)。在开始实验之前,设置了一定的编码方案。在本实施例中,三种不同的核酸序列由具有三种不同信号类型(1)、(2)和(1/2)的三轮检测编码,并且产生的汉明距离为3以允许错误检测。计划的码字为:
[0409]
序列a:(1)
–
(1)
–
(2)
[0410]
序列b:(2)
–
(2)
–
(1/2)
[0411]
序列c:(1/2)
–
(1/2)
–
(1)
[0412]
步骤2:探针组的杂交:对于每种靶核酸,应用自己的探针组,其与相应的目的核酸序列特异性杂交。每个探针组提供唯一标识符序列(t1)、(t2)或(t3)。这样,每种不同的靶核酸都被唯一标记。在本实施例中,序列(a)用(t1)标记,序列(b)用(t2)标记,并且序列(c)用(t3)标记。图16中的图示总结了图3的步骤1至3。
[0413]
步骤3:解码寡核苷酸和多解码物的杂交:对于存在的每个唯一标识符,应用通过其第一序列元件与相应的唯一标识符序列特异性杂交(此处为(t1)与(t1),(t2)与(t2)和(t3)与(t3))的某个解码寡核苷酸或多解码物。解码寡核苷酸或多解码物中的每一个提供定义了信号寡核苷酸杂交后将产生的信号的一个翻译物或两个翻译物元件。这里核酸序列(a)用(c1)标记,(b)用(c2)标记,并且(c)用翻译物元件(c1)和(c2)标记产生信号(1/2)。图16中的图示总结了图3的步骤4至6。
[0414]
步骤4:信号寡核苷酸的杂交:对于每种类型的翻译物元件,应用具有可与其他信号寡核苷酸的信号区分开的特定信号的信号寡核苷酸。信号寡核苷酸可以与相应的翻译物元件特异性杂交。图16中的图示总结了图3的步骤7至9
[0415]
步骤5:用于编码方案的信号检测:检测不同的信号。应注意,在本实施例中,核酸(a)、(b)和(c)在第一轮检测后已经可以区分。这与图5的步骤5形成对比,图5的步骤5由可以通过多解码物实现的额外信号类型(1/2)解释。尽管已经可以区分核酸序列,但额外的轮次有助于计划的汉明距离为3。图16中的图示对应于图3的步骤10。
[0416]
步骤6:选择性变性:如图3的步骤11和12中所述对待检测的所有核酸序列的解码(和信号)寡核苷酸和/或多解码物选择性地变性和去除。之后,不同探针组的唯一标识符序列可以用于下一轮杂交和检测。
[0417]
步骤7:第二轮检测:下一轮杂交和检测如步骤3至5中所述进行。应注意,在新一轮中,不同解码寡核苷酸和多解码物的混合发生了变化。例如,第一轮中使用的核酸序列(a)的解码寡核苷酸包括序列元件(t1)和(c1),而第2轮新的多解码物包括序列元件(t1)、(c1)和(c2)。应注意,现在2轮后已经给出了2的汉明距离,这是3轮后图3中的实施例的最终结果。
[0418]
步骤8:第三轮检测:再次使用解码寡核苷酸和/或多解码物的新组合,从而产生新
的信号组合。在信号检测之后,三个不同核酸序列的所得码字不仅是唯一的并且因此是可区分的,而且包括与其他码字的汉明距离为3。由于该汉明距离,信号检测(信号交换)中的错误不会产生有效码字,并且因此可以被检测到,并且由于汉明距离3也被纠正,与图3的编码方案相反。这样,可以在三轮检测中用两种不同的信号区分三种不同的核酸,从而允许错误检测和纠正。
[0419]
应注意,在每一轮检测中,特定唯一标识符提供的信号类型由特定解码寡核苷酸的使用控制。结果,在检测循环中应用的解码寡核苷酸的序列将探针组的结合特异性转录成独特的信号序列。
[0420]
解码寡核苷酸杂交(步骤4至6)和信号寡核苷酸杂交(步骤7至9)的步骤也可以以两种替代方式组合,如图4中示出。
[0421]
选择:1:同时杂交。替代图3的步骤4至9,解码寡核苷酸和信号寡核苷酸的特异性杂交也可以同时进行,在去除多余的解码寡核苷酸和信号寡核苷酸后,导致与图3的步骤9所示相同的结果。
[0422]
选择:2:预温育。除了图3的选择1之外,解码寡核苷酸和信号寡核苷酸可以在单独的反应中预温育,然后应用于具有已经结合的特异性探针组的靶核酸。
[0423]
1.通过两种不同信号类型和三轮检测对三种不同核酸序列进行信号编码的实施例
[0424]
图3示出了通过解码寡核苷酸介导的特异性信号的生成和检测的一般概念。它没有示出可以通过此程序实现的编码的一般概念。为了说明图3中示出过程用于生成编码方案的用途,图5示出了使用三种不同核酸序列进行多轮编码实验的一般实施例。在该实施例中,编码方案包括错误检测。
[0425]
步骤1:靶核酸。在本实施例中,必须通过仅使用两种不同类型的信号来检测和区分三种不同的靶核酸(a)、(b)和(c)。在开始实验之前,设置了一定的编码方案。在本实施例中,三种不同的核酸序列由具有两种不同信号(1)和(2)的三轮检测编码,并且产生的汉明距离为2以允许错误检测。计划的码字为:
[0426]
序列a:(1)
–
(2)
–
(2);
[0427]
序列b:(1)
–
(1)
–
(1);
[0428]
序列c:(2)
–
(1)
–
(2)。
[0429]
步骤2:探针组的杂交。对于每种靶核酸,应用自己的探针组,其与相应的目的核酸序列特异性杂交。每个探针组提供唯一标识符序列(t1)、(t2)或(t3)。这样,每种不同的靶核酸都被唯一标记。在本实施例中,序列(t)用(t1)标记,序列(b)用(t2)标记,并且序列(c)用(t3)标记。图示总结了图3的步骤1至3。
[0430]
步骤3:解码寡核苷酸的杂交。对于存在的每个唯一标识符,应用通过其第一序列元件与相应的唯一标识符序列特异性杂交(此处为(t1)与(t1),(t2)与(t2)和(t3)与(t3))的某个解码寡核苷酸。解码寡核苷酸的每一个都提供了定义信号寡核苷酸杂交后将生成的信号的翻译物元件。这里核酸序列(a)和(b)用翻译物元件(c1)标记,并且序列(c)用(c2)标记。图示总结了图3的步骤4至6。
[0431]
步骤4:信号寡核苷酸的杂交。对于每种类型的翻译物元件,应用具有可与其他信号寡核苷酸的信号区分开的特定信号(2)的信号寡核苷酸。信号寡核苷酸可以与相应的翻
译物元件特异性杂交。图示总结了图3的步骤7至9。
[0432]
步骤5:用于编码方案的信号检测。检测不同的信号。请注意,在本实施例中,核酸序列(c)可以通过它提供的独特信号(2)与其他序列区分开来,而序列(a)和(b)提供相同类型的信号(1),并且不能在第一个检测循环后区分。这是因为待检测的不同核酸序列的数量超过了可用的不同信号的数量这一事实。图示对应于图3的步骤10。
[0433]
步骤6:选择性变性。如图3的步骤11和12中对待检测的所有核酸序列的解码(和信号)寡核苷酸选择性地变性和去除。之后,不同探针组的唯一标识符序列可以用于下一轮杂交和检测。
[0434]
步骤7:第二轮检测。下一轮杂交和检测如步骤3至5中所述进行。应注意,在此新一轮中,不同解码寡核苷酸的混合发生了变化。例如,第一轮中使用的核酸序列(a)的解码寡核苷酸包括序列元件(t1)和(c1),而新解码寡核苷酸包括序列元件(c1)和(c2)。请注意,由于第一轮和第二轮信号的独特组合,现在可以清楚地区分所有三种序列。
[0435]
步骤8:第三轮检测。再次使用解码寡核苷酸的新组合,从而产生新的信号组合。在信号检测之后,三个不同核酸序列的所得码字不仅是唯一的并且因此是可区分的,而且包括与其他码字的汉明距离为2。由于汉明距离,信号检测(信号交换)中的错误不会产生有效码字,并且因此可以被检测到。通过这种方式,可以在三个检测轮中用两种不同的信号区分三种不同的核酸,从而允许错误检测。
[0436]
2.优于现有技术的优势
[0437]
编码策略
[0438]
与最先进的方法相比,根据本公开的方法的一个特别优势是解码寡核苷酸的使用打破了靶标特异性探针和信号寡核苷酸之间的依赖性。
[0439]
在不解耦靶标特异性探针和信号生成的情况下,如果使用两个不同的分子标签,则只能针对某靶标生成两种不同的信号。这些分子标签中的每一个都只能使用一次。同一分子标签的多次读出不会增加关于靶标的信息。为了产生编码方案,需要在每一轮之后更改靶标特异性探针组(seqfish),或者同一探针组上必须存在多种分子标签(如merfish、intronseqfish)。
[0440]
遵照根据本公开的方法,通过使用不同的解码寡核苷酸重复使用相同的唯一标识符(分子标签)以及少量的不同的、主要是成本密集的信号寡核苷酸来实现不同的信号。与其他方法相比,这带来了几个优势。
[0441]
(1)编码方案不是由靶标特异性探针组定义的,这是现有技术的所有其他方法的情况。这里编码方案由解码寡核苷酸转录。这导致关于轮数的更高灵活性和码字中信号选择的自由度。查看现有技术的方法(例如merfish或intronseqfish),所有靶序列的编码方案(可检测信号的数量、类型和序列)由特异性探针组上不同标签序列的存在来预定义的(在merfish的情况下,每个探针组16个不同标签中的4个,在intron fish的情况下,60个不同标签中的5个)。为了每个探针组产生足够数量的不同标签,这些方法使用相当复杂的寡核苷酸设计,在一个靶标特异性寡核苷酸上存在多个标签。为了改变特定靶核酸的编码方案,必须更换特异性探针组。根据本公开的方法描述了每种分析物使用单个唯一标签序列(唯一标识符),因为它可以在每一轮检测中重复使用以产生新信息。编码方案由检测轮次中使用的解码寡核苷酸的顺序定义。因此,编码方案不是由特异性探针(或唯一标签序列)
预先定义的,而是可以根据不同的需要进行调整,即使在实验期间也是如此。这是通过简单地改变检测轮次中使用的解码寡核苷酸或添加额外的检测轮次来实现的。
[0442]
(2)利用现有技术的方法不同信号寡核苷酸的数量必须与不同标签序列的数量相匹配(在merfish的情况下为16个,以及在intronseqfish的情况下为60个)。使用根据本公开的方法,不同信号寡核苷酸的数量与所使用的不同信号的数量相匹配。因此,对于此处描述的方法,信号寡核苷酸的数量保持不变,并且从不超过不同信号的数量,但会随着现有技术方法中编码方案的复杂性而增加(需要更多的检测轮次,需要更多不同的信号寡核苷酸)。结果,此处描述的方法导致大大降低的复杂性(信号寡核苷酸与环境或彼此之间的意外相互作用),并显著降低了测定成本,因为主要成本因素是信号寡核苷酸。
[0443]
在现有技术的方法中,靶标特异性探针组生成的不同信号的数量受限于该探针组可以提供的不同标签序列的数量。由于每个额外的标签序列都会增加靶标特异性探针的总尺寸,因此单个探针可以提供的不同标签的数量是有限的。这种限制是由几个问题(意外的分子间和分子内相互作用、成本、扩散速率、稳定性、合成期间的错误等)的尺寸依赖性增加导致的。此外,可以应用于特定分析物的靶标特异性探针的总数是有限的。在核酸的情况下,这种限制是由靶序列的长度和合适的结合位点的比例导致的。这些因素导致探针组可以提供的不同信号的数量受到严重限制(在merfish的情况下为4个信号,在intronseqfish的情况下为5个信号)。这种限制极大地影响了通过一定数量的检测轮可以产生的不同码字的数量。在本公开的方法中,只需要一个标签,并且可以在每一轮检测中自由地重复使用。这导致低寡核苷酸复杂性/长度,同时导致可能的最大编码效率(颜色数
轮数
)。我们的方法与其他方法相比在编码能力上的巨大差异如图1和图5中示出。因此,在本公开的方法中,产生相同量的信息所需的检测轮数要少得多。更少的检测轮数与以下项有关:更低的成本、更低的实验时间、更低的复杂性、更高的稳定性和成功率、待收集和分析的数据的更少量以及更高的结果准确性。
[0444]
编码能力
[0445]
下表1中比较的所有三种方法都使用在不同检测轮之间不变性的特异性探针组。对于intronseqfish,需要4轮检测来产生一轮编码的伪色,因此仅给出第4、8、12、16和20轮的数据。merfish方法使用恒定的4个信号数量,因此数据从尽可能最少的轮数开始。在8轮检测后,我们的方法超过了20轮merfish达到的最大编码能力(用一个星号表示),并且在12轮检测后,超过了intron fish的最大编码能力(用两个星号表示)。对于根据本公开的方法,假定使用3个不同的信号(与intronseqfish一样)。
[0446]
[0447][0448]
表1:编码能力比较
[0449]
如图6中示出,merfish的码字数不会随着检测循环的数量呈指数增长,但随着每轮增加而变得不那么有效。相比之下,根据本公开的方法中intronseqfish的码字数呈指数增长。所提出方法的曲线斜率远高于intron fish的曲线斜率,导致在20轮检测后可用的码字增加超过10,000倍。
[0450]
应注意,在seqfish的情况下也达到了编码能力的这种最大效率,其中特异性探针在每一轮检测后变性,并且新的探针组与每一轮检测的靶序列特异性杂交。然而,与编码方案仅使用一种特异性杂交的技术(所有其他方法)相比,这种方法具有很大的缺点:
[0451]
(1)为了使特异性探针有效变性,必须使用相当粗糙的条件(高温、高变性剂浓度、长温育时间),导致分析物丢失或损坏的可能性更高。
[0452]
(2)对于每一轮检测,必须对每个靶核酸序列使用自己的探针组。因此,实验所需的特异性探针的数量与编码方案所需的不同信号的数量成比例。这显著增加了测定的复杂性和成本。
[0453]
(3)由于每个靶核酸分子的杂交效率都受到一定概率的影响,不同检测轮之间信号强度的波动远高于仅使用一个特异性杂交事件的方法,降低了完整代码的比例。
[0454]
(4)特异性杂交所需的时间比信号寡核苷酸或解码寡核苷酸的杂交要长得多(在intronseqfish、merfish和seqfish出版物的方法部分可以看出),这大大增加了完成实验所需的时间。
[0455]
由于这些原因,所有其他方法都使用单一的特异性杂交事件并接受较低代码复杂性的主要缺点,并且因此需要更多的检测轮次和更高的寡核苷酸设计复杂性。
[0456]
根据本公开的方法结合了seqfish的优点(主要是关于编码方案的完全自由)与仅使用一个特异性杂交事件的方法的所有优点,同时消除了此类方法的主要问题。
[0457]
应注意,20轮后产生的大量码字也可用于在不同码字之间引入更高的汉明距离(差异),从而允许对1、2或甚至更多错误进行错误检测,并且甚至进行错误纠正。因此,即使
是非常高的编码能力仍然具有实际意义。
[0458]
对于共享某些部分(例如mrna剪接变体)的分析物/靶的组中的亚组/变异体的检测,可能会使用两个单独的码字。然而,信号将在完全相同的物理位置处生成,因此混合读出将是初始方法的结果。使用额外的轮次将信息添加至已经建立的代码中可以避免这个问题。
[0459]
如上所述,多解码物的使用进一步增加了编码方案的编码能力。多解码物的使用不再局限于具有与不同信号寡核苷酸和相应翻译物元件完全相同数量的不同信号类型,而是增加了可用于以下的信号类型:(n x(n+1))/2(n为使用的不同信号寡核苷酸的数量)。对于表1中使用的具有3种不同信号寡核苷酸的代码,这意指可以使用以下7种不同的信号类型:(s1)、(s2)、(s3)、(s1/s2)、(s1/s3)、(s2/s3)、(s1/s2/s3)。对编码效率的影响可以在表1b和图18中看到。
[0460][0461][0462]
表1b示出了四种方法的编码能力。
[0463]
表1b中比较的所有四种方法都使用在不同检测轮之间不变性的特异性探针组。对于intronseqfish,需要4轮检测来产生一轮编码的伪色,因此仅给出第4、8、12、16和20轮的数据。merfish方法使用恒定的4个信号数量,因此数据从尽可能最少的轮数开始。在4轮检
测后,此处描述的用多解码物的方法超过了用20轮merfish达到的最大编码能力(用一个星号表示),在7轮检测后,超过了intron fish的最大编码能力(用两个星号表示),并且在12轮检测后,超过了本公开的方法的最大编码能力(用三个星号表示)。假定使用3种不同的信号寡核苷酸(与intronseqfish一样)。
[0464]
3.选择性变性、寡核苷酸组装和唯一标识符的重复使用是效率惊人的根据本公开的方法的关键因素是解码寡核苷酸结合、信号寡核苷酸结合、信号检测和选择性变性的连续过程。为了生成编码方案,这个过程必须重复几次(取决于码字的长度)。由于在每个检测循环中重复使用相同的唯一标识符,因此从第一个检测循环到最后一个检测循环的所有事件都相互依赖。此外,选择性变性取决于两个不同的事件:虽然解码寡核苷酸必须以最高效率从唯一标识符中溶解,但特异性探针必须以最高效率保持杂交。
[0465]
因此,整个编码过程的效率e可以用以下等式描述:
[0466]
e=b
sp x(b
de x b
si x e
de x s
sp
)n[0467]
e=总效率
[0468]bsp
=特异性探针的结合
[0469]bde
=解码寡核苷酸的结合
[0470]bsi
=信号寡核苷酸的结合
[0471]ede
=解码寡核苷酸的去除
[0472]ssp
=去除过程期间特异性探针的稳定性
[0473]
n=检测循环数量
[0474]
基于此等式,可以针对给定的方法总效率估算每个单步的效率。计算在此基于每个过程具有相同的效率的假设。总效率描述了存在的总信号中的成功解码信号部分。
[0475]
该方法的总效率取决于由等式描述的不同因素的每个单步的效率。在平均分布效率的假设下,可以绘制总效率相对于单步效率的图,如图7中示出。可以看出,具有5个检测循环的编码方案的实际相关总效率只能在单步效率明显高于90%的情况下实现。例如,要达到50%的总效率,需要每个单步内的平均效率为97.8%。这些计算甚至基于100%信号检测和分析效率的假设。由于各种序列的寡核苷酸的宽dna解链曲线,本发明人在实验前假设选择性变性对于解码寡核苷酸的变性效率较低,并且序列特异性结合探针不够稳定。与此假设相反,我们发现在选择性变性期间,所有步骤都具有惊人的有效性和序列特异性探针的高度稳定性。
[0476]
通过实验,发明人基于5个检测循环实现了约30%至65%的总解码效率。通过上式计算每个单步(bsp、bde、bsi、ede、ssp)的效率表明平均效率为约94.4%至98%。这些高效率是非常令人惊讶的,并且是该领域技术人员无法轻易预料到的。
[0477]
4.实验数据
[0478]
背景
[0479]
该实验示出了10至50种不同的mrna种类的平行特异性检测,具有单分子分辨率。其基于5个检测循环、3种不同的荧光信号以及无信号间隙且汉明距离为2(错误检测)的编码方案。实验证明了根据本公开的方法的实现性和功能性。
[0480]
寡核苷酸及其序列
[0481]
实验中使用的所有寡核苷酸序列(靶标特异性探针、解码寡核苷酸、信号寡核苷
酸)都列在附录的序列表中。信号寡核苷酸r:st05*o_atto594购自biomers.net gmbh。所有其他寡核苷酸均购自integrated dna technologies。将寡核苷酸溶解在水中。储备溶液(100μm)储存在-20℃。
[0482]
实验概述
[0483]
将50个不同的靶标特异性探针组分为5组。待检测转录物的名称与靶标特异性探针组的名称相同(www.ensemble.org的转录物变体名称)。术语“新”表示经修改的探针设计。探针组的所有寡核苷酸序列都可以在序列表中找到。该表列出了探针组的唯一标识符名称以及在不同检测循环中使用的解码寡核苷酸的名称。生成的代码示出了在5个检测循环期间生成的荧光信号序列(g(绿色)=alexa fluor 488,o(橙色)=atto 594,y(黄色)=alexa fluor 546)。
[0484]
[0485]
[0486]
[0487][0488]
表2:实验概述
[0489]
实验的变化
[0490]
已经进行了实验的一些变化。实验1至4主要在于平行检测的转录物数量方面不同。列为靶标特异性探针组的组参见表6。实验5至8是单轮、单靶标对照,用于与解码信号进行比较。
[0491][0492]
表3:实验的变化
[0493]
实验细节
[0494]
a.细胞的接种和培养
[0495]
使hela细胞在hela细胞培养基中生长至接近100%汇合。hela细胞培养基包括dmem(thermo fisher,目录号:31885)和10%fcs(biochrom,目录号:s0415)、1%青霉素-链霉素(sigma-adrich,目录号:p0781)和1%mem非必需氨基酸溶液(thermo fisher,目录号:11140035)。吸出细胞培养基后,在用pbs(1.424g/l na2hpo4*2h2o、0.276g/l nah2po4*2h2o、8.19g/l nacl在水中,ph 7,4)进行洗涤步骤后,细胞在37℃下与胰蛋白酶edta溶液(sigma-aldrich,目录号:t3924)温育5min进行胰酶消化。然后将细胞接种到μ-slide 8well ibiditreat(ibidi,目录号:80826)的孔中。调整每孔的细胞数以在细胞粘附后达到约50%汇合。细胞与每孔200μl hela细胞培养基温育过夜。
[0496]
b.细胞的固定
[0497]
在吸出细胞培养基并用每孔200μl 37℃温热pbs进行两次洗涤步骤后,将细胞用200μl预冷甲醇(-20℃,roth,目录号:0082.1)在-20℃下固定10min。
[0498]
c.用苏丹黑复染
[0499]
吸出甲醇并向每个孔中添加150μl的在70%乙醇中稀释的0.2%苏丹黑溶液。孔在室温下在黑暗中温育5min。温育后,将细胞用每孔400μl 70%乙醇洗涤三次,以去除过量的
苏丹黑溶液。
[0500]
d.分析物/靶标特异性探针的杂交
[0501]
杂交之前,将细胞用200μl sm-洗涤缓冲液平衡。sm-洗涤缓冲液包括30mm柠檬酸na3、300mm nacl,ph7、10%甲酰胺(roth,目录:p040.1)和5mm氧钒核糖核苷(ribonucleoside vanadyl)复合物(neb,目录号:s1402s)。对于每个靶标特异性探针组,将1μl的100μm寡核苷酸储备溶液添加至混合物中。寡核苷酸储备溶液包括等摩尔量的相应靶标特异性探针组的所有靶标特异性寡核苷酸。用水将混合物的总体积调节至100μl,并与100μl的2x浓缩杂交缓冲液混合。2x浓缩杂交缓冲液包括120mm柠檬酸na3、1200mm nacl,ph7、20%甲酰胺和20mm氧钒核糖核苷复合物。将所得200μl杂交混合物添加至相应的孔中,并在37℃下温育2h。然后将细胞在37℃下用靶标探针洗涤缓冲液以每孔200μl洗涤三次,10min。靶标探针洗涤缓冲液包括30mm柠檬酸na3、300mm nacl,ph7、20%甲酰胺和5mm氧钒核糖核苷复合物。
[0502]
e.解码寡核苷酸的杂交
[0503]
杂交之前,将细胞用200μl sm-洗涤缓冲液平衡。对于每个解码寡核苷酸,将1.5μl的5μm储备溶液添加至混合物中。用水将混合物的总体积调节至75μl,并与75μl的2x浓缩杂交缓冲溶液混合。将所得150μl解码寡核苷酸杂交混合物添加到相应的孔中,并在室温下温育45min。然后将细胞在室温下用sm-洗涤缓冲液以每孔200μl洗涤三次,2min。
[0504]
f.信号寡核苷酸的杂交
[0505]
杂交之前,将细胞用200μl sm-洗涤缓冲液平衡。信号寡核苷酸杂交混合物对于所有实验轮1至4都是相同的,并且包括在1x浓缩杂交缓冲溶液中的0.3μm的每种信号寡核苷酸(参见表a3)。在每一轮中,每孔添加150μl该溶液,并在室温下温育45min。除了每种信号寡核苷酸的最终浓度为0.15μm之外,实验5至8的程序相同。然后,将细胞在室温下用sm-w洗涤缓冲液以每孔200μl洗涤3次,2min。
[0506]
g.荧光和白光成像
[0507]
将细胞在室温下用每孔200μl成像缓冲液洗涤一次。在没有trolox的实验(见表7,最后一列)中,成像缓冲液包括30mm柠檬酸na3、300mm nacl,ph7和5mm氧钒核糖核苷复合物。在具有trolox的实验中,成像缓冲液还包含10%vectacell trolox antifade试剂(vector laboratories,目录号:cb-1000),得到的最终trolox浓度为10mm。
[0508]
具有数值孔径为1.4的63x浸油物镜(zeiss,复消色差物镜)、pco.edge 4.2cmos摄像头(pco ag)和led光源(zeiss,colibri 7)的zeiss axiovert 200m显微镜用于区域成像。滤光片组和led波长根据所用荧光团的不同最优值进行调整。每张图像的照明时间对于alexa fluor 546和atto 594为1000ms,对于alexa fluor 488为400ms。
[0509]
在每个实验中,随机选择三个区域进行成像。对于每个区域,检测到32张图像的z堆栈(z-stack),z步长为350nm。此外,从这些区域拍摄了一张白光图像。在具有超过一个检测循环的实验中,第一轮检测的区域会在随后的每一轮中被发现并成像。
[0510]
h.选择性变性
[0511]
对于选择性变性,每个孔在42℃下用200μl的sm-洗涤缓冲液温育6min。该程序重复六次。
[0512]
在实验1至4中,步骤(e)至(h)重复5次。在第5个检测循环中省略步骤(h)。
[0513]
i.分析
[0514]
基于自定义imagej插件,对原始数据进行了半自动分析,以区分背景中的特定荧光信号。所有三个荧光通道的所得3d点云在计算机中与自定义vba脚本组合。5个检测循环的所得组合3d点云在vba脚本的基础上相互比对。所得比对揭示了检测到的唯一独特信号的码字。成功解码的信号用于基于自定义vba脚本和imagej插件的实验的定量和空间分析。
[0515]
结果
[0516]
1.解码信号的绝对数量
[0517]
下表4中列出了每个实验的每个区域的所有转录物的成功解码信号的绝对数量。总之,正确代码的总和描述了分配给相应实验中可检测的转录物的解码信号的总数,而错误代码的总和是相应实验中未检测到的解码信号的总数。信号总数包括成功解码和未成功解码的信号。
[0518]
[0519]
[0520]
[0521]
[0522][0523]
表4:解码信号的绝对数量
[0524]
表4示出与正确解码信号的数量相比,错误解码信号的数量非常少。某个转录物的解码信号的绝对值在一个实验的不同区域之间非常相似。可以成功解码的信号总数的比例在27.1%至64.5%之间。该比例取决于相应区域/实验中存在的转录物的数量和/或信号的总数。
[0525]
结论
[0526]
根据本公开的方法产生少量错误分配的码字,并且因此可以被认为是特异性的。成功解码信号的比例非常高,即使每个区域的信号数量非常高并且平行检测的转录物的数量非常高。可分配信号的高比例和高特异性使该方法具有实用性。
[0527]
不同实验之间相对转录物丰度的比较
[0528]
如图8中示出,对于两个比较(a和b),将实验之间检测到的转录物的重叠用于分析。每个条代表实验的所有三个区的平均丰度。还指出了这些区域之间的标准偏差。
[0529]
不同实验之间相对转录物丰度的相关性
[0530]
如从图9中可以看出,实验1的转录物的平均相对丰度与实验3、4和2的重叠转录物的丰度相关。相关系数以及用于线性回归的公式针对每个相关性进行了指示。
[0531]
图8示出了低标准偏差,表明一个实验的不同区域之间相对丰度的低变化。来自不同实验的转录物之间的相对丰度差异也非常低。对于来自在实验1、2和3中检测到的第1组的转录物的比较(图8a),也是这种情况。对于来自在实验1、2和4之间重叠的第2、3和4组的转录物,也是这种情况。这些丰度的非常高的相关性也可以在图9中看到。来自实验1的转录物的丰度与其他多轮实验的丰度非常相关。相关因子介于0.88和0.91之间,而线性回归的斜率介于0.97和1.05之间。
[0532]
结论
[0533]
转录物的相对丰度在一个实验的不同区域之间而且还在不同实验之间非常相关。这可以通过图3和图4的比较清楚地看出。实验之间的主要差异在于不同靶标的数量和因此检测到的信号的总数。因此,检测到的转录物数量以及信号的数量和密度不会干扰该方法准确量化转录物数量的能力。非常好的相关性进一步支持该方法的特异性和稳定性,即使信号数量非常多。
[0534]
细胞间信号分布的比较
[0535]
在图10中,示出了图像堆栈的最大投影。a:实验7的区域1(单轮、单转录物实验检测spock1),b:来自实验1区域1的所有选定信号的2d投影,分配给spock1,c:实验8的区域1(单轮、单转录物实验检测thrap3),d:来自实验1区域1的所有选定信号的2d投影,分配给thrap3。
[0536]
细胞内信号分布的比较
[0537]
在图11中,示出了图像堆栈的最大投影。示出了相应区域的放大子区域。a:实验8的区域1(单轮、单转录物实验检测thrap3),b:来自实验1区域1的选定信号的2d投影,分配给thrap3,c:实验5的区域1(单轮、单转录物实验检测ddx5),d:来自实验1区域1的所有选定信号的2d投影,分配给ddx5。
[0538]
图10示出了不同转录物之间细胞间分布的巨大差异。spock1似乎在一些细胞中非常丰富,但在其他细胞中几乎不存在(图10a)。thrap3在区域的所有细胞中示出更均匀的分布(图10c)。这些空间分布模式也可以通过分配给来自实验1的相应转录物的点云来清楚地观察到(图10b和d)。
[0539]
图11示出了不同转录物之间细胞间分布的巨大差异。thrap3可以主要在细胞的外周(细胞质)中观察到(图11a),而ddx5在细胞的中央(细胞核)中示出更高的丰度(图11c)。这些细胞内分布也可以通过分配给thrap3和ddx5的实验1的点云来观察(图11b和d)。
[0540]
结论
[0541]
除了量化的可靠性之外,多轮实验的点云也示出转录物的相同细胞内和细胞间分布模式。通过将分配的点云与仅检测一种特征mrna种类的单轮实验信号进行直接比较来清楚地证明了这一点。
[0542]
不同细胞周期依赖性转录物的分布模式
[0543]
图12的所有图像都示出了实验1的区域1。在每个图像中,示出了分配给某个转录物的点云,a:ccna2,b:cenpe,c:ccne1,d:所有转录物。图12示出了三种不同的细胞周期依赖性蛋白质的转录物。cenpe(图12b)也称为着丝粒蛋白质e,并且在g2期的期间积累。它被提出负责纺锤体伸长和染色体运动。它在分裂间期的期间不存在。ccna2(图12a)也称为周期蛋白a2。它通过在从g2期到m期的过渡期间与cdk1相互作用来调节细胞周期进程。有趣的是,两种mrna种类都存在明显的共定位。它们主要存在于区域1的三种中央细胞中。ccne1(图12c)也称为周期蛋白e1。这种周期蛋白与cdk2相互作用并负责从g1期到s期的过渡。图12清楚地示出,该基因的转录物不存在于三种中央细胞中,而是相当均匀地分布在其他细胞中。因此,它示出了相对于其他两个转录物的反定位。对应点云的数据来源于具有非常多数量的点并且点密度非常高的点云(图12d给出印象)。
[0544]
结论
[0545]
图12中示出的细胞周期依赖蛋白的三个解码点云示出了可以通过其相应功能解释的分布模式。这些数据强烈表明,本公开的的方法可靠地产生生物学相关数据,即使每个细胞的信号数量很少(图12c)并且信号密度非常高(图12d)。
[0546]
序列表
[0547]
在随附的序列表中,seq id no.1-1247是指示例性靶标特异性寡核苷酸的核苷酸序列。列出的寡核苷酸由靶标特异性结合位点(5'-端)、间隔物/接头序列(gtaac或tagac)和唯一标识符序列组成,这对于一个探针组的所有寡核苷酸都是相同的。
[0548]
在随附的序列表中,seq id no.1248-1397是指示例性解码寡核苷酸的核苷酸序列。
[0549]
在随附的序列表中,seq id no.1398-1400是指示例性信号寡核苷酸的核苷酸序列。对于每个信号寡核苷酸,相应的荧光团出现两次。一个荧光团与5'-端共价连接,并且一个荧光团与3'-端共价连接。seq id no.1398在其5'末端包括“5alex488n”,并且在其3'末端包括“3alexf488n”。seq id no.1399在其5'末端包括“5alex546”,并且在其3'末端包括“3alex546n”。seq id no.1400在其5'末端以及在其3'末端包括“atto594”。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1