使用抗BETV1抗体治疗过敏的方法与流程
使用抗bet v 1抗体治疗过敏的方法
技术领域
1.本公开涉及结合bet v 1的人抗体用于治疗或预防有需要的受试者的过敏反应和过敏性疾病的用途。
2.序列表
3.序列表的副本作为ascii格式的序列表通过efs-web以电子方式与本说明书同时提交,文件名为10821wo01_sequence_listing_st25,创建日期为2021年6月30日,并且大小为约32千字节。包含在该ascii格式文档中的序列表是说明书的一部分,并通过引用整体并入本文。
背景技术:
4.过敏性鼻炎(ar)是一种以一种或多种症状为特征的过敏性疾病,所述症状包含打喷嚏、瘙痒、鼻塞和鼻漏,并且还经常包含如疲劳、不适、易怒和可能的神经认知缺陷等症状。结膜炎也很常见,约65%的ar患者报告了结膜炎(rosario和bielory,《过敏与临床免疫学最新观点(current opinion in allergy and clinical immunology)》2011,11:471-476)。过敏性鼻炎影响欧洲约1亿人,并且发病率正在增加(wallace等人,《过敏与临床免疫学杂志(journal of allergy and clinical immunology)》2008,122:s1-84)。患有ar的人可能对花粉、霉菌、尘螨和/或动物皮屑过敏。通过过敏原特异性阳性皮肤点刺测试(spt)和/或阳性过敏原特异性ige抗体测试,通过免疫球蛋白e(ige)介导的炎症的阳性病史和证据证实ar的诊断。
5.在欧洲和美国,桦树的临床相关敏感影响了约20%至30%的过敏群体(参见例如pablos等人,《当前过敏和哮喘报告(current allergy and asthma reports)》2016,16:31)。桦树花粉含有过敏性和非过敏性蛋白质的混合物;bet v 1是最丰富的过敏性花粉蛋白(erler等人,《蛋白质组学(proteomics)》2011 11:1486-1498;schenk等人,《蛋白质组学杂志(journal of proteomic)》2011,74:1290-1300)。桦树过敏个体对bet v 1的敏感率达到》95%。由于粒径较大(》5μm),通常不会观察到花粉颗粒穿透下呼吸道,并且主要影响鼻部和眼部症状。然而,咳嗽和喘息并不罕见,并且与大气中可检测到的可吸入浓度的bet v 1相关,这表明花粉碎片可以穿透下呼吸道并加重哮喘(参见例如,taylor等人,《临床和实验过敏(clinical and experimental allergy)》2004,34:1591-1596;taylor等人,《国际过敏与免疫学档案(international archives of allergy and immunology)》2007,144:162-170)。此外,仲春花粉暴露与鼻炎非处方药的增加和哮喘相关急诊就诊的高峰有关;5岁至17岁的儿童与桦树、橡树、山毛榉和白蜡树花粉过敏的关联最为密切(ito等人,《环境健康:全球访问科学资源(environmental health:a global access science source)》2015,14:71)。高达70%的患有花粉过敏的人也会对特定的新鲜水果、蔬菜和坚果产生口腔反应,即口腔过敏综合征(oas),也称为花粉食物过敏。口腔过敏综合征不是一种单独的食物过敏,而是由于花粉和相关食物中存在的交叉反应表位而发生的;口腔过敏综合征症状通常表现为嘴唇、口腔和喉咙瘙痒,但可能涉及嘴唇和舌头肿胀和血管性水肿(bucher等
人,《过敏(allergy)》2004,59:1272-1276),导致人们避免食用这些新鲜水果、蔬菜和坚果。
6.用于治疗ar的建议包含避免过敏原、提供短期症状缓解的药物,如抗组胺药和鼻内皮质类固醇,以及过敏原特异性免疫疗法(sit)。尽管抗组胺药和鼻内皮质类固醇被广泛使用,但高达约一半的ar患者报告症状控制不佳或仅部分症状控制和短期缓解(参见例如,wallace等人,《过敏与临床免疫学最新观点》2017,17:286-294;wei,《生物医学与药物治疗(biomedicine&pharmacotherapy)》2016,83:989-997)。尽管使用了抗组胺药和鼻内皮质类固醇,但当ar的中度至重度症状持续存在时,仍需要进行特异性免疫疗法。尽管过敏原特异性sit在皮下免疫疗法(scit)和作为舌下免疫疗法(slit)片剂或滴剂中的应用已经成熟,但sit仍有许多局限性。例如,sit的功效是中等的,与服用安慰剂的人相比,完成治疗的人的过敏症状改善了约20%至30%,并且可能需要至少3年才能诱导免疫耐受(参见例如,nolte等人,《过敏与临床免疫学杂志》2016,138:1631-1638)。另外,sit的功效要求高依从性,以防止过敏原暴露后的鼻炎症状。scit的副作用发生在40%至50%的患者中,范围从轻度反应(例如,肿胀、注射部位反应、新生过敏应答和荨麻疹)到危及生命的反应(例如,哮喘加重和过敏反应)(参见例如,frew,《过敏与临床免疫学杂志》2010,125:s306-313)。另外,哮喘是对scit产生危及生命的全身反应的主要危险因素,因此中度至重度哮喘是scit的禁忌症。因此,仍然需要安全有效的疗法来治疗患有过敏的人。
技术实现要素:
7.一方面,提供了治疗受试者的桦树过敏的方法。在一些实施例中,所述方法包括向所述受试者施用一种或多种药物组合物,所述药物组合物包括:
8.(a)第一抗bet v 1抗体或其抗原结合片段,其中所述第一抗bet v 1抗体包括包含seq id no:2的氨基酸序列的重链互补决定区(hcdr)1、包含seq id no:3的氨基酸序列的hcdr2、包含seq id no:4的氨基酸序列的hcdr3、包含seq id no:6的氨基酸序列的轻链互补决定区(lcdr)1、包含seq id no:7的氨基酸序列的lcdr2以及包含seq id no:8的氨基酸序列的lcdr3;和/或
9.(b)第二抗bet v 1抗体或其抗原结合片段,其中所述第二抗bet v 1抗体包括包含seq id no:12的氨基酸序列的hcdr1、包含seq id no:13的氨基酸序列的hcdr2、包含seq id no:14的氨基酸序列的hcdr3、包含seq id no:16的氨基酸序列的lcdr1、包含seq id no:17的氨基酸序列的lcdr2以及包含seq id no:18的氨基酸序列的lcdr3;和/或
10.(c)第三抗bet v 1抗体或其抗原结合片段,其中所述第三抗bet v 1抗体包括包含seq id no:22的氨基酸序列的hcdr1、包含seq id no:23的氨基酸序列的hcdr2、包含seq id no:24的氨基酸序列的hcdr3、包含seq id no:26的氨基酸序列的lcdr1、包含seq id no:27的氨基酸序列的lcdr2以及包含seq id no:28的氨基酸序列的lcdr3。
11.另一方面,提供了减少受试者对壳斗目过敏原(fagales allergen)的过敏反应的一种或多种症状的方法。在一些实施例中,所述方法包括向所述受试者施用一种或多种药物组合物,所述药物组合物包括:
12.(a)第一抗bet v 1抗体或其抗原结合片段,其中所述第一抗bet v 1抗体包括包含seq id no:2的氨基酸序列的hcdr1、包含seq id no:3的氨基酸序列的hcdr2、包含seq id no:4的氨基酸序列的hcdr3、包含seq id no:6的氨基酸序列的lcdr1、包含seq id no:7
的氨基酸序列的lcdr2以及包含seq id no:8的氨基酸序列的lcdr3;和/或
13.(b)第二抗bet v 1抗体或其抗原结合片段,其中所述第二抗bet v 1抗体包括包含seq id no:12的氨基酸序列的hcdr1、包含seq id no:13的氨基酸序列的hcdr2、包含seq id no:14的氨基酸序列的hcdr3、包含seq id no:16的氨基酸序列的lcdr1、包含seq id no:17的氨基酸序列的lcdr2以及包含seq id no:18的氨基酸序列的lcdr3;和/或
14.(c)第三抗bet v 1抗体或其抗原结合片段,其中所述第三抗bet v 1抗体包括包含seq id no:22的氨基酸序列的hcdr1、包含seq id no:23的氨基酸序列的hcdr2、包含seq id no:24的氨基酸序列的hcdr3、包含seq id no:26的氨基酸序列的lcdr1、包含seq id no:27的氨基酸序列的lcdr2以及包含seq id no:28的氨基酸序列的lcdr3。
15.在一些实施例中,所述壳斗目过敏原是bet v 1。在一些实施例中,所述受试者对bet v 1和至少一种其它壳斗目过敏原敏感。在一些实施例中,所述至少一种其它壳斗目过敏原是桤木、榛树、橡木、角树、铁木、山毛榉、栗子、榛子或苹果。
16.另一方面,提供了治疗患有与桦树和交叉反应花粉相关的季节性或常年性过敏的受试者的方法。在一些实施例中,所述受试者患有中度至重度季节性过敏或中度至重度常年性过敏。在一些实施例中,所述方法包括向所述受试者施用一种或多种药物组合物,所述药物组合物包括:
17.(a)第一抗bet v 1抗体或其抗原结合片段,其中所述第一抗bet v 1抗体包括包含seq id no:2的氨基酸序列的hcdr1、包含seq id no:3的氨基酸序列的hcdr2、包含seq id no:4的氨基酸序列的hcdr3、包含seq id no:6的氨基酸序列的lcdr1、包含seq id no:7的氨基酸序列的lcdr2以及包含seq id no:8的氨基酸序列的lcdr3;和/或
18.(b)第二抗bet v 1抗体或其抗原结合片段,其中所述第二抗bet v 1抗体包括包含seq id no:12的氨基酸序列的hcdr1、包含seq id no:13的氨基酸序列的hcdr2、包含seq id no:14的氨基酸序列的hcdr3、包含seq id no:16的氨基酸序列的lcdr1、包含seq id no:17的氨基酸序列的lcdr2以及包含seq id no:18的氨基酸序列的lcdr3;和/或
19.(c)第三抗bet v 1抗体或其抗原结合片段,其中所述第三抗bet v 1抗体包括包含seq id no:22的氨基酸序列的hcdr1、包含seq id no:23的氨基酸序列的hcdr2、包含seq id no:24的氨基酸序列的hcdr3、包含seq id no:26的氨基酸序列的lcdr1、包含seq id no:27的氨基酸序列的lcdr2以及包含seq id no:28的氨基酸序列的lcdr3。
20.对于本文所公开的方法,在一些实施例中,所述药物组合物包括所述第一抗bet v 1抗体。在一些实施例中,所述药物组合物包括所述第二抗bet v 1抗体。在一些实施例中,所述药物组合物包括所述第三抗bet v 1抗体。在一些实施例中,所述药物组合物包括所述第一抗bet v 1抗体和所述第二抗bet v 1抗体。在一些实施例中,所述药物组合物包括所述第一抗bet v 1抗体和所述第三抗bet v 1抗体。在一些实施例中,所述药物组合物包括所述第二抗bet v 1抗体和所述第三抗bet v 1抗体。在一些实施例中,所述药物组合物包括所述第一抗bet v 1抗体、所述第二抗bet v 1抗体和所述第三抗bet v 1抗体。
21.在一些实施例中,所述抗bet v 1抗体在单个药物组合物中提供。在一些实施例中,所述抗bet v 1抗体在一种以上的药物组合物中提供,例如,单独的药物组合物中的每个抗bet v 1抗体。
22.在一些实施例中,所述药物组合物包括约5mg至约500mg的独立选择的剂量的所述
一种或多种抗bet v 1抗体(例如,所述第一抗bet v 1抗体、所述第二抗bet v 1抗体和所述第三抗bet v 1抗体中的每一种)。在一些实施例中,所述药物组合物包括约50mg、约100mg、约150mg、约200mg、约250mg、约300mg、约350mg、约400mg、约450mg或约500mg的独立选择的剂量的所述一种或多种抗bet v 1抗体(例如,所述第一抗bet v 1抗体、所述第二抗bet v 1抗体和所述第三抗bet v 1抗体中的每一种)。在一些实施例中,所述药物组合物包括约50mg的剂量的所述第一抗bet v 1抗体、所述第二抗bet v 1抗体和所述第三抗bet v 1抗体中的每一种。在一些实施例中,所述药物组合物包括约150mg的剂量的所述第一抗bet v 1抗体、所述第二抗bet v 1抗体和所述第三抗bet v 1抗体中的每一种。在一些实施例中,所述药物组合物包括约300mg的剂量的所述第一抗bet v 1抗体、所述第二抗bet v 1抗体和所述第三抗bet v 1抗体中的每一种。
23.在一些实施例中,皮下施用所述一种或多种抗bet v 1抗体或包括所述一种或多种抗bet v 1抗体的所述药物组合物。在一些实施例中,静脉内施用所述一种或多种抗bet v 1抗体或包括所述一种或多种抗bet v 1抗体的所述药物组合物。
24.在一些实施例中,施用单剂量的所述一种或多种抗bet v 1抗体或包括所述一种或多种抗bet v 1抗体的所述药物组合物。在一些实施例中,所述一种或多种抗bet v 1抗体或包括所述一种或多种抗bet v 1抗体的所述药物组合物在花粉季节开始之前施用一次。
25.在一些实施例中,所述第一抗bet v 1抗体包括包含seq id no:1的氨基酸序列的重链可变区(hcvr)以及包含seq id no:5的氨基酸序列的轻链可变区(lcvr)。在一些实施例中,所述第一抗bet v 1抗体包括包含seq id no:9的氨基酸序列的重链以及包含seq id no:10的氨基酸序列的轻链。
26.在一些实施例中,所述第二抗bet v 1抗体包括包含seq id no:11的氨基酸序列的hcvr以及包含seq id no:15的氨基酸序列的lcvr。在一些实施例中,所述第二抗bet v 1抗体包括包含seq id no:19的氨基酸序列的重链以及包含seq id no:20的氨基酸序列的轻链。
27.在一些实施例中,所述第三抗bet v 1抗体包括包含seq id no:21的氨基酸序列的hcvr以及包含seq id no:25的氨基酸序列的lcvr。在一些实施例中,所述第三抗bet v 1抗体包括包含seq id no:29的氨基酸序列的重链以及包含seq id no:30的氨基酸序列的轻链。
28.在一些实施例中:
29.用所述药物组合物治疗降低受试者的总鼻部症状评分(tnss);
30.用所述药物组合物治疗降低受试者的总眼部症状评分(toss);
31.用所述药物组合物治疗降低受试者的总症状评分(tss);
32.用所述药物组合物治疗降低受试者的每日药物评分(dms);
33.用所述药物组合物治疗降低受试者的组合症状和药物评分(csms);
34.用所述药物组合物治疗降低受试者的桦树皮肤点刺测试(spt)平均风团直径;和/或
35.用所述药物组合物治疗增加受试者未使用补救药物且所述受试者的tss≤2,总分为18的“良好日”的数量。
36.在一些实施例中,在至少28天、57天、85天或113天内测量所述tnss、toss、tss、dms、csms、spt平均风团直径和/或良好日的数量。在一些实施例中,在桦树花粉季节的持续时间内测量所述tnss、toss、tss、dms、csms、spt平均风团直径和/或良好日的数量。
37.在一些实施例中,用所述药物组合物治疗减少所述受试者的过敏性鼻炎症状。在一些实施例中,用所述药物组合物治疗:相对于治疗开始前所述受试者在鼻部过敏原攻击(nac)后的基线tnss auc(0小时至1小时)值,降低nac后受试者的总鼻部症状评分(tnss)auc(0小时至1小时)(例如,降低至少约15%、20%、25%、30%、35%、40%、45%、50%或更多);和/或相对于治疗开始前所述受试者在nac后的基线峰值tnss值,降低nac后受试者的峰值tnss(例如,降低至少约15%、20%、25%、30%、35%、40%、45%、50%或更多)。
38.在一些实施例中,施用单剂量的所述药物组合物:在施用所述药物组合物后的至少两个月内,将nac后受试者的tnss auc(0小时至1小时)降低至少约20%;和/或在施用所述药物组合物后的至少两个月内,将nac后受试者的峰值tnss降低至少约25%。
39.在一些实施例中,用所述药物组合物治疗可减少所述受试者的过敏性结膜炎症状。在一些实施例中,用所述药物组合物治疗:相对于治疗开始前所述受试者的基线总眼部症状评分(toss)值,降低受试者的toss(例如,降低至少约15%、20%、25%、30%、35%、40%、45%、50%或更多);和/或相对于治疗开始前所述受试者在nac后的基线toss auc(0小时至1小时)值,降低nac后受试者的toss auc(0小时至1小时)(例如,降低至少约15%、20%、25%、30%、35%、40%、45%、50%或更多)。
40.在一些实施例中,相对于治疗开始前所述受试者的基线csms或对照csms,用所述药物组合物治疗降低受试者在桦树花粉季节期间的组合症状和药物评分(csms)(例如,降低至少约10%、15%、20%、25%、30%、35%、40%、45%、50%或更多)。
41.在一些实施例中,相对于治疗开始前所述受试者的基线pnif值,用所述药物组合物治疗提高所述受试者的峰值鼻吸气流量(pnif)(例如,提高至少约25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%或更多)。
42.在一些实施例中,用所述药物组合物治疗降低所述受试者的桦树敏感(例如,降低至少约30%、40%、50%、60%、70%、80%、90%或更多),如通过使用桦树过敏原提取物的皮肤点刺测试(spt)测量的。在一些实施例中,在施用所述药物组合物后的至少两个月(例如,至少三个月、至少四个月、至少五个月或至少六个月)内,施用单剂量的所述药物组合物可将所述受试者的桦树敏感降低至少约60%或更多。
43.在一些实施例中,对于所述过敏原(例如,桦树花粉、bet v 1过敏原或壳斗目过敏原),待治疗的所述受试者的基线血清过敏原特异性ige水平≥0.35kua/l。在一些实施例中,待治疗的所述受试者具有使用过敏原(例如,桦树过敏原提取物或壳斗目过敏原)的基线阳性spt。
44.另一方面,提供了一种混合物,所述混合物包括两种或更多种抗bet v 1抗体或其抗原结合片段,用于治疗受试者的桦树过敏的方法中的用途。在一些实施例中,所述方法包括向有需要的受试者(例如,患有桦树过敏的受试者)施用如本文所公开的混合物。
45.另一方面,提供了包括两种或更多种抗bet v 1抗体或其抗原结合片段的混合物在药物制备中的用途,所述药物用于治疗受试者桦树过敏的方法中的用途。在一些实施例中,所述方法包括向有需要的受试者(例如,患有桦树过敏的受试者)施用如本文所公开的
混合物。
46.另一方面,提供了一种混合物,所述混合物包括两种或更多种抗bet v 1抗体或其抗原结合片段,用于减少受试者对壳斗目过敏原的过敏反应的一种或多种症状的方法中的用途。在一些实施例中,所述方法包括向有需要的受试者(例如,对壳斗目过敏原具有一种或多种过敏反应症状的受试者)施用如本文所公开的混合物。
47.另一方面,提供了包括两种或更多种抗bet v 1抗体或其抗原结合片段的混合物在药物制备中的用途,所述药物用于减少受试者对壳斗目过敏原的过敏反应的一种或多种症状的方法中的用途。在一些实施例中,所述方法包括向有需要的受试者(例如,对壳斗目过敏原具有一种或多种过敏反应症状的受试者)施用如本文所公开的混合物。
48.另一方面,提供了一种混合物,所述混合物包括两种或更多种抗bet v 1抗体或其抗原结合片段,用于治疗患有与桦树和交叉反应花粉相关的季节性或常年性过敏的受试者的方法中的用途。在一些实施例中,所述方法包括向有需要的受试者(例如,提供了患有与桦树和交叉反应花粉相关的季节性或常年性过敏的受试者)施用如本文所公开的混合物。
49.另一方面,提供了包括两种或更多种抗bet v 1抗体或其抗原结合片段的混合物在药物制备中的用途,所述药物用于治疗患有与桦树和交叉反应花粉相关的季节性或常年性过敏的受试者的方法中的用途。在一些实施例中,所述方法包括向有需要的受试者(例如,提供了患有与桦树和交叉反应花粉相关的季节性或常年性过敏的受试者)施用如本文所公开的混合物。
50.通过阅读随后的详细描述,其它实施例将显而易见。
附图说明
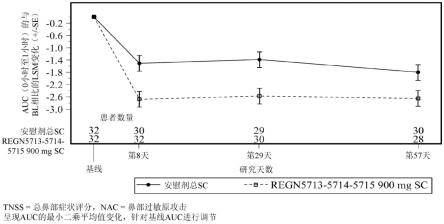
51.图1示出了与安慰剂相比,单剂量的抗bet v 1抗体混合物在给药后第8天(δ-1.2,p=0.001)、第29天(δ-1.2,p=0.001)和第57天(δ-0.9,p=0.024)降低了鼻部过敏原攻击(nac)后的总鼻部症状评分(tnss)auc(0小时至1小时)。呈现auc的最小二乘平均值变化,针对基线auc进行调节。圆圈=安慰剂;方块=抗bet v 1抗体混合物。
52.图2示出了与安慰剂相比,单剂量的抗bet v 1抗体混合物在给药后第8天(δ-32%,p=0.002)、第29天(δ-27%,p=0.003)和第57天(δ-19%,p=0.053)降低了nac后的tnss auc(0小时至1小时),以变化百分比测量。呈现auc的最小二乘平均值变化百分比,针对基线auc进行调节。圆圈=安慰剂;方块=抗bet v 1抗体混合物。
53.图3示出了与安慰剂相比,单剂量的抗bet v 1抗体混合物在给药后第8天(δ-35%,p=《0.001)、第29天(δ-29%,p《0.001)和第57天(δ-26%,p=0.003)降低了nac后的峰值tnss。在每个攻击时间点,使用患者在基线筛选攻击时达到tnss≥7所需的特定合格过敏原剂量评估受试者的tnss。圆圈=安慰剂;方块=抗bet v 1抗体混合物。
54.图4a示出了与安慰剂相比,单剂量的抗bet v 1抗体混合物在降低桦树敏感方面表现出持久的应答,这是通过第8天(δ-72%,p《0.001)、第29天(δ-66%,p《0.001)、第57天(δ-78%,p《0.001)和第113天(δ-74%,p《0.001)皮肤点刺测试中平均风团直径(mm)的auc与基线相比的变化百分比来测量的。圆圈=安慰剂;方块=抗bet v 1抗体混合物。
55.图4b示出了与安慰剂相比,单剂量的抗bet v 1抗体混合物在降低对桤木的敏感方面表现出持久的应答,这是通过第8天(δ-45%,p《0.001)、第29天(δ-46%,p《0.001)、
第57天(δ-53%,p《0.001)和第113天(δ-50%,p《0.001)皮肤点刺测试中平均风团直径(mm)的auc与基线相比的变化百分比来测量的。圆圈=安慰剂;方块=抗bet v 1抗体混合物。
56.图5a示出了与安慰剂相比,单剂量的抗bet v 1抗体混合物在给药后第8天(δ-0.48,p=0.013)、第29天(δ-0.59,p=0.007)和第57天(δ-0.30,p=0.191)降低了nac后的总眼部症状评分(toss)auc(0小时至1小时)。呈现auc的最小二乘平均值变化,针对基线auc进行调节。圆圈=安慰剂;方块=抗bet v 1抗体混合物。
57.图5b示出了与安慰剂相比,单剂量的抗bet v 1抗体混合物在给药后第8天(δ-42%,p《0.01)、第29天(δ-48%,p《0.05)和第57天(δ-37%)降低了nac后的toss auc(0小时至1小时),以变化百分比测量。呈现auc的最小二乘平均值变化百分比,针对基线auc进行调节。圆圈=安慰剂;方块=抗bet v 1抗体混合物。
58.图6示出了与安慰剂相比,单剂量的抗bet v 1抗体混合物提高了第8天(δ32%,p=0.092)、第29天(δ47%,p=0.017)和第57天(δ35%,p=0.121)的峰值鼻吸气流量(pnif);第29天达到统计学显著性。呈现auc的最小二乘平均值变化百分比,针对基线auc进行调节。圆圈=安慰剂;方块=抗bet v 1抗体混合物。
59.图7a至7e示出了与安慰剂组相比,在用抗bet v 1抗体混合物治疗的患者中,观察到嗜碱性粒细胞对桦树、桤木、榛树和苹果花粉的应答性受到显著抑制,而在草过敏原阴性对照中,未检测到嗜碱性粒细胞应答受到抑制。(a)通过ec50测量嗜碱性粒细胞对桦树花粉提取物的应答性。如通过ec值测量的,与安慰剂相比,观察到治疗组(n=13)中嗜碱性粒细胞对桦树过敏原的应答性受到显著抑制(第8天、第57天均为p《0.001;第113天p《0.01)。(b)通过ec50测量嗜碱性粒细胞对桤木花粉提取物的应答性。与安慰剂(n=13)相比,观察到治疗组(n=13)中嗜碱性粒细胞对桤木过敏原的应答性受到显著抑制,通过ec50的与基线相比的变化百分比来测量(第8天、第57天、第113天均为p《0.001)。(c)通过ec50测量嗜碱性粒细胞对榛树花粉提取物的应答性。与安慰剂(n=13)相比,观察到治疗组(n=13)中嗜碱性粒细胞对榛树过敏原的应答性受到显著抑制,通过ec50的与基线相比的变化百分比来测量(第8天,p《0.001,第57天,p=0.01)。(d)通过ec50测量嗜碱性粒细胞对苹果花粉提取物的应答性。与安慰剂(n=13)相比,观察到治疗组(n=13)的嗜碱性粒细胞对苹果过敏原的应答性受到显著抑制,通过ec50的与基线相比的变化百分比来测量(第8天、p《0.01,第57天和第113天,p《0.05)。(e)通过ec50测量嗜碱性粒细胞对草花粉提取物的应答性。
60.图8示出了用抗bet v 1抗体混合物治疗的患者中嗜碱性粒细胞激活的抑制(ec50值)和皮肤点刺测试(spt)中的降低之间的相关性。在第8天(r=-0.6,p=0.04)和第57天(r=-0.57,p=0.04),观察到桦树bat ec50与桦树spt(平均风团直径)auc的变化百分比呈负相关。在接受安慰剂的受试者中未观察到显著相关性。
61.图9a至9b示出了用抗bet v 1抗体混合物治疗的患者中嗜碱性粒细胞激活抑制(ec50值)和tnss应答(tnss
(0小时至1小时)
auc的变化百分比)之间的相关性。(a)第8天观察到ec50值与tnss
(0小时至1小时)
auc的改善%呈统计学显著负相关(r=-0.71,p=0.0095)。在接受安慰剂的受试者中未观察到显著相关性。(b)积极治疗组的应答者分析(tnss
(0小时至1小时)
auc降低≥60%与《60%)。
具体实施方式
62.定义
63.在描述本发明之前,应当理解,本发明不限于所描述的特定方法和实验条件,因为此类方法和条件可以变化。还应当理解,本文所用的术语仅用于描述具体实施例的目的,而无意进行限制,因为本发明的范围将仅由所附权利要求书限制。
64.除非另外定义,否则本文使用的所有技术和科学术语都具有与本发明所属领域的普通技术人员通常所理解相同的含义。
65.如本文所用,在提到具体列举的数值中使用时,术语“约”意指所述值可以从列举的值变动不大于1%。举例来说,如本文所用,表述“约100”包含99和101以及它们之间的全部值(例如,99.1、99.2、99.3、99.4等)。
66.如本文所使用的,术语“治疗(treat)”、“治疗(treating)”等意指缓解症状、暂时或永久消除症状的原因、或预防或减慢所述病症或病状的出现。
67.如本文所使用的,术语“bet v 1”是指天然/天然形式或重组产生的bet v 1蛋白。天然bet v 1蛋白约为17kd,并且以7链反平行β-折叠(β1
–
β7)、连接β1和β2的两个短α-螺旋(α1和α2)、长c端α-螺旋(α3)以及β2与β3之间富含甘氨酸的环基序的形式存在(kofler等人,《分子生物学杂志(j.mol.biol.)》2012,422(1):109-123)。在一些实施例中,bet v 1蛋白包括seq id no:31的氨基酸序列。在一些实施例中,bet v 1蛋白包括天然存在或重组产生的形式,其包括相对于seq id no:31的一个或多个氨基酸取代、缺失或添加。例如,在一些实施例中,bet v 1蛋白包括seq id no:32的氨基酸序列(来自uniprot:p15494的bet v 1氨基酸序列)。
68.如本文所使用的,术语“bet v 1片段”是指具有至少一个bet v1的抗原位点的多肽。在一些实施例中,bet v 1片段是具有bet v 1的至少两个抗原位点的多肽。在一些实施例中,抗原位点是共价连接的。在一些实施例中,抗原位点通过至少一个肽键连接。在一个实施例中,两个抗原位点通过至少一个肽键和抗原位点之间的间隔子连接。示例性bet v 1片段在wo2018/222854中公开,所述文献通过引用并入本文。
69.如本文所使用的,术语“抗体”是指抗原结合分子或分子复合物,所述抗原结合分子或分子复合物包括一组与特定抗原(例如,bet v 1)特异性结合或相互作用的互补决定区(cdr)。如本文所使用的,术语“抗体”包含包括四个多肽链、通过二硫键相互连接的两个重(h)链和两个轻(l)链以及其多聚体(例如,igm)的免疫球蛋白分子。在典型抗体中,每个重链包括重链可变区(在本文中缩写为hcvr或vh)和重链恒定区。重链恒定区包括三个结构域ch1、ch2和ch3。每条轻链包括轻链可变区(在本文中缩写为lcvr或v
l
)和轻链恒定区。轻链恒定区包括一个结构域(c
l
1)。vh区和v
l
区可以进一步再划分为高变区,称为互补决定区(cdr),其间插有更保守的区域,称为框架区(fr)。每个vh和v
l
由从氨基末端到羧基末端按照以下次序排列的三个cdr和四个fr构成:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。在一些实施例中,抗体(或其抗原结合部分)的fr可以与人种系序列相同,或者可以是天然的或经人工修饰的。可以基于两个或更多个cdr的并列分析来定义氨基酸共有序列。
70.如本文所使用的,术语“抗体”还包含完整抗体分子的抗原结合片段。本文中使用的术语抗体的“抗原结合部分”、抗体的“抗原结合片段”等包含特异性地结合抗原以形成复合物的任何天然存在的、酶促可获得的、合成的或遗传工程改造的多肽或糖蛋白。可以例如
使用任何合适的标准技术(诸如蛋白水解消化或涉及编码抗体可变结构域和任选地抗体恒定结构域的dna的操作和表达的重组基因工程技术)从全抗体分子衍生出抗体的抗原结合片段。这样的dna是已知的,和/或可以容易地从例如商业来源、dna文库(包含,例如噬菌体-抗体文库)获得,或者可以被合成。可以对dna测序,并化学地或通过使用分子生物学技术进行操作,例如,以将一个或多个可变结构域和/或恒定结构域排列为合适的构型,或导入密码子,产生半胱氨酸残基,修饰、添加或删除氨基酸等。
71.抗原结合片段的非限制性实例包含:(i)fab片段;(ii)f(ab')2片段;(iii)fd片段;(iv)fv片段;(v)单链fv(scfv)分子;(vi)dab片段;以及(vii)由模拟抗体的高变区的氨基酸残基组成的最小识别单位(例如,分离的互补决定区(cdr),如cdr3肽)或受约束的fr3-cdr3-fr4肽。其它工程化分子,如结构域特异性抗体、单结构域抗体、结构域缺失抗体、嵌合抗体、cdr嫁接抗体、双抗体、三抗体、四抗体、微抗体、纳米抗体(例如,单价纳米抗体、二价纳米抗体等)、小型模块化免疫药物(smip)和鲨鱼变异ignar结构域也涵盖在本文所使用的表述“抗原结合片段”内。
72.抗体的抗原结合片段通常将包括至少一个可变结构域。可变结构域可以具有任何尺寸或氨基酸组成并且通常将包括与一个或多个框架序列毗邻或符合读框的至少一个cdr。在具有vh结构域与v
l
结构域缔合的抗原结合片段中,vh和v
l
结构域可相对于彼此以任何合适的布置定位。例如,可变区可以是二聚体并且含有v
h-vh、v
h-v
l
或v
l-v
l
二聚体。可替代地,抗体的抗原结合片段可含有单体vh或v
l
结构域。
73.在某些实施例中,抗体的抗原结合片段可以含有与至少一个恒定结构域共价连接的至少一个可变结构域。可以在抗体的抗原结合片段内发现的可变结构域和恒定结构域的非限制性示例性构型包含:(i)v
h-ch1;(ii)v
h-ch2;(iii)v
h-ch3;(iv)v
h-ch1-ch2;(v)v
h-ch1-ch2-ch3;(vi)v
h-ch2-ch3;(vii)v
h-c
l
;(viii)v
l-ch1;(ix)v
l-ch2;(x)v
l-ch3;(xi)v
l-ch1-ch2;(xii)v
l-ch1-ch2-ch3;(xiii)v
l-ch2-ch3;以及(xiv)v
l-c
l
。在可变结构域和恒定结构域的任何构型(包含上面列出的任何示例性构型)中,可变结构域和恒定结构域可以彼此直接连接或者可以通过全长或部分铰链或接头区相连。铰链区可以由在单个多肽分子中邻近的可变结构域和/或恒定结构域之间产生柔性或半柔性连接的至少2个(例如,5个、10个、15个、20个、40个、60个或更多个)氨基酸组成。此外,抗体的抗原结合片段可以包括上文所列出的彼此和/或与一个或多个单体vh或v
l
结构域非共价缔合(例如,通过一个或多个二硫键)的可变结构域和恒定结构域构型中的任何一个的同源二聚体或异源二聚体(或其它多聚体)。
74.本文中使用的术语“抗体”也包含多特异性的(例如,双特异性的)抗体。多特异性抗体或抗体的抗原结合片段通常包括至少两个不同的可变结构域,其中每个可变结构域能够特异性地结合单独的抗原或相同抗原上的不同表位。任何多特异性抗体形式可以使用本领域可利用的常规技术改造,使其适用于本公开内容的抗体或抗体的抗原结合片段的背景。例如,本公开包含包括双特异性抗体的用途的方法,其中免疫球蛋白的一个臂对bet v 1或其片段具有特异性,并且所述免疫球蛋白另一个臂对于第二治疗靶具有特异性或与治疗部分缀合。可以在本公开的背景下使用的示例性双特异性形式包含但不限于例如,基于scfv的或双抗体双特异性形式、igg-scfv融合、双可变结构域(dvd)-ig、四杂交瘤(quadroma)、结节入孔(knobs-into-holes)、共同轻链(例如,具有结节入孔的共同轻链
等)、crossmab、crossfab、(seed)body、亮氨酸拉链、duobody、igg1/igg2、双作用fab(daf)-igg以及mab2双特异性形式(参见例如,klein等人,2012,《mabs》4:6,1-11,以及其中引用的参考文献,用于回顾前述形式)。还可以使用肽/核酸缀合构建双特异性抗体,例如,其中使用具有正交化学反应性的非天然氨基酸来产生位点特异性抗体-寡核苷酸缀合物,然后将其自组装成具有确定组成、价数和几何形状的多聚体复合物。(参见例如,kazane等人,《美国化学学会杂志(j.am.chem.soc.)》[电子版:2012年12月4日])。
[0075]
如本文所使用的,术语“人抗体”旨在包含具有源自人种系免疫球蛋白序列的可变区和恒定区的抗体。尽管如此,本公开的人抗体可以包含并非由人种系免疫球蛋白序列编码的氨基酸残基(例如,通过体外随机或位点特异性诱变或通过体内体细胞突变引入的突变),例如在cdr中,并且具体地说,在cdr3中。然而,如本文所使用的,术语“人抗体”并非旨在包含以下抗体,在这些抗体中源自另一个哺乳动物物种(如小鼠)的种系的cdr序列已经被移植于人类构架区序列上。
[0076]
如本文所使用的,术语“重组人抗体”旨在包含通过重组方式制备、表达、产生或分离的所有人抗体,如使用转染到宿主细胞内的重组表达载体表达的抗体(以下进一步描述)、从重组组合人抗体库中分离的抗体(以下进一步描述)、从对于人类免疫球蛋白基因而言为转基因的动物(例如,小鼠)中分离的抗体(参见例如,taylor等人,(1992)《核酸研究(nucl.acids res.)》20:6287-6295),或通过任何其它方式制备、表达、产生或分离的抗体,所述方式涉及将人免疫球蛋白基因序列剪接到其它dna序列上。这样的重组人抗体具有从人种系免疫球蛋白序列衍生出的可变区和恒定区。然而,在某些实施例中,此类重组人抗体经历体外诱变(或当使用转基因人ig序列的动物时,经历体内体细胞诱变),并且因此重组抗体的vh区和v
l
区的氨基酸序列是如下序列:虽然源自人种系vh序列和v
l
序列并与之相关,但可能并非天然在体内存在于人抗体种系库中。
[0077]“分离的抗体”是指已经从其天然环境的至少一种组分中鉴定和分离和/或回收的抗体。例如,已经从生物体的至少一种组分,或从天然存在或天然产生抗体的组织或细胞中分离或除去的抗体是“分离的抗体”。分离的抗体还包含重组细胞内的原位抗体。分离的抗体是已经经历至少一个纯化或分离步骤的抗体。根据某些实施例,分离的抗体可以基本上不含其它细胞物质和/或化学物质。
[0078]
术语“特异性结合”等意指抗体或其抗原结合片段与在生理条件下相对稳定的抗原形成复合物。特异性结合可以由至少约1
×
10-6
m或更小的平衡解离常数表征(例如,更小的kd表示更紧密的结合)。用于确定抗体是否特异性地结合抗原的方法是本领域众所周知的,且包含,例如,平衡透析、表面等离子体共振等。在一些实施例中,在表面等离子体共振测定中测量特异性结合。特异性结合来自一种物种的抗原的分离抗体可能对其它抗原具有交叉反应性或可能没有交叉反应性,如来自另一物种的直系同源物抗原。
[0079]
如本文中使用的,术语“k
d”是指特定抗体-抗原相互作用的平衡解离常数。
[0080]
如本文所使用的,术语“表面等离子体共振”是指允许通过例如使用biacore
tm
系统(瑞典乌普萨拉和新泽西州皮斯卡塔韦的法玛西亚生物传感器ab公司(pharmacia biosensor ab,uppsala,sweden and piscataway,n.j.)检测生物传感器基质内蛋白质浓度的变化来分析实时生物分子相互作用的光学现象。
[0081]
如本文所使用的,术语“表位”是指与称为互补位的抗体分子的可变区中的特定抗
原结合位点相互作用的抗原决定簇。单个抗原可以具有超过一个表位。因此,不同抗体可以与抗原上的不同区域结合并且可以具有不同的生物效应。术语“表位”还指抗原上b细胞和/或t细胞所响应的位点。其还指抗体所结合的抗原区域。表位可以是线性的或不连续的(例如,构象)。线性表位由多肽链中的邻近氨基酸残基来产生。构象表位由来自线性多肽链的不同区段的氨基酸在空间上并列而产生。在某些实施例中,表位可以包含作为分子的化学活性表面基团的决定簇,所述基团例如氨基酸、糖侧链、磷酰基或磺酰基,并且在某些实施例中,可具有特定三维结构特征和/或荷质比特征。表位也可以被定义为结构的或功能的。功能性表位一般是结构性表位的子集并且具有直接促成相互作用的亲和力的那些残基。由连续氨基酸形成的表位通常在暴露于变性溶剂时保留,而通过三级折叠形成的表位通常在用变性溶剂处理时丢失。在独特的空间构象中,表位通常包含至少3个(并且更常见地,至少5个或至少8个至10个)氨基酸。
[0082]
当用于提及核酸或其片段时,术语“基本同一性”或“基本上相同”表示,当通过适当的核苷酸插入或缺失与另一个核酸(或其互补链)进行最佳比对时,核苷酸序列同一性为核苷酸碱基的至少约90%,例如,至少约91%、92%、93%、94%、95%、96%、97%、98%或99%,如通过如fasta、blast或gap等任何众所周知的序列同一性算法所测量的,如以下所讨论的。在某些情况下,与参考核酸分子具有大体一致性的核酸分子可以编码与参考核酸分子所编码的多肽具有相同或大体上类似的氨基酸序列的多肽。
[0083]
当应用于多肽时,术语“基本同一性”和“基本上相同”意指两个肽序列在最佳比对时共享至少约90%的序列同一性,例如,至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的序列同一性。在一些实施例中,不相同的残基位置因保守性氨基酸取代而不同。“保守氨基酸置换”是这样的置换:其中一个氨基酸残基被置换为另一个含有具有类似化学性质(例如,电荷或疏水性)的侧链(r基团)的氨基酸残基。一般而言,保守氨基酸置换不会实质上改变蛋白的功能性质。
[0084]
通常使用序列分析软件来测量多肽的序列类似性。蛋白质分析软件使用关于指定到包含保守氨基酸置换的各种取代、缺失和其它修饰的相似性度量来匹配相似序列。例如,gcg软件含有程序诸如gap和bestfit,其可以与默认参数一起用来确定密切相关的多肽(例如来自不同生物物种的同源多肽)之间或野生型蛋白和其突变蛋白之间的序列同源性或序列同一性。参见例如,gcg 6.1版。多肽序列也可以使用默认或推荐参数,使用fasta进行比较;所述fasta是gcg 6.1版中的程序。fasta(例如,fasta2和fasta3)提供了询问序列与搜索序列之间的最佳重叠区域的对齐和序列同一性百分比(pearson,2000同上文)。当比较本公开的序列与含有大量来自不同生物的序列的数据库时,另一个优选的算法是使用默认参数的计算机程序blast,尤其是blastp或tblastn。(参见例如,altschul等人,1990,《分子生物学杂志》215:403-410和1997《核酸研究》25:3389-3402)。
[0085]
如本文所使用的,术语“过敏应答”、“过敏反应”、“过敏症状”等包含选自由以下组成的组的一种或多种体征或症状:荨麻疹(urticaria)(例如,荨麻疹(hives))、血管性水肿、鼻炎、哮喘、呕吐、打喷嚏、流鼻涕、鼻窦炎、流眼水、喘息、支气管痉挛、峰值呼气流量降低(pef)、胃肠不适、潮红、嘴唇肿胀、舌头肿胀、血压降低、过敏反应和器官功能障碍/衰竭。“过敏应答”、“过敏反应”、“过敏症状”等还包含免疫学应答和反应,例如ige产生增加和/或过敏原特异性免疫球蛋白产生增加。
[0086]
术语“过敏原”是指能够刺激易感个体过敏应答的物质、化学品、颗粒或组合物。过敏原可以包含在食物中或源自食物,例如乳制品(例如,牛奶)、蛋、芹菜、芝麻、小麦、大豆、鱼、贝类、糖(例如,存在于肉上的糖,如α-半乳糖)、花生、其它豆科植物(例如,豆类、豌豆、大豆等)和坚果。可替代地,过敏原可以包含在非食物内或源自非食物,例如灰尘(例如,含有尘螨)、花粉、昆虫毒液(例如,蜜蜂、黄蜂、蚊子、火蚁等的毒液)、霉菌、动物皮毛、动物皮屑、羊毛、乳胶、金属(例如,镍)、家用清洁剂、洗涤剂、药物、化妆品(例如,香水等)、药品(例如,青霉素(penicillin)、磺胺类、水杨酸盐等)、治疗性单克隆抗体(例如,西妥昔单抗(cetuximab))、豚草、草和桦树。在一些实施例中,过敏原是桦树花粉或包含在桦树内或源自桦树,例如,bet v 1蛋白。在本公开中,术语“过敏原”和“抗原”可以互换使用。
[0087]
如本文所使用的,术语“有需要的受试者”是指人或非人哺乳动物,其(i)表现出一种或多种过敏(例如,桦树过敏)症状或迹象,(ii)已被诊断为对过敏原(例如,桦树花粉过敏原)过敏;和/或(iii)发生过敏或对过敏原的过敏应答(例如,桦树过敏或过敏应答)的风险增加。在某些实施例中,所述术语包含对一种或多种过敏原(例如,桦树过敏原或其组分,如bet v 1蛋白)表现出过敏原敏感的受试者。在一些实施例中,如果受试者对过敏原表现出过敏原特异性ige水平≥0.35ku/l,则受试者被过敏原(例如,桦树过敏原或bet v 1蛋白)敏感。在某些实施例中,需要根据本公开的方法进行治疗的受试者是一种或多种血清生物标志物水平升高的受试者,所述血清生物标志物包含但不限于总ige、过敏原特异性ige(例如,桦树花粉ige或bet v 1ige)、胸腺和激活调节趋化因子(tarc)以及嗜酸性粒细胞趋化因子。例如,在一些实施例中,本公开的方法包括向过敏原特异性ige水平升高的患者(例如,桦树花粉或bet v 1ige水平≥0.35ku/l的受试者)施用抗bet v 1抗体或抗体混合物。术语“受试者”和“患者”在本文中可互换使用。
[0088]
术语“有需要的受试者”也可以包含,例如,具有伴随过敏或其它症状的受试者。例如,在一些实施例中,患有桦树过敏的受试者也可能患有口腔过敏综合征。在一些实施例中,待治疗的受试者是患有桦树过敏和对一种或多种其它壳斗目过敏原过敏的受试者。如本文所使用的,壳斗目过敏原(fagales order allergen)或“壳斗目过敏原(fagales allergen)”包含但不限于桦树花粉(bet v 1)、桤木花粉(aln g1和aln g4)、榛树花粉(cor a1、cor a2、cor a8、cor a9、cor a10、cor a11、cor a12、cor a13和cor a14)、角树花粉(car b1)、铁木花粉(ost c1)、栗子花粉(cas s1、cas s5、cas s8和cas s9)、山毛榉花粉(fag s1)和白橡树花粉(que a1和que a2)。本领域技术人员将认识到,bet v 1相关过敏原(也称为“壳斗目组1”过敏原或“pr-10过敏原”)也存在于食物中,如苹果(mal d 1)、杏(pru ar 1)、胡萝卜(dau c 1)、芹菜(api g 1)、樱桃(pru av 1)、栗子(cas s 1)、榛子(cor a 1)、猕猴桃(act c 8、act d 8和act d 11)、绿豆(vig r 1)、花生(ara h 8)、梨(pyr c 1)、覆盆子(rub i 1)、大豆(gly m 4)、草莓(fra a 1)、番茄(sola l 4)和核桃(jug r 5)。参见carlson,《过敏、哮喘和免疫学年鉴(annals of allergy,asthma&immunology)》2019,123:第359-365页。因此,术语“壳斗目过敏原”不仅包含花粉过敏原,还包含食物过敏原。在一些实施例中,受试者对桦树花粉(例如,桦树花粉提取物)或bet v 1过敏原以及对一种或多种其它壳斗目过敏原的过敏原特异性ige水平升高(例如,过敏原特异性ige的水平≥0.35ku/l)。
[0089]
介绍
[0090]
如本文所描述的,已经开发出针对主要桦树过敏原bet v 1的单克隆抗体混合物。据推测,高亲和力过敏原特异性单克隆igg抗体可以作为对过敏原提供“被动免疫”的形式施用。临床前研究表明,抗bet v 1抗体regn5713、regn5714和regn5715独立且非竞争性地结合bet v 1过敏原。数据还表明,当所有三种抗体一起施用时,bet v 1与人多克隆ige的最佳结合抑制发生,导致体外效应子细胞脱粒和随后的1型超敏反应减少。不受任何特定理论的约束,抗bet v 1抗体的这种活性预期可以防止所产生的引发响应于桦树过敏原和潜在交叉反应过敏原的过敏反应的炎性级联反应。
[0091]
本文所公开的抗bet v 1抗体混合物在至少若干个方面优于当前可用的疗法,如过敏原特异性免疫疗法(sit)。例如,阻断抗体混合物预期会更安全,因为过敏患者不会暴露于天然过敏原;提供更加可预测的功效;提供更多便利,因为单次剂量可以在过敏季节期间预防整个桦树组和桦树同源组的过敏症状;扩大了能够接受治疗的患者群体(例如,先前可能被禁止接受sit的哮喘患者);并且具有更快的起效。如本文所描述的,抗bet v 1抗体快速且持久地减少患有桦树过敏的患者的过敏症状。
[0092]
治疗方法
[0093]
一方面,提供了用于治疗桦树过敏或用于治疗、预防或改善受试者的桦树过敏的一种或多种症状的方法。另一方面,提供了用于治疗、预防或改善对桦树和/或桦树交叉反应花粉的季节性或常年性过敏(例如,中度至重度季节性或常年性过敏)的方法。在一些实施例中,所述方法包括向受试者施用一个或多个剂量的抗bet v 1抗体或抗bet v 1抗体的混合物(例如,包括一种或多种抗bet v 1抗体的药物组合物)。
[0094]
在一些实施例中,待治疗的受试者具有桦树花粉引发的过敏性鼻炎症状的病史,伴有或不伴有结膜炎。在一些实施例中,已经用采用桦树花粉提取物的阳性皮肤点刺测试(spt)诊断出待治疗的受试者。在一些实施例中,受试者具有平均风团直径≥5mm,大于阴性对照的阳性spt。在一些实施例中,已经用针对桦树花粉(例如,桦树花粉提取物)的阳性过敏原特异性ige测试和/或≥0.35ku/l的bet v 1抗原诊断待治疗的受试者。
[0095]
在一些实施例中,待治疗的受试者是成人。在一些实施例中,受试者患有伴随疾病或病状。伴随疾病或病状的非限制性实例包含过敏(例如,对一种或多种食物过敏原过敏和/或对一种或者多种非食物过敏原(如空气过敏原)过敏)、口腔过敏综合征和哮喘。在一些实施例中,受试者患有哮喘。在一些实施例中,受试者患有桦树引发的哮喘。在一些实施例中,受试者对桦树过敏原和一种或多种树同系物(例如,壳斗目过敏原)过敏。
[0096]
在一些实施例中,待治疗的受试者具有桦树花粉引发的过敏性鼻炎症状的病史,伴有或不伴有哮喘。在一些实施例中,待治疗的受试者具有桦树花粉引发的过敏性鼻炎症状的病史,伴有或不伴有结膜炎,伴有或不伴有哮喘。
[0097]
在一些实施例中,待治疗的受试者的过敏性鼻炎的一种或多种生物标志物的水平改变。在一些实施例中,生物标志物与2型免疫活性相关和/或是过敏原特异性生物标志物。在一些实施例中,生物标志物是血清生物标志物。在一些实施例中,生物标志物是总ige、过敏原特异性igg4或胸腺和激活调节趋化因子(tarc)。
[0098]
在一些实施例中,如本文所公开的用一种或多种抗bet v 1抗体治疗导致桦树过敏的一种或多种症状的改善或与桦树过敏相关的病状的改善。在一些实施例中,根据本文所公开的方法的治疗改善了受试者的过敏性鼻炎的一种或多种症状。如本文所使用的,“改
善过敏性鼻炎症状”包含减少受试者的过敏性鼻炎的一种或多种症状的严重程度或持续时间,或消除过敏性鼻炎的症状,如但不限于打喷嚏、(鼻、眼、耳或腭的)瘙痒、鼻漏、后鼻滴注、充血、嗅觉丧失、头痛、耳痛、流泪、红眼、眼睛肿胀和疲劳。在一些实施例中,通过总鼻部症状评分(tnss)测量过敏性鼻炎症状的减少。tnss是患者报告的充血、瘙痒、鼻漏和打喷嚏的综合症状评估,其中使用四分量表(0至3)为给定时间点的每个类别分配患者评估的症状评分,其中0表示无症状,评分1表示容易耐受的轻度症状,2表示令人烦恼但可以忍受的症状意识,3表示难以忍受和干扰日常活动的严重症状。tnss的计算方法是将每种症状的评分相加,总分为12分。在一些实施例中,在用过敏原进行鼻部过敏原攻击(nac)后测量tnss评分。在一些实施例中,测量受试者的基线tnss评分(例如,在治疗开始之前的筛查访视期间)。
[0099]
在一些实施例中,相对于基线或对照值(例如,开始治疗前受试者的基线tnss评分),治疗导致桦树花粉季节期间(例如,桦树花粉季节期间至少28天、57天、85天或113天或整个桦树花粉季节期间)tnss的改善。在一些实施例中,相对于基线或对照值,治疗导致tnss降低至少10%、15%、20%、25%、30%、35%、40%、45%、50%或更多。
[0100]
在一些实施例中,治疗导致nac后tnss的改善(例如,使用桦树花粉提取物),其中所述改善包括相对于受试者的基线评分,(i)充血、(ii)瘙痒、(iii)鼻漏或(iv)打喷嚏中的一项或多项的评分和/或总tnss评分降低。在一些实施例中,相对于受试者的基线评分,治疗导致tnss降低至少10%、15%、20%、25%、30%、35%、40%、45%、50%或更多。在一些实施例中,相对于受试者的基线评分,治疗导致tnss评分降低1点、2点、3点、4点、5点或更多点。
[0101]
在一些实施例中,相对于受试者的基线tnss auc(0小时至1小时)(例如,受试者在治疗开始前的基线tnss auc(0小时至1小时)),根据本文所公开的方法进行的治疗(例如,施用如本文所公开的抗bet v 1抗体或抗bet v 1抗体混合物)将受试者的tnss auc(0小时至1小时)降低至少约15%、20%、25%、30%、35%或更多。在一些实施例中,在nac后测量tnss auc(0小时至1小时)。在一些实施例中,相对于受试者的基线峰值tnss(例如,在开始治疗前的受试者的基线峰值tnss),治疗将受试者的峰值tnss降低至少约15%、20%、25%、30%、35%或更多。在一些实施例中,在nac后测量峰值tnss。在一些实施例中,通过确定治疗开始前受试者的过敏原(例如,bet v 1过敏原或桦树提取物)剂量达到tnss≥7来评估基线峰值tnss,并且通过向受试者施用与基线时达到tnss≥7相同剂量的过敏原来评估治疗后的峰值tnss。
[0102]
在一些实施例中,根据本文所公开的方法的治疗改善了受试者的过敏性结膜炎的一种或多种症状。如本文所使用的,“改善过敏性结膜炎症状”包含减少受试者过敏性结膜炎的严重程度或持续时间或消除一种或多种症状,如但不限于发痒、发红、流泪或肿眼泡。在一些实施例中,通过总眼部症状评分(toss)测量过敏性结膜炎症状的减少。toss是患者报告的眼部症状的综合症状评估。
[0103]
在一些实施例中,toss的范围为0至6,并且基于两种症状:瘙痒/发红/砂砾感和流泪/流水。2种症状中的每种都由患者分级为0(无症状)、1(轻度)、2(中度)或3(重度)。在其它实施例中,toss的范围为0至12,并且基于四项:瘙痒/灼热、发红、流水和流泪、浮肿和肿胀;使用四分制(0至3)为给定时间点的每个类别分配患者评估的症状评分,其中0表示无症
状,评分1表示容易耐受的轻度症状,2表示令人烦恼但可以忍受的症状意识,3表示难以忍受和干扰日常活动的严重症状。
[0104]
在一些实施例中,在用过敏原进行nac后测量toss评分。在一些实施例中,测量受试者的基线toss评分(例如,在治疗开始之前的筛查访视期间)。在一些实施例中,治疗导致nac后toss的改善(例如,使用桦树花粉提取物),其中所述改善包括相对于受试者的基线评分:(i)瘙痒/灼热、(ii)发红、(iii)流水和流泪或(iv)浮肿和肿胀中的一项或多项的评分和/或总toss评分降低。
[0105]
在一些实施例中,相对于受试者的基线评分,治疗导致toss降低至少10%、15%、20%、25%、30%、35%、40%、45%、50%或更多。在一些实施例中,相对于受试者的基线评分,治疗导致toss评分降低1点、2点、3点、4点、5点或更多点。在一些实施例中,相对于受试者的基线toss auc(0小时至1小时)(例如,在开始治疗前的受试者基线toss auc(0小时至1小时)),治疗将受试者的toss auc(0小时至1小时)降低至少约15%、20%、25%、30%、35%或更多。在一些实施例中,在nac后测量toss auc(0小时至1小时)。
[0106]
在一些实施例中,根据本文公开的方法的治疗导致受试者的总症状评分(tss)的改善(即降低)。tss通过将受试者的tnss(范围为0至12)和toss(范围为0至6)相加获得组合的tnss(0至18)来计算。在一些实施例中,测量受试者的基线tss评分(例如,在治疗开始之前的筛查访视期间)。在一些实施例中,相对于基线或对照值(例如,开始治疗前受试者的基线tss评分),治疗导致桦树花粉季节期间(例如,桦树花粉季节期间至少28天、57天、85天或113天或整个桦树花粉季节期间)tss的改善。在一些实施例中,相对于基线或对照值,治疗导致tss降低至少10%、15%、20%、25%、30%、35%、40%、45%、50%或更多。在一些实施例中,相对于受试者的基线评分,治疗导致tss评分降低1点、2点、3点、4点、5点或更多点。
[0107]
在一些实施例中,根据本文公开的方法的治疗导致受试者的每日药物评分(dms)的改善(即降低)。为了计算dms,受试者记录其每天的补救药物使用情况,包含何种药物以及这些预先指定的药物的量。此信息用于按照如下计算dms:地氯雷他定(desloratadine)5mg 6点/剂量;最大每日评分6点,奥洛他定(olopatadine)1mg/ml,每滴1.5点/滴;最大每日评分6点,糠酸莫米他松(mometasone furoate)50μg/剂量2.0点/喷雾;最大每日评分8点。最大dms评分为20。参见calderon等人,《临床与实验过敏(clin exp allergy)》2014;44(10):1228-39。在一些实施例中,测量受试者的基线dms评分(例如,在治疗开始之前的筛查访视期间)。在一些实施例中,相对于基线或对照值(例如,开始治疗前受试者的基线tss评分),治疗导致桦树花粉季节期间(例如,桦树花粉季节期间至少28天、57天、85天或113天或整个桦树花粉季节期间)dms的改善。在一些实施例中,相对于基线或对照值,治疗导致dms降低至少10%、15%、20%、25%、30%、35%、40%、45%、50%或更多。在一些实施例中,相对于受试者的基线评分,治疗导致dms评分降低1点、2点、3点、4点、5点或更多点。
[0108]
在一些实施例中,根据本文公开的方法的治疗导致受试者的组合症状和药物评分(csms)的改善(即降低)。csms通过将受试者的dms(范围为0至20)和tss(范围为0至18)相加获得组合的csms(0至38)来计算。在一些实施例中,测量受试者的基线csms评分(例如,在治疗开始之前的筛查访视期间)。在一些实施例中,相对于基线或对照值(例如,开始治疗前受试者的基线csms评分),治疗导致桦树花粉季节期间(例如,桦树花粉季节期间至少28天、57天、85天或113天或整个桦树花粉季节期间)csms的改善。在一些实施例中,相对于基线或对
照值,治疗导致csms降低至少10%、15%、20%、25%、30%、35%、40%、45%、50%或更多。在一些实施例中,相对于受试者的基线评分,治疗导致csms评分降低1点、2点、3点、4点、5点、6点、7点、8点、9点、10点或更多点。
[0109]
在一些实施例中,与基线值(例如,在治疗开始前的受试者的基线pnif)相比,根据本文所公开的方法的治疗改善了受试者的峰值鼻吸气流量(pnif)。在一些实施例中,在nac后测量pnif。在一些实施例中,相对于受试者的基线pnif(例如,治疗开始前受试者的基线pnif),治疗使受试者的pnif增加至少约15%、20%、25%、30%、35%、40%、45%、50%或更多。
[0110]
在一些实施例中,与基线值(例如,治疗开始前受试者的敏感水平)相比,根据本文所公开的方法的治疗降低了受试者的过敏原敏感(例如,对桦树过敏原的敏感)。在一些实施例中,与治疗开始前的受试者敏感水平相比,治疗将受试者的过敏原敏感(例如,桦树敏感)降低至少约20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%或更多。在一些实施例中,使用采用过敏原(例如,桦树过敏原提取物)的皮肤点刺测试来测量敏感水平。在一些实施例中,通过测量血清抗体(例如,过敏原特异性ige水平,如bet v 1或桦树花粉ige)来评估敏感水平。
[0111]
在一些实施例中,根据本文所公开的方法的治疗导致受试者在桦树花粉季节期间的良好日数量增加。如本文所使用的,“良好日”定义为不使用抗过敏补救药物,受试者的tss≤2的日子。
[0112]
在一些实施例中,根据本文所公开的方法的治疗改善了口腔过敏综合征的一种或多种症状。口腔过敏综合征症状通常包含嘴唇、口腔和喉咙瘙痒,也可以包含嘴唇和舌头肿胀以及血管性水肿。在一些实施例中,提供了通过施用如本文所公开的抗bet v 1抗体或抗bet v 1抗体混合物来治疗桦树花粉相关口腔过敏综合征的方法。
[0113]
在一些实施例中,根据本文所公开的方法的治疗(例如,施用如本文所公开的抗bet v 1抗体或抗bet v 1抗体混合物)导致如上文所描述的一种或多种改善,持续一段长时间,例如,至少一个月、至少两个月、至少三个月、至少四个月或更长时间。
[0114]
抗bet v 1抗体以及其抗原结合片段
[0115]
根据本公开的某些实施例,抗bet v 1抗体或其抗原结合片段包括重链可变区(hcvr)、轻链可变区(lcvr)和/或互补决定区(cdr),所述hcvr、lcvr和/或cdr包括如wo 2018/222854中所阐述的抗bet v 1抗体的任何氨基酸序列,所述文献通过引用并入本文。
[0116]
在一些实施例中,抗bet v 1抗体或其抗原结合片段包括包含seq id no:1的氨基酸序列的重链可变区(hcvr)的重链互补决定区(hcdr),以及包含seq id no:5的氨基酸序列的轻链可变区(lcvr)的轻链互补决定区(lcdr)。在一些实施例中,抗bet v 1抗体或其抗原结合片段包括三个hcdr(hcdr1、hcdr2和hcdr3)和三个lcdr(lcdr1、lcdr2和lcdr3),其中hcdr1包括seq id no:2的氨基酸序列,hcdr2包括seq id no:3的氨基酸序列,hcdr3包括seq id no:4的氨基酸序列,lcdr1包括seq id no:6的氨基酸序列,lcdr2包括seq id no:7的氨基酸序列,并且lcdr3包括seq id no:8的氨基酸序列。在一些实施例中,抗bet v 1抗体或其抗原结合片段分别包括seq id no:2、3、4、6、7和8的hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3,并且进一步包括与seq id no:1的氨基酸序列具有至少85%序列同一性(例如,至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一)的hcvr和与
seq id no:5的氨基酸序列具有至少85%序列同一性(例如,至少90%,91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性)的lcvr。在一些实施例中,抗bet v 1抗体或其抗原结合片段包括hcvr,所述hcvr包括seq id no:1,以及lcvr,所述lcvr包括seq id no:5。在一些实施例中,抗bet v 1抗体或其抗原结合片段包括重链,所述重链包括seq id no:9的氨基酸序列。在一些实施例中,抗bet v 1抗体或其抗原结合片段包括轻链,所述轻链包括seq id no:10的氨基酸序列。
[0117]
在一些实施例中,抗bet v 1抗体或其抗原结合片段包括包含seq id no:11的氨基酸序列的hcvr的hcdr,以及包含seq id no:15的氨基酸序列的lcvr的lcdr。在一些实施例中,抗bet v 1抗体或其抗原结合片段包括三个hcdr(hcdr1、hcdr2和hcdr3)和三个lcdr(lcdr1、lcdr2和lcdr3),其中hcdr1包括seq id no:12的氨基酸序列,hcdr2包括seq id no:13的氨基酸序列,hcdr3包括seq id no:14的氨基酸序列,lcdr1包括seq id no:16的氨基酸序列,lcdr2包括seq id no:17的氨基酸序列,并且lcdr3包括seq id no:18的氨基酸序列。在一些实施例中,抗bet v 1抗体或其抗原结合片段分别包括seq id no:12、13、14、16、17和18的hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3,并且进一步包括与seq id no:11的氨基酸序列具有至少85%序列同一性(例如,至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一)的hcvr和与seq id no:15的氨基酸序列具有至少85%序列同一性(例如,至少90%,91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性)的lcvr。在一些实施例中,抗bet v 1抗体或其抗原结合片段包括hcvr,所述hcvr包括seq id no:11,以及lcvr,所述lcvr包括seq id no:15。在一些实施例中,抗bet v 1抗体或其抗原结合片段包括重链,所述重链包括seq id no:19的氨基酸序列。在一些实施例中,抗bet v 1抗体或其抗原结合片段包括轻链,所述轻链包括seq id no:20的氨基酸序列。
[0118]
在一些实施例中,抗bet v 1抗体或其抗原结合片段包括包含seq id no:21的氨基酸序列的hcvr的hcdr,以及包含seq id no:25的氨基酸序列的lcvr的lcdr。在一些实施例中,抗bet v 1抗体或其抗原结合片段包括三个hcdr(hcdr1、hcdr2和hcdr3)和三个lcdr(lcdr1、lcdr2和lcdr3),其中hcdr1包括seq id no:22的氨基酸序列,hcdr2包括seq id no:23的氨基酸序列,hcdr3包括seq id no:24的氨基酸序列,lcdr1包括seq id no:26的氨基酸序列,lcdr2包括seq id no:27的氨基酸序列,并且lcdr3包括seq id no:28的氨基酸序列。在一些实施例中,抗bet v 1抗体或其抗原结合片段分别包括seq id no:22、23、24、26、27和28的hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3,并且进一步包括与seq id no:21的氨基酸序列具有至少85%序列同一性(例如,至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一)的hcvr和与seq id no:25的氨基酸序列具有至少85%序列同一性(例如,至少90%,91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性)的lcvr。在一些实施例中,抗bet v 1抗体或其抗原结合片段包括hcvr,所述hcvr包括seq id no:21,以及lcvr,所述lcvr包括seq id no:25。在一些实施例中,抗bet v 1抗体或其抗原结合片段包括重链,所述重链包括seq id no:29的氨基酸序列。在一些实施例中,抗bet v 1抗体或其抗原结合片段包括轻链,所述轻链包括seq id no:30的氨基酸序列。
[0119]
在一些实施例中,抗bet v 1抗体是本文所公开的抗体的生物等效物(例如,regn5713、regn5714或regn5715的生物等效物)。如本文所使用的,术语“生物等效物”是指抗bet v 1抗体,所述抗体是药物等效物或药物替代物,其吸收速率和/或程度与参考抗体
(例如,regn5713、regn5714或regn5715)在类似实验条件下以相同摩尔剂量(单剂量或多剂量)施用时没有显著差异。在一些实施例中,所述术语是指抗bet v 1抗体,所述抗体在其安全性、纯度和/或效力方面与本公开的抗bet v 1抗体(例如,regn5713、regn5714或regn5715)没有临床意义的差异。
[0120]
在一些实施例中,抗bet v 1抗体是igg1或igg4抗体。在一些实施例中,抗bet v 1抗体包括人igg1或igg4同种型的重链恒定区,其中所述恒定区包括一个或多个氨基酸修饰(例如,取代或缺失),例如,铰链、ch2或ch3区中的氨基酸修饰。
[0121]
在一些实施例中,用于本公开的方法中的抗bet v 1抗体可以具有ph依赖性结合特征。例如,与中性ph相比,用于本公开的方法的抗bet v 1抗体在酸性ph下可以表现出与bet v 1的结合降低。可替代地,与中性ph相比,本公开的抗bet v 1抗体在酸性ph下可以表现出与其抗原的增强结合。表述“酸性ph”包含小于约6.2的ph值,例如,约6.0、5.95、5.9、5.85、5.8、5.75、5.7、5.65、5.6、5.55、5.5、5.45、5.4、5.35、5.3、5.25、5.2、5.15、5.1、5.05、5.0或更小。本文中使用的表述“中性ph”是指约7.0至约7.4的ph。表述“中性ph”包含约7.0、7.05、7.1、7.15、7.2、7.25、7.3、7.35和7.4的ph值。
[0122]
可以例如通过就与中性ph相比在酸性ph与特定抗原结合减少(或增强)而筛选抗体群体,来获得具有ph依赖性结合特征的抗体。另外,在氨基酸水平修饰抗原结合结构域可以产生具有ph依赖性特征的抗体。例如,通过将抗原结合结构域的一个或多个氨基酸(例如,在cdr内部)置换为组氨酸残基,可以获得相对于中性ph在酸性ph时抗原结合作用减少的抗体。
[0123]
在一些实施例中,本文所公开的治疗方法包括使用两种或更多种如本文所公开的抗bet v 1抗体,例如,包括两种或三种如本文所公开的抗bet v 1抗体的药物组合物。
[0124]
在一些实施例中,所述组合或所述药物组合物包括:
[0125]
(a)第一抗bet v 1抗体或其抗原结合片段,其中所述第一抗bet v 1抗体包括包含seq id no:2的氨基酸序列的重链互补决定区(hcdr)1、包含seq id no:3的氨基酸序列的hcdr2、包含seq id no:4的氨基酸序列的hcdr3、包含seq id no:6的氨基酸序列的轻链互补决定区(lcdr)1、包含seq id no:7的氨基酸序列的lcdr2以及包含seq id no:8的氨基酸序列的lcdr3;和/或
[0126]
(b)第二抗bet v 1抗体或其抗原结合片段,其中所述第二抗bet v 1抗体包括包含seq id no:12的氨基酸序列的hcdr1、包含seq id no:13的氨基酸序列的hcdr2、包含seq id no:14的氨基酸序列的hcdr3、包含seq id no:16的氨基酸序列的lcdr1、包含seq id no:17的氨基酸序列的lcdr2以及包含seq id no:18的氨基酸序列的lcdr3;和/或
[0127]
(c)第三抗bet v 1抗体或其抗原结合片段,其中所述第三抗bet v 1抗体包括包含seq id no:22的氨基酸序列的hcdr1、包含seq id no:23的氨基酸序列的hcdr2、包含seq id no:24的氨基酸序列的hcdr3、包含seq id no:26的氨基酸序列的lcdr1、包含seq id no:27的氨基酸序列的lcdr2以及包含seq id no:28的氨基酸序列的lcdr3。
[0128]
在一些实施例中,药物组合物包括(a)和(b)。在一些实施例中,药物组合物包括(a)和(c)。在一些实施例中,药物组合物包括(b)和(c)。在一些实施例中,药物组合物包括(a)、(b)和(c)。
[0129]
人类抗体的制备
[0130]
用于在转基因小鼠中产生人抗体的方法是本领域中已知的。可以将任何此类已知方法用于本公开中用于制备与bet v 1蛋白特异性结合的人抗体的上下文。
[0131]
使用velocimmune
tm
技术(参见例如,us 6,596,541,再生元制药公司(regeneron pharmaceuticals))或用于产生单克隆抗体的任何其它已知方法,初步分离具有人可变区和小鼠恒定区的针对il-4r的高亲和力嵌合抗体。技术涉及生成转基因小鼠,所述转基因小鼠具有包括与内源性小鼠恒定区基因座可操作地连接的人类重链和轻链可变区的基因组,使得所述小鼠响应于抗原刺激产生包括人类可变区和小鼠恒定区的抗体。分离出编码抗体的重链和轻链可变区的dna并且将其与编码人类重链和轻链恒定区的dna可操作地连接。随后,在能够表达完全人类抗体的细胞中表达所述dna。
[0132]
一般来说,用所关注的抗原攻击小鼠,并从表达抗体的小鼠中回收淋巴细胞(如b细胞)。淋巴细胞可以与骨髓瘤细胞系融合以制备无限增殖杂交瘤细胞系,并且对此类杂交瘤细胞系进行筛选和选择以鉴别出产生对所关注的抗原具有特异性的抗体的杂交瘤细胞系。可以将编码重链和轻链可变区的dna分离并与所期望的重链和轻链的同种型恒定区连接。此类抗体蛋白可以在细胞(如cho细胞)中产生。可替代地,可以直接从抗原特异性淋巴细胞中分离出编码抗原特异性嵌合抗体或轻链和重链可变结构域的dna。
[0133]
首先,分离出具有人类可变区和小鼠恒定区的高亲和力嵌合抗体。使用本领域技术人员已知的标准程序对抗体进行表征和选择以获得期望的特征,包含亲和力、选择性、表位等。用期望的人恒定区替代小鼠恒定区以生成本公开的完全人抗体,例如野生型或经修饰的igg1或igg4。虽然所选择的恒定区可以根据具体用途而变化,但高亲和力抗原结合和靶特异性特征存在于可变区中。
[0134]
通常,当通过结合固定在固相上或溶液相中的抗原进行测量时,可用于本公开的方法的抗体具有如上所述的高亲和力。用期望的人恒定区替代小鼠恒定区以生成本公开的完全人抗体。虽然所选择的恒定区可以根据具体用途而变化,但高亲和力抗原结合和靶特异性特征存在于可变区中。
[0135]
用于鉴别在hcvr和lcvr氨基酸序列内的cdr的方法和技术是本领域众所周知的,且可以用于鉴别在本文公开的指定hcvr和/或lcvr氨基酸序列内的cdr。可以用于鉴别cdr的边界的示例性惯例包含,例如,kabat定义、chothia定义和abm定义。一般来说,kabat定义基于序列差异,chothia定义基于结构环区域的位置,并且abm定义是kabat和chothia方法之间的折衷方案。参见例如,kabat,"sequences of proteins of immunological interest,"national institutes of health,bethesda,md.(1991);al-lazikani等人,《分子生物学杂志》273:927-948(1997);和martin等人,《美国国家科学院院刊(proc.natl.acad.sci.usa)》86:9268-9272(1989)。公共数据库也可以用于鉴别抗体内的cdr序列。
[0136]
药物组合物
[0137]
一方面,本公开提供了包括向受试者施用一种或多种抗bet v 1抗体的方法,其中所述一种或多种抗bet v 1抗体包含在药物组合物中,所述药物组合物包括一种或更多种药学上可接受的媒剂、载体和/或赋形剂。在一些实施例中,一种或多种抗体用于治疗桦树过敏或用于治疗与桦树过敏相关的病状(例如,过敏性鼻炎或口腔过敏综合征)。
[0138]
在一些实施例中,药物组合物包括一种抗bet v 1抗体或其抗原结合片段(例如,分别包括seq id no:2、3、4、6、7和8的hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3的抗体,或分别包括seq id no:12、13、14、16、17和18的hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3的抗体,或分别包括seq id no:22、23、24、26、27和28的hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3的抗体)。
[0139]
在一些实施例中,药物组合物包括两种抗bet v 1抗体或其抗原结合片段。例如,在一些实施例中,药物组合物包括抗体,所述抗体分别包括seq id no:2、3、4、6、7和8的hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3,以及抗体,所述抗体分别包括seq id no:12、13、14、16、17和18的hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3。在一些实施例中,药物组合物包括抗体,所述抗体分别包括seq id no:2、3、4、6、7和8的hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3,以及抗体,所述抗体分别包括seq id no:22、23、24、26、27和28的hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3。在一些实施例中,药物组合物包括抗体,所述抗体分别包括seq id no:12、13、14、16、17和18的hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3,以及抗体,所述抗体分别包括seq id no:22、23、24、26、27和28的hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3。
[0140]
在一些实施例中,药物组合物包括三种抗bet v 1抗体或其抗原结合片段。例如,在一些实施例中,药物组合物包括抗体,所述抗体分别包括seq id no:2、3、4、6、7和8的hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3,抗体,所述抗体分别包括seq id no:12、13、14、16、17和18的hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3,以及抗体,所述抗体分别包括seq id no:22、23、24、26、27和28的hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3。
[0141]
各种药学上可接受的载体和赋形剂是本领域众所周知的。参见例如,《雷明顿氏药物科学(remington's pharmaceutical sciences)》,宾夕法尼亚州伊斯顿市的马克出版公司(mack publishing company,easton,pa)。在一些实施例中,载体适合于静脉内、肌肉内、口服、腹膜内、鞘内、透皮、局部或皮下施用。
[0142]
在一些实施例中,药物组合物包括可注射制剂,如用于静脉内注射、皮下注射、皮内注射和肌肉注射、滴注等的剂型。这些可注射制剂可以通过已知方法制备。例如,可以如下制备可注射制剂:例如,将上述抗体或其盐溶解、悬浮或乳化在常规地用于注射剂的无菌水性介质或油性介质中。作为用于注射的水性介质,存在例如生理盐水、含有葡萄糖和其它助剂等的等渗溶液,其可以与适当的增溶剂组合使用,所述增溶剂如醇(例如,乙醇)、多元醇(例如,丙二醇、聚乙二醇)、非离子表面活性剂[例如,聚山梨醇酯80、hco-50(氢化蓖麻油聚氧乙烯(50mol)加合物)]等。作为油性介质,采用例如芝麻油、大豆油等,其可以与增溶剂,如苯甲酸苯甲酯、苯甲醇等组合使用。这样制备的注射剂可以装入适当的安瓿中。
[0143]
根据本公开的方法向患者施用的一种或多种抗体的剂量可以根据患者的年龄和体型、症状、状况、施用途径等而变化。通常根据体重或体表面积计算剂量。视病症的严重程度而定,可以调整治疗的频率和持续时间。可以根据经验确定施用包括抗bet v 1抗体的药物组合物的有效剂量和时间表;例如,可以通过定期评估监测患者进展,并且相应地调节剂量。此外,可以使用本领域熟知的方法进行剂量的物种间按比例缩放(例如mordenti等人,1991,pharmaceut.res.8:1351)。本文其它地方公开了可用于本公开上下文中的抗bet v 1抗体的特定示例性剂量和涉及所述抗体的施用方案。
[0144]
各种递送系统是已知的并且可以用于施用药物组合物,例如,封装在脂质体、微颗粒、微胶囊、能够表达突变病毒的重组细胞、受体介导的胞吞作用中(参见例如,wu等人,1987,《生物化学杂志(j.biol.chem.)》262:4429-4432)。施用方法包含、但不限于真皮内、肌肉内、腹膜内、静脉内、皮下、鼻内、硬膜外和口服途径。所述组合物可以通过任何便利的途径,例如通过输注或团注、通过经上皮或粘膜皮肤内层(例如,口腔粘膜、直肠和肠道粘膜等)吸收施用,并且可以与其它生物活性剂一起施用。在一些实施例中,如本文所公开的药物组合物是静脉内施用的。在一些实施例中,如本文所公开的药物组合物是皮下施用的。
[0145]
在一些实施例中,本公开的药物组合物包含在容器内。因此,另一方面,提供了包括如本文所公开的药物组合物的容器。例如,在一些实施例中,药物组合物包含在选自由以下组成的组的容器内:玻璃小瓶、注射器、笔式递送装置和自动注射器。
[0146]
在一些实施例中,本公开的药物组合物例如使用标准针和注射器皮下或静脉内递送。在一些实施例中,注射器是预充式注射器。在一些实施例中,笔式递送装置或自动注射器用于递送本公开的药物组合物(例如,用于皮下递送)。笔式递送装置可以是可重复使用的或一次性的。可重复使用的笔式递送装置一般利用含有药物组合物的可更换的筒。一旦筒内的所有药物组合物都已施用并且筒变空时,就可以容易地丢弃空筒并且更换为含有药物组合物的新筒。然后可以再使用笔式递送装置。在一次性笔式递送装置中,没有可更换的筒。实际上,一次性笔式递送装置在装置内的储集器中预填充有药物组合物。一旦清空储集器中的药物组合物,就丢弃整个装置。
[0147]
合适的笔式或自动注射器递送装置的实例包含但不限于autopen
tm
(英国伍德斯托克的欧曼福德公司(owen mumford,inc.,woodstock,uk))、disetronic
tm
笔(瑞士波道夫的disetronic医疗系统公司(disetronic medical systems,burghdorf,switzerland))、humalog mix 75/25
tm
笔、humalog
tm
笔、humalin 70/30
tm
笔(印第安纳州印第安纳波利斯的礼来公司(eli lilly and co.,indianapolis,in))、novopen
tm
i、ii和iii(丹麦哥本哈根的诺和诺德公司(novo nordisk,copenhagen,denmark))、novopen junior
tm
(丹麦哥本哈根的诺和诺德公司)、bd
tm
笔(新泽西州富兰克林湖的贝迪医疗(becton dickinson,franklin lakes,nj))、optipen
tm
、optipen pro
tm
、optipen starlet
tm
以及opticlik
tm
(德国法兰克福市的赛诺菲公司(sanofi-aventis,frankfurt,germany))。应用于皮下递送本公开的药物组合物的一次性笔式递送装置的实例包含但当然不限于solostar
tm
笔(赛诺菲公司)、flexpen
tm
(诺和诺德公司)以及kwikpen
tm
(礼来公司)、sureclick
tm
自动注射器(加利福尼亚州的千橡市安进公司(amgen,thousand oaks,ca))、penlet
tm
(德国斯图加特的haselmeier公司(haselmeier,stuttgart,germany))、epipen(dey公司(dey,l.p.))以及humira
tm
笔(伊利诺伊州雅培科技园的雅培实验室(abbott labs,abbott park il))。
[0148]
在一些实施例中,使用控释系统递送药物组合物。在一个实施例中,可以使用泵(参见langer,同上;sefton,1987,crc crit.ref.biomed.eng.14:201)。在另一个实施例中,可以使用聚合物材料;参见medical applications of controlled release,langer和wise(编辑),1974,crc pres.,boca raton,florida。在又一个实施例中,可以将控释系统放置于组合物靶标附近,因此只需要全身剂量的一小部分(参见例如,goodson,1984,载于medical applications of controlled release,同上,第2卷,第115-138页)。其它控释系统在langer,1990,《科学(science)》,249:1527-1533的评论中进行了讨论。
1抗体。在其中施用三种抗bet v 1抗体的一些实施例中,至少一种抗体以不同于其它抗体的量施用。在其中施用三种抗bet v 1抗体的一些实施例中,所有三种抗体以不同的量施用。在其中施用三种抗bet v 1抗体的一些实施例中,所有三种抗体以相同的量施用。
[0154]
在一些实施例中,以约50mg至约1500mg(例如,约100mg至约1500mg、约100mg至约1000mg或约300mg至约1000mg)的总剂量施用一种或多种抗bet v 1抗体(例如,包括如本文所公开的regn5713、regn5714和/或regn5715的cdr和/或hcvr和lcvr序列的抗体)。在一些实施例中,一种或多种抗bet v 1抗体以以下的总剂量施用:约50mg、约75mg、约100mg、约125mg、约150mg、约175mg、约200mg、约225mg、约250mg、约275mg、约300mg、约325mg、约350mg、约375mg、约400mg、约425mg、约450mg、约475mg、约500mg、约525mg、约550mg、约575mg、约600mg、约625mg、约650mg、约675mg、约700mg、约725mg、约750mg、约775mg、约800mg、约825mg、约850mg、约875mg、约900mg、约925mg、约950mg、约975mg、约1000mg、约1025mg、约1050mg、约1075mg、约1100mg、约1125mg、约1150mg、约1175mg、约1200mg、约1225mg、约1250mg、约1275mg、约1300mg、约1325mg、约1350mg、约1375mg、约1400mg、约1450mg、约1475mg或约1500mg。
[0155]
个体剂量内包含的抗bet v 1抗体的量可以以每千克患者体重(即,mg/kg)的活性剂(例如,抗体)毫克数表示。例如,可以将抗bet v 1抗体以约0.0001mg/kg至约10mg/kg患者体重的剂量向患者施用,例如约1mg/kg至约10mg/kg或约1mg/kg、2mg/kg、3mg/kg、4mg/kg、5mg/kg、6mg/kg、7mg/kg、8mg/kg、9mg/kg或10mg/kg。
[0156]
在一些实施例中,一种或多种抗bet v 1抗体或包括一种或多种抗bet v 1抗体的药物组合物以约一周四次、一周两次、一周一次、每两周一次、每三周一次,每四周一次、每五周一次、每六周一次、每八周一次、每十二周一次的频率或更不频繁地向受试者施用,只要实现治疗应答。在一些实施例中,一种或多种抗bet v 1抗体每三个月施用一次、每四个月施用一次、每五个月施用一次、每六个月施用一次、每七个月施用一次、每八个月施用一次、每九个月施用一次、每十个月施用一次、每十一个月施用一次或每十二个月施用一次。在一些实施例中,一年一次或一年两次施用抗bet v 1抗体。在一些实施例中,在过敏季节开始之前(例如,在桦树花粉季节之前),一年一次或一年两次施用抗bet v 1抗体。
[0157]
在涉及以本文所描述的给药频率施用包括抗bet v 1抗体的药物组合物的某些实施例中,每个剂量以约50mg至约600mg,例如,约50mg、100mg、150mg、200mg、250mg或300mg的量施用,或在其中施用两种或更多种抗bet v 1抗体的实施例中,对于施用的每个剂量,每种抗bet v 1抗体以约50mg至约600mg,例如,约50mg、100mg、150mg、200mg、250mg或300mg的量施用。在施用两种抗bet v 1抗体的某些实施例中,对于施用的每个剂量,抗bet v 1抗体以1:1的比例施用。在施用三种抗bet v 1抗体的某些实施例中,对于施用的每个剂量,抗bet v 1抗体以1:1:1的比例施用。
[0158]
在一些实施例中,在限定的时间过程中向受试者施用多剂量的抗bet v 1抗体或抗bet v 1抗体的混合物。在一些实施例中,本公开的方法包括向受试者顺序施用多剂量的一种或多种抗bet v 1抗体。如本文所使用的,“依次施用”意指在不同时间点,例如在相隔预定间隔(例如,几小时、几天、几周或几个月)的不同日子,向受试者施用每个剂量的一种或多种抗bet v 1抗体。在一些实施例中,本公开的方法包括向患者依次施用单个初始剂量的一种或多种抗bet v 1抗体,随后施用一个或多个第二剂量的一种或多种抗bet v 1抗
体,并且任选地随后施用一个或多个第三剂量的一种或多种抗bet v1抗体。术语“初始剂量”、“第二剂量”和“第三剂量”是指施用一种或多种抗bet v 1抗体的时间顺序。因此,“初始剂量”是在治疗方案开始时施用的剂量(也被称为“负荷剂量”);“第二剂量”是在初始剂量之后施用的剂量;并且“第三剂量”是在第二剂量之后施用的剂量。
[0159]
在一些实施例中,初始剂量、第二剂量和第三剂量均含有相同量的一种或多种抗bet v 1抗体,但在施用频率方面彼此不同。在其它实施例中,在治疗过程期间,初始、第二和/或第三剂量中包含的一种或多种抗bet v 1抗体的量彼此不同(例如,适当地向上或向下调节)。在某些实施例中,一个或多个(例如,1、2、3、4或5个)剂量在治疗方案开始时作为“负荷剂量”施用,随后是在较低频率基础上施用的后续剂量(例如,“维持剂量”)。例如,抗bet v 1抗体或抗bet v 1抗体的混合物的第一量可以是抗bet v 1抗体或抗bet v 1的混合物的第二量的1.5x、2x、2.5x、3x、3.5x、4x或5x或更多。
[0160]
在一些实施例中,紧接着前一剂量后1周至30周(例如,1周、1 1/2周、2周、2 1/2周、3周、3 1/2周、4周、4 1/2周、5周、5 1/2周、6周、6 1/2周、7周、7 1/2周、8周、8 1/2周、9周、9 1/2周、10周、10 1/2周、11周、11 1/2周、12周、12 1/2周、13周、13 1/2周、14周、14 1/2周、15周、15 1/2周、16周、16 1/2周、17周、17 1/2周、18周、18 1/2周、19周、19 1/2周、20周、20 1/2周、21周、21 1/2周、22周、22 1/2周、23周、23 1/2周、24周、24 1/2周、25周、25 1/2周、26周、26 1/2周、27周、27 1/2周、28周、28 1/2周、29周、29 1/2周、30周或更多周)周施用每个第二剂量和/或第三剂量。如本文所使用的,短语“紧接着前一剂量”意指按照多次施用的顺序,在没有中间剂量的情况下在按顺序施用下一个剂量之前施用于患者的抗bet v 1抗体的剂量。
[0161]
本公开的方法可以包括向患者施用任何数量的第二剂量和/或第三剂量的抗bet v 1抗体或抗bet v 1抗体的混合物。举例来说,在某些实施例中,仅向患者施用单次二级剂量。在其它实施例中,将两个或更多个(例如,2、3、4、5、6、7、8或更多个)第二剂量施用给患者。同样,在某些实施例中,仅向患者施用单次三级剂量。在其它实施例中,将两个或更多个(例如,2、3、4、5、6、7、8或更多个)第三剂量施用给患者。
[0162]
在涉及多个第二剂量的一些实施例中,以与其它第二剂量的频率相同的频率施用每个第二剂量。类似地,在涉及多个第三剂量的一些实施例中,以与其它第三剂量的频率相同的频率施用每个第三剂量。或者,在治疗方案的过程中,向患者施用的第二和/或第三剂量的频率可以变化。医师也可以在治疗过程中调节施用频率,取决于在临床检查以后各个患者的需要。
[0163]
在一些实施例中,以每种抗体约50mg的剂量(三种抗体的总剂量约150mg)向受试者施用包括如本文所公开的第一抗bet v 1抗体、第二抗bet v 1抗体和第三抗bet v 1抗体中的每一种的药物组合物。在一些实施例中,皮下或静脉内向受试者施用药物组合物。
[0164]
在一些实施例中,以每种抗体约150mg的剂量(三种抗体的总剂量约450mg)向受试者施用包括如本文所公开的第一抗bet v 1抗体、第二抗bet v 1抗体和第三抗bet v 1抗体中的每一种的药物组合物。在一些实施例中,皮下或静脉内向受试者施用药物组合物。
[0165]
在一些实施例中,以每种抗体约300mg的剂量(三种抗体的总剂量约900mg)向受试者施用包括如本文所公开的第一抗bet v 1抗体、第二抗bet v 1抗体和第三抗bet v 1抗体中的每一种的药物组合物。在一些实施例中,皮下或静脉内向受试者施用药物组合物。
id no:16的lcdr1、seq id no:17的lcdr2和seq id no:18的lcdr3。
[0177]
regn5715是一种完全人抗bet v 1抗体,所述抗体包括seq id no:21的hcvr、seq id no:22的hcdr1、seq id no:23的hcdr2、seq id:24的hcdr3、seq id no:25的lcvr、seq id no:26的lcdr1、seq id no:27的lcdr2和seq id no:28的lcdr3。
[0178]
本研究的主要目的是评估regn5713-5714-5715在健康成人受试者中的安全性和耐受性。研究的次要目的是:表征健康成人中单剂量的regn5713-5714-5715的浓度时间曲线(a部分和b部分);评估单剂量的regn5713-5714-5715(a部分和b部分)的免疫原性;通过在单个sc剂量的regn5713-5714-5715(b部分)后测量由桦树过敏原鼻部过敏原攻击(nac)引起的桦树敏感的过敏受试者的总鼻部症状评分(tnss)来评估过敏症状的抑制作用;并且评估在单个900mg sc剂量的regn5713-5714-5715(b部分)后,通过皮肤点刺测试(spt)和连续桦树过敏原滴定引起的皮肤测试反应性。对于b部分,另外的探索性目的是:通过在单个sc剂量的regn5713-5714-5715后测量由桦树过敏原nac引起的桦树敏感过敏受试者的toss来评估过敏症状的抑制作用;通过在单个sc剂量的regn5713-5714-5715后测量由用桦树花粉提取物(nac)鼻内攻击的桦树敏感的ar受试者的pnif来评估过敏应答的抑制;通过在单个sc剂量的regn5713-5714-5715后测量由用桦树花粉提取物(nac)鼻内攻击的nac后桦树敏感的ar受试者的鼻粘膜组织的rna测序和鼻液中的趋化因子/细胞因子来评估过敏应答的抑制;并且评估对regn5713-5714-5715的临床应答与regn5713-5714-5715以及其组分在药物暴露前干扰基线时内源性血清ige与bet v 1结合的能力之间的关系。
[0179]
在a部分中,在获得知情同意后,对受试者进行资格评估。符合条件的受试者参加了基线前访视,在访视期间他们被收治。研究药物的给药发生在第二天,即研究第1天(随机)。sc给药后至少48小时或iv给药后至少24小时,对受试者进行临床监测。安全性评估后,受试者分别在sc给药后第3天或iv给药后的第2天出院。受试者在第8天、第15天、第22天、第29天、第43天、第57天、第85天、第99天和第113天(对于sc给药队列)或第4天、第8天、第15天、第22天、第29天、第43天、第57天、第85天、第99天和第113天(对于iv给药队列)返回诊所进行安全性评估。
[0180]
b部分是一项随机、安慰剂对照和双盲、单剂量鼻部过敏原攻击(nac)研究,用于评估安全性、耐受性和药物浓度随时间的变化,以及900mg sc regn5713-5714-5715对患有桦树花粉过敏的健康成年受试者的pd作用。b部分纳入发生在桦树地方性地理区域的桦树过敏季节之外。在获得知情同意后,受试者在至多12周的3部分筛选期期间进行资格评估。在筛查访视1期间,有桦树花粉ar史的受试者接受了病史、体检、针对桦树的spt、以及针对桦树花粉和bet v 1特异性ige的抽血。按照纳入/排除标准,如果受试者复合桦树、桦树花粉和bet v 1特异性ige的spt阳性标准,则受试者被邀请进行筛查访视2。在筛查访视2时,其接受了血清妊娠测试(如适用)、肺活量测定、ecg、慢性病毒感染(人免疫缺陷病毒感染[hiv]以及乙型肝炎和丙型肝炎)的血清学测试、血液学、化学、尿液分析,并且将根据剩余的研究合格标准进行评估。如果受试者在过去12个月内完成了历史性、阳性桦树spt或桦树ige,筛查访视1和2可以合并为一次访视。在筛查访视3/进入访视时,观察受试者至少10分钟,并且必须达到休息/基线tnss≤2,这表示受试者在nac前休息时(由于病毒感染、鼻窦炎、过敏等)没有活动鼻部症状。在开始nac之前,用连续过敏原滴定进行spt以评估早期反应(epr)。epr评估完成后,nac进行如下:
[0181]
·
nac使用每10分钟增加剂量的桦树提取物进行,直到1小时(上滴定阶段),或直到达到tnss≥7。
[0182]
·
记录峰值tnss。
[0183]
·
记录用于达到tnss≥7的桦树提取物浓度。
[0184]
·
在随后的一小时内观察受试者,并且在峰值tnss后约5分钟、15分钟、30分钟、45分钟、1小时和每小时记录tnss,至多到6小时。
[0185]
·
除tnss外,在nac程序和6小时观察期间,还测量了toss、pnif(以鼻腔通畅度升/分钟测量)和总打喷嚏次数。
[0186]
桦树过敏受试者在筛查nac(访视3)前tnss≤2,在上滴定阶段期间的第一个小时内峰值tnss≥7,符合入选条件。另外,为了符合资格,在第一次非零剂量与最高/峰值剂量后约10分钟之间,受试者必须经历pnif下降》20%或打喷嚏≥3次。
[0187]
研究药物的给药发生在研究第1天。sc给药后,在临床上对受试者进行至少8小时的监测。安全性评估后,受试者在sc给药后至少8小时出院。受试者在第4天、第8天、第29天、第57天、第85天、第99天和第113天返回诊所进行安全性评估。研究结束访视发生在研究药物施用后约16周。受试者参与研究约28周,包含筛查期。
[0188]
此研究是根据赫尔辛基宣言(declaration of helsinki)、国际协调会议良好临床实践(international conference on harmonization good clinical practices)指南的规定和适用的监管要求进行的。所述方案由所有现场的机构审查委员会/道德委员会审查和批准。所有成年患者均获得书面知情同意书。
[0189]
患者群体
[0190]
本研究在筛查访视时纳入了18岁至60岁(含)的成年健康男性和女性。
[0191]
纳入标准:患者必须符合以下标准才能有资格纳入研究:(1)筛查访视时18岁至60岁(含)的男性或女性;(2)筛查访视时体重指数(bmi)在18与31kg/m2(含)之间;(3)研究者基于研究药物给药前的病史、体检、生命体征测量和ecg判断受试者健康状况良好;(4)基于研究药物给药前筛查访视时获得的实验室安全性测试,受试者健康状况良好;(5)愿意并能够遵守临床访视和研究相关程序;(6)提供研究受试者或法律上可接受的代表签署的知情同意书。b部分另外的纳入标准:(7)能够理解并完成研究相关调查问卷;(8)基于受试者的回忆,有桦树花粉引发的ar症状的病史,伴有或不伴有结膜炎(持续至少2个季节);(9)在筛查期使用桦树花粉提取物具有spt阳性(平均风团直径≥5mm,比阴性对照大);(10)在筛查期对桦树花粉和bet v 1(≥0.35kua/l)具有阳性过敏原特异性ige(sige)测试;(11)在筛查访视中,使用桦树提取物的阳性nac的峰值tnss≥7,总共为12;以及(12)在筛查访视时在第一非零剂量与最高剂量nac后约10分钟之间,pnif下降》20%和/或打喷嚏≥3。
[0192]
排除标准:以下是本研究的排除标准:(1)研究者评估的具有临床意义的心血管、呼吸、肝脏、肾脏、胃肠道、内分泌、血液学、精神病或神经疾病病史,所述疾病可能会混淆研究结果或因参与研究而对受试者造成另外的风险;(2)有任何体检发现和/或研究的研究者认为可能会混淆研究结果或因参与研究而对受试者造成另外的风险的疾病史;(3)筛查访视1后60天内因任何原因住院(》24小时);(4)在筛查访视1前3个月内戒烟的当前吸烟者或前吸烟者(香烟或电子烟);(5)筛查访视1前一年内的药物或酒精滥用史(注:研究药物给药前药物和酒精筛查必须为阴性);(6)筛查时或给药前3个月内出现hiv、乙型肝炎或丙型肝
炎血清阳性,聚合酶链反应或蛋白质印迹记录的假阳性筛查测试除外;(7)过去5年内的任何恶性肿瘤,但已切除的皮肤基底细胞癌或鳞状上皮细胞癌或宫颈或肛门原位癌除外,3年内无局部复发或转移性疾病的证据;(8)筛选时肾小球滤过率估计值(使用变量肾病饮食调整研究方程或慢性肾病流行病学协作方程)《60毫升/分钟/1.73平方米;(9)研究者在筛查时或给药前评估的具有临床意义的异常ecg,或在重复测量中确认的异常间期(男性qtcf》470毫秒;女性》480毫秒);(10)对蛋白质治疗剂或调配物组分的急性超敏和/或过敏史,或研究者认为可能对受试者构成重大风险的过敏史;(11)在当前试验筛选前90天内或至少5个半衰期内(以较长者为准)参加任何评估另一种研究性药物或疗法的临床研究,或至少28天内参加其它研究性产品的研究,或6个月内参加免疫疗法的研究;(12)不愿意或无法遵守本研究的允许和禁止用药规范;(13)临床研究团队成员和/或其直系亲属,除非发起人事先批准;(14)已知对强力霉素(doxycycline)或类似化合物(即四环素(tetracycline))具有敏感性;(15)孕妇或哺乳期妇女;(16)怀孕测试结果呈阳性或基线时没有怀孕测试结果的有生育能力的妇女;(17)有生育能力的妇女,在第一次治疗开始前、研究期间以及最后给药后至少6个月内不愿意实施高效避孕;(18)在研究药物随访期间和研究药物最后剂量后6个月内,不愿意使用以下医学上可接受的节育措施的性活跃男性:输精管结扎术(具有外科手术成功的医学评估)或持续使用避孕套。b部分的另外的排除标准:(19)a部分中的研究药物regn5713-5714-5715的受体;(20)在访视3时,因nac而出现全身症状,包含但不限于喘息、喉咙紧缩或呼吸急促;(21)在桦树花粉季节之外或由于日常接触其它引起症状的过敏原而引起的显著鼻炎或鼻窦炎,这与研究者评估的研究nac评估一致;(22)预期其家庭或工作环境中过敏原暴露的主要变化与研究者评估的研究nac评估一致的受试者;(23)研究者判断的肺功能异常,预测fev1《80%;(24)哮喘的临床病史,需要长期药物治疗,如每年》6个月的定期吸入皮质类固醇;(25)上一年有2次或更多次哮喘加重需要住院或全身皮质类固醇治疗的哮喘临床病史;(26)严重复发性鼻窦炎病史,定义为过去2年每年至少3次需要抗生素治疗;(27)慢性阻塞性肺病(copd)病史;(28)筛查前5年内桦树过敏免疫疗法史(scit、舌下免疫疗法或口服免疫疗法);(29)筛查前6个月内使用抗ige或其它生物疗法;(30)筛选前6个月内用任何过敏原进行过敏原特异性免疫疗法;(31)在任何筛查访视中筛查act《20。
[0193]
研究治疗
[0194]
regn5713、regn5714和regn5715用于此研究,每种药物的浓度如下:
[0195]
·
regn5713、regn5714和regn5715药物产品,冻干265mg于20ml小瓶中
[0196]
·
regn5713/regn5714/regn5715安慰剂产品,冻干,于20ml小瓶中
[0197]
每种药物的重组药物为150mg/ml:regn5713、regn5714和regn5715。因此,150mg总剂量的regn5713、regn5714和regn5715(队列1)的总注射药物体积(sc)为1ml,450mg总剂量的regn5713、regn5714和regn5715(队列2)为3ml,900mg总剂量的regn5713、regn5714和regn5715(队列3和b部分)为6ml。可以将多个注射器用于sc注射。例如,队列3和b部分使用3个注射器(每个注射器2ml)注射sc药物。sc注射的优选的部位是腹部,但可以在腹部、大腿或上臂给予注射。
[0198]
对于a部分,有如下四个队列:
[0199][0200][0201]
对于b部分,在第1天施用900mg sc(300mg/mab)的regn5713-5714-5715或安慰剂。
[0202]
补救治疗:如果需要,根据研究者的判断,对出现过敏反应的受试者进行抗过敏补救治疗。在研究过程期间,受试者还可以根据ar症状的需要服用口服抗组胺药。然而,在nac或皮肤点刺测试访视前或期间5天内禁止口服抗组胺药。
[0203]
评估的结果
[0204]
对于a部分和b部分,主要端点是受试者报告或研究者观察到的治疗紧急不良事件(teae)的发生率和严重程度,以及与安慰剂相比,接受regn5713-5714-5715施用的sc或iv的受试者的其它安全变量。
[0205]
a部分和b部分的次要端点为:在访视时间表中规定的采样时间,血清中regn5713、regn5714和regn5715的总浓度;以及受试者中针对regn5713、regn5714和regn5715的治疗中出现的抗药物抗体的发生率。
[0206]
b部分的次要端点仅为:与安慰剂相比,在第8天、第29天和第57天,对nac反应的regn5713-5714-5715 900mg sc的tnss(峰值tnss后0小时至1小时)曲线下面积(auc)相对于治疗前基线tnss auc(峰值tnss后0小时至1小时)的变化和变化百分比;以及与安慰剂相比,相对于治疗前基线,regn5713-5714-5715 900mg sc在第8天、第29天和第57天用连续桦树过敏原滴定进行的皮肤点刺测试的平均风团直径的变化和变化百分比。
[0207]
用于评估功效的程序如下所述。
[0208]
总鼻部症状评分(tnss):总鼻部症状评分(tnss)以0分至12分为单位进行测量,是对鼻塞、瘙痒和鼻漏(每一个评分为0分至3分,3分为严重)以及打喷嚏(3分为》5个喷嚏)的综合症状评估。从预处理基线tnss对nac的反应开始,在第8天、第29天和第57天记录对nac反应的tnss,以评估regn5713-5714-5715对使用桦树过敏原的nac引起的ar症状的功效。
[0209]
总眼部症状评分(toss):总眼部症状评分(toss)以0分至12分为单位进行测量,是对眼部症状(瘙痒/灼热、发红、流水和流泪以及浮肿和肿胀)的综合症状评估。在nac评估期间记录toss评分。
[0210]
峰值鼻吸气流量(pnif):峰值鼻吸气流量(pnif,升/分钟)是测量鼻腔通畅或鼻塞的指标。在nac评估期间测量并记录pnif。
[0211]
安全性变量
[0212]
通过回顾不良事件(ae)、生命体征、12导联心电图(ecg)、体检和常规实验室安全
性测试,在整个研究(a部分和b部分)中评估安全性。另外,对于b部分,在筛查期间进行肺活量测定(符合美国胸科学会(american thoracic society)[ats]/欧洲呼吸学会(european respiratory society)[ers]),包含用力肺活量(fvc)(l)、用力呼气量(fev1)(l),fev1/fvc(%)、峰值呼气流量(升/秒)、用力呼气流量25至75(升/秒)以及哮喘控制测试(act),以排除任何肺功能异常和/或哮喘控制不良的受试者。在所有受试者的每次nac程序前进行act,并且在有哮喘史的受试者进行nac程序之前测量肺活量。fev1必须预测为≥80%,才能在任何有哮喘史的受试者中进行nac。
[0213]
药代动力学、药效学和其它生物标志物变量
[0214]
药代动力学变量包含以下内容:每个特定时间点血清中regn5713、regn5714和regn5715的浓度。
[0215]
在b部分中,在筛查访视1时和指定的研究日(例如,第8天、第29天、第57天和第113天),用连续过敏原滴定对桦树过敏原提取物和至少一种其它桦树同源树过敏原(例如,桤木)进行标准spt以评估敏感状态。皮肤点刺测试数据可以用于确定基线时桦树敏感与regn5713-5714-5715的pd作用之间的关系,以减少nac时的鼻部症状。将在筛选时和第29天使用桦树过敏原提取物进行使用连续过敏原滴定的滴定spt,以评估regn5713-5714-5715对皮肤风团大小应答(由肥大细胞脱颗粒介导)的pd作用。
[0216]
血清抗体按如下评估:
[0217]
·
筛查访视1(v1)和基线时过敏原特异性ige水平(桦树花粉,bet v1)
[0218]
·
筛查和基线时的过敏原特异性ige水平(bet v 1和其它常见过敏原),以评估敏感状态,并且评估对regn5713-5714-5715的反应与多/单敏感之间的关系
[0219]
·
使用nac前采集的血样,在第8天、第29天和第57天的过敏原特异性ige水平(bet v 1和其它常见过敏原)
[0220]
·
可以在筛查、基线和第8天、第29天和第57天使用nac前采集的血样测量血清抗体的另外的亚类(例如,针对桦树花粉和bet v 1的igg和igg4)
[0221]
另外,可以获得血液进行另外的探索性研究测试,以更好地了解regn5713-5714-5715对桦树过敏的影响。这可能包含在体外测定中评估regn5713-5714-5715与内源性血清ige之间对过敏原结合的有效竞争。还将测量针对其它相关树木过敏的血清ige,以与用regn5713-5714-5715治疗后的症状改善相关联。也可采集外周血样(全血、外周血单核细胞[pbmc]),用于探索性生物标志物研究,以研究治疗后对桦树花粉和其它过敏原的离体过敏应答的变化。nac后约6小时,可以从桦树过敏受试者处收集鼻刷。nac后2型炎性应答基因特征的变化将通过rna序列分析。
[0222]
nac后至多约6小时内,可以从桦树过敏受试者处获得鼻液。将测定桦树花粉过敏受试者鼻液中的2型细胞因子和趋化因子:将在nac后至多6小时内测量2型细胞因子(例如,il-4、il-13)和趋化因子(例如,tarc、嗜酸性粒细胞趋化因子)的水平,以评估用regn5713-5714-5715治疗后对桦树花粉过敏应答的抑制。
[0223]
结果
[0224]
研究受试者
[0225]
在a部分中,总共32位受试者被随机分组(24位受试者接受regn5713-5714-5715,8位受试者接受安慰剂)。在b部分中,总共64位受试者被随机分组(32位受试者接受
regn5713-5714-5715,32位受试者接受安慰剂)。在a部分和b部分随机分组的所有受试者均接受了其预期的研究治疗,并且在第113天研究访视结束时完成了研究。
[0226]
a部分中各治疗组的年龄、种族、民族和bmi的基线人口统计数据大体相似(表1)。在a部分的regn5713-5714-5715受试者中,16位(66.7%)为女性,平均身高和体重分别为169.2cm和67.5kg,相比之下,安慰剂受试者中的女性受试者为2位(25%),平均身高和体重分别为177.9cm和75.6kg。在b部分中,各治疗组的年龄、性别、种族、民族、身高、体重和bmi的基线人口统计数据大体相似(表2)。
[0227]
安全性
[0228]
当通过sc和iv途径施用时,regn5713-5714-5715通常耐受性良好。a部分或b部分中无sae、无死亡且无teae导致研究中止(表3、表4)。regn5713-5714-5715(a部分:88.9%,b部分:81.3%)与安慰剂(a部分:100%,b部分:93.8%)之间teae的总体频率相当(表3、表4)。任何teae均无剂量依赖性趋势。regn5713-5714-5715(a部分:25.0%,b部分:21.9%)与安慰剂(a部分:12.5%,b部分:25.0%)之间治疗相关teae的总体频率也相当(表3、表4)。
[0229]
a部分报告了两种注射部位反应(450mg sc regn5713-5714-5715组中为1[16.7%],并且900mg sc中为1[16.7%]),b部分报告了11个(900mg sc中为5[15.6%],安慰剂中为6[18.8%])。所有注射部位反应均为轻度反应。任何teae均无剂量依赖性趋势。在regn5713-5714-5715iv+sc组中,a部分中最常见的teae是头痛(接受regn5713-5714-5715的受试者占29.2%,接受安慰剂的受试者占50.0%)、鼻咽炎(20.8%对62.5%)和腹痛(16.7%对25.0%)。在b部分中,头痛(34.4%对28.1%)、鼻咽炎(15.6%对34.4%)和鼻窦炎(6.3%对15.6%)是regn5713-5714-5715组中最常见的teae。
[0230]
表1:a部分的人口统计和基线特征汇总
[0231][0232]
表2:b部分的人口统计和基线特征汇总
[0233][0234]
表3:a部分治疗突发不良事件的概述
[0235][0236]
表4:b部分治疗突发不良事件的概述
[0237][0238][0239]
药代动力学
[0240]
在a部分中,sc施用后,pk曲线表现出初始吸收阶段,t
max
约为8.5天,随后是所有三
种施用的抗体的单相消除阶段。所有三种抗体的半衰期相似,三种sc剂量的regn5713的平均半衰期为25.9
±
5.0天,三种sc剂量的regn5714的平均半衰期为31.7
±
4.3天,三种sc剂量的regn5715的平均半衰期为34.7
±
5.9天。regn5713-5714-5715浓度以剂量比例方式增加,auc
inf
和c
max
,呈剂量比例增加,与所有三种抗体的线性pk一致。iv施用后,观察到快速初始分配阶段,随后是单相消除阶段。所有三种抗体的半衰期与sc施用一致;regn5713、5714和5715分别为26.7
±
5.0天、29.9
±
4.7天和32.1
±
5.1天。regn5713显示出比regn5714和regn5715稍高的清除率和更低的血清浓度,以及稍短的半衰期,但所有三种抗体都显示出大致相似的pk特征。iv剂量的施用允许根据平均auc
inf
计算生物利用度(f)。在三种抗体中,不同剂量水平的f范围为70%至93%,所有sc剂量的平均f为regn5713为72%,regn5714为79%,regn5715为88%。
[0241]
在b部分中,在线性pk后,在bet v 1敏感患者中施用regn5713-5714-5715sc表现出与健康受试者中施用相似的浓度-时间曲线。视觉检查和浓度时间曲线的图形叠加显示,bet v 1敏感患者和健康志愿者之间的差异不大。
[0242]
功效
[0243]
符合b部分中评估的关键功效端点。如图1和表5所示,与单剂量安慰剂后8天、29天和57天相比,单剂量regn5713-5714-5715显著降低了nac后的tnss auc(0小时至1小时)(研究第8天、第29天、第57天,与基线nac相比,安慰剂调节的tnss auc变化分别为-1.17[p=0.001]、-1.18[p=0.001]和-0.85[p=0.024])。与基线相比的变化百分比产生了类似的结果,与基线nac相比,到第57天,tnss auc(0小时至1小时)显著降低(研究第8天、第29天和第57天,与基线nac相比,安慰剂调节的tnss auc的变化百分比分别为-31.57%[p=0.002]、-27.35%[p=0.003]和-19.00%[p=0.053])。参见图2和表5。用抗bet v 1混合物治疗两个月后,鼻部症状持续减少,8名受试者在2个月后表现出tnss auc下降100%。regn5713-5714-5715在第57天的相对治疗功效下降与安慰剂效应增加有关(研究第8天、第29天和第57天的tnss auc(0小时至1小时)下降百分比分别为-31.39%、-31.15%和-41.96%)。在所有研究日,regn5714-5714-5715的治疗效果始终保持在60%左右(研究第8天、第29天和第57天的tnss auc(0小时至1小时)下降百分比分别为-62.96%、-58.50%和-60.96%)。与安慰剂相比,用单剂量的regn5713-5714-5715治疗也显著降低了nac后第8天、第29天和第57天的峰值tnss。参见图3和表5。
[0244]
regn5713-5714-5715和安慰剂组(数据未示出)基线时连续桦树滴定spt中的平均风团直径相似,基线访视中观察到平均风团直径类似的auc分别为4.14和3.93(表2)。regn5713-5714-5715显著降低了第113天spt平均风团直径相对于安慰剂的auc(研究第8天、第29天、第57天和113天,相对于基线spt,安慰剂调节的变化百分比分别为-72.39%[p《0.001]、-65.61%[p《0.001]、-77.90%[p《0.001]、-73.56%[p《0.001])。参见图4a和表5。因此,即使在给药后3.5个月,单剂量抗bet v 1混合物在减少桦树敏感方面也显示出持久的应答。
[0245]
表5:关键功效端点
[0246][0247][0248]
基线时,受试者的nac引起的眼部症状最小;regn5713-5714-5715和安慰剂组的平均toss auc分别为1.3和2.1(表2)。如表5和图5a至5b所示,与给药后8天和29天的安慰剂相比,单剂量regn5713-5714-5715显著降低了nac后的toss auc(0小时至1小时),并且在给药后第57天出现了趋势(研究第8天、第29天和第57天,与基线nac相比,安慰剂调节的toss auc变化分别为-0.48[p=0.013]、-0.59[p=0.007]和-0.30[p=0.191])。两位(6.3%)安慰剂受试者和五位(15.6%)regn5713-5714-5715受试者在基线时无眼部症状,auc=0。另外,与安慰剂相比,抗bet v 1混合物组的峰值鼻吸气流量(pnif)至少提高了30%,在第29天达到了统计学显著性(研究第8天、第29天和57天,相对于基线auc,安慰剂调节的变化百分比分别为32%[p=0.092]、47%[p=0.017]和35%[p=0.121])。参见图6和表5。
[0249]
桦树同源过敏原的滴定皮肤点刺测试
[0250]
regn5713-5714-5715(5.3)组和安慰剂(4.9)组在基线时连续桤木滴定spt的平均风团直径的auc也相似(表2)。相对于安慰剂,regn5713-5714-5715显著降低了第113天桤木spt平均风团直径的auc。相对于基线spt,安慰剂调节的变化百分比为:-44.7%(第8天,p《.001)、-46.3%(第29天,p《.001)、-52.8(第57天,p《.001)、-49.8(第113天,p《.001)。参见图4b。
[0251]
嗜碱性粒细胞激活
[0252]
对b部分的患者的子集进行了生物标志物亚研究。在单个中心中对26位研究受试者(13位用regn5713-5714-5715治疗;13位用安慰剂治疗)进行了嗜碱性粒细胞激活测定。嗜碱性粒细胞激活以cd63表面表达为标志;例如通过流式细胞术测量为cd63+的嗜碱性粒细胞的百分比。增加浓度的桦树过敏原提取物用于离体刺激患者全血中的嗜碱性粒细胞。通过ec50测量嗜碱性粒细胞对过敏原刺激的应答性,所述ec50是实现50%的最大嗜碱性粒细胞的激活所需的桦树过敏原浓度。较高的ec50值表明嗜碱性粒细胞对过敏原刺激的应答性较低(即嗜碱性粒细胞应答性的抑制增加)。使用非参数测试比较治疗组与安慰剂组之间的与基线ec50相比的变化百分比。桦树的ec50与临床应答相关,所述临床应答包含nac和spt后的总鼻部症状评分(tnss)。
[0253]
使用b
ü
hlmann的flow 试剂盒(瑞士b
ü
llmann实验室ag公司(b
ü
hlmann laboratories ag,switzerland)进行嗜碱性粒细胞激活测试(bat),其中ccr3和cd63用于离体刺激患者全血中的嗜碱性粒细胞后,用七种升高浓度的过敏原提取物(0.0055ng/ml至22.72ng/ml)进行嗜碱性粒细胞检测,以生成剂量-应答曲线。通过流式细胞术分析中cd63表面表达的嗜碱性粒细胞阳性的百分比来测量嗜碱性粒细胞的激活。嗜碱性粒细胞对桦树、桤木、榛树、苹果和草混合物(过敏原来源:瑞士b
ü
llmann实验室ag公司或维也纳biomay ag公司(biomay ag,vienna))提取物的应答性通过ec50测量。
[0254]
与安慰剂(n=13)相比,观察到治疗的患者(n=13)嗜碱性粒细胞对桦树、桤木、榛树和苹果花粉提取物的应答性受到显著抑制,如通过与ec50的与基线相比的变化%(桦树和桤木:第8天、第57天、第113天均为p《0.001;榛树:第8天,p《0.001,第57天,p=0.01;苹果:第8天,p《0.01;第57天和第113天,p《0.05);第8天检测到最高ec50。参见图7a至7d。regn5713-5714-5715治疗未检测到嗜碱性粒细胞对草过敏原混合物(阴性对照)的应答抑制(图7e)。
[0255]
对用regn5713-5714-5715治疗的患者评估嗜碱性粒细胞抑制与皮肤点刺测试(spt)减少之间的关系。spt是通过用增加浓度的桦树过敏原刺穿患者前臂皮肤来进行的。在每种桦树过敏原浓度下诱导的平均风团直径(mwd)用于auc分析。在第8天(r=-0.6,p=0.04)和第57天(r=-0.57,p=0.04),在治疗组中观察到桦树嗜碱性粒细胞激活测定(bat)ec50与桦树spt(平均风团直径)auc的变化百分比呈负相关。参见图8。
[0256]
还评估了嗜碱性粒细胞抑制与tnss应答之间的关系。对接受regn5713-5714-5715的积极治疗组的分析还显示,第8天桦树过敏原的tnss
(0小时至1小时)
auc与ec50的变化百分比之间存在负相关,此时嗜碱性粒细胞对桦树刺激的应答被最大程度抑制(r=-0.71,p=0.0095)。参见图9a至9b。一位受试者未实现任何临床改善;在该受试者的血液中未检测到嗜碱性粒细胞应答性的抑制。
[0257]
结论
[0258]
当通过iv或sc途径施用时,regn5713-5714-5715通常耐受性良好。没有死亡或导致治疗或研究中止的teae。regn5713-5714-5715的浓度时间曲线表现出线性pk。如通过tnss测量的,单剂量的regn5713-5714-5715在8天内和至少两个月内减少了过敏症状,并且在研究第113天提供了减少桦树敏感的持久应答。
[0259]
用regn5713-5714-5715而非安慰剂治疗显著降低了对桦树花粉提取物的嗜碱性
粒细胞应答。值得注意的是,桦树过敏原的ec50与临床应答的改善相关,表明嗜碱性粒细胞对桦树花粉的敏感性越低(即ec50越高),患者可能获得的临床益处就越大。此研究表明,抗bet v 1单克隆抗体在桦树过敏患者中的临床功效可能部分通过抑制嗜碱性粒细胞和肥大细胞介导的过敏应答来实现。
[0260]
用regn5713-5714-5715治疗后,嗜碱性粒细胞对桤木(r aln g 1)、榛树(r cor a 1)花粉提取物和苹果(r mal d 1)的应答性受到显著抑制。这些数据也与spt结果一致,所述spt结果显示regn5713-5714-5715在用桤木花粉提取物spt后显著降低了平均风团直径。对同源过敏原的嗜碱性粒细胞应答的显著抑制表明,regn5713-5714-5715作为混合物可以改善对桦树以外的相关树木过敏原的过敏应答,并且可以治疗桦树花粉相关oas。
[0261]
总之,单次皮下剂量的regn5713-5714-5715耐受性良好,并且快速持久地减少桦树过敏原激发后的过敏症状。新型bet v 1mab混合物对其它交叉反应过敏原的过敏应答的抑制可以为预防和治疗季节性桦树和相关过敏提供方便、快速和长效的疗法。靶向主要桦树过敏原bet v 1的三抗体混合物为大多数患者提供了显著的临床改善。
[0262]
实例2:抗bet v 1单克隆抗体降低季节性过敏性鼻炎症状的功效的临床试验研究
[0263]
研究设计和目标
[0264]
此实例描述了一项3期、多中心、随机、双盲、安慰剂对照、平行组研究,用于评估抗bet v 1单克隆抗体在桦树花粉季节期间减少过敏性鼻炎和结膜炎症状以及补救药物的使用的功效(nct04709575)。
[0265]
主要目的是评估单剂量的regn5713-5714-5715后与安慰剂相比,在桦树花粉季节期间通过组合症状和药物评分(csms)测量的过敏症状的减少。次要目标是:(1)如通过总症状评分(tss)、总鼻部症状评分(tnss)、总眼部症状评分(toss)和每日药物评分(dms)所测量的,评估与安慰剂相比,单剂量regn5713-5714-5715后过敏症状和过敏缓解药物使用的减少;(2)评估regn5713-5714-5715的安全性和耐受性,包含超敏反应和局部注射部位反应的发生率;(3)如通过皮肤点刺测试(spt)平均风团直径所测量的,评估与安慰剂相比,单剂量regn5713-5714-5715后对桦树过敏原早期过敏应答的减少;(4)确定血清中regn5713、regn5714和regn5715浓度形式的总抗体(即游离和抗原结合)的全身暴露;(5)评估单剂量regn5713-5714-5715后受试者对regn5713、regn5714和regn5715的免疫原性;以及(6)评估“良好日”(定义为tss为≤2且不使用抗过敏补救药物的日子)。
[0266]
总研究持续时间约为28周,包含筛查,取决于当地桦树花粉季节的开始时间和结束时间。桦树花粉季节的长度将因地理位置而异。约300位桦树过敏受试者将被1:1随机分配为regn5713-5714-5715或安慰剂。
[0267]
患者群体
[0268]
此研究将招募患有桦树过敏的健康成年男性和女性受试者。
[0269]
纳入标准:受试者必须符合以下标准才能有资格纳入研究:(1)筛查时18岁及以上的健康男性和女性;(2)记录的或受试者报告的桦树花粉引发过敏性鼻炎症状的病史,伴有或不伴有结膜炎,持续至少2年;(3)在筛查期间用桦树花粉提取物达到阳性spt(即平均风团直径比阴性对照大至少5mm);(4)桦树花粉和bet v 1的sige阳性测试(即≥0.7kua/l);(5)愿意并能够遵守临床访视和研究相关程序;(6)提供研究受试者或法律上可接受的代表签署的知情同意书;(7)能够理解并完成研究相关调查问卷。
[0270]
排除标准:满足以下标准中的任何标准的受试者将被排除在这项研究之外:(1)参与先前的regn5713-5714-5715临床试验;(2)与桦树花粉季节无关的复发性或慢性鼻炎或鼻窦炎,或因与其它过敏原的日常接触而引起预期与桦树花粉季节一致的症状,如由研究者所评估的;(3)受试者预期其家庭或工作环境中过敏原暴露的重大变化,所述变化预期与研究评估一致,由研究者判断;(4)需要用抗生素、抗病毒药物或抗真菌药物治疗的持续性慢性或复发性急性感染,或筛查前4周内任何未经治疗的呼吸道感染。症状缓解后,可以重新评估参与者的资格;(5)活性sars-cov-2感染的记录;(6)研究者判断肺功能异常,fev1《筛查或随机分配时的预测值的70%;(7)上一年有2次或更多次哮喘加重需要住院或全身皮质类固醇治疗的中度到重度哮喘临床病史;(8)严重复发性鼻窦炎病史,定义为筛查前2年每年至少3次需要抗生素治疗;(9)鼻息肉病史;(10)除哮喘以外的活动性肺病;(11)筛查前5年内有桦树或相关树木过敏免疫疗法史(scit、slit或口服免疫疗法);(12)在筛查前6个月内使用改变2型炎症的抗ige或其它生物疗法;(13)筛查前6个月内使用除桦树以外的任何过敏原进行过敏原特异性免疫疗法;(14)有临床意义的心血管、呼吸、肝脏、肾脏、胃肠道、内分泌、血液学、精神病或神经系统疾病史,研究的研究者认为这些疾病可能会混淆研究结果或因参与研究而对受试者造成另外的风险;(15)研究的研究者认为可能会混淆研究结果或因参与研究而对受试者造成另外的风险的任何体检结果和/或任何疾病史;(16)受试者的任何实验室发现显示器官功能障碍或任何临床显著偏离正常范围的证据,由研究者在筛查访视时决定,包含但不限于:(a)临床显著/活跃的潜在肝胆疾病,或(b)筛查时的异常实验室值,如嗜中性粒细胞《1.5
×
103/μl或血小板《100,000个细胞/mm3;(17)筛查前一年内的药物或酒精滥用史;(18)过去5年内的任何恶性肿瘤,但已切除的皮肤基底细胞癌或鳞状上皮细胞癌或宫颈或肛门原位癌除外,3年内无局部复发或转移性疾病的证据;(19)如通过研究者所评估的,筛查期内有临床意义的异常ecg;(20)研究者认为可能对受试者构成重大风险的研究药物中赋形剂的急性超敏和/或过敏史;(21)在2个月内或至少5个半衰期(如已知)内接受研究药物或治疗,以较长者为准;(22)不愿意或无法遵守本研究的允许和禁止药物规范;(23)临床研究团队成员和/或其直系亲属,除非发起人事先批准;(24)孕妇或哺乳期妇女;(25)有生育能力的妇女(wocbp)*,其在研究药物施用前、研究期间以及研究药物给药后至少6个月内不愿意实施高效避孕;(26)在研究药物随访期间和研究药物施用后6个月内,不愿意使用以下医学上可接受的节育措施的性活跃男性:输精管结扎术(具有外科手术成功的医学评估)或持续使用避孕套。
[0271]
研究治疗
[0272]
regn5713、regn5714和regn5715在纸箱中的开放标签小瓶中单独提供。每个20ml小瓶含有265mg冻干蛋白。匹配的安慰剂作为冻干粉末在纸箱中的20ml开放标签小瓶中提供。药房手册中提供了创建以下治疗的说明:
[0273]
·
单次皮下(sc)剂量的regn5713-5714-5715 900mg(300mg/mab)
[0274]
·
替代regn5713-5714-5715的单个sc剂量的匹配安慰剂
[0275]
研究期间,将向受试者提供以下药物以治疗过敏症状:
[0276]
·
地氯雷他定5mg(第二代抗组胺药)
[0277]
·
奥洛他定1mg/ml(抗组胺滴眼液)
[0278]
·
糠酸莫米他松50ug/剂量(鼻内类固醇)
[0279]
从整个桦树花粉季节的研究药物给药开始,受试者将被要求使用电子日记来记录其每日药物使用情况,包含关于使用何种药物和预先指定的药物用量的信息。当受试者达到约tss≥4/18的症状阈值时,应该开始使用补救药物。将为受试者提供培训,以理解与tss≥4/18相关的症状的严重程度。应该指示受试者在预期的桦树花粉季节中不使用补救药物。还应该指导受试者在研究访视结束前5天内不使用抗组胺药(即地氯雷他定或奥洛他定)。
[0280]
受试者将按1:1随机分配为regn5713-5714-5715或匹配安慰剂。随机分配将基于以下进行分层:
[0281]
·
筛查时的血清特异性桦树花粉ige水平(《17.5kua/l与≥17.5kua/l)
[0282]
·
仅在北美:筛查时的血清特异性橡树花粉ige水平(《0.7kua/l与≥0.7kua/l)
[0283]
·
地理区域(北美与欧洲)
[0284]
功效程序
[0285]
用于评估功效的程序如下所述。
[0286]
总鼻部症状评分(tnss):tnss范围从0到12,基于对鼻塞、瘙痒、鼻漏和打喷嚏等4种鼻部症状的评估,根据李克特量表(likert scale)从0(无症状)到3(重度)分级。将使用电子日记来记录tnss。
[0287]
总眼部症状评分(toss):toss范围从0到6,基于2种症状:瘙痒/发红/砂砾感和流泪/流水。2种症状中的每种都被分级为0(无症状)、1(轻度)、2(中度)或3(重度)。将使用电子日记来记录toss。
[0288]
总症状评分(tss):tss通过将tnss和toss相加来计算,获得0至18的组合tss。
[0289]
每日药物评分:受试者将被要求使用电子日记来记录气每天的补救药物使用情况,包含何种药物以及这些预先指定的药物的量。此信息将用于按照如下计算dms:地氯雷他定5mg 6点/剂量;最大每日评分6点,奥洛他定1mg/ml,每滴1.5点/滴;最大每日评分6点,糠酸莫米他松(mometasone furoate)50μg/剂量2.0点/喷雾;最大每日评分8点。最大dms评分为20。
[0290]
组合症状和药物评分(csms):csms通过将dms和tss相加来计算,评分范围在0与38之间。
[0291]
哮喘控制调查问卷(acq):acq测量哮喘控制的充分性以及自发或治疗后哮喘控制的变化。acq-5由5个患者报告的项目构成,临床医生认为所述项目对评估控制最重要:(1)由于症状在夜间醒来,(2)早晨症状,(3)日常活动受限,(4)呼吸急促,以及(5)喘息。总评分范围为0至6,评分越高表示哮喘控制越差。评分为≥1.5被认为是不受控制的哮喘。acq-5将使用电子日记来记录。
[0292]
标准化鼻结膜炎生活质量调查问卷(rqlq(s)):rqlq(s)有7个领域的28个问题:活动限制、睡眠问题、鼻部症状、眼部症状、非鼻部/眼部症状、实际问题和情绪功能。活动领域中有3个特定于受试者的问题,允许受试者选择受其鼻结膜炎限制最大的3种活动。受试者回忆起前一周他们被其鼻结膜炎困扰的程度,并以7分量表(0[完全没有受损]至6[严重受损])回答每个问题。总体rqlq(s)评分是所有28个回答的平均值,而各个领域评分是这些领域中项目的平均值。将使用电子日记来记录rqlq(s)。
[0293]
花粉食物过敏症状调查问卷(pfasq):pfasq将在规定的时间点进行,以确定产生
过敏反应的食物类型、反应类型以及反应发生的时间。
[0294]
患者整体严重程度印象(pgi-s):pgi-s评估过去1周内季节性过敏症状的严重程度。症状严重程度范围为0(无症状)、1(轻度)、2(中度)和3(重度)症状。
[0295]
[0296]
[0297][0298]
本发明在范围上不受本文所描述的具体实施例的限制。实际上,除了本文中所描述的那些内容之外,本领域的技术人员根据前述说明和附图将显而易知本发明的各种修改。这样的改变意图落入所附权利要求的范围内。本文引用的所有专利和非专利文献的公开内容通过全文引用明确并入。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1