用于校准流通池中核酸文库接种效率的方法与流程
用于校准流通池中核酸文库接种效率的方法
1.相关申请的交叉引用
2.本专利申请要求2020年7月2日提交的美国临时申请序列号63/047,817的优先权,其公开内容以引用方式并入本文。
技术领域
3.本公开提供了用于校准流通池中多核苷酸接种效率的方法。
背景技术:
4.用于测序的流通池是含有小流体通道的载玻片,聚合酶、dntp和缓冲液可以通过流通池进行循环。通道内部的玻璃修饰有与靶标核酸上的接头序列互补的短寡核苷酸。将含有接头的靶标核酸进行稀释并与这些寡核苷酸杂交,以将单个的dna链暂时固定到流通池上(“多核苷酸接种”)。然后,使用例如利用引物延伸循环和这之后进行的化学变性的“桥式pcr”策略对文库链进行扩增。通过原位扩增方法将上述链扩增数千。将靶标核酸以低摩尔量(6pm至20pm)与流通池杂交。这会使dna模板链之间产生较大的物理分离。在扩增结束时,将小簇相同的dna保留为固定在2d表面上的分子,该分子可以全体经过测序。
技术实现要素:
5.流通池中的多核苷酸接种效率通常是对最终簇数进行计数来确定。本公开提供了一种用于确定流通池中多核苷酸接种效率的改进的新方法。
6.本公开提供了一种评估在流通池中的多核苷酸接种效率的方法,该方法包括:将多核苷酸接种到流通池中,时长为至少1分钟,以及(i)使该流通池与结合到或掺入到接种的多核苷酸上带标记的剂进行接触,并且确定该流通池中存在的标记量,从而确定该接种效率;或者(ii)收集上清液;通过使用步骤(a)或(b)定量该上清液中的该多核苷酸:(a)使用定量聚合酶链反应(qpcr)和/或微滴式的聚合酶链反应(pcr)扩增该上清液中的该多核苷酸;或者(b)使用第二流通池再次对该上清液进行接种,并且在该多核苷酸进行桥式扩增后对生成的簇进行计数;以及(c)通过对该上清液中定量的多核苷酸的数量与用于接种流通池的多核苷酸的数量进行比较,确定该流通池的接种效率。在一个实施方案中,该带标记的剂包括通过聚合酶掺入到接种的多核苷酸上的带标记的dntp。在另一实施方案中,该带标记的剂包括与接种的多核苷酸上的互补寡核苷酸结合的带标记的纳米颗粒或带标记的树枝状体。在另一实施方案中,该带标记的剂包括针对接种的多核苷酸带标记的接头或带标记的互补寡核苷酸。在另一实施方案中,该带标记的剂包括从接种的多核苷酸的末端生长出的带标记的结构。在另一或另外的实施方案中,该标记为可检测的发光或荧光标记。
7.在一个实施方案中,该方法通过观察未在表面上捕获而保留在本体接种溶液中的多核苷酸来确定接种效率。通过在接种过程结束时收集并分析来自流通池通道的上清液,可以确定有关该接种过程的更详细的信息。本文公开的方法尤其适用于检查图案化的流通池中的接种,其中,簇数不与接种的多核苷酸的数量直接相关,原因在于但不限于(1)多克
隆性、(2)之前的扩增复制物和(3)阱之间的空隙区域处的文库吸附。
8.在具体实施方案中,本公开提供了一种评估在流通池中的多核苷酸接种效率的方法,该方法包括:将多核苷酸接种到流通池中,时长为至少1分钟,以及收集上清液;通过使用步骤(a)或(b)定量该上清液中的该多核苷酸:其中,(a)包括:使用定量聚合酶链反应(qpcr)和/或微滴式的聚合酶链反应(pcr)扩增该上清液中的该多核苷酸;或者,(b)包括:使用第二流通池再次对该上清液进行接种,并且在该多核苷酸进行桥式扩增后对生成的簇进行计数;以及通过对该上清液中定量的多核苷酸的数量与用于接种流通池的多核苷酸的数量进行比较,确定该流通池的接种效率。在本文公开的任何实施方案的另一实施方案中,对流通池的一个通道的多核苷酸接种效率进行评估。在本文公开的任何实施方案的另一实施方案中,对流通池的一个以上通道的多核苷酸接种效率进行评估。在本文公开的任何实施方案的另一实施方案中,该流通池包括结合到该流通池的表面的多个引物。在本文公开的任何实施方案的另一实施方案中,该结合的引物包括具有seq id no:1序列的p5引物和/或具有seq id no:2序列的p7引物。在本文公开的任何实施方案的另一实施方案中,该多个引物随机结合到该流通池的表面。在本文公开的任何实施方案的另一实施方案中,该多个引物结合到该流通池的特定区域。在本文公开的任何实施方案的另一实施方案中,该多个引物结合到在该流通池表面上形成图案的阱阵列的表面。在本文公开的任何实施方案的另一实施方案中,该流通池用于下一代测序装置。在本文公开的任何实施方案的另一实施方案中,该多核苷酸包括接头。在本文公开的任何实施方案的另一实施方案中,该接头与桥式pcr相容。在本文公开的任何实施方案的另一实施方案中,该多核苷酸包括dna文库。在本文公开的任何实施方案的另一实施方案中,该dna文库是使用文库制备试剂盒生成的。在本文公开的任何实施方案的另一实施方案中,根据包括以下步骤的方法制备该dna文库:(a)使用转座体将引物同时片段化以及添加到隔离的dna中;(b)通过缩短循环的pcr扩增该片段化的dna,其中,该pcr扩增引物包含索引和接头序列;以及(c)洗涤并混合扩增的dna片段以形成dna文库。在本文公开的另一或另外的实施方案中,该转座体链接到磁珠上。在本文公开的另一或另外的实施方案中,该dna文库生成自与人类受检者隔离的基因组dna。在本文公开的另一或另外的实施方案中,将该多核苷酸接种到该流通池中,时长为5分钟至60分钟。在本文公开的另一或另外的实施方案中,将该多核苷酸接种到该流通池中,时长为10分钟至40分钟。在本文公开的另一或另外的实施方案中,该qpcr包括使用双链结合染料,该双链结合染料使双链扩增产物能够基于荧光水平进行定量。该双链结合染料的示例包括但不限于绿色i染料、bryt染料、picogreen染料、yoyo-1碘化物染料和金色染料。在本文公开的另一或另外的实施方案中,该qpcr包括用荧光报告子标记的序列特异的探针和与dna模板结合的淬灭剂分子。在本文公开的另一或另外的实施方案中,该淬灭剂分子为吸收多个波长上的光并且不发射光的深色淬灭剂。深色淬灭剂的示例包括但不限于dabsyl、black hole quenchers、iowa black fq、iowa black rq、irdye qc-1和qxl淬灭剂。在本文公开的另一或另外的实施方案中,用于对该上清液中的该多核苷酸进行定量的该第二流通池不同于该接种了多核苷酸的流通池。在本文公开的另一或另外的实施方案中,该第二流通池每次运行提供最高至12gb的序列数据,而该接种了多核苷酸的流通池每次运行提供最高至120gb的序列数据。在本文公开的另一或另外的实施方案中,使用接种了相同浓度的多核苷酸但具有不同接种时长的流通池多次执行该方法。在本文公开的另一或
另外的实施方案中,在各个时间点以定时的方式对具有多核苷酸的流通池的接种效率进行评估。
9.在某个实施方案中,本公开提供了一种本文公开的方法的用途,该用途用于建设具有提升的多核苷酸接种效率的流通池的表面。
10.本公开的一个或多个实施方案的细节在附图和下文描述中示出。根据说明书和附图以及权利要求书,其他特征、对象和优点将显而易见。
附图说明
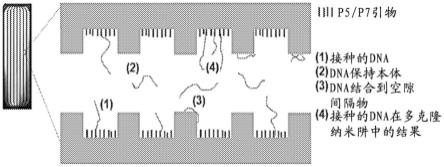
11.图1示出了图案化的流通池(fc)中的dna接种过程。由于dna分子具有多个目标,校准该接种过程的最有效方式是收集并分析上清液。
12.图2提供了实验性工作流程的实施方案,该实验性工作流程包括以下步骤:(1)将已知浓度的文库填充到流通池中,(2)接种该文库,以及(3)去除剩余的上清液以进行定量。
13.图3示出了两种用于定量文库接种效率的方法:(a)qpcr或微滴式pcr和(b)在miseq流通池上对上清液进行再次接种。
14.图4a至图4d示出了使用miseq流通池进行文库接种定量的结果。图4a至图4b示出了在接种5分钟之后未从图案化的流通池得到接种的剩余文库显著多于常规流通池的残留。图4c至图4d中的图案化流通池示出了在接种期间较长时间的温育可减少未接种的剩余文库片段。
15.图5示出了在图案化fc(蓝色数据集)和非图案化fc(绿色数据集)中利用上清液分析进行的实时接种过程。在接种后5分钟内,在fc泳道未图案化的情况下,将大多数dna文库进行接种,使极少量的dna留在上清液(绿色)中;而在图案化fc的情况下,约50%的dna文库未接种并在5分钟后留在上清液(蓝色)中。这一新手段有助于我们以定时的方式监测接种过程。
16.图6a至图6b示出了本公开的使用标记捕获或组装确定流通池接种的方法。图6a示出了一个过程,其中,流通池中实现高接种占用率之后进行簇集和测序。图6b示出了一个过程,由此确定流通池中具有低接种占用率,之后进一步重复接种直至实现期望的接种占用率。
17.图7示出了可在本公开的方法中使用的各种信号生成策略(例如参阅图6a至图6b)。
18.并入本说明书中并构成本说明书的一部分的附图示出了一个或多个本公开的实施方案,其与详细描述一起用于说明本公开的原理和实施方式。
具体实施方式
19.如本文和所附权利要求书中所用,单数形式“一个”、“一种”和“该”包括多个指代物,除非文中另外明确指出。因此,例如,提及“流通池”时,包括多个此类流通池,以及提及“dna文库”时,指一个或多个dna文库,等等。
20.另外,除非另有说明,否则使用“或”表示“和/或”。类似地,“包括”、“包含”、“具有”和“含有”是可互换的,并非旨在进行限制。
21.还应当理解,在各种实施方案的描述使用术语“包括”的情况下,本领域的技术人
员将理解,在一些特定实例中,实施方案可替代地使用语言“基本上由
……
组成”或“由
……
组成”来描述。
22.除非另有定义,否则本文所用的所有技术和科学术语都具有本公开文本所属技术领域普通技术人员通常理解的含义。虽然与本文所描述的方法和材料类似或等同的方法和材料也可用于本发明所公开的方法和组成的实践,但本文描述了示例性的方法、装置和材料。
23.本文中的术语“扩增”旨在表示通过生成模板的拷贝来增加模板多核苷酸序列的数量的过程。该扩增过程可以为指数的或线性的,但通常是指数的。在指数扩增中,由模板多核苷酸序列形成的拷贝数量以指数级增加。例如,在30轮的理想扩增反应中,模板dna的一个拷贝将产生2
30
个或1,073,741,824个拷贝。然而,如本文所描述的桥式扩增通常不在理想条件下发生,并且30个循环的“指数”反应可能只会产生几百个至几千个原始模板的拷贝,主要原因在于表面结合的引物的局部浓度有限以及与模板再杂交之间存在竞争。在线性扩增中,由模板多核苷酸序列形成的拷贝数量以线性速率增加。例如,在理想的4小时内以每分钟2,000个拷贝的拷贝速率进行的线性扩增反应中,模板dna的每个拷贝将产生480,000个拷贝。
24.术语“变性”是广义术语,其主要指dna碱基的物理分离,该dna碱基与例如单链多核苷酸序列的沃森-克里克dna双螺旋结构及其互补物进行相互作用。该术语也指上述两条链的物理分离。在其最广泛的意义上,该术语指形成一种情形的过程,在这一情形下,将另一个引物寡核苷酸或多核苷酸序列退火至双螺旋的一条或两条链变得可行。
25.如本文所用,术语“流通池”旨在表示具有一种或多种流体试剂可流过的表面的槽室。通常,流通池将具有至少一个流入进口和至少一个流出出口,以促进流体流动。可方便地用于本公开的方法中的流通池以及相关流体系统和检测平台的示例在以下文献中有所描述,例如:bentley等人,nature 456:53-59(2008);wo 04/018497;美国专利申请no.7,057,026;wo 91/06678;wo 07/123744;美国专利申请no.7,329,492;美国专利申请no.7,211,414;美国专利申请no.7,315,019;美国专利申请no.7,405,281和公开号为2008/0108082的美国专利,上述每一篇均以引用方式并入本文。
26.在一些实施方案中,流通池可容纳阵列。用于核酸测序的阵列通常具有核酸特征的随机空间模式。例如,得自illumina公司(san diego,calif.)的hiseq
tm
或miseq
tm
测序平台利用流通池,在该流通池上通过随机接种接着桥式扩增形成核酸阵列。然而,图案化阵列也可用于核酸测序或其他分析应用。示例性的图案化阵列、其制造方法及其使用方法在以下美国专利申请中有所阐述:公开号13/787,396;美国专利申请公开号13/783,043;美国专利申请公开号13/784,368;美国专利申请公开号2013/0116153a1;和美国专利申请公开号2012/0316086a1;这些文献中的每一篇文献均以引用方式并入本文。此类图案化阵列的特征可用于捕获单个核酸模板分子以进行接种,随后例如经由桥式扩增形成同质集落。此类图案化阵列尤其可用于核酸测序应用。
27.如本文所用的术语“等温”指系统或装置的温度保持恒定的过程,即,其中δt=0。可选地,这在系统/装置与外部热贮存器(例如,加热器、热浴、热电控制器(tec)等)接触时发生,并且以使得系统/装置可持续通过热交换将系统/装置调整到贮存器的温度的速率在系统/装置内实现动作或变化。
28.如本文所用,术语“多核苷酸”或“核酸”指脱氧核糖核酸(dna),然而,在适当的情况下,技术人员将认识到本文的系统和装置也可以应用于核糖核酸(rna)。应理解,该术语包括作为等同物的由核苷酸类似物形成的dna或rna的类似物。如本文所用,该术语还涵盖cdna,即由rna模板例如通过逆转录酶的作用产生的互补dna或拷贝dna。
[0029]“引物寡核苷酸”或“引物”为能够特别地退火至单链多核苷酸序列的寡核苷酸序列,从而该单链多核苷酸序列可在等温扩增反应的每个循环的引物退火步骤中遇到的条件下进行扩增。通常,扩增反应需要至少两个扩增引物,一般表示为“正向”和“反向”引物。在某些实施方案中,正向引物和反向引物可以彼此相同。引物寡核苷酸可以包括“模板特异部分”,其是在退火步骤期间能够退火至待扩增的单链多核苷酸分子(或在模板被视为单链的情况下其互补物)中的引物结合序列的核苷酸序列。引物结合序列通常将具有已知序列,并因此将与单链多核苷酸分子的已知序列-1和已知序列-2内的序列特别地互补。引物结合序列的长度不必与已知序列-1或已知序列-2的长度相同并可以更短,例如,16个至50个核苷酸、16个至40个核苷酸或20个至30个核苷酸的长度。引物寡核苷酸的最佳长度将取决于许多因素,并且通常而言,引物足够长(络合),从而使退火到除引物结合序列之外的序列的可能性非常低。在某些实施方案中,“引物寡核苷酸”以随机方式(非图案化的流通池)与流通池的表面进行结合或结合到流通池的特定区域,诸如,结合到阱的表面(图案化的流通池)。在另外的实施方案中,与流通池结合的该引物包括具有以下序列的p5引物和/或p7引物:
[0030]
p5:5'aatgatacggcgaccaccga 3'(seq id no:1)
[0031]
p7:5'caagcagaagacggcatacgagat 3'(seq id no:2)
[0032]
待扩增的多核苷酸分子通常是单链形式,作为ssdna或rna;或双链dna(dsdna)形式(例如,基因组dna片段、pcr和扩增产物,等)。因此,单链多核苷酸可以是多核苷酸双螺旋的有义链或反义链。使用标准技术制备适用于本公开的系统/装置中的单链多核苷酸分子的方法是本领域已知的。例如,可通过加热或用氢氧化物处理然后稀释来生成来自多核苷酸络合混合物的单链多核苷酸。初级多核苷酸分子的精确序列通常对本公开并不重要,并且可以是已知的或未知的。单链多核苷酸分子可以表示基因组dna分子(例如,人的基因组dna),该基因组dna分子包括内含子和外显子序列(编码序列),还有非编码调控序列,诸如,启动子和增强子序列。在具体实施方案中,待扩增的多核苷酸分子包括dna文库。在另外的实施方案中,使用文库制备试剂盒生成该dna文库。在又一个实施方案中,该文库制备试剂盒来自illumina公司(例如,ampliseq
tm
试剂盒、covidseq
tm
试剂盒、illumina dna制备试剂盒、illumina rna制备试剂盒、nextera
tm
试剂盒、surecell wta
tm
试剂盒、truseq
tm
试剂盒和trusight
tm
试剂盒)。
[0033]
如本文所用,“固相扩增”指在流通池的通道表面上进行的核酸扩增反应,使得全部或一部分扩增产物在形成时固定在该固体载体上。
[0034]
在本文所描述的系统/装置用于扩增核酸的过程中,固相扩增的引物通过与引物的5'端处或其附近的流通池的固体载体进行共价结合来固定,从而使引物的模板特异部分可自由退火至其同源模板,并且使3'羟基自由进行引物延伸。所选择的附接化学将取决于固体载体的性质,以及对其应用的任何官能化或衍生化。引物本身可包含可为非核苷酸化学修饰的部分,以促进附接。引物可包括5'端处的含硫亲核物质,诸如硫代磷酸或硫代磷酸盐。就固体承载的聚丙烯酰胺水凝胶而言,该亲核物质可与水凝胶中存在的溴乙酰胺基团
结合。例如,该引物可通过5'硫代磷酸盐附接到由聚合的丙烯酰胺和n-(5-溴乙酰氨基戊基)丙烯酰胺(brapa)组成的水凝胶而附接到固体载体上。
[0035]
简而言之,对于等温扩增,将双链“接头”序列连接到待扩增的dna片段(例如,随机片段化的基因组双链dna)的每个末端。然后,使dna接头分子流进流通池中,其中,这些分子随机附接到流通池通道的表面,以形成单分子阵列。在连接的接头序列含有用于表面附接的部分的情形下,dna接头序列可直接附接到表面。在这种情况下,附接通常使用过量的引物进行,该引物与已连接片段的每个末端处的接头序列中的一个接头序列的至少一部分互补。因此,该阵列将是适合于聚合酶延伸的引物的坪,其中,分散的单个分子的发散适合于扩增。如需要,可在用于扩增的单分子的分散阵列形成之后进行引物附接。该dna接头分子可以单链或双链形式进行附接,前提条件是该双链形式可经过处理以得到适于扩增的游离单链分子。
[0036]
在替代性实施方案中,在用于本公开的系统/装置的流通池的表面上制备引物的表面结合坪,之后将dna接头序列与表面固定的引物进行杂交,以形成杂交dna接头的单分子阵列。在引物的坪位于流通池表面上随机位置的情形下,该流通池为“非图案化的流通池”。在引物的坪组织成阱阵列或彼此分离的类似结构的情形下(其中,在这些空隙区域中,没有引物发生结合),该流通池为“图案化的流通池”。用聚合酶和dntp进行的以拷贝杂交链的循环延伸加之随后的原始dna接头序列的变性会产生所需的单链形式附接的单一dna分子阵列,然后可使其进行等温扩增循环。因此,该流通池的表面包括单链引物序列的坪,从而实现“桥式扩增”。在桥式扩增中,当该表面遇到适合杂交的条件时,该待扩增的单链核酸分子形成桥接,使接头序列在其自由端与结合到该流通池表面的互补单链引物序列进行杂交。然后,将核苷酸和dna聚合酶输送到该流通池中,以形成待扩增的核酸的互补链。然后,通过在变性试剂中流动使形成的双链序列变性,并且再次开始上述过程,从而在扩增循环期间在不改变系统温度的情况下形成扩增核酸簇。在典型实施方案中,绝大部分簇为单克隆,这是由单个原始核酸序列的扩增引起的。
[0037]
通常,用于形成dna簇的引物寡核苷酸为单链多核苷酸。其还可以含有天然和非天然碱基的混合物以及天然和非天然主链连杆,前提条件是任何非天然修饰不排除作为引物的功能(即,在扩增反应条件下退火至模板多核苷酸链并充当用于合成与该模板链互补的新多核苷酸链的起始点的能力)。该引物中的一个引物可含有使得引物能从表面去除(裂解)以使得形成单链簇的修饰。此类线性化簇可经历与另外的引物链杂交以实现测序反应。
[0038]
待扩增的多核苷酸以适当的比例固定,从而使当其附接于流通池的固体载体时,获得适当密度的附接的单链多核苷酸分子和引物寡核苷酸(“多核苷酸接种”)。在直接固定dna接头序列的情况下,用于固定化反应的溶液混合物中的引物寡核苷酸的比例高于单链多核苷酸分子的比例。然后,该固定化反应可产生具有dna接头序列的离散单分子的引物坪。对于杂交的dna接头反应,簇的密度通过用于与引物的坪杂交的dna接头序列的浓度来控制。引物寡核苷酸与单链多核苷酸分子的比率通常使得当固定到固体载体上时会形成引物寡核苷酸的“坪”,其包括多个引物寡核苷酸,这些引物寡核苷酸在整个流通池通道或其限定区域大致处于均匀密度,其中,一个或多个单链多核苷酸分子彼此间隔地分别固定在引物寡核苷酸的坪内。
[0039]
单个引物寡核苷酸与单链多核苷酸分子之间的距离(因此,以及该引物寡核苷酸
和单链多核苷酸分子的密度)可通过改变固定到流通池表面的引物寡核苷酸和单链多核苷酸分子的浓度予以控制。
[0040]
得到良好控制的多核苷酸接种过程可确保簇密度和测序质量的一致性。所有类型的测序流通池具有不同的通道几何尺寸、表面引物密度、图案化材料和结合方法,并且所有这些因素都会影响多核苷酸(例如,dna文库)接种到表面上的效率。理解和优化多核苷酸接种过程具有重要意义,尤其是当多核苷酸输入受限或需要长链读时。接种效率应尽可能接近100%。
[0041]
只要引物寡核苷酸和单链多核苷酸以适当的密度接种并固定在固体载体上,之后则可通过在共价结合的单链多核苷酸分子上进行等温扩增循环来产生延伸产物,从而使每个集落包括原始固定单链多核苷酸分子(及其互补序列)的多个拷贝。扩增的一个循环由杂交、延伸和变性步骤构成。在试剂组分(例如,缓冲液等)方面,这些步骤在传统核酸扩增工序如pcr中通常类似。适用于扩增核酸(例如杂交、延伸等)的试剂是本领域众所周知的。下文更详细地描述了示例性的试剂。
[0042]
因此,可以将中和/杂交缓冲液应用于单链多核苷酸分子和多个引物寡核苷酸,从而使结合到表面的单链多核苷酸分子的未结合的末端与结合到表面的引物寡核苷酸进行杂交,以形成络合物(其中,引物寡核苷酸与单链多核苷酸分子的区域或模板特异部分进行杂交并与其互补)。此过程形成了“桥式”结构。请同样参阅wo/0246456、美国序列号为no.60/783,618的专利申请、wo/9844151和wo/0018957,以对桥式扩增进行进一步讨论。
[0043]
适合的中和/杂交缓冲液是本领域中众所周知的(参阅纽约冷泉港实验室出版社出版的sambrook等人的《分子克隆实验指南》第3版、ausubel等人在《实验室指南》(current protocols)杂志上编辑的文章和以下描述扩增的说明部分)。适合的缓冲液可包括添加剂(诸如,甜菜碱或有机溶剂,以规格化不同模板序列的解链温度)和洗涤剂。示例性的杂交缓冲液包括2m的甜菜碱、20mm的tris、10mm的硫酸铵、2mm的硫酸镁、0.1%的triton、1.3%的dmso、8.8的ph值。
[0044]
接下来,通过将包括具有聚合酶活性的酶和dntp的延伸溶液施加到桥接络合物来完成延伸反应。通过按顺序添加核苷酸延伸络合物的引物寡核苷酸,以生成与单链多核苷酸分子互补的延伸产物。适合的延伸缓冲液/溶液是本领域中众所周知的(例如,参阅纽约冷泉港实验室出版社出版的sambrook等人的《分子克隆实验指南》第3版、ausubel等人在《实验室指南》(current protocols)杂志上编辑的文章和以下示例)。
[0045]
可在本公开的系统/装置中使用的具有聚合酶活性的酶的示例包括dna聚合酶(klenow片段、t4 dna聚合酶)和来自各种热稳定细菌的热稳定dna聚合酶(诸如,taq、vent、pfu、bst和tfl dna聚合酶)及其经基因修饰的衍生物(taqgold、vent exo、pfu exo等)。应当理解,由于在流通池中进行的扩增反应是等温的,因此相比于用于热循环扩增的聚合酶,可使用另外的和/或替代性的dna聚合酶,并且在大多数实施方案中,并非特别要求聚合酶一定要热稳定。另外,虽然具有链置换活性的酶(例如,bst聚合酶)在促进用于测序的有效簇的生长中表现出极佳性能,但任何dna聚合酶均可使用。
[0046]
用于形成dna簇的核苷三磷酸腺苷分子通常为脱氧核糖核苷酸三磷酸腺苷,例如,datp、dttp、dctp和dgtp。该核苷三磷酸腺苷分子可以为天然存在的或非天然存在的。
[0047]
在杂交和延伸步骤之后,将载体和附接的核酸在变性条件进行处理。适合的变性
缓冲液是本领域中众所周知的(例如,参阅纽约冷泉港实验室出版社出版的sambrook等人的《分子克隆实验指南》第3版、ausubel等人在《实验室指南》(current protocols)杂志上编辑的文章)。本公开的系统/装置产生等温核酸扩增;因此,本文中的核酸链并不通过升高温度或操纵温度进行变性,而是通过其它方法(例如、化学的或物理的方法等)进行变性。举例来说,已知改变ph值和低离子强度溶液可在基本上等温的温度条件下将核酸变形。甲酰胺和脲形成新的氢键,其中,核酸的碱基破坏引起沃森-克里克碱基配对的氢键。上述会产生单链核酸分子。或者,可通过使用低盐和高ph值(》12)的溶液或使用离液盐(例如,盐酸胍)进行处理来分离链。在一个具体实施方案中,以约0.25m到约0.1m的浓度使用氢氧化钠(naoh)溶液。在另选实施方案中,使用95%甲酰胺的水溶液或100%的甲酰胺。此类甲酰胺的实施方案示出了另外的优点,因为使用氢氧化物处理会损坏表面并在一些情况下产生较低强度的簇。与所使用的其它试剂一样,此类变性试剂会通过流动通道。
[0048]
变性之后将存在两种固定的核酸,一种是初始固定的单链多核苷酸分子,而另一种是其互补物,其从一个固定的引物寡核苷酸延伸而来。然后,形成的原始固定的单链多核苷酸分子和固定的延伸引物寡核苷酸(互补物)均可通过使载体经过进一步的杂交、延伸和变性的循环过程来引发又一轮扩增。此类又一轮扩增将产生核酸集落或“簇”,其包括单链多核苷酸序列的多个固定拷贝及其互补序列。单链多核苷酸分子的初始固定意味着单链多核苷酸分子只能与位于单链多核苷酸分子总长度的距离内的引物寡核苷酸进行杂交。因此,形成的核酸集落或簇的边界受限于相对局部的区域,其中初始单链多核苷酸分子是固定的。术语“簇”和“集落”在本文中可互换使用并指由多个相同的固定核酸链和多个相同的固定互补核酸链组成的固体载体上的离散位点。术语“集簇列”或“簇阵列”指由此类簇或集落形成的阵列。在该上下文中,术语“阵列”不应被理解为要求簇的有序布置。
[0049]
在典型实施方案中,待扩增的核酸固定在流通池内的通道的表面上。除非另有说明或通过上下文明确指示,否则如本文所用的术语“固定”旨在涵盖直接或间接的、共价或非共价结合。在本公开的某些实施方案中,共价结合可以作为典型,但一般来讲,一切要求在于分子(例如,核酸)在旨在使用载体的条件下(例如,在扩增应用中)保持固定或附接到载体。用于扩增的固定核酸分子可通过将经适当修饰的(单链或双链的)核酸分子直接附接到适当活性的表面或通过与表面固定引物进行杂交来获得,然后,使用聚合酶和dntp进行延伸循环以拷贝该杂交链。然后,延伸的链或化学附接的双螺旋可经过变性条件以产生期望的固定的单链核酸分子,然后可通过本文所描述的仪器使该分子进行等温扩增循环。将溶液中的dna杂交到流通池上的初始步骤可在比后续扩增反应中更高的温度下进行,然后,在基本上等温的温度条件下进行。该杂交步骤也可在扩增温度下进行,前提条件是输入的核酸链以单链形式供应到表面。
[0050]
制备模板核酸的一些实施方案可包括使靶标核酸片段化。在一些实施方案中,将已带条形码或已编索引的接头附接到片段化的靶标核酸(例如,dna文库)。可使用本领域已知的任何数量的方法(诸如,(酶或化学)连接、标签化、聚合酶延伸等)附接接头。在一些实施方案中,包括非连续转座子序列的转座体的插入可使得靶标核酸片段化。在包括环状转座体的一些实施方案中,包括转座子序列的靶标核酸可在转座子序列的片段化位点处进行片段化。可与本文提供的实施方案一起使用将靶标核酸片段化的方法的另外的示例可在,例如,公开号为2012/0208705的美国专利申请、公开号为2012/0208724的美国专利申请和
公开号为wo 2012/061832的国际专利申请中找到,上述专利申请中的每一篇通过引用的方式全文并入本文。
[0051]
各种流通池装置可用于执行本公开的方法,包括由illumina公司制造的流通池装置(例如,hiseq装置、novaseq装置、miseq装置和nextseq装置);由f.hoffmann-la roche有限公司制造的流通池装置(例如,gs flx装置和gs junior装置);和由life sciences制造的流通池装置(例如,solid/ion torrent装置)。在具体实施方案中,用于执行本公开的方法的流通池装置为由illumina公司制造的流通池装置。
[0052]
流通池通常包括一个或多个流体通道。在另外的实施方案中,可以使用本文公开的方法评估流通池的一个、两个、三个、四个、五个、六个、七个、八个或更多个流体通道的多核苷酸接种效率。如本文已经指出的,引物可以结合或固定到流通池的表面。通常,结合到流通池的引物为含有具有已知序列的引物的单链dna。为了进行桥式pcr扩增,使用具有不同但已知序列的多个(例如,两个、三个或四个)引物群是有益的。例如,illumina流通池包括p5(seq id no:1)和p7(seq id no:2)引物,其结合到流通池的表面,以使靶标多核苷酸进行桥式扩增。这些靶标多核苷酸通过在具有与p5引物和p7引物互补的序列的多核苷酸的末端处包括接头序列而进行桥式扩增。可使用具有含有所述序列的引物的更少拷贝pcr将此类接头添加到多核苷酸的末端。这些引物可进一步包括条形码或索引序列。可通过使用标准化学物质(包括硅烷化学物质)或通过附接到沉积于流通池表面上的聚合物将这些引物附接到流通池的表面(例如,参阅公开号为us20120316086a1的美国专利申请和公开号为wo2017201198a1的pct专利)。这些引物可以随机方式或作为有组织的阵列(即,图案化的流通池)附接或固定于流通池的表面上。例如,流通池表面可包括含有固定结合引物的微阱或纳米阱的有序阵列。用于接种本文所描述的流通池的多核苷酸可来自任何来源,包括来自不同种系发生界的各种生物体。例如,多核苷酸可以为已经从人类受检者身上隔离的片段化基因组dna。在具体实施方案中,多核苷酸呈dna文库的形式。基于源基因组dna制备dna文库的方法在本领域中是已知的,并且许多文库制备试剂盒是可商购获得的。在具体实施方案中,该文库制备试剂盒来自illumina公司(例如,ampliseq
tm
试剂盒、covidseq
tm
试剂盒、illumina dna制备试剂盒、illumina rna制备试剂盒、nextera
tm
试剂盒、surecell wta
tm
试剂盒、truseq
tm
试剂盒和trusight
tm
试剂盒)。关于该文库制备试剂盒可包括以下步骤:(a)使用转座体将引物同时片段化以及添加到隔离的dna中;(b)使用缩短循环的pcr扩增该片段化的dna,其中,该pcr扩增引物包含索引和接头序列;以及(c)洗涤并混合扩增的dna片段以形成dna文库。该转座体可结合到固体基质(如磁珠)。可以将多核苷酸接种到流通池中,其限定时长包括10秒、20秒、30秒、40秒、50秒、1分钟、2分钟、3分钟、4分钟、5分钟、6分钟、7分钟、8分钟、9分钟、10分钟、11分钟、12分钟、13分钟、14分钟、15分钟、16分钟、17分钟、18分钟、19分钟、20分钟、21分钟、22分钟、23分钟、24分钟、25分钟、26分钟、27分钟、28分钟、29分钟、30分钟、31分钟、32分钟、33分钟、34分钟、35分钟、36分钟、37分钟、38分钟、39分钟、40分钟、41分钟、42分钟、43分钟、44分钟、45分钟、46分钟、47分钟、48分钟、49分钟、50分钟、51分钟、52分钟、53分钟、54分钟、55分钟、56分钟、57分钟、58分钟、59分钟、60分钟、90分钟、120分钟,或包括上述或处于上述任意两个时间点(例如,5分钟至60分钟、10分钟至40分钟等)之间的范围,包括其分数增量。
[0053]
通常,研究多核苷酸接种效率(例如,dna文库接种效率)通过计量最终簇数来查看
捕获了多少多核苷酸来进行。本公开提供了确定接种效率的方法。
[0054]
本公开在一个实施方案中提供了确定多核苷酸接种效率的方法,该方法通过查看未捕获于表面上而保留在本体接种溶液中的多核苷酸来确定接种效率。通过在接种过程结束时收集并分析来自流通池通道的上清液,可以确定有关该接种过程的更详细的信息。本文公开的方法可用于检查图案化的流通池中的接种,其中,簇数不与接种的多核苷酸的数量直接相关,原因在于,例如,(1)多克隆性、(2)之前的扩增复制物和(3)阱之间的空隙区域处的文库吸附(参阅图1)。
[0055]
在具体实施方案中,本公开提供了一种评估在流通池中的多核苷酸接种效率的方法,该方法包括:将多核苷酸接种到流通池中,时长为至少1分钟,以及收集上清液;通过使用步骤(a)或(b)定量该上清液中的该多核苷酸:(a)使用定量聚合酶链反应(qpcr)和/或微滴式的聚合酶链反应(pcr)扩增该上清液中的该多核苷酸;或者(b)使用第二流通池再次对该上清液进行接种,并且在该多核苷酸进行桥式扩增后对生成的簇进行计数;以及通过对该上清液中定量的多核苷酸的数量与用于接种流通池的多核苷酸的数量进行比较,确定该流通池的接种效率。
[0056]
在接种过程后回收上清液,以及使用本文公开的方法(包括使用qpcr或微滴式pcr,或通过接种另一流通池)定量多核苷酸。也称为定量聚合酶链反应(qpcr)的实时聚合酶链反应(实时pcr)为基于聚合酶链反应(pcr)的分子生物学的实验室技术。其可用于在pcr期间(即,实时)而不如传统pcr一般只在结束时监测dna靶向分子的扩增。实时pcr可定量使用(定量实时pcr)和半定量(即,高于/低于一定量的dna分子)使用(半定量实时pcr)。用于在实时pcr中检测pcr产物的两种常见方法是(1)嵌入有任何双链dna的非特异性荧光染料和(2)由带有荧光报告子标记的寡核苷酸组成的序列特异dna探针,这使得检测可以仅在探针与其互补序列杂交之后进行。本文所描述的qpcr反应可利用用于此类pcr反应的任何可商购获得的热稳定的聚合酶,以及可使用双链结合染料进行定量或使用探针/淬灭剂系统。该双链结合染料的示例包括但不限于绿色i染料、bryt染料、picogreen染料、yoyo-1碘化物染料和金色染料。在具体实施方案中,本文公开的qpcr反应使用带有荧光报告子标记的序列特异的探针和与dna模板结合的淬灭剂分子。通常,该淬灭剂分子为吸收多个波长上的光并且不发射光的深色淬灭剂。该深色淬灭剂的示例包括但不限于dabsyl、black hole quenchers、iowa black fq、iowa black rq、irdye qc-1和qxl淬灭剂。
[0057]
在另选实施方案中,本公开提供了通过对用上清液接种另一流通池产生的簇进行计数来定量该上清液中的多核苷酸。例如,从接种hiseq流通池或nextseq流通池获得的上清液(最高至120gb序列数据)可与miseq流通池(最高至12gb序列数据)一起使用以进行定量。还可设想利用此类过程的其它与市售流通池的排列/组合。
[0058]
本公开还提供了一种通过文库介导荧光团捕获或组装(lmfca)定量流通池接种的方法。在本公开的lmfca方法中,使用可检测标记在流通池中进行接种效率的测量。例如,本公开提供了一种评估在流通池中的多核苷酸接种效率的方法,该方法包括:将多核苷酸接种到流通池中,时长为至少1分钟;用可检测物标记流通池中结合的/接种的多核苷酸;以及定量该流通池中的带标记的多核苷酸,以及取决于接种效率,去除该标记并再次接种该流通池(参阅,例如,图6b)或去除该标记并接着关注簇和/或序列(参阅,例如,图6a)。
[0059]
在流通池上标记核苷酸的方法包括但不限于:(i)使用带标记的核苷酸和聚合酶;(ii)使用dna树枝状体或带有荧光团标记的经标记的纳米颗粒和用于与接种的多核苷酸进行杂交的互补寡核苷酸;(iii)从该接种的多核苷酸生长的带标记的结构;以及(iv)结合到接种的多核苷酸的带标记的接头(参阅图7)。
[0060]
适合的标记包括荧光标记、发光标记、放射性标记、显色标记等。通常,该标记为荧光的或发光的,从而实现使用ccd相机等对其进行检测和定量。
[0061]
在一个实施方案中,流通池用包括多核苷酸的组合物并以适于使多核苷酸“接种”到流通池的期望时间进行接种,该多核苷酸根据条件包括至少一个接头区域。可以将多核苷酸接种到流通池中,其限定时长包括10秒、20秒、30秒、40秒、50秒、1分钟、2分钟、3分钟、4分钟、5分钟、6分钟、7分钟、8分钟、9分钟、10分钟、11分钟、12分钟、13分钟、14分钟、15分钟、16分钟、17分钟、18分钟、19分钟、20分钟、21分钟、22分钟、23分钟、24分钟、25分钟、26分钟、27分钟、28分钟、29分钟、30分钟、31分钟、32分钟、33分钟、34分钟、35分钟、36分钟、37分钟、38分钟、39分钟、40分钟、41分钟、42分钟、43分钟、44分钟、45分钟、46分钟、47分钟、48分钟、49分钟、50分钟、51分钟、52分钟、53分钟、54分钟、55分钟、56分钟、57分钟、58分钟、59分钟、60分钟、90分钟、120分钟,或包括上述或处于上述任意两个时间点(例如,5分钟至60分钟、10分钟至40分钟等)之间的范围,包括其分数增量。如图6所示,一旦流通池经过初始接种,流通池便与标记已经接种和保留在流通池上的多核苷酸的组合物进行接触。通常,流通池会经过洗涤,以在与标记接种到流通池上的多核苷酸的组合物进行接触之前去除任何未结合的多核苷酸。图7描绘了标记结合到流通池上的多核苷酸的各种技术。然后,对流通池进行成像处理或选择流通池的区域进行成像处理,以确定标记的量或存在的“信号”(例如,荧光)的量,从而确定接种效率。该“信号”通常与包括特定接种效率的已知信号进行比较,以确定实验测量的接种效率。如图6a所示,在基于所测量的信号存在足够接种的情形下,这可指示流通池或流通池的某处具有特定的占用率。在流通池的占用率处于期望的量的情形下,则接着处理流通池,以诱导簇集和/或序列分析。如图6b所示,在基于所测量的信号存在接种效率太低或不足的情形下,则从初始接种收集获得的未结合的多核苷酸可用于“再次接种”流通池,以及再次执行信号测量,以确定接种效率。可重复此过程,直到在流通池上存在期望的接种,以便执行簇集和/或测序。
[0062]
如图7所示,可在存在带标记的核苷酸时延伸接种的多核苷酸的互补链的条件下使用足以使聚合酶结合的接头掺入带标记的(例如,经过荧光标记的)并用于标记接种的多核苷酸的核苷酸。直到定量流通池中的信号量之后,该带标记的互补链不会经过去杂交。一旦该信号完成定量,便可以通过加热和/或加盐去除带标记的互补核酸。
[0063]
在图7的另一实施方案中,可使用包括,例如,与接种的多核苷酸上的接头序列互补的序列的带标记结构来标记流通池中的接种的多核苷酸。与链接到带标记结构的接头序列互补的该序列将与接种的多核苷酸上的接头序列进行杂交,并且因此“链接”该带标记结构到接种的多核苷酸。该带标记结构可以为包括荧光部分的纳米颗粒,或包括一个或多个荧光部分的树枝状体。直到定量流通池中的信号量之后,该带标记结构不会去除。一旦该信号完成定量,便可通过,例如,裂解接头序列和/或将与该接头序列杂交的寡核苷酸去杂交/去变性,以去除该带标记结构。
[0064]
在图7的另一实施方案中描绘了标记接种的多核苷酸的方法,其包括:从接种的寡
核苷酸的末端生长带标记结构。在此实施方案中,寡核苷酸或接种的多核苷酸上的接头序列的同源物结合到接种的多核苷酸,并且寡核苷酸结构从接头生长,其中,该结构带有可检测标记。直到定量流通池中的信号量之后,该生长的结构不会去除。一旦该信号完成定量,便可通过,例如,裂解接头序列和/或将与该接头序列杂交的寡核苷酸去杂交,以去除该结构。
[0065]
在图7的另一实施方案中,可将带标记接头附接到接种的多核苷,然后进行定量,以确定标记的量以及因此确定流通池中接种的多核苷酸的量。该带标记接头可在首次链延伸后裂解或去除。该带标记接头将包括与多核苷酸上的同源接头核苷酸序列互补的序列,或者将包括多核苷酸上的结合伴侣(例如,生物素/链霉亲和素等)的同源物。该接头将包括可检测标记,诸如荧光标记。
[0066]
为了用于本文所描述的流通池应用,还提供了试剂盒和制品。此类试剂盒可包括分隔开来以接纳一个或多个容器的载体、包装或容器,例如,小瓶、管等,每个容器包括将用于本文所描述的方法中的独立元件中的一个元件。适合的容器包括,例如,瓶、小瓶、注射器和试管。该容器可由多种材料形成,诸如,玻璃或塑料。
[0067]
例如,该容器可包含本文所描述的一种或多种qpcr和/或miseq试剂。可选地,该容器具有无菌入口(例如,该容器可以为溶液袋或具有可被皮下注射针刺穿的塞子的小瓶)。可选地,此类试剂盒包括具有辨别描述或标记或关于其在本文所描述方法中使用说明的试剂。
[0068]
试剂盒通常将包括一个或多个附加容器,每个容器带有各种材料(诸如可选地呈浓缩形式的附加试剂和/或装置)中一种或多种从商业和用户的观点出发期望用于本文所描述方法中的材料。此类材料的非限制性示例包括但不限于以标记列出了内容物和/或使用说明的缓冲液、稀释剂、过滤器、针状物、注射器、载体、包装、容器、小瓶和/或管,和注有使用说明的包装说明书。也通常将包括一套说明书。
[0069]
说明标记可在容器上或与容器相关联。在形成标记的字母、数字或其它字符附接、模制或蚀刻到容器本身的情形下,标记可在容器上,而在其存在于同样支撑容器的容座或载体如包装说明书内时,标记可与容器相关联。标记可用于指示内容物将用于特定流通池应用。例如,在本文所描述的方法中,该标记还可指示使用内容物的方向。
[0070]
实施例
[0071]
关于流通池装置中定量文库接种的概述。流通池加载有已知dna文库浓度(参阅图2)。在文库接种后,将上清液从流通池泳道中去除并定量未接种的文库片段。提出了两种利用收集的上清液定量未接种文库片段的方法(参阅图3)。一种方法为使用qpcr或微滴式pcr来确定上清液中未接种的文库浓度,另一种方法为使用illumina公司的miseq流通池来确定测序簇数结果。
[0072]
使用miseq定量上清液中的文库接种。从以不同接种时长进行接种的图案化的hiseq fc或常规hiseq fc收集的上清液的接种结果在图4中的miseq簇图像中示出。在5分钟的接种时长内,从图案化的hiseq通道收集的上清液中存在更多的dna,这意味着与常规的非图案化的流通池相比,图案化的hiseq流通池中的接种效率较低(参阅图4a至图4b)。在文库接种时长延长到60分钟的情形下,在上清液中会留下更少的dna,但仍存在一组不能被捕获到表面上以进行簇集的dna片段(参阅图4c)。因此,可确定接种过程包括在时间基础上
的有效性。此外,还可比较图案化和非图案化的流通池上的接种效率,但使用目前方法无法做到。
[0073]
使用qpcr定量上清液中的文库接种。同样使用了qpcr对定量流通池的接种效率进行测试。使用相同浓度的dna文库接种图案化的流通池泳道和非图案化的流通池泳道。之后,在特定的时间点收集来自不同泳道的上清液进行分析。qpcr分析表明,可以定时的方式监测接种/未接种到特定的流通池表面。此外,dna文库被捕获到图案化的流通池的p5/p7表面所花的时间长于其被捕获到非图案化流通池的表面所花的时间(参阅图5)。使用前述技术,可评估表面的引力动态,以便建设可更高效地将多核苷酸接种于图案化流通池上的表面。
[0074]
本公开已描述了多个实施方案。然而,应当理解,在不脱离本公开的实质和范围的前提下,可进行各种修改。因此,其他实施方案也在以下权利要求书的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1