一种利用CRISPR/Cas9系统敲除小鼠Abhd12基因的方法和应用与流程
一种利用crispr/cas9系统敲除小鼠abhd12基因的方法和应用
技术领域
1.本发明涉及转基因技术领域,更具体地涉及一种利用crispr/cas9系统敲除小鼠abhd12基因的方法和应用。
背景技术:
2.abhd12基因编码一种酶,可催化2-花生四烯酰甘油(2-ag)的水解,这是作用于大麻素受体cb1和cb2的主要内源性大麻素脂质递质。内源性大麻素系统参与广泛的生理过程,包括神经传递、情绪、食欲、疼痛感、成瘾行为和炎症。该基因的突变与神经退行性疾病pharc(多发性神经病、听力损失、共济失调、色素性视网膜炎和白内障)有关,这是由内源性大麻素代谢的先天性错误引起的。与abhd12相关的疾病包括多发性神经病、听力损失、共济失调、色素性视网膜炎以及白内障和锥体营养不良。
3.在人和小鼠中,abdh12蛋白在氨基酸组成上有很高的同源性,达到93%。在氨基酸数量上是一致的,均有398个氨基酸。
4.通常建立基因敲除动物模型,是通过基于同源重组的敲除载体来实现的。这种打靶载体构建繁琐,周期长,费用高,而且效率极低。而且抗性筛选基因通常残留在基因组上,对小鼠表型可能产生影响,即使删除后也会留下ioxp或者frt 的重组酶位点序列片段。
5.基于crispr(clustered regularly interspaced short palindromic repeats)/cas9 系统介导的基因组编辑技术,是继锌指核酸酶(zinc-finger nucleases,zfns)和类转录激活因子效应物核酸酶(transcription activa-tor-1ike effector nuclease, talen)后的第三代基因组编辑技术,是基于细菌的获得性免疫系统改造而成。 crispr/cas9是基于细菌或古细菌规律成簇的间隔短回文重复 crispr(clustered regularly interspaced short palindromic repeats)介导的获得性免疫系统衍生而来的基因编辑技术。该技术通过rna碱基互补配对识别dna,指导cas9核酸酶切割识别的双链dna,诱发同源重组(hdr,homologousdirected repair)或非同源末端链接(nhej,non-homologous end-joining),进而实现目的dna编辑。该技术的基本要求之一就是设计识别受体细胞内基因组序列的sgrna(sgrna,single guiding rna)位点,该分子负责识别特异性的基因编辑位点。然后介导结合cas9蛋白行使dna酶切活性,在设计的位点引入dna双链断裂损伤,通过胞内的nhej或hdr修复途径引入突变。因此,sgrna是该技术的重要组成部分。过人工设计crrna和tracrrna这两种rna,可以改造形成具有引导作用的sgrna(single guide rna),从而引导cas9对dna的定点切割。使用crispr/cas9编辑基因成败的关键就在于sgrna。目前还未有高效的利用crispr/cas9系统敲除小鼠abhd12基因的方法,急需加大研究力度,设计高效的crrna,填补这方面的空白。
技术实现要素:
6.本发明为解决现有技术问题提供了一种利用crispr/cas9系统敲除小鼠 abhd12
基因的方法和应用。
7.本发明为实现上述目的,采用如下技术方案来实现:
8.一种利用crispr/cas9系统敲除小鼠abhd12基因的方法,其特征在于,包括以下步骤:
9.1)合成针对abhd12基因的crrna,其中crrna1序列如seq id n0.1所示;crrna2序列如seq id n0.2所示。
10.其中,seq id n0.1:
11.‘
5-ggcacagaggttcacgtttcguuuuagagcuaugcuguuuug-3’;
12.seq id no.2:
13.‘
5-gtagcacttgtcatctaccaguuuuagagcuaugcuguuuug-3’。
14.进一步的,上述一种利用crispr/cas9系统敲除小鼠abhd12基因的方法,还包括以下步骤:
15.2)pmsg处理c57bl/6雌性小鼠,再注射hcg,与雄性小鼠合笼交配,次日取受精卵进行显微注射,将步骤1)所述的crrna,tracrrna与cas9蛋白共注射到受精卵中,取注射后存活的受精卵移植到假孕母鼠体内,产出小鼠,即为 f0小鼠。
16.进一步的,上述一种利用crispr/cas9系统敲除小鼠abhd12基因的方法,还包括以下步骤:
17.3)提取f0代小鼠尾部dna,pcr扩增并将产物送测序,鉴定是否为嵌合体。
18.进一步的,上述一种利用crispr/cas9系统敲除小鼠abhd12基因的方法,还包括以下步骤:
19.4)待雄性founder小鼠到6-10周龄,雌性小鼠到4-8周龄,分别与野生型异性小鼠交配获得f1代杂合子小鼠,小鼠出生10-20天后pcr鉴定,若有阳性小鼠出生,则表示转基因已经整合到生殖细胞。
20.进一步的,上述一种利用crispr/cas9系统敲除小鼠abhd12基因的方法,还包括以下步骤:
21.4)待雄性founder小鼠到8周龄,雌性小鼠到6周龄,分别与野生型异性小鼠交配获得f1代杂合子小鼠,小鼠出生14天后pcr鉴定,若有阳性小鼠出生,则表示转基因已经整合到生殖细胞。
22.进一步的,上述利用crispr/cas9系统敲除小鼠abhd12基因的方法获得的abhd12基因敲除小鼠动物模型.
23.进一步的,上述利用crispr/cas9系统敲除小鼠abhd12基因的方法获得的abhd12基因敲除小鼠动物模型在制备预防或者治疗下述疾病的药物或者保健品中的应用,所述疾病包括多发性神经病、听力损失、共济失调、色素性视网膜炎以及白内障和锥体营养不良中的一种或者多种。
24.进一步的,上述利用crispr/cas9系统敲除小鼠abhd12基因的方法在制备预防或者治疗下述疾病的药物或者保健品中的应用,其特征在于,所述疾病包括多发性神经病、听力损失、共济失调、色素性视网膜炎以及白内障和锥体营养不良中的一种或者多种。
25.本发明具有以下有益效果:
26.1、本技术方案发明人通过对小鼠abhd12基因进行分析,进行同源比对,选择同源
性最低的基因序列做为靶序列,并设计了guide rna序列,与cas9蛋白一起对对小鼠abhd12基因进行了敲除,有效的提高了靶序列的特异性,使利用该靶序列获得的小鼠模型特异性敲除了abdh12基因,减少脱靶的可能性。虽然本发明对abhd12基因基因进行同源对比选择同源性低的靶序列,然而并不是每一个选择的靶序列都能不脱靶,还需要进行脱靶验证。
27.2、本技术方案选用的crispr/cas9系统,crispr-cas9里面需要两个组件,一个是crrna+tracrrna,另外一个是内切酶也就是cas9。sgrna包括 crrna和tracrrna。当sgrna和cas9在细胞内作用时,基因组的靶标会被修饰。使用cas9核酸内切酶只需要提供一个包含特异的20bp的guide rna来决定靶向特异性。sgrna是由crrna(crisprrna)与tracrrna(trans_activatingcrispr rna)嵌合构成的一个约100个核苷酸大小的rna复合物,能够与靶向的dna形成rna-dna复合物,这段靶向dna序列叫做前间隔序列。crrna 与trancrrna-起构成的sgrna与cas9相互作用形成核糖核蛋白。sgrna的5' 端的约20bp(对应的是crrna)通过rna-dna互补配对指引cas9与靶序列结合进而对靶位点进行切割,造成dna双链断裂(double strand break,dsb)。在细胞中,核酸酶造成的dsb在没有修复模板的情况下,以非同源末端连接 (nonhomologous end_joining,nhej)的方式进行修复。nhej能够引起随机长度的碱基插入或缺失,可以破坏编码基因的翻译阅读框架,因此,本发明能更简单、高效的对基因进行修饰,实现了仅合成一对sgrna就能对小鼠abhd12进行基因编辑的效果,同时方法简单、高效。
附图说明
28.附图1显示本发明的基因敲除策略,选择abdh12基因的外显子3-7作为敲除区域,guide rna设计在外显子3-7外的内含子中;
29.附图2为f0小鼠pcr鉴定结果,10,13,14和17号小鼠鉴定为阳性f0小鼠;
30.附图3为阳性小鼠测序分析,可见基因组间删除了9942bp;
31.附图4为f1小鼠鉴定情况,26,27,28,35,36和37号小鼠鉴定为阳性f1;
32.附图5为pcr引物在基因组上相对位置。
具体实施方式
33.下面结合实例对本发明的方法做进一步说明,实施例中未注明具体条件的实验方法,通常可按常规条件,如j.萨姆布鲁克(sambrook)等编写的《分子克隆实验指南》中所述的条件,或按照制造厂商所建议的条件进行。本领域相关的技术人员可以借助实施例更好地理解和掌握本发明。但是,实现本发明的方法不应限于本发明实施例所记载的具体方法步骤。
34.实施例1
35.靶向敲除基因sgrna的合成:敲除策略见附图1。
36.从ncbi数据库中下载小鼠abhd12基因的核苷酸序列,并进行同源比对。根据guide rna的pam设计原则及同源比对的结果,合成了crrna1和crrna2,序列分别为:
37.1、合成crrna1序列
38.seq id n0.1=5
’‑
ggcacagaggttcacgtttcguuuuagagcuaugcuguuuug-3';
39.2、合成crrna2序列
40.seq id n0.2=5
’‑
gtagcacttgtcatctaccaguuuuagagcuaugcuguuuug-3'。
41.实施例2
42.pmsg处理c57bl/6雌性小鼠,再注射hcg,与雄性小鼠合笼交配,次日取受精卵进行显微注射,将步骤(1)所述的crrna,tracrrna与cas9蛋白【neb公司产品(货号m0646)】:共注射到受精卵中,取注射后存活的受精卵移植到假孕母鼠体内,胚胎移植的小鼠将会在手术后21天左右出生,即为f0代小鼠,待小鼠出生14天后剪尾提取dna并进行pcr鉴定。dna抽提及pcr检测时间为2-3 天。因此这个周期所需时间约为40天。f0小鼠pcr鉴定结果见附图2。
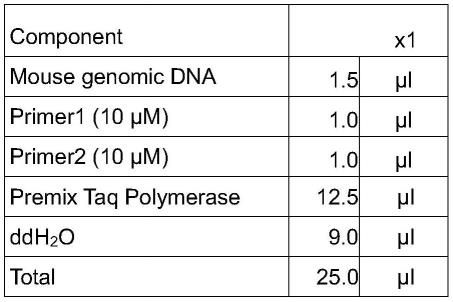
43.实施例3
44.待雄性founder小鼠到8周龄,雌性小鼠到6周龄,可分别与野生型异性小鼠交配获得f1代杂合子小鼠,小鼠出生14天后pcr鉴定,若有阳性小鼠出生,则表示转基因已经整合到生殖细胞,这个过程需要120天左右。
45.附图3为阳性小鼠测序分析,可见基因组间删除了9942bp;
46.附图4为f1小鼠鉴定情况,26,27,28,35,36和37号小鼠鉴定为阳性 f1。
47.pcr引物f1设计在敲除区域上游外侧,r1设计在敲除区域下游外侧,r2设计在敲除区域内;附图5为pcr引物在基因组上相对位置。
48.以下为引物序列
49.pcr primers1(annealing temperature 60.0℃):
50.f1=seq id no.3=5'-aggaaagcattaactctctctgcg-3'
51.r1=seq id no.4=5'-gactctgacccgagaagctaac-3'
52.product size:557bp
53.pcr primers2(annealing temperature 60.0℃):
54.f1=seq id no.5=5'-aggaaagcattaactctctctgcg-3'
55.r2=seq id no.6=5'-agaagggaaggctttaacaggata-3'
56.product size:542bp。
57.以下表1为pcr混合体系:
58.表1pcr混合体系
[0059][0060]
以下表2为pcr反应条件:
[0061]
表2pcr反应条件
[0062][0063]
通过以上实施例1-3,本发明采用新型基因组编辑技术crispr/cas9系统,在中国实验用小鼠(house mouse)abhd12基因上及其附近设计敲除靶位点,利用合成好的abhd12基因敲除grna序列,通过电击法转染小鼠受精卵细胞200枚,并将受精卵细胞移植入代孕母鼠子宫中,待出生后,通过鉴定获得31只abhd12 基因敲除小鼠。并且本发明利用crispr/cas9系统能够快速高效的将目的基因大片段敲除,并且不留下外源基因片段。证明本发明利用crispr/cas9系统快速高效的构建了abhd12基因敲除小鼠模型。
[0064]
以上仅为本发明的较佳实施例而已,不能以此限定本发明的保护范围,即大凡依本发明权利要求书及发明内容所做的简单的等效变化与修改,皆仍属于本发明专利申请的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1