一种双硒代马来酰亚胺类化合物的制备方法
1.本发明属于有机合成领域,具体涉及一种通过自由基偶联制备双硒代马来酰亚胺类化合物的方法。
背景技术:
2.硒是人体非常重要的元素。含硒化合物广泛分布于天然产物和生物活性化合物中,其在有机化学、食品化学、农业化学和材料学中有着非常重要的应用。因此,发展合成含硒化合物的新方法吸引着广大合成化学家的兴趣。
3.马来酰亚胺作为核心骨架广泛存在于许多天然产物和药物活性化合物中,马来酰亚胺及其衍生物在有机合成、功能材料和生物学中被广泛应用。到目前为止,有关马来酰亚胺直接官能团化方法的报道较少,马来酰亚胺直接硒化方法的报道只有两篇。2017年,baidya研究组发展了钌催化的马来酰亚胺单硒化的方法。随后,吴研究组发展了铜催化的马来酰亚胺芳胺化硒化的方法,反应在氧气气氛中120度进行。不饱和碳键的双硒化在有机化学和药物化学中有着非常广泛的应用,因此大量方法被发展用于炔和联烯类化合物的双硒化。然而,目前尚无有关马来酰亚胺双硒化方法的报道。
4.随着人类对环境保护和能源节约意识的提高,发展环境友好、能源消耗小、操作简便的合成方法吸引了大量有机合成化学家的兴趣。因此,发展非金属试剂促进的室温下马来酰亚胺双硒化的方法就显得尤为重要和迫切。
技术实现要素:
5.本发明提供一种以pifa(二(三氟乙酰氧基)碘代苯)为氧化剂,以马来酰亚胺和二硒醚为原料的直接合成双硒代马来酰亚胺类化合物的方法,该方法原料易得,制备方法简单。
6.一种双硒代马来酰亚胺类化合物的制备方法,包括:在溶剂中,室温下,以pifa为氧化剂,马来酰亚胺类化合物和二硒醚类化合物进行反应,反应结束后经过后处理得到所述的双硒代马来酰亚胺类化合物;
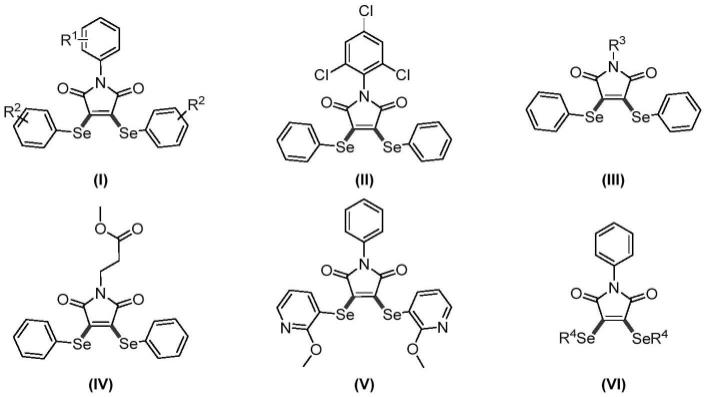
7.所述的双硒代马来酰亚胺类化合物的结构如式(i)~(vi)所示:
[0008][0009]
式(i)中,r1为氢、c1~c4烷基、卤素或乙酰基,r2为氢、c1~c4烷基、卤素或氰基;式(iii)中,r3为氢、c1~c4烷基或环己基;式(vi)中,r4为c1~c4烷基;
[0010]
所述的马来酰亚胺类化合物的结构如式(vii)~(x)所示:
[0011][0012]
式(vii)中,r1为氢、c1~c4烷基、卤素或乙酰基;式(ix)中,r3为氢、c1~c4烷基或环己基;
[0013]
所述的二硒醚类化合物的结构如式(xi)~(xiii)任一个所示:
[0014][0015]
式(xi)中,r2为氢、c1~c4烷基、卤素或氰基;式(xiii)中,r4为c1~c4烷基。
[0016]
优选地,所述的马来酰亚胺类化合物与所述的二硒醚类化合物的摩尔比为:1:1.5或1:2.0,以提高反应的产率。减少二硒醚的量会使反应产率降低。
[0017]
所述的马来酰亚胺类化合物与所述的氧化剂pifa的摩尔比为1:2.0,以提高反应的产率。减少氧化剂的量会使反应产率降低。
[0018]
马来酰亚胺类化合物和二硒醚类化合物的反应溶剂为n,n-二甲基甲酰胺。其它种类的溶剂,包括极性溶剂和非极性溶剂均使反应产率降低或无产物生成。
[0019]
所述的合成的反应方程式为:
[0020][0021]
作为优选,r1为氢、甲基、氯、溴或乙酰基;r2为氢、乙基、溴或氰基;r3为氢、甲基、乙基、叔丁基、环己基或苄基;r4为乙基或丁基。
[0022]
所述的合成反应可能的原理为:pifa与二硒醚反应生成硒基自由基和三氟乙酰氧基碘苯自由基。硒基自由基进攻马来酰亚胺生成硒代自由基中间体。该自由基被三氟乙酰氧基碘苯自由基氧化,生成硒代阳离子中间体。阳离子中间体去质子化生成单硒代马来酰亚胺。硒基自由基进攻单硒代马来酰亚胺生成双硒代自由基中间体。该自由基被三氟乙酰氧基碘苯自由基氧化,生成双硒代阳离子中间体。阳离子中间体去质子化生成双硒代马来酰亚胺类化合物。
[0023]
与现有技术相比,本发明具有以下优点:
[0024]
本发明方法以马来酰亚胺与二硒醚为原料,通过自由基偶联首次合成了双硒代马来酰亚胺类化合物。反应原料廉价易得,制备方法简单;以pifa为氧化剂,廉价易得,因此反应成本低。反应在室温下空气气氛中进行,因此操作简单。反应时间短,产率高。本发明方法可适用于合成不同种类的双硒代马来酰亚胺类化合物。
具体实施方式
[0025]
下面结合实施例来详细说明本发明,但本发明并不仅限于此。
[0026]
实施例1
[0027]
4ml的反应瓶中分别加入n-苯基马来酰亚胺(0.2mmol)、1,2-二苯二硒醚(0.3mmol)、pifa(0.4mmol)和dmf(2.0ml),室温搅拌。tlc跟踪检测反应。0.5小时后,反应结束。反应体系中加入水和二氯甲烷,分离有机层。用二氯甲烷将水层洗两次,结合所有有机层,并用水洗两次。有机层用无水硫酸钠干燥,浓缩,柱层析分离(10%的乙酸乙酯石油醚溶液),得到产物72.5mg,产率为75%,反应过程如下式所示:
[0028][0029]
对本实施例制备得到的产物进行核磁共振分析:1h nmr(400mhz,cdcl3)δ7.57(d,j=7.0hz,4h),7.43
–
7.30(m,11h)ppm;
13
c nmr(101mhz,dmso-d6)δ166.04,138.85,133.34,131.82,129.39,128.85,128.32,127.92,126.82,126.77ppm;
77
se nmr(115mhz,cdcl3)δ359.55ppm。
[0030]
实施例2
[0031]
4ml的反应瓶中分别加入n-苯基马来酰亚胺(0.2mmol)、1,2-二苯二硒醚(0.3mmol)、pifa(0.4mmol)和dmso(2.0ml),室温搅拌。tlc跟踪检测反应。36小时后,无产物生成。反应过程如下式所示:
[0032][0033]
实施例3
[0034]
4ml的反应瓶中分别加入n-苯基马来酰亚胺(0.2mmol)、1,2-二苯二硒醚(0.3mmol)、pifa(0.5mmol)和dmf(2.0ml),室温搅拌。tlc跟踪检测反应。0.5小时后,反应结束。反应体系中加入水和二氯甲烷,分离有机层。用二氯甲烷将水层洗两次,结合所有有机层,并用水洗两次。有机层用无水硫酸钠干燥,浓缩,柱层析分离(10%的乙酸乙酯石油醚溶液),得到产物69.6mg,产率为72%,反应过程如下式所示:
[0035][0036]
对本实施例制备得到的产物进行核磁共振分析:1h nmr(400mhz,cdcl3)δ7.57(d,j=7.0hz,4h),7.43
–
7.30(m,11h)ppm;
13
c nmr(101mhz,dmso-d6)δ166.04,138.85,133.34,131.82,129.39,128.85,128.32,127.92,126.82,126.77ppm;
77
se nmr(115mhz,cdcl3)δ359.55ppm。
[0037]
实施例4
[0038]
4ml的反应瓶中分别加入n-苯基马来酰亚胺(0.2mmol)、1,2-二苯二硒醚(0.4mmol)、pifa(0.4mmol)和dmf(2.0ml),室温搅拌。tlc跟踪检测反应。0.5小时后,反应结束。反应体系中加入水和二氯甲烷,分离有机层。用二氯甲烷将水层洗两次,结合所有有机层,并用水洗两次。有机层用无水硫酸钠干燥,浓缩,柱层析分离(10%的乙酸乙酯石油醚溶液),得到产物68.6mg,产率为71%,反应过程如下式所示:
[0039][0040]
对本实施例制备得到的产物进行核磁共振分析:1h nmr(400mhz,cdcl3)δ7.57(d,j=7.0hz,4h),7.43
–
7.30(m,11h)ppm;
13
c nmr(101mhz,dmso-d6)δ166.04,138.85,133.34,131.82,129.39,128.85,128.32,127.92,126.82,126.77ppm;
77
se nmr(115mhz,cdcl3)δ359.55ppm。
[0041]
实施例5
[0042]
4ml的反应瓶中分别加入n-苯基马来酰亚胺(0.2mmol)、1,2-二苯二硒醚(0.3mmol)、pida(二(乙酰氧基)碘苯)(0.4mmol)和dmf(2.0ml),室温搅拌。tlc跟踪检测反应。18小时后,无产物生成。反应过程如下式所示:
[0043][0044]
实施例6
[0045]
4ml的反应瓶中分别加入n-(4-乙基)苯基马来酰亚胺(0.2mmol)、1,2-二苯二硒醚(0.3mmol)、pifa(0.4mmol)和dmf(2.0ml),室温搅拌。tlc跟踪检测反应。1小时后,反应结束。反应体系中加入水和二氯甲烷,分离有机层。用二氯甲烷将水层洗两次,结合所有有机层,并用水洗两次。有机层用无水硫酸钠干燥,浓缩,柱层析分离(2%的乙酸乙酯石油醚溶液),得到产物70.6mg,产率为69%,反应过程如下式所示:
[0046][0047]
对本实施例制备得到的产物进行核磁共振分析:1h nmr(400mhz,cdcl3)δ7.56
–
7.54(m,4h),7.36(t,j=7.3hz,2h),7.30(t,j=7.3hz,4h),7.24
–
7.18(m,4h),2.64(q,j=7.6hz,2h),1.22(t,j=7.6hz,3h)ppm;
13
c nmr(101mhz,cdcl3)δ166.30,143.97,138.42,134.90,129.27,129.02,128.86,128.37,125.83,28.45,15.42ppm;
77
se nmr(115mhz,cdcl3)δ358.84ppm。
[0048]
实施例7
[0049]
4ml的反应瓶中分别加入n-(4-乙酰基)苯基马来酰亚胺(0.2mmol)、1,2-二苯二硒
醚(0.3mmol)、pifa(0.4mmol)和dmf(2.0ml),室温搅拌。tlc跟踪检测反应。0.5小时后,反应结束。反应体系中加入水和二氯甲烷,分离有机层。用二氯甲烷将水层洗两次,结合所有有机层,并用水洗两次。有机层用无水硫酸钠干燥,浓缩,柱层析分离(20%的乙酸乙酯石油醚溶液),得到产物78.8mg,产率为75%,反应过程如下式所示:
[0050][0051]
对本实施例制备得到的产物进行核磁共振分析:1h nmr(400mhz,cdcl3)δ7.97(d,j=8.4hz,2h),7.54(d,j=8.0hz,4h),7.47(d,j=8.4hz,2h),7.37(t,j=7.2hz,2h),7.31(t,j=7.2hz,4h),2.58(s,3h)ppm;
13
c nmr(101mhz,cdcl3)δ196.98,165.68,138.74,135.80,135.56,135.01,129.38,129.08,128.99,125.63,125.10,26.58ppm;
77
se nmr(115mhz,cdcl3)δ363.28ppm。
[0052]
实施例8
[0053]
4ml的反应瓶中分别加入n-(2,4,6-三氯)苯基马来酰亚胺(0.2mmol)、1,2-二苯二硒醚(0.4mmol)、pifa(0.4mmol)和dmf(2.0ml),室温搅拌。tlc跟踪检测反应。1小时后,反应结束。反应体系中加入水和二氯甲烷,分离有机层。用二氯甲烷将水层洗两次,结合所有有机层,并用水洗两次。有机层用无水硫酸钠干燥,浓缩,柱层析分离(2%的乙酸乙酯石油醚溶液),得到产物109.1mg,产率为93%,反应过程如下式所示:
[0054][0055]
对本实施例制备得到的产物进行核磁共振分析:1h nmr(400mhz,cdcl3)δ7.55
–
7.53(m,4h),7.41
–
7.39(m,2h),7.38
–
7.35(m,2h),7.33
–
7.29(m,4h)ppm;
13
c nmr(101mhz,cdcl3)δ164.22,139.19,136.24,136.02,134.61,129.31,128.93,128.51,126.74,125.90ppm;
77
se nmr(115mhz,cdcl3)δ365.74ppm。
[0056]
实施例9
[0057]
4ml的反应瓶中分别加入n-甲基马来酰亚胺(0.2mmol)、1,2-二苯二硒醚(0.4mmol)、pifa(0.4mmol)和dmf(2.0ml),室温搅拌。tlc跟踪检测反应。0.5小时后,反应结束。反应体系中加入水和二氯甲烷,分离有机层。用二氯甲烷将水层洗两次,结合所有有机层,并用水洗两次。有机层用无水硫酸钠干燥,浓缩,柱层析分离(10%的乙酸乙酯石油醚溶液),得到产物67.4mg,产率为80%,反应过程如下式所示:
[0058][0059]
对本实施例制备得到的产物进行核磁共振分析:1h nmr(400mhz,cdcl3)δ7.38(d,j
=7.9hz,4h),7.26
–
7.22(m,2h),7.19
–
7.16(m,4h),2.86(s,3h)ppm;
13
c nmr(101mhz,cdcl3)δ167.38,138.38,134.68,129.22,128.75,126.02,24.67ppm;
77
se nmr(115mhz,cdcl3)δ353.54ppm。
[0060]
实施例10
[0061]
4ml的反应瓶中分别加入n-环己基马来酰亚胺(0.2mmol)、1,2-二苯二硒醚(0.3mmol)、pifa(0.4mmol)和dmf(2.0ml),室温搅拌。tlc跟踪检测反应。1小时后,反应结束。反应体系中加入水和二氯甲烷,分离有机层。用二氯甲烷将水层洗两次,结合所有有机层,并用水洗两次。有机层用无水硫酸钠干燥,浓缩,柱层析分离(5%的乙酸乙酯石油醚溶液),得到产物69.5mg,产率为71%,反应过程如下式所示:
[0062][0063]
对本实施例制备得到的产物进行核磁共振分析:1h nmr(400mhz,cdcl3)δ7.46(d,j=7.5hz,4h),7.34(t,j=7.2hz,2h),7.29
–
7.26(m,4h),3.86(tt,j=12.3,3.7hz,1h),2.03
–
1.94(m,2h),1.78(d,j=13.1hz,2h),1.63
–
1.61(m,2h),1.29
–
1.13(m,4h)ppm;
13
c nmr(101mhz,cdcl3)δ167.36,138.00,134.62,129.20,128.66,126.11,51.77,29.85,25.87,24.92ppm;
77
se nmr(115mhz,cdcl3)δ352.22ppm。
[0064]
实施例11
[0065]
4ml的反应瓶中分别加入n-苄基马来酰亚胺(0.2mmol)、1,2-二苯二硒醚(0.3mmol)、pifa(0.4mmol)和dmf(2.0ml),室温搅拌。tlc跟踪检测反应。1小时后,反应结束。反应体系中加入水和二氯甲烷,分离有机层。用二氯甲烷将水层洗两次,结合所有有机层,并用水洗两次。有机层用无水硫酸钠干燥,浓缩,柱层析分离(5%的乙酸乙酯石油醚溶液),得到产物70.6mg,产率为71%,反应过程如下式所示:
[0066][0067]
对本实施例制备得到的产物进行核磁共振分析:1h nmr(400mhz,cdcl3)δ7.46(d,j=7.5hz,4h),7.37
–
7.26(m,11h),4.62(s,2h)ppm;
13
c nmr(101mhz,cdcl3)δ167.08,138.39,136.08,134.62,129.27,128.77,128.62,128.60,127.81,126.08,42.41ppm;
77
se nmr(115mhz,cdcl3)δ355.58ppm。
[0068]
实施例12
[0069]
4ml的反应瓶中分别加入马来酰亚胺(0.2mmol)、1,2-二苯二硒醚(0.3mmol)、pifa(0.4mmol)和dmf(2.0ml),室温搅拌。tlc跟踪检测反应。0.5小时后,反应结束。反应体系中加入水和二氯甲烷,分离有机层。用二氯甲烷将水层洗两次,结合所有有机层,并用水洗两次。有机层用无水硫酸钠干燥,浓缩,柱层析分离(20%的乙酸乙酯石油醚溶液),得到产物57.0mg,产率为70%,反应过程如下式所示:
[0070][0071]
对本实施例制备得到的产物进行核磁共振分析:1h nmr(400mhz,cdcl3)δ7.68(brs,1h),7.36(d,j=7.2hz,4h),7.24(t,j=7.3hz,2h),7.20
–
7.15(m,4h)ppm;
13
c nmr(101mhz,cdcl3)δ167.08,139.44,134.57,129.28,128.78,125.93ppm;
77
se nmr(115mhz,cdcl3)δ355.10ppm。
[0072]
实施例13
[0073]
4ml的反应瓶中分别加入n-丙酸甲酯基马来酰亚胺(0.2mmol)、1,2-二苯二硒醚(0.4mmol)、pifa(0.4mmol)和dmf(2.0ml),室温搅拌。tlc跟踪检测反应。1小时后,反应结束。反应体系中加入水和二氯甲烷,分离有机层。用二氯甲烷将水层洗两次,结合所有有机层,并用水洗两次。有机层用无水硫酸钠干燥,浓缩,柱层析分离(20%的乙酸乙酯石油醚溶液),得到产物78.9mg,产率为80%,反应过程如下式所示:
[0074][0075]
对本实施例制备得到的产物进行核磁共振分析:1h nmr(400mhz,cdcl3)δ7.49
–
7.47(m,4h),7.35(t,j=7.3hz,2h),7.30
–
7.26(m,4h),3.77(t,j=7.2hz,2h),3.61(s,3h),2.57(t,j=7.2hz,2h)ppm;
13
c nmr(101mhz,cdcl3)δ170.94,166.88,138.34,134.66,129.22,128.76,125.93,51.77,34.53,32.65ppm;
77
se nmr(115mhz,cdcl3)δ355.84ppm。
[0076]
体外抗菌活性测试:
[0077]
我们选用生物膜形成阳性株金黄色葡萄球菌jp-21为研究对象,采用微量稀释法测试化合物对金黄色葡萄球菌的抑菌活性,操作如下:将0.512g化合物溶于10ml dmso中,配置成化合物母液51200mg/l。在试管架上排列试管13支,用移液器向第一支试管中加入配制好的菌液(106cfu/ml)1980μl,其余的试管加入配制好的茵液lml。第十三支试管中加入配制好的菌液2ml,然后吸取配制好的药物原液20μl,加入第一支试管,用移液器充分混匀后,再用移液器从第一支试管中吸取l ml加入第二支试管中,以此类推,至十二管,然后再从第十二管中吸取l ml。将试管放到恒温37℃摇床上,隔夜培养24h后,观察结果,此实验反复操作,以得出合适结果,以菌株不生长的化合物浓度为样品的最小抑制mic。
[0078]
微量稀释法测试化合物对金黄色葡萄球菌的最小抑菌浓度(mic),结果显示该化合物对金黄色葡萄球菌的mic值为8μg/ml。
[0079]
此结果初步表明该化合物具有抗菌活性。
[0080]
实施例14
[0081]
4ml的反应瓶中分别加入n-苯基马来酰亚胺(0.2mmol)、1,2-二邻溴苯基二硒醚(0.4mmol)、pifa(0.4mmol)和dmf(2.0ml),室温搅拌。tlc跟踪检测反应。0.5小时后,反应结束。反应体系中加入水和二氯甲烷,分离有机层。用二氯甲烷将水层洗两次,结合所有有机层,并用水洗两次。有机层用无水硫酸钠干燥,浓缩,柱层析分离(10%的乙酸乙酯石油醚溶
液),得到产物102.6mg,产率为80%,反应过程如下式所示:
[0082][0083]
对本实施例制备得到的产物进行核磁共振分析:1h nmr(600mhz,cdcl3)δ7.57(d,j=7.5hz,2h),7.48(d,j=7.5hz,2h),7.42(t,j=7.7hz,2h),7.35
–
7.31(m,3h),7.23
–
7.18(m,4h)ppm;
13
c nmr(151mhz,cdcl3)δ166.03,138.75,135.48,133.18,131.49,130.28,129.01,128.88,127.99,127.98,127.86,125.87ppm;
77
se nmr(115mhz,cdcl3)δ379.08ppm。
[0084]
实施例15
[0085]
4ml的反应瓶中分别加入n-苯基马来酰亚胺(0.2mmol)、1,2-二间氰基苯基二硒醚(0.3mmol)、pifa(0.4mmol)和dmf(2.0ml),室温搅拌。tlc跟踪检测反应。0.5小时后,反应结束。反应体系中加入水和二氯甲烷,分离有机层。用二氯甲烷将水层洗两次,结合所有有机层,并用水洗两次。有机层用无水硫酸钠干燥,浓缩,柱层析分离(20%的乙酸乙酯石油醚溶液),得到产物64.0mg,产率为60%,反应过程如下式所示:
[0086][0087]
对本实施例制备得到的产物进行核磁共振分析:1h nmr(400mhz,cdcl3)δ7.80
–
7.76(m,4h),7.66(d,j=7.7hz,2h),7.45
–
7.39(m,4h),7.33(t,j=7.3hz,1h),7.27(d,j=8.5hz,2h)ppm;
13
c nmr(151mhz,cdcl3)δ165.50,138.77,137.80,137.65,132.53,131.07,129.95,129.08,128.12,126.64,125.82,117.49,113.60ppm;
77
se nmr(115mhz,cdcl3)δ367.04ppm。
[0088]
体外抗菌活性测试:
[0089]
我们选用生物膜形成阳性株金黄色葡萄球菌jp-21为研究对象,采用微量稀释法测试化合物对金黄色葡萄球菌的抑菌活性,操作如下:将0.512g化合物溶于10ml dmso中,配置成化合物母液51200mg/l。在试管架上排列试管13支,用移液器向第一支试管中加入配制好的菌液(106cfu/ml)1980μl,其余的试管加入配制好的茵液lml。第十三支试管中加入配制好的菌液2ml,然后吸取配制好的药物原液20μl,加入第一支试管,用移液器充分混匀后,再用移液器从第一支试管中吸取l ml加入第二支试管中,以此类推,至十二管,然后再从第十二管中吸取l ml。将试管放到恒温37℃摇床上,隔夜培养24h后,观察结果,此实验反复操作,以得出合适结果,以菌株不生长的化合物浓度为样品的最小抑制mic。
[0090]
微量稀释法测试化合物对金黄色葡萄球菌的最小抑菌浓度(mic),结果显示该化合物对金黄色葡萄球菌的mic值为4μg/ml。
[0091]
这些结果初步表明该化合物具有抗菌活性。
[0092]
实施例16
[0093]
4ml的反应瓶中分别加入n-苯基马来酰亚胺(0.2mmol)、1,2-二对甲基苯基二硒醚
(0.3mmol)、pifa(0.4mmol)和dmf(2.0ml),室温搅拌。tlc跟踪检测反应。0.5小时后,反应结束。反应体系中加入水和二氯甲烷,分离有机层。用二氯甲烷将水层洗两次,结合所有有机层,并用水洗两次。有机层用无水硫酸钠干燥,浓缩,柱层析分离(10%的乙酸乙酯石油醚溶液),得到产物76.7mg,产率为75%,反应过程如下式所示:
[0094][0095]
对本实施例制备得到的产物进行核磁共振分析:1h nmr(600mhz,dmso)δ7.45(t,j=7.7hz,2h),7.41(d,j=8.0hz,4h),7.37(t,j=7.4hz,1h),7.30(d,j=7.7hz,2h),7.14(d,j=7.9hz,4h),2.29(s,6h)ppm;
13
c nmr(151mhz,dmso)δ165.90,138.69,138.12,133.71,131.79,130.03,128.80,127.86,126.79,123.01,20.73ppm;
77
se nmr(115mhz,dmso)δ340.74ppm。
[0096]
实施例17
[0097]
4ml的反应瓶中分别加入n-苯基马来酰亚胺(0.2mmol)、1,2-二(2-甲氧基吡啶-3-基)二硒醚(0.4mmol)、pifa(0.4mmol)和dmf(2.0ml),室温搅拌。tlc跟踪检测反应。1小时后,反应结束。反应体系中加入水和二氯甲烷,分离有机层。用二氯甲烷将水层洗两次,结合所有有机层,并用水洗两次。有机层用无水硫酸钠干燥,浓缩,柱层析分离(20%的乙酸乙酯石油醚溶液),得到产物46.9mg,产率为43%,反应过程如下式所示:
[0098][0099]
对本实施例制备得到的产物进行核磁共振分析:1h nmr(400mhz,dmso)δ8.11(dd,j=4.9,1.6hz,2h),7.74(dd,j=7.5,1.6hz,2h),7.50(t,j=7.6hz,2h),7.43
–
7.37(m,3h),6.92(dd,j=7.4,4.9hz,2h),3.82(s,6h)ppm;
13
c nmr(101mhz,dmso)δ166.28,160.63,146.26,142.29,137.83,131.77,128.92,128.04,126.87,117.88,110.19,53.88ppm;
77
se nmr(115mhz,cdcl3)δ296.48ppm。
[0100]
实施例18
[0101]
4ml的反应瓶中分别加入n-苯基马来酰亚胺(0.2mmol)、1,2-二丁基二硒醚(0.3mmol)、pifa(0.4mmol)和dmf(2.0ml),室温搅拌。tlc跟踪检测反应。0.5小时后,反应结束。反应体系中加入水和二氯甲烷,分离有机层。用二氯甲烷将水层洗两次,结合所有有机层,并用水洗两次。有机层用无水硫酸钠干燥,浓缩,柱层析分离(10%的乙酸乙酯石油醚溶液),得到产物62.1mg,产率为70%,反应过程如下式所示:
[0102][0103]
对本实施例制备得到的产物进行核磁共振分析:1h nmr(400 mhz,cdcl3)δ7.45(t,j=7.8 hz,2h),7.36
–
7.32(m,3h),3.39(t,j=7.5 hz,4h),1.80
–
1.72(m,4h),1.50
–
1.41(m,4h),0.94(t,j=7.4 hz,6h)ppm;
13
c nmr(101 mhz,cdcl3)δ166.24,136.81,131.71,129.00,127.75,126.10,33.03,27.00,22.69,13.49 ppm;
77
se nmr(115 mhz,cdcl3)δ257.35 ppm。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1