一种R-(+)-2-(4-羟基苯氧基)丙酸甲酯的环保制备方法与流程
一种r-(+)-2-(4-羟基苯氧基)丙酸甲酯的环保制备方法
技术领域
1.本发明涉及一种r-(+)-2-(4-羟基苯氧基)丙酸甲酯的环保制备方法,属于化合物制备技术领域。
背景技术:
2.r-(+)-2-(4-羟基苯氧基)丙酸甲酯是合成禾草灵、精盖草能等苯氧基丙酸类除草剂的重要中间体。
3.目前文献和专利报道的合成方法主要以对苯二酚作为起始原料来制备r-(+)-2-(4-羟基苯氧基)丙酸甲酯,存在反应时间长,杂质多,收率低的缺点。
4.发明专利申请cn105753656a中,将对苯二酚与氢氧化钠水溶液放入反应釜中反应,生成含对羟基苯酚钠的混合溶液,再和2-氯丙酸甲酯进行取代反应,生成含r-(+)-2-(4-羟基苯氧基)丙酸甲酯的混合溶液;该反应在碱性条件下反应,易造成酯类化合物水解,产品纯度偏低,需要重结晶处理,操作繁琐。
5.美国专利us4981998a中用过量对苯二酚和(s)-(-)-2-卤代丙酸反应制备r-(+)-2-(4-羟基苯氧基)丙酸,之后继续酯化反应制备r-(+)-2-(4-羟基苯氧基)丙酸甲酯;该技术中对苯二酚回收工艺繁琐,过量的对苯二酚易氧化,导致产品颜色不合格。
6.发明专利cn100422129a中采用增加还原剂亚硫酸氢钠来避免对苯二酚的氧化,但对苯二酚过度烷基化反应导致杂质偏高,同时还原剂对反应有抑制作用,实际收率较低。
7.此外,现有工艺还存在三废多,环保压力较大的缺点。
技术实现要素:
8.本发明的主要目的是:克服现有技术存在的问题,提供一种r-(+)-2-(4-羟基苯氧基)丙酸甲酯的环保制备方法,原料易得,反应副产物少,产品收率高;有效减少三废排放,反应过程绿色环保。
9.本发明解决其技术问题的技术方案如下:一种r-(+)-2-(4-羟基苯氧基)丙酸甲酯的环保制备方法,其特征是,包括以下步骤:第一步、在惰性气体保护下,于甲醇中,将2-(4-苄氧基苯氧基)乙醛、多聚甲醛、氯化铵在第一催化剂作用下加热反应,反应结束后降温析晶,抽滤并洗涤固形物,干燥后获得1-酰胺基-2-(4-苄氧基苯氧基)乙醛;其中,2-(4-苄氧基苯氧基)乙醛、多聚甲醛、氯化铵的当量比为1:(1.0~1.5):(1.0~2.0);第二步、在惰性气体保护下,于四氢呋喃中,先降温并将1-酰胺基-2-(4-苄氧基苯氧基)乙醛、三氯化铝、硼氢化钠混合,再升温回流反应;反应结束后,减压蒸馏脱除四氢呋喃,加入水并以盐酸调节ph至3~4,以萃取溶剂进行萃取,收集有机相并洗涤,经减压蒸馏脱除溶剂后获得r-(+)-2-(4-苄氧基苯氧基)丙酰胺;其中,1-酰胺基-2-(4-苄氧基苯氧基)乙醛、硼氢化钠、三氯化铝的当量比为1:(1.2~1.5):(1.5~2.0);
第三步、在甲醇中加入r-(+)-2-(4-苄氧基苯氧基)丙酰胺、钯碳,在氢气氛下加压加热反应,反应结束后过滤,将滤液减压浓缩获得r-(+)-2-(4-羟基苯氧基)丙酰胺;其中,r-(+)-2-(4-苄氧基苯氧基)丙酰胺、钯碳的当量比为1:(0.005~0.05);第四步、在惰性气体保护下,将r-(+)-2-(4-羟基苯氧基)丙酰胺加至甲醇中,加入第二催化剂后升温,滴加酸性甲醇溶液后保温反应;反应结束后过滤,将滤液降温后,抽滤并洗涤固形物,干燥后获得r-(+)-2-(4-羟基苯氧基)丙酸甲酯;其中,r-(+)-2-(4-羟基苯氧基)丙酰胺、酸性甲醇溶液所含氢离子、第二催化剂的当量比为1:(1.4~1.6):(0.01~0.02)。
10.该方法先将2-(4-苄氧基苯氧基)乙醛与多聚甲醛、氯化铵混合于甲醇中,在第一催化剂作用下,升温回流进行曼尼希加成反应,制备得1-酰胺基-2-(4-苄氧基苯氧基)乙醛;接着,在硼氢化钠和三氯化铝的作用下,还原生成r-(+)-2-(4-苄氧基苯氧基)丙酰胺;之后,在钯碳中加氢脱苄基得r-(+)-2-(4-羟基苯氧基)丙酰胺;最后加入酸性甲醇溶液,在第二催化剂作用下经氨基酯化制备光学纯r-(+)-2-(4-羟基苯氧基)丙酸甲酯。
11.相较于传统工艺中采用对苯二酚为起始原料,该方法采用2-(4-苄氧基苯氧基)乙醛为原料,在反应过程中不会发生对位烷基化反应,可以避免多酚过度烷基化杂质的产生,原料易得,副反应少,后处理简便,产品收率高;各步骤的溶剂均可回收套用,有效减少三废排放,反应过程绿色环保。
12.本发明进一步完善的技术方案如下:优选地,第一步中,加热反应时在30℃~70℃下保温反应,当hplc检测2-(4-苄氧基苯氧基)乙醛≤0.5%时反应结束;反应结束后,先经减压蒸馏除甲醇或增添甲醇使反应体系总体积或总重量达到预设值,再降温至0℃~5℃析晶。
13.更优选地,第一步中,2-(4-苄氧基苯氧基)乙醛、多聚甲醛、氯化铵的当量比为1:(1.1~1.2):(1.4~1.6);加热反应时在50℃~60℃下保温反应2~8h;所述第一催化剂为盐酸、硫酸、磷酸、醋酸、氨基磺酸、三氯化铝、氯化锌之一。
14.更优选地,第一步中,加热反应时保温反应4~6h;所述惰性气体为氮气;所述第一催化剂为盐酸;采用适量甲醇洗涤固形物,洗涤后真空干燥。
15.采用以上优选方案后,可进一步优化第一步的具体技术细节。
16.优选地,第二步中,先将1-酰胺基-2-(4-苄氧基苯氧基)乙醛加至四氢呋喃,降温至0℃~10℃,分批加入三氯化铝,降温至-5℃~0℃,分批加入硼氢化钠,在-5℃~0℃保温2~6h,之后升温至回流反应10~20h;当hplc检测1-酰胺基-2-(4-苄氧基苯氧基)乙醛≤0.5%时反应结束;1-酰胺基-2-(4-苄氧基苯氧基)乙醛、硼氢化钠、三氯化铝的当量比为1:(1.3~1.4):(1.6~1.8)。
17.更优选地,第二步中,升温回流反应15~18h;所述惰性气体为氮气;萃取溶剂为二氯甲烷,萃取至少3次;洗涤时依次采用3%盐酸、饱和食盐水洗涤。
18.采用以上优选方案后,可进一步优化第二步的具体技术细节。
19.优选地,第三步中,反应前先以氮气置换至少3次,再以氢气置换至少3次;反应时控制氢气压力为0.1~0.5mpa,在40℃~70℃下保温反应4~8小时,当hplc检测r-(+)-2-(4-苄氧基苯氧基)丙酰胺≤0.5%时反应结束;反应结束后先降温并以氮气置换至少3次再过滤;r-(+)-2-(4-苄氧基苯氧基)丙酰胺、钯碳的当量比为1:(0.01~0.02)。
20.更优选地,第三步中,反应时控制氢气压力为0.2~0.3mpa,在50℃-60℃下保温反应5~6小时。
21.采用以上优选方案后,可进一步优化第三步的具体技术细节。
22.优选地,第四步中,所述第二催化剂为三苯基膦、三对苯甲基膦、三间基苯基膦、二苯基甲氧基膦、二甲基苯基磷之一;加入第二催化剂后升温至30℃~70℃;所述酸性甲醇溶液为氯化氢甲醇溶液、溴化氢甲醇溶液、硫酸甲醇溶液、多聚磷酸甲醇溶液之一;滴加酸性甲醇溶液后30℃~70℃保温反应5~20h;当hplc检测r-(+)-2-(4-羟基苯氧基)丙酰胺≤0.5%时反应结束;反应结束后,若温度大于50℃则降温至40℃~50℃过滤,若温度小于或等于50℃则直接过滤;将滤液降温至0℃~5℃后抽滤。
23.更优选地,第四步中,所述惰性气体为氮气;所述第二催化剂为三苯基膦;加入第二催化剂后升温至50℃~60℃;所述酸性甲醇溶液为氯化氢甲醇溶液;滴加酸性甲醇溶液后50℃~60℃保温反应10~12h;抽滤后采用甲醇洗涤固形物并真空干燥。
24.采用以上优选方案后,可进一步优化第四步的具体技术细节。其中,当采用氯化氢甲醇溶液时,所得副产物氯化铵可在回收后直接用作第一步反应的原料,实现循环利用,进一步提升环保效益。
25.与现有技术相比,本发明采用2-(4-苄氧基苯氧基)乙醛经曼尼希加成反应、还原脱苄基及伯酰胺酯化反应,制备r-(+)-2-(4-羟基苯氧基)丙酸甲酯;该工艺路线原料易得,反应转化率高,副产物少,产品收率高,整个工艺的平均收率不低于78%,产品纯度99.0%以上,后处理简便易行,适合工业化生产。
附图说明
26.图1为本发明的工艺路线图。
27.图2为本发明实施例1中1-酰胺基-2-(4-苄氧基苯氧基)乙醛的核磁氢谱1h nmr图。
28.图3为本发明实施例1中r-(+)-2-(4-苄氧基苯氧基)丙酰胺的核磁氢谱1h nmr图。
29.图4为本发明实施例1中r-(+)-2-(4-羟基苯氧基)丙酰胺的核磁氢谱1h nmr图。
30.图5为本发明实施例1中r-(+)-2-(4-羟基苯氧基)丙酸甲酯的核磁氢谱1h nmr图。
具体实施方式
31.具体实施时,如图1所示,本发明的r-(+)-2-(4-羟基苯氧基)丙酸甲酯的环保制备方法,包括以下步骤:第一步、在惰性气体保护下,于甲醇中,将2-(4-苄氧基苯氧基)乙醛(ⅰ)、多聚甲醛、氯化铵在第一催化剂作用下加热反应,反应结束后降温析晶,抽滤并洗涤固形物,干燥后获得1-酰胺基-2-(4-苄氧基苯氧基)乙醛(ⅱ);其中,2-(4-苄氧基苯氧基)乙醛、多聚甲醛、氯化铵的当量比为1:(1.0~1.5):(1.0~2.0),优选1:(1.1~1.2):(1.4~1.6)。
32.具体而言,惰性气体为氮气;加热反应时在30℃~70℃下保温反应,优选在50℃~60℃下保温反应2~8h,更优选保温反应4~6h。当hplc检测2-(4-苄氧基苯氧基)乙醛≤0.5%时反应结束。反应结束后,先经减压蒸馏除甲醇或增添甲醇使反应体系总体积或总重量达到预设值,再降温至0℃~5℃析晶。
33.第一催化剂为盐酸、硫酸、磷酸、醋酸、氨基磺酸、三氯化铝、氯化锌之一,优选盐酸。采用适量甲醇洗涤固形物,洗涤后真空干燥。
34.第二步、在惰性气体保护下,于四氢呋喃中,先降温并将1-酰胺基-2-(4-苄氧基苯氧基)乙醛、三氯化铝、硼氢化钠混合,再升温回流反应;反应结束后,减压蒸馏脱除四氢呋喃,加入水并以盐酸调节ph至3~4,以萃取溶剂进行萃取,收集有机相并洗涤,经减压蒸馏脱除溶剂后获得r-(+)-2-(4-苄氧基苯氧基)丙酰胺(ⅲ);其中,1-酰胺基-2-(4-苄氧基苯氧基)乙醛、硼氢化钠、三氯化铝的当量比为1:(1.2~1.5):(1.5~2.0),优选1:(1.3~1.4):(1.6~1.8)。
35.具体而言,惰性气体为氮气;先将1-酰胺基-2-(4-苄氧基苯氧基)乙醛加至四氢呋喃,降温至0℃~10℃,分批加入三氯化铝,降温至-5℃~0℃,分批加入硼氢化钠,在-5℃~0℃保温2~6h,之后升温至回流反应10~20h(优选15~18h);当hplc检测1-酰胺基-2-(4-苄氧基苯氧基)乙醛≤0.5%时反应结束;萃取溶剂为二氯甲烷,萃取至少3次;洗涤时依次采用3%盐酸、饱和食盐水洗涤。
36.第三步、在甲醇中加入r-(+)-2-(4-苄氧基苯氧基)丙酰胺、钯碳,在氢气氛下加压加热反应,反应结束后过滤,将滤液减压浓缩获得r-(+)-2-(4-羟基苯氧基)丙酰胺(ⅳ);其中,r-(+)-2-(4-苄氧基苯氧基)丙酰胺、钯碳的当量比为1:(0.005~0.05),优选1:(0.01~0.02)。
37.具体而言,反应前先以氮气置换至少3次,再以氢气置换至少3次;反应时控制氢气压力为0.1~0.5mpa(优选0.2~0.3mpa),在40℃~70℃下保温反应4~8小时,优选在50℃-60℃下保温反应5~6小时;当hplc检测r-(+)-2-(4-苄氧基苯氧基)丙酰胺≤0.5%时反应结束;反应结束后先降温并以氮气置换至少3次再过滤。
38.第四步、在惰性气体保护下,将r-(+)-2-(4-羟基苯氧基)丙酰胺加至甲醇中,加入第二催化剂后升温,滴加酸性甲醇溶液后保温反应;反应结束后过滤,将滤液降温后,抽滤并洗涤固形物,干燥后获得r-(+)-2-(4-羟基苯氧基)丙酸甲酯(
ⅴ
);其中,r-(+)-2-(4-羟基苯氧基)丙酰胺、酸性甲醇溶液所含氢离子、第二催化剂的当量比为1:(1.4~1.6):(0.01~0.02)。
39.具体而言,惰性气体为氮气;第二催化剂为三苯基膦、三对苯甲基膦、三间基苯基膦、二苯基甲氧基膦、二甲基苯基磷之一,优选三苯基膦;加入第二催化剂后升温至30℃~70℃,优选50℃~60℃;酸性甲醇溶液为氯化氢甲醇溶液、溴化氢甲醇溶液、硫酸甲醇溶液、多聚磷酸甲醇溶液之一,优选氯化氢甲醇溶液;滴加酸性甲醇溶液后30℃~70℃保温反应5~20h,优选50℃~60℃保温反应10~12h;当hplc检测r-(+)-2-(4-羟基苯氧基)丙酰胺≤0.5%时反应结束;反应结束后,若温度大于50℃则降温至40℃~50℃过滤,若温度小于或等于50℃则直接过滤;将滤液降温至0℃~5℃后抽滤;抽滤后采用甲醇洗涤固形物并真空干燥。
40.下面结合实施例对本发明作进一步详细描述。但是本发明不限于所给出的例子。
41.实施例1本实施例的具体反应过程如下:第一步、1-酰胺基-2-(4-苄氧基苯氧基)乙醛的制备:氮气保护下,将2-(4-苄氧基苯氧基)乙醛:243g(1.0mol)投入到甲醇:1215g中,加入多聚甲醛:103.6g(1.15mol),氯化铵:80.2g(1.5mol),搅拌下加入36%盐酸:12g,升温至
50℃~60℃保温反应10~12h,中控2-(4-苄氧基苯氧基)乙醛≤0.5%(hplc),反应结束,减压蒸出部分甲醇,定溶体系总重:1000g,降温至0~5℃析晶,抽滤,少量甲醇漂洗,真空干燥得到1-酰胺基-2-(4-苄氧基苯氧基)乙醛:274g(hplc:99.2%,收率:96%)。
42.1-酰胺基-2-(4-苄氧基苯氧基)乙醛的核磁氢谱1h nmr如图2所示,1h nmr(90hz,cdcl3),δ=5.16(s,2h,ch2),5.50(d,1h,ch),6.99(d,2h,arh),7.01(d,2h,arh),7.21(s,2h,nh2),7.32(m,1h,arh),7.40(m,2h,arh),7.48(m,2h,arh),9.72(d,1h,cho)。
43.第二步、r-(+)-2-(4-苄氧基苯氧基)丙酰胺的制备:氮气保护下,将1-酰胺基-2-(4-苄氧基苯氧基)乙醛:274g(0.96mol)投入到四氢呋喃:820g中,降温至0℃~10℃,分批加入三氯化铝:242.16g(1.6mol)。三氯化铝加完,降温至-5℃~0℃,分批加入硼氢化钠:49g(1.3mol),加完在-5℃~0℃保温2~6h,升温至回流反应15~18h,取样中控1-酰胺基-2-(4-苄氧基苯氧基)乙醛≤0.5%(hplc)。反应结束,减压蒸出四氢呋喃,向残余液中加水:1000g,用36%盐酸调节ph=3~4,用二氯甲烷500ml
×
3萃取三次,合并有机相,分别用3%盐酸:150ml洗涤,饱和食盐水150ml洗涤,减压脱溶得到r-(+)-2-(4-苄氧基苯氧基)丙酰胺:239.7g(hplc:99.0%,收率:92%)。
44.r-(+)-2-(4-苄氧基苯氧基)丙酰胺的核磁氢谱1h nmr如图3所示,1h nmr(90hz,cdcl3),δ=1.54(d,3h,ch3),4.78(q,1h,ch),5.16(s,2h,ch2),6.99(q,2h,arh),7.01(d,2h,arh),7.21(s,2h,nh2),7.32(m,1h,arh),7.40(m,2h,arh),7.48(m,2h,arh)。
45.第三步、r-(+)-2-(4-羟基苯氧基)丙酰胺的制备:将r-(+)-2-(4-苄氧基苯氧基)丙酰胺:239g(0.88mol)投入到高压釜中,加入甲醇:1200g、钯碳:3.6g,氮气置换三次,氢气置换三次,控制氢气压力:0.2~0.3mpa,升温至50℃~60℃,保温反应5~6h,中控r-(+)-2-(4-苄氧基苯氧基)丙酰胺≤0.5%(hplc),反应结束,降温,氮气置换三次,过滤,滤液减压浓缩得r-(+)-2-(4-羟基苯氧基)丙酰胺:155g(hplc:99.5%,收率:97%)。
46.r-(+)-2-(4-羟基苯氧基)丙酰胺的核磁氢谱1h nmr如图4所示,1h nmr(90hz,cdcl3),δ=1.54(d,3h,ch3),4.78(q,1h,ch),6.82(d,2h,arh),7.11(d,2h,arh),7.21(s,2h,nh2),9.08(s,1h,oh)。
47.第四步、r-(+)-2-(4-羟基苯氧基)丙酸甲酯的制备:将r-(+)-2-(4-羟基苯氧基)丙酰胺:155g(0.85mol)加入到甲醇:775g中,加入三苯基膦:3.4g(0.013mol),氮气置换三次,升温至50℃~60℃,缓慢滴加20%氯化氢甲醇溶液:233.6g(含氯化氢:1.28mol),滴加完毕,50℃~60℃搅拌反应10~12h,取样中控分析r-(+)-2-(4-羟基苯氧基)丙酰胺≤0.5%(hplc),反应结束,降温至40℃~50℃过滤,回收氯化铵:42.8g(干重)。滤液继续降温至0℃~5℃,在0℃~5℃保温析晶1h,抽滤,滤饼用甲醇:50g漂洗,滤饼真空干燥得r-(+)-2-(4-羟基苯氧基)丙酸甲酯:155.2g(hplc:99.4%,收率:92.1%)。
48.r-(+)-2-(4-羟基苯氧基)丙酸甲酯的核磁氢谱1h nmr如图5所示,1h nmr(90hz,cdcl3),δ=1.62(d,3h,ch3),3.70(s,3h,ch3),4.89(m,1h,ch),6.82(d,2h,arh),7.11(d,2h,arh),9.08(s,1h,oh)。
49.以上各步骤中的中控分析方法均为:高效液相hplc:agilent c18色谱柱(5μm,250
×
4.6mm);流动相:0.1% h3po4:甲醇(80:20);检测波长:280nm;流速:1.0ml/min;柱温:60
℃;进样量:10μl。
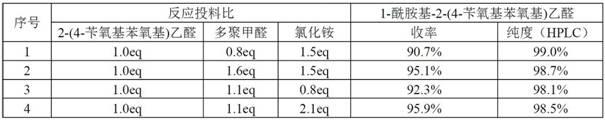
50.对比例11-酰胺基-2-(4-苄氧基苯氧基)乙醛的制备(按照实施例1的第一步操作),具体数据见表1:表1:不同投料比下制备1-酰胺基-2-(4-苄氧基苯氧基)乙醛分析数据对比例2r-(+)-2-(4-苄氧基苯氧基)丙酰胺的制备(按照实施例1中第二步操作),具体数据见表2:表2:不同投料比下制备r-(+)-2-(4-苄氧基苯氧基)丙酰胺分析数据对比例3r-(+)-2-(4-羟基苯氧基)丙酰胺的制备(按照实施例1中第三步操作),具体数据见表3:表3:不同投料比下制备r-(+)-2-(4-羟基苯氧基)丙酰胺分析数据对比例4r-(+)-2-(4-羟基苯氧基)丙酸甲酯的制备(按照实施例1中第四步操作),具体数据见表4:表4:不同投料比下制备r-(+)-2-(4-羟基苯氧基)丙酸甲酯分析数据除上述实施例外,本发明还可以有其他实施方式。凡采用等同替换或等效变换形成的技术方案,均落在本发明要求的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1