用于鉴定水稻Pik座位多个稻瘟病抗性等位基因的功能标记组、引物组合及其应用
用于鉴定水稻pik座位多个稻瘟病抗性等位基因的功能标记组、引物组合及其应用
技术领域
1.本发明涉及分子生物学技术领域,具体涉及一种用于鉴定水稻pik座位多个稻瘟病抗性等位基因的功能标记组、引物组合及其应用。
背景技术:
2.水稻是世界上非常重要的粮食作物之一。由稻梨孢(pyricularia oryzae cav)引起的稻瘟病是迄今为止世界上最具有杀伤力的水稻病害,全世界因水稻稻瘟病造成的水稻每年平均减少产量约10%-30%,严重时达40%-50%,更甚的是颗粒无收。到今天为止,这种病在生产上还不能完全得到适当的控制,伴随着温室效应加剧全球气候开始变暖,水稻稻瘟病害的爆发向不可收拾的趋势发展;因此筛选抗稻瘟病的优良品种,从源头上控制稻瘟病的发生非常重要。关于稻瘟病抗性品种的筛选主要是进行人工接种鉴定或自然诱发鉴定,方法原始,机制不够明确,人工接种的方法进行稻瘟病抗性鉴定,鉴定的周期比较长,病原菌生理小种滞后,利用自然诱发鉴定方法又存在病原菌分布不均匀,年度间抗性差异大等问题。所以利用分子标记辅助选择的方法提高品种的稻瘟病抗性有重要的应用价值。
3.目前已经克隆多个水稻抗稻瘟病基因,如pizt,pi9,pigm,pi2,pik,pi21,pi54等。稻瘟病抗性基因的克隆为稻瘟病的分子标记辅助育种提供了重要的基础,促进了稻瘟病抗性品种的培育从基于人工接种鉴定的传统育种方法到基于分子标记辅助选择的分子育种方法的过渡。
4.pik座位的抗性基因是目前在育种中应用效果较好的抗性基因座。该座位包含7个抗性等位基因,即pi1、pikm_ts、piks、pika、pik、pikp、pi7。这些抗性基因有不同的抗性效应,有的抗性等位基因已经失去了育种应用价值。所以准确的鉴定不同的抗性等位基因有重要的育种应用价值。
5.已经有专利文献和文章报道过pik座位抗性基因的分子标记鉴定方法,但这些分子标记大都只考虑了抗病品种和感病品种pik基因间的序列差异,但并不能区分不同抗性等位基因间的差异。
技术实现要素:
6.本发明在不同稻瘟病抗病等位基因及感病基因间进行了多序列比对,从中筛选出了可以用于区分pik座位不同等位基因的snp/indel位点,在此基础上开发了可用于pik座位抗感基因区分,以及不同抗性等位基因区分的功能标记组,用这些用功能标记组可以准确区分不同的抗性等位基因,有重要育种应用价值。基于此,本发明要求保护如下技术方案:
7.本发明的第一方面,保护一种用于鉴定水稻pik座位多个稻瘟病抗性等位基因的功能标记组,所述功能标记组为kasp功能标记组,包括功能标记mpik1、mpik2、mpik3、 mpik4、mpik5,所述稻瘟病抗性等位基因包括pi1、pikm_ts、piks、pika、pik、pikp 和pi7,标
记mpik1、mpik2、mpik3、mpik4、mpik5中snp/indel位点基因型与等位基因的对应关系如下表所示:
[0008] mpik1mpik2mpik3mpik4mpik5pi1taatttpikm_tstaatatpikstaatacpikacaagatpiktaatatpikpcgcgacpi7caagac
[0009]
所述snp/indel位点的具体位置如下表中所示:
[0010]
标记编号分子标记类型物理位置差异碱基mpik_1snppi1基因序列的第2040位[t/c]mpik_2snppi1基因序列的第8824位[aa/gc]mpik_3indelpi1基因序列的第489位[gc/t]mpik_4indelpi1基因序列的第11284位[t/aa]mpik_5snppi1基因序列的第5419位[t/c]
[0011]
注:表中所述pi1基因的核苷酸序列如seq id no.16所示。
[0012]
本发明的第二方面,保护用于检测上述的功能标记组的成套的kasp引物组,由如下(1)-(5)组成:
[0013]
(1)用于检测mpik1的kasp引物组:引物1、引物2和引物3,所述引物1为自5’端到3’端依次为标签序列a和序列表中序列1的第22-44位的单链dna,所述引物2为自5’端到3’端依次为标签序列b和序列表中序列2的第22-44位的单链dna,所述引物 3为核苷酸序列如序列表中序列3所示的单链dna;
[0014]
(2)用于检测mpik2的kasp引物组:引物4、引物5和引物6,所述引物4为自5’端到3’端依次为标签序列a和序列表中序列4的第22-44位的单链dna,所述引物5为自5’端到3’端依次为标签序列b和序列表中序列5的第22-41位的单链dna,所述引物 6为核苷酸序列如序列表中序列6所示的单链dna;
[0015]
(3)用于检测mpik3的kasp引物组:引物7、引物8和引物9,所述引物7为自5’端到3’端依次为标签序列a和序列表中序列7的第22-42位的单链dna,所述引物8为自5’端到3’端依次为标签序列b和序列表中序列8的第22-41位的单链dna,所述引物 9为核苷酸序列如序列表中序列9所示的单链dna;
[0016]
(4)用于检测mpik4的kasp引物组:引物10、引物11和引物12,所述引物10为自 5’端到3’端依次为标签序列a和序列表中序列10的第22-46位的单链dna,所述引物 11为自5’端到3’端依次为标签序列b和序列表中序列11的第22-46位的单链dna,所述引物12为核苷酸序列如序列表中序列12所示的单链dna;
[0017]
(5)用于检测mpik5的kasp引物组:引物13、引物14和引物15,所述引物13为自 5’端到3’端依次为标签序列a和序列表中序列13的第22-42位的单链dna,所述引物 14为自5’端到3’端依次为标签序列b和序列表中序列14的第22-40位的单链dna,所述引物15为核苷
酸序列如序列表中序列15所示的单链dna。
[0018]
优选地,所述标签序列a为fam荧光标签序列,所述标签序列b为hex荧光标签序列。
[0019]
优选地,所述引物1-15的序列依次如序列表中seq id no.1~15所示。
[0020]
本发明的第三方面,保护上述的功能标记组在鉴定或者辅助鉴定水稻pik座位的稻瘟病抗性等位基因类型或者在水稻分子标记辅助育种中的应用。
[0021]
本发明的第四方面,保护上述的kasp引物组在鉴定或者辅助鉴定水稻pik座位的稻瘟病抗性等位基因类型或者在水稻分子标记辅助育种中的应用。
[0022]
本发明的第五方面,保护一种鉴定水稻pik座位多个稻瘟病抗性等位基因的方法,包括如下步骤:
[0023]
1)提取待测水稻样品的基因组dna;
[0024]
2)使用权利要求3所述的引物组合对提取的基因组dna进行pcr扩增,检测扩增产物中的kasp功能标记组中的snp/indel差异位点,每个标记单独扩增,根据权利要求 1中的表中功能标记mpik1、mpik2、mpik3、mpik4、mpik5中snp/indel位点基因型与等位基因的对应关系来判断待测样品的pik座位稻瘟病抗性等位基因为pi1、pikm_ts、 piks、pika、pik、pikp、pi7中的哪一种。
[0025]
在所述方法中,采用前述的引物组合进行pcr扩增,采用荧光检测仪检测扩增产物,根据荧光信号判断功能标记mpik1、mpik2、mpik3、mpik4、mpik5中差异位点基因型,对应关系为下表所示:
[0026][0027]
pcr反应体系为10ul的体系:含1.0ul 10
×
parms buffer,1.0ul dntp,每组kasp 引物的3条引物各1.0ul,每条引物的浓度为4mol
·
l-1
,0.2ul parms pcr酶,30~50ng/ul 的模板dna1.0ul,3.8ul ddh2o。
[0028]
pcr反应程序为:94℃5min;94℃30s,58℃30s,72℃45s,35个循环;最后 72℃延伸10min。
[0029]
本发明的有益效果是:
[0030]
通过在不同抗病等位基因及感病基因间进行多序列比对,从中筛选出可以用于区分 pik座位不同等位基因的snp位点,在此基础上成功开发了可用于pik座位抗感基因区分,以及不同抗性等位基因区分的功能标记组。用这些功能标记组可以准确区分不同的抗
性等位基因,有重要育种应用价值。
[0031]
本发明建立的基于功能标记组的鉴定方法可以实现对不同的抗性等位基因进行准确的鉴定。在此基础上可对不同的抗性等位基因进行系统评估,筛选出效应更强,能在育种中发挥重要作用的抗性等位基因;本发明开发的功能标记组还可以直接利用分子标记辅助选择的方法将抗性等位基因迅速导入优良育种材料中;本发明的功能标记组和鉴定方法可以大大加快抗性等位基因鉴定,加快育种进程。
附图说明
[0032]
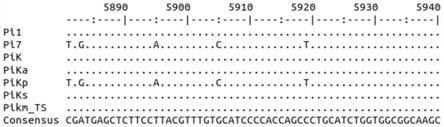
图1是7个不同抗性等位基因序列比对部分结果。
[0033]
图2是13份水稻育种材料的kasp标记检测结果图。
[0034]
图3是208份水稻种质资源的kasp标记检测结果图。
具体实施方式
[0035]
下面结合实施例对本发明作进一步说明,但并不因此而限制本发明。
[0036]
下述实施例中的实验方法,如无特别说明,均为常规方法。
[0037]
实施例1
[0038]
(1)不同等位基因间的序列比对及特征snp/indel的获得
[0039]
利用不同抗性等位基因的基因组序列进行序列比对。不同的抗病等位基因及其 genbank登录号为pi1(hq606329)、pikm_ts(ab462256)、piks(hq662329)、 pika(ab616659)、pik(hm048900)、pikp(hm035360)、pi7(hq660231)。相应的水稻品种日本晴的等位基因作为感病等位基因的对照。7个不同抗性等位基因序列比对部分结果如图1所示。
[0040]
pik座位的抗性等位基因由两个串联的基因构成,分别为pik-1和pik-2。其中pik-1 有3个外显子,pik-2有2个外显子。为了使变异位点能反映更多的功能信息,进一步利用不同等位基因的外显子序列进行序列对比。
[0041]
序列对比后,根据基因序列及外显子序列对比的结果(表1)选择可以鉴定不同等位基因的特征变异序列,用于进一步的分子标记开发。
[0042]
表1.可以区分不同抗性等位基因的特征变异序列
[0043]
[0044][0045]
注:表1中,1)whole:pik不同等位基因序列比对,1_cds2、1_cds3:pik-1第2、3外显子多序列比对; 2_cds2:pik-2第2外显子多序列比对;
[0046]
2)var_s,var_e:序列比对文件中包含变异的起、止位置;
[0047]
3)r200,l200:变异序列的上、下游200bp位置,用于提取部分序列进行标记开发。
[0048]
在上述分析的基础上,进一步选择表1中比对编号从10到13的序列比对结果中的 snp/indel位点进行kasp标记开发,其中两个分子标记的靶标序列来自外显子的序列变异。
[0049]
(2)特征snp/indel的kasp功能标记开发
[0050]
在获得上述特征变异序列的基础上,进一步进行不同抗性等位基因间的序列比对,根据序列比对结果筛选出用于鉴定不同抗性等位基因的snp/indel位点。取snp/indel位点侧翼200bp的序列进行kasp标记的引物设计。最终获得的功能标记组见表2。
[0051]
表2.用于pik座位不同等位基因区分的功能标记组
[0052]
比对文件
1)
pi1pikm_tspikspikapikpikppi7s
2)
kasp标记piflag17_260tttctccno_hitmpik1piflag14_217aaaaaaaaaagcaano_hitmpik2piflag16_197tttgtggno_hitmpik3piflag15_201taaaaaano_hitmpik4piflag16_215ttcttccno_hitmpik5
[0053]
注:1)piflag17_260:表示多序列比对文件piflag17中第260位的snp/indel,其余比对文件的含义类推;
[0054]
2)no_hit:日本晴基因组中无同源序列。
[0055]
对表2中的snp/indel位点设计kasp标记专用引物,每组kasp引物包括包括2 条位点特异引物和1条共用引物,在其中一条特异引物的5’端加有fam荧光标签序列,在另一条特异引物的5’端加有hex荧光标签序列,引物序列如表3中所示(引物1-15 的序列分别如序列表中seq id no.1~15所示):
[0056]
表3.kasp标记专用引物
[0057]
[0058][0059]
注:表中下划线部分为荧光标签序列。
[0060]
(3)基于功能标记组的抗性等位基因鉴定
[0061]
取水稻叶片利用ctab法或其它dna提取方法进行dna提取,得到用于pcr扩增的模板dna。
[0062]
pcr扩增及pcr产物检测:合成功能标记组中的引物,对得到的模板dna进行pcr 扩增,扩增条件为:10ul的反应体系:含1.0ul 10
×
parms buffer,1.0ul dntp,每组 kasp引物的3条引物(每条引物浓度4mol
·
l-1
)各1.0ul,0.2ul gttaq(parms pcr 酶,武汉市景肽生物技术有限公司,货号是no53278),1.0ul模板dna(50ng/ul), 3.8ul ddh2o。pcr反应程序为:94℃5min;94℃30s,58℃30s,72℃45s,35 个循环;最后72℃延伸10min。采用fam和hex作为报告荧光,以及rox作为参比荧光,扩增产物可在具有这3种荧光检测通道的酶标仪以及定量pcr仪中进行快速检测。
[0063]
基因型鉴定:将检测的荧光信号转换为表2中的功能标记组中的snp/indel位点的核苷酸,荧光信号与snp/indel位点基因型的对应关系如表4中所示,功能标记位点基因型和pik座位等位基因对应关系如表5中所示。根据检测得到的5个标记的功能标记组的基因型鉴定结果确定样品的稻瘟病抗性基因具体是pi1、pikm_ts、piks、pika、pik、pikp、 pi7中的哪一个等位基因,当待测样品基因组dna分别用mpik1、mpik2、mpik3、mpik4、 mpik5标记检测时,根据表4将kasp标记分析时产生的荧光信号转换为snp/indel位点的核苷酸信息;综合5个分子标记检测结果,根据表5判断其对应的等位基因型。snp/indel 位点的具体位置如表6所示。
[0064]
表4.荧光信号和snp/indel位点基因型数据转换表
[0065][0066]
表5.功能标记位点基因型和pik座位等位基因对应表
[0067]
基因型mpik1mpik2mpik3mpik4mpik5pi1taatttpikm_tstaatatpikstaatacpikacaagatpiktaatatpikpcgcgacpi7caagacs
‑‑‑‑‑
[0068]
表6.差异位点位置
[0069]
标记编号分子标记类型物理位置
1)
差异碱基mpik_1snppi1基因序列的第2040位[t/c]mpik_2snppi1基因序列的第8824位[aa/gc]mpik_3indelpi1基因序列的第489位[gc/t]mpik_4indelpi1基因序列的第11284位[t/aa]mpik_5snppi1基因序列的第5419位[t/c]
[0070]
注:1):pi1基因的编码序列为hq606329:2660-14748,具体核苷酸序列如seq id no.16所示。
[0071]
按照上述方法对13份水稻重要育种材料的pik功能标记组鉴定,kasp标记检测结果图如图2所示,pik座位等位基因检测结果如表7中所示。
[0072]
表7. 13份水稻育种材料pik座位等位基因检测结果
[0073]
水稻材料名称mpik-1mpik-2mpik-3mpik-4mpik-5等位基因中花11caagacpi7azucena
‑‑‑‑‑
sirgc127742
‑‑‑‑‑
sirgc127652caagacpi7
26r
‑‑‑‑‑
s空育131caatatpika王恢1号caagacpi7恢927caagacpi7r498caagacpi7r280caagacpi7ir64caagacpi7n22caaga-pi7稻花香2号taagacpiks
[0074]
注:表中“等位基因”列的结果s代表该水稻品种为感稻瘟病品种。
[0075]
表7的检测结果与已知的各水稻品种对应的等位基因类型相符合,验证了采用本发明的kasp功能标记组对水稻进行pik座位稻瘟病抗性基因分型准确可靠。
[0076]
实施例2、208份水稻资源的pik功能标记组鉴定
[0077]
按照实施例1中的方法鉴定208份水稻资源的pik功能标记组,kasp标记检测结果图如图3所示,pik座位等位基因检测结果如表8中所示,表中s代表感病,r代表抗病;部分水稻材料的基因组dna利用本发明的5个标记,检测为pik座位的感病等位基因,但是其表型为抗性,可能是由于这些材料含有pik座位之外的稻瘟病抗性基因。
[0078]
表8. 208份水稻育种材料pik座位等位基因检测结果
[0079]
[0080]
[0081]
[0082]
[0083]
[0084]
[0085]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1