预测黑色素瘤患者对免疫疗法敏感性的生物标志物、应用和装置的制作方法
1.本发明涉及分子生物学领域,特别是涉及一种预测黑色素瘤患者对免疫疗法敏感性的生物标志物、应用和装置。
背景技术:
2.晚期黑色素瘤经典的治疗手段为靶向治疗、化疗和/或放疗。然而随着治疗进程的发展,癌细胞终将适应并逐渐发展出相应的耐药抗性。免疫检查点抑制剂(immune checkpoint inhibitors,icis)带来了晚期黑色素瘤治疗的极大变革,然而,仅有部分黑色素瘤患者能获益于这种治疗方法,因此亟需有效的生物标志物预测临床获益人群。目前临床上常见的免疫治疗疗效预测生物标志物包括tmb和pd-l1,已展现出一定的预测效力,然而依然存在很多的局限。
3.pd-l1作为免疫治疗生物标志物应用最为广泛。pd-l1是一种表达于细胞膜表面的蛋白,由人体cd274基因编码。通过与cd8
+
t细胞上的pd-1及b7.1结合,传导免疫抑制信号,抑制效应t细胞。临床上通过免疫组化方法对手术或穿刺后取得的肿瘤组织进行切片染色,镜下观察根据着色深浅来评价表达情况。通常pd-l1蛋白高表达的实体瘤患者,对免疫治疗应答率更高。但是,pd-l1检测由于不同抗pd-(l)1药物都有各自对应的pd-(l)1检测抗体和平台,导致缺乏统一的标准;另外pd-l1的表达具有动态变化的特点,导致pd-l1表达与免疫治疗效果之间的关系仍有一些争议。
4.tmb全称“肿瘤突变负荷”(tumor mutational burden),是获得nccn指南推荐的免疫治疗生物标志物(biomarker)。通过全外显子组测序(wes)或大基因panel(如msk-impact、foundation one等)对肿瘤组织或外周血游离肿瘤dna(ctdna)的全部或特定基因编码区进行深度测序,并通过一定的生物信息学变异识别软件,计算得到每mb基因区域内发生体细胞突变的个数。多个独立临床研究表明,在包括黑色素瘤、肺癌及结肠腺癌在内的多个癌种中,tmb与免疫治疗疗效存在显著的正相关关系。然而,tmb检测对技术平台要求较高,工作周期较长,并且测序成本高昂。
技术实现要素:
5.基于此,有必要提供一种预测黑色素瘤患者对免疫疗法敏感性的生物标志物,以快速且准确地预测黑色素瘤免疫疗法的疗效。
6.此外,还提供一种该生物标志物在制备预测黑色素瘤患者对免疫检查点抑制剂疗法敏感性或制备预测肿瘤突变负荷程度的试剂或试剂盒中的应用、装置、计算机设备和可读存储介质。
7.一种预测黑色素瘤患者对免疫疗法敏感性的生物标志物,包括突变型herc1基因。
8.上述预测黑色素瘤患者对免疫疗法敏感性的生物标志物,包括突变型herc1基因,该基因的突变与tmb值存在显著相关性,能够作为新的生物标志物预测黑色素瘤患者对免
疫疗法敏感性,能够快速筛选免疫疗法的获益人群且准确率高,节约检测成本,扩大识别能从免疫疗法中获益的黑色素瘤患者的人群覆盖度,对黑色素瘤患者的治疗具有重要的意义。
9.上述生物标志物在制备预测黑色素瘤患者对免疫检查点抑制剂疗法敏感性或制备预测肿瘤突变负荷程度的产品中的应用。
10.检测上述生物标志物的试剂在制备预测黑色素瘤患者对免疫检查点抑制剂疗法敏感性或制备预测肿瘤突变负荷程度的产品中的应用。
11.在其中一个实施例中,免疫检查点包括pd-1、pd-l1和ctla4中的至少一种。
12.在其中一个实施例中,上述产品用于核酸水平或蛋白水平的检测。
13.在其中一个实施例中,上述产品包括用于执行以下任一种方法的试剂:
14.聚合酶链反应、变性梯度凝胶电泳、核酸测序法、核酸分型芯片检测、变性高效液相色谱法、原位杂交、高分辨率熔解法以及氨基酸测序法。
15.在其中一个实施例中,上述产品还包括样品的处理试剂,上述样品的处理试剂包括样品裂解试剂、样品纯化试剂以及样品核酸提取试剂中的至少一种。
16.一种用于预测黑色素瘤患者对免疫检查点抑制剂疗法敏感性的装置,包括:
17.数据获取模块,用于获取受试者的herc1基因的突变情况;
18.输出预测模块,用于根据受试者的herc1基因的突变情况,输出该受试者对免疫疗法敏感性的预测结果。
19.在其中一个实施例中,上述根据受试者的herc1基因的突变情况,输出该受试者对免疫检查点抑制剂疗法敏感性的预测结果包括:
20.若herc1基因中存在非同义突变的目标位点,预测该受试者对免疫检查点抑制剂疗法敏感;否则,预测该受试者对免疫检查点抑制剂疗法不敏感。
21.一种计算机设备,具有处理器和存储器,该存储器上存储有计算机程序,该处理器执行所述计算机程序时实现预测黑色素瘤患者对免疫疗法敏感性的全部步骤,所述步骤包括:
22.获取受试者的herc1基因的突变情况;
23.根据受试者的herc1基因的突变情况,输出该受试者对免疫疗法敏感性的预测结果。
24.一种计算机存储介质,其上存储有计算机程序,该计算机程序被执行时实现预测黑色素瘤患者对免疫疗法敏感性的全部步骤,所述步骤包括:
25.获取受试者的herc1基因的突变情况;
26.根据受试者的herc1基因的突变情况,输出该受试者对免疫疗法敏感性的预测结果。
附图说明
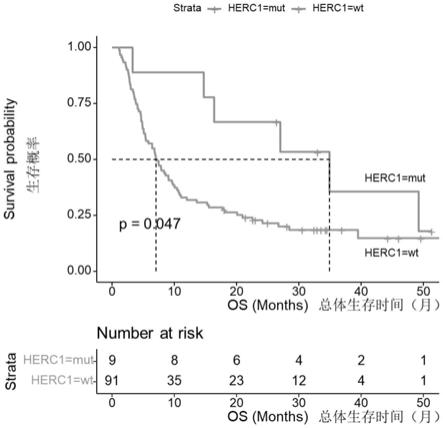
27.图1为根据患者的基因突变分组绘制的生存曲线;
28.图2为多因素回归分析得到的各指标对应的风险比率;
29.图3为统计herc1基因突变与tmb的关系得到的箱线图。
具体实施方式
30.为使本发明的上述目的、特征和优点能够更加明显易懂,下面对本发明的具体实施方式做详细的说明。在下面的描述中阐述了很多具体细节以便于充分理解本发明。但是本发明能够以很多不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似改进,因此本发明不受下面公开的具体实施例的限制。
31.除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。
32.本文所述的术语“标志物”指要用作分析患者实验样品的靶标的分子。所述的“免疫检查点”是指免疫系统中存在的一些抑制性信号通路。机体在正常情况下,免疫检查点可以通过调节自身免疫反应的强度来维持免疫耐受,然而机体在受到肿瘤侵袭时,免疫检查点的激活会抑制自身免疫,有利于肿瘤细胞的生长和逃逸。通过使用免疫检查点抑制剂,可以恢复机体正常的抗肿瘤免疫反应,从而控制和清除肿瘤。所述的“肿瘤突变负荷”是指肿瘤基因组去除胚系突变后的体细胞突变数量,定义为每百万碱基中被检测出的体细胞基因编码错误、碱基替换、基因插入或缺失错误的总数,即定量单位为“mutations/mb”。
33.所述的“非同义突变”是指可导致多肽产物的氨基酸序列改变或功能性rna碱基序列改变的基因突变。所述的“错义突变”是指编码某种氨基酸的密码子经碱基替换以后,变成编码另一种氨基酸的密码子,从而使多肽链的氨基酸种类和序列发生改变。所述的“框内插入突变”是指三个或三的倍数的碱基插入导致的突变,使基因增加一个或几个氨基酸。所述的“框内缺失突变”是指三个或三的倍数的碱基缺失导致的突变,使基因丢失一个或几个氨基酸。所述的“无义突变”是指由于某个碱基的改变使代表某种氨基酸的密码子突变为终止密码子,从而使肽链合成提前终止。所述的“移码突变”是指dna分子由于某位点碱基的缺失或插入,引起阅读框变化,造成下游的一系列密码改变,使原来编码某种肽链的基因变成编码另一种完全不同的肽链序列。所述的“剪切位点突变”是指dna转录成rna后,去掉内含子的过程中,内含子与外显子的连接区域碱基序列为外显子+gt+内含子+ag时,gt...ag某一位点发生突变,造成的剪切异常。所述的“hazard ratio”是风险比率,风险率(hazard rate)是单位时间内发生的事件数占被试总体的百分比。而风险比率(hazard ratio)是两个风险率的比值。在生存分析中,hazard ratio是一个解释变量的两个水平所描述的条件所对应的hazard rate的比值。风险比率反映了两个风险率之间的差别,这种差别是由各种外生变量引起的,比如干预类型的不同(比如用药或者不用药)、性别的影响(男性或者女性)等等。
34.所述的“探针”是利用核苷酸碱基顺序互补的原理,与被测定的靶序列互补,以检测被测靶序列的一小段单链dna或者rna片段(20bp~500bp)。所述的“引物”是指寡核苷酸,无论其是在经纯化的限制性消化物中天然存在或是合成产生的,所述寡核苷酸当置于诱导与核酸链互补的引物延伸产物合成的条件下时(例如,存在核苷酸和诱导剂诸如dna聚合酶和在合适的温度和ph下),所述寡核苷酸能够作为合成的起始点而起作用。
35.本技术一实施方式提供了一种预测黑色素瘤患者对免疫疗法敏感性的生物标志物,包括突变型herc1基因。
36.上述预测黑色素瘤患者对免疫疗法敏感性的生物标志物,包括突变型herc1基因,
该基因的突变与tmb值存在显著相关性,能够作为新的生物标志物预测黑色素瘤患者对免疫疗法敏感性,能够快速筛选免疫疗法的获益人群且准确率高,节约检测成本,扩大识别能从免疫疗法中获益的黑色素瘤患者的人群覆盖度,对黑色素瘤患者的治疗具有重要的意义。
37.在其中一个实施例中,上述突变型herc1基因的突变类型为在体细胞上基因组上发生的非同义突变,包括错义突变、框内插入突变、框内缺失突变、无义突变、移码突变和剪切位点突变中的至少一种。
38.在其中一个实施例中,上述突变型herc1基因的突变位点包括但不限于以下位点中的至少一个:herc1基因的p.g3682e、p.s2422f、p.t4807i、p.v374a、p.s463f、p.h1447y、p.p216l、p.t22a和p.l1148f位点。
39.本技术一实施方式还提供了一种上述生物标志物在制备预测黑色素瘤患者对免疫检查点抑制剂疗法敏感性或制备预测肿瘤突变负荷程度的产品中的应用。
40.本技术一实施方式还提供了一种检测上述生物标志物的试剂在制备预测黑色素瘤患者对免疫检查点抑制剂疗法敏感性或制备预测肿瘤突变负荷程度的产品中的应用。
41.在其中一个实施例中,检测上述生物标志物的试剂包括特异性识别herc1基因的探针、特异性扩增herc1基因的引物和特异性结合herc1基因编码的蛋白的结合剂中的至少一种。
42.在其中一个实施例中,免疫检查点包括pd-1、pd-l1和ctla4中的至少一种。
43.在其中一个实施例中,上述产品用于核酸水平或蛋白水平的检测。herc1基因是一种能够编码蛋白质的基因,因而其基因的突变通常也会表现在转录水平和翻译水平上,本领域技术人员可以从dna水平直接检测或从rna和蛋白水平对其突变进行检测以间接反映其是否发生突变,这些都可以应用于本发明。
44.核酸水平(dna或rna水平)的检测剂可选用本领域技术人员所公知的试剂,例如能够与该dna或rna杂交的寡核苷酸探针。在一些实施例中,采用分子反向探针(molecular inversion probes,mip)技术设计的探针集合在染色体上的具体坐标(以grch37为参考基因组)如表1所示,参考的herc1基因序列的ncbi登录号为nm_003922。表1中的序列是通过mipgen设计出,评分均在88分以上,所有探针可同时使用,覆盖herc1基因的编码区,也可以针对某一位点单独使用某一探针。可以理解的是,在其他实施例中,可以采用其他能够检测herc1基因序列的探针或引物。并且本领域技术人员也容易想到将mrna反转录成cdna后对cdna进行检测,这些技术手段的常规置换不超出本发明的保护范围。
45.表1
46.47.[0048][0049]
注:表1中“坐标”列的内容的具体含义:例如,“chr15:63901354-63901515/16,29/+”是指,探针的序列为15号染色体正链上从63901354~63901369的共16个碱基的延伸(extension)序列,以及从63901487~63901515的共29个碱基的连接(ligation)序列;“chr15:63901276-63901437/16,24/
‑”
是指,探针的序列为15号染色体负链上从63901422~63901437的共16个碱基的延伸(extension)序列,以及从63901276~63901299的共24个碱基的连接(ligation)序列。表1中其他探针序列的表示方法与上述例子原理相同。
[0050]
在其中一个实施例中,上述产品包括用于执行以下任一种方法的试剂:聚合酶链
反应、变性梯度凝胶电泳、核酸测序法、核酸分型芯片检测、变性高效液相色谱法、原位杂交、高分辨率熔解法以及氨基酸测序法。上述方法用于在核酸水平或蛋白水平检测herc1基因的突变情况,可以理解的是,能够实现该目的的方法都可以采用,且上述产品包括用于执行这些方法的试剂。
[0051]
具体地,聚合酶链反应选自限制性片段长度多态性法、单链构象多态性法、taqman探针法、竞争性等位基因特异性pcr和等位基因特异性pcr中的至少一种。
[0052]
核酸测序法可以为转录组测序或基因组测序。在一些实施例中,上述核酸测序法是高通量测序,也称作二代测序(ngs)。可用的ngs的测序平台包括但不限于roche/454flx、illumina/solexa genomeanalyzer和applied biosystems solid system等。在其他一些实施例中,也可以采用sanger测序(一代测序)或三代测序进行基因组测序。在基因组测序中,判断目标基因是否发生突变的标准可以是,当测序平均深度达至500x以上时至少有5x携带了突变信号。转录组测序也可以通过二代测序平台快速全面地获得某一物种特定细胞或组织在某一状态下的几乎所有的转录本及基因序列,可以用于研究基因表达量、基因功能、结构、可变剪接和新转录本预测等。
[0053]
在其中一个实施例中,上述产品还包括样品的处理试剂,上述样品的处理试剂包括样品裂解试剂、样品纯化试剂以及样品核酸提取试剂中的至少一种。
[0054]
在一些实施例中,样品裂解试剂包括去污剂和盐。去污剂的作用是使蛋白质变性、破坏膜结构和去除与核酸相互作用的蛋白质;盐的作用是提供合适的裂解环境、抑制核酸酶对核酸的降解以及维持核酸结构稳定。在一个可选的具体示例中,去污剂选自sds、triton x-100、np-40和tween 20中的一种。在一个可选的具体示例中,盐选自tris、edta和nacl中的至少一种。在其他一些实施例中,样品裂解试剂包括硫氰酸胍。
[0055]
在一些实施例中,样品纯化试剂包括dna纯化试剂、rna纯化试剂或蛋白纯化试剂。样品纯化是为了保证后续实验不受杂质干扰以及防止目标样品被降解。
[0056]
在一些实施方式中,所述样品选自黑色素瘤患者的血液、血清、血浆、脑脊髓液、组织或组织裂解液、细胞培养上清、精液以及唾液样品中的至少一种。其中,优选的检测样品为血液、血清、血浆,更优选的它们来自外周血。
[0057]
在一些实施方式中,所述组织为黑色素瘤组织或癌旁组织。
[0058]
本技术一实施方式还提供一种用于预测黑色素瘤患者对免疫检查点抑制剂疗法敏感性的方法,该方法包括步骤a1和步骤a2,具体地:
[0059]
步骤a1:获取受试者的herc1基因的突变情况。
[0060]
具体地,可以通过二代测序来获得受试者的herc1基因的突变情况。可以理解的是,在其他实施例中,也可以采用其他方法来获得受试者的herc1基因的突变情况。
[0061]
步骤a2:根据受试者的herc1基因的突变情况,输出该受试者对免疫疗法敏感性的预测结果。
[0062]
在其中一个实施例中,上述根据受试者的herc1基因的突变情况,输出该受试者对免疫检查点抑制剂疗法敏感性的预测结果包括:若herc1基因中存在非同义突变的目标位点,预测该受试者对免疫检查点抑制剂疗法敏感;否则,预测该受试者对免疫检查点抑制剂疗法不敏感。
[0063]
具体地,上述突变型herc1基因的非同义突变的目标位点包括但不限于以下位点
中的至少一个:herc1基因的p.g3682e、p.s2422f、p.t4807i、p.v374a、p.s463f、p.h1447y、p.p216l、p.t22a和p.l1148f位点。
[0064]
基于与上述预测黑色素瘤患者对免疫检查点抑制剂疗法敏感性的方法相同的思想,本技术一实施方式还提供一种用于预测黑色素瘤患者对免疫检查点抑制剂疗法敏感性的装置,包括数据获取模块和输出预测模块。
[0065]
具体地,数据获取模块,用于获取受试者的herc1基因的突变情况。
[0066]
输出预测模块,用于根据受试者的herc1基因的突变情况,输出该受试者对免疫疗法敏感性的预测结果。
[0067]
本发明还提供了一种计算机设备,具有处理器和存储器,该存储器上存储有计算机程序,该处理器执行所述计算机程序时实现预测黑色素瘤患者对免疫疗法敏感性的全部步骤:获取受试者的herc1基因的突变情况;根据受试者的herc1基因的突变情况,输出该受试者对免疫疗法敏感性的预测结果。
[0068]
据此,本发明一实施方式还提供了一种计算机存储介质,其上存储有计算机程序,该计算机程序被执行时实现预测黑色素瘤患者对免疫疗法敏感性的全部步骤,所述步骤包括:获取受试者的herc1基因的突变情况;根据受试者的herc1基因的突变情况,输出该受试者对免疫疗法敏感性的预测结果。
[0069]
本领域普通技术人员可以理解实现上述方法中的全部或部分流程,是可以通过计算机程序来指令相关的硬件来完成,所述的计算机程序可存储于一非易失性的计算机可读取存储介质中,该计算机程序在执行时,可包括如上各方法的实施例的流程。其中,本技术所提供的各实施例中所使用的对存储器、存储、数据库或其他介质的任何引用,均包括非易失性和易失性存储器中的至少一种。非易失性存储器可包括只读存储器(read-only memory,rom)、磁带、软盘、闪存或光存储器等。易失性存储器可包括随机存取存储器(random access memory,ram)或外部高速缓冲存储器。作为说明而非局限,ram可以是多种形式,比如静态随机存取存储器(static random access memory,sram)或动态随机存取存储器(dynamic random access memory,dram)等。
[0070]
本发明的生物标志物突变型herc1基因在预测免疫疗法敏感性和肿瘤突变负荷程度时具有较高的准确率,所以能够以某种可能性或预测值来评估免疫疗法敏感性和肿瘤突变负荷程度。但熟练的技术人员明白,对于多因素造成的疾病,没有生物标志物对该疾病的发生和治疗效果的预测准确率能达到100%。因此,在常规的临床诊断中,通常综合考虑各种临床症状和生物标志物来诊断、治疗和控制潜在的疾病。
[0071]
具体实施例
[0072]
为了说明本发明的生物标志物突变型herc1基因预测黑色素瘤患者对免疫疗法敏感性和肿瘤突变负荷程度的可行性,在此采用100例黑色素瘤患者的数据作为案例分析。
[0073]
实施例1
[0074]
1.数据获取
[0075]
从dfci(dana-farber cancer institute)数据库中获取100例接受免疫检查点抑制剂(依匹木单抗)治疗的皮肤黑色素瘤(skin cutaneous melanoma,skcm)晚期(iv期)患者的数据,其中包括基因突变数据、治疗方案数据和总体生存(overall survival,os)数据,如表2所示。
[0076]
将herc1基因发生体细胞非同义突变(包括错义突变、框内插入突变、框内缺失突变、无义突变、移码突变和剪切位点突变中的至少一种)的样本归为herc1=mut组,其中,样本数为9,具体突变位点为p.g3682e、p.s2422f、p.t4807i、p.v374a、p.s463f、p.h1447y、p.p216l、p.t22a或p.l1148f;将herc1基因未发生任何体细胞非同义突变或仅在herc1基因非编码区存在突变的样本归为herc1=wt组,样本数为91。
[0077]
表2
[0078]
[0079]
[0080][0081]
注:表2中“wt”代表herc1基因无突变,“mut”代表herc1基因存在突变;表2中“os_s”是指overall survival status;“os_s”一列中0代表最后一次随访的时候,病人尚未达到终点(死亡),1代表达到终点。
[0082]
2.生存分析
[0083]
将100例患者的生存数据根据以上分组进行生存分析,绘制生存曲线(又称kaplan-meier曲线),如图1所示,该生存曲线纵坐标为生存概率(survival probability),横坐标为总体生存时间(os),位于上方的曲线代表herc1=mut组的随时间变化的生存概率,位于下方的曲线代表herc1=wt组的随时间变化的生存概率。图1下半部分的“number at risk”表上对应的数字是生存曲线上在相应时间点的存活人数的具体值。从图1中可以看出,突变型herc1基因与免疫治疗的总体生存(os)的延长密切相关,herc1=mut组相对于herc1=wt组的免疫治疗效果更优(p《0.05)。
[0084]
3.多因素分析
[0085]
除了herc1基因的突变情况,同时将获取的临床信息指标(性别和年龄)纳入分析,开展多因素回归分析,得到各指标对应的风险比率(hazard ratio),结果如图2所示。从图2中可知,herc1=mut组的hr(hazard ratio)值为0.41(置信区间为0.18~0.95),p=0.038,说明其可作为独立因素用来预测黑色素瘤患者对免疫治疗的敏感性。
[0086]
4.分析herc1基因突变与tmb的关系
[0087]
将突变频率大于或等于10mutations/mb的样本定义为tmb-high,即肿瘤突变负荷高,否则定义为tmb-low,即肿瘤突变负荷低。将所有样本进行tmb检测,将检测结果与herc1基因突变情况对应分析。分析结果如表3和图3所示。
[0088]
表3
[0089]
分组tmb-hightmb-lowtmb-high比例herc1=wt335836.3%herc1=mut8188.9%
[0090]
图3是herc1基因突变与tmb的关系的箱线图,表3是herc1基因突变与tmb的关系的统计结果,结合图3和表3可以看出,herc1=mut组的tmb-high比例为88.9%,而herc1=wt组的tmb-high比例为36.3%,herc1=mut组的tmb-high比例远高于herc1=wt组(p=0.001),说明herc1基因突变与tmb具有显著的相关性,可用herc1基因的突变情况来预测tmb情况。
[0091]
综上,携带herc1基因突变的晚期黑色素瘤患者应答免疫治疗的概率较高,其突变状态可能是一个可用于预测黑色素瘤免疫治疗效果的分子亚型分类标志物。
[0092]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0093]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。应当理解的是,在本领域技术人员在本发明提供的技术方案的基础上,通过合乎逻辑的分析、推理或有限的试验得到的技术方案,均在本发明所附权利要求的保护范围内。因此,本发明专利的保护范围应以所附权利要求为准,说明书及附图可以用于解释权利要求的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1