一种CHO细胞蛋白表达系统用表达载体及CHO细胞的筛选方法与流程
一种cho细胞蛋白表达系统用表达载体及cho细胞的筛选方法
技术领域
1.本发明属于重组蛋白筛选系统的构建领域,具体涉及一种cho细胞蛋白表达系统用表达载体及cho细胞的筛选方法。
背景技术:
2.当前,在庞大的医药市场中,生物制药仍是一个快速增长的领域,其中重组蛋白表现出高增长和庞大的市场占有量,重组蛋白的特异性及高表达量在临床应用中具有重要意义,加上未来良好的应用前景,给早期的药物研发过程带来了巨大压力。中国仓鼠卵巢(cho)细胞仍然是生产重组蛋白药物的首选哺乳动物系统,如何快速地寻找到能够稳定并大量分泌正确重组蛋白的细胞系变得尤为重要。传统的细胞筛选通常采用有限稀释法或细胞分选法,工作量大、耗时长,比如筛选1000个细胞往往需要8周以上,最终可能获得一个好的克隆;此外,在挑选克隆时,传统的方法容易对细胞造成机械损伤,使得克隆成活率明显下降。目前生产企业通常使用半固体培基法进行单克隆筛选。通过半固体培养法挑取独立的单克隆,不需要进行多次的亚克隆和单克隆,缩短了制备周期,避免了阳性克隆的丢失,从而可以短时间内制备大容量多样性的重组蛋白。
3.前期有学者利用流式分选法联合半固体培养基的方法,具体方法是细胞生长在半固体培养基中,形成单克隆细胞团,同时将抗体分泌在细胞团周围,半固体培养基中含有荧光标记的二抗,能与抗体的fc片段发生特异性结合,当用一定波长的光激发时即可发出荧光。接着使用图像分析系统对单克隆细胞团的大小、荧光强度进行测定,从而筛选出生长旺盛、表达量高的单克隆细胞团(caron aw,nicolas c,gaillet b,et al.fluorescent labeling in semi-solid medium for selection of mammalian cells secreting high-levels of recombinant proteins.bmc biotechnol,2009,9:42.)。然而,这种筛选策略虽然有一定的效果,但是在筛选过程中,使用了抗体,价格昂贵,不适合普通的实验室或生产企业规模化推广应用。还有学者开发的clone pix system筛选方法,是一种基于荧光检测技术但无需表达载体自身产生荧光,可以在短时间内挑选大量克隆,有效避免了人工筛选细胞的弊端,加上细胞处于半固体培养基中,挑选过程较为柔和,增加了细胞存活率,明显提高了工作效率。然而,这种技术开发的半固体培养基,价格极其昂贵,货期较长,配方保密,加上国外的物流成本较高,使得其实际应用时受到诸多限制。
4.公布号cn106190948a的中国发明专利申请公开了一种cho-s细胞半固体培养基及其配制方法与应用,该发明公开了半固体培养基的配方,虽然能用于细胞培养,无法基于此种培养基进行筛选,并且仅能适用于cho-s细胞;此外,cd forticho培养基仍为进口产品,价格不菲,使得该方法的实际应用度不高。目前,基于半固体培养基的cho细胞重组蛋白筛选方面尚不十分理想。
技术实现要素:
5.本发明的目的是提供一种cho细胞蛋白表达系统用表达载体,可以应用到cho细胞
蛋白表达系统中,以荧光强弱来指示上游目的基因的表达,方便克隆细胞株的筛选。
6.本发明的第二个目的是提供一种蛋白表达系统中cho细胞的筛选方法,解决现有克隆筛选方法存在的筛选周期长、容易对细胞造成机械伤害等问题。
7.为了实现以上目的,本发明所采用的技术方案是:
8.一种cho细胞蛋白表达系统用表达载体,所述表达载体含有启动子、f2a序列和poly a序列,在所述f2a序列的上游插入有目的基因,下游插入有荧光标记和筛选标记融合基因;所述f2a序列的核苷酸序列如seq id no:1所示。
9.本发明的上述表达载体,下游荧光标记基因的表达与上游目的基因的表达呈正相关,可利用荧光显微镜直观观察荧光标记基因的表达量,进而可以通过荧光强度强弱确定生长旺盛、表达量高的细胞株,利用半固体培养基更能方便该类细胞株的克隆筛选。
10.优选地,所述启动子的上游插入有ucoe元件,所述目的基因插入在所述启动子的下游;所述启动子为cmv启动子。
11.优选地,poly a序列的下游插入有mar元件,poly a序列的上游插入所述荧光标记和筛选标记融合基因。
12.为进一步实现稳定转染细胞株的筛选,优选地,所述荧光标记为rfp基因。所述筛选标记为杀稻瘟菌素抗性基因,其核苷酸序列如seq id no:4所示。
13.优选地,所述目的基因编码分泌蛋白。进一步优选地,所述目的基因为seap基因或egfp基因;seap基因的核苷酸序列如seq id no:7所示,egfp基因的核苷酸序列如seq id no:5所示。
14.一种蛋白表达系统中cho细胞的筛选方法,包括以下步骤:
15.(1)将上述表达载体转染cho细胞;
16.(2)使用半固体培养基对步骤(1)转染后的cho细胞进行培养,观察荧光标记基因的表达,根据荧光强弱筛选细胞株。
17.本发明的用于蛋白表达系统中cho细胞的筛选方法,在f2a序列的上下游分别插入目的基因和荧光标记基因,载体转染cho细胞后,放置于半固体培养基中培养,根据荧光标记基因(rfp)的荧光强弱,即可在半固体培养基中挑选出生长旺盛、表达量高的细胞株。试验证实,下游标记基因的荧光强弱可用来指示上游目的基因的表达(即下游标记基因的荧光强度与上游目的基因表达量呈正相关),利用该方法既能缩短细胞克隆的筛选周期,又能减少实验成本,同时也保留了半固体培养基筛选单克隆细胞株的优势。
18.cho细胞可以为cho-s、cho-k1、dg44细胞或cho的任何细胞类型。
19.为更好的促进cho细胞的生长,降低适用于克隆筛选的半固体培养基成本,优选地,步骤(2)中,所述半固体培养基为添加有甲基纤维素及胎牛血清的dmem高糖培养基,其中甲基纤维素的质量终浓度为3~7%,胎牛血清的体积终浓度为5~10%。
20.进一步优选地,甲基纤维素的质量终浓度为5~7%,胎牛血清的体积终浓度为5~10%。
附图说明
21.图1为本发明实施例中表达载体(pcmv-egfp-ires-luc)的物理图谱;
22.图2为本发明实施例中表达载体(pcmv-egfp-f2a-luc)的物理图谱;
wpre-f2a-rfp-blasticidin-polya-mar的重组载体。其中,wpre、ucoe、mar、luc元件的核苷酸序列分别如seq id no:10-13所示。
41.实施例1双顺反子表达载体的构建
42.本实施例的cho细胞蛋白表达系统用表达载体,名称为pcmv-egfp-f2a-rfp-blasticidin重组质粒,其结构为ucoe-启动子-egfp-wpre-f2a-rfp-blasticidin-polya-mar。f2a基因的核苷酸序列如seq id no:1所示。egfp基因的核苷酸序列如seq id no:5所示。rfp基因的核苷酸序列如seq id no:3所示。筛选标记基因(blasticidin)的核苷酸序列如seq id no:4所示。
43.本实施例的重组载体的构建过程如下:
44.1、pcmv-egfp-f2a-luc、pcmv-egfp-e2a-luc表达载体的构建
45.1.1、pcmv-egfp-f2a-luc表达载体的构建
46.1)合成f2a序列
47.设计并人工合成f2a序列(如seq id no:1所示),具体交由通用生物基因(安徽)有限公司完成。
48.为便于克隆及保证序列完整性,合成f2a序列时,5'端引入agcatgcat序列,其中agc为保护碱基,atgcat为nsii酶切位点;3
′
端引入cccggg ata,其中ata为酶切保护碱基,cccggg为xmai酶切位点。
49.2)构建pcmv-egfp-f2a-luc表达载体
50.用nsii/xmai双酶切合成的f2a序列,同时用nsii/xmai双酶切pcmv-egfp-ires-luc质粒dna(pcmv-egfp-ires-luc质粒图谱如图1所示)。琼脂糖凝胶电泳鉴定酶切结果,凝胶回收酶切后的f2a序列片段和pcmv-egfp-ires-luc线性质粒dna。
51.合成f2a序列的双酶切体系为:合成f2a序列10μl(1μg/μl),10
×
neb buffer 2.1 3μl,nsii/xmai(10u/μl)各0.5μl,补足水至30μl,酶切条件为:37℃,酶切3min。
52.pcmv-egfp-ires-luc质粒的双酶切体系为:pcmv-egfp-ires-luc质粒5μl(1μg/μl),10
×
neb buffer 2.1 2μl,nsii/i/xmai(10u/μl)各0.5μl,补足水至20μl;酶切条件为:37℃,酶切3min。
53.取酶切后的f2a序列片段和pcmv-egfp-ires-luc线性质粒dna(摩尔比5:1),使用neb公司的连接试剂盒,25℃连接5min。将连接产物加入到dh5α感受态细胞悬液中转化,取150μl转化菌液接种到含有氨苄青霉素的lb平板上,37℃培养过夜,挑取单菌落继代培养。提取重组质粒进行双酶切(nsii/i/xmai)验证,验证正确的质粒,进行测序验证,构建正确的质粒命名为pcmv-egfp-f2a-luc(质粒图谱如图2所示)。
54.1.2、pcmv-egfp-e2a-luc表达载体的构建
55.1)合成e2a序列
56.设计并人工合成e2a序列(如seq id no:2所示),具体交由通用生物基因(安徽)有限公司完成。
57.为便于克隆及保证序列完整性,合成e2a序列时,5'端引入agc atgcat序列,其中agc为保护碱基,atgcat为nsii酶切位点;3
′
端引入cccggg ata,其中ata为酶切保护碱基,cccggg为xmai酶切位点。
58.2)构建pcmv-egfp-e2a-luc表达载体
p110μmol/l1.00.4μmol/lp210μmol/l1.00.4μmol/l10
×
pcr buffer 2.51
×
dntp25μmol/l2.0200μmol/l模板dna100ng/μl1.04.0ng/μltaq酶5u/μl0.50.1u/μl
77.pcr条件如下:95℃3min,94℃40s,60-56℃30s,72℃40s,每个退火温度4个循环,最后55℃,30个循环,72℃3min。琼脂糖凝胶电泳回收扩增产物,送生物公司测序验证,结果表明,扩增出的dna片段与genbank公开的seap序列完全一致。
78.2、pcmv-seap-f2a-rfp-blasticdin载体的构建
79.用kpni/nhei双酶切seap序列的pcr扩增产物(经测序验证正确的序列),同时用kpni/nhei双酶切pcmv-egfp-f2a-rfp-blasticidin质粒,采用常规的酶切方法,37℃、3h。琼脂糖凝胶电泳鉴定酶切结果,凝胶回收seap序列片段和pcmv-egfp-f2a-rfp-blasticidin线形质粒;酶切回收后的seap片段及pcmv-egfp-f2a-rfp-blasticidin线性质粒dna按5:1(摩尔比)进行连接,16℃连接过夜;然后将连接产物加入到dh5α感受态细胞悬液中,进行转化,将200μl菌液接种在含有氨苄青霉素lb平板上,37℃培养过夜,挑取单菌落继代培养,并进行重组质粒的双酶切(kpni/nhei)验证,选取酶切验证正确的质粒,进行测序验证,将目的基因序列完全正确的载体命名为pcmv-seap-f2a-rfp-blasticidin(质粒图谱如图8所示)。
80.实施例3
81.本实施例的蛋白表达系统中cho细胞的筛选方法,包括以下步骤:
82.1、含seap的表达载体转染cho-s细胞
83.选择生长状态良好的cho-s细胞接种到24孔培养板上,待铺板密度达到约80%时进行转染。具体操作步骤如下:12μl lipofectamine2000添加到300μl无血清dmem/f12培养基中,在37℃孵箱中静置5min(即lipofectamine2000混合液);将300μl无血清的dmem/f12培养基与4.8μg表达载体(pcmv-seap-f2a-rfp-blasticdin)混合,37℃孵箱中静置5min(即表达载体混合液);将上述lipofectamine2000混合液和表达载体混合液再次混合,37℃孵箱中静置20min;同时用pbs将24孔培养板上的细胞清洗三遍,加入300μl含10%血清的dmem/f12完全培养基。然后,将脂质体与各组质粒dna的混合液轻轻滴入孔中,尽快轻轻摇晃培养平板使其混匀;放入5%co2的细胞培养箱中,37℃培养4~6小时后,再更换一次完全培养基,放入细胞培养箱内继续培养。
84.2、半固体培养基培养及荧光筛选
85.2.1、半固体培养基配制
[0086]2×
h-dmem,供应商hyclone,货号sh30045.04。甲基纤维素,供应商sigma,货号m0512-500g,在20℃下,2%的该甲基纤维素黏度为4000cps。
[0087]
称量h-dmem培养基,加入超纯水,充分搅拌溶解,0.22μm滤膜过滤除菌得到2
×
h-dmem培养基。准确称量甲基纤维素加入去离子水中,在52℃的水浴锅中轻轻晃动容器,使甲基纤维素均匀溶解在去离子水中,400rpm磁力搅拌器皿充分搅拌60min使其充分溶解,121℃高压灭菌20min,待降为室温后,放入4℃冰箱保存备用(2
×
甲基纤维素溶液)。
[0088]
细胞间超净工作台里,在50ml无菌离心管中,加入40ml的2
×
h-dmem培养基,再加入10ml胎牛血清,接着加入400μl的浓度为2.5mg/ml的杀稻瘟菌素溶液。然后加入50ml2
×
甲基纤维素溶液(按照1:1的体积比)混合,4℃条件下600rpm磁力搅拌器搅拌过夜。将配制好的半固体培养基在-20℃冰箱保存备用。
[0089]
采用上述方法配制的半固体培养基为含质量终浓度5%甲基纤维素、体积终浓度10%胎牛血清的dmem高糖培养基。
[0090]
2.2、基于半固体培养基的cho细胞中稳定筛选系统的建立
[0091]
从-20℃冰箱取出配制的半固体培养基,4℃过夜,使其溶解完全。在超净工作台,选择6孔板进行铺板,同时取3个50ml无菌离心管,在50ml无菌离心管中,3种配方的半固体培养基各加15ml,接着分别加入3000~12000个细胞(即每个孔500~2000个细胞),再次混合均匀,取2ml混合物到每个孔中(避免产生气泡,并且平铺)。最后放入恒温培养箱(36.5℃,5%co2)培养5天。
[0092]
2.3、荧光筛选
[0093]
将在半固体培养基中生长5天的细胞克隆,根据荧光强弱挑选13个克隆,放置到dmem/f12完全培养基中继续扩大培养,达到一定数量后(50万/毫升),使用无血清培养基悬浮培养7天。收取上清液并裂解细胞,分别采用western blot技术和碱性磷酸酶试剂盒验证rfp和seap的表达量。
[0094]
实施例4
[0095]
本实施例的蛋白表达系统中cho细胞的筛选方法,与实施例3基本相同,区别仅在于,半固体培养基中,甲基纤维素的质量分数为7%。
[0096]
实施例5
[0097]
本实施例的蛋白表达系统中cho细胞的筛选方法,与实施例3基本相同,区别仅在于,半固体培养基中,甲基纤维素的质量分数为3%。
[0098]
试验例1 egfp和rfp在cho细胞中瞬时表达的效果检测
[0099]
选择生长状态良好的cho-s细胞接种到6孔培养板上,待铺板密度达到约80%时进行转染。具体操作步骤如下:将10μl lipofectamine2000添加到240μl无血清dmem/f12培养基中,在37℃孵箱中静置5min,将无血清的dmem/f12培养基分别与250μl(5μg)表达载体(pcmv-egfp-f2a-rfp,pcmv-egfp-e2a-rfp,pcmv-egfp-ires-rfp)混合,37℃孵箱中静置20min;同时用pbs将6孔培养板上的细胞清洗三遍,加入2ml无血清的dmem/f12细胞培养基。然后,将脂质体与各组质粒dna的混合液轻轻滴入孔中,尽快轻轻摇晃培养平板使其混匀;放入5%co2的细胞培养箱中,37℃培养6h后,将无血清的dmem/f12培养基更换成dmem/f12完全培养基,放入细胞培养箱内继续培养。48h后,倒置荧光显微镜下观察egfp和rfp的瞬时表达情况。
[0100]
结果如图9所示,由f2a介导的上下游基因的表达水平明显优于e2a和ires,即f2a介导的egfp和rfp的荧光表达水平较高,更适宜在表达重组蛋白方面应用。
[0101]
试验例2不同半固体培养基的培养效果比较
[0102]
对比实施例5、4、3,步骤2.2中培养5天后在荧光显微镜下观察rfp的表达,图10、图11、图12分别对应甲基纤维素用量3%、7%、5%。
[0103]
结果显示,5%甲基纤维素浓度的配方下,细胞存活率高,且荧光更易观察(图12)。
[0104]
试验例3 seap在基于半固体培养基的cho细胞中稳定筛选中的效果检测
[0105]
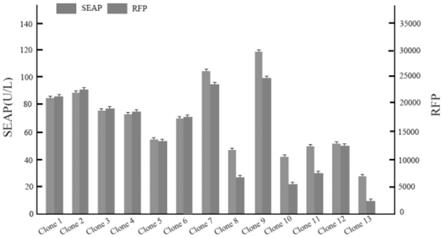
按实施例3的方法,将在半固体培养基中生长5天的细胞克隆,根据荧光强弱挑选13个克隆,放置到dmem/f12完全培养基中继续扩大培养(图13),达到一定数量后(50万/毫升),使用无血清培养基悬浮培养7天。收取上清液并裂解细胞,分别采用western blot技术和碱性磷酸酶试剂盒验证rfp和seap的表达量。
[0106]
结果如图14和图15所示。结果显示:下游基因rfp的表达可以用来指示上游基因seap的表达(图14,图15)。
[0107]
以上试验数据表明:本发明建立的这种基于半固体培养基的cho细胞重组蛋白筛选系统有利于在短时间内筛选高效表达的单克隆细胞株,获得了较好的效果,适于重组蛋白筛选系统的快速建立。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1