莪术醇类衍生物、制备方法及其在制备抗炎药物中的应用
1.本发明涉及药物技术领域,具体来说涉及莪术醇类衍生物、制备方法及其在制备抗炎药物中的应用。
背景技术:
2.炎症是具有血管系统的活体组织对各种损伤因子的刺激所发生的以防御反应为主的病理生理过程,参与多种疾病(如心血管疾病、骨质疏松、糖尿病、自身免疫性疾病、动脉粥样硬化、神经退行性疾病等)的发生发展。目前,抗炎药物在临床治疗中是仅次于抗感染药物的第二大类药物,临床使用的抗炎药物主要包括非甾体类抗炎药和甾体类抗炎药,但都会出现不同程度的不良反应,如非甾体类抗炎药对胃肠道的刺激和肾脏损害、糖皮质激素类药可能诱发或加重感染等。
3.传统中药是开发抗炎药物的重要资源,因此从传统中药中寻找具有抗炎活性前体,通过结构优化,对发现新抗炎药物具有重要意义。莪术为姜科植物蓬莪术,广西莪术和温郁金的干燥根茎,其中莪术油为莪术中提取的挥发油,是莪术的主要有效成分,有较好的抗肿瘤、抗炎、抗病毒作用。报道莪术油可用于急性糜烂性食管炎、慢性萎缩性胃炎、轮状病毒肠炎有很好的疗效。莪术醇是莪术油的主要成分之一,可能是一种潜在的对各种炎症介质产生的抑制活性的新型抗炎药物的先导化合物。
技术实现要素:
4.有鉴于此,本发明以莪术醇为前体,设计合成莪术醇类衍生物,以期发现高效抗炎活性化学实体,为进一步以莪术油为原料制备抗炎药物提供了新的选择。
5.本发明的技术方案如下:
6.一方面,本发明莪术醇类衍生物的结构式如式i和式ii所示:
[0007][0008]
其中,r独立地选自卤素,r1独立地选自-oh。
[0009]
进一步优选的,所述式i莪术醇类衍生物的结构式如下:
[0010][0011]
另一方面,本发明还提供了上述莪术醇类衍生物的制备方法,包括以下步骤:以间氯过氧苯甲酸为氧化剂,室温条件下对莪术醇双键发生环氧化反应;将反应产物溶解在异丙醇中,以氢氧化钠为碱,加热回流,得到中间体莪术醇单醇(im,intermediate);
[0012][0013]
以莪术醇单醇为前体,在碱性条件下进行酯化反应,得到莪术醇酯类衍生物。
[0014][0015]
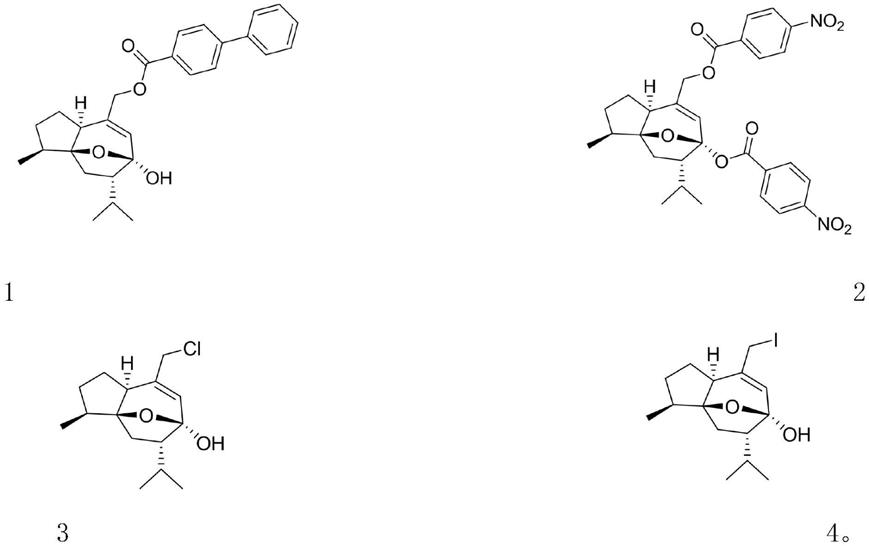
优选的,所述酯化反应的取代基为以莪术醇单醇(im)为前体,进行酯化,得到单酯衍生物(1)及双酯类衍生物(2),结构式如下:
[0016][0017]
本领域技术人员可根据酯化反应的反应物特性选择合适的反应条件及催化剂,如溶剂可选的为n,n-二甲基甲酰胺、二氯甲烷,催化剂可选的为4-二甲氨基吡啶、碘化钾。
[0018]
作为一种实施方式,以莪术醇单醇为前体,在三苯基膦的催化下,进行卤素取代反应,得到莪术醇卤素取代衍生物。
[0019][0020]
优选的,所述卤素反应的反应物为ncs(n-氯代丁二酰亚胺)及nis(n-碘代丁二酰亚胺),在三苯基膦的催化下,以中间体(im)为前体,进行卤素取代反应,得到氯取代衍生物(3)及碘取代衍生物(4),结构式如下:
[0021][0022]
作为一种实施方式,本发明将莪术醇溶于干燥的丙酮和氢溴酸混合溶液中,加热回流,得到式ii所示卓同类衍生物。
[0023][0024]
优选的,所述丙酮和氢溴酸混合溶液先用无水硫酸钠干燥,再加入五氧化二磷深度除水。
[0025]
再一方面,本发明还提供了上述莪术醇类衍生物在制备抗炎药物中的应用。
nmr(150mhz,acetone-d6)δ:165.39(c-1
′
),145.53(c-5
′
),139.67(c-8
′
),138.17(c-8),129.99(c-10
′
and c-12
′
),129.11(c-2
′
),129.04(c-9
′
and c-13
′
),128.28(c-7),128.21(c-11
′
),127.13(c-4
′
and c-6
′
),127.07(c-3
′
and c-7
′
),103.01(c-6),85.93(c-3a),65.90(c-9),59.14(c-5),49.64(c-8a),40.07(c-3),36.24(c-4),31.32(c-2),30.80(c-10),27.54(c-1),22.30(c-11),20.96(c-12),11.24(c-13);esi-ms m/z:455.4[m+na]
+
。
[0040]
实施例2
[0041]
莪术醇双酯类衍生物的合成
[0042]
合成中间体im,合成方法同实施例1。
[0043]
将中间体im(50mg,1equiv.)溶解于n,n-二甲基甲酰胺(dmf),依次加入氢化钠(48mg,10equiv.)及催化量碘化钾,室温搅拌15min,随后加入对硝基苯甲酰氯(110mg,3equiv.),室温下搅拌,tlc(5%的硫酸乙醇显色)跟踪至反应完全,加水淬灭,依次用饱和酒石酸,饱和食盐水洗,无水硫酸钠干燥后减压浓缩,经柱色谱(石油醚∶乙酸乙酯=15∶1)分离得43mg白色固体,即为莪术醇双酯类衍生物(2),收率40%。
[0044]1h nmr(600mhz,acetone-d6)δ:8.39(t,j=8.9hz,4h,h-4
′
,h-6
′
and h-4
″
,h-6
″
),8.34
–
8.29(m,4h,h-3
′
,h-7
′
and h-3
″
,h-7
″
),6.35(s,1h,h-7),4.99
–
4.92(m,2h,h-9),1.09(d,j=6.5hz,3h,h-12),1.02(d,j=6.5hz,3h,h-11),0.98(d,j=6.6hz,3h,h-13);
13
c nmr(150mhz,acetone-d6)δ:164.14(c-1
′
),161.43(c-1
″
),150.82(c-5
′
),150.78(c-5
″
),136.54(c-8),135.97(c-2
′
),135.60(c-2
″
),130.85(c-3
′
and c-7
′
),130.76(c-3
″
and c-7
″
),126.27(c-7),123.73(c-4
′
and c-6
′
),123.70(c-4
″
and c-6
″
),106.19(c-6),89.27(c-3a),66.73(c-9),58.33(c-5),49.45(c-8a),39.86(c-3),34.60(c-4),31.05(c-2),30.32(c-10),27.47(c-1),21.93(c-11),21.03(c-12),11.10(c-13);esi-ms m/z:573.3[m+na]
+
。
[0045]
实施例3
[0046]
莪术醇单醇氯取代衍生物的合成
[0047]
合成中间体im,合成方法同实施例1。
[0048]
将中间体im(50mg,1equiv.)溶解于二氯甲烷中,依次加入n-氯代丁二酰亚胺(ncs)(40mg,1.5equiv.)及三苯基膦(pph3)(78mg,1.5equiv.),室温下搅拌,tlc(5%的硫酸乙醇显色)跟踪至反应完全,饱和食盐水洗,无水硫酸钠干燥后减压浓缩,经柱色谱(石油醚∶乙酸乙酯=15∶1)分离得43mg无色透明液体,即为莪术醇单醇氯取代衍生物(3),收率81%。
[0049]1h nmr(600mhz,cdcl3)δ:5.92(s,1h,h-7),4.01(s,2h,h-9),1.03(d,j=6.7hz,3h,h-11),1.00(d,j=6.5hz,3h,h-12),0.89(d,j=6.6hz,3h,h-13);
13
c nmr(150mhz,cdcl3)δ:140.06(c-8),128.75(c-7),103.27(c-6),87.44(c-3α),59.41(c-5),49.33(c-8a),46.65(c-9),40.31(c-3),36.30(c-4),31.09(c-2),30.66(c-10),27.14(c-1),22.65(c-11),21.42(c-12),11.75(c-13);esi-ms m/z:293.7[m+na]
+
。
[0050]
实施例4
[0051]
莪术醇单醇碘取代衍生物的合成
[0052]
合成中间体im,合成方法同实施例1。
[0053]
将中间体im(600mg,1equiv.)溶解于二氯甲烷中,依次加入n-碘代丁二酰亚胺
(nis)(804mg,1.5equiv.)及三苯基膦(pph3)(936mg,1.5equiv.),室温下搅拌,tlc(5%的硫酸乙醇显色)跟踪至反应完全,饱和食盐水洗,无水硫酸钠干燥后减压浓缩,经柱色谱(石油醚∶乙酸乙酯=15∶1)分离得612mg无色透明液体,即为莪术醇单醇碘取代衍生物(4),收率71%。
[0054]1h nmr(600mhz,cdcl3)δ:6.03(s,1h,h-7),3.96(d,j=9.4hz,1h,h-9),3.84(d,j=9.4hz,1h,h-9),1.04(d,j=6.6hz,3h,h-11),1.01(d,j=6.5hz,3h,h-12),0.90(d,j=6.6hz,3h,h-13);
13
c nmr(150mhz,cdcl3)δ:141.77(c-8),127.28(c-7),103.37(c-6),87.23(c-3α),60.03(c-5),49.78(c-8a),40.39(c-3),36.31(c-4),31.16(c-2),30.16(c-10),27.48(c-1),22.74(c-11),21.49(c-12),11.75(c-13),9.30(c-9);esi-ms m/z:385.5[m+na]
+
。
[0055]
实施例5
[0056]
卓同类衍生物的合成
[0057]
在反应瓶中加入30ml丙酮,再加入5ml 40%的氢溴酸溶液,此体系用无水硫酸钠干燥三小时,再加入五氧化二磷深度除水,过滤,得滤液。将100mg莪术醇溶于此滤液中,加热回流,tlc跟踪至反应完全,加入饱和碳酸氢钠溶液中和体系中过量的溴化氢,无水硫酸钠干燥后减压浓缩,经柱色谱(石油醚∶乙酸乙酯=10∶1)分离得35mg白色固体,即为卓同类衍生物(5),收率33%。
[0058]1h nmr(cdcl3,400mhz)δ:7.08(s,1h,h-6),7.00(s,1h,h-9),3.46(hept,j=6.8hz,1h,h-11),3.07(p,j=7.0hz,1h,h-4),2.81(dd,j=16.7,7.7hz,1h,h-2),2.54(dd,j=16.7,11.5hz,1h,h-2),2.22(s,3h,h-14),1.92(m,1h,h-3),1.73(m,1h,h-6),1.17(d,j=3.1hz,3h,h-15),1.16(d,j=3.1hz,3h,h-12or h-13),1.04(d,j=7.1hz,3h,h-12or h-13),0.99(d,j=2.0hz,3h,h-17or h-18),0.98(d,j=2.2hz,3h,h-17or h-18);
13
c nmr(cdcl3,100mhz)δ:185.34(c-8),158.57(c-7),151.83(c-5),144.92(c-1),144.82(c-10),138.84(c-9),130.71(c-6),48.70(c-3),46.66(c-4),38.57(c-2),29.66(c-11),28.30(c-16),25.03(c-14),22.60(c-12),22.41(c-13),21.65(c-17),21.56(c-18),14.22(c-15);esi-ms m/z:281.1[m+na]
+
。
[0059]
实施例6
[0060]
lps诱导的小鼠炎症模型进行抗炎活性评价
[0061]
主要试剂:lps(lipoplysaccharides from escherichia coli o55b5)l2880-500mg,lot#127m4030v,美国sigma公司;mouse il-6elisa试剂盒,美国thermo fisher scientific公司;细胞增殖及毒性检测试剂盒(cck-8),大连美仑生物技术有限公司。
[0062]
1、小鼠原代腹腔巨噬细胞(peritoneal macrophage,pms)的制备及培养:昆明小鼠腹腔注射3%巯基乙酸盐培养基3ml/只,三天后异氟烷将小鼠吸入麻醉致死,放入75%酒精浸泡1-2分钟,超净工作台操作。腹腔注射10ml生理盐水灌洗腹腔,轻柔两分钟,富集腹腔游离细胞,1000rpm/3min离心细胞液,弃上清,适量dmem完全培养基重悬细胞,细胞计数仪计数,调整活细胞密度为1.0
×
106个/ml,以100μl/孔接种于96孔板,置于37℃、5%co2培养箱培养,待2-3h细胞贴壁后进行实验。
[0063]
2、elisa法检测化合物对lps刺激小鼠原代腹腔巨噬细胞释放炎症细胞因子的影响
[0064]
将培养贴壁后的pms进行如下处理:
[0065]
medium组:加入等体积的完全培养基;
[0066]
lps50组(模型组):加入终浓度为50ng/ml的lps;
[0067]
lps50+化合物组:加入终浓度为50ng/ml的lps和终浓度为52.03μmol/l的实施例1-5化合物,继续培养4h。
[0068]
将所收集细胞上清按酶联免疫吸附实验(enzyme linked immunosorbent assay,elisa)试剂盒操作手册检测细胞因子il-6水平,检测方法具体步骤简述如下:
[0069]
(1)包被捕获抗体。取出酶标板,每孔加入100μl稀释后的捕获抗体4℃孵育过夜;
[0070]
(2)活化酶标板。将孵育过夜的酶标板用pbs洗液洗板4次,每孔加入200μl样本稀释液37℃孵育1h;
[0071]
(3)上样。酶标板用pbs洗液洗板4次,每孔加入标准品100μl,以及加入稀释五倍的待测样本,37℃孵育2h,或4℃孵育过夜;
[0072]
(4)检测抗体。酶标板用pbs洗液洗板4次,每孔加入100μl稀释后的检测抗体,37℃孵育1h;
[0073]
(5)avidin-hrp酶。酶标板用pbs洗液洗板4次,每孔加入100μl稀释后的avidin-hrp酶结合工作液,37℃孵育30min;
[0074]
(6)显色。酶标板用pbs洗液洗板5次,每孔加入100μl的tmb显色液,避光显色15min;
[0075]
(7)终止显示。每孔加入100μl终止液,立即测定od
450
吸光值。根据标准品所浓度梯度及od
450
绘制标准曲线,并按照标准曲线公式计算出各样品中il-6浓度。
[0076]
抑制率=[(模型组细胞因子平均含量-化合物处理后细胞因子平均含量)/模型组细胞因子平均含量]
×
100%。
[0077]
3、cck-8法检测化合物对小鼠原代腹腔巨噬细胞活力的影响
[0078]
小鼠原代腹腔巨噬细胞(peritoneal macrophage,pms)的制备及培养同实施例2。
[0079]
将培养贴壁后的pms进行如下处理:
[0080]
medium组,加入等体积的完全培养基;
[0081]
化合物组,加入终浓度为52.03μmol/l的实施例1-5化合物,继续培养4h。
[0082]
弃上清,避光环境下,将cck-8:dmem=1:10进行配制,混匀,每孔加入100μl,另加入不含细胞及化合物的cck-8液3孔,继续孵育1h,立即测定od
450
吸光值。
[0083]
细胞存活率=[(化合物组吸光度值-cck-8液吸光度平均值)/(medium组吸光度平均值-cck-8液吸光度平均值)]
×
100%。
[0084]
用lps刺激小鼠腹腔巨噬细胞后,细胞上清液中释放大量致炎细胞因子il-6,与medium组比较,有显著差异,表明用lps刺激小鼠腹腔巨噬细胞成功建立体外模拟体内炎症模型。当加入化合物后,上清液中致炎细胞因子释放量降低,与模型组比较,有显著差异,表明本发明的化合物能够降低lps刺激小鼠腹腔巨噬细胞上清液中致炎细胞因子的释放量,具有抗炎活性。且本发明的化合物对小鼠原代腹腔巨噬细胞的生长没有影响。
[0085]
表1化合物对炎症细胞因子和细胞活力的影响
[0086][0087][0088]
注:
**
,p《0.01vs medium;p《0.05;p《0.01vs lps50。
[0089]
以上所述的具体实施方式,对本发明的目的、技术方案和有益效果进行了进一步详细说明,所应理解的是,以上所述仅为本发明的具体实施方式而已,并不用于限定本发明的保护范围,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1