E41基因在调控植物胚胎发育中的应用
no.1~5任意一项所示的核苷酸序列编码所得。
10.其中,seq id no.1所示核苷酸序列为e41基因的基因组全长序列,序列长度为3393bp;seq id no.2~5所示核苷酸序列为e41基因不同剪接体编码区的核苷酸序列,序列长度依次为2981bp、2997bp、2983bp、2802bp;编码的氨基酸序列长度依次为803aa、766aa、604aa、570aa。
11.本发明通过研究找到了一个能够影响植物胚胎发育的基因,命名为e41,通过亚细胞定位分析确定其编码的蛋白定位于过氧化物酶体。并且,拟南芥中t-dna插入造成的e41基因突变体植株,仅能获得杂合突变体,且后代植物中野生型和杂合符合1:2分离比。相比野生型,杂合突变体中部分种子发育受到影响,出现干瘪皱缩的表型。表明,e41基因是一个植物过氧化物酶体新蛋白的编码基因,其会影响植物种子的发育。
12.利用上述蛋白可以促进植物胚胎发育,而蛋白活性降低或丧失将影响种子胚胎发育,导致无法得到有活力的种子。
13.进一步地,所述植物为双子叶植物。更进一步地,所述植物为拟南芥。
14.植物因e41基因缺失引起胚胎发育异常,表现为幼嫩种子呈白色透明状,成熟后干瘪皱缩无活力,后代无法得到纯合突变体的植物。本发明研究表明,将e41基因导入胚胎发育异常的植物中,可以得到胚胎发育正常的转基因植物。
15.本发明提供的e41基因在作物育种方面具有潜在的应用价值。
16.在科学研究中,需要构建胚胎发育异常的模式植物,基于e41基因功能缺失导致植物胚胎发育异常这一特点,本发明提供了该基因在构建胚胎发育异常植物模型方面的应用。具体的,利用基因工程技术使植物e41基因的表达降低或不表达。
17.进一步地,所述应用的途径包括:
18.(1)利用基因突变、基因敲除、基因干扰或基因沉默技术导致e41基因的缺失或表达量降低,从而构建胚胎发育异常的植物模型。
19.(2)将e41基因导入受体植株中,培育得到功能获得性的转基因植株;所述受体植株为因缺失e41基因引起胚胎发育异常的植物。
20.更进一步地,所述植物为拟南芥。构建的胚胎发育异常的拟南芥,其胚胎发育迟缓或无法形成胚胎,随着角果成熟逐渐干瘪皱缩。
21.与现有技术相比,本发明具有以下有益效果:
22.(1)本发明首次公开e41基因编码的植物过氧化物酶体新蛋白对胚胎发育的影响,e41基因的突变造成纯合突变体致死性状。
23.(2)本发明为加深过氧化物酶体功能研究及植物胚胎发育等性状的研究和应用提供了新的基因资源及理论指导。
附图说明
24.图1为烟草瞬时表达亚细胞定位图;
25.其中,cfp-pts1为过氧化物酶体marker,e41-yfp、yfp-e41、mvenus-e41.2、mvenus-e41.3和mvenus-e41.4分别为e41主要剪接体蛋白融合在yfp荧光蛋白n端、c端和e41其他三种剪接体蛋白融合在mvenus荧光蛋白c端;bar=10μm。
26.图2为突变体t-dna插入位置示意图;
27.其中,白色框表示utr区域,黑色框表示外显子区域,黑线表示内含子区域。
28.图3为突变体e41-1和e41-2种子性状;
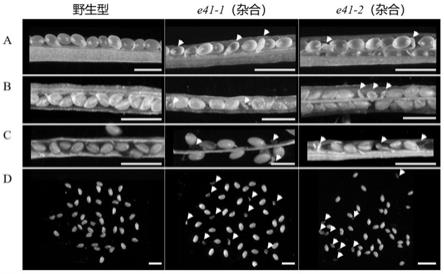
29.其中,a图为幼嫩角果中种子形态,箭头所指为异常的白色透明种子和轻度皱缩的种子;b、c图为成熟过程中种子形态,箭头所指为发育异常,提前发黄皱缩的种子;d图为成熟种子形态,箭头所指为干瘪异常种子;bar=1mm。
30.图4为互补载体的结构示意图;
31.其中,a图为内源启动子启动的e41基因组序列;b图为内源启动子启动的e41编码区序列。
32.图5为阳性苗的t-dna插入检测及基因型鉴定;
33.其中,a图为内源启动子启动的e41编码区序列载体互补株和e41基因组序列载体互补株t-dna插入检测结果;b图为基因型鉴定结果。
具体实施方式
34.为了使本领域技术人员更好地理解本发明方案,下面结合具体实施例对本发明的技术方案进行清楚、完整的描述。应该指出,以下详细说明都是示例性的,且仅仅是本发明一部分的实施例,而不是全部的实施例。
35.基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都应当属于本发明保护的范围。
36.除非另有指明,本文使用的所有技术和科学术语具有与本技术所属技术领域的普通技术人员通常理解的相同含义。本发明实施例中所用的实验材料均为本领域常规的实验材料,均可通过商业渠道购买得到。未注明详细条件的实验方法使按照常规实验方法或按照供应商所建议的操作说明书进行的。
37.实施例1
38.1、e41基因亚细胞定位载体的构建
39.通过改造pcambia1300载体得到带yfp荧光蛋白标签的pcambia1300-yfp载体。根据e41基因主要剪接体(如seq id no.2所示)的cds序列设计引物,以拟南芥cdna为模板,扩增出cds序列。将扩增出的片段连接到yfp的n端或c端。所用引物分别为e41-y-f和e41-y-r、y-e41-f和y-e41-r。
40.引物序列为:
41.e41-y-f:5
’‑
cacgggggactctagaatggcgagaaaagctaacaatagttttttc-3’;
42.e41-y-r:5
’‑
cttgctcaccattgttggatccccgagtcgagcagccaactggttc-3’;
43.y-e41-f:5
’‑
gtacaagagatctgcgtcgactatggcgagaaaagctaacaatagttttttc-3’;
44.y-e41-r:5
’‑
cgatcggggaaattcgagctctcagagtcgagcagccaactggttc-3’;
45.另外,通过改造pearleygate 100载体得到带mvenus荧光蛋白标签的pearleygate100-mvenus载体。根据e41基因非主要剪接体(seq id no.3、seq id no.4、seq id no.5)的cds序列设计引物,以拟南芥cdna为模板,扩增出cds序列;将扩增出的片段连接到yfp的c端;所用引物分别为v-e41.2-f和y-e41.2-r,v-e41.2-f和y-e41.3-r,v-e41.4-f和y-e41.4-r。
46.引物序列为:
47.v-e41.2-f:5
’‑
gacgagctgtacaagtctagaatggcgagaaaagctaacaatag-3’;
48.y-e41.2-r:5
’‑
ggtcttaattaactctctagatcataagatatggcaacacc-3’;
49.v-e41.3-r:5
’‑
ggtcttaattaactctctagatcaaggatacaaaaacatggttgatgcaacc-3’;
50.v-e41.4-f:5
’‑
gacgagctgtacaagtctagaatgattcttcatttgattgagtggg-3’;
51.v-e41.4-r:5
’‑
ggtcttaattaactctctagatcagagtcgagcagccaactggttc-3’。
52.pcr反应条件为:
53.95℃、3min;95℃、15sec,58℃、15min,72℃、2min24sec,35个循环;72℃,5min。
54.采用琼脂糖凝胶电泳回收这两个片段。
55.对于yfp融合在基因c端的载体,用xbai和bamhi双酶切pcambia1300-yfp载体,用同源重组法连接目的片段和线性化载体,得到35s-e41-yfp重组载体;对于yfp融合在基因n端的载体,用sali和saci双酶切pcambia1300-yfp载体,用同源重组法连接目的片段和线性化载体,得到35s-yfp-e41重组载体。对于mvenus融合在基因n端的载体,用xbai酶切pearleygate 100-mvenus载体,用同源重组法连接目的片段和线性化载体,分别得到mvenus-e41.2、mvenus-e41.3和mvenus-e41.4三种重组载体。
56.取1μl重组产物,用冻融法转化到大肠杆菌dh5α中,转化产物涂布到卡那霉素抗性(50μg/ml)的lb培养基。37℃培养过夜,挑单克隆进行提取质粒。构建好的载体经测序验证后保存备用。
57.2、亚细胞定位实验
58.参照试剂盒说明书方法将实施例1中获得的测序正确的载体转化农杆菌。
59.通过农杆菌渗透法将融合表达载体注射到本氏烟草叶片中,同时注射35s-cfp-skl载体作为过氧化物酶体对照,48h后利用激光共聚焦显微镜观察荧光信号。
60.实验结果见图1。yfp蛋白融合在主要剪接体蛋白n端(e41蛋白的过氧化物酶体定位信号肽pts1未被阻挡)或者c端(yfp会挡住过氧化物酶体定位信号肽),均定位到过氧化物酶体;mvenus蛋白融合在e41非主要剪接体蛋白n端,均定位到过氧化物酶体。以上结果均表明e41是过氧化物酶体蛋白。
61.实施例2
62.1、t-dna插入突变体鉴定
63.从arabidopsis biological resource center(abrc,https://abrc.osu.edu/)购买到两种t-dna插入造成的e41突变体,分别记为e41-1和e41-2,t-dna插入位置见图2。
64.用三引物法进行突变体基因型鉴定。引物由t-dna引物设计网站(http://signal.salk.edu/tdnaprimers.2.html)设计。网站设计的引物分别记为e41-1-lp和e41-1-rp、e41-2-lp和e41-2-rp。lb引物为该网站提供的lbb1.3。
65.引物序列为:
66.e41-1-lp:5
’‑
taccagtcacgtgaatcgttg-3’;
67.e41-1-rp:5
’‑
actcttcttccaaaagcctgc-3’;
68.e41-2-lp:5
’‑
gcagacttgtttacgcaaagg-3’;
69.e41-2-rp:5
’‑
gcagacttgtttacgcaaagg-3’;
70.lbb1.3:5
’‑
attttgccgatttcggaac-3’;
71.pcr反应条件为:
72.95℃、3min;95℃、15sec,58℃、15min,72℃、15sec,32个循环;72℃,5min。
73.突变体后代无法得到纯合突变体。
74.对杂合突变体后代进行基因型鉴定,利用适合性卡方检验分析后代野生型和杂合突变体的基因型分离比符合1:2的孟德尔分离定律(表1),说明缺失e41蛋白会影响纯合突变体后代发育。
75.表1、杂合突变体后代分离群体的适合性卡方测验
[0076][0077]
注:χ
20.05
(1)=3.84
[0078]
2、t-dna插入突变体的性状分析
[0079]
如图3所示,打开野生型和突变体发育过程中的角果,观察到突变体中存在发育异常的种子。幼嫩时异常种子呈白色透明状,随着角果成熟种子逐渐干瘪皱缩,最终收获时种子中存在瘦小异常种子。
[0080]
实施例3
[0081]
1、e41互补载体构建和遗传转化实验
[0082]
为了验证t-dna突变体株系无法获得纯合后代的性状缺失是由于e41基因突变后代种子无法顺利发育导致的,而不是由于未知的t-dna插入造成的,构建内源表达e41的载体进行互补。互补载体的结构示意图如图4。
[0083]
内源表达e41的载体由内源启动子(seq id no.10)启动e41基因组序列(seq id no.1)组成以及内源启动子(seq id no.6)启动e41编码区序列(seq id no.2)。先用引物e41-pro-f和e41-pro-r扩增e41的启动子,回收到的目的片段与用hindiii和xbai双酶切的pcambia1300-yfp载体相连,转化大肠杆菌dh5α感受态后,挑单菌落提质粒。构建好的载体经测序验证后保存备用,记为pcambia1300-pro-yfp。
[0084]
以拟南芥基因组dna为模板,用引物e41-g-f和e41-g-r扩增e41的基因组序列,回收到的目的片段与用xbai和sali双酶切的pcambia1300-pro-yfp载体相连,转化大肠杆菌dh5α感受态后,挑单菌落提质粒。构建好的载体经测序验证后保存备用,记为pcambia1300-pro-genomic。
[0085]
以拟南芥逆转录cdna为模板,用引物e41-c-f和e41-c-r扩增e41编码区序列(seq id no.2),回收到的目的片段与用xbai和sali双酶切的pcambia1300-pro-yfp载体相连,转化大肠杆菌dh5α感受态后,挑单菌落提质粒。构建好的载体经测序验证后保存备用,记为pcambia1300-pro-cdna。
[0086]
参照试剂盒说明书方法将测序正确的载体转化农杆菌。
[0087]
用花序侵染法将农杆菌转入e41-1突变体,得到t0代转基因种子。
[0088]
pcr反应条件为:95℃、3min;95℃、15sec,58℃、15min,72℃、15sec,32个循环;72℃,5min。
[0089]
引物序列为:
[0090]
e41-pro-f:5
’‑
acgacggccagtgccaagcttaacttcaaatttaatgaggcctcctc-3’;
[0091]
e41-pro-r:5
’‑
accattgttggatcctctagaggatccctttaatacaactaattcag-3’;
[0092]
e41-g-f:5
’‑
gtattaaagggatcctctagaatggcgagaaaagctaacaatag-3’;
[0093]
e41-g-r:5
’‑
ggccgctacactcgagtcgaccctgattcgtttcttaccctttcaa-3’;
[0094]
e41-c-f:5
’‑
gtattaaagggatcctctagaatggcgagaaaagctaacaatag-3’;
[0095]
e41-c-r:5
’‑
ggccgctacactcgagtcgaccctgattcgtttcttaccctttcaa-3’。
[0096]
2、互补转基因阳性苗的筛选和鉴定
[0097]
将t0代转基因种子播种在含潮霉素(50μg/ml)抗性的1/2ms培养基中进行筛选,在正常光照下培养约1周,观察并筛选阳性苗。将抗性苗移栽到营养土中,阳性苗用引物t1-f和t1-r进行t-dna插入检测。使用内源启动子载体互补的阳性苗用引物ne41-1-lp、ne41-1-rp、lbb1.3进行基因型鉴定。
[0098]
引物序列为:
[0099]
t1-f:5
’‑
aacagaaaagtggcgcaagc-3’;
[0100]
t1-r:5
’‑
atcgcaagaccggcaacagga-3’;
[0101]
ne41-1-lp:5
’‑
cccctgtgtttcctatgctgcttg-3’;
[0102]
ne41-1-rp:5
’‑
ttggagattacgcctgtcatc-3’;
[0103]
pcr反应条件为:
[0104]
95℃、3min;95℃、15sec,58℃、15min,72℃、15sec,32个循环;72℃,5min。
[0105]
结果如图5所示,筛选到互补成功的纯合t-dna插入突变体,说明突变体角果发育异常是由e41缺失造成的。
[0106]
以上所述仅为本发明的优选实施例,并不用于限制本发明,对于本领域的技术人员来说,本技术可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1