喹啉酸羟化酶基因quiA及其编码的蛋白和应用
喹啉酸羟化酶基因quia及其编码的蛋白和应用
技术领域
1.本发明属于环境微生物领域,涉及参与有毒吡啶衍生物的微生物降解过程中的羟化酶基因quia及其应用。
背景技术:
2.吡啶衍生物是自然界最丰富的氮杂环化合物之一。它们包括单羧酸吡啶衍生物例如皮考啉酸,烟酸和异烟酸等,双羧酸吡啶衍生物如喹啉酸等。喹啉酸,又称2,3-吡啶二羟酸,属烟酸类化合物。在工业上,通过化学合成法可大量合成喹啉酸,是用于合成农药(咪唑啉酮类除草剂如灭草烟等)、医药(局部麻醉剂、杀菌剂、复合维生素b、抗生素喹诺酮等)、颜料、及染料(蓝色染料氮杂铜钛)的重要中间化工原料;此外喹啉酸能与铜、铁、锌、镉和铀等金属生成不溶性盐,可用作沉淀剂,用于金属的重量法测定以及沉淀分离。近年来,喹啉酸作为重要的中间体,可通过生物合成法合成烟酸、烟酰胺等吡啶衍生物,广泛应用于食品和药品行业。此外,喹啉酸是哺乳动物和微生物细胞中l-色氨酸的代谢产物,是一种强烈的神经毒性物质,其积累与很多神经退行性疾病有关,例如癫痫、阿尔茨海默病、抑郁症、亨廷顿病等。喹啉酸还可引发细胞产生过多的氧自由基,使脂质过氧化从而导致细胞死亡。喹啉酸在工业、医药、食品和农业等领域发挥着重要的作用,越来越受到人们的重视。由于喹啉酸的应用和来源的广泛性使其在环境中逐渐积累,再加上其生物毒性,对生态系统和人类健康造成严重的威胁。微生物降解环境中的喹啉酸具有安全、效率高、费用低和无二次污染等多个优点,目前报道中已筛选到几株可降解喹啉酸的微生物,但有关喹啉酸降解的基因和酶并没有报道,这严重制约了对喹啉酸的环境行为和生态安全方面的研究。因此有必要深入研究喹啉酸的微生物代谢的降解途径、降解机制,这对研究喹啉酸在环境迁移、转化和降解等环境行为及生态安全性具有重要的指导价值。
3.获得喹啉酸降解菌株和降解基因在治理环境中积累的喹啉酸等有毒吡啶衍生物有以下作用:(1)用于土壤和水体中喹啉酸的消除;(2)通过现代生物工程技术构建重组菌株,进而研究酶学特性,对喹啉酸等有毒吡啶衍生物污染修复具有重要意义。综上所述,开展喹啉酸降解过程中的降解基因、酶的研究具有非常重要的理论和实际应用价值。
技术实现要素:
4.本发明的目的是针对现有喹啉酸微生物降解机制研究的缺乏,提供喹啉酸羟化酶基因,该基因参与喹啉酸降解的起始步骤。本发明羟化酶quia能将喹啉酸吡啶环的6号位置加入羟基,生成6-羟基喹啉酸。本发明的另一目的是提供该喹啉酸羟化酶基因quia编码的蛋白quia。quia是首次发现参与喹啉酸降解的四组份羟化酶。本发明的又一目的是提供羟化酶基因quia及其编码蛋白的应用。
5.本发明的目的通过以下技术方案实现:
6.一个喹啉酸羟化酶基因quia,其核苷酸序列为seq id no.1。
7.通过构建转座子随机突变文库的方法来寻找目的基因。转座子诱变采用双亲接合
的方法,将转座供体菌escherichia coli sm10
λpir
质粒psc137上的转座序列转移至受体菌alcaligenes faecalis jq191中进行插入诱变。通过影印平板法筛选得到不能降解喹啉酸的突变株,利用arbitary pcr的方法,克隆突变菌株中被插入失活的基因,经测序、组装和数据库比对后得到羟化酶基因quia的基因序列,并委托上海生工生物技术有限公司对序列进行合成。所述的羟化酶基因quia编码的蛋白quia,其氨基酸序列为seq id no.2。
8.含有所述的羟化酶基因quia的重组表达载体。
9.所述的重组表达载体优选将所述的羟化酶基因quia同源重组至质粒pbbr-mcs2所得。
10.含有所述的羟化酶基因quia的重组菌株的构建,所述的表达菌株优选pseudomonas putida kt2440。
11.所述羟化酶quia在降解喹啉酸中的应用。
12.所述羟化酶quia在去除土壤和水体喹啉酸中的应用;
13.本发明的有益效果如下:
14.1.本发明分离到alcaligenes faecalis jq191,其能够降解和以喹啉酸为唯一碳源和氮源生长。在此基础上,本发明用构建转座子随机突变文库的方法从菌株jq191中得到一个四组份羟化酶基因quia的基因序列。在ncbi(the uniprotknowledge base/swissprot databases)中进行blastp在线氨基酸序列分析和同源性比较,发现该基因为一个新基因,全长(从起始密码子到终止密码子)4541bp,可编码1493个氨基酸。
15.2.本发明提供的羟化酶基因quia能在24h内完全降解200mg/l的喹啉酸,此外quia还可用于构建降解喹啉酸的重组菌株,用于去除土壤、水体中的喹啉酸,具有非常重要的理论和应用价值。
附图说明
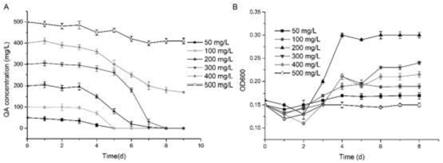
16.图1菌株jq191对喹啉酸的降解及生长实验;a:菌株jq191对不同浓度喹啉酸的降解;b:菌株jq191利用不同浓度喹啉酸为唯一碳源生长图。
17.图2羟化酶基因quia异源表达功能验证策略图。
18.图3重组菌株kt/pbbr-quia降解喹啉酸的能力检测。a:重组菌株kt/pbbr-quia降解喹啉酸的uv扫描图谱;b:重组菌株kt/pbbr-quia降解喹啉酸的hplc图谱。
19.图4重叠延伸构建quia1a2a3
his
a4 pcr策略图。
20.图5羟化酶quia sds-page电泳图。m:蛋白marker;1:重组菌株kt/pbbr-quia粗酶液;2:10mm咪唑洗脱液;3:50mm咪唑洗脱液;4:100mm咪唑洗脱液;5:150mm咪唑洗脱液。
21.图6羟化酶quia降解喹啉酸的紫外扫描图。
22.图7羟化酶quia催化喹啉酸的产物lc/ms图谱。
具体实施方式
23.实施例1喹啉酸解菌株jq191的分离和筛选
24.1.1喹啉酸降解菌株jq191的富集驯化分离
25.土壤样品采自南京市的污水处理厂,经富集驯化来筛选喹啉酸降解菌株。取5.0g污泥样品加到含200mg/l喹啉酸的100ml msm培养基中,放置在30℃、180rpm的摇床中培养7
天。然后将5ml的富集液转接至新鲜的含200mg/l喹啉酸的100ml msm培养基中,连续转接6次。
26.msm培养基配方(msm):1.0g nh4no3,1.5g k2hpo4·
3h2o,0.5g kh2po4,1.0g nacl,0.2g mgso4·
7h2o,加去离子水定容至1l。固体培养基中每100ml加入1.2g琼脂。
27.1.2降解菌株的纯化、筛选和鉴定
28.利用紫外分光光度计和高效液相色谱仪检测第六次转接的富集液中喹啉酸的残留量。对有降解效果的富集液进行梯度稀释,取10-3
至10-6
梯度稀释液各0.1ml,分别涂布于加有200mg/l喹啉酸的msm固体培养基上,30℃培养7天。挑取平板上的单菌落,进一步划线纯化,将得到的纯化单菌接种于加有200mg/l喹啉酸的msm液体培养基中,30℃,180rpm培养5天,后验证各单菌落是否有喹啉酸降解功能。
29.通过富集驯化分离筛选得到一株喹啉酸降解菌,命名为jq191。菌株jq191在lb固体平板上生长4天后,菌落呈淡黄色、圆形、边缘不整齐、表面凸起;菌株jq191为革兰氏阴性细菌,电镜图显示该菌株为椭圆形,有鞭毛。菌株jq191氧化酶、过氧化氢酶、voges-proskauer试验为阳性。
30.16s rrna基因序列系统发育分析:以菌株的总dna为模板,利用16s rrna基因通用引物进行pcr扩增,正向引物为5
′‑
agagtttgatcctggctcag-3
′
,反向引物为5
′‑
taccttgttacgactt-3
′
。pcr反应体系(50μl)为:模板1.0μl,引物(25μm)各2.0μl,2
×
taq master mix缓冲液25.0μl,超纯水20μl。聚合酶链式反应条件:95℃预变性5min;95℃变性0.5min,58℃退火0.5min,72℃延伸1.5min,循环30次;72℃延伸10min。3.0μl pcr产物于0.75%琼脂糖凝胶上进行电泳检测,pcr产物用回收试剂盒(axygen公司)进行切胶回收,ta克隆后送于南京金斯瑞生物技术有限公司进行测序。测序后获得的16s rrna基因序列在eztaxon-e server进行同源性比对,菌株jq191与alcaligenes faecalis dsm 16503
t
(genebank登录号为aubt01000026)的序列相似性为99.4%。另外,结合菌株的形态学和生理生化特征将jq191鉴定为粪产碱菌属(alcaligenes)。
31.1.3菌株jq191降解喹啉酸的特性及生长实验
32.菌株预培养:将jq191接种至lb液体培养基中,30℃培养至对数中期,低速(6000rpm)离心收集菌体,菌体用新鲜、无菌基础盐培养基洗涤2遍,重悬于基础盐培养基中。
33.降解特性实验:将培养好的菌株分别接入6个含有不同浓度喹啉酸(50mg/l、100mg/l、200mg/l、300mg/l、400mg/l和500mg/l)的100ml基础盐培养基中,调节接入菌体的初始浓度为od
600
=2,30℃培养,定时取样测定菌株的降解曲线;
34.生长实验:将培养好的菌株分别接入6个含有不同浓度喹啉酸(50mg/l、100mg/l、200mg/l、300mg/l、400mg/l和500mg/l)的100ml基础盐培养基中,调节菌株初始od
600
为0.1,30℃培养,定时取样测定菌株的生长曲线。
35.定时取上清液样品1ml,12000rpm离心5min,用0.22μm水相滤器过滤,处理好的样品用高效液相色谱(hplc)进行检测剩余喹啉酸的含量。高效液相色谱条件:色谱分离柱为kromasil 100-5c18反相(6mm
×
250mm
×
5μm),温30℃;甲醇/水/乙酸(12.5:87.5:2,v/v/v)流动相,流速为1.0ml/min;紫外检测波长为260nm;进样量20μl。菌体的生长量用紫外分光光度计检测,检测波长为600nm。
36.实验结果表明菌株jq191降解喹啉酸的最佳浓度为200mg/l,菌株可以利用喹啉酸为唯一碳源生长(图1)。
37.实施例2喹啉酸羟化酶基因的克隆及功能验证
38.2.1转座子诱变与筛选
39.转座子诱变采用双亲接合的方法,将转座供体菌escherichia coli sm10
λpir
质粒psc137上的转座序列转移至受体菌jq191中进行插入诱变。再将转座子诱变突变株,利用影印平板的方法,筛选到一株不能降解喹啉酸的突变株(jq191-m)。
40.2.2 arbitary pcr克隆突变基因
41.2.2.1突变菌株jq191-m基因组总dna的提取
42.菌株jq191-m基因组总dna使用细菌基因组提取试剂盒(biomiga)进行提取,基因组总dna溶于te缓冲液(ph 8.0),-20℃保存。
43.2.2.2转座子插入突变基因的arbitary pcr克隆
44.2.2.2.1引物设计
45.引物设计如下:
46.137-1:5
’‑
cagggacaccaggatttat-3’(seq id no.3);
47.137-2:5
’‑
cttccgtcacaggtaggcg-3’(seq id no.4);
48.arb1:5
’‑
ggccacgcgtcgactagtacnnnnnnnnnngatat-3’(seq id no.5)
49.arb2:5
’‑
ggccacgcgtcgactagtac-3’(seq id no.6);
50.arb6:5
’‑
ggccacgcgtcgactagtacnnnnnnnnnnacgcc-3’(seq id no.7);
51.2.2.2.2 arbitary pcr体系与程序
52.1以基因组dna为模版,用引物137-1和随机引物arb1、arb6,进行第一轮pcr扩增:
53.pcr反应体系为:
[0054][0055][0056]
反应程序:
[0057][0058]
2以第一轮的pcr产物为模版,用引物137-2和随机引物arb2进行第二轮pcr扩增:
[0059]
pcr反应体系为:
[0060][0061][0062]
反应程序:
[0063]
[0064]
2.2.3克隆序列的测定、组装与分析
[0065]
arbitary pcr的产物经过电泳鉴定纯度,再用dna凝胶回收试剂盒进行切胶回收。纯化后,将dna片段克隆至pmd18-t载体,将酶连产物转化至e.coli dh5α感受态细胞,具体经过氨苄青霉素筛选过的转化子,扩大培养后,提取质粒,通过质粒dna的大小判断片段是否插入pmd18-t载体。选择含插入片段的转化子,委托上海生工生物技术有限公司完成测序。利用bioedit,omiga等软件将测序得到的dna序列进行剪切和拼接。在http://www.ncbi.nlm.nih.gov在线查询分析,利用orf finder功能分析开放阅读框。利用blast功能在genbank中进行orf的同源性比较。
[0066]
2.3 quia基因的合成
[0067]
根据2.2中经过测序,剪切和拼接的基因序列信息委托上海生工生物技术有限公司进行合成,合成的目的基因全长为4541bp,合成的序列经过质检,测序合格后进行后续实验。
[0068]
2.4喹啉酸羟化酶基因的扩增及功能验证
[0069]
2.4.1喹啉酸羟化酶基因的扩增
[0070]
以正向引物:
[0071]5’‑
cacacaggaaacagctatgaaggctaaagttttcaattac-3’(seq id no.8);
[0072]
反向引物:
[0073]5’‑
cgcgaattttaacaaaatattaacgcttacgcgggatccttgcgccc-3’(seq id no.9)。通过pcr以合成的dna序列为模板扩增出quia基因。
[0074]
特异性扩增体系(50μl):
[0075][0076]
反应程序如下:
[0077][0078][0079]
2.4.2重组菌株的构建(策略见图2)
[0080]
2.4.2.1质粒线性化和pcr产物纯化
[0081]
以正向引物:
[0082]5’‑
agctgtttcctgtgtgaaattg-3’(seq id no.10),
[0083]
反向引物:
[0084]5’‑
gcgttaatattttgttaaaattcgcgttaaatttttgttaaatcag-3’(seq id no.11)将质粒pbbr-mcs2进行线性化,并用dpnⅰ消除模版污染。pcr产物使用凝胶纯化回收试剂盒,具体方法参考试剂盒说明书。0.75%的琼脂糖核酸电泳检测pcr产物。
[0085]
2.4.2.2表达菌株的构建及验证
[0086]
于冰水域中配制如下反应体系(10μl):
[0087][0088]
混匀后,在37℃水浴30min,反应完成后立即置于冰水浴中冷却5min,将同源重组产物转入大肠杆菌表达菌株e.coli dh5α中。挑取转化子至50mg/l km的3ml lb试管中,在37℃、180rpm摇床培养,提取质粒获得阳性转化子,分别进行pcr验证和送往上海生工生物技术科技有限公司进行测序,验证插入质粒pbbr1mcs-2的dna片段序列是否正确,将获得的阳性克隆含有pbbr-quia的e.coli dh5α表达菌株命名为e.coli/pbbr-quia。
[0089]
将供体菌e.coli/pbbr-quia、受体菌pseudomonas putida kt2440(jimenez ji,canales a,jimenez-barbero j,ginalski k,rychlewski l,garcia jl,diaz e.2008.deciphering the genetic determinants for aerobic nicotinic acid degradation:the niccluster from pseudomonas putida kt2440.proc natl acad sci u s a105:11329
–
11334)、含prk600质粒的辅助菌(biovector ntcc保藏中心)分别接入含有相应抗生素的lb液体培养基中,培养至对数期,离心后用无菌水重悬菌体按1:2:1的体积比在离心管中混合均匀。将无菌滤膜放置在无抗性的lb平板上,随后吸取混合菌液200μl加
至滤膜上,30℃静置培养3天后,用液体lb洗下滤膜上的菌体,震荡混匀,取100μl菌液涂布于选择性抗性lb平板(km和cm)上。培养4天挑取转入质粒的接合子,在km和cm双抗平板上划线纯化以备后续的降解功能验证试验,并命名成功转入质粒的结合子为重组菌株kt/pbbr-quia。
[0090]
2.5重组菌株的功能验证
[0091]
将重组菌株kt/pbbr-quia接至双抗性(km和cm)lb液体培养基中,培养至对数期,离心后用无机盐重悬菌体,按1:1的体积转接至含有200mg/l喹啉酸的无机盐中,2天之后,用紫外分光光度计和高效液相色谱进行检测。紫外分光光度计检测波长为200-400nm,hplc色谱条件同1.3。通过紫外分光光度计和高效液相色谱进行检测均发现有新的产物生成(图3)。
[0092]
实施例3羟化酶quia的纯化及活力测定
[0093]
3.1羟化酶quia的纯化
[0094]
3.1.1纯化载体和菌株的构建
[0095]
连接有6
×
his-tag的quia基因片段的扩增引物(策略见图4):
[0096]
引物p1:
[0097]5’‑
caatttcacacaggaaacagctatgaaggctcccgttttc-3’(seq id no.12)
[0098]
引物p2:
[0099]5’‑
ttagtgatggtgatggtgatgttgtgtcggttgcgtggc-3’(seq id no.13)
[0100]
引物p3:
[0101]5’‑
catcaccatcaccatcactaaaacaggaaagctgccatg-3’(seq id no.14)
[0102]
引物p4:
[0103]5’‑
gaattttaacaaaatattaacgcttacgcgggatccttgcgccc-3’(seq id no.15);(下划线表示6
×
his-tag序列)。
[0104]
如图4所示,通过以上4个引物特异性扩增quia基因,并且将6
×
his tag连接到quia3的c端,便于后期纯化。pcr扩增程序同2.3.1,根据扩增片段长度不同调整延伸时间。构建重组纯化菌株方法同2.3.2,需要测序验证目的基因(quia3)连接有6个his-tag,并且重组纯化菌株命名为kt/pbbr-quia1a2a3
his
a4。
[0105]
3.1.2 quia的表达、部分纯化
[0106]
重组纯化菌株kt/pbbr-quia1a2a3
his
a4在lb培养基中,30℃,180rpm摇床培养至od 600nm为2到3之间,然后离心收集菌体,采用pbs(50mm,ph 7.0)将菌体洗两遍,用15ml的pbs缓冲液重悬菌体,超声破碎5-10min,12000rpm离心30min,收集上清,用镍离子亲和层析柱对quia进行纯化,纯化后的酶进行蛋白质电泳检测,检测结果见图6。
[0107]
3.2 quia活力测定
[0108]
酶活反应体系(1ml):加有pbs(50mm,ph 7.0),0.1mm喹啉酸,0.1mm pms,反应酶量(3.1中纯化所得)200μl,30℃反应。每个反应以加入喹啉酸开始计时,通过紫外扫描进行定时检测。喹啉酸的紫外吸收峰最高是260nm,经过反应后产生羟化产物,此物质的紫外吸收峰为260nm和310nm,因此通过紫外扫描(260nm-400nm)可以看到在310nm处紫外峰明显升高,降解情况见图6。将酶反应液通过煮沸,过滤,进行hplc检测喹啉酸的降解情况。酶活力单位(u)定义:本实验中1个酶活单位(u)定义为:在30℃条件下,每分钟减少1μmol喹啉酸所
需的酶量(μg)。酶学实验表明部分纯化后的quia降解喹啉酸的比酶活为0.79
±
0.33μm/min/μg protein。
[0109]
3.3代谢产物的确定
[0110]
酶促反应后的降解产物采用lc/ms技术进行检测和鉴定分析。ltq orbitrap xl质谱分析仪(thermo fisher scientific)ms分析离子源为esi,正离子检测模式。液质检测数据用xcalibur软件处理分析。
[0111]
lc/ms检测结果分析指出quia能羟基化喹啉酸,产物为6-羟基喹啉酸(图7)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1