工程化病毒载体减少了炎症和免疫反应的诱导
工程化病毒载体减少了炎症和免疫反应的诱导
1.本技术是申请日为2017年6月8日、发明名称为“工程化病毒载体减少了炎症和免疫反应的诱导”的中国发明专利申请no.201780045910.3的分案申请。
2.本发明是在美国国立卫生研究院授予的hg008525下借助政府资助下进行的。政府拥有本发明的某些权利。
3.相关申请数据
4.本技术要求2016年6月8日提交的美国临时申请第62/347,302号的优先权,出于所有目的将其在此通过引用整体并入本文。
技术领域
5.本发明涉及基于病毒的疗法领域。特别是,它涉及重组病毒。
6.本发明的技术领域
7.基因疗法具有预防、治疗和治愈多种人疾病的巨大潜力[1]。2012年,glybera
tm
(替帕阿利泼金(alipogene tiparvovec))成为第一个被批准在西方世界使用的病毒基因疗法[2]。glybera
tm
利用腺相关病毒(aav)作为病毒载体,将人脂蛋白脂酶(lpl)基因递送给lpl缺乏症患者的肌肉细胞[3]。许多aav临床试验目前正在美国和欧盟进行或正在计划中[4-6]。
[0008]
aav是一种小的无包膜病毒,其包装长约5kb的单链线性dna基因组,并且已经适合用作基因转移载体[4]。aav的编码区侧翼为反向末端重复序列(itr),其充当dna复制的起点并作为主要包装信号(primary packaging signal)[7,8]。正链和负链均可被同样很好地包装到病毒体中并且能够感染[9-11]。另外,两个itr之一中的小缺失允许包装自身互补载体,其中基因组在病毒脱壳后自我退火。这导致更高效的细胞转导,但编码能力降低了一半[12,13]。虽然aav与任何人疾病无关,但》70%的人对一种或大多数血清型具有血清反应阳性[14,15]。aav载体的典型施用途径包括静脉内、肌内、视网膜下和颅内注射。aav基因疗法最常用于递送野生型基因来治疗单基因疾病,aav载体已被用于转导肝脏、骨骼和心肌、视网膜和中枢神经系统中的细胞[16-26]。另外,现在越来越有兴趣使用aav来递送crispr-cas9基因编辑或递送针对传染病(诸如人免疫缺陷病毒(hiv)和甲型流感病毒)的广泛中和抗体[27-32]。
[0009]
尽管基因疗法取得了一些进展,但关键的问题是病毒载体引发的炎症反应[33,34]。1999年一个受到公众高度关注的案例最好地说明了这一点,当时jesse gelsinger在临床试验中使用腺病毒进行基因疗法4天后由于过度炎症而死亡[35]。虽然与腺病毒相比,已显示aav引起弱得多的炎症[36,37],但glybera
tm
疗法仍然包括12周的免疫抑制,开始于glybera
tm
施用前三天[38]。这些免疫抑制和抗炎药物(环孢菌素a、霉酚酸酯和甲基泼尼松龙)在治疗期间削弱患者的免疫系统,并且所有患者仍然产生针对aav衣壳的中和抗体,从而避免了未来的再施用。此外,许多aav基因疗法临床试验不会预防性地使用免疫抑制,并且仅在出现炎症或组织损伤的体征时才施用皮质类固醇,这与可变的治疗功效相关[22,23]。有趣的是,与其引发炎症和免疫反应的能力一致,aav载体也已被开发为针对传染病和
癌症的疫苗载体[39-41]。
[0010]
炎症已被暗示为成功的aav介导的转基因表达的关键决定因素。研究发现,在小鼠中施用aav后,人工诱导全身性炎症(诸如肿瘤坏死因子(tnf)的上调)导致了肝脏中转基因表达的下降[42]。这表明,如果给予足够的炎症反应,可以破坏对aav编码的转基因的免疫耐受性。另一项研究表征了aav感染后小鼠肝脏中的炎症,并且发现血清中肝酶瞬时增加,肝脏病理学也与门静脉和小叶炎症一致[43]。令人惊讶的是,作者观察到aavrh.32.33病毒(与测试的其他aav血清型相比,其诱导更高的肝酶)的使用也导致转基因表达下降至检测水平以下,再次表明炎症和免疫反应与转基因表达差相关。
[0011]
在血友病b临床试验中,已观察到一个亚组的患者显示肝酶升高,这种短暂的转氨酶升高(transaminitis)伴随着转基因编码的因子ix水平下降[22,23]。对患有转氨酶升高的患者使用逐渐减量的皮质类固醇疗法,其随后使血清中的转氨酶水平正常化并且挽救因子ix表达的进一步下降。总之,这些观察结果与aav转导的肝细胞的免疫介导的破坏相容,并证明由aav施用引发的炎症和免疫反应是个安全性问题并且可妨碍人中的治疗功效。因此,开发本质上避免引发炎症的病毒载体将是有利的。此外,代替用药物进行全身免疫抑制,避免引发特异性免疫反应将是有益的。
[0012]
先前已经表明,在aav通过内吞途径进入细胞期间,aav的dna基因组被toll样受体9(tlr9)感知[36,44]。tlr9是在免疫细胞(诸如b细胞、单核细胞、巨噬细胞和浆细胞样树突状细胞)的内体膜上发现的模式识别受体(prr),并与aav基因组中发现的未甲基化cpg基序结合[45,46]。这导致tlr9二聚化,其引发信号转导的级联,该级联激活nf-κb(也称为p52-rela复合物)并诱导i型干扰素(ifn)。nf-κb继而驱动多种促炎细胞因子(诸如tnf)的转录上调,从而导致炎症和免疫细胞募集,而分泌的ifn则诱导许多干扰素刺激的基因(isg)的表达并建立抗病毒状态。重要的是,小鼠中tlr9的基因消除在肝脏中在aav治疗后消除了炎性细胞因子的诱导,并且还减少了针对aav的抗体和t细胞的形成[36]。因此,tlr9在刺激aav感染期间的早期炎症和先天性免疫反应中起关键作用,这也有助于引发适应性免疫。最后,另外两种模式识别受体tlr2和tlr4涉及引发对aav结构蛋白的反应[47,48]。
[0013]
在tlr9领域,在细胞培养中阻断tlr9活化的常用工具是短单链dna寡核苷酸,其结合tlr9但不激活它[49,50]。已知存在几种此类序列-一些是合成的,另一些源自生物体
–
并且它们通常不具有序列同源性[51-59]。结构研究揭示了抑制性寡核苷酸如何紧密结合tlr9,但不会引发tlr9二聚化,这是tlr9活化和下游信号传导所必需的[60]。除了直接结合tlr9以拮抗其活化以外,其他阻断tlr9活化或tlr9介导的炎症的机制已被假定或显示用于其他tlr9抑制性寡核苷酸[综述于49中]。这些机制包括竞争受体介导的内吞作用或吞噬作用,抑制tlr9运输或抑制tlr9加工成功能活性产物,抑制内体酸化或内体中关键蛋白酶的活性,或阻断tlr9下游的信号传导蛋白。当将这些抑制性寡核苷酸在细胞培养基中与tlr9配体(诸如dna病毒或含cpg的寡核苷酸)反式提供时,它们被内吞并且可以与tlr9结合,从而阻止其被刺激性配体激活。反式补充抑制性寡核苷酸在免疫学实验中被广泛采用,但本领域中不清楚将这些序列整合到病毒基因组中是否可以使其避免引发炎症和免疫反应。
[0014]
虽然已显示aav与腺病毒相比引起弱得多的炎症反应,但glybera
tm
替帕阿利泼金治疗仍然包括始于glybera
tm
替帕阿利泼金施用前3天的12周的免疫抑制。这些免疫抑制药物强烈地阻碍t细胞活化,因此在治疗期间削弱患者的免疫系统。设计在施用时避免和引起
减小的炎症反应或没有炎症反应的病毒载体将是有利的。此外,如果免疫抑制不是全身性的,并且如果其是短暂的,那将是有益的。预防炎症和免疫反应还可以改善转基因表达,并且可允许为了将来的目的再施用病毒载体。
[0015]
本领域一直需要改善病毒载体用于治疗和体内生产生物产品的功效。
[0016]
发明概述
[0017]
根据本发明的一个方面,提供了核酸分子。其包含与抑制性核酸序列共价连接的病毒基因组,所述抑制性核酸序列与tlr9结合但不引发tlr9活化。
[0018]
根据另一个方面,提供了用于向哺乳动物细胞递送所需功能的重组病毒。所述重组病毒包含与抑制性核酸序列共价连接的病毒基因组,所述抑制性核酸序列与tlr9结合但不引发tlr9活化。
[0019]
另一个实施方案是治疗哺乳动物的方法。该方法包括向有此需要的哺乳动物施用重组病毒。所述重组病毒包含与抑制性核酸序列共价连接的病毒基因组,所述抑制性核酸序列与tlr9结合但不引发tlr9活化。
[0020]
另一方面是制备重组病毒的病毒基因组的方法。将抑制性核酸序列插入病毒基因组中。所述抑制性核酸序列与tlr9结合但不引发tlr9活化。
[0021]
根据一个方面,提供了核酸分子。其包含反向末端重复序列(itr)和抑制tlr9介导的炎症的核酸序列。
[0022]
本发明的另一方面是核酸分子。该分子包含与抑制tlr9介导的炎症的抑制性核酸序列共价连接的病毒基因组。
[0023]
本发明的另一个方面是用于向哺乳动物细胞递送所需功能的重组病毒。所述重组病毒包含病毒基因组,其包含抑制tlr9介导的炎症的抑制性核酸序列。
[0024]
本发明的另一个方面是制备重组病毒的病毒基因组的方法。将核酸序列插入病毒基因组中。所述核酸序列抑制tlr9介导的炎症。
[0025]
根据本发明的另一个方面,提供了核酸载体。所述载体包含至少一种核酸序列。所述核酸序列能够抑制tlr9介导的炎症。
[0026]
本发明的另一个方面是降低具有基因组的经修饰的病毒的免疫原性的方法。该方法包括将核酸序列插入基因组中。所述核酸序列抑制tlr9介导的炎症。与不含该抑制性序列的病毒相比,经修饰的病毒在宿主中引起降低的炎症反应。
[0027]
本发明的另一个方面是增加病毒性引入的转基因在宿主细胞中表达的方法。该方法包括向宿主中引入具有基因组的经修饰的病毒。所述基因组包含核酸序列。所述核酸序列抑制tlr9介导的炎症。与不含抑制性序列的病毒相比,所述经修饰的病毒在宿主细胞中导致更高的转基因表达。
[0028]
本发明的另一个方面是包含病毒衣壳的组合物,所述病毒衣壳包裹抑制tlr9介导的炎症的核酸序列。
[0029]
本领域技术人员在阅读本说明书后将明白的这些以及其他方面和实施方案为本领域提供了用于利用病毒载体和病毒体更好地治疗哺乳动物以及更好地使用病毒载体和病毒粒子来在宿主细胞、宿主组织和宿主动物中生产转基因产品的工具。
[0030]
可将任何和所有上述方面与以下任何特性组合。
[0031]
病毒基因组可以是腺相关病毒(aav)基因组。
[0032]
病毒基因组可选自腺病毒、单纯疱疹病毒、水痘、天花病毒、乙型肝炎病毒、巨细胞病毒、jc多瘤病毒、bk多瘤病毒、猴痘病毒、带状疱疹病毒、爱泼斯坦-巴尔病毒、人疱疹病毒7、卡波西氏肉瘤相关疱疹病毒和人细小病毒b19。
[0033]
病毒基因组可以是单链的。
[0034]
病毒基因组可以包装在病毒体中。
[0035]
病毒基因组可包含可在人细胞中表达的基因。
[0036]
病毒基因组可以是用于裂解靶肿瘤细胞的细胞毒性病毒。
[0037]
抑制性核酸序列可包含c41寡核苷酸序列tggcgcgcacccacggcctg(seq id no:1)。
[0038]
抑制性核酸序列可包含多个拷贝的c41序列(seq id no:1)。
[0039]
抑制性核酸序列可包含由接头序列分开的两个拷贝的c41序列(seq id no:1)。
[0040]
接头序列是aaaaa(seq id no:8)。
[0041]
抑制性核酸序列可选自:
[0042]
odn 2088:tcc tgg cgg gga agt(seq id no:2);
[0043]
odn 4084-f:cctggatgggaa(seq id no:3);
[0044]
odn inh-1:cctggatgggaattcccatccagg(seq id no:4);
[0045]
odn inh-18:cct gga tgg gaa ctt acc gct gca(seq id no:5);
[0046]
odn ttaggg:tt agg gtt agg gtt agg gtt agg g(seq id no:6);和
[0047]
g-odn:ctc cta ttg ggg gtt tcc tat(seq id no:7)。
[0048]
抑制性核酸序列可以是细菌序列。
[0049]
病毒基因组、重组病毒、载体或核酸序列可包含非人基因。
[0050]
抑制性核酸序列可被插入在病毒基因组的3'非翻译区的下游或其中。
[0051]
病毒基因组可通过磷酸二酯键与抑制性核酸序列共价连接。
[0052]
病毒基因组、重组病毒、载体或核酸序列可包含可检测标记。
[0053]
可检测标记可以是诱导型的。
[0054]
抑制性核酸序列可包含seq id no:9中所示的人端粒序列。
[0055]
病毒基因组可以是自我互补的。
[0056]
病毒基因组可以与多种抑制性核酸序列共价连接。
[0057]
多种抑制性核酸序列可包含抑制序列及其反向互补序列。
[0058]
抑制性核酸序列可包含c41序列(seq id no:1)的三个拷贝,每个拷贝由接头序列分开。
[0059]
抑制性核酸序列可选自:
[0060]
odn 2114:tcctggaggggaagt(seq id no:16);
[0061]
odn 4024:tcctggatgggaagt(seq id no:17);
[0062]
odn inh-4:ttcccatccaggcctggatgggaa(seq id no:18);
[0063]
odn inh-13:cttaccgctgcacctggatgggaa(seq id no:19);
[0064]
odn poly-g:gggggggggggggggggggg(seq id no:20);
[0065]
odn gpg:tgactgtgaaggttagagatga(seq id no:21);
[0066]
odn irs-869:tcctggaggggttgt(seq id no:22);
[0067]
odn irs-954:tgctcctggaggggttgt(seq id no:23);和
[0068]
odn 21158:cctggcgggg(seq id no:24)。
[0069]
抑制性核酸序列可以是odn ttaggg(seq id no:6)。
[0070]
抑制性序列可以与接头共价连接。
[0071]
抑制性序列可以在接头的上游。
[0072]
抑制性核酸序列可包含多个拷贝的odn ttaggg(seq id no:6)。
[0073]
多个拷贝的odn ttaggg(seq id no:6)可各自通过接头分开。
[0074]
抑制性核酸序列可包含至少2个、至少3个、至少4个或至少5个拷贝的odn ttaggg(seq id no:6),每个拷贝通过接头分开。
[0075]
抑制性核酸序列可以是人序列。
[0076]
病毒基因组、重组病毒、载体或核酸序列可包含非人核酸序列。
[0077]
病毒基因组、重组病毒、载体或核酸序列可包含人基因。
[0078]
病毒基因组、重组病毒、载体或核酸序列可包含人核酸序列。
[0079]
可以将抑制性核酸序列插入在病毒基因组的5'非翻译区。
[0080]
可将抑制性核酸序列插入在病毒基因组的启动子的上游。
[0081]
病毒基因组、重组病毒、载体或核酸序列可包含诱导型启动子。
[0082]
抑制性核酸序列可包含seq id no:1的两个重复单体。
[0083]
抑制性核酸序列可包含seq id no:1的三个重复单体。
[0084]
抑制性核酸序列可包含seq id no:6或seq id no:9。
[0085]
抑制性核酸序列可包含seq id no:6或seq id no:9的三个重复单体。
[0086]
抑制性核酸序列可包含seq id no:6或seq id no:9的5个重复单体。
[0087]
可以重复施用步骤。
[0088]
病毒基因组可以包装在病毒体中。
[0089]
插入步骤可以使用dna连接酶。
[0090]
病毒基因组在病毒体中时可以是单链的。
[0091]
重组病毒的病毒基因组可包含用于递送至人细胞并在其中表达的基因。
[0092]
病毒基因组、重组病毒、载体或核酸序列可包含分开每个所述核酸序列的接头。
[0093]
病毒基因组、重组病毒、载体或核酸序列可包含至少2个、至少3个、至少4个、或至少5个拷贝的所述核酸序列。
[0094]
抑制性核酸可以与基因共价连接。
[0095]
抑制性核酸序列可以与c41寡核苷酸序列tggcgcgcacccacggcctg(seq id no:1)具有95%同一性。
[0096]
抑制性核酸序列可以与seq id no:9具有95%同一性。
[0097]
抑制性核酸序列可以与选自以下的序列具有95%同一性:
[0098]
odn 2088:tcc tgg cgg gga agt(seq id no:2);
[0099]
odn 4084-f:cctggatgggaa(seq id no:3);
[0100]
odn inh-1:cctggatgggaattcccatccagg(seq id no:4);
[0101]
odn inh-18:cct gga tgg gaa ctt acc gct gca(seq id no:5);
[0102]
odn ttaggg:tt agg gtt agg gtt agg gtt agg g(seq id no:6);和
[0103]
g-odn:ctc cta ttg ggg gtt tcc tat(seq id no:7)。抑制性核酸序列可以与选
自以下的序列具有95%同一性:
[0104]
odn 2114:tcctggaggggaagt(seq id no:16);
[0105]
odn 4024:tcctggatgggaagt(seq id no:17);
[0106]
odn inh-4:ttcccatccaggcctggatgggaa(seq id no:18);
[0107]
odn inh-13:cttaccgctgcacctggatgggaa(seq id no:19);
[0108]
odn poly-g:gggggggggggggggggggg(seq id no:20);
[0109]
odn gpg:tgactgtgaaggttagagatga(seq id no:21);
[0110]
odn irs-869:tcctggaggggttgt(seq id no:22);
[0111]
odn irs-954:tgctcctggaggggttgt(seq id no:23);和
[0112]
odn 21158:cctggcgggg(seq id no:24)。
[0113]
抑制性核酸序列可包含多个拷贝的seq id no:6和/或seq id no:9。
[0114]
抑制性核酸序列可包含由接头序列分开的两个拷贝的seq id no:6和/或seq id no:9。
[0115]
附图概述
[0116]
图1.病毒基因疗法以及炎症和免疫反应的示意图。
[0117]
图2.显示tlr9在病毒进入以及炎症和免疫反应期间感测aav dna的示意图。来自rogers等,2011,frontiers in microbiology,“innate immune responses to aav vectors,”第2卷,论文194。
[0118]
图3a-3b.图3a显示单链寡核苷酸c41(seq id no:1)的核苷酸序列。图3b显示aav-egfp和aav-egfp-c41基因组的组织。itr,反向末端重复;lpa,晚期多腺苷酸化信号。在这种情况下描述的目标转基因是egfp。插入具有c41序列。图3b中描绘的间隔子示于seq id no:8中。
[0119]
图4显示用aav病毒(dj衣壳、自身互补的aav基因组、编码egfp)模拟感染或感染的hek293 tlr9细胞中的nf-κb活性。**,p《0.005;n.s.,不显著的。该实验使用粗制病毒制剂。
[0120]
图5.流式细胞术直方图,其显示用具有或不具有c41的aav病毒模拟感染或感染的hek293 tlr9细胞中的gfp表达。该实验使用粗制病毒制剂。
[0121]
图6a-6b.图6a显示了“端粒”(seq id no:9)的核苷酸序列,其为含有来自哺乳动物端粒的(ttaggg)4(seq id no:6)基序的单链寡核苷酸。图6b显示了aav-egfp-端粒基因组的组织。插入具有“端粒”序列。图6b中所示的间隔子是seq id no:8。
[0122]
图7a-7b.图7a显示通过流式细胞术分析的在用相似量的指定aav病毒感染b细胞系后2天的转导细胞(gfp+)的百分比。图7b显示了通过elisa测定的感染后18小时的原代人cd14+单核细胞上清液中的tnf的产生。
[0123]
图8a-8b.设计自我互补的aav载体。(图8a)“c41”和“端粒”的dna序列。(图8b)aav载体(scaav-egfp)和经修饰的载体的基因组组织。lpa:polya信号。
[0124]
图9a-9c.体外人免疫细胞中针对各种aav载体的炎症反应。(图9a)用aav2病毒(moi:105vg/细胞)感染原代人巨噬细胞,18小时后收集上清液,并通过elisa分析其tnf水平。5μm odn2006(一种含有cpg的寡核苷酸)用作阳性对照。(图9b,图9c)与(a)类似地感染来自两个不同供体的原代人cd14+单核细胞并分析其tnf水平。显示的数据是n=3个技术重复的平均值
±
s.d.。*p《0.05(非配对t检验),与scaav-egfp相比。
[0125]
图10a-10e.aav载体的进一步表征。(图10a)“对照”的dna序列。(图10b)经修饰的载体的基因组组织。(图10c)与(图9a)类似地用aav2病毒感染原代人巨噬细胞,并通过elisa分析其tnf水平。与(图9b,图9c)类似地感染(图10d)原代人单核细胞,并通过elisa分析其tnf水平。所示数据(图10c,图10d)为n=3个技术重复的平均值
±
s.d.。*p《0.05(非配对t检验),与scaav-egfp相比。(图10e)与(图12a,图12b和图12c)类似地用指定的aav2病毒感染成年c57bl/6小鼠,并通过qrt-pcr分析一块肝脏的指定基因表达。显示的数据是每个条件下n=5只小鼠(除对于scaav-egfp-3x对照n=3只小鼠外)的平均值
±
s.d.。*p《0.05(非配对t检验),与盐水条件相比。n.s.:不显著(p》0.05)。
[0126]
图11a-11b.(图11a)与(图9a)类似地使用不同批次的两种aav2病毒感染原代人巨噬细胞,并分析其tnf水平。(图11b)以指定的moi用aav2病毒感染hela细胞,48小时后收获细胞,并通过流式细胞术分析其gfp表达。显示了gfp阳性细胞的百分比。显示的数据是n=3个技术重复的平均值
±
s.d.。*p《0.05(非配对t检验),与scaav-egfp相比。
[0127]
图12a-12c.成年小鼠在体内对各种aav载体的静脉内施用的炎症反应。(图12a,图12b和图12c)通过尾静脉注射用指定的aav2病毒(10
11
vg/小鼠)感染成年c57bl/6小鼠。2小时后,对动物实施安乐死,并通过qrt-pcr分析一块肝脏的指定基因表达。对于每种基因,将盐水注射设定为1倍表达。显示的数据为每个条件下n=3只小鼠(图12a)或每个条件下n=4只小鼠(图12b和图12c)的平均值
±
s.d.。*p《0.05(非配对t检验)*,与盐水条件相比。n.s.:不显著(p》0.05)。
[0128]
图13.单链aav载体(ssaav-egfp)和ssaav-egfp-5x端粒的基因组组织。
[0129]
图14a-14c.在视网膜下施用各种aav载体后新生小鼠体内的炎症和免疫反应。(图14a,图14b和图14c)新生儿cd1小鼠(p1)通过视网膜下注射接受指示的aav8病毒(1.8x10
8 vg/小鼠眼)。在p21,对动物实施安乐死,并将眼杯解剖出来。通过qrt-pcr分析视网膜和眼杯的其余部分的指示基因表达。对于每种基因,将盐水注射设定为1倍表达。每个三角形代表一只动物。显示的数据为n=3只小鼠(盐水)和n=5只小鼠(每种病毒),并显示平均值。
[0130]
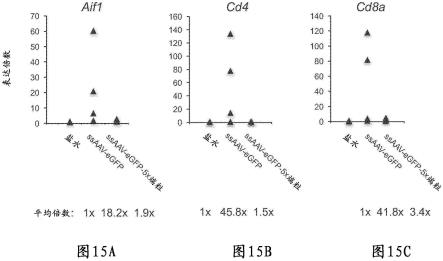
图15a-15c.在视网膜下施用各种aav载体后新生小鼠在体内的视网膜中的免疫细胞标志物的分析。(图15a,图15b和图15c)与(图14a-14c)类似地,通过qrt-pcr分析视网膜的指定基因表达。已知aif1(iba1)在小胶质细胞中表达,而cd4和cd8a分别是辅助细胞和溶细胞性t细胞的标志物。对于每种基因,将盐水注射设定为1倍表达。每个三角形代表一只动物。显示的数据是n=3只小鼠(盐水)和n=5只小鼠(每种病毒),并显示平均值。
[0131]
图16.眼中的gfp表达。新生儿cd1小鼠(p1)通过视网膜下注射接受指示的aav8病毒(1.8x10
8 vg/小鼠眼)。在p30,将动物安乐死并在平铺在载玻片上(flat-mounted)的眼杯中观察gfp表达。显示的数据是每种条件下n=2只小鼠。
[0132]
图17a-17b.图17a显示了c41(seq id no:1)的核苷酸序列,其为单链寡核苷酸。图17b显示了aav-egfp和aav-egfp-c41基因组的组织。itr,反向末端重复;lpa,晚期多腺苷酸化信号。在这种情况下描述的目标转基因是egfp。插入具有c41序列。图17b中描绘的间隔子示于seq id no:8中。
[0133]
图18a-18b.图18a显示“端粒”(seq id no:9)的核苷酸序列,其为含有来自哺乳动物端粒的(ttaggg)4(seq id no:6)基序的单链寡核苷酸。图18b显示aav-egfp-端粒基因组的组织。插入具有“端粒”序列。图18b中所示的间隔子是seq id no:8。
[0134]
发明详述
[0135]
发明人已开发了病毒载体和病毒体,其具有它们自己的针对宿主免疫和炎症系统的保护作用。这些载体和病毒体携带短核酸序列,其抑制toll样受体9(tlr9)的活化,tlr9是一种激活哺乳动物细胞中炎症和免疫反应的宿主蛋白。
[0136]
用于抑制tlr9的短核苷酸序列可以是任何来源。其可以是细菌、人、合成或其他来源。一个特定序列是来自铜绿假单胞菌(pseudomonas aeruginosa)的20个核苷酸长的“c41”[tggcgcgcacccacggcctg(seq id no:1)]。另一特定序列来自人端粒并包含(ttaggg)4(seq id no:6)。其他抑制性序列示于seq id no:2-5、7、9和16-24中。还可使用与这些序列具有至少80%同源性/同一性的抑制性序列。还可使用与这些序列共享至少85%、至少90%、至少95%、至少96%、至少97%、至少98%和/或至少99%同源性/同一性的抑制性序列。可使用串联阵列形式或者通过间隔子或接头序列或病毒基因组的其他部分在病毒载体中分开的形式的多个拷贝的抑制性序列。在一些实施方案中,使用一个、两个、三个、四个、五个、六个、七个、八个、九个、十个、十五个或二十个拷贝。在一些实施方案中,抑制性序列的一个或多个拷贝在正链上,一些拷贝在病毒基因组的负链上。
[0137]
将抑制性寡核苷酸序列作为病毒基因组或病毒体的一部分而不是作为单独的试剂引入宿主细胞中。这使得寡核苷酸序列的作用是局部的而非全身性的。此外,免疫逃避是短暂现象,因为其是在aav或其它病毒进入过程中发生的,不像利用药物的免疫抑制可持续数周。另外,其确保有益的拮抗剂活性发生在需要的地方-采用病毒或病毒基因组。如果病毒或病毒基因组不在宿主细胞中复制,那么寡核苷酸的作用将是短暂的。如果病毒或病毒基因组发生复制,则作用将与复制共同扩展。
[0138]
可使用任何重组dna工程化方法将抑制性核酸序列插入病毒基因组中。这可涉及体外或体内重组。例如,可使用dna连接酶或其他核酸联接酶来完成体外重组。体内重组可以通过用分开的供体分子共转化宿主细胞来实现,所述供体分子共有它们将籍以使用宿主细胞机器重组的同源性。或者,单个供体分子可以在体内与宿主细胞序列重组。还可使用这些方法的组合。通常,插入将涉及一个脱氧核糖核苷酸与另一个脱氧核糖核苷酸的标准键联(磷酸二酯键)。然而,可能存在这样的情况,其中在抑制性核酸序列与病毒基因组的其余部分之间将使用非标准键联。任选地,抑制性核酸序列位于病毒基因组的非翻译区。
[0139]
基因组可任选地含有治疗性基因和/或标记基因。通常,该基因是非病毒基因,或非天然存在于病毒基因组中的基因。该基因是能够在哺乳动物宿主细胞或动物中表达的。表达可处于病毒启动子或与该基因一起引入的启动子的控制下。作为实例,表达可以是诱导型、可阻遏型、条件响应型或组成型。治疗性基因是编码对宿主有益的rna或蛋白质产物的基因。例如,益处可以是改善健康、防止感染或补救缺陷。标记可使人能够追踪病毒或其产物或组分的位置、复制水平、增殖水平、转录水平或翻译水平。合适的标记包括易于检测的标志,诸如荧光蛋白、生色蛋白等。任选地,可以使用或添加第二试剂用于检测标记蛋白或用于对可检测物质进行显影。引入的基因可以是人或非人的,异源的(来自另一物种)或同源的(来自相同物种)或内源的(来自同一受试者)。
[0140]
可以使用任何dna病毒基因组,无论是单链的还是双链的。可使用的合适病毒的实例包括但不限于腺相关病毒(aav)、腺病毒、单纯疱疹病毒、水痘、天花病毒、乙型肝炎病毒、巨细胞病毒、jc多瘤病毒、bk多瘤病毒、猴痘病毒、带状疱疹病毒、爱泼斯坦-巴尔病毒、人疱
疹病毒7、卡波西氏肉瘤相关疱疹病毒、人细小病毒b19和肠道病毒的野生型或变体。病毒可以是但不限于细胞毒性的、溶细胞性的或引起潜伏感染。还可使用其中已进行了病毒基因组修饰的病毒载体。例如,可使用经修饰以编码较少病毒蛋白质的基因组。作为另一个实例,可使用经修饰以不编码病毒蛋白质的病毒基因组。作为非限制性实例,病毒基因组可包括反向末端重复和/或其他非编码的遗传元件,其有助于将工程化病毒基因组包装到衣壳中。
[0141]
可将病毒基因组作为裸dna、在脂质体中、与聚合物复合、以浓缩或压实状态、以金颗粒、以病毒体或任何其他适合于施用的方式递送至哺乳动物宿主细胞。通常将施用完整的病毒基因组,但在某些情况下,可能需要使用部分基因组。部分基因组可由宿主细胞或另一种基因组或病毒实体提供的辅助功能补充。例如,如果治疗有效载荷很大并且必须省略一些必需的病毒功能以进行包装,则可以使用部分基因组。
[0142]
可根据对该目的有效的任何途径向哺乳动物或哺乳动物细胞施用重组病毒。施用可以是全身性的,例如通过血液施用。其可以口服、皮下、局部、经颊、经肛(anally)、肌内、静脉内、瘤内、颅内、鞘内、视网膜下等递送。任何合适的载体或媒介物也可用于施用。可能需要预处理细胞或哺乳动物以使它们对重组病毒更具渗透性或接受性。“需要”重组病毒的哺乳动物可以是病毒对其有益的哺乳动物。其可以是患有疾病或缺陷的哺乳动物。其可以是将对其进行诊断或分析的哺乳动物。即使其没有疾病或缺陷,其也可以是能受益于所施用的重组病毒的哺乳动物。
[0143]
总之,我们的结果显示将c41或人端粒序列整合到aav基因组中(a)不会降低病毒包装和感染性,(b)阻止了tlr9介导的炎症,(c)减少了促炎细胞因子的诱导和(d)增加了转基因表达。增加的转基因表达可归因于免疫反应降低,因为tlr9激活也诱导干扰素表达,这引发抗病毒状态。我们在下面显示的工程化免疫逃避特性是特异性的(针对tlr9)、短暂的(例如,可在病毒进入期间发生),并且不会导致全身免疫抑制(仅针对aav感染的免疫细胞)。
[0144]
可将我们使用的抑制性核酸序列以及本领域已知的其他病毒整合到其他病毒中,所述其他病毒与aav一样,对人和其他哺乳动物具有潜在用途,但引发可能不合需要的炎症/免疫反应。例如,优先感染和裂解癌细胞的溶瘤病毒用于杀死或缩小肿瘤。这些病毒是复制性的(与用于基因疗法的aav载体不同),因此它们可以释放新的病毒体以缩小剩余的肿瘤。实例包括单纯疱疹病毒、腺病毒和肠道病毒的野生型或变体。一些报道显示由化学疗法产生的免疫抑制可以增强溶瘤病毒疗法,因为免疫系统通常会试图使溶瘤病毒失活,从而阻止它感染癌细胞。因此,将抑制性寡核苷酸整合在溶瘤病毒如单纯疱疹病毒的基因组中有可能使其逃避免疫清除并且持续更长时间用于溶瘤作用。
[0145]
以上公开内容总体上描述了本发明。本文公开的所有参考文献明确地通过引用并入。通过参考以下具体实施例可以获得更完整的理解,所述实施例仅出于说明的目的而提供,并不意图限制本发明的范围。本发明的公开内容包括权利要求中明确引述的所有实施方案。另外,从属权利要求中公开的所有特征同样适用于它们基于其他独立权利要求的独立权利要求。因此,明确地预期和公开了从属权利要求与其他独立权利要求的此类组合。
[0146]
实施例1
–
经修饰的病毒基因组的构建
[0147]
为了设计具有能够特异性逃避免疫细胞中tlr9活化的能力的aav载体,我们将由5
个核苷酸长的间隔子(aaaaa;seq id no:8)分开的两个拷贝的c41插入在编码增强型绿色荧光蛋白(egfp)的aav载体的3'非翻译区(图3b)。随后,我们生产了野生型aav-egfp病毒和aav-egfp-c41病毒(含有两个c41插入物)。两种病毒的感染滴度相当(~109个感染单位/ml,通过在hela细胞上的滴定测定),表明在病毒基因组中添加c41不会妨碍病毒包装和感染性,这是对于必须大规模产生以用于基因疗法的病毒载体的重要考虑因素。
[0148]
实施例2
–
经修饰的病毒基因组降低nf-κb激活
[0149]
为了测量炎症反应,我们使用稳定表达tlr9的hek293细胞(hek293 tlr9细胞),所述tlr9感知aav dna基因组,并且还在nf-kb的转录控制下表达碱性磷酸酶。当nf-κb被激活时(其表明炎症),碱性磷酸酶被分泌到培养基中并作用于所提供的底物,导致可在平板读数器上测量的培养基颜色的变化。我们模拟感染hek293tlr9细胞或用aav-egfp或aav-egfp-c41感染它们。与文献一致,aav-egfp感染诱导了nf-κb活性的小但统计学显著的增加(图4)。相反,与模拟感染的细胞相比,aav-egfp-c41感染没有显著差异,表明该病毒能够逃避引发炎症反应。
[0150]
实施例3
–
经修饰的病毒基因组转导更多细胞并表达更多转基因
[0151]
我们使用流式细胞术分析了用于egfp表达的上述三种条件(图4中描述的)。我们发现aav-egfp-c41比aav-egfp转导更多的细胞(52.7%的gfp+对比34.6%的gfp+)(图5)。此外,来自aav-egfp-c41感染的gfp+细胞表达的egfp约为来自aav-egfp感染的gfp+细胞的两倍(平均荧光强度[mfi]5335对比2749)。
[0152]
总之,我们通过将抑制性寡核苷酸整合在病毒基因组中来改造aav载体以逃避tlr9介导的炎症。
[0153]
实施例4-将c41或端粒序列整合在aav基因组中转导了更多细胞并降低了tnf诱导。
[0154]
我们插入了三个拷贝的“端粒”(源自哺乳动物端粒的序列,其含有抑制性(ttaggg)4基序(seq id no:6),已显示其阻断tlr9信号传导(图6a和图6b))。当在hela细胞上滴定时,aav-egfp-端粒病毒产生与aav-egfp和aav-egfp-c41相似的病毒滴度,证明了“端粒”的整合不会妨碍病毒包装和感染性。
[0155]
当我们用相似量的aav-egfp或aav-egfp-c41或aav-egfp-端粒病毒感染b细胞系时,aav-egfp-c41和aav-egfp-端粒病毒均比aav-egfp转导更多的细胞(图7a)。该发现也表明抑制性序列在aav基因组中的整合增加了转基因表达。
[0156]
随后,我们从血液中收获原代人cd14+单核细胞并使它们经受上述类似的感染条件。我们对上清液进行elisa以分析tnf的产生,因为tnf是由nf-κb激活诱导的原型促炎细胞因子。与模拟感染相比,aav-egfp感染增加了tnf产生,而aav-egfp-c41和aav-egfp-端粒感染显示tnf产生没有或几乎没有增加(图7a-7b),表明这两种病毒能够逃避引发炎症反应。
[0157]
实施例5
–
设计自身互补的aav载体
[0158]
研究人员通常使用短的抑制性寡核苷酸(通常长度为10-30个核苷酸)来拮抗细胞培养物中的tlr9信号传导。然而,尚不清楚这些抑制性寡核苷酸是否在更大得多的病毒基因组的背景下保留功能性(即,该序列在两个末端与长得多的序列共价连接)。为了测试这种可能性,我们利用编码增强型绿色荧光蛋白(egfp)的自身互补(sc)aav载体,并分别将来
自细菌和哺乳动物端粒的3个拷贝的“c41”或“端粒”[52,57,58,61]插入在含有载体基因组的质粒中(图8a和8b)。我们从sc aav载体开始,因为它们已被证明与单链(ss)aav载体相比在引发tlr9激活方面更高效并且在小鼠肝脏中诱导更多的炎症。由于预测“c41”和“端粒”具有强的二级结构,我们在抑制性寡核苷酸的拷贝之间使用aaaaa接头。另外,3xc41和3x端粒序列被置于polya序列之后和右侧反向末端重复序列(itr)的上游,因此它们将在病毒进入期间存在于dna基因组中,但在成功转导后将不存在于随后的mrna转录物中(“scaav-egfp-3xc41”和“scaav-egfp-3x端粒”)。最后,为了确定抑制性寡核苷酸在病毒基因组中的位置是否重要,我们还产生了如下载体,其中3x端粒位于左itr与启动子之间(“scaav-3x端粒-egfp”)。
[0159]
实施例6-原代人巨噬细胞和单核细胞在体外的炎症反应
[0160]
我们将各种aav载体包装到aav2血清型中并感染原代人单核细胞衍生的巨噬细胞,感染复数(moi)为每细胞105个病毒基因组(vg)。正如预期的那样,我们发现巨噬细胞的scaav-egfp感染引起上清液中tnf的强烈诱导,所述tnf是一种原型炎性细胞因子,在刺激发热、细胞凋亡和炎症方面具有明确的作用,并且在tlr9信号传导和nf-κb激活后产生(图9a)。相反,scaav-egfp-3x41和scaav-egfp-3x端粒均使tnf诱导显著降低》95%,表明与野生型(wt)载体相比,“c41”或“端粒”在这些病毒中的整合可以逃避引发炎症反应。此外,scaav-3x端粒-egfp还能够阻止tnf诱导》95%,证明插入的抑制性寡核苷酸可被置于病毒基因组的其他部分并保留阻断炎症的能力。将利用磷酸盐缓冲盐水(pbs)的模拟感染和利用odn 2006(一种商购可得的含有cpg的寡核苷酸,已知其强烈激活tlr9/nf-kb和炎症)的处理分别作为阴性和阳性对照。我们测试了原代人cd14+单核细胞,并且再次发现scaav-egfp引发了强烈的tnf诱导,而scaav-egfp-3xc41和scaav-egfp-3x端粒消除了大部分tnf诱导(图9b)。scaav-3x端粒-egfp同样降低tnf诱导,尽管抑制为~85%,这可能是由于细胞类型或供体组织之间的差异造成的。tnf诱导的逃避也在从另一个供体获得的原代cd14+单核细胞中再现(图9c)。
[0161]
作为进一步的表征,我们将3个拷贝的“对照”(即不阻断tlr9的随机序列)或1个拷贝的“端粒”插入含有载体基因组的质粒中(图10a,图10b)。我们选择序列“对照”,因为其已在tlr9实验中用作阴性对照寡核苷酸。我们发现scaav-egfp-1x端粒与人巨噬细胞中的scaav-egfp相比能够降低tnf诱导,但不如scaav-egfp-3x端粒有效(图10c)。这表明1个拷贝的端粒可以减轻炎症。我们还观察到scaav-egfp-3x对照在人单核细胞中与scaav-egfp一样有效地引发tnf分泌,表明插入抑制tlr9的序列是阻断炎症所必需的(图10d)。
[0162]
由于aav载体被认为是生物制剂并且可能表现出批次之间的差异,我们生产了另一批scaav-egfp和scaav-egfp-3x端粒aav2病毒,并发现scaav-egfp-3x端粒与wt载体相比,能够使tnf诱导减少~75%(图11a)。基于多种病毒制剂以及供体单核细胞和巨噬细胞(图9a-9c,图10a-10e和图11a-11b),我们得出如下结论,与wt载体相比,我们的含有3个拷贝的“c41”或“端粒”的工程化载体使tnf诱导减少约75-98%。平均而言,与scaav-egfp相比,scaav-egfp-3x端粒减少~85%的tnf诱导。重要的是,我们没有观察到从产生任何上述aav2载体获得的病毒滴度的差异(通过针对病毒基因组的qpcr测定的),表明工程化载体在包装中没有缺陷(数据未显示)。此外,当我们以一系列moi用scaav-egfp和scaav-egfp-3x端粒感染hela细胞(一种广泛用于滴定aav感染性的允许细胞系)时,我们没有观察到超过
病毒滴度的4个log的转导差异(gfp+细胞%),证明工程化载体在转导细胞方面具有同等的能力(图11b)。
[0163]
实施例7-小鼠体内肝组织中的炎症反应
[0164]
静脉内递送aav通常用于转导肝细胞以用于基因疗法。以前的研究表明,静脉内施用aav后,小鼠肝脏中的枯否细胞(常驻肝脏抗原呈递细胞)能够在1-9小时后感知sc aav基因组并引发炎症和先天性免疫反应[36]。这些反应包括诱导促炎细胞因子诸如tnf和il6和i型干扰素诸如ifn-β。tlr9-/-小鼠在肝脏中不表现出这些炎症和先天性免疫反应,证明了tlr9在体内作为先天性免疫传感器的中心作用。另外,免疫细胞诸如嗜中性粒细胞、巨噬细胞和天然杀伤(nk)细胞在aav施用后2小时浸润肝脏。为了确定我们的工程化载体是否可以在体内减少肝脏的炎症,我们通过尾静脉注射施用pbs或等量的scaav-egfp或scaav-egfp-3x端粒。我们选择scaav-egfp-3x端粒用于体内表征,因为“端粒”源自人序列并且可能优选用于临床应用。与先前的工作一致,scaav-egfp刺激肝脏中tnf和il6的表达增加(与盐水相比约3至10倍),显示了炎症(图12a)。相反,scaav-egfp-3x端粒显示炎症标志物几乎没有增加或没有增加。我们在随后的实验中测试了更多的小鼠,并发现与盐水相比,scaav-egfp在肝脏中刺激了统计学上显著的tnf诱导,而scaav-egfp-3x端粒和scaav-egfp-3xc41没有该刺激作用(图12b和12c),表明了它们逃避引发肝脏炎症的能力。最后,我们证实了scaav-egfp-3x对照与scaav-egfp相比不能预防肝脏的炎症(图10e)。
[0165]
实施例8-设计单链aav载体并体内测定小鼠眼组织中的炎症反应
[0166]
接下来,我们设计了单链aav载体ssaav-egfp,通过将5个拷贝的“端粒”与aaaaa接头插入,然后以反义方向将另外5个拷贝插入在质粒中,得到ssaav-egfp-5x端粒(图13)。由于病毒基因组的正链和负链都同样可能被包装到病毒颗粒中,这确保了每个包装的病毒基因组在正确的方向上具有5个拷贝的“端粒”。产生并纯化两种aav8病毒。同样,我们没有观察到两种载体之间的滴度差异,表明包装效率相似(数据未显示)。选择ssaav-egfp,因为其先前已用于小鼠视网膜下注射并在眼内高效转导光感受器[62]。
[0167]
几个研究表明,眼睛和大脑中的aav基因疗法似乎通常是安全的[63]。虽然通常认为眼睛是免疫豁免的部位,但已知其中有小神经胶质细胞,即中枢神经系统的常驻巨噬细胞,据报道它们表达tlr9并对cpg基序起反应[64-67]。最近通过视网膜下注射在食蟹猴中递送aav载体的研究报告了动物的剂量相关的前段和后段炎症,并且由于严重的眼部炎症,猕猴过早地被安乐死[68]。此外,来自安乐死动物的玻璃体抽吸物证实存在中性粒细胞和巨噬细胞。另一项利用犬模型的研究类似地观察到视网膜下注射aav载体后的前后葡萄膜炎,17只眼中有3只发展了多灶性脉络膜视网膜炎,这同样与较高的载体剂量相关[69]。这些发现强烈表明aav载体在眼睛中受到先天性免疫监视,并可引发有害的炎症和免疫反应。
[0168]
通过视网膜下注射向新生儿眼中递送盐水或相似量的ssaav-egfp或ss-aav-egfp-5x端粒并测量炎性和免疫基因的表达。接受盐水注射的三只小鼠在视网膜中的tnf表达一致地低,并设定为1倍表达(图14a)。相反,在接受ssaav-egfp的5只小鼠中,2只表现出温和的tnf上调(1.9倍和8.3倍),而3只动物表现出大的tnf诱导(62.2倍,534倍和1003倍),对于五只动物平均为321倍。该发现表明虽然炎症存在差异,但一些动物在ssaav-egfp视网膜下注射后在视网膜中产生非常强的炎症反应。可变性可能归因于每种注射程序或每只动物的免疫状态的差异。令人惊讶的是,接受ssaav-egfp-5x端粒的5只动物的平均tnf诱导率
为5.6倍,变化性要小得多,这表明ssaav-egfp-5x端粒能够避免引发强烈的炎症。在眼杯的其余部分观察到类似的结果,但幅度较低,表明炎症不限于视网膜(图14b)。我们还测量了视网膜中的ifng表达,所述ifng是对抗病毒免疫反应至关重要的ii型干扰素[70],并观察到类似的模式(图14c)。之前的研究表明视网膜下注射aav可在眼内引发免疫细胞浸润。因此,我们还分析了已知在不同类型的免疫细胞中特异性表达的基因的表达。我们发现与盐水相比,ssaav-egfp注射中aif1(编码iba1,小神经胶质细胞的一种特异性标记[71,72])的表达高达18.2倍,表明小神经胶质细胞在视网膜中的增殖和/或活化(图15a)。相反,ssaav-egfp-5x端粒仅显示1.9倍的aif1表达的诱导。另外,我们发现ssaav-egfp对cd4和cd8a(分别为cd4+辅助t细胞和cd8+溶细胞性t细胞的标记)的诱导为45.8倍和41.8倍,而ssaav-egfp-5x端粒仅显示1.5倍和3.4倍的诱导(图15b和15c)。同样地,用ssaav-egfp处理的小鼠之间存在相当大的差异,其中一个亚组的动物显示出强烈的诱导。这些结果表明视网膜下注射施用ssaav-egfp可以刺激t细胞在视网膜中的浸润,而ssaav-egfp-5x端粒强烈地减少其。总之,我们的数据表明,虽然ssaav-egfp在视网膜和周围组织中诱导强烈的炎症和免疫反应,并且观察到显著的变化性,但ssaav-egfp-5x端粒能够减轻这些反应的大部分。
[0169]
鉴于体外和体内炎症的显著差异,我们试图确定长期基因表达是否存在任何差异。在视网膜下注射小鼠后29天,我们在p30检查平铺在载玻片上的眼杯,发现与ssaav-egfp相比,在ssaav-egfp-5x端粒处理的眼中更多的细胞是gfp+,并且gfp表达更强,表明基因表达增强(图16)。因此,工程化载体能够减少视网膜中的炎症和免疫反应,并且还增强转基因表达。
[0170]
实施例9-材料和方法
[0171]
动物
[0172]
c57bl/6小鼠(雄性,7-9周龄)购自jackson laboratory,cd1小鼠购自charles river laboratories。
[0173]
aav载体
[0174]
在该研究中使用自身互补(sc)或单链(ss)aav载体。自身互补载体在一个itr中缺少末端分辨序列。所有载体基因组的侧翼均为aav2 itr。scaav-egfp购自cell biolabs(vpk-430),并在之前已进行了描述[73]。scaav-egfp从巨细胞病毒(cmv)启动子表达增强型绿色荧光蛋白(egfp),并包括sv40内含子和sv40 polya序列。ssaav-egfp先前已进行了描述[62]并且最初获自harvard df/hcc dna resource core(克隆id:evno00061595)。ssaav-egfp含有cmv增强子/启动子、人β-珠蛋白内含子、egfp和β-珠蛋白polya序列。已描述了源自铜绿假单胞菌的“c41”(5
′‑
tggcgcgcacccacggcctg-3
′
;seq id no:1)和源自哺乳动物端粒的“端粒”(5'-tttagggttagggttagggttaggg-3';seq id no:9;初始t核苷酸对于功能是任选的)的序列[52,57,58,61]。一种广泛使用的“端粒”寡核苷酸(由invivogen制造,目录代码“tlrl-ttag”)与公开的研究相比具有额外的t(粗体),因此包括在序列中。在该研究过程中,invivogen在其制造的“端粒”寡核苷酸(目录代码“tlrl-ttag151”)中除去了该额外的t。另外,“对照”(5'-gctagatgttagcgt-3';seq id no:34)用作不抑制tlr9激活的阴性对照序列(invivogen,目录号“tlr1-2088c”)。
[0175]
为了设计scaav-egfp,将序列插入在紧邻右侧itr的5'处发现的独特spei位点。为了促进亚克隆,在紧邻插入序列的5'产生独特的clai位点,从而允许序列的clai/spei亚克
隆。插入3个拷贝的“c41”、“端粒”或“对照”,用aaaaa接头分开,分别得到scaav-egfp-3xc41、scaav-egfp-3x端粒和scaav-egfp-3x对照。或者,插入一个“端粒”拷贝,其具有aaaaa接头(seq id no:8),得到scaav-egfp-1x端粒。我们还使用独特的avrii位点在左itr与cmv启动子之间插入3x端粒,得到scaav-3x端粒-egfp。
[0176]
为了设计ssaav-egfp,插入kpni-5x端粒(有义)-5x端粒(反义)-nhei,使其紧邻与右itr相邻的xbai位点的5'。同样地,将aaaaa用作“端粒”拷贝之间的接头。添加“端粒”的有义和反义序列两者,因为单链aav载体具有等同的包装病毒基因组的正链或负链的机会,从而确保所有包装的aav基因组将以正确的方向携带5个拷贝的“端粒”。
[0177]
通过hek293细胞的三重转染将自身互补载体包装到aav2(vigene biosciences)中,并使用碘克沙醇梯度超速离心纯化,然后使用pbs中的amicon ultra-15柱浓缩至500μl。使用源自itr和aav标准的引物通过qpcr滴定纯化的病毒。病毒的最终产量范围为0.5-3x 10
13
vg。
[0178]
基于先前描述的方案[74,75]将单链载体包装到aav8中。简言之,将aav载体、rep2-cap8包装质粒和腺病毒辅助质粒用聚乙烯亚胺转染到hek293t细胞中,并在转染后72小时收集上清液。用8.5%w/v的peg8000和0.4m nacl沉淀aav8病毒,并以7000g离心。将沉淀重悬于裂解缓冲液(150mm nacl和20mm tris,ph8.0)中,加入mgcl2至终浓度为1mm。将重悬的病毒与25u/ml benzonase(sigma)在37℃孵育15分钟,并在碘克沙醇梯度上运行。使用amicon 100k柱(emd millipore)将回收的aav载体用pbs洗涤3次,并浓缩成100-500μl的pbs。使用先前的aav标准的连续稀释液进行蛋白质凝胶以测定病毒滴度,以进行比较。
[0179]
用于体外研究的原代人单核细胞和单核细胞衍生的巨噬细胞
[0180]
购买来自未鉴定的健康供体的人外周血单核细胞(pbmc)(zenbio)。根据哈佛医学院的伦理指南进行该研究。根据制造商的说明书(miltenyi biotec)使用抗cd14磁性微珠从pbmc中正向选择cd14+单核细胞,或者cd14+单核细胞购自stemcell technologies。为了获得单核细胞衍生的巨噬细胞,将单核细胞与50ng/ml重组人巨噬细胞集落刺激因子(rhm-csf,购自peprotech)一起培养5-6天以允许分化成巨噬细胞。将单核细胞和巨噬细胞新鲜使用或冷冻保存以用于随后的研究。
[0181]
将1x105个单核细胞或巨噬细胞分别接种于96孔圆底板或96孔平底板中的每孔190ul rpmi生长培养基中,并在pbs中以指定的moi用10ul aav2病毒感染。模拟感染(添加10μl pbs)和odn2006(最终浓度为5μm,invivogen)(一种已知激活tlr9并引发炎症的含cpg的寡核苷酸)用作阴性和阳性对照。感染后18小时,收集上清液并通过低速离心澄清,然后进行elisa以检测人tnf(thermo scientific)。
[0182]
hela细胞感染
[0183]
hela细胞对aav2载体具有高度许可性,通常用于测定aav2载体制剂的转导滴度[76]。简言之,将hela细胞在12个孔中接种过夜,并在感染时约为80%汇合(~约3x105个细胞)。以指定的moi用连续10倍稀释的病毒感染细胞,并孵育48小时,然后用pbs中的1%低聚甲醛固定,然后对gfp+细胞进行流式细胞术分析。将pbs模拟感染的细胞用于测定gfp+信号。
[0184]
体内肝脏研究
[0185]
如前所述[36]通过尾静脉注射给成年c57bl/6小鼠静脉注射100ul pbs或aav2病
毒(10
11
vg/动物)。2小时后,处死动物并将肝脏右中叶的一部分保存在rnalater溶液(thermo scientific)中。通过使用rna提取试剂盒(omega bio-tek)从10-30mg机械破碎的肝脏样品中提取总rna。用高容量rna-to-cdna试剂盒(thermo scientific)将相似量的rna逆转录成cdna,并使用taqman fast advanced主混合物(thermo scientific)和商购可得的针对指定的靶基因(idt)的预先设计的具有fam报告染料的引物/探针,利用定量pcr(qpcr)测定相似量的cdna。通过使用δδct方法针对管家基因actb或gapdh进行标准化来计算每个基因的表达水平,并且表达为与注射盐水的小鼠相比的倍数水平。所有qpcr反应均在realplex4mastercycle(eppendorf)上进行。
[0186]
体内眼研究
[0187]
如前所述[74,75]对出生后第1天(p1)cd1新生儿眼睛进行视网膜下注射。使用由femtojet(eppendorf)控制的拉出角度的玻璃移液管将约0.2μl aav8病毒(1.8x10
8 vg/眼睛)引入视网膜下空间。在p21,处死动物并解剖出眼杯。如肝脏研究中所述,对视网膜和眼杯的其余部分进行rna提取,逆转录和qpcr。为了通过组织学可视化gfp表达,在p30切取眼睛,将其在4%低聚甲醛中固定2小时,并在pbs中洗涤3次。通过去除角膜、晶状体、虹膜、玻璃体和外周肌肉来解剖眼杯。在keyence bz-x700显微镜上使用x10物镜拍摄平铺在载玻片上的眼杯的图像。在同一成像组中同一成像设置下拍摄用于组间比较的图像。
[0188]
统计
[0189]
将不成对的双尾student’s t检验用于比较所有情形下两个未配对实验组之间的差异。p值《0.05被认为是统计学上显著的。没有假定预先指定的效应大小,并且通常每种条件使用3至5次重复。
[0190]
本技术涉及以下实施方式:
[0191]
1.一种核酸分子,其包含:
[0192]
与抑制性核酸序列共价连接的病毒基因组,所述抑制性核酸序列与tlr9结合但不引发tlr9活化。
[0193]
2.一种用于向哺乳动物细胞递送所需功能的重组病毒,其包含:
[0194]
与抑制性核酸序列共价连接的病毒基因组,所述抑制性核酸序列与tlr9结合但不引发tlr9活化。
[0195]
3.实施方式2的重组病毒,其中所述病毒基因组是腺相关病毒(aav)基因组。
[0196]
4.实施方式2的重组病毒,其中所述病毒基因组选自腺病毒、单纯疱疹病毒、水痘、天花病毒、乙型肝炎病毒、巨细胞病毒、jc多瘤病毒、bk多瘤病毒、猴痘病毒、带状疱疹病毒、爱泼斯坦-巴尔病毒、人疱疹病毒7、卡波西氏肉瘤相关疱疹病毒和人细小病毒b19。
[0197]
5.实施方式2的重组病毒,其中所述病毒基因组是单链的。
[0198]
6.实施方式2的重组病毒,其中所述病毒基因组包装在病毒体中。
[0199]
7.实施方式2的重组病毒,其中所述病毒基因组包含可在人细胞中表达的基因。
[0200]
8.实施方式2的重组病毒,其中所述病毒基因组是用于裂解靶肿瘤细胞的细胞毒性病毒。
[0201]
9.实施方式2的重组病毒,其中所述抑制性核酸序列包含c41寡核苷酸序列tggcgcgcacccacggcctg(seq id no:1)。
[0202]
10.实施方式2的重组病毒,其中所述抑制性核酸序列包含多个拷贝的c41序列
(seq id no:1)。
[0203]
11.实施方式10的重组病毒,其中所述抑制性核酸序列包含由接头序列分开的两个拷贝的c41序列(seq id no:1)。
[0204]
12.实施方式11的重组病毒,其中所述接头序列是aaaaa(seq id no:8)。
[0205]
13.实施方式2的重组病毒,其中所述抑制性核酸序列选自:
[0206]
odn 2088:tcc tgg cgg gga agt(seq id no:2);
[0207]
odn 4084-f:cctggatgggaa(seq id no:3);
[0208]
odn inh-1:cctggatgggaattcccatccagg(seq id no:4);
[0209]
odn inh-18:cct gga tgg gaa ctt acc gct gca(seq id no:5);
[0210]
odn ttaggg:tt agg gtt agg gtt agg gtt agg g(seq id no:6);和
[0211]
g-odn:ctc cta ttg ggg gtt tcc tat(seq id no:7)。
[0212]
14.实施方式2的重组病毒,其中所述抑制性核酸序列是细菌序列。
[0213]
15.实施方式2的重组病毒,其中所述病毒基因组包含非人基因。
[0214]
16.实施方式2的重组病毒,其中所述抑制性核酸序列被插入在所述病毒基因组的3'非翻译区的下游或其中。
[0215]
17.实施方式2的重组病毒,其中所述病毒基因组通过磷酸二酯键与所述抑制性核酸序列共价连接。
[0216]
18.实施方式2的重组病毒,其还包含可检测标记。
[0217]
19.实施方式18的重组病毒,其中所述可检测标记是可诱导的。
[0218]
20.实施方式2的重组病毒,其中所述抑制性核酸序列包含seq id no:9中所示的人端粒序列。
[0219]
21.实施方式2的重组病毒,其中所述病毒基因组是自身互补的。
[0220]
22.实施方式2的重组病毒,其中所述病毒基因组与多个抑制性核酸序列共价连接。
[0221]
23.实施方式22的重组病毒,其中所述多个抑制性核酸序列包含抑制序列及其反向互补序列。
[0222]
24.实施方式10的重组病毒,其中所述抑制性核酸序列包含3个拷贝的c41序列(seq id no:1),每个拷贝由接头序列分开。
[0223]
25.实施方式2的重组病毒,其中所述抑制性核酸序列选自:
[0224]
odn 2114:tcctggaggggaagt(seq id no:16);
[0225]
odn 4024:tcctggatgggaagt(seq id no:17);
[0226]
odn inh-4:ttcccatccaggcctggatgggaa(seq id no:18);
[0227]
odn inh-13:cttaccgctgcacctggatgggaa(seq id no:19);
[0228]
odn poly-g:gggggggggggggggggggg(seq id no:20);
[0229]
odn gpg:tgactgtgaaggttagagatga(seq id no:21);
[0230]
odn irs-869:tcctggaggggttgt(seq id no:22);
[0231]
odn irs-954:tgctcctggaggggttgt(seq id no:23);和
[0232]
odn 21158:cctggcgggg(seq id no:24)。
[0233]
26.实施方式13的重组病毒,其中所述抑制性核酸序列是odn ttaggg(seq id no:
6)。
[0234]
27.实施方式26的重组病毒,其中所述抑制序列与接头共价连接。
[0235]
28.实施方式26的重组病毒,其中所述抑制序列在所述接头的上游。
[0236]
29.实施方式2的重组病毒,其中所述抑制性核酸序列包含多个拷贝的odn ttaggg(seq id no:6)。
[0237]
30.实施方式29的重组病毒,其中所述多个拷贝的odn ttaggg(seq id no:6)各自通过接头分开。
[0238]
31.实施方式30的重组病毒,其中所述抑制性核酸序列包含至少2个、至少3个、至少4个或至少5个拷贝的odn ttaggg(seq id no:6),每个拷贝通过接头分开。
[0239]
32.实施方式30的重组病毒,其中所述接头是aaaaa。
[0240]
33.实施方式2的重组病毒,其中所述抑制性核酸序列是人序列。
[0241]
34.实施方式2的重组病毒,其中所述病毒基因组包含非人核酸序列。
[0242]
35.实施方式2的重组病毒,其中所述病毒基因组包含人基因。
[0243]
36.实施方式2的重组病毒,其中所述病毒基因组包含人核酸序列。
[0244]
37.实施方式2的重组病毒,其中所述抑制性核酸序列被插入在病毒基因组的5'非翻译区中。
[0245]
38.实施方式2的重组病毒,其中所述抑制性核酸序列被插入在病毒基因组的启动子的上游。
[0246]
39.实施方式2的重组病毒,其还包含诱导型启动子。
[0247]
40.实施方式2的重组病毒,其中所述抑制性核酸序列包含seq id no:1的两个重复单体。
[0248]
41.实施方式2的重组病毒,其中所述抑制性核酸序列包含seq id no:1的三个重复单体。
[0249]
42.实施方式2的重组病毒,其中所述抑制性核酸序列包含seq id no:6或seq id no:9。
[0250]
43.实施方式2的重组病毒,其中所述抑制性核酸序列包含seq id no:6或seq id no:9的三个重复单体。
[0251]
44.实施方式2的重组病毒,其中所述抑制性核酸序列包含seq id no:6或seq id no:9的五个重复单体。
[0252]
45.一种治疗哺乳动物的方法,其包括:
[0253]
向有此需要的哺乳动物施用实施方式2的重组病毒。
[0254]
46.实施方式45的方法,其中所述病毒基因组是腺相关病毒(aav)基因组。
[0255]
47.实施方式45的方法,其中病毒基因组选自腺病毒、单纯疱疹病毒、水痘、天花病毒、乙型肝炎病毒、巨细胞病毒、jc多瘤病毒、bk多瘤病毒、猴痘病毒、带状疱疹病毒、爱泼斯坦-巴尔病毒、人疱疹病毒7、卡波西氏肉瘤相关疱疹病毒和人细小病毒b19。
[0256]
48.实施方式45的方法,其中所述病毒基因组是单链的。
[0257]
49.实施方式45的方法,其中所述病毒基因组包装在病毒体中。
[0258]
50.实施方式45的方法,其中所述病毒基因组是用于将可表达基因递送至人细胞的基因治疗载体。
[0259]
51.实施方式45的方法,其中所述病毒基因组是用于裂解靶肿瘤细胞的细胞毒性病毒。
[0260]
52.实施方式45的方法,其中所述抑制性核酸序列包含c41寡核苷酸序列(seq id no:1)。
[0261]
53.实施方式45的方法,其中所述抑制性核酸序列包含c41序列的多个拷贝(seq id no:1)。
[0262]
54.实施方式45的方法,其中所述抑制性核酸序列包含由接头序列分开的两个拷贝的c41序列(seq id no:1)。
[0263]
55.实施方式54的方法,其中所述接头序列是aaaaa(seq id no:8)。
[0264]
56.实施方式45的方法,其中所述抑制性核酸序列是细菌序列。
[0265]
57.实施方式45的方法,其中所述病毒基因组包含用于递送至人细胞并在其中表达的基因。
[0266]
58.实施方式45的方法,其中重复所述施用步骤。
[0267]
59.一种制备重组病毒的病毒基因组的方法,其包括:
[0268]
将抑制性核酸序列插入病毒基因组中,其中所述抑制性核酸序列与tlr9结合但不引发tlr9活化。
[0269]
60.如实施方式59所述的方法,其还包括:
[0270]
将所述病毒基因组包装在病毒体中。
[0271]
61.实施方式59的方法,其中所述插入步骤使用dna连接酶。
[0272]
62.实施方式59的方法,其中所述病毒基因组选自腺病毒、单纯疱疹病毒、水痘、天花病毒、乙型肝炎病毒、巨细胞病毒、jc多瘤病毒、bk多瘤病毒、猴痘病毒、带状疱疹病毒、爱泼斯坦-巴尔病毒、人疱疹病毒7、卡波西氏肉瘤相关疱疹病毒和人细小病毒b19。
[0273]
63.实施方式59的方法,其中所述病毒基因组在病毒体中时是单链的。
[0274]
64.实施方式59的方法,其中所述病毒基因组是用于将可表达基因递送至人细胞的基因治疗载体。
[0275]
65.实施方式59的方法,其中所述病毒基因组是用于裂解靶肿瘤细胞的细胞毒性病毒。
[0276]
66.实施方式59的方法,其中所述抑制性核酸序列包含c41寡核苷酸序列(seq id no:1)。
[0277]
67.实施方式59的方法,其中所述抑制性核酸序列包含多个拷贝的c41序列(seq id no:1)。
[0278]
68.实施方式59的方法,其中所述抑制性核酸序列包含由接头序列分开的两个拷贝的c41序列(seq id no:1)。
[0279]
69.实施方式68的方法,其中所述接头序列是aaaaa(seq id no:8)。
[0280]
70.实施方式59的方法,其中所述抑制性核酸序列是细菌序列。
[0281]
71.实施方式59的方法,其中所述重组病毒的病毒基因组包含用于递送至人细胞并在其中表达的基因。
[0282]
72.一种核酸分子,其包含:
[0283]
反向末端重复序列(itr)和抑制tlr9介导的炎症的核酸序列。
[0284]
73.一种用于向哺乳动物细胞递送所需功能的重组病毒,其包含:
[0285]
包含抑制tlr9介导的炎症的核酸序列的病毒基因组。
[0286]
74.一种制备重组病毒的病毒基因组的方法,其包括:
[0287]
将核酸序列插入病毒基因组中,其中所述核酸序列抑制tlr9介导的炎症。
[0288]
75.一种包含能够抑制tlr9介导的炎症的至少一种核酸序列的核酸载体。
[0289]
76.实施方式75的核酸载体,其包含多个所述核酸序列。
[0290]
77.实施方式75的核酸载体,其中接头将每个所述核酸序列分开。
[0291]
78.实施方式75的核酸载体,其包含至少2个、至少3个、至少4个或至少5个拷贝的所述核酸序列。
[0292]
79.实施方式75的核酸载体,其中所述核酸与基因共价连接。
[0293]
80.一种降低具有基因组的经修饰的病毒的免疫原性的方法,所述方法包括在所述基因组中插入核酸序列,所述抑制性核酸序列抑制tlr9介导的炎症,由此所述经修饰的病毒与不含所述核酸序列的病毒相比在宿主中引起降低的炎症反应。
[0294]
81.一种增加通过病毒引入的转基因在宿主细胞中的表达的方法,所述方法包括向宿主中引入具有基因组的经修饰的病毒,所述基因组包含核酸序列,所述核酸序列抑制tlr9介导的炎症,由此与不含所述核酸序列的病毒相比,所述经修饰的病毒导致宿主细胞中更高的转基因表达。
[0295]
82.一种包含病毒衣壳的组合物,所述病毒衣壳包裹抑制tlr9介导的炎症的核酸序列。
[0296]
83.实施方式2的重组病毒,其中所述抑制性核酸序列与c41寡核苷酸序列tggcgcgcacccacggcctg(seq id no:1)具有95%同一性。
[0297]
84.实施方式2的重组病毒,其中所述抑制性核酸序列与seq id no:9具有95%同一性。
[0298]
85.实施方式2的重组病毒,其中所述抑制性核酸序列与选自由以下组成的组的序列具有95%同一性:
[0299]
odn 2088:tcc tgg cgg gga agt(seq id no:2);
[0300]
odn 4084-f:cctggatgggaa(seq id no:3);
[0301]
odn inh-1:cctggatgggaattcccatccagg(seq id no:4);
[0302]
odn inh-18:cct gga tgg gaa ctt acc gct gca(seq id no:5);
[0303]
odn ttaggg:tt agg gtt agg gtt agg gtt agg g(seq id no:6);和
[0304]
g-odn:ctc cta ttg ggg gtt tcc tat(seq id no:7)。
[0305]
86.实施方式2的重组病毒,其中所述抑制性核酸序列与选自由以下组成的组的序列具有95%同一性:
[0306]
odn 2114:tcctggaggggaagt(seq id no:16);
[0307]
odn 4024:tcctggatgggaagt(seq id no:17);
[0308]
odn inh-4:ttcccatccaggcctggatgggaa(seq id no:18);
[0309]
odn inh-13:cttaccgctgcacctggatgggaa(seq id no:19);
[0310]
odn poly-g:gggggggggggggggggggg(seq id no:20);
[0311]
odn gpg:tgactgtgaaggttagagatga(seq id no:21);
[0312]
odn irs-869:tcctggaggggttgt(seq id no:22);
[0313]
odn irs-954:tgctcctggaggggttgt(seq id no:23);和
[0314]
odn 21158:cctggcgggg(seq id no:24)。
[0315]
87.实施方式45的方法,其中所述抑制性核酸序列包含seq id no:6或seq id no:9。
[0316]
88.实施方式45的方法,其中所述抑制性核酸序列包含多个拷贝的seq id no:6和/或seq id no:9。
[0317]
89.实施方式45的方法,其中所述抑制性核酸序列包含由接头序列分开的两个拷贝的seq id no:6和/或seq id no:9。
[0318]
90.实施方式45的方法,其中所述抑制性核酸序列是人序列。
[0319]
参考文献
[0320]
1.naldini l.gene therapy returns to centre stage.nature.2015;526(7573):351-60.doi:10.1038/nature15818.pubmed pmid:26469046.
[0321]
2.yla-herttuala s.endgame:glybera finally recommended for approval as the first gene therapy drug in the european union.mol ther.2012;20(10):1831-2.doi:10.1038/mt.2012.194.pubmed pmid:23023051;pubmed central pmcid:pmcpmc3464639.
[0322]
3.gaudet d,methot j,kastelein j.gene therapy for lipoprotein lipase deficiency.curr opin lipidol.2012;23(4):310-20.doi:10.1097/mol.0b013e3283555a7e.pubmed pmid:22691709.
[0323]
4.samulski rj,muzyczka n.aav-mediated gene therapy for research and therapeutic purposes.annu rev virol.2014;1(1):427-51.doi:10.1146/annurev-virology-031413-085355.pubmed pmid:26958729.
[0324]
5.mingozzi f,high ka.therapeutic in vivo gene transfer for genetic disease using aav:progress and challenges.nat rev genet.2011;12(5):341-55.doi:10.1038/nrg2988.pubmed pmid:21499295.
[0325]
6.kotterman ma,schaffer dv.engineering adeno-associated viruses for clinical gene therapy.nat rev genet.2014;15(7):445-51.doi:10.1038/nrg3742.pubmed pmid:24840552;pubmed central pmcid:pmcpmc4393649.
[0326]
7.mclaughlin sk,collis p,hermonat pl,muzyczka n.adeno-associated virus general transduction vectors:analysis of proviral structures.j virol.1988;62(6):1963-73.pubmed pmid:2835501;pubmed central pmcid:pmcpmc253280.
[0327]
8.hauswirth ww,berns ki.origin and termination of adeno-associated virus dna replication.virology.1977;78(2):488-99.pubmed pmid:867815.
[0328]
9.zhong l,zhou x,li y,qing k,xiao x,samulski rj,et al.single-polarity recombinant adeno-associated virus 2 vector-mediated transgene expression in vitro and in vivo:mechanism of transduction.mol ther.2008;16(2):290-5.doi:10.1038/sj.mt.6300376.pubmed pmid:18087261.
[0329]
10.zhoux,zengx,fanz,lic,mccownt,samulskirj,etal.adeno-associatedvirusofasingle-polaritydnagenomeiscapableoftransductioninvivo.molther.2008;16(3):494-9.doi:10.1038/sj.mt.6300397.pubmedpmid:18180769.
[0330]
11.samulskirj,changls,shenkt.arecombinantplasmidfromwhichaninfectiousadeno-associatedvirusgenomecanbeexcisedinvitroanditsusetostudyviralreplication.jvirol.1987;61(10):3096-101.pubmedpmid:3041032;pubmedcentralpmcid:pmcpmc255885.
[0331]
12.mccartydm.self-complementaryaavvectors;advancesandapplications.molther.2008;16(10):1648-56.doi:10.1038/mt.2008.171.pubmedpmid:18682697.
[0332]
13.mccartydm,monahanpe,samulskirj.self-complementaryrecombinantadeno-associatedvirus(scaav)vectorspromoteefficienttransductionindependentlyofdnasynthesis.genether.2001;8(16):1248-54.doi:10.1038/sj.gt.3301514.pubmedpmid:11509958.
[0333]
14.calcedor,morizonoh,wangl,mccarterr,hej,jonesd,etal.adeno-associatedvirusantibodyprofilesinnewborns,children,andadolescents.clinvaccineimmunol.2011;18(9):1586-8.doi:10.1128/cvi.05107-11.pubmedpmid:21775517;pubmedcentralpmcid:pmcpmc3165215.
[0334]
15.calcedor,vandenberghelh,gaog,linj,wilsonjm.worldwideepidemiologyofneutralizingantibodiestoadeno-associatedviruses.jinfectdis.2009;199(3):381-90.doi:10.1086/595830.pubmedpmid:19133809.
[0335]
16.bainbridgejw,smithaj,barkerss,robbies,hendersonr,balaggank,etal.effectofgenetherapyonvisualfunctioninleber'scongenitalamaurosis.nengljmed.2008;358(21):2231-9.doi:10.1056/nejmoa0802268.pubmedpmid:18441371.
[0336]
17.maguiream,highka,auricchioa,wrightjf,pierceea,testaf,etal.age-dependenteffectsofrpe65genetherapyforleber'scongenitalamaurosis:aphase1dose-escalationtrial.lancet.2009;374(9701):1597-605.doi:10.1016/s0140-6736(09)61836-5.pubmedpmid:19854499;pubmedcentralpmcid:pmcpmc4492302.
[0337]
18.maguiream,simonellif,pierceea,pughen,jr.,mingozzif,bennicellij,etal.safetyandefficacyofgenetransferforleber'scongenitalamaurosis.nengljmed.2008;358(21):2240-8.doi:10.1056/nejmoa0802315.pubmedpmid:18441370;pubmedcentralpmcid:pmcpmc2829748.
[0338]
19.jacobsonsg,cideciyanav,ratnakaramr,heone,schwartzsb,romanaj,etal.genetherapyforlebercongenitalamaurosiscausedbyrpe65mutations:safetyandefficacyin15childrenandadultsfollowedupto3years.archophthalmol.2012;130(1):9-24.doi:10.1001/archophthalmol.2011.298.pubmedpmid:
21911650;pubmed central pmcid:pmcpmc3600816.
[0339]
20.kaplitt mg,feigin a,tang c,fitzsimons hl,mattis p,lawlor pa,et al.safety and tolerability of gene therapy with an adeno-associated virus(aav)borne gad gene for parkinson'sdisease:an open label,phase i trial.lancet.2007;369(9579):2097-105.doi:10.1016/s0140-6736(07)60982-9.pubmed pmid:17586305.
[0340]
21.leone p,shera d,mcphee sw,francis js,kolodny eh,bilaniuk lt,et al.long-term follow-up after gene therapy for canavan disease.sci transl med.2012;4(165):165ra3.doi:10.1126/scitranslmed.3003454.pubmed pmid:23253610;pubmed central pmcid:pmcpmc3794457.
[0341]
22.manno cs,pierce gf,arruda vr,glader b,ragni m,rasko jj,et al.successful transduction of liver in hemophilia by aav-factor ix and limitations imposed by the host immune response.nat med.2006;12(3):342-7.doi:10.1038/nm1358.pubmed pmid:16474400.
[0342]
23.nathwani ac,tuddenham eg,rangarajan s,rosales c,mcintosh j,linch dc,et al.adenovirus-associated virus vector-mediated gene transfer in hemophilia b.n engl j med.2011;365(25):2357-65.doi:10.1056/nejmoa1108046.pubmed pmid:22149959;pubmed central pmcid:pmcpmc3265081.
[0343]
24.carpentier ac,frisch f,labbe sm,gagnon r,de wal j,greentree s,et al.effect of alipogene tiparvovec(aav1-lpl(s447x))on postprandial chylomicron metabolism in lipoprotein lipase-deficient patients.j clin endocrinol metab.2012;97(5):1635-44.doi:10.1210/jc.2011-3002.pubmed pmid:22438229.
[0344]
25.manno cs,chew aj,hutchison s,larson pj,herzog rw,arruda vr,et al.aav-mediated factor ix gene transfer to skeletal muscle in patients with severe hemophilia b.blood.2003;101(8):2963-72.doi:10.1182/blood-2002-10-3296.pubmed pmid:12515715.
[0345]
26.jaski be,jessup ml,mancini dm,cappola tp,pauly df,greenberg b,et al.calcium upregulation by percutaneous administration of gene therapy in cardiac disease(cupid trial),a first-in-human phase 1/2 clinical trial.j card fail.2009;15(3):171-81.doi:10.1016/j.cardfail.2009.01.013.pubmed pmid:19327618;pubmed central pmcid:pmcpmc2752875.
[0346]
27.ran fa,cong l,yan wx,scott da,gootenberg js,kriz aj,et al.in vivo genome editing using staphylococcus aureus cas9.nature.2015;520(7546):186-91.doi:10.1038/nature14299.pubmed pmid:25830891;pubmed central pmcid:pmcpmc4393360.
[0347]
28.balazs ab,chen j,hong cm,rao ds,yang l,baltimore d.antibody-based protection against hiv infection by vectored immunoprophylaxis.nature.2011;481(7379):81-4.doi:10.1038/nature10660.pubmed pmid:22139420;pubmed central pmcid:pmcpmc3253190.
9.mediators inflamm.2010;2010:986596.doi:10.1155/2010/986596.pubmed pmid:20490286;pubmed central pmcid:pmcpmc2873634.
[0369]
50.trieu a,roberts tl,dunn ja,sweet mj,stacey kj.dna motifs suppressing tlr9 responses.crit rev immunol.2006;26(6):527-44.pubmed pmid:17341193.
[0370]
51.krieg am,wu t,weeratna r,efler sm,love-homan l,yang l,et al.sequence motifs in adenoviral dna block immune activation by stimulatory cpg motifs.proc natl acad sci u s a.1998;95(21):12631-6.pubmed pmid:9770537;pubmed central pmcid:pmcpmc22882.
[0371]
52.gursel i,gursel m,yamada h,ishii kj,takeshita f,klinman dm.repetitive elements in mammalian telomeres suppress bacterial dna-induced immune activation.j immunol.2003;171(3):1393-400.pubmed pmid:12874230.
[0372]
53.stunz ll,lenert p,peckham d,yi ak,haxhinasto s,chang m,et al.inhibitory oligonucleotides specifically block effects of stimulatory cpg oligonucleotides in b cells.eur j immunol.2002;32(5):1212-22.doi:10.1002/1521-4141(200205)32:5<1212::aid-immu1212>3.0.co;2-d.pubmed pmid:11981808.
[0373]
54.lenert p,rasmussen w,ashman rf,ballas zk.structural characterization of the inhibitory dna motif for the type a(d)-cpg-induced cytokine secretion and nk-cell lytic activity in mouse spleen cells.dna cell biol.2003;22(10):621-31.doi:10.1089/104454903770238094.pubmed pmid:14611683.
[0374]
55.lenert p,yasuda k,busconi l,nelson p,fleenor c,ratnabalasuriar rs,et al.dna-like class r inhibitory oligonucleotides(inh-odns)preferentially block autoantigen-induced b-cell and dendritic cell activation in vitro and autoantibody production in lupus-prone mrl-fas(lpr/lpr)mice in vivo.arthritis res ther.2009;11(3):r79.doi:10.1186/ar2710.pubmed pmid:19476613;pubmed central pmcid:pmcpmc2714127.
[0375]
56.lenert ps.targeting toll-like receptor signaling in plasmacytoid dendritic cells and autoreactive b cells as a therapy forlupus.arthritis res ther.2006;8(1):203.doi:10.1186/ar1888.pubmed pmid:16542467;pubmed central pmcid:pmcpmc1526546.
[0376]
57.kaminski jj,schattgen sa,tzeng tc,bode c,klinman dm,fitzgerald ka.synthetic oligodeoxynucleotides containing suppressive ttaggg motifs inhibit aim2 inflammasome activation.j immunol.2013;191(7):3876-83.doi:10.4049/jimmunol.1300530.pubmed pmid:23986531;pubmed central pmcid:pmcpmc3878640.
[0377]
58.shirota h,gursel i,gursel m,klinman dm.suppressive oligodeoxynucleotides protect mice from lethal endotoxic shock.j immunol.2005;174(8):4579-83.pubmed pmid:15814679.
[0378]
59.peter m,bode k,lipford gb,eberle f,heeg k,dalpke ah.characterization of suppressive oligodeoxynucleotides that inhibit toll-like receptor-9-mediated activation of innate immunity.immunology.2008;123(1):118-28.doi:10.1111/j.1365-2567.2007.02718.x.pubmed pmid:17961163;pubmed centralpmcid:pmcpmc2433270.
[0379]
60.ohto u,shibata t,tanji h,ishida h,krayukhina e,uchiyama s,et al.structural basis of cpg and inhibitory dna recognition by toll-like receptor 9.nature.2015;520(7549):702-5.doi:10.1038/nature14138.pubmed pmid:25686612.
[0380]
61.li y,cao h,wang n,xiang y,lu y,zhao k,et al.a novel antagonist of tlr9 blocking all classes of immunostimulatory cpg-odns.vaccine.2011;29(11):2193-8.doi:10.1016/j.vaccine.2010.10.042.pubmed pmid:21036131.
[0381]
62.xiong w,maccoll garfinkel ae,li y,benowitz li,cepko cl.nrf2 promotes neuronal survival in neurodegeneration and acute nerve damage.j clin invest.2015;125(4):1433-45.doi:10.1172/jci79735.pubmed pmid:25798616;pubmed central pmcid:pmcpmc4396467.
[0382]
63.mingozzi f,high ka.immune responses to aav vectors:overcoming barriers to successful gene therapy.blood.2013;122(1):23-36.doi:10.1182/blood-2013-01-306647.pubmed pmid:23596044;pubmed central pmcid:pmcpmc3701904.
[0383]
64.karlstetter m,ebert s,langmann t.microglia in the healthy and degenerating retina:insights from novel mouse models.immunobiology.2010;215(9-10):685-91.doi:10.1016/j.imbio.2010.05.010.pubmed pmid:20573418.
[0384]
65.chinnery hr,naranjo golborne c,leong cm,chen w,forrester jv,mcmenamin pg.retinal microglial activation following topical application of intracellular toll-like receptor ligands.invest ophthalmol vis sci.2015;56(12):7377-86.doi:10.1167/iovs.15-17587.pubmed pmid:26574796.
[0385]
66.doi y,mizuno t,maki y,jin s,mizoguchi h,ikeyama m,et al.microglia activated with the toll-like receptor 9 ligand cpg attenuate oligomeric amyloid{beta}neurotoxicity in in vitro and in vivo models of alzheimer's disease.am j pathol.2009;175(5):2121-32.doi:10.2353/ajpath.2009.090418.pubmed pmid:19834064;pubmed central pmcid:pmcpmc2774075.
[0386]
67.chinnery hr,mclenachan s,binz n,sun y,forrester jv,degli-esposti ma,et al.tlr9 ligand cpg-odn applied to the injured mouse cornea elicits retinal inflammation.am j pathol.2012;180(1):209-20.doi:10.1016/j.ajpath.2011.09.041.pubmed pmid:22085974;pubmed central pmcid:pmcpmc3338340.
[0387]
68.ye gj,budzynski e,sonnentag p,nork tm,miller pe,sharma ak,et al.safety and biodistribution evaluation in cynomolgus macaques of raav2tyf-pr1.7-hcngb3,a recombinant aav vector for treatment of achromatopsia.hum gene ther clin dev.2016.doi:10.1089/hum.2015.164.pubmed pmid:26956923.
[0388]
69.komaromy am,alexander jj,rowlan js,garcia mm,chiodo va,kaya a,et al.gene therapy rescues cone function in congenital achromatopsia.hum mol genet.2010;19(13):2581-93.doi:10.1093/hmg/ddq136.pubmed pmid:20378608;pubmed central pmcid:pmcpmc2883338.
[0389]
70.schoenborn jr,wilson cb.regulation of interferon-gamma during innate and adaptive immune responses.adv immunol.2007;96:41-101.doi:10.1016/s0065-2776(07)96002-2.pubmed pmid:17981204.
[0390]
71.imai y,ibata i,ito d,ohsawa k,kohsaka s.a novel gene iba1 in the major histocompatibility complex class iii region encoding an ef hand protein expressed in a monocytic lineage.biochem biophys res commun.1996;224(3):855-62.doi:10.1006/bbrc.1996.1112.pubmed pmid:8713135.
[0391]
72.ito d,imai y,ohsawa k,nakajima k,fukuuchi y,kohsaka s.microglia-specific localisation of a novel calcium binding protein,iba1.brain res mol brain res.1998;57(1):1-9.pubmed pmid:9630473.
[0392]
73.gray jt,zolotukhin s.design and construction of functional aav vectors.methods mol biol.2011;807:25-46.doi:10.1007/978-1-61779-370-7_2.pubmed pmid:22034025.
[0393]
74.matsuda t,cepko cl.electroporation and rna interference in the rodent retina in vivo and in vitro.proc natl acad sci u s a.2004;101(1):16-22.doi:10.1073/pnas.2235688100.pubmed pmid:14603031;pubmed central pmcid:pmcpmc314130.
[0394]
75.wang s,sengel c,emerson mm,cepko cl.a gene regulatory network controls the binary fate decision of rod and bipolar cells in the vertebrate retina.dev cell.2014;30(5):513-27.doi:10.1016/j.devcel.2014.07.018.pubmed pmid:25155555;pubmed central pmcid:pmcpmc4304698.
[0395]
76.martino at,herzog rw,anegon i,adjali o.measuring immune responses to recombinant aav gene transfer.methods mol biol.2011;807:259-72.doi:10.1007/978-1-61779-370-7_11.pubmed pmid:22034034;pubmed central pmcid:pmcpmc3593270.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1