一种鉴定小麦千粒重性状的SNP位点、CAPS分子标记引物对及其应用
一种鉴定小麦千粒重性状的snp位点、caps分子标记引物对及其应用
技术领域
1.本发明属于基因工程领域,具体涉及一种鉴定小麦千粒重性状的snp位点、caps分子标记引物对及其应用。
背景技术:
2.小麦(triticum aestivuml.)的基因组为异源六倍体,由a、b和d三个同源性极高的基因组组成,基因组庞大且复杂,这为小麦遗传育种研究的发展提供了挑战。小麦是一种重要的粮食作物,选育高产小麦品种一直被育种家高度重视。研究证明,主要受籽粒大小性状影响的千粒重是小麦最稳定的产量直接构成因素,小麦的千粒重每增加1g,每公顷小麦的产量将增加140-160kg(tian et al.2006)。可见,提高小麦千粒重以增加产量是小麦最重要的育种目标之一。小麦的产量由小穗数、穗粒数和千粒重等三要素构成,中国小麦产量的提高主要是依靠增加穗粒数和千粒重(王兰芬等);而淀粉占小麦籽粒干重的65-75%,淀粉合成的量及所占比例显著影响小麦千粒重,从而影响小麦产量。
3.淀粉的合成是一个复杂的过程,目前已经确认参与胚乳淀粉合成的酶主要有六种,包括腺苷二磷酸葡萄糖焦磷酸化酶(agpase)、颗粒结合型淀粉合成酶(gbss)、可溶性淀粉合成酶(ss)、分支酶(be)、去分支酶(dbe)和葡萄糖-6磷酸转移酶(gpt1)等。由于这些酶的相互作用,保证了植物体合成新的淀粉从而满足自身需求,其中agpase在高等植物中催化1-磷酸葡萄糖(g-1-p)与腺苷三磷酸(atp)形成腺苷二磷酸葡萄糖(adpg)和焦磷酸(ppi),而adpg是直链和支链淀粉合成的底物,同时其浓度直接影响淀粉合成的速率和效率,因此agpase是小麦、水稻和玉米等高等植物中淀粉合成途径中的关键酶。王月福等研究表明agpase的活性变化与籽粒灌浆速率和淀粉含量的积累呈显著地正相关。smidansky等人将含有特异位点突变的玉米agpase基因转入小麦中,能够显著增加籽粒的重量及其淀粉含量;但如果该基因发生突变或进行人工敲除,则该酶的活性会随之降低或消失,从而抑制淀粉的合成。目前为止,在小麦中对于taagps基因的优良等位变异筛选及其分子标记几乎没有报道,这极大阻碍了小麦淀粉合成关键基因agpase在小麦产量性状改良中的应用。因此,克隆与小麦千粒重相关基因taagpl1,开发相关的功能标记,进行单倍型分析,并与千粒重性状进行关联分析寻找优异的单倍型,对于提高小麦千粒重、获得高产小麦新品种具有极其重要的意义。
技术实现要素:
4.本发明的目的在于提供一种鉴定小麦千粒重性状的snp位点、caps分子标记引物对及其应用,检测小麦taagpl1-1b基因优异等位变异,筛选和鉴定小麦千粒重性状,提高高千粒重小麦种质的选育效率。
5.本发明提供了一种鉴定小麦千粒重性状的snp位点,所述snp位点位于小麦taagpl1-1b基因编码区序列第1944bp处,且多态性为a/c。
6.优选的,所述taagpl1-1b基因编码区cds序列如seq id no.1所示。
7.本发明还提供了一种鉴定所述snp位点的caps分子标记引物对,包括序列为seq id no.2所示的上游引物caps-f和序列为seq id no.3所示的下游引物caps-r。
8.本发明还提供了一种检测小麦中taagpl1-1b基因的优异等位变异的方法,包括如下步骤:
9.利用所述的引物对对待测材料的基因组dna进行pcr扩增,得pcr扩增产物;
10.用限制性内切酶taq i对所述pcr扩增产物进行酶切,检测酶切产物的多态性;
11.当所述酶切产物包括401bp和42bp的两个短片段时,等位变异类型为taagpl1-1b-c;当所述酶切产物没有短片段时,等位变异类型为taagpl1-1b-a。
12.优选的,所述pcr扩增使用的反应体系以50μl计包括:待测材料的基因组dna 20ng,10μm上游引物caps-f 0.3μl,10μm下游引物caps-r 0.3μl,2
×
kod onetm pcr master mix 25μl和余量的ddh2o;
13.所述pcr扩增反应的程序为:第一阶段94℃预变性3min;第二阶段98℃变性10s,59℃退火30s,68℃延伸3min,32个循环;第三阶段:68℃终延伸5min。
14.本发明还提供了所述的snp位点或所述的caps分子标记引物对或所述的方法在小麦育种中的应用。
15.本发明还提供了所述的snp位点或所述的caps分子标记引物对或所述的方法在小麦辅助育种中的应用。
16.本发明还提供了所述的snp位点或所述的caps分子标记引物对或所述的方法在鉴定小麦千粒重类型中的应用。
17.本发明还提供了所述的snp位点或所述的caps分子标记引物对或所述的方法在筛选高千粒重小麦中的应用。
18.本发明还提供了一种分子标记辅助选育高千粒重小麦的方法,利用所述caps分子标记引物对对目标小麦进行分子标记,筛选小麦taagpl1-1b基因编码区序列第1944bp处,多态性为c的种质进行后续筛选。
19.本发明提供的snp位点,位于小麦taagpl1-1b基因编码区第1944bp处,且多态性为a/c;当碱基为c时,为高千粒重小麦。利用本发明所述snp位点,能将高千粒重小麦和低千粒重的小麦区分开。
20.本发明采用casp分子标记引物对检测小麦中与千粒重相关的taagpl1-1b基因的等位变异,只需通过简单的dna提取、pcr特异性扩增、酶解检测即可完成对样品的鉴别,便于检测和筛选具有高千粒重的小麦品种或品系,可大大加快小麦高产品种的选育进程。
附图说明
21.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍。
22.图1为taagpl1-1b编码区与启动子的pcr扩增结果;
23.图2为taagpl1-1b启动子与编码区序列在普通六倍体小麦中的变异位点与形成的两种单倍型;
24.图3为taagpl1-1b-hap1和taagpl1-1b-hap2两种小麦单倍型在taagpl1-1b基因编
码区(1bp
─
3351bp)的核苷酸序列差异;
25.图4为taagpl1-1b-hap1和taagpl1-1b-hap2两种小麦单倍型taagpl1-1b基因启动子区域(-2225bp
─‑
1bp)的核苷酸序列差异;
26.图5为taagpl1-1b在两种单倍型小麦品种中的千粒重分析结果;
27.图6为taagpl1-1b-hap1和taagpl1-1b-hap2两种小麦单倍型扩增taagpl1-1b基因编码区片段(1901bp
─
2344bp)的核苷酸序列差异;
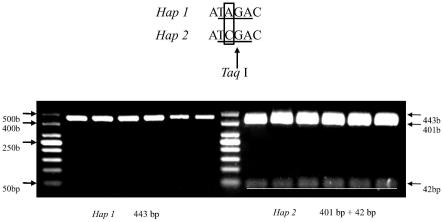
28.图7为taagpl1-1b启动子单倍型酶切产物电泳检测结果。
具体实施方式
29.本发明提供了一种鉴定小麦千粒重性状的snp位点,位于小麦taagpl1-1b基因编码区序列第1944bp处,且多态性为a/c;碱基为c时,所述小麦为千粒重小麦。
30.在本发明中,所述snp位点位于小麦taagpl1-1b基因编码区序列第1944bp位点,所述位点上存在a/c碱基突变,与小麦千粒重性状具有显著的相关性。本发明所述taagpl1-1b基因编码区序列在小麦基因组基因库(http://plants.ensembl.org/triticum_aestivum/info/index)中的登录号为traescs7b02g183300,所述taagpl1-1b基因编码区cds序列如seq id no.1所示。本发明所述snp的多态性位点位于taagpl1-1b基因编码区第1944bp处,且多态性为a/c。通过对所述snp位点进行鉴定分型可确定待测小麦千粒重性能:当所述位点为c碱基时,所述小麦千粒重性状为高千粒重。
31.本发明提供了鉴定所述的snp位点的caps分子标记引物对,包括序列为seq id no.2所示的上游引物caps-f(5
’‑
catgtgcagaaagtggaca-3’)和序列为seq id no.3所示的下游引物caps-r(5
’‑
agaaggatctgattgttcca-3’)。利用本发明所述caps分子标记引物对能够检测小麦中与千粒重相关的taagpl1-1b基因的等位变异,检测和筛选具有高千粒重的小麦品种或品系,可大大加快小麦高产品种的选育进程。
32.本发明提供了利用上述caps分子标记引物对检测小麦中taagpl1-1b基因的等位变异的方法,包括如下步骤:
33.利用所述引物对对待测材料的基因组dna进行pcr扩增,得pcr扩增产物;
34.用限制性内切酶taqi对所述pcr扩增产物进行酶切,检测酶切产物的多态性;
35.当所述酶切产物包括401bp和42bp的两个短片段时,等位变异类型为taagpl1-1b-c;当所述酶切产物没有短片段时,等位变异类型为taagpl1-1b-a。
36.本发明首先提取待测材料的基因组dna。本发明所述待测材料优选为小麦。本发明对所述小麦的种类没有特殊要求,任何种类的小麦均可。本发明对所述待测小麦基因组dna提取的方法没有特殊限定,采用本领域常规的植物细胞基因组提取方法即可。在本发明具体实施过程中,以待测小麦叶片或其他组织为材料,利用ctab法进行提取。本发明所述ctab法按照常规方法进行。
37.得小麦基因组dna后,本发明以待测小麦基因组dna为模板,利用所述引物对进行pcr扩增反应获得pcr扩增产物。本发明中所述pcr扩增反应使用的反应体系以10μl计优选的包括:小麦基因组dna 20ng,10μm上游引物caps-f 0.3μl,10μm下游引物caps-r0.3μl,2
×
kod onetm pcr master mix 25μl和余量的ddh2o。本发明所述kod onetm pcr master mix购买自东洋纺生物公司。本发明所述小麦基因组dna的浓度优选为100~200ng/μl;所述
基因组dna的od
260
/od
280
比值优选为0.6~0.8。
38.本发明所述pcr扩增反应的程序优选为:第一阶段94℃预变性3min;第二阶段98℃变性10s,59℃退火30s,68℃延伸3min,32个循环;第三阶段:68℃终延伸5min。
39.本发明在所述pcr扩增完成后,优选的将pcr扩增产物保存于4℃。本发明利用所述引物对能够扩增不同单倍型小麦中的taagpl1-1b片段(1901bp~2344bp),pcr扩增反应所得pcr扩增产物中含有目标snps位点所在的dna片段。
40.得pcr扩增产物后,对其扩增产物进行回收,并测定浓度。本发明用限制性内切酶taqi对所述pcr扩增产物进行酶切,得到酶切产物。本发明所述酶切使用的反应体系以10μl计优选包括:pcr扩增产物300ng,taq i 0.5μl,buffer 1μl、bsa1μl,补ddh2o至10μl。本发明所述taqi限制性内切酶购自于大连宝生物公司。
41.得到酶切产物后,本发明检测酶切产物的多态性,根据检测结果判断小麦中taagpl1-1b基因的等位变异类型。本发明所述检测优选采用琼脂糖凝胶电泳进行分析。本发明优选根据酶切产物的片段大小检测小麦中taagpl1-1b基因的等位变异,并且通过等位变异的类型能够判定小麦千粒重性状。具体的,当所述酶切产物包括401bp和42bp的两个短片段时,等位变异类型为taagpl1-1b-c,鉴定为高千粒重小麦;当所述酶切产物没有短片段时,等位变异类型为taagpl1-1b-a,鉴定为低千粒重小麦。
42.本发明还提供了上述的snp位点或caps分子标记引物对或方法在(a)~(d)任一项中的应用:
43.(a)小麦育种;(b)小麦辅助育种;(c)鉴定小麦千粒重类型;(d)筛选高千粒重小麦。
44.本发明还提供了一种分子标记辅助选育高千粒重小麦的方法,利用上述caps分子标记引物对对目标小麦进行分子标记,筛选小麦taagpl1-1b基因编码区序列第1944bp处,多态性为c的种质进行后续筛选。
45.为了进一步说明本发明,下面结合附图和实施例对本发明提供的技术方案进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
46.实施例1
47.1.引物设计
48.根据taagpl1基因的三拷1a、1b、1d在小麦基因组数据库(http://plants.ensembl.org/triticum_aestivum/info/index)中的序列差异(taagpl1-1a:traescs7a02g287400,taagpl1-1b:traescs7b02g183300,taagpl1-1d:traescs7d02g284900),设计taagpl1-1b特异的启动子扩增引物taagpl1-1b-promoter-sf(seq id no.4)和taagpl1-1b-promoter-sr(seq id no.5),以及编码区扩增引物taagpl1-1b-cds-sf1(seq id no.6)、taagpl1-1b-cds-sr2(seq id no.7)、taagpl1-1b-cds-sf2(seq id no.8)和taagpl1-1b-cds-sr2(seq id no.9),引物合成与测序由河南尚亚生物技术公司完成,具体核苷酸序列如下:
49.taagpl1-1b-promoter-sf:5
’‑
tcgctcgctcttcttcagc-3’;
50.taagpl1-1b-promoter-sr:5
’‑
tgccaccgccgagtatgacg-3’;
51.taagpl1-1b-cds-sf1:5
’‑
atgcttctcaacttctcgt-3’;
52.taagpl1-1b-cds-sr2:5
’‑
gctgagacgagtgctaacc-3’;
53.taagpl1-1b-cds-sf2:5
’‑
catgtggatgacaatgctgac-3’;
54.taagpl1-1b-cds-sr2:5
’‑
cttactactgatgctgcctgc-3’。
55.2.小麦总dna的提取
56.随机选取321份普通小麦品种,采用ctab法提取小麦总dna:首先将小麦叶片或其他组织液氮速冻研磨,加入1ml预热的ctab抽提液,65℃水浴1h。然后12000g离心后,取上清加入等体积的氯仿:异戊醇(24:1)混合液振荡。12000g离心10min,将上清转移至新管,加入2倍体积无水乙醇混匀,-20℃静置30min。再离心去上清,用75%乙醇洗涤两遍,晾干后,加入100μl无菌水溶解dna。
57.3.taagpl1-1b基因启动子与编码区的扩增与测序
58.以步骤2321个六倍体小麦dna为模板,分别利用taagpl1-1b-promoter-sf/r,taagpl1-1b-cds-sf1/r1与taagpl1-1b-cds-sf2/r2这三对引物,使用高保真pcr酶kod onetm pcr master mix(购自东洋纺生物公司)扩增taagpl1-1b的启动子与编码区序列,taagpl1-1b的启动子和编码区对应的核苷酸序列分别如seq id no.10和seq id no.1所示。
59.pcr体系中包含:25μl kod onetm pcr master mix(2
×
),上下游引物各0.3μl(10μm),200ngdna模板,补充ddh2o至总体积50μl。
60.pcr反应程序为:第一阶段,94℃预变性3min;第二阶段,98℃变性10s,59℃退火30s,68℃延伸3min,32个循环;第三阶段,68℃保持5min。
61.扩增结果如图1所示:其中,图1中(a)为以taagpl1-1b-promoter-sf/r为扩增引物对扩增的taagpl1-1b的启动子片段,大小为2320bp;图1中(b)为以taagp l1-1b-cds-sf1/r1为扩增引物对扩增的taagpl1-1b的编码区片段,大小为1873bp;图1中(c)为以taagpl1-1b-cds-sf2/r2为扩增引物对扩增的taagpl1-1b的编码区片段,大小为1964bp。
62.分别回收321个品种的pcr扩增目的片段,并与zt4-blunt克隆载体(购自于庄盟生物公司)连接,转化大肠杆菌,每个小麦品种挑取三个以上阳性克隆,用通用引物t7-f/r(购买自庄盟生物公司,t7的上游引物t7-f的核苷酸序列如seq id no.11所示:5
’‑
taatacgactcactataggg-3’;t7的下游引物t7-r的核苷酸序列如seq id no.12所示:5
’‑
aagaacatcgattttccatggcag-3’)测序。
63.4.taagpl1-1b基因启动子与编码区的序列比对与单倍型分析
64.使用dnaman软件(http://www.lynnon.com)对测序结果进行拼接并进行序列比对。序列比对结果发现在321个小麦品种中的taagpl1-1b编码区中(1bp
─
3351bp)存在4个snp(1944 a/c,2209 g/c,2566 c/t,2209 g/a),其中2个snp(1944 a/c,2566 c/t)位于外显子上,但不会引起编码氨基酸的改变,属于无义突变位点。
65.启动子区域(-2225bp
─‑
1bp)存在8个snp多态性变异位点,通过dnasp5.10软件(http://www.ub.edu/dnasp)对启动子进行单倍型鉴定,结果发现这12个snp紧密连锁形成两种单倍型,分别命名为taagpl1-1b-hap1、taagpl1-1b-hap2,具体如图2所示,其中taagpl1-1b-hap1和taagpl1-1b-hap2两种单倍型在taagpl1-1b基因编码区(1bp
─
3351bp)的核苷酸序列差异如图3所示;在taagpl1-1b基因启动子区域(-2225bp
─‑
1bp)的核苷酸序列差异如图4所示。
66.5.不同单倍型小麦品种在六倍体小麦中的千粒重分析
67.步骤1321种小麦品种的单倍型及在六倍体小麦中的千粒重情况如表1,taagpl1-1b-hap1单倍型的平均千粒重和taagpl1-1b-hap2单倍型的平均千粒重比较结果如表2和图5。
68.表1不同小麦品种的单倍型及千粒重
69.70.71.72.73.74.75.76.77.78.[0079][0080]
表2六倍体小麦taagpl1-1b单倍型平均千粒重
[0081][0082]
根据表1~2和图5可以看出,321个小麦品种中,共有166个品种小麦为hap1单倍型,并且平均千粒重为34.91g;155个品种小麦为hap2单倍型,并且平均千粒重为42.20g,在hap2单倍型小麦品种的平均千粒重显著高于hap1单倍型中最高,hap2为高千粒重优异单倍型。
[0083]
6.caps分子标记开发
[0084]
根据图2记载的内容可以看出,taagpl1-1b两种单倍型存在单碱基的差异,hap2其中一个snp:1944bp(c/a)位于序列tcga;hap1其中一个snp:1944bp(c/a)位于序列taga,根据此处的差异开发酶切扩增多态性(caps)分子标记,将taagpl1-1b基因编码区序列第1944bp的多态性标记命名为caps-1944。
[0085]
在识别caps-1944的snp上下游设计引物caps-f和caps-r,以步骤1hap1单倍型小麦品种hap1单倍型小麦二芒麦、hap1单倍型小麦洛旱13、hap1单倍型小麦五花头、hap1单倍型小麦蚰子麦、hap1单倍型小麦科农199和hap1单倍型小麦石4185,以及hap2单倍型小麦品种hap2单倍型小麦宛原选9号、hap2单倍型小麦洋白麦、ha p2单倍型小麦科农9204、hap2单倍型小麦小偃54、hap2单倍型小麦京411和hap2单倍型小麦石新828的dna为模板,扩增不同小麦品种中的taagpl1-1b片段(1902bp—2344bp),taagpl1-1b-hap1和taagpl1-1b-hap2两种小麦单倍型扩增taagpl1-1b基因编码区片段(1901bp—2344bp)的核苷酸序列差异如图6。使用taqi对纯化的pcr产物进行酶切,对酶解产物进行电泳检验,电泳检测结果如图7,其中图7从左到右对应的依次为hap1单倍型小麦二芒麦、hap1单倍型小麦洛旱13、hap1单倍型小麦五花头、hap1单倍型小麦蚰子麦、hap1单倍型小麦科农199、hap1单倍型小麦石4185、hap2单倍型小麦宛原选9号、hap2单倍型小麦洋白麦、hap2单倍型小麦科农9204、hap2单倍型小麦小偃54、hap2单倍型小麦京411和hap2单倍型小麦石新828。
[0086]
由图7可以看出,hap1单倍型小麦品种扩增产物经酶切后仍为单一的443bp的条带,而hap2单倍型材料的扩增产物经酶切后则变为两个片段,分别为401bp和42bp,本发明caps-1944分子标记能够区分hap2与其它单倍型,与小麦千粒重形状具有显著的相关性,利用本发明所述snp位点能够筛选高千粒重小麦,可应用于高千粒重小麦新品种的分子设计育种。
[0087]
尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1