一种7-氧代雷酚内酯的不对称合成方法及其用途与流程
本发明属于有机化合物制备领域,具体地本发明涉及一种用于制备雷公藤甲素(triptolide)和雷公藤内酯酮(triptonide)的关键中间体7-氧代雷酚内酯的制备方法,以及利用该方法制备7-氧代雷酚内酯的过程中产生的一系列新化合物。
背景技术:
1、雷公藤(tripterygium wilfordii hook.f.)是一种传统中药,在我国有悠久的使用历史,用于祛风除湿、活血通络、消肿止痛、杀虫、消炎、解毒。1972年,美国科学家kupchan从雷公藤植物中分离得到了雷公藤甲素(化合物2,triptolide)和雷公藤内酯酮(化合物3,triptonide)。后续研究表明,这两个化合物具有良好的抗肿瘤,免疫抑制,消炎等活性。近期研究表明雷公藤内酯酮可以作为一种潜在的非激素类男性避孕药使用。复杂的分子结构和良好的生物活性使得雷公藤甲素成为合成化学和药物化学领域研究的热点分子。但遗憾的是在植物雷公藤中雷公藤甲素的含量极低,分离收率仅约0.001%,限制了相关研究的开展。因此发展高效的化学合成路线来制备这些珍贵的化合物具有重要的意义。
2、
3、1980年,berchtold小组报道了雷公藤甲素的首次全合成(j.am.chem.soc.1980,102,1200.)。他们以6-甲氧基-1-萘满酮为起始原料,采用烷基化反应的方法构建c10位的全碳季碳中心,然后经过分子内aldol反应和内酯化反应形成分子骨架,后续通过对氧化态的调整,完成了雷公藤甲素的全合成。该方法具有重要的学术价值,但由于路线冗长,起始原料价格昂贵,且只能用于外消旋产物的合成,因此不具备实际应用价值。
4、
5、1999年,杨丹课题组完成了雷公藤甲素2(triptolide)的首次不对称全合成(j.am.chem.soc.1999,121,5579.)。他们选用2-异丙基苯酚作为起始原料,发生多步碳链增长反应以后,与8-苯基薄荷醇缩合,得到手性酯基化合物。该化合物与醋酸锰作用后发生串联的自由基环化反应得到三环化合物。随后通过酯基还原和钯催化环化插羰反应构建不饱和内酯环,完成四环骨架的构建。该合成路线较长,所涉及的自由基环化等反应条件苛刻,使用的8-苯基薄荷醇等试剂价格昂贵,所以很难进行大量化合物的制备。
6、
7、2010年,李援朝课题组报道了一条以松香酸为原料的合成路线(tetrahedron2007,63,11204.)。他们通过多步转化将松香酸含异丙基的六元环芳构化,然后构建不饱和内酯环。虽然松香酸价格低廉,但该路线较长,所使用的锇酸等试剂为剧毒重金属试剂,且价格昂贵,不易购买,限制了该方法在工业级制备方面的应用。
8、
9、2014年,李瀛小组报道了一种新颖的合成雷公藤甲素2(triptolide)骨架的新方法(org.biomol.chem.2014,12,732.)。他们以5-甲氧基-1-甲基萘满酮为原料,通过手性苯乙胺诱导的不对称robinson环化反应和底物控制的双键选择性还原构建两个关键的手性中心。后续经过钯催化的插羰环化构建不饱和内酯环和friedel-crafts反应引入异丙基来完成分子骨架的构建。该路线所采用的5-甲氧基-1-甲基萘满酮等物料商业不可得,要通过多步反应合成,且整体路线较长,难以应用于工业化生产。
10、
11、经过四十余年的发展,针对雷公藤甲素(化合物2,triptolide)的全合成,共有二十多条合成路线报道,但由于路线长,收率低,物料昂贵等原因,都难以工业化生产。因此发展新颖可工业化的雷公藤甲素(化合物2,triptolide)的合成路线具有重要的意义。
技术实现思路
1、本发明的目的是提供一种高产率、低成本、简洁方便地制备7-氧代雷酚内酯(化合物1)的方法。
2、本发明的另一目的是提供了制备7-氧代雷酚内酯(化合物1)的中间体。
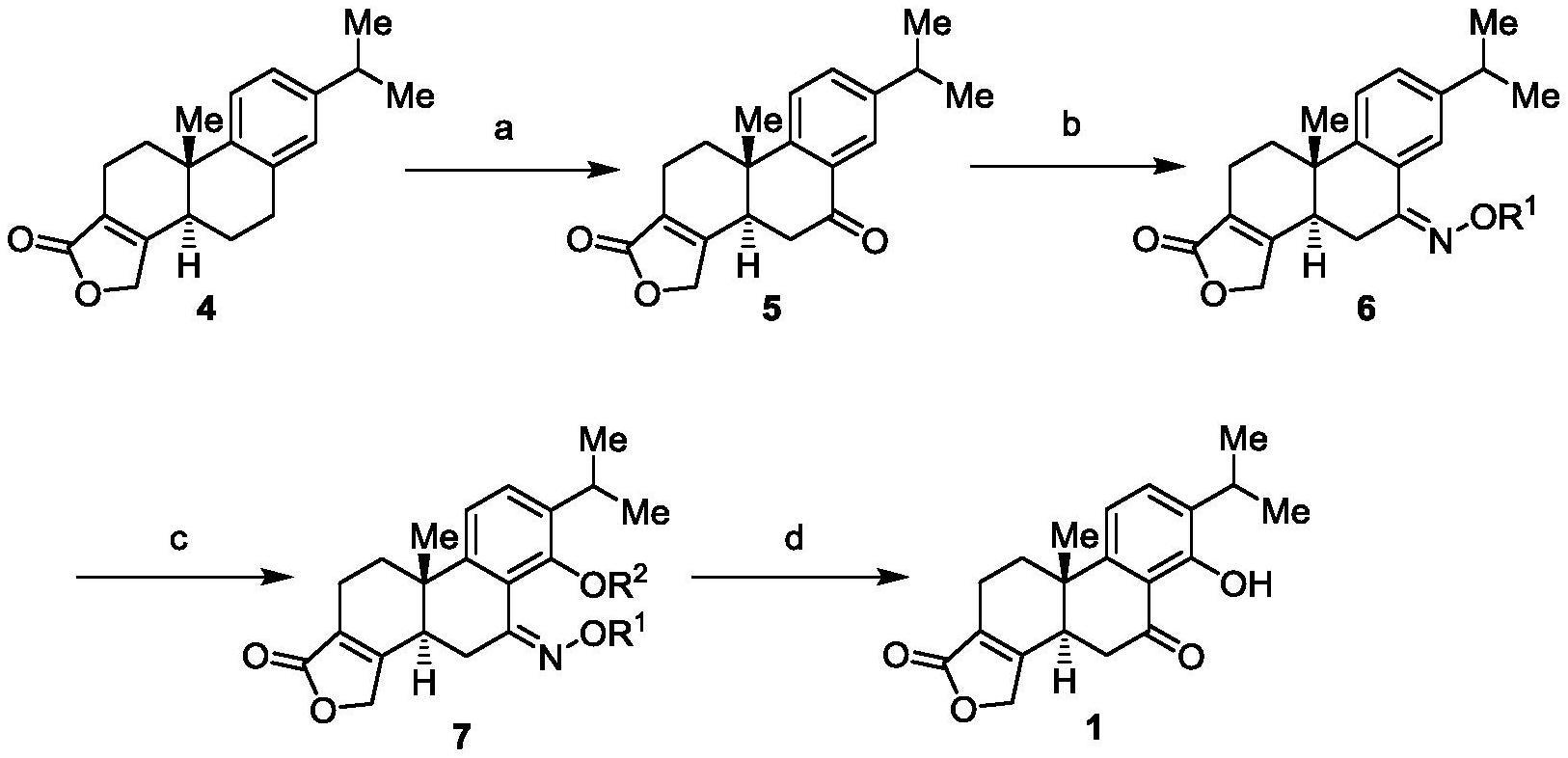
3、在本发明的第一方面,提供了一种制备7-氧代雷酚内酯的方法,所述方法包括以下步骤:
4、(a)在第一溶剂中,将化合物4与第一氧化剂混合,苄位氧化得到化合物5
5、
6、在另一优选例中,所述化合物4以去氢松香酸为起始原料,经过文献中报道的方法经过七步转化制备得到(tetrahedron 2021,85,132031;heterocycles 1997,44,95)。
7、在另一优选例中,所述第一氧化剂选自下组:二氧化硒、三氧化铬、2,3-二氯-5,6-二氰对苯醌、重铬酸钾、硝酸铈铵、三氟甲磺酸铈、2-碘酰基苯甲酸、戴斯-马丁试剂、溴化铜、硫酸酮、氯铬酸吡啶、3,5-二甲基吡唑、二氯铬酸吡啶盐、二苯基二硒、亚碘酰苯、重铬酸钠、六羰基铬、过氧叔丁醇、钯碳、氢氧化钯碳、醋酸锰、醋酸钯、溴化亚铜、碘化亚铜、乙酰丙酮钴、氧气、三氯化钌、醋酸碘苯、三氟乙酰碘苯;优选二氧化硒、三氧化铬、2,3-二氯-5,6-二氰对苯醌、重铬酸钾、硝酸铈铵,或其组合。
8、在另一优选例中,所述第一氧化剂为三氧化铬。
9、在另一优选例中,所述第一氧化剂与化合物4的当量比为0.1-5.0,优选1.0-5.0,更优选2.0-2.5。
10、在另一优选例中,所述第一溶剂选自下组:醋酸、水、二氯甲烷、1,2-二氯乙烷、氯仿、乙腈、水、dmso、dmf、四氢呋喃、1,4-二氧六环、乙醚、丙酮、吡啶、苯、乙酸乙酯,或其组合,优选为二氯甲烷、1,4-二氧六环、乙腈,或其组合。
11、在另一优选例中,所述第一溶剂为混合溶剂,优选为水和有机溶剂的混合溶剂,更优选为水和醋酸的混合溶剂。
12、在另一优选例中,所述第一溶剂中,水和有机溶剂的体积比为0.8-1.2:0.8-1.2,优选1:1。
13、在另一优选例中,所述步骤(a)在15-40℃下进行。
14、在另一优选例中,所述步骤(a)的反应时间为8-16h。
15、(b)在第二溶剂中,化合物5与羟胺类化合物进行缩合反应,得到化合物6
16、
17、其中,r1选自下组:氢、c1-c6烷基、c6-c10芳基、c1-c6烷基酰基、或c6-c10芳基酰基;
18、在另一优选例中,r1选自下组:氢、c1-c4烷基、c1-c4烷基酰基,更优选c1-c3烷基。
19、在另一优选例中,所述羟胺类化合物选自下组:甲氧基胺或其盐、乙氧基胺或其盐、丙氧基胺或其盐、羟胺或其盐、甲酸羟胺或其盐、醋酸羟胺或其盐,或其组合。
20、在另一优选例中,所述羟胺类化合物与化合物5的当量比为1.0-5.0,更优选1.5-3.0。
21、在另一优选例中,所述第二溶剂选自下组:吡啶、2,6-二甲基吡啶、甲醇、乙醇、异丙醇、叔丁醇、醋酸、三氟乙酸、甲苯、二甲苯、三甲苯、二氯甲烷、1,2-二氯乙烷、氯仿、乙腈、水、dmso、dmf、四氢呋喃、1,4-二氧六环、乙醚、丙酮、苯、乙酸乙酯,或其组合;优选为吡啶、甲醇、乙腈,或其组合。
22、在另一优选例中,所述步骤(b)在15-80℃下进行。
23、在另一优选例中,所述步骤(b)的反应时间为6-18h。
24、在另一优选例中,当所述羟胺类化合物为羟胺时,所述步骤(b)还包括:
25、(b.1)将得到的肟化合物6-1与酯化试剂混合,进行酯化反应,得到化合物6
26、
27、其中,r1选自下组:c1-c6烷基酰基或c6-c10芳基酰基。
28、在另一优选例中,所述酯化试剂为酸酐,例如醋酸酐。
29、在另一优选例中,所述酯化试剂与肟化合物6-1的当量比为5-20,更优选8-12,更优选8-10。
30、在另一优选例中,所述步骤(b.1)还需要加入第一催化剂,例如dmap。
31、在另一优选例中,所述步骤(b.1)中,所述第一催化剂与所述化合物6-1的当量比为0.05-0.5,优选0.05-0.1。
32、在另一优选例中,所述步骤(b.1)在15-40℃下进行。
33、在另一优选例中,所述步骤(b.1)的反应时间为1-3h。
34、(c)在第三溶剂中,在第二催化剂作用下,将化合物6与第二氧化剂和任选地配体混合,进行氧化反应,得到化合物7
35、
36、其中r2选自下组:氢、c1-c6烷基、c6-c10芳基、c1-c6烷基酰基、或c6-c10芳基酰基;
37、在另一优选例中,r2选自下组:氢、c1-c4烷基、c1-c4烷基酰基,更优选c1-c3烷基或c1-c3烷基酰基。
38、在另一优选例中,r1和r2相同或不同,优选不同。
39、在另一优选例中,所述第二氧化剂选自下组:双氧水、过硫酸钾、单过硫酸氢钾、过硫酸氢钾、过氧单磺酸钾、(二乙酰氧基碘)苯、三氟乙酰碘苯、苯醌、醋酸铜、氧气,或其组合,优选过氧单磺酸钾或(二乙酰氧基碘)苯。
40、在另一优选例中,所述第二氧化剂与化合物6的当量比为1-5,优选1-2。
41、在另一优选例中,所述第二催化剂选自下组:醋酸钯、三氟醋酸钯、氯化钯或者是新戊酸钯,优选醋酸钯。
42、在另一优选例中,所述化合物6与第二催化剂的当量比为5-100,更优选10-30。
43、在另一优选例中,所述配体选自下组:三苯基膦、偶氮二甲酸二甲酯、偶氮二甲酸二乙酯或者是偶氮二甲酸二异丙酯,或其组合,优选三苯基膦。
44、在另一优选例中,所述化合物6与配体的当量比为5-100,更优选10-30。
45、在另一优选例中,所述第三溶剂选自下组:醋酸、醋酸酐、三氟乙酸、甲醇、乙醇、异丙醇、叔丁醇、甲苯、二甲苯、三甲苯、二氯甲烷、1,2-二氯乙烷、1,1,2,2-四氯乙烷、氯仿、乙腈、水、dmso、dmf、四氢呋喃、1,4-二氧六环、乙醚、丙酮、吡啶、苯、乙酸乙酯,或其组合;优选醋酸、醋酸酐、1,1,2,2-四氯乙烷、三氟乙酸、甲醇,或其组合。
46、在另一优选例中,所述步骤(c)在60-100℃下进行。
47、在另一优选例中,所述步骤(c)的反应时间为4-24h。
48、(d)在第四溶剂中,将化合物7与水解试剂混合,反应得到化合物1
49、
50、在另一优选例中,所述水解试剂为酸,所述酸选自下组:盐酸、硫酸、硝酸、磷酸、对甲苯磺酸、对甲苯磺酸吡啶盐、三氟乙酸、氯化锌、三氟化硼乙醚、氯化锂、氯化铁、三氯化铈或二氯化钴,或其组合;优选为浓盐酸、硫酸或对甲苯磺酸,或其组合。
51、在另一优选例中,所述水解试剂与化合物7的质量体积比为0.05-0.2g/ml,优选0.05-0.1g/ml。
52、在另一优选例中,所述第四溶剂选自下组:甲醇、乙醇、异丙醇、叔丁醇、甲苯、乙腈、水、dmso、四氢呋喃、1,4-二氧六环、乙酸乙酯,或其组合;优选为甲醇,四氢呋喃,1,4-二氧六环,或其组合。
53、在另一优选例中,所述步骤(d)在60-120℃下进行,优选100℃。
54、在另一优选例中,所述步骤(d)的反应时间为8-16h。
55、在本发明的第二方面,提供了一种化合物,所述化合物具有下式结构:
56、
57、其中,r1选自下组:氢、c1-c6烷基、c6-c10芳基、c1-c6烷基酰基、或c6-c10芳基酰基;
58、r2选自下组:氢、c1-c6烷基、c6-c10芳基、c1-c6烷基酰基、或c6-c10芳基酰基。
59、在另一优选例中,r1和r2相同或不同,优选不同。
60、在另一优选例中,r1选自下组:氢、c1-c4烷基、c1-c4烷基酰基,更优选c1-c3烷基。
61、在另一优选例中,r2选自下组:氢、c1-c4烷基、c1-c4烷基酰基,更优选c1-c3烷基或c1-c3烷基酰基。
62、在另一优选例中,所述化合物选自下组:
63、
64、在本发明的第三方面,提供了如本发明第二方面所述的化合物的用途,所述化合物用于制备7-氧代雷酚内酯、雷公藤甲素、雷公藤内酯酮。
65、应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
- 还没有人留言评论。精彩留言会获得点赞!