一种美洲大蠊多肽提取物及其在口洁产品中的应用的制作方法
1.本发明涉及药品、医疗器械和日化用品领域,具体涉及一种消炎镇痛、修复粘膜的美洲大蠊多肽提取物及其在口洁产品中的应用。
背景技术:
2.美洲大蠊(periplanetaamericana)属昆虫纲,蜚蠊目,蜚蠊科,在地球上已经生存了3.5亿年,是世界上生命力最强、最古老、至今繁衍最成功的昆虫类群之一。我国现存最早的药学专著《神农本草经》记载,“味咸寒,主血瘀症坚,寒热,破积聚,喉咽痹,内寒无子”,将之列为中品,属于既能治病,又能养身的中药。现代药理学研究表明,美洲大蠊具有明显的促进组织修复再生、抗肿瘤及抗肝炎作用(中国中药杂志,2007,32:2326-2331)。
3.现有技术中美洲大蠊提取物口洁产品多是利用美洲大蠊提取物粗品作为原料的漱口剂,主要功效是利用“美洲大蠊蛋白”的消炎解毒作用,其产品定位主要是抑制细菌生长。
技术实现要素:
4.为了克服现有技术的不足和缺点,本发明提供一种美洲大蠊多肽提取物的制备方法,同时还提供了用该提取方法提取的美洲大蠊多肽提取物的应用。
5.具体技术方案如下:
6.一种美洲大蠊多肽提取物,其制备方法为:
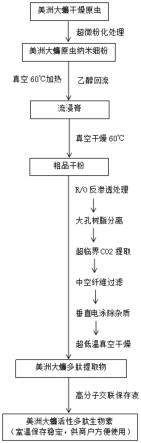
7.取美洲大蠊干燥原虫,置超微粉碎机上粉碎至成纳米级粉体;将所述纳米级粉体置真空提取罐中,加入10倍体积的95%乙醇,于-8mpa真空度下加热60℃,逆流动态提取,得提取流浸膏,再经真空干燥取得美洲大蠊提取粗品干粉;
8.取美洲大蠊提取粗品干粉,用纯化水1:100的比例分散、搅拌、溶解,用1um的折叠式滤器过滤后,将滤液注入聚酰胺膜反渗透(r/o)装置,得渗滤液,备用;
9.取渗滤液注入装有d101,d941,h103,nka
‑ⅱ
等不同型号、不同配比组合的大孔树脂分离柱子中,以水醇混合液(水:乙醇=100:33)进行洗脱,让其以0.65l/min流速通过,利用大孔树脂不同的吸附作用,去除粘液质、粘多糖、纤维素等特异性杂质,取得初纯液(流浸膏),备用;
10.取流浸膏,注入超临界二氧化碳提取设备中,利用液化二氧化碳相变的特性,对流浸膏中的大分子杂环蛋白类杂质作进一步的去除,取得纯度更高的提取物(稠浸膏),备用;
11.取稠浸膏,用纯化水按1:50的比例分散、搅拌、溶解,注入专门的中空纤维超滤装置中,去除大分子蛋白质组分,得超滤提取液,备用;
12.取超滤提取液注入垂直电泳组合系统分离装置中,利用组分中不同分子量保留时间不同的原理,在电场的作用下,层析出不同的分离液,达到去除大分子肽或长链肽的目的,获取活性多肽组分的层析液,即美洲大蠊多肽成分提取液;
13.取美洲大蠊多肽成分提取液,采用超低温真空干燥设备,于-40
±
5℃和-10
±
2mpa
的条件下,干燥12小时,得美洲大蠊多肽提取物,保存备用。
14.用该方法提取的美洲大蠊多肽提取物置于海藻酸钠溶解保存,可使该美洲大蠊多肽提取物稳定保存。
15.该美洲大蠊多肽提取物可在口洁产品中的应用。
16.优选的,所述口洁产品可以为药品、医疗器械或日化用品。
17.优选的,所述口洁产品的形式为喷剂、含潄剂、片剂、凝胶剂、膜剂。
18.优选的,所述口洁产品的组份包括美洲大蠊多肽提取物0.1~6份、冬凌草提取物0.5~0.8份、三叶青提取物0.5~0.8份、金线莲提取物0.5~0.8份、丁香酚0.3~0.6份、伞花烃0.3~0.6份、积雪草苷0.3~0.6份。
19.优选的,所述口洁产品喷剂的组分包括美洲大蠊多肽提取物3~6份、冬凌草提取物0.5~0.8份、三叶青提取物0.5~0.8份、金线莲提取物0.5~0.8份、丁香酚0.3~0.6份、伞花烃0.3~0.6份、积雪草苷0.3~0.6份、聚氧乙烯40氢化蓖麻油11~13份、丙二醇25~35份、丙三醇85~95份、甘草酸二钾0.08~0.12份、三氯蔗糖0.15~0.2份、伊代欣糖0.08~0.12份、清凉剂0.25~0.3份、尼泊金甲酯0.8~0.12份、尼泊金丙酯0.4~0.6份、香精1~3份、纯化水900~1000份。
20.优选的,口洁产品喷剂的制备方法为:
21.s1.在配制罐中注入总配制量80%的纯化水,投入丙三醇搅匀,另取配制量5%的纯化水分散溶解美洲大蠊多肽提取物后,加入配制罐中,搅拌均匀;
22.s2.取总配制量10%的纯化水,于另一适宜容器中,加入甘草酸二钾、三氯蔗糖、伊代欣糖制得甜味溶液,倒入步骤s1所得的溶液中,继续搅拌;
23.s3.取丙二醇与氢化蓖麻油混合搅匀后,加入尼泊金甲酯、尼泊金丙酯、清凉剂溶解完全后,加入香精,搅匀后倒入s2所得的配制溶液中,继续搅拌;
24.s4.取冬凌草提取物、三叶青提取物、金线莲提取物、丁香酚、伞花烃、积雪草苷,用总配制量5%的纯化水溶解后,倒入配制罐中,搅拌均匀,既得;
25.s5.将配制好的半成品液体分装于适宜容器中,加盖密封后,转至外包装工序,装箱。
26.本发明的有益之处在于:本发明使用采用生物活性仿生亲和纯化提纯技术处理后直接获得的活性的美洲大蠊多肽提取物,其制备步骤简便、利于产业化,且试验结果显示该美洲大蠊多肽提取物对口腔粘膜修复的效果显著,对于开发口洁类药品、医疗器械、日化用品等提供了新的物质基础。
附图说明
27.图1为本发明美洲大蠊多肽提取物的制备步骤示意图;
28.图2为实施例4中细胞划痕测试中不同组别细胞图像(显微镜100x)。
具体实施方式
29.为了更好的理解本发明,下面结合实施案例进一步阐述本发明的内容,但发明的内容不仅仅局限于下面的实施案例。
30.实施例1美洲大蠊多肽提取物的制备:
31.取美洲大蠊干燥原虫,置超微粉碎机上粉碎至成纳米级粉体;将所述纳米级粉体置真空提取罐中,加入10倍体积的95%乙醇,于-8mpa真空度下加热60℃,逆流动态提取,得提取流浸膏,再经真空干燥取得美洲大蠊提取粗品干粉;
32.取美洲大蠊提取粗品干粉,用纯化水1:100的比例分散、搅拌、溶解,用1um的折叠式滤器过滤后,将滤液注入聚酰胺膜反渗透(r/o)装置,得渗滤液,备用;
33.取渗滤液注入装有d101,d941,h103,nka
‑ⅱ
等不同型号、不同配比组合的大孔树脂分离柱子中,以水醇混合液(水:乙醇=100:33)进行洗脱,让其以0.65l/min流速通过,利用大孔树脂不同的吸附作用,去除粘液质、粘多糖、纤维素等特异性杂质,取得初纯液(流浸膏),备用;
34.取流浸膏,注入超临界二氧化碳提取设备中,利用液化二氧化碳相变的特性,对流浸膏中的大分子杂环蛋白类杂质作进一步的去除,取得纯度更高的提取物(稠浸膏),备用;
35.取稠浸膏,用纯化水按1:50的比例分散、搅拌、溶解,注入专门的中空纤维超滤装置中,去除大分子蛋白质组分,得超滤提取液,备用;
36.取超滤提取液注入垂直电泳组合系统分离装置中,利用组分中不同分子量保留时间不同的原理,在电场的作用下,层析出不同的分离液,达到去除大分子肽或长链肽的目的,获取活性多肽组分的层析液,即美洲大蠊多肽成分提取液;
37.取美洲大蠊多肽成分提取液,采用超低温真空干燥设备,于-40
±
5℃和-10
±
2mpa的条件下,干燥12小时,得美洲大蠊多肽提取物,保存备用。
38.实施例2美洲大蠊多肽安全性检测:
39.2.1试验材料:
40.2.1.1试验菌株:
41.鼠伤寒沙门氏菌的组氨酸缺陷型ta97、ta98、ta100和ta102菌株购自krishgen biosystems和chi scientific。在测试之前,四种菌株均通过实验室鉴定,且菌株的生物学特性符合测试要求。
42.2.1.2代谢物活化系统:s9
43.2.1.3阳性物:
44.2.1.3.1叠氮化钠(nan3)购自国药集团化学试剂有限公司(批号:20180321)。
45.2.1.3.2敌克松(dexon)购自accustandard(批号:4030165-01)。
46.2.1.3.3 2-氨基芴(2-af)购自aladdin(批号:h1511011)。
47.2.1.3.4 1,8-二羟基蒽醌(dorbane)购自sigma-aldrich(批号:wxbb0392)。
48.2.1.3.5 2-氨基蒽(2-aa)购自sigma-aldrich(批号:stbd3302v)。
49.2.1.4培养条件:37℃培养箱
50.2.2试验步骤:
51.2.2.1准备细菌:试验前,将菌株接种于营养肉汤中,于恒温培养箱中约37℃下静置培养近16h。使菌株每毫升达到约1
×
109。
52.2.2.2受试物配制:以无菌超纯水为溶剂,配制不同浓度的染毒溶液,分别为50mg/ml、15.81mg/ml、5mg/ml和1.58mg/ml。
53.2.2.3分组:设4个不同剂量组,进行代谢活化和非代谢活化处理,同时分别设有溶剂对照组、阳性对照组、无菌对照组和空白对照组。
54.2.2.4染毒时间:48h
55.2.2.5平皿掺入法:
56.非代谢活化:将顶层琼脂培养基2.0ml分装于试管中,45℃水浴中保温,然后每管依次加入0.1ml试验菌株增菌液,0.1ml受试物溶液和0.5ml磷酸盐缓冲液,充分混匀,迅速倾入底层培养基平板上,转动平皿,使之分布均匀。所有剂量组及对照组均设3个平行重复皿。将平皿水平放置待冷凝固化后,倒置于37℃恒温培养箱里培养48h。培养结束后,观察背景菌落生长情况,并记录每皿回变菌落数。
57.代谢活化系统:将非代谢活化试验中的0.5ml磷酸盐缓冲液替换成s9混合液,其他操作与非代谢活化试验相同。
58.2.3试验结果:
59.细菌回变个体值、平均值及标准差:
60.表2-1试验菌落数统计值表(mean
±
sd)
[0061][0062]
表2-2试验菌落数统计值表(mean
±
sd)
[0063][0064][0065]
表2-3试验菌落数个体值
[0066][0067]
表2-4首次试验菌落数个体值
[0068][0069][0070]
2.4结论:
[0071]
无论代谢活化与否,各剂量组与溶剂对照组比较无明显细菌毒性,所有试验菌株各剂量回复突变菌落数均低于溶剂对照组的2倍。
[0072]
根据《化妆品安全技术规范》(2015)的判定标准,在本次试验条件下,测试样品对试验菌株无致突变性。
[0073]
实施例3美洲大蠊多肽提取物的粘膜刺激性:
[0074]
3.1受试物质:
[0075]
将样品稀释为5%的水溶液。
[0076]
3.2实验动物及环境:
[0077]
3.2.1普通级动物房:实验动物使用许可证号:syxk(粤)2017-0173。
[0078]
3.2.2动物种属品系:普通级新西兰兔;动物合格证号:44007600008193。
[0079]
3.2.3动物来源:广州市花都区花东信华实验动物养殖场scxk(粤)2019-0023。
[0080]
3.2.4环境:温度(t):18-25℃,相对湿度(%rh):40-70%。
[0081]
3.3试验步骤:
[0082]
试验前24h,对实验动物的两只眼睛进行常规检查。
[0083]
试验时,轻轻拉开实验动物一侧眼睛的下眼睑,吸取受试物0.1ml滴入结膜囊内,将眼被动闭合1s,滴入受试物后24小时内不冲洗眼睛。另一侧眼不作处理作为自身对照。
[0084]
试验结束后的1h、24h、48h、72h、4d、7d、14d和21d对眼睛进行检查并进行评分,如72h内未出现刺激反应,或第7d或第14d眼睛完全恢复,可提前终止试验。必要时用2%荧光素钠检查角膜。
[0085]
3.4结果评价:根据24h、48h和72h观察时点受试动物角膜、虹膜或结膜的评分,计算刺激反应积分,根据刺激反应积分和恢复时间评价,按表3-1进行眼刺激性反应分级。
[0086]
3-1产品眼刺激性反应分级
[0087][0088]
注:当角膜、虹膜、结膜积分为0时,可判为无刺激性。
[0089]
3.5试验结果
[0090]
3-2 眼刺激性试验结果
[0091][0092][0093]
根据化妆品安全技术规范2015年版第六章之急性眼刺激性/腐蚀性实验的判定标准,在本次试验条件下,样品美洲大蠊多肽提取物对新西兰兔急性眼刺激试验结果为无刺激性。
[0094]
实施例4美洲大蠊多肽人牙龈成纤维细胞(hgf)划痕测试:
[0095]
4.1实验材料:
[0096]
4.1.1细胞系:人牙龈成纤维细胞(hgf),购自北纳创联,代数:6
[0097]
4.1.2完全培养基:含10%胎牛血清(fbs)的dmem培养基(fbs购自gibco,lot:42q1095k)
[0098]
4.1.3维持培养基:含1%fbs的dmem培养基(fbs购自gibco,lot:42q1095k)
[0099]
4.1.4测试条件:温度37
±
0.5℃,湿度》90%,5%co2浓度
[0100]
4.1.5溶液及对照:
[0101]
阴性对照组(nc):维持培养基
[0102]
阳性对照组(pc):含1ng/ml egf的维持培养基
[0103]
待测物质(ta):称取0.2153g样品,加入2.15ml维持培养基,配置成100mg/ml的储备液,再依次使用维持培养基稀释至待测浓度。
[0104]
4.2试验步骤:
[0105]
4.2.1细胞活性测试
[0106]
4.2.1.1细胞常规培养。制备密度为5~7
×
104个/ml的细胞悬液,将细胞悬液接种于96孔细胞培养板,每孔100μl,培养18-24h。
[0107]
4.2.1.2弃去孔中原培养液,每孔加入100μl不同浓度的测试样品,返回培养箱孵育48
±
1h。
[0108]
4.2.1.3取出培养板,每孔加入20μl mtt溶液,培养箱孵育3-4h。去除孔中液体,每孔加入100μl dmso,置于振荡器振荡10-15min后,在酶标仪570nm波长处测定吸光度。
[0109]
4.2.1.4数据分析:细胞活性以阴性对照组的细胞活性为100%,计算各组相对细胞活性(viability)。
[0110]
4.2.2细胞划痕测试
[0111]
4.2.2.1常规培养细胞,调整细胞密度为3.0~5.0
×
105个/ml,使用带有2孔插入物的24孔细胞培养板,每孔接种70μl,返回培养箱培养18-24h至细胞融合。
[0112]
4.2.2.2小心用镊子取出培养板中的培养插入物,培养插入物2孔之间形成一道平整的无细胞区域。用pbs清洗细胞层3次,去除脱落的细胞。
[0113]
4.2.2.3每孔加入1ml含不同浓度的测试样品的培养液,同时在镜下采集图像,记为0h,标记所采集的位置。
[0114]
4.2.2.4每隔24h,在所标记的相同位置,采集图片,记为24h和48h。
[0115]
4.2.2.5数据分析:采用ipp图像分析软件,分析每个图像划痕区域的面积,以0h为100%,计算相对面积。
[0116]
4.3试验结果:
[0117]
4.3.1细胞活性测试
[0118]
表4-1各组细胞相对活性(mean
±
sd)
[0119][0120]
4.3.2细胞划痕测试
[0121]
表4-2不同组别划痕相对面积大小(%)
[0122][0123]
在4.3.2测试条件下,24h时,与阴性对照组相比,阳性对照组的划痕相对面积明显减少(p《0.05),样品美洲大蠊多肽提取物在4.0mg/ml、1.0mg/ml、0.25mg/ml浓度下划痕相对面积明显减少(p《0.05)。48h时,与阴性对照组相比,阳性对照组的划痕相对面积均明显减少(p《0.05),样品美洲大蠊多肽提取物在4.0mg/ml、1.0mg/ml、0.25mg/ml浓度下划痕相对面积均明显减少(p《0.05)。提示样品美洲大蠊多肽提取物对人牙龈成纤维细胞有一定的促进修复作用。
[0124]
实施例5口洁喷剂配方一:
[0125]
美洲大蠊活性多肽提取物3份、冬凌草提取物0.5份、三叶青提取物0.5份、金线莲提取物0.5份、丁香酚0.3份、伞花烃0.3份、积雪草苷0.3份、聚氧乙烯40氢化蓖麻油11份、丙二醇25份、丙三醇85份、甘草酸二钾0.08份、三氯蔗糖0.15份、伊代欣糖0.08份、清凉剂0.25份、尼泊金甲酯0.8份、尼泊金丙酯0.4份、香精1份、纯化水870.84份。
[0126]
实施例6口洁喷剂配方二:
[0127]
美洲大蠊活性多肽提取物3份、冬凌草提取物0.65份、三叶青提取物0.65份、金线莲提取物0.65份、丁香酚0.45份、伞花烃0.45份、积雪草苷0.45份、聚氧乙烯40氢化蓖麻油12份、丙二醇30份、丙三醇90份、甘草酸二钾0.1份、三氯蔗糖0.175份、伊代欣糖0.1份、清凉剂0.275份、尼泊金甲酯0.1份、尼泊金丙酯0.5份、香精2份、纯化水855.45份。
[0128]
实施例7口洁喷剂配方三:
[0129]
美洲大蠊活性多肽提取物6份、冬凌草提取物0.8份、三叶青提取物0.8份、金线莲提取物0.8份、丁香酚0.6份、伞花烃0.6份、积雪草苷0.6份、聚氧乙烯40氢化蓖麻油13份、丙二醇35份、丙三醇95份、甘草酸二钾0.12份、三氯蔗糖0.2份、伊代欣糖0.12份、清凉剂0.3份、尼泊金甲酯0.12份、尼泊金丙酯0.6份、香精3份、纯化水842.34份。
[0130]
实施例8口洁喷剂制备方法:
[0131]
口洁喷剂的制备方法为:s1.在配制罐中注入总配制量80%的纯化水,投入丙三醇搅匀,另取配制量5%的纯化水分散溶解美洲大蠊多肽提取物后,加入配制罐中,搅拌均匀;
[0132]
s2.取总配制量10%的纯化水,于另一适宜容器中,加入甘草酸二钾、三氯蔗糖、伊代欣糖制得甜味溶液,倒入步骤s1所得的溶液中,继续搅拌;
[0133]
s3.取丙二醇与氢化蓖麻油混合搅匀后,加入尼泊金甲酯、尼泊金丙酯、清凉剂溶解完全后,加入香精,搅匀后倒入s2所得的配制溶液中,继续搅拌;
[0134]
s4.取冬凌草提取物、三叶青提取物、金线莲提取物、丁香酚、伞花烃、积雪草苷,用适量水总配制量5%的纯化水溶解后,倒入配制罐中,搅拌均匀,既得;
[0135]
s5.将配制好的半成品液体分装于适宜容器中,加盖密封后,转至外包装工序,装
箱。
[0136]
表6-1口洁喷剂产品检测结果
[0137][0138]
实施例9口洁含潄剂配方一:
[0139]
美洲大蠊活性多肽提取物0.1份、冬凌草提取物0.5份、三叶青提取物0.5份、金线莲提取物0.5份、丁香酚0.3份、伞花烃0.3份、积雪草苷0.3份、聚氧乙烯40氢化蓖麻油11份、丙二醇25份、丙三醇85份、甘草酸二钾0.08份、三氯蔗糖0.15份、伊代欣糖0.08份、清凉剂0.25份、尼泊金甲酯0.8份、尼泊金丙酯0.4份、香精1份、纯化水873.74份。
[0140]
实施例10口洁含潄剂配方二:
[0141]
美洲大蠊活性多肽提取物1.1份、冬凌草提取物0.65份、三叶青提取物0.65份、金线莲提取物0.65份、丁香酚0.45份、伞花烃0.45份、积雪草苷0.45份、聚氧乙烯40氢化蓖麻油12份、丙二醇30份、丙三醇90份、甘草酸二钾0.1份、三氯蔗糖0.175份、伊代欣糖0.1份、清凉剂0.275份、尼泊金甲酯0.1份、尼泊金丙酯0.5份、香精2份、纯化水860.35份。
[0142]
实施例11口洁含潄剂配方三:
[0143]
美洲大蠊活性多肽提取物2份、冬凌草提取物0.8份、三叶青提取物0.8份、金线莲提取物0.8份、丁香酚0.6份、伞花烃0.6份、积雪草苷0.6份、聚氧乙烯40氢化蓖麻油13份、丙二醇35份、丙三醇95份、甘草酸二钾0.12份、三氯蔗糖0.2份、伊代欣糖0.12份、清凉剂0.3份、尼泊金甲酯0.12份、尼泊金丙酯0.6份、香精3份、纯化水846.34份。
[0144]
实施例12口洁含潄剂制备方法:
[0145]
口洁含潄剂的制备方法为:s1.在配制罐中注入总配制量80%的纯化水,投入丙三醇搅匀,另取配制量5%的纯化水分散溶解美洲大蠊多肽提取物后,加入配制罐中,搅拌均匀;
[0146]
s2.取总配制量10%的纯化水,于另一适宜容器中,加入甘草酸二钾、三氯蔗糖、伊
代欣糖制得甜味溶液,倒入步骤s1所得的溶液中,继续搅拌;
[0147]
s3.取丙二醇与氢化蓖麻油混合搅匀后,加入尼泊金甲酯、尼泊金丙酯、清凉剂溶解完全后,加入香精,搅匀后倒入s2所得的配制溶液中,继续搅拌;
[0148]
s4.取冬凌草提取物、三叶青提取物、金线莲提取物、丁香酚、伞花烃、积雪草苷,用总配制量5%的纯化水溶解后,倒入配制罐中,搅拌均匀,既得;
[0149]
s5.将配制好的半成品液体分装于适宜容器中,加盖密封后,转至外包装工序,装箱。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1