非肿瘤EBV相关T/NK细胞淋巴组织增殖性疾病的生物标志物及应用
非肿瘤ebv相关t/nk细胞淋巴组织增殖性疾病的生物标志物及应用
技术领域
1.本发明涉及ebv相关t/nk细胞淋巴组织增殖性疾病,属于生物技术、疾病诊断、治疗、疗效评估等技术领域,具体地涉及一种非肿瘤ebv相关t/nk细胞淋巴组织增殖性疾病的生物标志物及应用。
背景技术:
2.eb病毒(ebv)是一种常见的γ型疱疹病毒,全世界范围内成人感染率超过90%。ebv感染与多种恶性疾病的发生发展相关。ebv持续感染t或者nk细胞可引起ebv相关的t/nk淋巴细胞增殖性疾病,即ebv-t/nk-lpds。根据2016年who淋巴系统疾病分类,ebv-t/nk-lpds包括慢性活动性ebv感染(caebv),和ebv相关噬血细胞综合征(ebv hlh)。相比于欧美,ebv-t/nk-lpds更常见于亚洲和中南美洲地区,并且通常发生在儿童和青少年人群,但成人起病人群相比于儿童起病具有更差的预后。ebv-t/nk-lpds疾病临床症状复杂多样,在疾病进程中,急转为hlh、向肿瘤(nk/t细胞淋巴瘤、侵袭性nk细胞白血病等)的恶性转化、持续严重的ebv感染等将导致不良的临床结局。
3.目前领域内对于该疾病的认识十分有限,尤其是成人人群的研究非常少,阻碍了对该疾病发病分子机理的全面认识和有效治疗手段的发展。大部分患者缺少精准有效的治疗方案,治疗方法主要是观察等待、支持治疗、抗病毒治疗、糖皮质激素治疗、抗hlh治疗以及异基因的造血干细胞移植(allo-hsct);allo-hsct是目前被认为唯一可以彻底治愈疾病的方法。但由于疾病表现的异质性以及移植相关死亡率和并发症的高发生率,在临床环境中,何时、何人进行allo-hsct并不明确。缺乏可靠的预测预后指标及标志物,制约临床治疗方案的选择。
4.在正常情况下,先天和适应性免疫可以控制ebv感染而不出现疾病表现。以往研究表明,原发性免疫缺陷病(primary immunodeficiency diseases,pids)易伴随严重、持续的ebv感染。国际上零散病例中候选基因突变研究发现,ebv-t/nk-lpds中存在nk细胞毒杀伤功能或激活通路基因突变。这提示抗病毒免疫基因先天变异是该疾病发生发展的重要遗传基础之一,并具有预测疾病严重性的潜在应用价值。有限的日本儿童队列研究表明,在ebv感染的t/nk细胞中出现肿瘤驱动基因的体细胞突变与caebv的疾病进展及不良预后相关。
5.上述零散、少数分子学研究提示抗病毒免疫基因或肿瘤驱动基因遗传突变与ebv相关疾病的发生发展关系密切,明确其临床意义将有助于预测疾病不良预后,从而优化治疗策略。但目前ebv感染性疾病中遗传学研究极其有限,缺乏相关生物标志物的研究报道,严重制约了其在临床中的实际应用。
技术实现要素:
6.为解决上述技术问题,本发明公开了一种非肿瘤ebv相关t/nk细胞淋巴组织增殖
性疾病的生物标志物及其应用。本发明研究了与非肿瘤ebv相关t/nk细胞淋巴组织增殖性疾病相关联的抗病毒免疫相关基因的先天遗传突变,以及ebv感染的t/nk细胞群体中的肿瘤驱动基因的体细胞突变,综合上述遗传突变分析筛选得到26个基因组成的基因panel,应用该基因panel有助于推动在hlh发生前对非肿瘤ebv-t/nk-lpds进行分层的临床研究,以及为后续开展大规模多中心研究提供理论基础。
7.为实现上述技术目的,本发明公开了一种与非肿瘤ebv相关t/nk细胞淋巴组织增殖性疾病的发生相关联的生物标志物,所述生物标志物包含如下基因中的一种或两种以上,或各所述基因编码的蛋白:
8.kmt2d、ifih1、unc13d、tyk2、nlrp12、cftr、orai1、nod2、ddx3x、tet2、arid1a、bcor、dnmt3a、crebbp、stat3、jak2、stat5a、socs1、elf4、kat6b、mga、alk、ptpn23、msn、notch2、spen。与此同时,各基因的具体碱基序列如说明书中的序列表。
9.其中,先天遗传突变基因包括kmt2d、ifih1、unc13d、tyk2、nlrp12、cftr、orai1、nod2,体细胞突变基因包括ddx3x、tet2、arid1a、bcor、dnmt3a、crebbp、stat3、jak2、stat5a、socs1、elf4、kat6b、mga、alk、ptpn23、msn、notch2、spen、kmt2d。即kmt2d既属于先天遗传突变基因,又与体细胞突变有关。各种突变的具体研究策略如具体实施例描述。
10.进一步地,所述生物标志物包含基因ifih1和/或ddx3x、kmt2d、tet2、arid1a、bcor、dnmt3a、crebbp中任意一种及以上,或各基因编码的蛋白。
11.进一步地,各所述基因的筛选方法如下:
12.1)样本收集:获取实验对象的外周血并通过密度离心分离获得pbmcs,及采用ebv sorting pcr/fish方式分选pbmcs中b细胞、t细胞、nk细胞,进一步检测各细胞内的ebv载量;
13.2)基因测序与分析:从步骤1)实验对象的pbmcs、ebv感染的b细胞、t细胞和nk细胞进行外显子测序和分析;
14.构建372个抗病毒免疫相关基因的知识库,其中,对于突变位点进一步地采用gatk-haplotypecaller软件全面扫描、gatk软件对变异的质量进行评分校准,及采用annovar对突变位点进行注释、利用polyphen2、sift及cadd三个生物信息工具预测变异位点对氨基酸序列、功能的影响,并与1000g项目中的中国普通人群进行比较用于识别出先天突变基因;
15.对于体细胞突变进一步地利用定制的24个基因的panel进行靶向深度测序、利用sureselect xt2进行测序文库构建,及目标富集文库采用illumina hiseq 2500平台进行高通量测序,筛选得到体细胞突变基因。
16.本发明的目的之二是公开一种用于检测及辅助诊断非肿瘤ebv相关t/nk细胞淋巴组织增殖性疾病的试剂盒,所述试剂盒内包含上述各基因或各基因编码蛋白的定性和/或定量检测剂及基因突变体检测剂。
17.进一步地,所述试剂盒内还包含样本预处理剂,所述样本为年龄在3~74岁之间的非肿瘤ebv相关t/nk细胞淋巴组织增殖性疾病患者的b细胞、t细胞和nk细胞,优选年龄超过20岁患者的数量占总患者总量的71.4%以上。
18.本发明的目的之三是公开一种上述生物标志物在制备非肿瘤ebv相关t/nk细胞淋巴组织增殖性疾病的检测及辅助诊断试剂盒中的应用。
19.进一步地,所述非肿瘤ebv相关t/nk细胞淋巴组织增殖性疾病为慢性活动性ebv感染和/或ebv相关噬血细胞综合征。
20.进一步地,所述试剂盒内还包含样本预处理剂,所述样本为年龄在3~74岁之间的非肿瘤ebv相关t/nk细胞淋巴组织增殖性疾病患者的b细胞、t细胞和nk细胞,且优选年龄超过20岁患者的数量占总患者总量的71.4%以上。
21.进一步地,所述生物标志物中任意一个以上基因发生突变,则判定为非肿瘤ebv相关t/nk细胞淋巴组织增殖性疾病易感患者,且所述易感患者的预后效果差于非易感患者。研究发现ebv感染的病人多数临床表现为传染性单核细胞增多症样表现,比如发热、脾大、淋巴结肿大等,少数病人表现皮肤症状,比如5.0%的病人表现为蚊虫叮咬症、8.4%的病人表现为种痘样水疱病变。且hlh大多发生在疾病起病的一年之内,而肿瘤转化大多数发生在起病一年之后。并且,研究发现hlh发生和肿瘤转化的病人均表现为高血浆ebv载量,血浆中ebv copies≥6.72
×
103copies/ml。
22.本发明的目的之四是公开上述生物标志物在制备非肿瘤ebv相关t/nk细胞淋巴组织增殖性疾病的预后检测试剂盒中的应用。
23.进一步地,所述生物标志物包含基因ifih1和/或ddx3x、kmt2d、tet2、arid1a、bcor、dnmt3a、crebbp中任意一种及以上,或各基因编码的蛋白。
24.进一步地,携带任意一种以上基因突变的患者预后效果差于未携带任何突变基因的患者。具体表现为,未携带任何遗传变异的患者,其血浆ebv负荷相对更低,hlh的发生率更低,其预后生存率更高。
25.有益效果:
26.本发明建立了包括372个抗免疫病毒相关的基因知识库,并应用该知识库进行系列遗传统计分析,筛选得到ebv-t/nk-lpds中发生高频先天变异的基因,通过体细胞突变分析筛选,得到ebv-t/nk-lpds中发生体细胞突变的肿瘤相关驱动基因,并对ebv-t/nk-lpds临床数据进行采集及综合分析,建立起非肿瘤ebv相关t/nk细胞淋巴组织增殖性疾病的生物标志物及应用。应用生物标志物及临床标记物可作为预测ebv-t/nk-lpds的预后因素,应用该新构建的基因panel具有早期识别高危型非肿瘤ebv-t/nk-lpds的诊断意义,与此同时,还有助于推动在hlh发生前对非肿瘤ebv-t/nk-lpds进行分层的临床研究并为后续开展大规模多中心研究提供理论基础。
附图说明
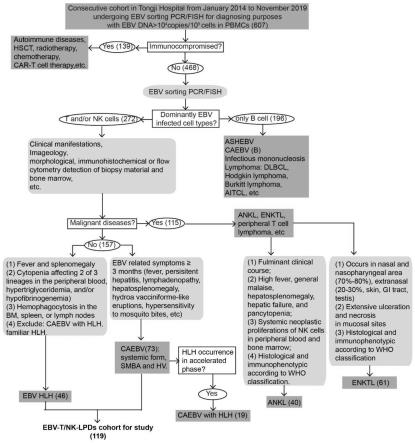
27.图1为本发明设计的ebv-t/nk-lpds诊断流程图。
28.图2为本发明设计的样本收集、分离及检测示意图,其中,图2a为采用macs技术从pbmcs中分离b、t和nk细胞,图2b、2c、2d分别为流式细胞术检测b、t、nk细胞纯度的示意图。
29.图3为本发明设计的先天变异和体细胞突变的研究策略示意图。
30.图4为hlh和肿瘤转化与血浆中高ebv载量相关的测试图,其中,图4a为119例非肿瘤ebv-t/nk-lpds中hlh发生和肿瘤转化的累积事件曲线;图4b为kaplan-meier生存曲线比较ebv hlh、caebv伴hlh和caebv不伴hlh的总生存率;采用对数秩检验对数据进行统计分析;图4c为发生hlh与未发生hlh患者血浆ebv载量比较;图4d为有无恶性转化患者血浆ebv载量比较,采用mann-whitney检验对数据进行统计学分析。*,p《0.05。
31.图5为使用cox比例风险模型根据临床特征对总生存期进行单因素和多因素分析结果示意图。
32.图6为对372个抗ebv相关免疫基因的分类示意图。
33.图7为非肿瘤ebv-t/nk-lpds的先天变异相关示意图;其中,图7a为将非肿瘤ebv-t/nk-lpds、ankl、nktcl患者的372个抗病毒免疫相关基因的预测损伤先天变异与1000g项目的中国普通人群的预测损伤种系变异数进行比较。数据采用student’s t-test进行统计学分析。***,p《0.001。图7b为8个基因(kmt2d、ifih1、unc13d、tyk2、nlrp12、cftr、orai1、nod2)的预测损伤先天变异在非肿瘤ebv-t/nk-lpds中显著富集。比较非肿瘤ebv-t/nk-lpds中8个基因的突变率与1000g的中国人群的突变率。采用卡方检验和fisher精确检验对数据进行统计学分析。*,p《0.05;***,p《0.001。图7c为维恩图显示,与1000g的中国人群相比,非肿瘤ebv-t/nk-lpds、nktcl和ankl的先天变异显著富集的基因部分重叠。
34.图8为非肿瘤ebv-t/nk-lpds的体突变相关示意图;其中,图8a为显示73例非肿瘤性ebv-t/nk-lpds的体细胞突变图谱。图8b为在ebv感染的非肿瘤ebv-t/nk-lpds的t/nk细胞中发现的体细胞突变(n=73,病人的数量),并将其分为四种基因类型,分别是ddx3x、表观遗传修饰因子、jak/stat通路和其他肿瘤驱动基因。图8c为四种基因型在非肿瘤ebv-t/nk-lpds中的体细胞突变率。
35.图9为先天与体细胞突变影响的信号通路与血浆ebv载量和预后相关示意图,其中,图9a显示了每个非肿瘤ebv-t/nk-lpds患者的7个基因亚型的突变全景图。每一列代表一个病人。将先天与体细胞变异分为7个遗传亚型,见左图。右边的百分比表示各亚型的突变率。图9b为kaplan-meier生存曲线比较有和无7种亚型遗传变异的患者的总生存率。采用对数秩检验对数据进行统计分析。图9c为有与无7种亚型遗传变异的hlh发生率比较。图9d为将7个亚型基因变异组与无任何基因变异组的血浆ebv载量进行比较。采用mann-whitney u检验对数据进行统计学分析。*,p《0.05;**,p《0.01;***,p《0.001;ns,无显著性。图9e为kaplan-meier生存曲线比较了在表观遗传修饰因子和/或rig-i样受体通路中携带任何遗传突变的患者和不携带任何两种亚型遗传突变患者之间的总生存率。采用对数秩检验对数据进行统计分析。
具体实施方式
36.本发明建立了包括372个抗免疫病毒相关的基因知识库,并应用该知识库进行系列遗传统计分析,筛选得到ebv-t/nk-lpds中发生高频先天变异的基因,通过体细胞突变分析筛选,得到ebv-t/nk-lpds中发生体细胞突变的肿瘤相关驱动基因,并对ebv-t/nk-lpds临床数据进行采集及综合分析,建立起非肿瘤ebv相关t/nk细胞淋巴组织增殖性疾病的生物标志物及应用。应用生物标志物及临床标记物可作为预测ebv-t/nk-lpds的预后因素,应用该新构建的基因panel具有早期识别高危型非肿瘤ebv-t/nk-lpds的诊断意义。
37.下面将结合附图,对本发明的具体实施方式进行清楚、完整地描述,显然,所描述的实施方式仅仅是本发明的一部分实施方式,而不是全部的实施方式。基于本发明中的实施方式,本领域普通技术人员在没有做出创造性劳动前提下对这些实施方式进行多种变化、修改、替换和变型,仍落入本发明保护的范围内。
38.下述实验例中所使用的实验方法如无特殊说明,均为常规方法;所使用的材料、试
剂等,如无特殊说明,为可从商业途径得到的试剂和材料。在整个说明书中,除非另有特别说明,本文使用的术语应理解为如本领域中通常所使用的含义。因此,除非另有定义,本文使用的所有技术和科学术语具有与本发明所属领域技术人员的一般理解相同的含义。若存在矛盾,本文定义优先。
39.英文缩写及释义
40.ebv-t/nk-lpds:非肿瘤ebv相关t/nk细胞淋巴组织增殖性疾病
41.ebv hlh:和ebv相关噬血细胞综合征
42.caebv-t/nk:t/nk细胞型慢性活动性ebv感染
43.pbmcs:外周血单核细胞
44.hsct:造血干细胞移植
45.car-t:嵌合抗原受体t细胞
46.ashebv:无症状高ebv携带
47.hlh:噬血细胞综合征,慢性活动性eb病毒病
48.smba:严重蚊虫叮咬症
49.ha:种痘样水泡样病变
50.dlbcl:弥漫大b细胞淋巴瘤
51.aitcl:血管免疫母t细胞淋巴瘤
52.ankl:侵袭性nk细胞白血病
53.enktl:结外nk/t细胞淋巴瘤
54.wes:外显子组测序
55.ebv sorting pcr/fish:细胞分选后pcr/fish技术鉴定ebv感染
56.实施例1
57.实验对象及材料:
58.1.实验对象
59.本发明中纳入的患者来自武汉华中科技大学同济附属医院在2014年1月至2019年11月期间,从出于诊断目的进行ebv sorting pcr/fish检查的ebv高载量的患者中筛选得到。这些患者符合2016年who淋巴肿瘤疾病分类中非肿瘤ebv-t/nk-lpds,具体的ebv hlh/caebv-t/nk的诊断标准,排除了继发性免疫缺陷的病人、ebv相关肿瘤患者等,关于ebv-t/nk-lpds的具体诊断流程如图1所示,其中,图1括号内数字是病人的数量。与此同时,该研究根据《赫尔辛基宣言》进行,并经华中科技大学同济医学院伦理委员会批准(2019s949),每位患者均获得知情同意。
60.2.样本收集
61.采集上述实验对象的新鲜外周血,进一步使用lymphopreptm分离液通过密度离心获得pbmcs,pbmcs中b细胞、t细胞、nk细胞采用磁珠分选方式获得,其中,本发明优选采用的磁珠为德国公司miltenyi biotec gmbh生产的产品;且可以采用ebv sorting pcr/fish方式对b细胞、t细胞、nk细胞进行分选,本发明优选使用广州da an gene生产的ebv核酸实时荧光定量pcr试剂盒检测细胞中的ebv dna拷贝数量,与此同时,本发明还优选使用美国agilent公司生产的ebv编码的小核rna探针并应用fish技术检测细胞内的ebv载量,具体检测结果如图2所示。
62.基因测序与分析:
63.3.外显子测序和分析
64.我们对来自ebv hlh/caebv-t/nk(n=97)、ankl(n=27)和nktcl(n=35)患者的pbmcs、ebv主要感染的nk和/或t细胞群体,成对的皮肤组织或粒细胞作为对照,进行了wes,其中,具体研究策略如图3。依据说明书的标准操作流程,使用德国qiagen公司生产的qiamp dna blood mini试剂盒从pbmcs中提取基因组dna。经过建库后,采用illumina novaseq平台进行高通量测序。使用bwa软件将原始数据与人类基因组hg38进行比对,保留比对到人参考基因组的数据进行后续分析。先天变异和体细胞变异分别采用gatk-haplotypecaller及gatk-mutect2检测。利用公共数据库中健康人群信息(1000g、exac和genomad)过滤排除单核苷酸多态性位点,即snps。将等位基因频率maf≤0.01的罕见变异纳入后续分析。使用polyphen2,sift和cadd等生物信息学工具预测变异对氨基酸结构及功能的潜在影响。
65.4.先天突变分析
66.应用gatk-haplotypecaller软件全面扫描ebv-t/nk-lpds患者的先天变异位点。利用gatk软件对变异的质量进行评分校准。采用annovar对突变位点进行注释。过滤先天突变位点的标准如下:(i)排除同义变异;(ii)位点测序深度需》10reads;(iii)突变等位基因频率》25%;(iv)保留exome aggregation consortium,简称exac_eas、the 1000genome project,简称1000g_eas和the genome aggregation database,简称genomad_eas,数据库中的最小等位基因频率maf《1%的位点。利用polyphen2、sift及cadd三个生物信息工具预测变异位点对氨基酸序列、功能影响。上述软件之一预测为损伤性位点则保留,进行后续分析。致病性和可能致病性变异按下列标准进行分类:无义突变、移码突变、剪接位点突变以及预测的可能改变蛋白质序列或功能的错义突变。
67.5.二代靶向深度测序
68.我们对73例ebv hlh/caebv-t/nk患者的ebv感染的nk、t和/或b细胞,利用定制的24个基因的panel进行了靶向深度测序,且1000次覆盖以上。利用sureselect xt2进行测序文库构建,目标富集文库采用illumina hiseq 2500平台进行高通量测序。定制的panel包括的基因集合通过以下标准进行选择:(i)初始研究队列中20例wes患者中候选的体细胞突变基因;(ii)已报道的ebv相关肿瘤ankl和nktcl中高频突变的基因;(iii)由cosmic肿瘤相关数据库,网址为https://cancer.sanger.ac.uk/cosmic提供的肿瘤驱动性基因集合。
69.6.转录组学测序
70.我们对8例ebv hlh/caebv-t/nk患者和6例健康供体的nk细胞和t细胞进行了rna测序。采用illumina novaseq 6000平台进行高通量测序。使用tophat2软件将rna-seq原始数据与参考人类基因组hg38进行比对,保留比对到参考基因组的数据进行后续分析。利用cufflinks软件计算基因表达值fpkm。差异表达基因采用deseq和degseq软件检测,筛选标准为fdr《0.1并且fold change》1.5。差异表达基因富集的生物通路利用david工具进行分析。使用基因集富集分析软件gsea对特定基因表达印迹进行功能富集分析。
71.实施例2
72.病人特征和临床预后因素:
73.结合图1可知,从607例以诊断目的进行ebv sorting pcr/fish的病人中筛选,纳入119例非肿瘤ebv-t/nk-lpds在我们的研究中,包括46例ebv hlh和73例caebv-t/nk。中位
起病年龄为28岁,病人年龄范围为3~74岁,年龄超过20岁的病人占总人群的71.4%。与既往研究的不同,既往的研究以儿童和青少年为主。ebv感染的优势细胞群包括nk细胞,其感染率为67.2%,t细胞,其感染率为23.5%以及t、nk混合感染细胞类型。大多数病人表现为传染性单核细胞增多症样表现,比如发热、脾大、淋巴结肿大等,少数病人表现皮肤症状,比如5.0%的病人表现为蚊虫叮咬症、8.4%的病人表现为种痘样水疱病变,具体临床症状如下表1所示。
74.hlh发生在54.6%的病人中,包括以hlh急性起病的病人,如38.7%的ebv hlh,和caebv进展期发生的hlh。重要的是,hlh大多发生在疾病起病的一年之内,本发明研究发现在66个病人中有60个有发生,发生率为90.9%,而肿瘤转化大多数发生在起病一年之后,研究发现在6个病人中出现5个,发生率为83.3%,具体如图4a、4b所示。
75.非肿瘤ebv-t/nk-lpds的治疗方法包括抗病毒治疗、抗hlh治疗、支持治疗等,有22例接受了allo-hsct。在随访期间(中位,347天;范围,79-3783天)。病人表现异质性的预后,包括51.3%死亡(中位,140天;范围,26-3783天)和48.7%幸存(中位,609天;范围,79-3783天)。而且我们发现hlh发生和肿瘤转化的病人表现为高血浆ebv载量(p《0.05),具体如图4c和4d所示。
76.表1:非肿瘤ebv-t/nk-lpds的临床特征
77.[0078][0079]
表1中,no.(%),number(percentage of each group)
[0080]
进一步的采用单变量和多变量的cox比例风险模型进行预测及分析,包括一系列临床特征,以确定与总生存期相关的临床预后因素,具体如图5所示。单因素分析表明起病年龄≥37岁、hlh发生、血浆ebv载量≥6.72
×
103copies/ml、血小板减少、贫血和hlh-2004/1994方案治疗,而allo-hsct和种痘样水疱病变为两个有利预后因素。然后,将单变量分析得到的重要预后因素进一步进行多变量cox模型分析,以确定独立预后因素。血小板减少症、贫血和使用hlh-2004/1994方案的治疗被排除在多因素分析之外,因为这些因素参与了hlh发生的诊断或治疗。因此,我们对起病年龄≥37岁、hlh发生、血浆ebv载量≥6.72
×
103拷贝/ml、疫苗样水疹、异体hsct等5个预后因素进行总生存的多因素模型分析。在多因素分析中,hlh[hr:5.624;95%置信区间(ci):2.743-11.530;p<0.001]仍然是唯一独立的有害事件和allo-hsct(hr:0.318;ci:0.111-0.908;p=0.032)仍是唯一独立的有利因素。
[0081]
实施例3
[0082]
抗病毒免疫相关基因先天突变富集在非肿瘤ebv-t/nk-lpds:
[0083]
以往研究表明,持续性严重的ebv感染与少数t/nk细胞激活或细胞毒性相关基因缺陷有关,提示抗病毒免疫基因先天缺陷导致的病毒清除不力是ebv感染性疾病发生的重要遗传基础之一。因此,我们首先构建了包含372个抗病毒免疫相关基因的知识库,主要来源于pids,如图6。并检测了97例非肿瘤ebv-t/nk-lpds患者的先天变异,其中包括62例caebv-t/nk和35例ebv hlh。考虑ebv相关肿瘤同样存在t/nk细胞中ebv持续感染,我们研究了62例肿瘤性ebv-t/nk-lpds的先天变异,包括27例ankl和35例nktcl。在非肿瘤ebv-t/nk-lpds队列中,我们在205个基因中鉴定出518个预测的破坏性种系变异(maf≤0.01)。与1000g数据库的健康人群(中位数:4;iqr:3-6)相比,非肿瘤ebv-t/nk-lpd患者(中位数:6;iqr:4-8),nktcl(中位数:6;iqr:4-8)和ankl(中位数:7;iqr:5-9)具有更多的372个抗病毒免疫相关基因先天变异,具体如图7a所示。
[0084]
为了识别非肿瘤ebv-t/nk-lpds富集的先天突变基因,我们比较了1000g项目中中国普通人群和ebv-t/nk-lpds疾病队列中抗病毒免疫相关基因突变负荷的差异。在非肿瘤ebv-t/nk-lpds患者中发现8个基因的先天变异显著富集。kmt2d是最常见的突变基因(16.49%相对7.64%,p=0.019),其次是ifih1(14.43%相对3.32%,p《0.001),unc13d(13.40%相对3.32%,p《0.001),tyk2(10.31%相对3.65%,p=0.022),nlpr12(9.28%相对3.32%,p=0.034),nod2(6.19%相对1.66%,p=0.029),cftr(8.25%相对2.66%,p=0.032)和orai1(6.19%相对0.33%,p=0.001),具体如图7b所示。8个基因中有4个涉及先天免疫通路,包括ifnα/β信号通路:tyk2和2个病毒识别通路,即rig-1样受体通路:ifih1和nod-like受体通路:nlpr12和nod2。另外四个基因参与了几种不同的抗病毒途径,包括典型的hlh相关基因unc13d、表观遗传修饰基因kmt2d、离子通道途径中的cftr和orai1。kmt2d、ifih1在ankl中也具有较高的先天变异率,tyk2、cftr和orai1在nktcl中具有高频的先天突变,具体如图7c所示,该发现提示ebv感染相关的恶性肿瘤和非肿瘤的增殖性疾病具有一些相似的抗病毒免疫基因先天突变。
[0085]
实施例4
[0086]
结合图8,如图8a、8b、8c可知,ebv感染的t/nk细胞中累积体细胞突变:
[0087]
通过对20例患者进行外显子组测序,我们系统地刻画了非肿瘤ebv-t/nk-lpds患者,其中包括16例caebv-t/nk和4例ebv hlh的体细胞突变谱。在556个基因中共鉴定出631个体细胞突变(maf≤0.01),其中包括547个错义,41个错义,18个剪接位点突变和25个插入/缺失。77个基因为重现性突变基因,有两个以上病人中出现这种现象,最高频的突变基因包括rig-i样受体途径中的rna解旋酶ddx3x(6/20)、表观遗传调节因子tet2(3/20)和kmt2d(2/20)以及jak-stat信号通路的转录因子stat3(3/20)。为了在更大患者人群中进一步验证体细胞突变的研究结果,我们对73例患者进行了靶向测序,其中包括已进行了wes(n=20)分析的患者和新入组的53例患者。24个用于靶向测序的基因按照以下标准选择:(i)在我们的发现队列中发现的重现性体细胞突变基因,这些基因在ebv相关疾病中已被报道或在cancer gene gensus中被记录;(ii)在我们的发现队列中未被发现但经常在ankl/nktcl或其他类型淋巴瘤中发生突变的基因。我们在ebv感染的t/nk细胞中检测到19个基因87个体细胞突变,涉及67.12%的患者,其中26.03%的患者rig-i样受体通路发生ddx3x突
变,35.62%的患者发生表观遗传调控因子tet2、kmt2d、arid1a或dnmt3a突变。10.96%的患者存在jak-stat信号通路突变,17.81%的患者存在其他肿瘤驱动基因突变,如肿瘤抑制因子mga、ptpn23或spen、转录因子elf4、notch2或间变性淋巴瘤激酶alk,具体如图9b、9c。我们的研究结果提示在非肿瘤ebv-t/nk-lpds的ebv感染的t/nk细胞中,驱动基因的体细胞突变十分常见。
[0088]
实施例5
[0089]
图9给出了先天/体细胞突变影响的信号通路与血浆ebv载量和预后相关:
[0090]
接下来,我们研究了先天/体细胞变异影响的信号通路,并探讨了其潜在的临床意义。未携带任何先天/体细胞遗传变异的非肿瘤ebv-t/nk-lpds患者的预后更好。与携带遗传突变的患者相比,未携带突变的患者,其hlh的发生率更低(12.5%相对57.0%,p=0.024),具体如图9b和9c所示。将检测到的先天/体细胞突变基因按照生物学功能进行分类,包括表观遗传修饰因子(53.3%)、rig-i样受体通路(41.1%)、jak/stat通路(26.1%)、其他肿瘤驱动基因(28.8%)、nod样受体通路(14.4%)、hlh相关基因(13.4%)和离子通道通路(13.4%),具体如图9a所示。如图9d所示,表观遗传修饰因子或rig-i样受体通路中存在遗传突变的患者,其血浆ebv负荷明显高于未携带任何遗传变异的患者。此外,如9e所示,与未携带表观修饰因子及rig-i通路突变的患者相比,携带上述两类突变的患者,其生存率明显降低。这些发现表明,本发明在非肿瘤ebv-t/nk-lpds患者中检测出的遗传突变,如(先天突变和体细胞突变)具有临床危险度分层的潜在应用价值
[0091]
综上所述,针对于非肿瘤ebv-t/nk-lpds患者的临床表现和预后具有高度异质性。本发明采用大样本,以成人发病为主的非肿瘤ebv-t/nk-lpds队列,系统地探索该疾病临床和分子特点。这使得我们可以从临床特征、预后和可能的发病机制等方面更好地研究非肿瘤ebv-t/nk-lpds,并为其它ebv感染相关疾病提供新思路。
[0092]
具体的,我们的研究表明,在非肿瘤ebv-t/nk-lpds中ebv感染诱发的hlh是主要的突发事件,也是一个独立的不利预后因素,而allo-hsct仍然是唯一的独立有利因素。尽管allo-hsct是一种很好的治疗选择,但移植物抗宿主病等导致的相关死亡率阻碍其应用。由于疾病的非恶性性质和高度异质性的预后,在明确诊断后决定谁应该进行移植仍是一个巨大的挑战。我们的研究结果表明有54.6%的非肿瘤ebv-t/nk-lpds发生hlh,其中90.9%的hlh初始发作发生在发病后1年内,在hlh发生前对非肿瘤ebv-t/nk-lpds进行早期分层对实现最佳的临床管理具有重要意义。
[0093]
以往对家族性免疫缺陷病的研究表明,严重ebv感染的遗传易感性主要涉及t/nk细胞细胞毒性和活化相关基因突变。本发明纳入了已知的少数易感基因,并扩大候选基因集,构建抗病毒免疫基因知识库。该知识库包括372个免疫相关基因,可分为hlh相关基因如细胞毒通路相关基因、已知病毒易感性基因、t/nk细胞功能相关基因和其他pid基因。我们在大样本成人非肿瘤ebv-t/nk-lpd患者中描述了抗病毒免疫基因和肿瘤驱动基因的先天突变和体细胞突变,并探索了遗传缺陷和关键临床特征之间的关联性。与以往报道一致,unc13d和kmt2d先天突变在本发明纳入的成人ebv-t/nk-lpds患者中存在高频突变。此外,本发明首次发现参与天然免疫功能,如病毒识别信号通路相关基因突变。上述新潜在易感基因的鉴定为进一步研究非肿瘤ebv-t/nk-lpds的病原学提供了新方向。本发明进一步发现,在ebv感染的t/nk细胞中,驱动基因的体细胞突变十分常见,这与之前caebv主要发生在
儿童和青少年和肿瘤性的ebv-t/nk-lpds(ankl,nktcl)的研究结果一致。本发明研究数据表明,非肿瘤ebv-t/nk-lpds可根据这些先天/体细胞变异进行临床分层,并与其他关键临床因素联合指导临床诊疗。未携带先天/体细胞变异的患者临床预后较好,而携带表观遗传调控因子和/或rig-i样受体通路基因突变的患者预后较差,这将有助于筛选低风险和高危ebv感染人群,实现个性化精准治疗和更好的临床管理。尽管是单中心研究,但本发明发现关键的先天突变和体细胞突变可作为非肿瘤ebv-t/nk-lpds的预后分层的潜在工具。这些早期数据有助于推动在hlh发生前对非肿瘤ebv-t/nk-lpds进行分层的临床研究,以及为后续开展大规模多中心研究提供理论基础。
[0094]
以上实施例仅为最佳举例,而并非是对本发明的实施方式的限定。除上述实施例外,本发明还有其他实施方式。凡采用等同替换或等效变换形成的技术方案,均落在本发明要求的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1