化合物Tomivosertib的制备工艺的制作方法
化合物tomivosertib的制备工艺
技术领域
1.本发明涉及生物医药技术领域,具体地,涉及一种激酶抑制剂化合物tomivosertib的制备工艺。
背景技术:
2.effector治疗公司正在开发tomivosertib(eft-508),一种有效的mnk1和mnk2激酶选择性抑制剂,用于癌症的口服治疗。目前,其临床试验适应症覆盖了:弥漫性大b细胞淋巴瘤、头颈部肿瘤、肝细胞癌、激素难治性前列腺癌、淋巴瘤、转移性乳腺癌、转移性结直肠癌、非小细胞肺癌、移行细胞癌、实体瘤,这些适应症目前均处于2期临床研究阶段,其中除转移性乳腺癌在加拿大处于2期临床研究外,其余适应症均在美国处于2期临床研究。
3.tomivosertib的化学结构具体如式i所示化合物:
[0004][0005]
然而,目前化合物tomivosertib的新的制备工艺仍有待改进。
技术实现要素:
[0006]
本发明旨在至少在一定程度上解决相关技术中的技术问题之一。为此,本发明的一个目的在于提出一种化合物tomivosertib新的制备工艺。相比于现有技术所述的方法合成步骤较多,利用本发明所述的制备工艺方法,简化了合成制备式i所示化合物tomivosertib的工艺步骤,该路线总体步骤较少,条件简单易操作,每一步选择性好,总体产量较高,适合于原料药的工业化大生产的需求。
[0007]
在本发明的一个方面,本发明提供了一种式i所示化合物tomivosertib的制备工艺。根据本发明的实施例,该方法包括:
[0008]
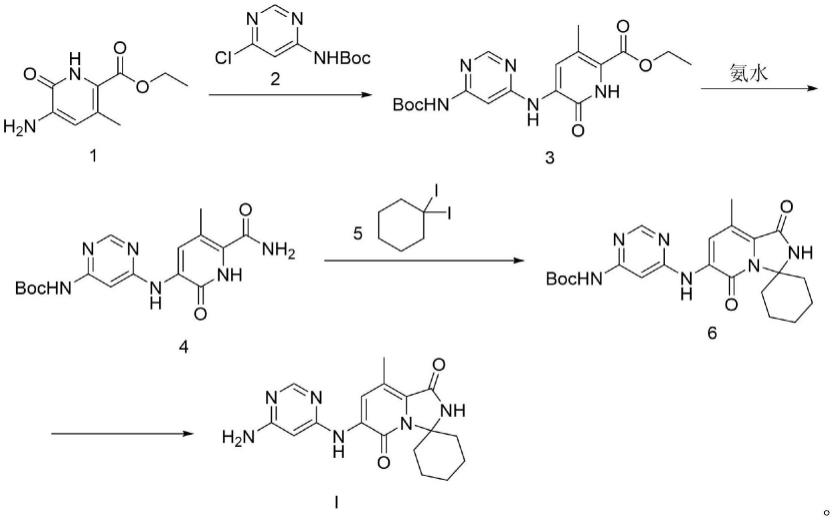
(1)使式1所示化合物与式2所示化合物接触,以便获得式3所示化合物;
[0009]
(2)使式3所示化合物与氨水接触,以便获得式4所示化合物;
[0010]
(3)使式4所示化合物与式5所示化合物接触,以便获得式6所示化合物;
[0011]
(4)使式6所示化合物与hcl/dioxane溶液接触,以便获得式i所示化合物,
[0012][0013]
本发明所述的合成路线采用商售原料(其中式1所示化合物的cas号为1509897-36-2,式2所示化合物的cas号为1849595-31-8),化合物tomivosertib的制备工艺,其用式1所示化合物和式2所示化合物为起始物料,经过卤代反应、酰胺反应后,再经过一次卤代反应,最后脱保护基合成目标分子,总体步骤是4步反应。发明人发现,相对于已有文献步骤较多,利用本发明所述的制备工艺方法,简化了合成制备式i所示化合物tomivosertib的工艺步骤,该路线总体步骤较少,条件简单易操作,每一步选择性好,总体产量较高,适合于原料药的工业化大生产的需求。
[0014]
在本文中所使用的术语“接触”应做广义理解,其可以是任何能够使得至少两种反应物发生化学反应的方式,例如可以是将两种反应物在适当的条件下进行混合。根据需要,可以在搅拌下,将需要进行接触的反应物进行混合,由此,搅拌的类型并不受特别限制,例如可以为机械搅拌,即在机械力的作用下进行搅拌。
[0015]
在本文中,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。在本发明的描述中,“多个”的含义是两个或两个以上,除非另有明确具体的限定。
[0016]
根据本发明的实施例,上述制备式3所示化合物、式4所示化合物、式6所示化合物、式i所示化合物的方法还可以具有下列附加技术特征至少之一:
[0017]
根据本发明的实施例,本发明所述的化学反应可以按照本领域已知的任何方法进行。制备式3所示化合物、式4所示化合物、式6所示化合物、式i所示化合物的原料的来源并不受特别限制,其可以是采用任何已知的方法制备的,或者市售获得的。
[0018]
根据本发明的实施例,在步骤(1)中,式1所示化合物与式2所示化合物、k2co3的接触方式并不受特别限制。由此,可以提升式1所示化合物与式2所示化合物、k2co3接触反应的效率,加快反应速度,进一步提高利用该方法制备式3所示化合物的效率。
[0019]
根据本发明的实施例,在步骤(1)中,包括如下步骤:室温下,将式1所示化合物和式2所示化合物加入搅拌中的dioxane中,继续搅拌下,加入k2co3,将混合物在氮气保护下,
保持在95℃~100℃反应2h,反应毕,将反应液过滤后减压浓缩,浓缩物用体积比为(8~12):1的石油醚/乙酸乙酯混合溶剂在硅胶上柱层析纯化产物,得式3所示化合物。由此,可以提升式1所示化合物与式2所示化合物、k2co3接触反应的效率,加快反应速度,进一步提高利用该方法制备式3所示化合物的效率。
[0020]
根据本发明的实施例,在步骤(1)中,式1所示化合物与式2所示化合物、k2co3的摩尔比为1:(1.05~1.3):(1.1~1.5),优选式1所示化合物与式2所示化合物、k2co3的摩尔比为1:1.1:1.2。由此,可以进一步提高利用该方法制备式3所示化合物的效率。
[0021]
根据本发明的实施例,在步骤(1)中,优选所述硅胶柱层析的溶剂为体积比为10:1的石油醚/乙酸乙酯混合溶剂。
[0022]
根据本发明的一个具体实施例,在步骤(1)中,包括如下步骤:室温下,将式1所示化合物(19.6g,0.1mol)和式2所示化合物(25.3g,0.11mol)加入搅拌中的dioxane(200ml)中,继续搅拌下,加入k2co3(16.6g,0.12mol),将混合物在氮气保护下,保持在95℃~100℃反应2h,反应毕,将反应液过滤后减压浓缩,浓缩物用体积比为10:1的石油醚/乙酸乙酯混合溶剂在硅胶上柱层析纯化产物,得式3所示化合物,得量34.8g,收率89.4%。
[0023]
根据本发明的实施例,在步骤(2)中,使式3所示化合物与氨水的接触方式并不受特别限制。由此,可以提升式3所示化合物与氨水接触反应的效率,加快反应速度,进一步提高利用该方法制备式4所示化合物的效率。
[0024]
根据本发明的实施例,在步骤(2)中,包括如下步骤:室温下,将式3所示化合物加入甲醇中,再加入氨水于密封管中,将混合物搅拌并在60℃~68℃加热反应2小时45分钟~3小时30分钟,tlc显示原料完全消耗,将反应液冷却至室温,混合液用乙酸乙酯萃取三次,合并有机相后用盐水洗涤后浓缩,浓缩物用体积比为(8~12):1的石油醚/乙酸乙酯混合溶剂在硅胶上柱层析纯化产物,得式4所示化合物。由此,可以提升式3所示化合物和氨水接触反应的效率,加快反应速度,进一步提高利用该方法制备式4所示化合物的效率。
[0025]
根据本发明的实施例,在步骤(2)中,式3所示化合物和氨水的质量体积比为1:(30~40)(g/v),优选式3所示化合物和氨水的质量体积比为1:33.3。由此,反应物利用率较高,不会造成原料、实际的浪费,目标化合物收率较高。
[0026]
根据本发明的实施例,在步骤(2)中,优选式3所示化合物和氨水反应的温度为65℃,反应时间为3小时。由此,反应物利用率较高,不会造成原料、实际的浪费,目标化合物收率较高。
[0027]
根据本发明的实施例,在步骤(2)中,优选所述硅胶柱层析的溶剂为体积比为10:1的石油醚/乙酸乙酯混合溶剂。
[0028]
根据本发明的一个具体实施例,在步骤(2)中,包括如下步骤:室温下,将式3所示化合物(6.0g,0.0154mol)加入甲醇(20ml)中,再加入氨水(200ml)于500ml的密封管中,将混合物搅拌并在65℃加热反应3小时,tlc显示原料完全消耗,将反应液冷却至室温,混合液用乙酸乙酯(3
×
100ml)萃取三次,合并有机相后用盐水(100ml)洗涤后浓缩,浓缩物用体积比为10:1的石油醚/乙酸乙酯混合溶剂在硅胶上柱层析纯化产物,得式4所示化合物,得量5.1g,收率91.9%。
[0029]
根据本发明的实施例,在步骤(3)中,式4所示化合物与式5所示化合物、以及与pd(oac)2、xantphos、cs2co3的接触方式并不受特别限制。由此,可以提升式4所示化合物与式5
所示化合物、以及与pd(oac)2、xantphos、cs2co3接触反应的效率,加快反应速度,进一步提高利用该方法制备式6所示化合物的效率。
[0030]
根据本发明的实施例,在步骤(3)中,包括如下步骤:室温下,将式4所示化合物和式5所示化合物加入1,4-二氧六环中,搅拌均匀,加入pd(oac)2、xantphos和cs2co3,将反应液在氮气保护下,升温保持在96℃~100℃反应4h,反应毕,将反应液过滤后减压浓缩,浓缩物用体积比为(8~12):1的石油醚/乙酸乙酯混合溶剂在硅胶上柱层析纯化产物,得式6所示化合物。由此,可以提升式4所示化合物与式5所示化合物、以及与pd(oac)2、xantphos、cs2co3接触反应的效率,加快反应速度,进一步提高利用该方法制备式6所示化合物的效率。
[0031]
根据本发明的实施例,在步骤(3)中,式4所示化合物与式5所示化合物、以及与pd(oac)2、xantphos、cs2co3反应的摩尔比为1:(1.0~1.3):(0.12~0.2):(0.12~0.2):(3.5~5),优选式4所示化合物与式5所示化合物、以及与pd(oac)2、xantphos、cs2co3反应的摩尔比为1:1.05:0.15:0.15:4。由此,反应物利用率较高,不会造成原料、实际的浪费,目标化合物收率较高。
[0032]
根据本发明的实施例,在步骤(3)中,优选所述硅胶柱层析的溶剂为体积比为10:1的石油醚/乙酸乙酯混合溶剂。
[0033]
根据本发明的一个具体实施例,在步骤(3)中,包括如下步骤:室温下,将式4所示化合物(36.0g,0.1mol)和式5所示化合物(35.3g,0.105mol)加入1,4-二氧六环(720ml)中,搅拌均匀,加入pd(oac)2(3.4g,0.015mol),xantphos(14.4g,0.015mol)和cs2co3(130.3g,0.4mol),将反应液在氮气保护下,升温保持在100℃反应4h,反应毕,将反应液过滤后减压浓缩,浓缩物用体积比为10:1的石油醚/乙酸乙酯混合溶剂在硅胶上柱层析纯化产物,得式6所示化合物,得量35.3g,收率80.1%。
[0034]
根据本发明的实施例,在步骤(4)中,式6所示化合物与hcl/dioxane溶液的接触方式并不受特别限制。由此,可以提升式6所示化合物与hcl/dioxane溶液接触反应的效率,加快反应速度,进一步提高利用该方法制备式i所示化合物的效率。
[0035]
根据本发明的实施例,在步骤(4)中,包括如下步骤:0℃下,在搅拌下,向式6所示化合物中加入4mhcl/dioxane溶液,加毕,保持温度在0℃反应0.5h,反应毕后,反应液减压浓缩至固体,得到式i所示化合物。由此,可以提升式6所示化合物与hcl/dioxane溶液接触反应的效率,加快反应速度,进一步提高利用该方法制备式i所示化合物的效率。
[0036]
根据本发明的实施例,在步骤(4)中,4m盐酸二氧六环溶液的制取方法为:称取定量的二氧六环,通干燥hcl气体,称重至计算量,停止通气即可得到。
[0037]
根据本发明的实施例,在步骤(4)中,式6所示化合物与4mhcl/dioxane溶液的质量体积比为1:(8~11)(g/v),优选式6所示化合物与4mhcl/dioxane溶液的质量体积比为1:10(g/v)。由此,反应物利用率较高,不会造成原料、实际的浪费,目标化合物收率较高。
[0038]
根据本发明的一个具体实施例,在步骤(4)中,包括如下步骤:0℃下,在搅拌下,向式6所示化合物(44.0g,0.1mol)中加入4m的hcl/dioxane溶液(440ml),加毕,保持温度在0℃反应0.5h,反应毕后,反应液减压浓缩至固体,得到式i所示化合物,得量32.3g,收率94.9%,hplc纯度99.7%。
[0039]
根据本发明的实施例,式i所示化合物的合成路线可以如下所示:
[0040][0041]
相对于现有技术,本发明所述的制备方法,其至少具有以下有益效果:本发明所述的方法,本路线采用商售原料,经过卤代反应、酰胺反应后,再经过一次卤代反应,最后脱保护基合成目标分子,总体步骤是4步。其中,第一步卤代反应,式1所示化合物中含有两种氨基(伯胺和仲氨),式2所示化合物中也存在氨基,所以选择氨基保护的式2所示化合物作为原料,为了避免式1所示化合物中的仲氨参与卤代反应,设置反应温度时采用较低的温度(比如95~100℃),采用无机碱比如k2co3作为反应试剂,保证了较高的产率。第二步利用氨水脱除羧酸保护基后同时进行酰胺化反应,减少了反应步骤,同时具有较高的产率。采用封管作为反应容器,可以有效缩短反应时间,提高反应效率。第三步原料卤代反应的位点较多,通过加入催化剂和配体进行特异性的卤代反应,有效提高了反应的选择性,减少了副反应。第四步采用盐酸的二氧六环溶液脱除氨基保护基,该反应产率高,操作简单,无需进行纯化。相对于已有文献步骤较多,本发明所述的制备工艺路线总体步骤较少,条件简单易操作,每一步选择性好,总体产量较高,适合于原料药的工业化大生产的需求。
具体实施方式
[0042]
下面详细描述本发明的实施例。下面描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
[0043]
实施例1式3所示化合物的合成
[0044]
室温下,将式1所示化合物(19.6g,0.1mol)和式2所示化合物(25.3g,0.11mol)加入搅拌中的dioxane(200ml)中,继续搅拌下,加入k2co3(16.6g,0.12mol),将混合物在氮气保护下,保持在95℃~100℃反应2h,反应毕,将反应液过滤后减压浓缩,浓缩物用体积比为10:1的石油醚/乙酸乙酯混合溶剂在硅胶上柱层析纯化产物,得式3所示化合物,得量34.8g,收率89.4%。
[0045]
lc-ms(apci):m/z=390.2(m+1)
+
。
[0046]
实施例2式3所示化合物的合成
[0047]
室温下,将式1所示化合物(19.6g,0.1mol)和式2所示化合物(24.1g,0.105mol)加入搅拌中的dioxane(200ml)中,继续搅拌下,加入k2co3(15.2g,0.11mol),将混合物在氮气保护下,保持在95℃~100℃反应2h,反应毕,将反应液过滤后减压浓缩,浓缩物用体积比为8:1的石油醚/乙酸乙酯混合溶剂在硅胶上柱层析纯化产物,得式3所示化合物,得量34.0g,收率87.3%。
[0048]
实施例3式3所示化合物的合成
[0049]
室温下,将式1所示化合物(19.6g,0.1mol)和式2所示化合物(29.9g,0.13mol)加入搅拌中的dioxane(200ml)中,继续搅拌下,加入k2co3(20.7g,0.15mol),将混合物在氮气保护下,保持在95℃~100℃反应2h,反应毕,将反应液过滤后减压浓缩,浓缩物用体积比为12:1的石油醚/乙酸乙酯混合溶剂在硅胶上柱层析纯化产物,得式3所示化合物,得量34.6g,收率88.8%。
[0050]
实施例4式4所示化合物的合成
[0051]
室温下,将式3所示化合物(6.0g,0.0154mol)加入甲醇(20ml)中,再加入氨水(200ml)于500ml的密封管中,将混合物搅拌并在65℃加热反应3小时,tlc显示原料完全消耗,将反应液冷却至室温,混合液用乙酸乙酯(3
×
100ml)萃取三次,合并有机相后用盐水(100ml)洗涤后浓缩,浓缩物用体积比为10:1的石油醚/乙酸乙酯混合溶剂在硅胶上柱层析纯化产物,得式4所示化合物,得量5.1g,收率91.9%。
[0052]
lc-ms(apci):m/z=361.2(m+1)
+
。
[0053]
实施例5式4所示化合物的合成
[0054]
室温下,将式3所示化合物(6.0g,0.0154mol)加入甲醇(20ml)中,再加入氨水(180ml)于500ml的密封管中,将混合物搅拌并在60℃加热反应3小时30分钟,tlc显示原料完全消耗,将反应液冷却至室温,混合液用乙酸乙酯(3
×
100ml)萃取三次,合并有机相后用盐水(100ml)洗涤后浓缩,浓缩物用体积比为8:1的石油醚/乙酸乙酯混合溶剂在硅胶上柱层析纯化产物,得式4所示化合物,得量4.9g,收率88.3%。
[0055]
实施例6式4所示化合物的合成
[0056]
室温下,将式3所示化合物(6.0g,0.0154mol)加入甲醇(20ml)中,再加入氨水(240ml)于500ml的密封管中,将混合物搅拌并在68℃加热反应2小时45分钟,tlc显示原料完全消耗,将反应液冷却至室温,混合液用乙酸乙酯(3
×
100ml)萃取三次,合并有机相后用盐水(100ml)洗涤后浓缩,浓缩物用体积比为12:1的石油醚/乙酸乙酯混合溶剂在硅胶上柱层析纯化产物,得式4所示化合物,得量5.0g,收率90.5%。
[0057]
实施例7式6所示化合物的合成
[0058]
室温下,将式4所示化合物(36.0g,0.1mol)和式5所示化合物(35.3g,0.105mol)加入1,4-二氧六环(720ml)中,搅拌均匀,加入pd(oac)2(3.4g,0.015mol),xantphos(14.4g,0.015mol)和cs2co3(130.3g,0.4mol),将反应液在氮气保护下,升温保持在100℃反应4h,反应毕,将反应液过滤后减压浓缩,浓缩物用体积比为10:1的石油醚/乙酸乙酯混合溶剂在硅胶上柱层析纯化产物,得式6所示化合物,得量35.3g,收率80.1%。
[0059]
lc-ms(apci):m/z=441.3(m+1)
+
。
[0060]
实施例8式6所示化合物的合成
[0061]
室温下,将式4所示化合物(36.0g,0.1mol)和式5所示化合物(33.6g,0.10mol)加入1,4-二氧六环(700ml)中,搅拌均匀,加入pd(oac)2(2.7g,0.012mol),xantphos(11.5g,0.012mol)和cs2co3(114.0g,0.35mol),将反应液在氮气保护下,升温保持在96℃反应4h,反应毕,将反应液过滤后减压浓缩,浓缩物用体积比为8:1的石油醚/乙酸乙酯混合溶剂在硅胶上柱层析纯化产物,得式6所示化合物,得量34.6g,收率78.5%。
[0062]
实施例9式6所示化合物的合成
[0063]
室温下,将式4所示化合物(36.0g,0.1mol)和式5所示化合物(40.3g,0.12mol)加入1,4-二氧六环(850ml)中,搅拌均匀,加入pd(oac)2(4.5g,0.02mol),xantphos(19.2g,0.02mol)和cs2co3(163.0g,0.5mol),将反应液在氮气保护下,升温保持在98℃反应4h,反应毕,将反应液过滤后减压浓缩,浓缩物用体积比为12:1的石油醚/乙酸乙酯混合溶剂在硅胶上柱层析纯化产物,得式6所示化合物,得量35.1g,收率79.7%。
[0064]
实施例10式i所示化合物的合成
[0065]
0℃下,在搅拌下,向式6所示化合物(44.0g,0.1mol)中加入4mhcl/dioxane溶液(440ml),加毕,保持温度在0℃反应0.5h,反应毕后,反应液减压浓缩至固体,得到式i所示化合物,得量32.3g,收率94.9%,测定hplc纯度99.7%。
[0066]
lc-ms(apci):m/z=341.2(m+1)
+
。
[0067]
实施例11式i所示化合物的合成
[0068]
0℃下,在搅拌下,向式6所示化合物(44.0g,0.1mol)中加入4mhcl/dioxane溶液(350ml),加毕,保持温度在0℃反应0.5h,反应毕后,反应液减压浓缩至固体,得到式i所示化合物,得量32.1g,收率94.3%,测定hplc纯度99.4%。
[0069]
实施例12式i所示化合物的合成
[0070]
0℃下,在搅拌下,向式6所示化合物(44.0g,0.1mol)中加入4mhcl/dioxane溶液(480ml),加毕,保持温度在0℃反应0.5h,反应毕后,反应液减压浓缩至固体,得到式i所示化合物,得量32.0g,收率94.0%,测定hplc纯度99.5%。
[0071]
实施例13式i所示化合物的合成
[0072]
0℃下,在搅拌下,向式6所示化合物(44.0g,0.1mol)中加入4mhcl/dioxane溶液(880ml),加毕,保持温度在10℃反应1h,反应毕后,反应液减压浓缩至固体,得到式i所示化合物,得量31.0g,收率91.1%,测定hplc纯度97.8%。
[0073]
实施例13为对比实施例,在本实施例中,发明人调节了式6所示化合物与4mhcl/dioxane溶液的质量体积比为1:20(g/v),且调节保温反应的温度及时间为在保持温度10℃反应1h。结果表明相比于本发明实施例10~实施例12,对比实施例13在技术效果上,其得到的产物的hplc纯度要比实施例10~实施例12的明显低,且由实施例13的方法得到的目标化合物的收率并未得到提高相反降低了。
[0074]
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结
合和组合。
[0075]
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1