DGAT1基因启动子区域变异位点及其在检测猪肉肌内脂肪含量上的应用
dgat1基因启动子区域变异位点及其在检测猪肉肌内脂肪含量上的应用
技术领域
1.本发明属于分子生物学领域,涉及dgat1基因启动子区变异位点及其在检测猪肉肌内脂肪含量上的应用。
背景技术:
2.我国是肉类生产和消费大国,肉类总产量占世界总产量三分之一左右,其中猪肉占到一半以上。近年来,随着人们生活水平的不断提高,对猪肉的需求逐渐由“量”向“质”转变,即猪肉的品质问题成为人们日益关注的重点,美味、营养、健康肉品已成为人们追求的新目标。在影响猪肉品质的诸多因素中,肌内脂肪(intramuscular fat,imf)含量发挥着重要作用,与猪肉的嫩度、多汁性和风味高度相关,是决定猪肉品质的关键因素。因此,通过提高猪肉中肌内脂肪含量来改善猪肉肉质、提高食用价值、满足广大消费者的要求具有重要的现实意义。
3.imf是猪肉中脂肪沉积的主要形式之一,它指的是同一部位肌肉内部、肌纤维之间沉积的脂肪,主要位于肌内膜、肌束膜或肌外膜上,主要成分是磷脂和甘油三酯。有研究表明,肌内脂肪的含量越低,肌肉的嫩度、多汁性、风味及总体可接受程度也越低,2%-3%的肌内脂肪含量是衡量肉质的一个理想标准。此外,猪的肌内脂肪性状具有相对较高的遗传力(h2=0.52)。因此,研究肌内脂肪对改善猪肉品质、生产健康肉产品及提高猪产业经济效益具有重要意义,开发和利用分子标记及相关检测技术使得肌内脂肪性状在遗传育种改良中获得较快进展。
4.哺乳动物的脂肪以三酰基甘油(tg)的形式存储代谢能,而tg的合成需要酶的催化,其中发挥作用的酶是二酰基甘油酰基转移酶(dgat),dgat基因包括二酰基甘油酰基转移酶1(dgat1)基因和二酰基甘油酰基转移酶2(dgat2)基因,前者属于酰基辅酶a 胆固醇酰基转移酶(acat)基因家族,后者属于单酰甘油酰基转移酶(mgat)基因家族,分别编码微粒体酶dgat1和dgat2,是定位于内质网的跨膜蛋白,其拓扑结构具有与其他蛋白质和细胞器相互作用的能力,影响脂肪代谢及脂类在组织中的沉积,参与调节动物机体的能量合成和分解代谢。dgat1基因是定位于内质网的跨膜蛋白,其拓扑结构具有与其他蛋白质和细胞器相互作用的能力,影响脂肪代谢及脂类在组织中的沉积,参与调节动物机体的能量合成和分解代谢,在脂肪合成过程中起着关键作用,影响着动物体内脂肪的形成与分解。
技术实现要素:
5.本发明的目的在于提供一种用于检测猪肌内脂肪含量的snp分子标记及其应用,方便快速地判断猪肉肌内脂肪含量情况,从而获得更好肉质提供依据。
6.本发明的目的通过以下技术方案实现:
7.一种用于检测猪肌内脂肪含量的snp分子标记,该snp分子标记位于dgat1基因启动子区的转录起始密码子上游379bp处,该位点碱基是c或t。因此,将该snp命名为c.
‑ꢀ
379c
>t。该位点的基因型是cc、ct或tt。
8.其中,猪dgat1基因序列参见chromosome 4,nc_010446.5(452890..463665)。另外, dgat1基因启动子区起始密码子(atg)前约2000bp序列在序列表中列出(如seq idno.1所示),其中起始密码子上游379bp处为snp分子标记位点,用下划线标出,其基因型为cc、ct或tt。
9.一种用于检测上述snp分子标记的引物对,所述引物对的序列分别为:
10.dgat1-3f:5
’‑
ccacaacgcactaggcatttc-3’11.dgat1-3r:5
’‑
gggcaccactacctcagatcc-3’。
12.一种用于对上述snp分子标记的c/t突变位点进行基因分型的试剂盒,该试剂盒包含上述的引物对。
13.上述的snp分子标记、上述的引物对,或上述的试剂盒在检测猪肉肌内脂肪含量中的应用,对所述snp分子标记的c/t突变位点进行基因分型,基因型为tt或ct的猪肉样品的肌内脂肪含量高于基因型为cc的猪肉样品的肌内脂肪含量。
14.一种辅助选育猪高肌内脂肪性状遗传改良的方法,对上述snp分子标记的c/t突变位点进行基因分型,基因型为tt或ct的猪肉样品的肌内脂肪含量高于基因型为cc的猪肉样品的肌内脂肪含量。
15.作为一种优选技术方案,所述方法具体包括以下步骤:
16.1)提取待检测猪肉样品的dna;
17.2)采用上述的引物对或上述的试剂盒对步骤1)获得的dna进行pcr扩增,获得扩增片段;
18.3)通过pcr-rflp-pvuⅱ方法对扩增片段进行酶切分型,不同基因型的酶切产物会呈现不同的条带数:cc基因型为两条带(134bp、581bp),ct基因型为三条带(134bp、 581bp、715bp),tt基因型为一条带(715bp);
19.4)当分型结果为tt型或ct型时,判断其猪肉样品的肌内脂肪含量高于cc型的猪肉样品肌内脂肪含量。
20.进一步优选的:步骤2)中pcr扩增反应25μl体系:t3 mix 22μl、上下游引物各1μl、待检测dna 1μl;pcr反应程序:98℃,3min;98℃,10s;65℃,10s退火;72℃,10s; 34个循环;72℃,3min。
21.进一步优选的:所述pcr-rflp-pvuⅱ方法的反应体系为:待检测pcr扩增产物 17μl、pvuⅱ酶1μl、tango buffer 2μl;反应条件为:37℃,1h。
22.本发明的有益效果:本发明通过研究甘油三酯合成中的关键基因dgat1与猪肉肌内脂肪含量性状相关性,在启动子区筛选出了一个与猪肉肌内脂肪含量性状相关的snp位点,从而获得了与肌内脂肪含量相关的功能基因和分子遗传标记,为进一步控制猪肉肌内脂肪含量、辅助猪高肌内脂肪性状遗传改良奠定基础,对于提高肉品质具有重要意义,为方便快速地判断猪肉肌内脂肪含量情况,从而获得更好肉质提供依据。
附图说明
23.图1为snp位点筛选结果。
图2为部分pcr产物酶切结果。图3为突变位点与肌内脂肪含量的相关性分析结果。图4为不同基因型个体中dgat1的表达量分析结果。
具体实施方式
24.下面结合实施例对本发明做进一步说明,下列实施例中未注明具体条件的实验方法,通常按照本领域的公知手段。
25.实施例1
26.1.实验材料
27.1.1实验动物
28.本研究采用260头杜长大三元杂交猪,实验动物来自于南通嘉仑食品厂,在同一条件下饲养,采集背最长肌组织分别用于dna提取、rna提取、肌内脂肪含量的测定。
29.1.2 dna提取,rna提取,pcr及电泳试剂
30.dna提取试剂:tris-饱和酚、蛋白酶k、氯仿、异戊醇、无水乙醇
31.rna提取试剂:trizol、氯仿、异丙醇、无水乙醇
32.pcr及电泳试剂:t3 pcr mix、dna marker
33.10xtbe:tris 108g,edta
·
2h2o 7.44g,硼酸55g,溶于去离子水并定容至1000ml。
34.1.3仪器设备
35.实时荧光定量pcr仪:美国应用生物系统公司
36.低温高速离心机:eppendorf,德国
37.超低温冰箱、nanodrop分光光度计:thermo,美国
38.可调式微量移液器:eppendorf,德国
39.gel eq凝胶成像系统:bio-rad,美国
40.电子天平:yamatoz,美国
41.恒温水浴锅:北京医疗设备厂
42.手术镊子、手术剪、手术刀、医用纱布、游标卡尺、圆形取样器、新华定性滤纸、自封袋、标签纸:南京农业大学后勤处
43.扩增片段由上海生工生物公司提供测序
44.2.实验方法
45.2.1肌内脂肪含量测定
46.(1)将定量滤纸分摊在洁净的搪瓷盘中,105℃烘干2h以上,直至其重量没有变化为止。用精密天平(感量:0.00001g)准确称量烘干后滤纸的重量(w1)。
47.(2)将2-3g肌肉样剪(切)碎后用烘干滤纸包裹,称量纸包重量(w2)。将纸包分摊在洁净的搪瓷盘中,放入烘箱中,65℃烘干15h以上(可过夜),直至其重量没有变化为止。称量烘干后纸包的重量(w3)。
48.(3)将烘好的滤纸包放入索氏抽提器中,倒入无水乙醚浸泡过夜(乙醚全部淹没滤纸包),第二天早上打开乙醚回流装置,75℃回流9h以上。(乙醚容易挥发,在瓶口用水封口,并且定时观察回流状态,及时的补充乙醚。)
49.(4)抽提完毕后取出滤纸包分摊在洁净的搪瓷盘中,在通风处发挥完乙醚30min,
使乙醚充分挥发,105℃烘干2h以上,直至其重量没有变化为止,称量烘干后纸包的重量 (w4)。
50.(5)计算公式:本实验中以粗脂肪含量来近似表示肌内脂肪含量。
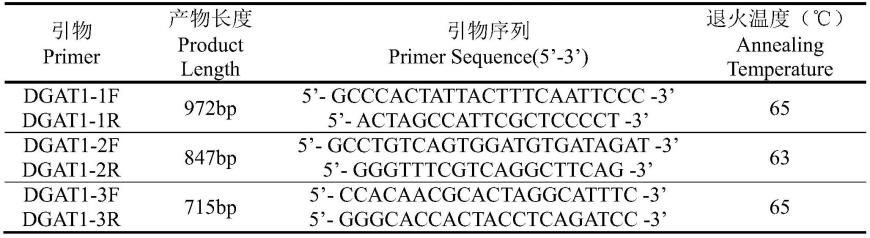
[0051][0052]
为消除样品前处理过程中各样品水分损失不等所造成的误差,肌内脂肪相对含量用抽提总脂重量占烘干后样品重(105℃烘干15h)的百分比值表示。计算公式如下:
[0053][0054]
2.2肌肉dna的提取
[0055]
(1)剪下100mg左右样品,切碎,放到2.0ml ep管内;
[0056]
(2)往ep管中分别加裂解液1ml和蛋白酶k 50μl充分混匀,水浴锅内55℃水浴消化 12h至过夜,次日向2ml管中加tris饱和酚900μl,摇匀器上混匀15min,4℃,12000rpm离心15min;
[0057]
(3)吸取1000μl上层液体放入2ml ep管内,加氯仿/异戊醇(24:1,v:v)500μl和 500μl饱和酚,摇匀器上混匀15min,4℃;12000rpm离心15min;
[0058]
(4)吸取850μl上层液体放入2ml ep管中,加氯仿/异戊醇(24:1,v:v)850μl,摇匀器上混匀15min,4℃,12000rpm离心15min;
[0059]
(5)吸取700μl上层液体放入2ml ep管中,加氯仿700μl,摇匀器上混匀15min, 4℃,12000rpm离心15min;
[0060]
(6)吸取500μl上层液体放入1.5ml ep管中,加2倍体积无水乙醇,轻轻摇晃后, 4℃,10000rpm离心10min;
[0061]
(7)弃去上层液体,加1ml 70%无水乙醇,轻轻摇晃,4℃,10000rpm离心5min;
[0062]
(8)倒掉上层液体,除去管内剩余液体,超净台吹干至ep管内无水滴,干燥时间约25min;
[0063]
(9)样品加50μl 55℃去离子水,使dna完全溶解,进行样品质量检测,最后放入
‑ꢀ
20℃冰箱保存。
[0064]
2.3dna浓度测定及dna样品混池
[0065]
采用nanodrop分光光度计测定260头猪背最长肌样品dna浓度,计算od260/od280 比值判定dna提取质量。如果所有样品od260/od280比值应为1.8-2.0,则说明该dna的提取质量是合格的。
[0066]
2.4引物设计合成
[0067]
依据genbank数据库猪基因序列dgat1(chromosome 4, nc_010446.5(452890..463665)),对启动子区转录起始密码子前2000bp分三段分别设计三对引物对dgat1-1f和dgat1-1r、dgat1-2f和dgat1-2r、dgat1-3f和dgat1-3r。引物序列见表1。
[0068]
表1猪dgat1基因引物设计信息
[0069][0070]
2.5 pcr-rflp反应体系和程序
[0071]
本实验所使用的pcr反应体系如表2,表3:
[0072]
表2测序pcr反应体系(测序寻找snp的反应体系)
[0073][0074]
表3酶切分型反应体系
[0075][0076]
pcr反应程序:
[0077]
98℃,3min;
[0078]
98℃,10s、65℃,10s、72℃,10s(34个循环);
[0079]
72℃,3min;
[0080]
4℃保存;
[0081]
将扩增好的pcr产物按照表3体系进行酶切,反应体系为:37℃,1h。
[0082]
2.6琼脂糖凝胶电泳检测
[0083]
扩增产物及酶切产物用1.5%的琼脂糖凝胶进行电泳,电压120v左右,电泳30min左右之后,用凝胶成像系统进行观察。将扩增成功得到的pcr产物进行酶切。待酶切反应结束后,将酶切产物进行琼脂糖凝胶电泳。不同的基因型对应了不同数目的条带数,根据电泳结果中每个样品的条带数来确定样品的基因类型。
[0084]
2.7组织rna提取
[0085]
(1)用depc水清洗擦净匀浆机转子,最后再用trizol清洗;
[0086]
(2)取约100mg背最长肌组织放于2ml ep管内,往管中加入500μl的trizol,用匀浆机处理组织样,最后再加入500μl的trizol。室温下放置5min。
[0087]
(3)每个ep管中加入200μl氯仿,用振荡器震荡30s,使液体和组织完全混匀后,室温静置3min。4℃、12000rpm离心15min;
[0088]
(4)取上层液体加入到新取的1.5ml ep管中,向ep管中加入500μl异丙醇,完全混
匀后,室温静置10min,4℃、12000rpm离心10min;
[0089]
(6)倒掉上层液体,注意底部的沉淀,加入1ml的预冷75%乙醇,温和震荡,悬浮沉淀。4℃,12000rpm离心5min;
[0090]
(8)倒掉上层液体,保留底部rna,若底部仍有水分再用移液枪去除,置超净台中风干25min;
[0091]
(9)在ep管中加入30μl 55℃的depc水,静置10min,测定rna质量后放于-80℃保存或直接用于反转录。
[0092]
2.8反转录
[0093]
反应体系为10μl,具体成分见表4:
[0094]
表4反转录体系
[0095][0096]
将需要反转录的pcr管放入pcr仪内,反应程序为:首先37℃条件下作用15min,其次为85℃条件下作用5s,最后4℃条件下保存,反应结束后将得到的cdna放于-20℃冰箱中贮存。
[0097]
2.9定量引物设计
[0098]
dgat1基因定量引物序列见表5。
[0099]
表5猪dgat1基因定量引物设计信息
[0100][0101]
2.10荧光实时定量pcr(real time quantitative pcr)
[0102]
在荧光定量分析仪上完成该实验,其荧光定量pcr反应体系见表6,反应条件见表7,本实验中用rplp0基因作为内参基因,用2-δδct
法对有效性数据进行统计分析。
[0103]
表6荧光定量pcr反应体系
[0104][0105]
表7荧光定量反应条件
[0106][0107]
3.实验结果
[0108]
3.1 snp筛选
[0109]
随机选取12个dna样品作为模板,分别利用dgat1-1f和dgat1-1r、dgat1-2f和 dgat1-2r、dgat1-3f和dgat1-3r对dgat1基因启动子区域进行扩增,得到猪dgat1 基因转录起始密码子上游共约2000bp左右片段,然后将pcr产物进行测序(由生工生物工程(上海)股份有限公司服务)。测序结果表明仅在引物对dgat1-3f和dgat1-3r扩增的片段中发现了一处snp位点,位于dgat1基因转录起始密码子上游379bp处,分别为胞嘧啶c或胸腺嘧啶t,如图1所示,该snp命名为c.-379c>t。
[0110]
3.2 pcr-rflp基因分型
[0111]
针对上述snp位点,使用引物dgat1-3f和dgat1-3r进行pcr扩增,通过使用pvu
ꢀⅱ
限制性内切酶对pcr产物进行酶切来鉴定基因型。通过琼脂糖凝胶电泳,不同基因型的酶切产物会呈现不同的条带数:cc基因型为两条带(134bp、581bp),ct基因型为三条带(134bp、581bp、715bp),tt基因型为一条带(715bp)。经统计,在260头杜长大三元杂交群体中,cc基因型个体有118个,tt基因型个体有15个,ct杂合型有127个,部分 pcr产物酶切结果展示如图2。
[0112]
3.3突变位点与肌内脂肪含量的相关性
[0113]
对不同基因型个体数量进行统计并分析snp与肌内脂肪含量的相关性,结果表明,二者之间存在相关性。tt型个体肌内脂肪含量(3.198%
±
0.315)最高,ct型个体肌内脂肪含量(3.188%
±
0.108)其次,cc型个体的肌内脂肪含量(2.857%
±
0.112)最低,cc型和 ct型个体的肌内脂肪含量差异显著(p《0.05)。由于在该群体中,纯合突变个体数量极少,标准差大,导致突变型纯合子tt与野生型纯合子cc个体间的肌内脂肪含量未表现出显著差异,但其肌内脂肪含量仍然呈现升高趋势,如图3。
[0114]
3.4不同基因型个体中dgat1的表达
[0115]
选取cc型个体7个,tt型个体7个,用这两组样本cdna做模板进行荧光定量pcr 分析验证。结果表明,dgat1在两组间的表达量差异显著(p《0.05)。如图4。
[0116]
3.5转录因子结合位点预测
[0117]
根据jaspar database网站对dgat1启动子区c.-379c》t位点转录因子结合位点的预测,预测结果如表8。
[0118]
表8 dgat1启动子区c.-379c>t
[0119]
碱基类型拟结合转录因子cmyod1t——
[0120]
4.结果分析
[0121]
本发明所筛选的突变位点与猪肉肌内脂肪含量显著相关性,可以开发为snp分子标记并用于检测猪肌内脂肪含量。对于dgat1启动子区c.-379 c》t,基因型为tt或ct的猪肉
样品的肌内脂肪含量高于基因型为cc的猪肉样品的肌内脂肪含量。当dgat1基因启动子区的c.-379 c》t位点为c时,可能有转录因子myod1与之结合,从而调控dgat1基因的表达,进而影响肌内脂肪的沉积。
[0122]
本发明在启动子区域筛选了一个与肌内脂肪含量相关的snp位点,从而获得了与肌内脂肪含量相关的功能基因和分子遗传标记,通过优选该snp分子标记的优势等位基因及对该位点的快速检测,能够为猪肉中肌内脂肪含量调控相关的snp分子标记辅助育种提供参考依据,同时对猪肉品质改良具有重要意义。
[0123]
可以知道,上述实施例仅为了说明发明原理而采用的示例性实施方式,然而本发明不仅限于此,本领域技术人员在不脱离本发明实质情况下,可以做出各种改进和变更,这些改进和变更也属于本发明的保护范围。
[0124]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1