维生素B6杂质化合物的制备方法及应用与流程
维生素b6杂质化合物的制备方法及应用
技术领域
1.本发明涉及化学制药领域。更具体的说,本发明涉及维生素b6原料药及上市产品中杂质的制备、标化及结构鉴定,以及其作为杂质对照品的应用。
背景技术:
2.维生素b6,又名吡哆素。英文名:vitamin b6(缩写:vb6),中文化学名:6-甲基-5-羟基-3,4-吡啶二甲醇盐酸盐,化学结构式,如下式(i):维生素b6作为一种水溶性维生素,在酵母、肝脏、谷粒、肉、鱼、蛋、豆类及花生中含量较多。维生素b6为人体内辅酶的组成成分,参与多种代谢反应,尤其是和氨基酸代谢有密切关系。维生素b6注射液最早于1957年在日本上市,规格1ml:10mg和1ml:30mg。临床上的适应症包括,适用于维生素b6缺乏的预防和治疗;防治异烟肼中毒;用于妊娠、放射病及抗癌药所致的呕吐;脂溢性皮炎等。维生素b6注射液也用于全胃肠道外营养及因摄入不足所致营养不良、进行性体重下降时维生素b6的补充。另外,下列情况对维生素b6需要量增加:妊娠及哺乳期、甲状腺功能亢进、烧伤、长期慢性感染、发热、先天性代谢障碍病(胱硫醚尿症、高草酸盐症、高胱氨酸尿症、黄嘌呤酸尿症)、充血性心力衰竭、长期血液透析、吸收不良综合症伴肝胆系统疾病(如酒精中毒伴肝硬化)、肠道疾病(乳糜泻、热带口炎性肠炎、局限性肠炎、持续腹泻)、胃切除术后。新生儿遗传性维生素b6依赖综合征。
3.作为医药产品,目前维生素b6上市剂型有片剂及注射液。另外作为肠外营养产品、保健品、饲料中均添加了维生素b6。维生素b6对光、热、强碱均不稳定,因此,其产品中很容易产生降解杂质。但目前官方药典收载的维生素b6产品的质量标准中除原料药中规定了特定杂质ep杂质a及杂质b,其他制剂产品均未规定特定杂质。维生素b6注射液的用法包括皮下注射和静脉注射,如果杂质研究不透彻将严重影响产品临床用药安全性,而现有各官方药典均未对特定杂质进行严格限制。《new dimer of pyridoxol (vitamin b6)》 journal of organic chemistry (1969), 34(6), 1993-6、《analysis of photo
‑ꢀ
and heat-reaction products of vitamin b6》 bitamin (1999), 73(10), 599-606、jp11209221a、jp11080122a对杂质的降解途径进行了报道,但无详细的杂质制备方法,无法提供维生素b6质量控制及质量研究必须用到的杂质对照品制备方法。
技术实现要素:
4.针对上述存在的问题,本发明提供了一种分离制备这类杂质对照品的方法,且该方法是一种通用性的方法,同样适用于其他大极性、酸性条件带电荷、常规反相色谱、正相
色谱或定向合成很难获得的物质的分离制备方法,同时对制备的杂质对照品进行标化和结构确证,为维生素b6原料药及制剂产品质量研究提供杂质对照品,提高药品的质量和安全性。
5.本发明提供了如下特性的化合物的分离制备方法,这种化合物往往具有如下特征:(1)大极性,即logd分配系数
(ph1.5-ph7.4)
≤0.0;(2)具有弱碱性或强碱的解离常数;(3)酸性条件下稳定,中性或碱性条件下不稳定;(4)酸性条件一般以带电荷形式存在;(5)酸性条件常规反相色谱条件无合适保留或不保留,峰形较差,很难进行准确定量;正相色谱因这类物质极性太大不适用;(6)以维生素b6为例,其原料药以盐酸盐的形式作为药用原料药使用,其原料药制备过程、贮藏过程产生的杂质或副产物一般具有与维生素b6相似或相近的结构特征,从而具有相似的物理化学特性参数。
6.(7)开发了专属性更强、灵敏度更高的维生素b6产品有关物质的检测方法,并实现所有杂质在同一色谱条件下灵敏、准确检出。
7.本发明以如下在维生素b6注射液生产、贮藏和使用过程最易产生的降解杂质为例来详述这类物质的制备方法,这几个降解杂质(式(ii)、式(iii)、式(iv)、式(v))的化学结构如下:
具体地,本发明通过以下技术方案加以实现:1.维生素b6杂质化合物的制备方法,包括以下步骤:1)制备维生素b6杂质化合物的富集母液;2)使用hplc法检测维生素b6杂质化合物的生成情况;
3)采用以硅胶表面键合极性基团的十八烷基硅烷键合硅胶为填料的制备色谱柱对步骤1)得到的富集母液进行分离,同时使用液相色谱-质谱联用仪进行定性和纯度分析;4)将步骤3)中得到的高纯度的目标馏分进行合并收集;5)将步骤4)中收集的馏分进行减压处理,得到维生素b6杂质化合物的含盐产物;6)采用中压制备液相色谱对含盐产物进行除盐,合并所有收集的目标馏分;7)将步骤6)中得到的目标馏分进行减压浓缩,得到维生素b6杂质化合物;其中所述维生素b6杂质化合物选自以下化合物:。
8.2. 维生素b6杂质化合物的制备方法,包括以下步骤:1)制备维生素b6杂质化合物的富集母液;2)使用hplc法检测维生素b6杂质化合物的生成情况;3)采用以硅胶表面键合极性基团的十八烷基硅烷键合硅胶为填料的制备色谱柱对步骤1)得到的富集母液进行分离,同时使用液相色谱-质谱联用仪进行定性和纯度分析;4)将步骤3)中得到的高纯度的目标馏分进行合并收集;5)将步骤4)中收集的馏分进行减压蒸馏,得到维生素b6杂质化合物;其中所述维生素b6杂质化合物为:
9.3. 根据项1或2所述的方法,其中,所述步骤1)中所述制备维生素b6杂质化合物的富集母液是在加剧高温、光照或氧化条件下进行的。
10.4.根据项3所述的方法,其中,所述高温为75℃至100℃。
11.5. 根据项4所述的方法,其中,所述高温为80℃。
12.6. 根据项1或2所述的方法,其中,所述步骤2)中hplc法检测的检测条件如下:用十八烷基硅烷键合硅胶为填充剂的gl sciences inertsil ods-3,250mm
×
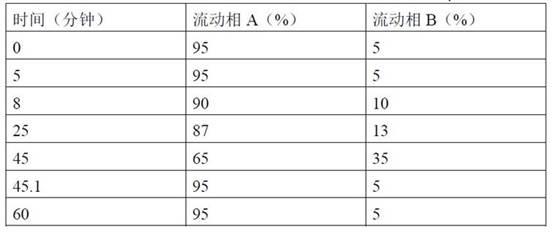
4.6mm,5μm;以用磷酸调节ph值至2.8的0.04%戊烷磺酸钠溶液为流动相a,以甲醇为流动相b,进行梯度洗脱;流速为每分钟1.0ml;检测波长为210nm;柱温20℃;进样体积10 μl
。
13.7. 根据项1或2所述的方法,其中,所述步骤3)中的色谱柱为waters xbridge prep shield rp18,5μm,30
×
150mm或快速分离柱。
14.8. 根据项7所述的方法,其中,所述快速分离柱为40g快速分离柱或80g快速分离柱。
15.9. 根据项1或2所述的方法,其中,所述步骤3)中的液相色谱-质谱联用仪进行纯度分析的步骤为:取从制备色谱柱收集的目标馏分适量,加水稀释后作为供试品溶液,取供试品溶液10μl,注入液相色谱仪,以十八烷基硅烷键合硅胶为填充剂;以用甲酸调节ph值至3.0的0.01mol/l甲酸铵溶液为流动相a,以甲醇为流动相b,进行梯度洗脱;流速为1.0ml/min;柱温30℃;电喷雾正离子模式(esi+),。
16.10. 根据项1或2所述的方法,其中,所述步骤4)中的高纯度的目标馏分是指纯度不低于95%的目标馏分。
17.11. 根据项1所述的方法,其中,所述步骤5)中的减压处理为减压浓缩或减压蒸馏。
18.12. 根据项1所述的方法,其中,所述步骤6)中的中压制备液相色谱为以20~35μm的十八烷基硅烷键合硅胶为填料的快速分离柱或waters xbridge prep shield rp18,5μm,30
×
150mm,以水和甲醇或乙腈为流动相,流速设定为20ml/min-25ml/min。
19.13. 根据项12所述的方法,其中,所述流动相为水和甲醇,流速设定为20ml/min。
20.14. 根据项6所述的方法,其中,所述步骤3)中的色谱柱采用的流动相水相为缓冲盐或离子对试剂的水溶液。
21.15. 根据项14所述的方法,其中,所述缓冲盐包括甲酸或甲酸盐、三氟乙酸、乙酸或乙酸盐、磷酸或磷酸盐、柠檬酸或柠檬酸盐,所述的盐包括钾盐、钠盐、铵盐。
22.16. 根据项14所述的方法,其中,所述离子对试剂为烷基磺酸盐。
23.17. 根据项16所述的方法,其中,所述烷基磺酸盐为庚烷磺酸盐、戊烷磺酸盐或辛
烷磺酸盐。
24.18. 根据项14所述的方法,其中,所述步骤3)中的色谱柱采用的流速为10~30ml/min,优选15~25ml/min,更优选15ml/min-20ml/min。
25.19. 根据项18所述的方法,其中,所述步骤3)中的色谱柱采用的流动相水相为甲酸铵溶液。
26.20. 根据项17所述的方法,其中,所述步骤3)中的色谱柱采用的流动相水相为戊烷磺酸钠溶液。
27.21. 根据项19所述的方法,其中,所述甲酸铵的浓度为1mm~500mm,优选10mm~50mm,更优选10mm。
28.22. 根据项6所述的方法,其中,所述步骤3)中的色谱柱为waters xbridge prep shield rp18,5μm,30
×
150mm,流动相为10mm甲酸铵溶液,其中所述维生素b6杂质化合物为:。
29.23. 根据项6所述的方法,其中,所述步骤3)中的色谱柱为快速分离柱,流动相a相为0.04%戊烷磺酸钠溶液,b相为甲醇,进行梯度洗脱,检测波长为210nm和290nm,流速为20ml/min,其中所述维生素b6杂质化合物为:。
30.24. 式ii的化合物在维生素b6杂质检查时作为杂质对照品的用途,式(ii)。
31.25. 式iii的化合物在维生素b6杂质检查时作为杂质对照品的用途,式(iii)。
32.26.式iv的化合物在维生素b6杂质检查时作为杂质对照品的用途,式(iv)。
33.27.式v的化合物在维生素b6杂质检查时作为杂质对照品的用途,式(v)。
34.28. 根据项24-27中任一项所述的用途,其中,所述维生素b6有关物质检测时的hplc条件为:用十八烷基硅烷键合硅胶为填充剂的色谱柱;以用磷酸调节ph值至2.8的0.04%戊烷磺酸钠溶液为流动相a,以甲醇为流动相b,进行梯度洗脱;流速为每分钟1.0ml;检测波长为210nm;柱温20℃;进样体积10 μl。
35.29. 根据项28所述的用途,其中所述色谱柱为gl sciences inertsil ods-3,250mm
×
4.6mm,5μm。
36.30. 维生素b6相关物质的检测方法,其中,所述检测方法采用高效液相色谱对维生素b6及其制剂中杂质进行检测,其高效液相色谱条件包括:用十八烷基硅烷键合硅胶为填充剂的色谱柱;以用磷酸调节ph值至2.8的0.04%戊烷磺酸钠溶液为流动相a,以甲醇为流动相b,进行梯度洗脱;流速为每分钟1.0ml;检测波长为210nm;柱温20℃;进样体积10 μl
。
37.31. 根据项30所述的方法,其中所述色谱柱为gl sciences inertsil ods-3,250mm
×
4.6mm,5μm。
38.与现有技术相比,本发明具有以下有益的技术效果:表1中涉及的杂质,为维生素b6注射液在贮存过程中易产生的杂质,现各官方药典均未按特定杂质对其进行严格限制,且当前市场也无该杂质的销售。为确保药品使用过程中的安全性,详细透彻的杂质研究是非常必要的。查阅相关文献信息,仅有杂质降解途径报导,并无详细制备方法。针对表1中杂质,本发明提供一种维生素b6降解杂质对照品的制备、分离、纯化方法,该方法可低成本、快速、大量制备高纯度b6降解杂质对照品,解决了目前维生素b6原料及其制剂质量控制和杂质研究中存在的杂质对照品缺乏问题。为进一步提高维生素b6及其制剂产品质量安全性和保障消费者身体健康等提供了有利的技术支持,具有重要的现实意义。
附图说明
39.图1为式(ii)化合物富集母液hplc图。
40.图2为式(iii)化合物富集母液hplc图。
41.图3为式(iv)化合物富集母液hplc图。
42.图4为式(v)化合物富集母液hplc图。
43.图5为式(ii)化合物制备分离典型谱图。
44.图6为式(iii)化合物制备分离典型谱图。
45.图7为式(iv)和式(v)化合物制备分离典型谱图。
46.图8为式(ii)化合物质谱图(正负离子模式),其中图8a为正离子模式,图8b为负离子模式。
47.图9为式(ii)化合物核磁共振1hnmr谱图。
48.图10为式(ii)化合物核磁共振13cnmr谱图。
49.图11为式(iii)化合物质谱图(正负离子模式),其中图11a为正离子模式,图11b为负离子模式。
50.图12为式(iii)化合物核磁共振1hnmr谱图。
51.图13为式(iii)化合物核磁共振13cnmr谱图。
52.图14为式(iii)化合物核磁共振二维核磁hmbc谱。
53.图15为式(iv)化合物质谱图(正负离子模式),其中图15a为正离子模式,图15b为
负离子模式。
54.图16为式(iv)化合物核磁共振1hnmr谱图。
55.图17为式(iv)化合物核磁共振13cnmr谱图。
56.图18为式(iv)化合物核磁共振二维核磁hmbc谱。
57.图19为式(iv)化合物核磁共振二维核磁hsqc谱。
58.图20为式(v)化合物质谱图(正负离子模式),其中图20a为正离子模式,图20b为负离子模式。
59.图21为式(v)化合物核磁共振1hnmr谱图。
60.图22为式(v)化合物核磁共振13cnmr谱图。
61.图23为式(v)化合物核磁共振二维核磁hmbc谱。
62.图24为式(v)化合物核磁共振二维核磁hsqc谱。
63.图25为自制维生素b6注射液40℃/rh75%三个月有关物质图谱。
64.图26为维生素b6注射液参比制剂40℃/rh75%三个月有关物质图谱。
65.图27为自制维生素b6注射液裸放光照5天有关物质图谱。
66.图28为采用本发明分析方法检测有关物质的系统适用性图谱。
67.图29为采用本发明分析方法检测有关物质的参比制剂有关物质图谱。
68.图30为采用中国药典分析方法检测有关物质的系统适用性图谱。
69.图31为采用中国药典分析方法检测有关物质的参比制剂有关物质图谱。
具体实施方式
70.为使本发明的目的、技术方案和优点更加清楚,下面将结合本发明中的附图,对本发明中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
71.本发明所使用的维生素b6原料药、自制维生素b6注射液、维生素b6参比制剂均为中国大冢制药赠送。本发明所使用的其他原料、试剂、溶剂没有特别的限制,可采用商购的常规原料、试剂、溶剂。色谱柱或填料购自博纳艾杰尔、waters、agilent公司或其代理商。
72.杂质制备中用到的分离设备:高压制备型高效液相色谱(hplc):waters自动纯化系统,包括2489uv/visible检测器、2545二元高压梯度泵、2767自动样品收集器及masslyn4.0工作站。或与之功能相当的仪器设备。
73.中压制备型液相色谱:博纳艾杰尔生产的cheetah自动纯化系统(mp200),由紫外检测器、二元中压泵、手动进样系统及收集台组成。或与之功能相当的仪器设备。
74.采集数据所用的仪器及方法:质谱采集采用agilent infinity series 1290-6120quadrupole lc-ms,esi源,正/负离子模式;详细配置为:g4225a 1260在线脱气机、g1312b 1260 二元梯度泵、g1367e1260高压自动进样器、g1330b 1290柱温箱及g1316c 1290检测器,数据采集工作站为:采集核磁共振氢谱(hnmr)数据,所使用的仪器型号为:brukeravance600,共振频
率:600mhz,使用溶剂:式(ii)~式(iv)化合物为d2o;式(v)化合物为氘代二甲基亚砜。
75.核磁共振委托天津瀚盟测试科技(天津)有限公司完成。
76.式(ii)~式(v)是维生素b6原料药或制剂产品经高温、光照或氧化条件缓慢产生的,因此,为了得到高含量的含有式(ii)~式(v)的样品,根据式(ii)~式(v)的降解途径不同,通过加剧高温、光照或氧化条件,获得的式(ii)~式(v)含量较高样品,并进一步通过分离纯化获得式(ii)~式(v)对照品。
77.实施例1 式(ii)化合物的制备和鉴定一、富集母液的制备制备含有上述式(ii)化合物的富集母液:取维生素b6原料药约2g,加30%h2o2约10ml,80℃水浴加热8h,取出,置60℃烘箱过夜,自“加30%h2o2约10ml”起,重复3个循环,得到式(ii)化合物的富集母液,呈黄色澄明液体,于2~8℃密封保存。
78.可替代地,水浴温度可以在适当的范围内变化,如75℃-100℃,h2o2的浓度也可以在适当的范围内变化,如8%-30%h2o2。
79.二、式(ii)富集母液的hplc分析方法取式(ii)化合物的富集母液,将其用水稀释至适宜浓度后,使用hplc法检测式(ii)化合物的生成情况并用面积归一化法估算其含量,hplc谱图见图1。式(ii)化合物采用面积归一化法测得的含量约为28%~34%。液相色谱相对(vb6)保留时间为0.39。
80.色谱条件:用十八烷基硅烷键合硅胶为填充剂(gl sciences inertsil ods-3,250mm
×
4.6mm,5μm);以0.04%戊烷磺酸钠溶液(用磷酸调节ph值至2.8)为流动相a,以甲醇为流动相b,按表2进行梯度洗脱;流速为每分钟1.0ml;检测波长为210nm;柱温20℃;进样体积10 μl。
81.。
82.在该色谱条件下,vb6的保留时间约为22分钟。该色谱条件为基于离子对的反相hplc分析方法,这对杂质的制备分离来讲是非常具有挑战性的。
83.三、式(ii)化合物的分离纯化1)富集母液初分、确认及后处理由图1可知,其富集母液中主成分维生素b6基本全部破坏掉,富集母液中式(ii)的归一化含量较高,约为34%,保留时间约为8.7分钟。根据母液粗品的分析色谱条件及式(ii)在该条件下的保留时间,拟采用waters高压制备液相进行分离制备。
84.色谱柱采用硅胶表面键合极性基团的十八烷基硅烷键合硅胶为填料的制备色谱柱,如waters xbridge prep shield rp18,规格:5μm,30
×
150mm,该色谱柱对大极性物质有较好的保留和良好的峰形。
85.制备分离的色谱条件:为了获得良好的色谱峰形,流动相水相优选缓冲盐体系,本次实验选择10mm甲酸铵溶液作为流动相。流速为15ml/min。检测波长为210nm、220nm同时检测。式(ii)化合物母液不经浓缩处理,直接进样分离,进样体积为4ml,采用纯水相等度洗脱16分钟。设置启动收集的阈值,自动收集,仪器自动将式(ii)母液中所有含量大于收集阈值的成分收集在不同试管中。式(ii)化合物在制备条件下的出峰时间约为10min。典型的分离图谱图5所示。将式(ii)化合物目标馏分,即接收时间约在9.2min~10.2min试管内样品,采用液相色谱-质谱联用仪进行纯度及定性分析,要求目标馏分主峰在正离子模式下m/z 约为 158,主峰纯度不低于95%,根据检测结果,可适当调整收集阈值,使目标馏分符合要求。
86.液相色谱-质谱的分析条件如下:取收集的目标馏分适量(约3-5滴),如分离谱图中目标峰为平头峰,加水适当稀释,作为供试品溶液。照高效液相色谱-质谱法(中国药典2015年版第四部通则0512和通则0431)试验,以十八烷基硅烷键合硅胶为填充剂;以0.01mol/l甲酸铵溶液(用甲酸调节ph值至3.0)为流动相a,以甲醇为流动相b,按表3进行梯度洗脱;流速为每分钟1.0ml;柱温30℃;采用质谱检测器,电喷雾正离子模式(esi+),取供试品溶液10μl,注入质谱检测器,记录质谱图,主峰质荷比(m /z)应约为158.0。
87.。
88.将式(ii)所有富集母液于waters高压制备液相,进行自动排样分离,自动进样体积为2ml,自动收集试管数量为480根(15mm*150mm)。
89.将所有式(ii)纯度大于95%的目标馏分样品进行合并,于35~40℃,减压(油泵:-0.095~0.10mpa)浓缩至10~20ml,得式(ii)含盐产物。
90.2)式(ii)含盐产物除盐式(ii)富集母液初分时,流动相中使用到了甲酸铵,因此式(ii)含盐产物中,含大量有甲酸铵。采用中压制备液相,进行除盐。色谱条件为:以水和甲醇或乙腈为流动相,以十八烷基硅烷键合硅胶为填料(20~35μm)的40g快速分离柱为色谱柱,检测波长为210nm和254nm,流速设定为20ml/min。先用高比例水相等度洗脱3~5分钟,比如98%水相。由于式(ii)的极性较大,优先选择有机相为甲醇。然后在5~10min内将有机相(甲醇)比例升至40%,收集目标峰,取式(ii)含盐产物直接进样,上样体积为2-3ml。每次进样收集结束后,快速回到初始有机相比例进行色谱柱平衡,平衡7~10分钟,将全部式(ii)含盐产物溶液按此法进行除盐。合并所有收集的目标馏分,35~40℃,减压(油泵:-0.095~0.10mpa)进行浓缩,得淡黄色油状物,为式(ii)化合物。
91.可替代地,也可以选择十八烷基硅烷键合硅胶为填料(20~35μm)的80g快速分离柱为色谱柱,流速可以在适当的范围内变化,如20ml/min~25ml/min,上样体积可以在适当的范围内变化,如2-3ml~4-6ml。
92.此外,为了获得更高的纯化效果,还可以采用高压制备液相色谱,如waters xbridge prep shield rp18,5μm,30
×
150mm。
93.四、式(ii)化合物的标化式(ii)的纯度采用液相色谱法进行双人、不同仪器、各自平行配制6份样品进行纯度标化,取12份样品的均值作为最终的纯度。
94.在式(ii)化合物富集母液的分析方法色谱条件下,式(ii)化合物保留时间约为8.2分钟,因此,除将梯度洗脱程序在25分钟后重新回到初始有机相比例的平衡过程,平衡时间为10分钟,其他同富集母液分析方法。经标化后,式(ii)对照品的液相色谱纯度为96.23%(210nm)。
95.五、式(ii)化合物的结构鉴定结构鉴定:除进行色谱保留时间的确认,还进行了质谱、核磁共振氢谱、碳谱。
96.式(ii)谱图显示分子离子峰 m/z = 157.9 [m+h]
+
/155.9 [m-h]-,所对应的分子量与提供的分子式理论分子量157.12(c6h7no4)相符,谱图见附图8。式(ii)化合物核核磁共振氢谱、碳谱见附图9-10。
[0097][0097]
实施例2 式(iii)化合物的制备和鉴定一、富集母液的制备取维生素b6原料药1g,加水约500ml溶解,用1mol/l氢氧化钠调节ph至5.0-6.0,充氮30~60min,密封,光照20天~30天,得到式(iii)化合物的富集母液,呈黄色澄明液体,室温保存。为了富集到足够的粗品,平行制备10份母液。
[0098]
二、式(iii)富集母液的hplc分析方法采用hplc方法,将式(iii)化合物的富集母液直接进样分析,检测式(iii)的生成情况并用面积归一化法估算其含量,hplc谱图见图2。式(iii)化合物随光照时间延长,生成量也逐渐增多,光照20~30天,生成量由hplc面积归一化法测得为23%~36%。液相色谱相对(vb6)保留时间为0.87。具体实验条件及方法同实施例1中式(ii)化合物母液的hplc分析方法。
[0099]
三、式(iii)化合物的分离纯化
1)富集母液初分、确认及后处理将式(iii)富集母液进行适当浓缩后,采用博纳艾杰尔生产的cheetah自动纯化系统(mp200),对式(iii)富集母液进行初步分离。以十八烷基硅烷键合硅胶为填料(20~35μm)的40g或80g快速分离柱为固定相,可通过微调梯度洗脱程序。本次实验选择10mm甲酸铵溶液作为流动相(甲酸或氨水调ph为4.8)。甲醇作为有机相。流速为20ml/min~25ml/min,检测波长为210nm、260nm,先用88%水相等度洗脱17分钟,收集目标峰(14分钟~18分钟)后将有机相比例由12%增加至70%并维持3分钟后将有机相比例降至12%平衡7~10分钟,完成一个分离程序。典型的分离图谱如图6所示。
[0100]
可替代地,也可以选择十八烷基硅烷键合硅胶为填料(20~35μm)的80g快速分离柱为色谱柱,流速可以在适当的范围内变化,如20ml/min~25ml/min。
[0101]
目标馏分的纯度及质谱确认:取收集液适量(约3-5滴),如分离谱图中目标峰为平头峰,加水适当稀释,摇匀,作为供试品溶液。按照式(ii)质谱确认的条件进行分析,主峰质荷比(m /z)应约为170.1,主峰纯度不低于95%。剩余富集母液按照上述分离程序重复进样即可。
[0102]
将纯度大于95%的目标馏分加稀氨水或稀甲酸调节ph至5.5~6.0,减压蒸馏浓缩(40℃,-0.08mpa),去除溶剂,得到淡黄色固体,为式(iii)化合物含盐产物。
[0103]
2)式(iii)化合物含盐产物除盐式(iii)化合物含盐产物含有甲酸铵,采用博纳艾杰尔生产的cheetah自动纯化系统(mp200)进行除盐。色谱条件为:以水和甲醇或乙腈为流动相,以十八烷基硅烷键合硅胶为填料(20~35μm)的40g快速分离柱为色谱柱,检测波长为210nm和260nm,流速设定为20ml/min。将上述固体加水溶解成浓度约为30mg/ml的溶液,起始有机相比例为10%,15分钟线性升到90%,收集目标馏分,进样体积为2ml。目标馏分峰收集完毕调整有机相比例为10%,平衡7~10分钟,完成一个除盐程序。将剩余样品,按照该程序全部进行除盐。合并所有目标馏分,加盐酸调ph至5.5~6.0,减压浓缩(40℃,-0.08mpa)除去全部溶剂,或减压浓缩除去大部分有机溶剂后冻干得到类白色固体。
[0104]
可替代地,也可以选择十八烷基硅烷键合硅胶为填料(20~35μm)的80g快速分离柱为色谱柱,流速可以在适当的范围内变化,如20ml/min~25ml/min,上样体积可以在适当的范围内变化,如2~5ml。
[0105]
此外,为了获得更高的纯化效果,还可以采用高压制备液相色谱,如waters xbridge prep shield rp18,5μm,30
×
150mm。
[0106]
四、式(iii)化合物的标化采用液相色谱法进行双人、不同仪器、各自平行配制6份样品进行纯度标化,取12份样品的均值作为最终的纯度。
[0107]
在式(iii)化合物富集母液的分析方法色谱条件下,式(iii)化合物保留时间约为16.8分钟,因此,除将梯度洗脱程序在25分钟后重新回到初始有机相比例的平衡过程,平衡时间为10分钟,其他同富集母液分析方法。经标化后,式(iii)对照品的液相色谱纯度为99.63%(210nm)。
[0108]
五、式(iii)化合物的结构鉴定结构鉴定:除进行色谱保留时间的确认,还进行了质谱、核磁共振氢谱、碳谱、二维
核磁谱。
[0109]
式(iii)谱图显示分子离子峰 m/z = 169.9 [m+h]+/168.0 [m-h]-,所对应的分子量与提供的分子式理论分子量169.18(c8h11no3)相符,谱图见附图11。式(iii)核磁共振氢、碳谱、二维核磁hmbc谱见附图12~14。其谱图解析如下:核磁共振氢谱、碳谱数据及归属如下表:核磁共振氢谱、碳谱数据及归属如下表:二维核磁hmbc谱,显示碳氢远程相关的测试数据如下:
实施例3 式(iv)化合物的制备和鉴定一、富集母液的制备取维生素b6原料药2g,加水约40ml溶解,用1mol/l氢氧化钠调节ph至3.0-5.0。将溶液置西林瓶中,轧盖密封,121℃灭菌1~2h,得到式(iv)化合物的富集母液,呈淡黄色澄明液体,室温保存。
[0110]
二、式(iv)化合物母液的hplc分析方法取式(iv)化合物的富集母液,将其用水稀释至适宜浓度后,使用hplc方法检测式(iv)的生成情况并用面积归一化法估算其含量,hplc谱图见图3。式(iv)化合物在灭菌2小时的溶液中含量约为6%~7%,液相色谱相对(vb6)保留时间为1.39。实验条件及方法同实施例1中式(ii)母液的hplc分析方法。
[0111]
三、式(iv)化合物的分离纯化1)富集母液初分、确认及后处理采用博纳艾杰尔生产的cheetah自动纯化系统(mp200),对式(iv)富集母液进行初步分离。以十八烷基硅烷键合硅胶为填料(20~35μm)的40g快速分离柱为固定相,流动相a相为0.04%戊烷磺酸钠溶液(ph2.8),b相为甲醇,按下表进行梯度洗脱,检测波长为210nm和
290nm,流速为20ml/min。
[0112]
分离梯度洗脱程序如下:。
[0113]
可替代地,也可以选择十八烷基硅烷键合硅胶为填料(20~35μm)的80g快速分离柱为色谱柱,流速可以在适当的范围内变化,如15ml/min-20ml/min,戊烷磺酸钠溶液的ph可以在适当的范围内变化,如ph2.5-4.0。
[0114]
取式(iv)化合物的富集母液1ml-3ml,上样,收集30min~36min的馏分,进液相色谱-质谱联用仪进行定性确认。液质联用仪的分析方法同式(ii)项下的色谱条件。根据液质联用仪分析结果,式(iv)馏分主峰质荷比(m /z)为320.9 [m+h]
+
/ 318.9 [m-h],主峰纯度不低于90%。典型的分离图谱图7所示。
[0115]
重复上述分离程序,收集并合并式(iv)的馏分,用稀氨水调节ph值约3.5-4.5,室温减压(-0.08mpa)蒸馏,除去全部溶剂,得到淡黄色固体。
[0116]
根据质谱信息推测的式(iv)的化学结构,其很容易与戊烷磺酸钠成盐,因此,不进行除盐处理。
[0117]
式(iv)化合物的纯度确认采用与富集液分析相同的方法确认。式(iv)的纯度为95.12%。
[0118]
四、式(iv)化合物的结构鉴定结构鉴定:除进行色谱保留时间的确认,还进行了质谱、核磁共振氢谱、碳谱、二维核磁hsqc谱、hmbc谱。
[0119]
式(iv)谱图显示分子离子峰 m/z = 320.9 [m+h]
+
/ 318.9 [m-h]-,所对应的分子量与提供的化合物碱基的理论分子量320.34(c
16h20
n2o5)相符,图谱见附图15。式(iv)化合物核磁共振氢、碳谱、二维核磁hsqc谱、hmbc谱见附图16~19。
[0120]
核磁共振氢谱、碳谱数据及归属如下表:
二维核磁hsqc谱、hmbc谱,显示的碳氢相关关系如下表:
实施例4 式(v)化合物的制备和鉴定一、富集母液的制备取维生素b6原料药2g,加水约40ml溶解,用1mol/l氢氧化钠调节ph至3.0-5.0。将溶液置西林瓶中,密封,121℃灭菌6h,得到式(v)化合物的富集母液,呈淡黄色澄明液体,室温保存。
[0121]
二、式(v)母液的hplc分析方法取式(v)化合物的富集母液,将其用水稀释至适宜浓度后,使用hplc方法检测式(v)的生成情况并用面积归一化法估算其含量,hplc谱图见图4。式(v)化合物在灭菌6小时的溶液中hplc归一化含量约为14%,液相色谱相对(vb6)保留时间为2.11。实验条件及方法同实施例1中式(ii)母液的hplc分析方法。
[0122]
三、式(v)化合物的分离纯化
xbridge prep shield rp18,5μm,30
×
150mm。
[0131]
四、式(v)化合物的标化采用液相色谱法进行双人、不同仪器、各自平行配制6份样品进行纯度标化,取12份样品的均值作为最终的纯度。色谱条件与富集液分析相同的方法确认。经标化后,式(v)对照品纯度约为95.78%。
[0132]
五、式(v)化合物的结构鉴定结构鉴定:除进行色谱保留时间的确认,还进行了质谱、核磁共振氢谱、碳谱、二维核磁hsqc谱、hmbc谱。
[0133]
式(v)谱图显示分子离子峰m/z = 320.9 [m+h]
+
/ 318.9 [m-h]-,所对应的分子量与提供的分子式理论分子量320.34(c
16h20
n2o5)相符,谱图见附图20。式(v)核磁共振氢、碳谱、二维核磁hsqc谱、hmbc谱见附图21~24。
[0134][0134]
二维核磁hsqc谱、hmbc谱,显示的碳氢相关关系如下表:实施例5 式(ii)~式(v)化合物作为杂质对照品的应用照高效液相色谱法(中国药典2020年版四部通则0512)试验。
[0135]
供试品溶液:取维生素b6注射液0月样品、稳定性研究加速(加速试验条件:40℃/rh75%)3月样品、稳定性研究参比制剂加速(加速试验条件:40℃/rh75%)3月样品、影响因素研究光照(试验条件:光照强度5000lx)样品各适量,加水稀释制成每1ml中约含2mg的溶液,作为各供试品溶液。精密量取各供试品溶液适量,用水定量稀释制成每1ml中约含2μg的溶液,作为各对照溶液。
[0136]
系统适用性溶液:取外购的已知杂质zz-01、zz-02、zz-12、吡哆醛、rrt0.39(式ii)、rrt0.87(式iii)及rrt2.11(式v)对照品各适量,分别加水(zz-01如有需加适量dmso使溶解,zz-02及rrt2.11加适量甲醇助溶)溶解并稀释制成每1ml中约含1mg的溶液,作为各成
分对照品贮备液。取维生素b6对照品及各成分对照品贮备液适量,加水溶解并稀释制成每1ml中约含维生素b
6 2mg、各杂质均约2μg的混合溶液。
[0137]
色谱条件同杂质富集液分析方法。
[0138]
分析仪器waters高效液相色谱仪或agilent高效液相色谱仪,配紫外或dad检测器、柱温箱、自动进样器、高压二元泵或低压四元泵系统。
[0139]
取系统适用性溶液10μl,注入液相色谱仪,记录谱图。出峰依次顺序为:rrt0.39、吡哆醛、rrt0.87、zz-12、维生素b6、zz-01、zz-02及rrt2.11,吡哆醛峰与rrt0.87峰之间的分离度不低于1.0,其余各成分峰间的分离度应不低于1.5,理论塔板数按维生素b6峰计算应不低于5000。
[0140]
精密量取各对照溶液、供试品溶液各10μl,注入液相色谱仪,记录色谱图,按照主成分自身对照法计算各杂质含量,结果见下表。自制及参比制剂加速3月及自制光照裸放5天hplc谱图见附图25~27。
[0141]
通过上述实验结果可知,加速试验条件下维生素b6注射液主要降解杂质为rrt1.39(式iv)、rrt2.11(式v),光照条件下主要降解杂质为rrt0.39(式ii)、rrt0.87(式
iii),而维生素b6注射液在生产及贮藏过程中,极易受到温度及光照影响,从而产生上述杂质,为有效控制产品质量,确保用药安全性,主要降解杂质rrt0.39(式ii)、rrt0.87(式iii)、rrt1.39(式iv)、rrt2.11(式v)的研究是非常必要的。
[0142]
实施例6:维生素b6注射液有关物质检测方法对比维生素b6注射液在中国药典2020年版二部、欧洲药典ep10.0中均有收载,其中也规定了维生素b6注射液有关物质的检测方法,但ep10.0收载的维生素b6注射液有关物质检测方法采用以十八烷基硅烷键合硅胶为填充剂(250mm
×
4.6mm,5μm)为固定相,以100% ph3.0的磷酸二氢钾溶液(取磷酸二氢钾2.72g,加水900ml溶解,用磷酸调节ph至3.0,加水稀释至1000ml)为流动相进行等度洗脱,检测波长为210nm;中国药典2020年版二部维生素b6注射液有关物质检测方法采用以十八烷基硅烷键合硅胶为填充剂(250mm
×
4.6mm,5μm)为固定相,以0.04%戊烷磺酸钠溶液(用冰醋酸调节ph值至3.0)为流动相a,甲醇为b相,以a:b,85:15(v:v)进行等度洗脱。检测波长为291nm;由于ep10.0的分析方法为纯水相,没有加任何有机相,很多降解杂质在该方法下无法获得有效分离与洗脱,因此重点就中国药典方法进行了检测结果对比。
[0143]
取工艺验证三批维生素b6注射液及参比制剂(批号:6022372,购于费森尤斯卡比),分别采用自建分析方法(色谱条件同杂质富集液分析方法)及中国药典方法对维生素b6注射液进行有关物质检测,系统适用性溶液、供试品溶液及对照溶液的配制方法同实施例5,结果见下表:
根据上述结果,本发明开发的分析方法在杂质检出个数、杂质检出量上都显著优于中国药典2020版二部维生素b6注射液有关物质检测方法。
[0144]
方法对比中参比制剂有关物质监测的典型谱图见附图28-31。
[0145]
应当说明的是,本发明技术方案中所涉及的数值或数值端点,其含义或意义的保护范围并不局限于数字本身,本领域技术人员能够理解,它们包含了那些已被本领域广为接受的可允许误差范围,例如实验误差、测量误差、统计误差和随机误差等等,而这些误差范围均包含在本发明的范围之内。
[0146]
以上举例以及描述是为了方便该技术领域的其他技术人员能对该发明进行理解以及使用,同时对该领域比较熟悉的技术人员以及研究学者可以根据自己的理解对这些实施案例作出修改以便提高效果降低成本。因此本发明包括但不限于以上实施案例,该技术领域内其他技术人员根据本发明的提供内容,在不脱离本发明的范畴内所进行的修改和改进都在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1