一种C-型人神经红蛋白及其制备方法
一种c-型人神经红蛋白及其制备方法
技术领域
1.本发明涉及生物技术领域,尤其涉及一种c-型人神经红蛋白及其生物制备方法。
背景技术:
2.神经红蛋白(ngb)是2000首次由德国科学家发现的一种血红素(heme)蛋白。ngb在低铁和高铁状态下其血红素辅基血红素都具有六配位结构,并含有一对二硫键和一个单独的120位半胱氨酸(cys120)。至今已得知的ngb生理功能有:
①
氧载体功能,ngb较高的氧亲和力,能可逆的结合氧;
②
在缺氧、缺血以及氧化损伤情况下,神经红蛋白会大量表达,保护神经元不受损害;
③
可以保护神经细胞对抗氧化应激;
④
可以清除神经细胞中的活性氧物种;
⑤
可以作为o2传感器,活化其他蛋白,具有调节功能。但是对ngb的具体生理学功能仍然不确定,因此构建一种稳定性更好的神经红蛋白对于其结构-性质-功能之间的关系的进一步研究,以及基于神经红蛋白的蛋白酶的分子设计具有重要意义。
3.构建新型稳定的神经红蛋白,一直是一个探索性的路程,然而目前还没有报道通过将辅基血红素与蛋白肽链之间形成共价键的方法来构建c-型神经红蛋白。
技术实现要素:
4.有鉴于此,本发明提供了一种血红素稳定性和蛋白稳定性较高的c-型人神经红蛋白及其制备方法。
5.为了实现上述发明目的,本发明提供以下技术方案:
6.本发明在人神经红蛋白分子内血红素的一个轴向配体组氨酸(his64)定点突变为甲硫氨酸(met64),同时在血红素4-位乙烯基附近的第71位引入一个半胱氨酸(cys71),在b-型血红素蛋白ngb分子中构建了c-型血红素配位结构和硫醚键,其中血红素与蛋白肽链以共价键的方式相结合,获得一种c-型人神经红蛋白h64m/v71c ngb,其氨基酸序列如seq id no.1所示。
7.本发明还提供了编码根据权利要求1所述的c-型人神经红蛋白的dna分子以及包含该dna分子的载体。
8.本发明还提供了所述的c-型人神经红蛋白、dna分子或所述的载体在制备具有抗氧化作用的蛋白药物中的应用。
9.本发明还提供了所述的c-型人神经红蛋白的制备方法,利用定点突变技术,将seq id no.2所示的神经红蛋白的第64氨基酸突变为甲硫氨酸,第71位氨基酸突变为半胱氨酸,将突变质粒在宿主中进行表达,然后经分离、纯化,获得c-型人神经红蛋白。
10.本发明中,所述宿主为大肠杆菌。一些实施方案中,优选为大肠杆菌bl21系列。一些具体实施例中,具体为大肠杆菌bl21(de3)菌株。
11.本发明中,所述分离的方法为超声破碎菌体。一些实施方案中,所述超声破碎菌体具体为40w超声破碎2小时。具体的,所述超声破碎间断进行,超声5秒间歇5秒,如此循环,共2小时。
12.本发明中,所述纯化为经盐析透析后进行柱纯化。一些实施方案中,所述柱纯化为依次经deae阴离子交换柱、g75凝胶柱、monoq阳离子交换柱分离。
13.在生物体系中,共价键结合方式对于维持蛋白结构的稳定性发挥着重要的作用。本发明通过在b-型血红素蛋白ngb分子中构建血红素与蛋白肽链之间形成共价键,获得了稳定性明显提高的建c-型人神经红蛋白。
14.本发明通过对神经红蛋白晶体结构为模板进行计算机模拟分析,发现可在血红素的一个轴向配体组氨酸(his64)定点突变为甲硫氨酸(met64),同时在血红素4-位乙烯基附近第71位引入一个半胱氨酸(cys71),进而能在b-型血红素蛋白ngb分子中构建c-型血红素蛋白的血红素配位结构和硫醚键,血红素与蛋白肽链以共价键的方式相结合,实现构建c-型人神经红蛋白。本发明基于基因工程和蛋白质工程技术,分离纯化得到突变体蛋白h64m/v71c ngb,其氨基酸序列如seq id no.1所示。通过实验进一步证实,h64m/v71c ngb表现出高血红素稳定性和蛋白热稳定性,可以广泛用于研究c-型血红素的结构与功能关系以及c-型血红素蛋白酶的分子设计如蛋白质药物设计等。
附图说明
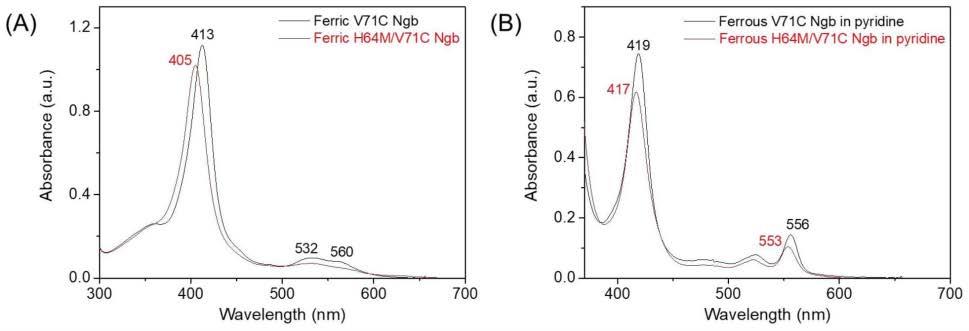
15.图1为v71c ngb(黑线)和h64m/v71c ngb(红线)的氧化态和吡啶还原态的uv-vis光谱;
16.图2为v71c ngb(a)和h64m/v71c ngb(b)的质谱;
17.图3为在酸性条件下使用丁酮萃取v71c ngb(a)和h64m/v71c ngb(b)蛋白溶液中的血红素;
18.图4为v71cngb(a)和h64m/v71c ngb(b)热变性的紫外可见光谱变化;插图分别为405nm和413nm处吸光值随温度的变化曲线图。
具体实施方式
19.本发明提供了一种c-型人神经红蛋白的制备方法。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
20.本发明采用的试材皆为普通市售品,皆可于市场购得。
21.下面结合实施例,进一步阐述本发明:
22.实施例1
23.基于基因工程和蛋白质工程,运用定点突变技术,在神经红蛋白第64位引入甲硫氨酸(met),第71位引入半胱氨酸(cys),将突变质粒在大肠杆菌bl21(de3)中表达,通过超声破菌、盐析透析以及deae阴离子交换、柱层分离g75、阳离子交换柱monoq方法,进行蛋白质的分离纯化,获得v71cngb和h64m/v71cngb突变体蛋白。
24.h64m/v71c ngb突变体蛋白的氨基酸序列如seq id no.1所示:
25.merpepelirqswrcvsrsplehgtvlfarlfalepdllplfqyncrqfsspedclsspefldmirkvmlcidaavtnvedlssleeylaslgrkhravgvklssfstvgesllymlekclgpaftpatraawsqlygavvqam
srgwdge。
26.实施例2
27.用uv-vis调蛋白溶液吸光度1.0-1.5之间,取洗净吹干的圆口比色皿中先后加入1ml蛋白溶液,暴露于空气中的蛋白呈氧化态,加入1ml 0.2m naoh+40%pyridine混合液,封口,混匀后进行抽氧充氮处理(抽气10min,充入n210 min,循环2~3次),再加入无氧的连二亚硫酸钠溶液,混合均匀后记录下光谱。
28.wt ngb属于b-型血红素蛋白中的一种,其吡啶血红素光谱中的α峰位于556nm,对于ngb双突变体h64m/v71c ngb,其吡啶血红素光谱中的α峰位于553nm,说明乙烯基与所引入cys的巯基发生加成反应,生成了一个共价键,使血红素与蛋白肽链进行了单共价键结合,实现向c-型人神经红蛋白的结构转化。
29.h64m/v71c ngb吡啶血红素光谱中的α峰位于553nm,v71c ngb位于556nm(图1b),说明h64m/v71c ngb蛋白中辅基血红素的一个乙烯基被饱和,暗示这个乙烯基与所引入cys的巯基发生加成反应,生成了一个共价键,使血红素与蛋白肽链进行了单共价键结合。
30.实施例3
31.在g2-xs qtof电喷雾质谱(waters)上测量蛋白质质谱,纯化得到的高纯度的突变体蛋白样品先得用pd10脱盐柱进行脱盐处理,用一级水洗脱,将脱盐的蛋白质溶液与含有1%甲酸的50%乙腈溶液(乙腈:水,1:1)混合均匀,并转移到质谱仪室中以通过直接注射方法进行测量,通过使用软件maxent1将多电荷峰计算转化为蛋白质分子量。以非共价键相连的b-型血红素将与蛋白肽链分离,从而得到的质谱结果是脱辅基蛋白,v71c ngb的理论脱辅基蛋白质量约为(16937.0da),如图2a所示,实际计算的16934.5da的质量与理论计算的具有一对分子内二硫键(16935.0da)的脱辅基v71c ngb的质量一致,wt ngb同样对于脱辅基蛋白质量。h64m/v71c ngb的检测结果显示其分子量为17575.5da(图2b),对应于h64m/v71c脱辅基蛋白的理论分子量16929.0da加两个氧(32.0da)和血红素(615.5da)的分子量之和,说明在突变体h64m/v71c ngb中,cys71与血红素的4-乙烯基发生了加成反应,形成了硫醚键,使血红素与蛋白肽链进行了共价键合,即h64m/v71cngb具有c-型血红素蛋白结构。
32.实施例4
33.分别在瓶子中加入2ml 50μm左右的v71c ngb和h64m/v71c ngb蛋白溶液,用hcl调节ph值为2.0,再加入等体积丁酮,反复振摇数次,观察两种不同蛋白情况下的上层有机相的颜色。当用hcl调节蛋白溶液ph值为2.0左右,蛋白处于去折叠状态,这时用丁酮就可以将血红素从蛋白溶液的水相萃取到丁酮的有机相中,而原本红色的蛋白溶液由于辅基的去除就会变成无色,而丁酮有机相由于溶解了血红素而呈现红棕色。对于h64m/v71c ngb上层有机相呈无色,v71c ngb呈红棕色(图3),同样的萃取实验却不能将h64m/v71cngb蛋白溶液的血红素从蛋白萃取到丁酮中,说明血红素与蛋白肽链之间已经形成了共价键的结合方式,从而不能进行酸化丁酮萃取,即具有高血红素稳定性。
34.实施例5
35.将v71c ngb和h64m/v71c ngb蛋白溶于磷酸二氢钾-氢氧化钾的缓冲溶液(ph 7.0)中,使蛋白溶液浓度为10μm。采用圆二色光谱仪来检验蛋白的热稳定性,扫描范围为250~700nm,蛋白溶液在每个测量温度下恒温10min,确保达到平衡状态,然后测量并记录各个不同温度下蛋白的光谱图。v71c ngb和h64m/v71c ngb的soret峰分别为413nm和
405nm,分别将两种蛋白soret峰的吸光值进行拟合,soret峰在413nm处对温度的曲线图显示v71c ngb的变性中点温度tm为95.4
±
0.5(图4a,插图),wt ngb显示变性中点温度tm为92.6
±
0.5℃。与wt和v71c ngb相比,当温度升高至100℃时,h64m/v71cngb仅经历部分去折叠,soret峰和可见区条带的强度略微降低(图4b),因此估计tm高于100℃。这些结果表明,通过构建血红素与蛋白肽链之间形成的共价键,h64m/v71c ngb表现出极高的热稳定性,并且在100℃时保留几乎一半的a-螺旋结构,以及结合有血红素的完整蛋白质结构。
36.以上结果表明,c-型人神经红蛋白h64m/v71c ngb,即具有类似细胞色素c的血红素-半胱氨酸硫醚键,其血红素辅基与蛋白肽链共价链接具有高稳定性。与wt和v71c ngb相比,h64m/v71c ngb的血红素稳定性和蛋白热稳定性明显提高。
37.以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1