一种特异识别AAV9衣壳蛋白的多克隆抗体及制备方法
一种特异识别aav9衣壳蛋白的多克隆抗体及制备方法
技术领域
1.本发明涉及一种医药生物化工技术领域,具体地说,是关于一种特异性识别aav9衣壳蛋白的多克隆抗体制备方法。
背景技术:
2.腺相关病毒(adeno-associated virus ,aav)属于细小病毒科依赖病毒属,该病毒在人类及灵长类等脊椎动物体内广泛存在,目前科学界普遍认为aav不会引起人类疾病的产生。近年来国内外科研平台将aav载体用于体内基因治疗的临床试验数量逐步增加,其优异的安全性,以及针对靶向器官组织的高效转导性,使其成为针对体内基因治疗的首选载体系统。aav病毒粒子直径约25 nm,其中包裹着4.7 kb的单链dna基因组,基因组由rep基因和cap基因组成,两侧是反向末端重复序列(inverted terminal repeats,itr),左侧的orf编码四种复制蛋白,根据它们的分子量命名为:rep78、rep68、rep52和rep40,右侧的orf通过不同起始密码子编码三个衣壳蛋白vp1、vp2和vp3,这三种结构蛋白共用一个共同的羧基末端,但具有不同的氨基末端,aav组装过程中,vp1、vp2和vp3以1:1:10的比例形成二十面体病毒衣壳。
3.由于aav不同血清型之间具有较高的保守性,大多aav衣壳蛋白抗体缺乏特异性,往往一种抗体识别多种血清型aav,目前市面上还没有特异性针对aav9衣壳蛋白的商业化抗体。基于此,本发明根据aav1-aav10衣壳蛋白一级结构序列分析,共发现8处aav9衣壳可变区(aa262-269,aa448-483,aa488-510,aa527-540,aa545-557,aa576-601,aa661-668,aa706-718),将aav9衣壳独有的可变区dna序列进行人工拼接后合成,经过原核蛋白表达纯化,以纯化的蛋白为抗原免疫日本大耳朵白兔,制备兔多克隆抗体,采用多种方式验证人工制备的抗原任然保留了抗原性,并且理论上制备的抗体具有较好的特异性,仅能识别aav9病毒衣壳蛋白,为后续研究aav9的生物学功能以及aav9载体的改造及优化奠定了基础。
技术实现要素:
4.针对上述技术问题,本发明提供一种抗aav9衣壳可变区的多克隆抗体,其特征在于,用于制备aav9衣壳可变区多克隆抗体的氨基酸序列为seq id no:1,其dna编码序列为seq id no:2。
5.一种抗aav9衣壳可变区的多克隆抗体的制备方法包括如下步骤:(1)获得aav9衣壳蛋白可变区氨基酸序列;(2)编码步骤(1)中氨基酸序列为可变区的dna序列并构建到pet-30a原核表达载体,5
′
末端酶切位点为xhoⅰ,3
′
末端酶切位点为ndeⅰ,得到重组pet-30a-aav9-vr可变区蛋白质粒;(3)将重组pet-30a-aav9-vr可变区蛋白质粒导入大肠杆菌菌株 bl21(de3)进行扩增,接种于含有卡拉霉素的琼脂平板培养基上进行阳性克隆的筛选,纯化得到aav9可变区蛋白;
(4)aav9可变区蛋白免疫日本大耳朵白兔,得到抗aav9衣壳可变区的多克隆抗体。
6.所述的aav9衣壳蛋白可变区氨基酸序列为aav9可变区中的aa262-269,aa448-483,aa488-510,aa527-540,aa545-557,aa576-601,aa661-668,aa706-718可变区序列拼接所得。
7.本发明将所述的抗aav9衣壳可变区的多克隆抗体或所述的aav9病毒载体在选择性识别aav9病毒衣壳蛋白上的应用。
8.aav载体具有免疫原性低、很少或几乎不整合宿主基因组、可实现组织异性等特点,目前aav载体已逐渐成为体内基因治疗的主要载体。已有三种基于aav载体的基因治疗药物上市,分别是glybera、luxturna和zolgensma。glybera采用aav1携带脂蛋白脂酶基因,用于治疗遗传性脂蛋白酯酶缺乏的患者,于2012年10月获得欧洲药品管理局批准上市;luxturna采用aav2将正常的rpe65基因导入患者体内,用于治疗由rpe65基因突变导致的遗传性视网膜疾病,于2017年12月获得美国食品药品监督管理局批准;zolgensma采用aav9携带治疗基因smn1,用于治疗2岁以下的脊髓性肌肉萎缩症患者,于2019年5月经美国食品药品监督管理局批准上市。aav载体的开发以及优化离不开aav抗体的使用,本研究旨在建立一种原核表达aav9衣壳蛋白可变区抗原肽的方法以及制备一种特异性识别aav9的多克隆抗体。
9.为获得大量可用作抗原免疫日本大耳朵白兔的aav9可变区蛋白,我们将构建的pet-30a-aav9-vr原核表达质粒转化入大肠杆菌菌bl21(de3)中。分析发现,细菌内aav9可变区蛋白能被iptg诱导性表达,且主要以包涵体的形式存在,这可能与aav9可变区蛋白诱导性表达的速度过快和细菌内浓度过高有关。
10.由于重组aav9可变区蛋白带有his标签,本发明在尿素变性的条件下利用ni-nta树脂亲和层析法成功获得高纯度的aav9可变区蛋白。为制备抗aav9可变区蛋白多克隆抗体,我们将纯化后的aav9可变区蛋白用做抗原免疫日本大耳朵白兔,经过1次启动免疫和2次加强免疫后,获得高效价的抗aav9衣壳可变区多克隆抗体。该抗体能特异性识别和结合aav9衣壳蛋白,而不能识别其他血清型aav,如aav2、aav6等,可有效用于aav9衣壳蛋白的免疫印迹、elisa等生物化学分析实验。
11.综上所述,本实验成功建立了aav9衣壳可变区的原核表达纯化技术,成功制备了抗aav9衣壳可变区的多克隆抗体,制备的抗体理论上仅识别aav9衣壳蛋白,上述研究有助于后续aav载体的改造、新型aav载体的筛选、aav检测以及aav生物学功能等研究。
附图说明
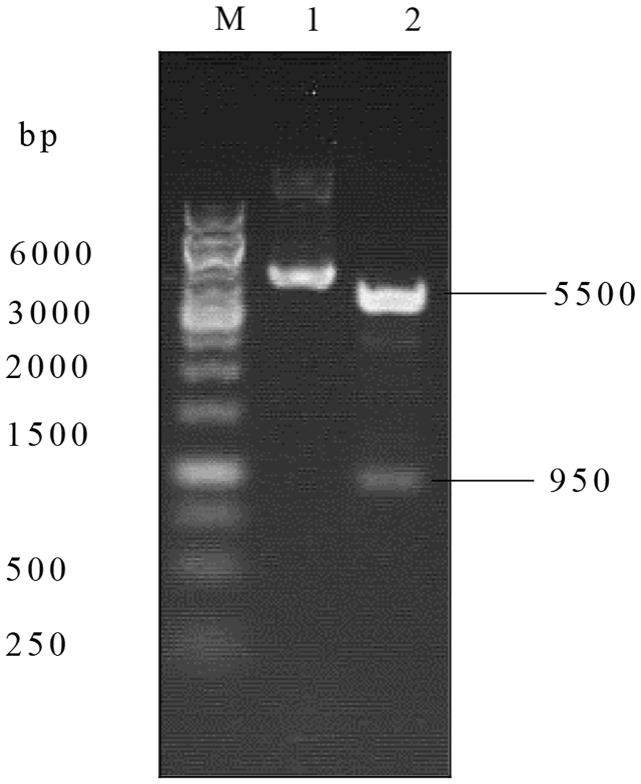
12.图1为pet30a-aav9-vr可变区质粒的酶切鉴定,其中,m:dnamaker1:aav9可变区质粒2:xhoi+ndei酶切后。
13.图2sds-page分析aav9可变区蛋白的诱导表达,其中,m:proteinmarker;1:iptg诱导0h;2:iptg诱导2h;3:iptg诱导4h;4:iptg诱导6h;5:iptg诱导8h,箭头指示aav9可变区蛋白所在的位置。
14.图3sds-page分析aav9可变区蛋白的纯化,其中,m:标准蛋白marker-441;1:ni-nta树脂亲和层析纯化后的纯化蛋白;2:iptg诱导6h全菌;3:iptg诱导0h全菌,箭头指示aav9可变区蛋白所在的位置。
15.图4westernbloting鉴定aav9可变区蛋白,其中,1:iptg诱导0h;2:ni-nta树脂亲和层析纯化后的纯化蛋白,指示aav9可变区蛋白所在的位置。
16.图5elisa分析制备血清的效价。
17.图6westernbloting分析制备抗体的特异性。
18.图7抗血清用于细胞免疫荧光检测。
具体实施方式
19.本发明的实施例所用的材料为pet-30a表达质粒及大肠杆菌菌株bl21(de3)购自北京全式金生物技术股份有限公司,日本大耳白兔(雄性)购自湖北省实验动物研究中心。ni-nta蛋白纯化树脂,羊抗兔igg-his抗体、hrp标记的羊抗兔igg由北京中杉金桥生物技术有限公司提供,ecl显色液为美国thermoscientific公司产品;ni-nta树脂为德国novagen公司产品,弗氏不完全佐剂和弗式完全佐剂为购自美国sigma-aldrich公司,其它化学试剂由美国sigma等公司提供。
20.实施例1aav衣壳可变区蛋白序列获得从ncbi网站下载获得aav1-aav10衣壳蛋白氨基酸序列,将序列导入软件dnaman,序列同源性比对分析,发现8处aav9可变区(aa262-269,aa448-483,aa488-510,aa527-540,aa545-557,aa576-601,aa661-668,aa706-718),将可变区序列进行拼接,获得的序列即为aav9衣壳蛋白可变区序列,编码可变区的dna序列由金唯智生物公司合成并构建到pet-30a原核表达载体,5
′
末端酶切位点为xhoⅰ,3
′
末端酶切位点为ndeⅰ。aav9可变区质粒pet30a-aav9-vr经xhoi+ndei酶切后,用1%的琼脂糖凝胶电泳分离,可见5500bp与1000bp两个限制性片段(图1),结果与预期一致。酶切鉴定为阳性的重组质粒经dna测序,证实质粒中插入序列正确,阅读框架对接无误。
21.可变区蛋白原核表达将经过测序检验正确的重组pet-30a-aav9-vr可变区蛋白质粒通过转化导入大肠杆菌菌株bl21(de3)中,接种于含有卡拉霉素的琼脂平板培养基上进行阳性克隆的筛选,筛选出的阳性克隆接种到5ml含有卡拉霉素的lb液体培养基中,37℃220rpm振荡培养,待菌液od值达到0.8-1.0时,加入终浓度为1mmol/l的iptg继续同条件培养,分别在诱导0h、2h、4h、6h和8h后进行取样,5000rpm离心3min,收集菌体并重悬于pbs中(kh2po42mmol/l,na2hpo410mmol/l,nacl137mmol/l,kcl2.7mmol/l),超声裂解细菌后,11000
×
g离心,分别取上清和沉淀制样,经sds-page分析aav9可变区蛋白的表达情况,由此确定最佳外源蛋白诱导表达条件。
22.将重组pet-30a/aav9可变区质粒转化入大肠杆菌bl21(de3)中,iptg(终浓度为1mmol/l诱导0-6h,每间隔2h进行取样,经过15%的sds-page分析,结果(图2)显示iptg诱导后,在相对分子质量20kd附近有一新蛋白产生,与预期aav9可变区蛋白重组蛋白的相对分子质量一致。确认条件后,将大肠杆菌进行放大培养,收集过夜菌液进行超声裂解,取诱导后的细菌沉淀通过ni-nta亲和层析法纯化蛋白,得到的纯化后蛋白经sds-page分析,结果(图3)显示aav9可变区蛋白位置与预期相符合。
23.可变区蛋白的纯化及复性经过上述的诱导鉴定,将成功转化pet-30a/aav可变区蛋白的bl21(de3)阳性单克隆菌放大培养(1000ml培养液)。待菌液od值达到0.8-1.0时,继续采用终浓度为1mmol/l的iptg诱导表达8h后,5000rpm离心5min收集菌体经高浓度尿素(8 mol/l 尿素,0.1 mol/l na2hpo4,0.01 mol/l tris-hcl,ph 8.0)裂解细菌,37℃振荡裂解2h,离心30min去除不溶性碎片。根据曹春雨等文献中所提供的破碎细菌方法,本实验采用离心后将上清液置于超声条件下进行超声破碎细菌,使细菌充分裂解,最终收集上清。上清与ni-nta树脂杂交2h后上柱,用洗脱液a(8 mol/l尿素,100 mmol/l na2hpo4,10 mmol/l tris,ph6.3)洗脱杂蛋白,再用洗脱液 b(8 mol/l 尿素,100 mmol/l na2hpo4,10 mmol/l tris,ph4.3)洗脱目的蛋白。纯化后的蛋白用ni-nt亲和层析分离纯化上清中的重组蛋白。纯化后的重组蛋白经尿素浓度梯度递减的透析液,分步透析去除尿素而复性。透析缓冲溶液为50mmol/l tris-hcl(ph为7.5) 250mmol/l nacl 0.01mmol/l edta 1mol/l dtt其中尿素浓度梯度下降,其含量分别为5、2.5、1和0mol/l(各透析12h)透析后的蛋白于-80℃保存备用。
24.由于诱导表达的 aav9可变区蛋白带有 6
×ꢀ
his标签,实验采用ni-nta亲和层析法对表达菌中的aav9可变区蛋白进行纯化。纯化后的蛋白经不同浓度的尿素透析缓冲液复性后,使用 sds-page 和 western blotting(抗his标签抗体作为一抗)对其进行纯度和特异性鉴定。结果(图4)显示,大肠杆菌中诱导表达的aav9可变区蛋白能被ni-nta高效纯化。
25.兔多克隆抗血清制备纯化后的aav9可变区蛋白用作抗原免疫日本大耳朵白兔,首次免疫取 600 μg(480 μl蛋白抗原与520 μl佐剂乳化,并加入1 ml pbs)抗原与弗氏完全佐剂乳化后,颈部脱毛后背部多点注射。注射前,分别从日本大耳朵白兔里取2 ml动脉血清,作为后续实验阴性对照。依据吕亚丰等相关实验结论,针对再注射增强免疫,本研究选择两周后进行2次加强免疫,每次间隔时间两周,加强免疫采用aav9可变区蛋白与弗氏不完全佐剂乳化,颈背部脱毛后背部多点注射。末次免疫后耳中动脉取血,4℃静置1 h后,4℃,12000r/min 离心收集血清,加入等体积甘油、1%叠氮钠后-20℃保存备用。
26.制备的抗血清抗体效价检测间接elisa法被用于检测本研究制备的抗血清中aav9可变区蛋白多克隆抗体效价。将纯化的aav9可变区蛋白用包被缓冲液(ph为9.6的碳酸盐溶液)稀释至终浓度为10μg/ml 后,加入96孔酶标板,每孔100μl,置于4℃包被16 h,3%的bsa 于37℃封闭2 h,减少非特异性结合,加入系列稀释的血清,100μl/孔,以未免疫日本大耳朵白兔血清为阴性对照,pbs为空白对照,37℃孵育1h ;再加入1:5000稀释的带有hrp标记的羊抗兔 igg,100μl/孔,37℃孵育1h ;tmb 法显色,采用终止液终止反应后,使用酶标仪检测各孔a450 值。以空白对照调零,待测孔a450 值与阴性对照孔a450 值的比值≥ 2.1 即判为阳性,以能获得阳性的最大稀释度作为待检血清的抗体效价。
27.血清效价检测将纯化的aav9可变区蛋白用抗原包被酶标板,免疫血清等比稀释后作为一抗,结果(图 5)表明elisa 法检测制备抗血清的效价1:10240000。
28.法鉴定制备的aav9可变区蛋白抗体以本实验制备的抗血清为一抗,western bolt法检测多种血清型aav,以验证本实验制备的抗aav9可变区抗体。aav2、aav6、aav9病毒样品经 sds-page 分离后以 300 ma 恒
流电转移到 pvdf膜,膜采用含5% bsa的tbst封闭2 h。用本实验制备的aav抗体为一抗(1:100稀释)4℃孵育过夜,羊抗兔 igg 为二抗,室温孵育1h后使用tbst进行漂洗,ecl法显色并记录结果。制备抗体用于aav9可变区蛋白重组蛋白的 western bloting 检测。以纯化的aav2、aav6、aav9为样品,以制备的aav衣壳蛋白可变区抗体为一抗,western blotting 检测aav抗体对不同血清型的aav病毒的识别效果,结果(图 6)表明, 制备的aav抗体能特异性识别和结合aav9病毒,可用于该种血清型aav病毒相关的western blot 检测。
29.细胞免疫荧光法鉴定aav9可变区蛋白抗体将表达aav9衣壳蛋白的质粒转染4t-1细胞,转染48h后将细胞接种于玻片继续培养,待细胞贴壁后,pbs洗涤3次,4%多聚甲醛室温固定细胞15 min,0.5%的tritonx-100室温通透20 min,pbs洗涤玻片3次后,正常山羊血清室温封闭30 min,每张玻片滴加本实验制备的抗血清(1:200 稀释)后放入湿盒,4℃孵育过夜,pbs 洗 涤玻片后滴加荧光二抗(1:200 稀释),湿盒中室 温避光孵育 1 h,洗涤未结合的二抗后,滴加 dapi(1:50)避光孵育 10-15 min(复染细胞核),pbs 洗去多余的dapi,用含有抗荧光淬灭剂的封片剂封片,荧光显微镜观测结果。在293t细胞中转染aav9衣壳蛋白质粒,以制备的aav9可变区抗体为一抗,以cy3标记的羊抗兔 igg 为二抗,免疫荧光法检测293t细胞内aav9衣壳蛋白的表达。结果(图7)显示,制备抗体能有效用于血清型aav9的细胞免疫荧光分析。
30.本发明的技术方案对aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav10病毒衣壳蛋白氨基酸序列进行同源比对,共发现10处aav9衣壳可变区,将8处aav9衣壳可变区氨基酸序列依次连接即为本发明所指aav9可变区vr的氨基酸序列seq id no.1,由氨基酸序列得到编码aav9衣壳可变区的dna序列如seq id no.2,将dna序列插入到原核表达载体pet30a获得质粒pet30a-aav-vr,转化大肠杆菌扩增,采用iptg诱导表达多价抗原肽,在变性条件下经ni-nta树脂进行纯化,然后透析复性,纯化得到aav9可变区蛋白免疫日本大耳朵白兔,以此制备多克隆抗体,elisa检测抗体效价,western-blot及细胞免疫荧光检测抗体的应用。
31.序列表《110》三峡大学《120》一种特异识别aav9衣壳蛋白的多克隆抗体及制备方法《160》总数目18《210》1《211》141《212》氨基酸序列《213》人工序列《223》衣壳蛋白可变区vr的氨基酸序列《400》1nstsggsssktingsgqnqqtlkfsvagpsnmavqgrnyipgpsrvsttvtqnnnsefawpgasswahkegedrffplsgskqgtgrdnvdadksygqvatnhqsaqaqaqtgwvqnqgiafnkdklnyksnnvefavnte《210》2《211》423《212》dna
《213》人工序列《223》衣壳蛋白可变区vr的dna序列《400》2aacagcacgagcggcggcagcagtagcaaaaccattaacggcagcggtcagaatcagcagaccctgaaatttagcgtggcgggcccgagcaacatggcggtgcaaggccgcaactatattccgggcccgagccgcgtgagcaccaccgtgacgcagaacaataacagcgaatttgcgtggccgggcgcgagcagctgggcgcataaagaaggcgaagatcgcttttttccgctgagcggcagcaaacaaggcaccggccgcgataacgtggatgcggataaaagctatggccaagtggcgaccaaccatcagagcgcgcaagcgcaagcgcagaccggctgggtgcagaaccaaggcattgcgtttaacaaagataaactgaactataaaagcaacaacgtggaatttgcggtgaacaccgaa《210》3《211》8《212》氨基酸序列《213》人工序列《223》衣壳蛋白可变区aa262-269的氨基酸序列《400》3nstsggss《210》4《211》24《212》dna《213》人工序列《223》衣壳蛋白可变区aa262-269的dna序列《400》4aacagcacgagcggcggcagcagt《210》5《211》36《212》氨基酸序列《213》人工序列《223》衣壳蛋白可变区aa448-483的氨基酸序列《400》5sktingsgqnqqtlkfsvagpsnmavqgrnyipgps《210》6《211》423《212》dna《213》人工序列《223》衣壳蛋白可变区aa448-483的dna序列《400》6agcaaaaccattaacggcagcggtcagaatcagcagaccctgaaatttagcgtggcgggcccgagcaacatggcggtgcaaggccgcaactatattccgggcccgagc《210》7
《211》23《212》氨基酸序列《213》人工序列《223》衣壳蛋白可变区aa488-510的氨基酸序列《400》7rvsttvtqnnnsefawpgasswa《210》8《211》69《212》dna《213》人工序列《223》衣壳蛋白可变区aa488-510的dna序列《400》8cgcgtgagcaccaccgtgacgcagaacaataacagcgaatttgcgtggccgggcgcgagcagctgggcg《210》9《211》14《212》氨基酸序列《213》人工序列《223》衣壳蛋白可变区aa527-540的氨基酸序列《400》9hkegedrffplsgs《210》10《211》42《212》dna《213》人工序列《223》衣壳蛋白可变区aa527-540的dna序列《400》10cataaagaaggcgaagatcgcttttttccgctgagcggcagc《210》11《211》13《212》氨基酸序列《213》人工序列《223》衣壳蛋白可变区aa545-557的氨基酸序列《400》11kqgtgrdnvdadk《210》12《211》39《212》dna《213》人工序列《223》衣壳蛋白可变区aa545-557的dna序列
《400》12aaacaaggcaccggccgcgataacgtggatgcggataaa《210》13《211》26《212》氨基酸序列《213》人工序列《223》衣壳蛋白可变区aa576-601的氨基酸序列《400》13sygqvatnhqsaqaqaqtgwvqnqgi《210》14《211》78《212》dna《213》人工序列《223》衣壳蛋白可变区aa576-601的dna序列《400》14agctatggccaagtggcgaccaaccatcagagcgcgcaagcgcaagcgcagaccggctgggtgcagaaccaaggcatt《210》15《211》8《212》氨基酸序列《213》人工序列《223》衣壳蛋白可变区aa661-668的氨基酸序列《400》15afnkdkln《210》16《211》24《212》dna《213》人工序列《223》衣壳蛋白可变区aa661-668的dna序列《400》16gcgtttaacaaagataaactgaac《210》17《211》13《212》氨基酸序列《213》人工序列《223》衣壳蛋白可变区aa706-718的氨基酸序列《400》17yksnnvefavnte《210》18
《211》39《212》dna《213》人工序列《223》衣壳蛋白可变区aa706-718的dna序列《400》18tataaaagcaacaacgtggaatttgcggtgaacaccgaa
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1