用于生产TCRγδ的制作方法
用于生产tcr
γδ
+
t细胞的方法
技术领域
1.本发明涉及用于分离和选择性体外扩增vδ2-tcrγδ
+ t细胞的新方法及其临床应用。
背景技术:
2.tcrγδ
+ t细胞
3.颌类脊椎动物的免疫系统包括能够识别和消除肿瘤细胞的各种淋巴细胞群,其构成了癌症免疫疗法的基础。一个群的特征在于,由γ链和δ链的连接形成的t细胞受体(tcr)的表达。 tcrγδ
+ t细胞(这里也称为γδt细胞)占人外周血淋巴细胞(pbls)的1-10%,但是在健康个体的上皮组织中充分富集,其中它们达到t细胞的50%。1tcrγδ
+ t细胞具有强大的主要组织相容性复合体(mhc)-对恶性和受感染的细胞具有无限制的细胞毒性,同时留下未损伤的健康细胞和组织。因此,它们通常被认为是针对感染和肿瘤的第一线监测机制。14.在人类中,根据编码其δ链的基因,对tcrγδ
+ t细胞的不同亚群或子群进行鉴定和分类。外周血中大约60-95%的tcrγδ
+ t细胞表达与vγ9链有关的vδ2链,而大部分其余的tcrγδ
+ t细胞表达与各种vγ元素:vγ2、vγ3、vγ4、vγ5或vγ8相关的vδ1链。其他(更罕见的)人 tcrγδ
+ t细胞群表达vδ3、vδ5、vδ6、vδ7和vδ8链。
2-4
5.vδ2
+ tcrγδ
+ t细胞
6.目前基于tcrγδ
+ t细胞的过继性免疫治疗方法仅限于vδ2
+
tcrγδ
+ t细胞子群(这里也称为vδ2
+ t细胞)。
5,6
大多数vδ2
+ t细胞对非肽烷基磷酸酯如异戊烯焦磷酸(ipp)具有特异性反应,该ipp在肿瘤细胞中以及暴露于骨强化的氨基双膦酸盐如唑来膦酸盐和帕米膦酸盐的个体中异常产生。这些化合物与白细胞介素-2结合后,体外刺激vδ2
+ t细胞的增殖和抗肿瘤细胞毒性作用,并产生用于临床应用的纯化的细胞群。
5-7
然而,迄今为止完成的临床试验在癌症患者中显示出较低的客观应答百分比。8因此,目前基于γδt细胞的治疗虽然可行并且安全,但是具有明显的局限性。67.vδ1
+ tcrγδ
+ t细胞
8.人vδ1
+
tcrγδ
+ t细胞(在此也称为vδ1
+ t细胞)构成了所有tcrγδ
+ pbl的1-40%,但是在上皮部位如肠和皮肤中是主要的γδt细胞群。虽然从未在临床试验中评估,但该细胞亚群也可显示出强烈的抗肿瘤活性。渗透皮肤、结肠、肾和肺肿瘤的vδ1
+ t细胞对自体的和同种异体的癌细胞都具有细胞毒性。
9-13
在急性淋巴细胞白血病(all)的骨髓移植后,在供体的外周血vδ1
+ t细胞数量增加和改善的5-10年无病生存率之间也发现了一个有趣的相关性。
14
重要的是,注入的vδ1
+ t细胞在这些患者中持续数年。
14,15
在另一种情况下,具有高vδ1
+ t细胞计数的低度恶性非霍奇金淋巴瘤患者在1年的随访中病情稳定,与vδ1
+ t细胞数量少的患者相比,临床病程有所改善。
16
在慢性淋巴细胞白血病(cll)患者中循环vδ1
+ t细胞也通常增加
17
,并且与低风险b-cll患者的非进展相关。
18
最后,在人免疫缺陷病毒(hiv)
19
和疟疾
20
感染以及肾脏移植后的人细胞病毒(hcmv)感染中也观察到了循环vδ1
+ t细胞的数量增加。
4,21
然而,在不同情况下,vδ1
+ t细胞的子群可表现出免疫抑制和调节性质,
这一功能也可用于治疗目的。
22
9.已经描述了在体外特异性扩增vδ1
+ t细胞的少数方法,尽管它们中没有一个可以适用于临床应用(siegers,g.et al.,2014,ref.中进行了评述
22
)。meeh et al.首先展示了来自健康供体的 vδ1
+ t细胞可响应于all白血病母细胞而体外扩增。
23
knight,a.及其同事和merims,s.及其同事分离出外周血vδ1
+ t细胞,并在植物凝集素(pha)或抗cd3单克隆抗体(mab),il-2 和经辐照的同种异体的外周血单核细胞(pbmc)存在下,处理3周。
24,25
在最近的一项研究中, pha与白细胞介素-7(il-7)联合使用。
26
siegers,g.et al.报道了两步培养方案,其中首先用伴刀豆球蛋白-a(cona)、il-2和il-4对挑选的tcrγδ
+ t细胞处理6-8天,随后用il-2和il-4另外再刺激10天。
27
在培养期之后,vδ1
+ t细胞在59%的培养物中扩增,其在半数培养物中是主要亚群(平均70%的vδ1
+ t细胞);然而,用这种方法可以实现vδ1
+ t细胞最多25倍增加。
27
国际专利申请号pct/ca99/01024(以wo 00/26347公开)中也描述了这种两步培养方法。根据这些发明人,为了在去除有丝分裂原后细胞增殖的继续,第二培养基中的il-2和il-4都是必需的。后来又开发了这种方案的一个变形,其中在cona、il-2和il-4存在下,首先将全部 pbmcs培养6-13天,随后消除污染性tcrγδ
+ t细胞的磁性和用il-2、il-4和cona刺激剩余细胞10天。21天后,vδ1
+ t细胞从136增加到24,384倍,尽管可以达到低得多的纯度水平(少于 30%的培养细胞为vδ1
+ t细胞),然而大多数污染物细胞(约55%的细胞)是vδ2
+ t细胞。
28
10.最后,我们小组先前已经描述了选择性扩增和分化富集vδ1
+ t细胞的细胞群的方法, vδ1
+ t细胞表达自然细胞毒性受体(ncrs),其可以介导对白血病细胞系和cll患者肿瘤细胞的杀伤改善。
29
该专利方法包括,在用普通γ链细胞因子(如il-2或il-15)和tcr激动剂 (例如pha或抗cd3mab)刺激的情况下,在培养基中培养tcrγδ
+ t细胞或其前体2-3周(作为wo 2012/156958公开的国际专利申请号pct/ib2012/052545)。这种方法的一个重要限制是获得的细胞数量少,不适合于临床应用。
11.其他人tcrγδ
+ t细胞亚群
12.人类中的大部分非vδ1
+
和非vδ2
+
tcrγδ
+ t细胞表达vδ3tcr链。人tcrγδ
+
vδ3
+ t细胞约占循环t细胞的0.2%,
30
但在cmv激活
4,21
的肾脏和干细胞移植受者的外周血、hiv感染
31
或b
‑ꢀ
cll
17
患者和健康肝脏中富集。
32
激活的tcrγδ
+
vδ3
+ t细胞能体外杀伤cd1d
+
细胞和上皮肿瘤。4然而,可用的细胞培养方法不能产生大量用于临床应用的tcrγδ
+
vδ3
+ t细胞。
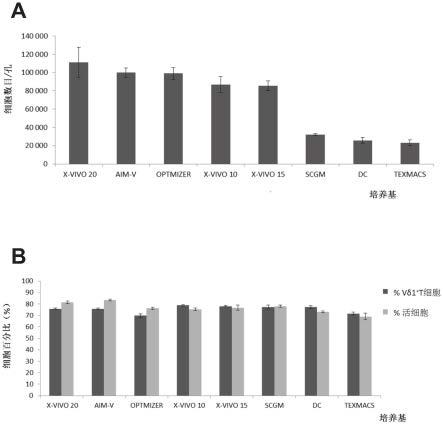
13.用于生产tcrγδ
+ t细胞富集群的其他方法
14.已经使用几种方法在体外同时扩增tcrγδ
+ t细胞群的几个亚群。用板结合的抗 tcrγδmab和il-2处理全部pbmcs3周,导致产生约90%的tcrγδ
+ t细胞,其中大部分是 vδ2
+ t细胞,有少量vδ1
+ t细胞。
33
lopez et al.通过在il-2存在下,用高剂量干扰素-γ(ifn-γ),il-12,抗-cd2 mab和可溶性抗-cd3 mab处理细胞,产生了抗细胞凋亡的 tcrγδ
+ t细胞。vδ2
+ t细胞是细胞扩增后的主要亚群。
34
最近,多克隆tcrγδ
+ t细胞在肿瘤起源的γ-辐照的人工抗原呈递细胞(aapc)存在的情况下扩增,该肿瘤起源被基因修饰以共表达cd19、cd64、cd86、cd137l和膜结合的il-15。
3,35
在可溶性il-2和il-21存在下,进一步培养细胞。
15.需要体外扩增vδ2-tcrγδ
+ t细胞的改进方法
16.最近的研究表明,具有vδ1链的tcrγδ
+ t细胞以及既不具有vδ1链也不具有vδ2链
的tcrγδ
+
t细胞,具有使其在过继性免疫治疗中具有更引人注目的抗癌效应的性质。
36
vδ2-tcrγδ
+
t细胞(这里也称为vδ2-γδt细胞)在体外和体内都比vδ2
+
t细胞表现出更高的抗肿瘤细胞毒性和更高的存活能力。
26,29,37
因此,高度富集vδ2-γδt细胞的医药产品,预期会产生更有效的抗肿瘤作用,并为治疗患者提供更多益处。尽管在过去的5年中,已经描述了几种可以在体外产生大量的肿瘤靶向性vδ2-γδt细胞的方法,但关键的未解决的问题仍然排除了这些细胞的临床应用:1)在制造过程中不安全的试剂和材料的使用;2)最终细胞产品,特别是从不同供体或从癌症患者获得的细胞产品的组成的高度变化;和/或3)最终产品的低抗肿瘤活性。
22,27,28,38
本领域需要可靠的临床级细胞培养方法,其可以在体外或离体生成大量基本上是纯的vδ2-γδt细胞(即,包含大于90%的这些细胞),其与来自不同供体,特别是来自癌症患者的细胞一致且具有类似功效。
17.先前关于注入的vδ2
+
t细胞的临床数据表明,用于治疗疾病的tcrγδ
+
t细胞的临床相关剂量包含至少约1
×
109个活细胞。因此,旨在产生用于临床应用的vδ2-γδt细胞的方法,应该能够使这些细胞体外扩增至少1,000倍。然而,vδ2-γδt细胞对烷基磷酸酯不响应,且它们识别的抗原的知识非常有限,这限制了它们在体外的扩增。植物凝集素如pha和con-a,已经用于在临床前的范围内在体外扩增和富集(达到非常高的纯度水平)这些细胞。因此,由于还未知的原因,这些常见的有丝分裂原对于vδ2-γδt细胞具有显著的选择性,促进它们在培养物中的增殖,同时抑制污染物vδ2
+
t细胞的生长(或诱导细胞凋亡)。
27,29
然而,如果无意中将植物凝集素注入人体则其可能是有毒的,由于安全考虑,监管机构不推荐将其用于临床应用。此外,根据我们的数据,植物凝集素在体外诱导vδ2-γδt细胞的扩增时不如单克隆抗体有效,其产生更少数量的细胞。几个小组已经在抗cd3单克隆抗体而不是pha存在下,培养了tcrγδ
+
t细胞。然而,抗cd3mab与也在污染物cd3
+
tcrαβ
+
t细胞和cd3
+
vδ2
+
t细胞上表达的cd3分子结合,导致最终细胞产品的纯度水平降低。因此,在用抗cd3mab刺激之前,必须通过磁激活细胞分选(macs)或通过荧光激活细胞分选(facs)分离vδ2-γδt细胞。
25,40
进一步使事情复杂化,分别用于分离总tcrγδ
+
t细胞,tcrγδ
+
vδ1
+
t细胞和tcrγδ
+
vδ3
+
t细胞的关键试剂,例如抗tcrγδmab,抗tcrvδ1mab和抗tcrvδ3mab,目前尚未制造或批准(由监管机构)用于临床使用。因此,尚不可能产生足够数量的适合直接应用于人类的纯化的vδ2-γδt细胞。
22
本领域需要不依赖于植物凝集素和其他不安全试剂来生产纯化的vδ2-γδt细胞群的方法。
18.在之前的研究中,denigeretal.开发了肿瘤来源的人工抗原呈递细胞(aapc),以繁殖高数量的表达γ和δtcr链的多克隆库的tcrγδ
+
t细胞。
37
但是,正如作者所指出的,
41
该方法不能解决与tcrγδ
+
t细胞的临床应用有关的关键阻碍。例如,大多数成分目前都不是以gmp质量生产的,而且进一步的发展仍然取决于制造商将来的兴趣,复杂的监管批准,同时假设可以用不同的试剂获得相同的细胞产品,并且来自癌症患者。此外,在本研究中缺失关于所产生的细胞产品的准确组成(和变异性)的关键细节,因此阻碍了该方法的潜在应用。
19.白细胞介素-2,白细胞介素-7和白细胞介素-15是非常多效性的分子,对包括tcrαβ
+
t和vδ2
+
t细胞的多种免疫细胞具有强烈的刺激作用。因此,这些试剂不适合用于vδ2-γδt细胞的体外扩增,因为污染的细胞也会在培养中扩增,损害细胞纯度。此外,这些促炎性细胞因子与γδtcr激动剂的典型组合通常导致受刺激的细胞的激活诱导细胞死亡
(aicd)和获得更少数量的细胞。本领域需要可依赖更多选择性试剂、用于从高度不纯的起始样品中扩增vδ2-γδt 细胞的方法。
20.已经使用il-2和il-4的组合在体外扩增vδ1
+ t细胞,取得了一些成功。然而,我们发现,培养基中il-4的存在诱导vδ2-γδt细胞上自然杀伤(nk)激活受体(如nkg2d和ncrs)的强烈下调,减弱了它们的抗肿瘤反应(表3)。即使在il-2存在时,也发生il-4对vδ2-γδt细胞的抑制作用。沿着同样的路线,在一项独立研究中,mao,y.及其同事最近证明,用il-4和抗 tcrvδ1mab处理的培养的vδ1
+ t细胞,相对于vδ2
+ t细胞,分泌显著更少的ifn-γ和更多的 il-10。此外,il-4处理的vδ1
+ t细胞表达较低水平的nkg2d,也表明il-4削弱了tcrγδ
+ t细胞介导的抗肿瘤免疫应答。
42
这些观察结果以及近期有关产生白细胞介素-17的vδ1
+ t细胞的肿瘤促进作用的发现(参考文献
43,44
),引起了人们对其应用的担忧,并强调需要对效应物vδ1
+
淋巴细胞进行详细的表征,其可能被认为用于过继性细胞疗法。本领域显然需要能够体外扩增vδ2-γδt细胞,而没有il-4的免疫抑制或抑制作用的方法。
21.最后,几种公开的旨在体外扩增vδ2-γδt细胞的方法,需要有天然或人工饲养细胞,其通常以病毒感染或转化的细胞或细胞系,细菌和寄生虫的形式。这些培养方法更复杂,更容易受微生物污染,更不适合临床应用。
技术实现要素:
22.本发明提供了体外扩增和分化人vδ2-tcrγδ
+ t细胞的新方法,其不需要使用饲养细胞或微生物或病毒组分。首先,本发明人旨在提高培养的vδ2-tcrγδ
+ t细胞的扩增和纯度水平。在存在t细胞有丝分裂原和il-4且不存在il-2,il-7和il-15的情况下,开发了一种新的更有效和选择性的扩增培养细胞的方法。最后,通过另外的体外优化步骤,将获得的vδ2-tcrγδ
+ t 细胞分化为更具细胞毒性的表型。在去除il-4并向培养基中加入t细胞有丝分裂原和il-15,il
‑ꢀ
2或il-7之后,先前获得的vδ2-tcrγδ
+ t细胞产生促炎性细胞因子并表达高水平的激活自然杀伤受体(nkr),其在体外介导肿瘤细胞杀伤。重要的是,注入小鼠中后,分化的tcrγδ
+ t 细胞维持其细胞毒性表型并抑制体内肿瘤生长。
23.本文所述的细胞培养方法非常稳健、高度可重复且与大规模临床应用完全兼容。它产生足够数量的分化的vδ2-tcrγδ
+ t细胞,用于癌症的过继性免疫治疗,以及各种实验、治疗和商业化的应用。
24.因此,在第一方面,本发明提供一种用于扩增和分化样品中的vδ2-tcrγδ
+ t细胞的方法,其包括:
25.(1)在不存在具有白细胞介素-15样活性的生长因子的情况下,在包含t细胞有丝分裂原和至少一种具有白细胞介素-4样活性的生长因子的第一培养基中培养样品中的细胞;和
26.(2)在不存在具有白细胞介素-4样活性的生长因子的情况下,在包含t细胞有丝分裂原和至少一种具有白细胞介素-15样活性的生长因子的第二培养基中培养步骤(1)中获得的细胞。
27.优选地,本发明提供一种用于扩增和分化样品中的vδ2-tcrγδ
+ t细胞的方法,其包括:
28.(1)在不存在白细胞介素-15,白细胞介素-2和白细胞介素-7的情况下,在包含t细
胞有丝分裂原和白细胞介素-4的第一培养基中培养样品中的细胞;和
29.(2)在不存在白细胞介素-4的情况下,在包含t细胞有丝分裂原和白细胞介素-15的第二培养基中培养步骤(1)中获得的细胞。
30.新获得的方法(本文中详述)是基于先前未鉴定的vδ2-tcrγδ
+ t细胞的生物学特性,并且在别处没有描述过。
具体实施方式
31.本发明涉及用于分离和选择性体外/离体扩增和分化vδ2-tcrγδ
+ t细胞的新方法及其临床应用。发明人测试了临床级激动剂抗体和细胞因子的多种组合在培养中扩增和分化(超过2-3 周)外周血vδ2-tcrγδ
+ t细胞的能力。在不存在饲养细胞和微生物来源的分子情况下,在培养中分离和扩增tcrγδ
+ t细胞。发明人已经证明,通过在不存在白细胞介素-2,白细胞介素
‑ꢀ
7和白细胞介素-15的情况下,在包含t细胞有丝分裂原和白细胞介素-4的第一培养基中培养 vδ2-tcrγδ
+ t细胞(在此也称为vδ2-γδt细胞),并且在不存在白细胞介素-4的情况下,在含有t细胞有丝分裂原和白细胞介素-15,白细胞介素-2或白细胞介素-7的第二培养基中传代培养这些细胞,可以在体外选择性地扩增这些细胞。其他关键生长因子如干扰素-γ,白细胞介素-21和白细胞介素-1β也被添加到一个或两种培养基中,以进一步提高培养的vδ2-γδt细胞的扩增和纯度水平。
32.第一培养基支持vδ2-γδt细胞的选择性存活和扩增(在14天内vδ1
+ t细胞增加高达 8,000倍;表3)。重要的是,在培养的最初几天,白细胞介素-2,白细胞介素-7和白细胞介素-15的不存在,有助于污染物细胞(包括tcrαβ
+ t和vδ2
+ t细胞)的饥饿和凋亡,这严重依赖于这些存活的细胞因子。
33.最后,在第二培养基中存在il-2,il-7或il-15且不存在il-4,使得先前选择的vδ2-γδt 细胞群的分化成为可能,其在体外扩增了总共数千倍,并且在培养21天后达到总细胞的>90% (表3和7)。该第二个培养步骤是必须的,以将细胞的生理特性改变为更合适的表型以用作抗肿瘤或抗病毒治疗。在第二个培养步骤后获得的扩增和分化的vδ2-γδtpbls表达高水平的激活自然杀伤受体(nkr),包括nkp30和nkp44,其与t细胞受体协同作用以在体外介导肿瘤细胞的靶向,而不靶向健康细胞。与未治疗的动物相比,扩增和分化的vδ2-γδtpbls细胞在携带肿瘤的免疫缺陷小鼠中的注入,抑制了肿瘤生长并限制了肿瘤向多个器官的传播。在生物化学和组织学分析中没有发现与治疗相关的毒性的证据。重要的是,获得了扩增和分化的vδ2-γδt pbl,其与从健康供体和白血病患者的血液样品中获得的具有相似的功效。最后,本发明公开了使用与工业和临床应用完全相容的材料和试剂分离和培养细胞的方法。首先以适用于临床级细胞分选机(clinimacs;miltenyi biotec,gmbh;germany)的两步方案对 tcrγδ
+ t细胞进行分选。然后,在无血清细胞培养基中用最少的操作培养细胞。将封闭的大的透气塑料细胞培养袋用作细胞培养的接受者,而不是打开的培养板或烧瓶。所有使用的试剂和材料(或等效的试剂和材料)目前都可以获得,并以临床级质量或者良好生产规范 (gmp)质量生产,且不含动物源组分。因此,通过这种方法生产的细胞可以用于各种实验、治疗和商业化应用。
34.第一方面,本发明提供了一种从含有tcrγδ
+ t细胞或其前体的样品中扩增和分化vδ2
‑ tcrγδ
+ t细胞的方法,其包括:
35.(1)在不存在具有白细胞介素-15样活性的生长因子的情况下,在包含t细胞有丝分裂原和至少一种具有白细胞介素-4样活性的生长因子的第一培养基中培养样品中的细胞;在不存在下;和
36.(2)在不存在具有白细胞介素-4样活性的生长因子的情况下,在包含t细胞有丝分裂原和至少一种具有白细胞介素-15样活性的生长因子的第二培养基中培养步骤(1)中获得的细胞。
37.本发明第一方面的方法导致vδ2-tcrγδ
+ t细胞的扩增的细胞群。“扩增”是指最终制备中所需或目标细胞类型的数目高于初始或起始细胞群中的数目。
38.术语“t细胞有丝分裂原”是指可以通过tcr信号刺激t细胞的任何试剂,包括但不限于植物凝集素类,例如植物凝集素(pha)和伴刀豆球蛋白a(cona),和非植物来源的凝集素,激活t细胞的抗体和其他非凝集素/非抗体有丝分裂原。优选的抗体克隆包括抗cd3抗体如okt-3和ucht-1克隆,抗tcrγδ抗体如b1和immu510,或抗tcrvδ1抗体如δtcs1。在本发明的上下文中,抗体被理解为包括单克隆抗体(mabs),多克隆抗体,抗体片段(例如fab和f(ab
′
)2),单链抗体,单链可变片段(scfv)和重组产生的结合伴侣。在一个实施例中,抗体是抗cd3单克隆抗体(mab)。其它有丝分裂原包括佛波醇12-肉豆蔻酸酯-13
‑ꢀ
乙酸酯(tpa)及其相关化合物,如欧亚瑞香脂或细菌化合物(例如葡萄球菌肠毒素a(sea) 和链球菌蛋白a)。t细胞有丝分裂原可以是可溶的或固定的,并且在本发明的方法中可以使用多于一种的t细胞有丝分裂原。
39.在本发明中,清楚地证明了两种不同的细胞因子组,一方面是白细胞介素-4,另一方面是白细胞介素-15,白细胞介素-2和白细胞介素-7,它们在每个培养步骤中必须用于非常特定的目的,且对培养的vδ2-γδt细胞具有相反的作用。基于现在il-4和il-15/il-2/il-7对vδ2-γδt 细胞的作用的研究,对于本领域技术人员来说显而易见的是,这两组细胞因子是具有“白细胞介素-4样活性”或具有“白细胞介素-15样活性”的两组生长因子的示例性成员,其可在本发明的范围内使用。
40.术语“具有白细胞介素-4样活性的生长因子”是指在促进对培养中的vδ2-γδt细胞的相似生理作用的能力方面与il-4具有相同活性的任何化合物,包括但不限于il-4和il-4模拟物或 il-4的任何功能等价物。il-4促进的vδ2-γδt细胞(如本发明所述)的生理作用包括nkg2d 和ncr的表达水平的减少,细胞毒性功能的抑制和选择性存活率的提高。另一组也独立报道了il-4对vδ2-γδt细胞的一些相关活性。在这项研究中,il-4显著抑制了包括来自激活的 tcrγδ
+ t细胞的ifn-γ和tnf-α的促炎性细胞因子的分泌。
45
41.术语“具有白细胞介素-15样活性的生长因子”是指在促进对培养中的vδ2-γδt细胞的相似生理作用的能力方面与il-15具有相同活性的任何化合物,包括但不限于il-15和il-15模拟物或il-15的任何功能等价物,包括il-2和il-7。由il-15,il-2和il-7促进的对培养的vδ2-γδt细胞(如本发明所述)的生理作用基本上相同,即诱导细胞分化为更具细胞毒性的表型,包括nkg2d和ncr(nkp30和nkp44)表达水平的上调,抗肿瘤细胞毒性功能提高和促炎细胞因子如ifn-γ的产生增加。
42.术语“在不存在白细胞介素-15,白细胞介素-2和白细胞介素-7的情况下”和“在不存在白细胞介素-4的情况下”不仅指培养基中完全不存在这些细胞因子,还包括使用这样的细胞因子的浓度水平非常低,以至于它们不能在靶细胞中产生可测量的反应或生理作
用,因此对于实际目的可以认为是不存在的。此外,在本发明的范围内并且根据标准定义,“靶细胞中可测量的生理作用”是指细胞的生理状态的任何可测量的变化。例如,细胞生理状态的变化可以通过其激活状态的变化(通过早期激活细胞标记物cd69的表达水平的上调或下调来识别)来测量;或通过与这些细胞因子接触几小时或几天后,其分化状态的变化(通过nkg2d或ncr的上调或下调来识别)来检测。可测量的生理作用也可以是通过cfse染色或本领域已知的其他技术测量的细胞增殖速率的变化。对于本领域技术人员而言显而易见的是,在第一培养基中培养的细胞不能接受il-2,il-7和il-15或功能相似的生长因子的功能相关的刺激。此外,第二培养基中的细胞不能接受il-4或功能相似的生长因子的功能相关的刺激。优选地,这些细胞因子不能以高于2ng/ml的最终浓度存在于细胞培养基中;更优选不高于1ng/ml,更优选不高于0.1ng/ml,更优选它们不存在。
43.优选地,本发明提供了一种扩增和分化样品中的vδ2-γδt细胞的方法,其包括:
44.(1)在不存在白细胞介素-15,白细胞介素-2和白细胞介素-7的情况下,在包含t细胞有丝分裂原和白细胞介素-4的第一培养基中培养样品中的细胞;和
45.(2)在不存在白细胞介素-4的情况下,在包含t细胞有丝分裂原和白细胞介素-15的第二培养基中培养步骤(1)中获得的细胞。
46.在另一个实施例中,本发明提供了一种用于扩增和分化样品中的vδ2-γδt细胞的方法,其包括:
47.(1)在不存在白细胞介素-15,白细胞介素-2和白细胞介素-7的情况下,在包含t细胞有丝分裂原和白细胞介素-4的第一培养基中培养样品中的细胞;和
48.(2)在不存在白细胞介素-4的情况下,在包含t细胞有丝分裂原和白细胞介素-2的第二培养基中培养步骤(1)中获得的细胞。
49.此外,在另一个实施例中,本发明提供了一种扩增和分化样品中的vδ2-γδt细胞的方法,其包括:
50.(1)在不存在白细胞介素-15,白细胞介素-2和白细胞介素-7的情况下,在包含t细胞有丝分裂原和白细胞介素-4的第一培养基中培养样品中的细胞;和
51.(2)在不存在白细胞介素-4的情况下,在包含t细胞有丝分裂原和白细胞介素-7的第二培养基中培养步骤(1)中获得的细胞。
52.第一或第二培养基,或两种培养基可另外包含其他可有助于vδ2-γδt细胞生长和扩增的成分。可以加入的其它成分的示例包括但不限于,血浆或血清,纯化的蛋白质如白蛋白,脂质来源如低密度脂蛋白(ldl),维生素,氨基酸,类固醇和任何支持或促进细胞生长和/或存活的其他补充剂。
53.第一或第二培养基或两种培养基还可以含有其他生长因子,其包括可以进一步提高vδ2-γδt细胞扩增的细胞因子。这样的细胞因子的示例包括但不限于:(i)干扰素-γ和任何具有干扰素-γ样活性的生长因子,(ii)白细胞介素-21和任何具有白细胞介素-21样活性的生长因子,和(iii)il-1β和任何具有白细胞介素-1β样活性的任何生长因子。可以添加的其他生长因子的示例包括共刺激分子,例如人抗slam抗体,cd27的任何可溶性配体或cd7的任何可溶性配体。在第一或第二培养基中,或者在两种培养基中可以包括这些生长因子的任何组合。
54.术语“具有干扰素-γ样活性的生长因子”是指在促进vδ2-γδt细胞在培养中的存
活或增殖的能力方面与ifn-γ具有相同活性的任何化合物,其包括但不限于ifn-γ和ifn-γ模拟物或ifn
‑ꢀ
γ的任何功能等价物。
55.术语“具有白细胞介素-21样活性的生长因子”是指在促进vδ2-γδt细胞在培养中的存活或增殖的能力方面与il-21具有相同活性的任何化合物,并且其包括但不限于il-21和il-21模拟物或il-21的任何功能等同物。
56.术语“具有白细胞介素-1β样活性的生长因子”是指在促进vδ2-γδt细胞在培养中的存活或增殖的能力方面与il-1β具有相同活性的任何化合物,其包括但不限于il-1β和il-1β模拟物或il-1β的任何功能等价物。
57.具体而言,发明人已经发现,与用一种生长因子获得的扩增相比,向第一或第二培养基或两种培养基添加具有干扰素-γ样活性的第二生长因子,使vδ2-γδt细胞的扩增提高。
58.因此,在一个实施例中,本发明的第一方面的方法包括:
59.(1)在不存在白细胞介素-2,白细胞介素-7和白细胞介素-15的情况下,在包含t细胞有丝分裂原,白细胞介素-4和干扰素-γ的第一培养基中培养样品中的细胞;和
60.(2)在不存在白细胞介素-4的情况下,在包含t细胞有丝分裂原,白细胞介素-15和干扰素-γ的第二培养基中培养步骤(1)中获得的细胞,以扩增和分化vδ2-γδt细胞。
61.优选地,具有ifn-γ样活性的生长因子以约1至约1000ng/ml的量存在。更优选地,该生长因子以约2至约500ng/ml的量存在。更优选地,该生长因子以约20至约200ng/ml的量存在。最优选地,第二培养基包含约70ng/ml的、具有ifn-γ样活性的生长因子,例如ifn-γ。
62.本发明人还发现,与使用一种或两种生长因子获得的扩增相比,向第一或第二培养基或两种培养基中添加具有ifn-γ样活性的第二生长因子和具有il-21样活性的第三生长因子,导致vδ2-γδt细胞的扩增提高。
63.因此,在一个实施例中,本发明的第一方面的方法包括:
64.(1)在不存在白细胞介素-2,白细胞介素-7和白细胞介素-15的情况下,在包含t细胞有丝分裂原,白细胞介素-4,干扰素-γ和白细胞介素-21的第一培养基中培养样品中的细胞;和
65.(2)在不存在白细胞介素-4的情况下,在包含t细胞有丝分裂原,白细胞介素-15和干扰素-γ的第二培养基中培养步骤(1)中获得的细胞,以扩增和分化vδ2-γδt细胞。
66.优选地,具有il-21样活性的生长因子以约1至约500ng/ml的量存在。更优选地,该生长因子以约2至约200ng/ml的量存在。更优选地,该生长因子以约5至约100ng/ml的量存在。最优选地,第二培养基包含约15ng/ml的、具有il-21样活性的生长因子,例如il-21。
67.本发明人还发现,与使用一种、两种或三种生长因子获得的扩增相比,向第一或第二培养基或两种培养基中添加具有ifn-γ样活性的第二生长因子和具有il-21样活性的第三生长因子以及具有il-1β样活性的第四生长因子,导致vδ2-γδt细胞的扩增提高。
68.因此,在一个实施例中,本发明的第一方面的方法包括:
69.(1)在不存在白细胞介素-2,白细胞介素-7和白细胞介素-15的情况下下,在包含t细胞有丝分裂原,白细胞介素-4,干扰素-γ,白细胞介素-21和白细胞介素-1β的第一培养基中培养样品中的细胞;和
70.(2)在不存在白细胞介素-4的情况下,在包含t细胞有丝分裂原,白细胞介素-15,干扰素-γ和白细胞介素-21的第二培养基中培养步骤(1)中获得的细胞,以扩增和分化vδ2-γδt细胞。
71.优选地,具有il-1β样活性的生长因子以约1至约500ng/ml的量存在。更优选地,该生长因子以约2至约200ng/ml的量存在。更优选地,该生长因子以约5至约100ng/ml的量存在。最优选地,第二培养基包含约15ng/ml的具有il-1β样活性的生长因子,例如il-1β。
72.本发明人还发现,与不使用这种分子所获得的扩增相比,向第一或第二培养基或两种培养基中加入共刺激分子,导致vδ2-γδt细胞的扩增提高。
73.因此,在一个实施例中,本发明的第一方面的方法包括:
74.(1)在不存在白细胞介素-2,白细胞介素-7和白细胞介素-15的情况下,在包含t细胞有丝分裂原,白细胞介素-4和cd27的任何分子配体,或slam的任何分子配体或cd7受体的任何分子配体的第一培养基中培养样品中的细胞;和
75.(2)在不存在il-4的情况下,在包含t细胞有丝分裂原和白细胞介素-15的第二培养基中培养步骤(1)中获得的细胞,以扩增vδ2-γδt细胞。
76.术语“分子配体”是指与特异性目标受体(specific target receptor)结合的任何分子或化合物。具体而言,发明人已经发现,添加cd27的可溶性配体或cd7的可溶性配体或slam 的可溶性配体导致vδ2-γδt细胞的扩增提高。这些可溶性配体构成这些分子受体中的每一个的功能性激动剂,并且与这些受体结合的任何类似的激动剂可以诱导对vδ2-γδt细胞的相同作用,例如,激动性抗体如人抗slam抗体,人抗cd27抗体和人抗cd7抗体。
77.在整个培养期间可以进行多个传代培养步骤。例如,前述的各传代培养步骤可以进一步分成两个传代培养步骤(1a)和(1b)以及(2a)和(2b),根据最初描述的方法可以使用不同的成分组合。
78.因此,在一个实施例中,本发明的第一方面的方法包括:
79.(1)在不存在白细胞介素-2,白细胞介素-7和白细胞介素-15的情况下,在包含t细胞有丝分裂原,白细胞介素-4,干扰素-γ,白细胞介素-1β和白细胞介素-21的第一培养基中培养样品中的细胞;和
80.(2a)在不存在白细胞介素-4的情况下,在包含t细胞有丝分裂原,白细胞介素-15和白细胞介素-21的第二培养基中培养步骤(1)中获得的细胞;和
81.(2b)在不存在白细胞介素-4的情况下,在包含t细胞有丝分裂原,白细胞介素-15和干扰素-γ的第三培养基中培养步骤(2a)中获得的细胞,以扩增vδ2-γδt细胞。
82.在另一个实施例中,本发明的第一方面的方法包括:
83.(1a)在不存在白细胞介素-2,白细胞介素-7和白细胞介素-15的情况下,在包含t细胞有丝分裂原,白细胞介素-4,干扰素-γ和白细胞介素-21的第一培养基中培养样品中的细胞;和
84.(1b)在不存在白细胞介素-2,白细胞介素-7和白细胞介素-15的情况下,在包含t细胞有丝分裂原,白细胞介素-4,干扰素-γ和白细胞介素-1β的第二培养基中培养步骤(1a)中获得的细胞;和
85.(2)在不存在白细胞介素-4的情况下,在包含t细胞有丝分裂原和白细胞介素-15的第三培养基中培养步骤(1b)中获得的细胞;以扩增vδ2-γδt细胞。
86.通过本发明的方法获得的tcrγδ
+
t细胞可以用于各种实验、治疗和商业化应用。这包括但不限于,这种细胞后续的的基因修饰或基因编辑,例如以改善其治疗潜力为目的。例如,目的是通过嵌合抗原受体(car)或tcr在这些细胞上的表达来重定向tcrγδ
+
t细胞的特异性。通过tcrγδ
+
细胞的电穿孔来插入遗传物质,或通过用病毒载体(如含有所需遗传物质的慢病毒或逆转录病毒)感染这些细胞,可以诱导car表达。这样的基因编辑可以通过改善归巢、细胞因子的生产、再循环杀伤和/或改善植入,来改善tcrγδ
+
t细胞的潜力。
87.本发明提供了用于在培养中选择性扩增vδ2-tcrγδ
+
t细胞的新方法。本发明第一方面的方法是在样品上进行的,在本文中也称为“起始样品”。该方法可以使用未分级的样品或富集了tcrγδ
+
t细胞的样品。
88.该样品可以是含有tcrγδ
+
t细胞或其前体的任何样品,其包括但不限于血液、骨髓、淋巴组织、上皮细胞、胸腺、肝脏、脾脏、癌组织、淋巴结组织、感染组织、胚胎组织和部分或富集部分。该样品优选为血液,包括外周血或脐带血或其部分,包括血沉棕黄层细胞,白细胞分离产物,外周血单核细胞(pbmc)和低密度单核细胞(ldmc)。在一些实施例中,样品是人血或其部分。可以使用本领域已知的技术如密度梯度离心从血液样品获得细胞。例如,可将全血分层到等体积的ficoll-hypaque
tm
上,然后在室温下以400
×
g离心15-30分钟。界面材料将含有低密度的单核细胞,可将其收集并在培养基中洗涤,并在室温下以200
×
g离心10分钟。
89.在存在血清或血浆的情况下,可以在任何合适的哺乳动物细胞培养基例如aim-v
tm
,rpmi1640,optmizercts
tm
(gibco,lifetechnologies),exvivo-10,exvivo-15或exvivo-20(lonza)中培养或保持分离的或未纯化的tcrγδ
+
t细胞。例如,可以将细胞转移到临床级透气细胞静态培养袋(saintgobain)或miltenyibiotec的临床级细胞培养袋中。将含有细胞和培养基的细胞袋在37℃和5%co2黑暗下置于培养箱中。
90.在第一培养基中培养样品或其部分(例如pbmc)之前,该样品或其部分可以富集某些细胞类型和/或耗尽其他细胞类型。特别地,该样品或其部分可以富集t细胞,或富集tcrγδ
+
t细胞,或耗尽tcrαβ
+
t细胞或耗尽非tcrγδ
+
t细胞。在一个优选的实施例中,样品首先耗尽tcrαβ
+
t细胞,然后富集cd3
+
细胞。
91.可以使用本领域已知的技术使样品富集或耗尽某些细胞类型。在一个实施例中,通过用含有结合至待耗尽细胞的特定分子的抗体的抗体混合物培养样品或其部分,可以耗尽特定表型的细胞。优选地,混合物(cocktail)中的抗体偶联于磁珠,当这些细胞被迫通过磁选柱时,磁珠可用于磁耗尽或富集靶细胞。
92.一旦样品中的细胞被分馏和富集,如果需要的话,在不存在具有白细胞介素-15样活性的生长因子,例如白细胞介素-15,白细胞介素-2和白细胞介素-7的情况下,在含有t细胞有丝分裂原和至少一种具有白细胞介素-4样活性的生长因子如白细胞介素-4的第一培养基中培养细胞。
93.优选地,第一培养基中的t细胞有丝分裂原以约10至约5000ng/ml的量存在。更优选地,该t细胞有丝分裂原以约20至约2000ng/ml的量存在。更优选地,该t细胞有丝分裂原以约50至约1000ng/ml的量存在。最优选地,该培养基含有70ng/ml的t细胞有丝分裂原。
94.优选地,具有白细胞介素-4样活性的生长因子以约1至约1000ng/ml的量存在。更优选地,该生长因子以约5至约500ng/ml的量存在。更优选地,该生长因子以约20至约200
ng/ml的量存在。最优选地,该培养基包含约100ng/ml的具有白细胞介素-4样活性的生长因子,例如il-4。
95.优选在第一培养基中培养细胞约2天至约21天的时间段。更优选地,约3天至约14天。更优选地,约4天至8天。
96.在第一培养基中培养后,在不存在具有白细胞介素-4样活性的生长因子例如il-4的情况下,在包含t细胞有丝分裂原和至少一种具有白细胞介素-15样活性的生长因子如il-15,il-2 或il-7的第二培养基中,将该细胞进行传代培养。如果将细胞进行传代培养,例如在il-15和 il-4都存在的情况下,则增殖继续,但是细胞活力降低,并且位于细胞表面的关键nk受体 (例如nkg2d,nkp30和nkp44)被内化到细胞内部。因此,这些受体不能再与其在肿瘤细胞上表达的配体结合,这降低了这些细胞的抗肿瘤细胞毒活性。
97.传代培养步骤包括在新的培养基中培养步骤1中获得的细胞。这可以通过向第一培养基添加新鲜的培养基来实现,优选在除去一部分第一培养基之后。这可以通过离心和/或倾析细胞,除去一部分第一培养基并在第二培养基中重悬细胞来完成。优选地,传代培养步骤涉及除去至少3/4的第一培养基。应该进行传代培养步骤,因为对于vδ2-γδt细胞的扩增和分化来说,在传代培养步骤中除去具有白细胞介素-4样活性的生长因子是重要的。
98.优选地,在第二培养基中,该t细胞有丝分裂原以约0.1至约50μg/ml的量存在。更优选地,该t细胞有丝分裂原以约0.3至约10μg/ml的量存在。更优选地,该t细胞有丝分裂原以约0.5至约5μg/ml的量存在。最优选地,该培养基包含1μg/ml的t细胞有丝分裂原。
99.优选地,具有白细胞介素-15样活性的生长因子,例如il-15,il-2或il-7以约1至约 1000ng/ml的量存在。更优选地,该生长因子以约2至约500ng/ml的量存在。更优选地,该生长因子以约20至约200ng/ml的量存在。最优选地,第二培养基包含约70ng/ml的具有白细胞介素-15样活性的生长因子,例如il-15,il-2或il-7。
100.优选在第二培养基中培养细胞约2天至约30天的时间段。更优选地,约5天至约21天。更优选地,约10天至15天。
101.优选地,在本发明的第一方面,第一和第二培养基都补充有血清或血浆。第一和第二培养基中的血浆量优选为约0.5vol%至约25vol%,例如约2vol%至约20vol%或约2.5vol%至约 10vol%,例如约5vol%。可以从任何来源获得血清或血浆,包括但不限于人外周血、脐带血或来自另一种哺乳动物物种的血液。血浆可以来自单个供体,或可以来自多个供体。如果临床使用自体tcrγδ
+ t细胞,即回输到获得原始样品的同一患者中,那么优选也使用自体血浆 (即来自同一患者)以避免向患者引入有害产物(如病毒)。血浆应该是人源的,以避免给患者服用动物产品。
102.可以使用包括荧光激活细胞分选、免疫磁性分离、亲和柱色谱、密度梯度离心和细胞筛选的本领域已知的技术,来将根据本发明的第一方面的方法获得的tcrγδ
+ t细胞与最终培养物中可能存在的其他细胞分离。
103.通过本发明的第一方面的方法获得的tcrγδ
+ t细胞也是有用的。因此,本发明人描述了tcrγδ
+ t细胞的细胞制剂。
104.在第二方面,本发明提供一种富含根据本发明第一方面的方法制备的tcrγδ
+ t细胞的细胞制剂。
105.在第三方面,本发明提供一种富含tcrγδ
+ t细胞的细胞制剂,其中总细胞的大于
80%是 tcrγδ
+ t细胞。
106.优选地,在本发明的第二和第三方面,tcrγδ
+ t细胞在富集群中占总细胞的大于80%,更优选大于90%,最优选大于95%。
107.通过本发明的第一和第二方面的方法获得的tcrγδ
+ t细胞可以用于任何和所有的应用。 tcrγδ
+ t细胞被认为是针对传染性病原体的第一道防线。另外,tcrγδ
+ t细胞对各种来源 (包括b细胞淋巴瘤、肉瘤和癌)的转化细胞具有内在的细胞溶解活性。结果,根据本发明的方法获得并离体培养的tcrγδ
+ t细胞可以输注到患者体内,用于治疗或预防由免疫抑制引起的感染、癌症或疾病。
108.因此,在第四方面,本发明提供一种调节免疫应答的方法,包括将有效量的、根据本发明的第一或第二方面的方法制备的或者根据本发明的第二或第三方面从细胞制剂获得的 tcrγδ
+ t细胞给药至有需要的动物。
109.本文所用的术语“有效量”是指在达到所需结果一段时间内的剂量的有效量。
110.本文所用的术语“动物”包括动物界的所有成员。优选地,动物是哺乳动物,更优选地是人。
111.在第五方面,本发明提供一种治疗感染的方法,包括将有效量的、根据本发明的第一或第二方面的方法制备的或者根据本发明的第二或第三方面从细胞制剂获得的tcrγδ
+ t细胞给药至有需要的动物。
112.可以治疗的感染的例子,包括但不限于,例如由分枝杆菌引起的细菌感染(例如结核病),例如如由单纯疱疹病毒(hsv)、人免疫缺陷病毒(hiv)或肝炎病毒引起的病毒感染,和由例如疟原虫引起的寄生虫感染(例如疟疾)。
113.在第六方面,本发明提供一种治疗癌症的方法,包括将有效量的、根据本发明的第一或第二方面的方法制备的或者根据本发明的第二或第三方面从细胞制剂获得的tcrγδ
+ t细胞给药至有需要的动物。
114.可以治疗的癌症的例子,包括但不限于,白血病,其包括慢性淋巴细胞白血病、慢性骨髓性性白血病、急性骨髓性白血病、急性淋巴细胞白血病和t细胞和b细胞白血病;淋巴瘤 (霍奇金和非霍奇金病);淋巴组织增生性疾病;浆细胞瘤;组织细胞瘤;黑色素瘤;腺瘤;肉瘤;固体组织癌;低氧肿瘤;鳞状细胞癌;泌尿生殖系统癌症如宫颈癌和膀胱癌;造血系统癌症;头颈部癌症和神经系统癌症。
115.在一个实施例中,待治疗的癌症是慢性淋巴细胞白血病。在这样的一个实施例中,可以从患有慢性淋巴细胞白血病(cll)的患者获得pbmcs。在培养和扩增tcrγδ
+ t细胞之后,扩增的细胞将不会显著地包含癌性cll细胞,使得它们非常适合于重新输注回患者体内。
116.本发明的这些方面,还延伸至tcrγδ
+ t细胞在调节免疫应答、治疗感染或治疗如上所述的癌症的方法中的应用,tcrγδ
+ t细胞是通过本发明的第一或第二方面的方法获得的或从根据本发明的第二或第三方面的细胞制剂获得的。本发明还包括根据本发明第一或第二方面的方法获得的tcrγδ
+ t细胞在制备药品或药物组合物中的用途,以调节免疫应答、治疗感染或治疗如上所述的癌症。
117.根据本发明获得的tcrγδ
+ t细胞也可以用于实验模型中,例如以进一步研究和阐明细胞的功能。另外,这些细胞可以用于针对tcrγδ
+ t细胞识别的抗原/表位的鉴定研
(1)t细胞有丝分裂原,(2)具有白细胞介素-2样活性的生长因子和(3)具有白细胞介素-7样活性的生长因子的第一培养基中,培养起始样品中的tcrγδ
+
t细胞。然后在包含(1)具有白细胞介素-2样活性的生长因子和(2)具有白细胞介素-7样活性的生长因子的第二培养基中,培养第一步获得的细胞以扩增tcrγδ
+
t细胞。
126.相反,本发明是不同的,由于两个培养步骤具有不同的目的,故二者必然是不同的。由于已经解释的原因(参见上文),本发明清楚地排除了在第一培养步骤中使用具有白细胞介素-2样活性或白细胞介素-7样活性的生长因子。虽然本发明描述了在第一和/或第二培养基中存在其他生长因子,包括细胞因子如干扰素-γ,il-1β和il-21,但是这些细胞因子不能被认为具有白细胞介素-2样活性或白细胞介素-7样活性,因为它们对vδ2-γδt细胞的生理作用是非常不同的。例如,在干扰素-γ,il-1β和il-21(不存在il-2,il-7和il-15)存在的情况下培养的细胞不能获得其完全的细胞毒性作用和分化状态,因此干扰素-γ,il-1β和il-21不能模拟由il-2,il-7和il-15诱导的对培养的vδ2-γδt细胞的高度促炎作用(表2)。此外,这些细胞因子中的一些,如干扰素-γ和il-1β属于结构上不同的细胞因子家族。
127.下面将参照以下实施例和附图来描述本发明。
附图说明
128.图1展示了在磁激活细胞分选(macs)前后,从健康供体采集的外周血液样品中tcrγδ
+
tpbls的百分比。从一个健康志愿者获得50-150ml新鲜外周血并用pbs(invitrogengibco)以1∶1比例(体积比)稀释,并在ficoll-paque(histopaque-1077;sigma-aldrich)中以体积比为1∶3(1份聚蔗糖与3份稀释的血液)在1,500rpm和25℃下离心35分钟。收集含有单核细胞(pbmcs)的间期并洗涤(在pbs中)。全部tcrγδ
+
t细胞用偶联至磁珠的抗tcrγδmab标记,并用磁选柱(miltenyibiotec,德国)分离tcrγδ
+
t细胞(至大于75%纯度)。用以下荧光单克隆抗体标记细胞:抗cd3-percp-cy5.5(biolegend;克隆sk7);抗tcr-vδ1-apc(miltenyibiotec,克隆rea173);抗小鼠igg1κ-apc同种型对照(miltenyibiotec;克隆is5-21f5)。在fortessii流式细胞仪(bdbiosciences)上分析细胞。展示6个独立实验的代表性结果。
129.图2展示了在两步macs分选程序前后,从健康供体采集的外周血液样品中tcrγδ
+
tpbls的百分比。从健康志愿者获得50-150ml新鲜外周血并用pbs(invitrogengibco)以1∶1比例(体积比)稀释,并在ficoll-paque(histopaque-1077;sigma-aldrich)中以体积比为1∶3(1份聚蔗糖与3份稀释的血液)在1,500rpm和25℃下离心35分钟。收集含有单核细胞(pbmcs)的间期并洗涤(在pbs中)。然后通过在偶联至生物素的鼠抗人tcrαβ单克隆抗体(mab)(miltenyibiotecref#701-48,克隆bw242/412)的存在下进行孵育,来标记不需要的tcrαβ+t淋巴细胞。然后用偶联至磁珠的鼠抗生物素mab(miltenyibiotecref#173-01)再次标记细胞。最后,将细胞悬浮液加载到磁选柱(miltenyibiotec,德国)上,并将tcrαβ
+
t淋巴细胞磁耗尽(并丢弃)。用偶联至超顺磁性葡聚糖铁颗粒的鼠抗人cd3mab(miltenyibiotecref#273-01,克隆okt-3,靶向位于cd3ε链上的表位),标记存在于剩余细胞群中的cd3
+
细胞(其中大部分是tcrγδ
+
t细胞)。将细胞加载到磁性macs分离柱上,并正向选择(纯化)cd3
+
细胞。将细胞进行染色用于tcrγδ,cd3,tcrvδ1和tcrvδ2标记,并在
fortessaii流式细胞仪(bdbiosciences)上分析。展示6个独立实验的代表性结果。
130.图3展示了测试的培养条件的总结。a-c.如前所述,通过macs分离来自健康供体的tcrγδ
+
pbls,并在补充有5%人血清,1mml-谷氨酰胺的完全培养基(optmizercts,gibco)中以100万细胞/ml在96孔板中于37℃和5%co2下培养。通过多孔平均分配细胞,并在存在三种抗-cd3mab和il-4的固定组合的情况下培养,进一步补充不同浓度的il-2,il-7,il-15或ifn-γ。每隔5-6天加入补充有相同生长因子的新鲜培养基。在培养期结束时,进行细胞计数并通过流式细胞术分析细胞表型。每种生长因子分别以500ng/ml至0.1ng/ml的系列稀释度使用。图表显示对于每种细胞因子(il-2,il-7,il-15和ifn-γ),获得的最佳培养条件(即,vδ1
+
细胞的最高倍扩增)。对照样品仅含有il-4和抗cd3mab。d.通过macs用来自相同供体的外周血的抗人cd3mab(与顺磁珠偶联)分离全部cd3
+
pbls,并如前所述进行培养和分析。展示了3个技术重复的平均值
±
sd。使用graphpad-prism软件进行统计分析。使用studentt检验评估子群之间的差异,并且在图中以
*
p<.05;
**
p<.01;和
***
p<.001表示其显著性。
131.图4展示了在体外培养15天前后的vδ1
+
tpbls的百分比。如前所述,通过macs分离来自健康供体的tcrγδ
+
pbl,并在200ng/mlifn-γ,1ug/mlα-cd3和100ng/mlil-4存在的情况下培养。每隔5-6天添加一部分含有相同生长因子组合的新鲜培养基。展示了第15天的facs图分析。3个独立实验的代表性结果。
132.图5展示了一组测试的细胞培养基。如先前所述通过macs分离来自健康供体的tcrγδ
+
tpbls,并在不同的市售无血清临床级细胞培养基进行培养。在存在70ng/mlifn-γ,1μg/mlα-cd3和100ng/mlil-4的情况下,在第一培养基中培养细胞,然后在存在100ng/mlil-15和2μg/ml抗cd3mab(不存在il-4)的情况下,在第二培养基中培养。展示了在第15天进行facs分析后细胞的最终数目和细胞百分比。展示了3个技术重复的平均值
±
sd。
133.图6展示了vδ1
+
t细胞在培养中体外扩增以成为主要细胞亚群。从8个健康供体中收集的8个血沉棕黄层单元,获得70ml浓缩外周血(对应于450ml外周血)。将血液未经稀释在ficoll-paque(histopaque-1077;sigma-aldrich)中以1∶3的体积比(1份聚蔗糖与3份血液)在1,600rpm和25℃下离心35分钟。收集含有单核细胞(pbmcs)的间期并洗涤(在盐水缓冲液中)。通过先前描述的2步macs分离tcrγδ
+
pbl,并在补充有5%自体血浆和1mml-谷氨酰胺的无血清培养基(optmizer,gibco)中重悬。将细胞以0.5
×
106个细胞/ml的浓度接种,并在37℃和5%co2的培养箱中的封闭的透气的1l细胞培养塑料袋中扩增。根据之前描述的两步方案将生长因子添加到细胞培养基中:向第一培养基中加入70ng/ml抗cd3mab,100ng/mlil-4,70ng/mlifn-γ,7ng/mlil-21和15ng/mlil-1β,向第二培养基中加入70ng/mlil-15,100ng/mlifn-γ,15ng/mlil-21和1μg/ml抗cd3mab。每隔5-6天,除去一部分旧培养基并添加补充生长因子的新鲜培养基。在这个系统中不需要辅料“饲养层”细胞。右图显示通过流式细胞术分析的总活细胞中cd3
+
vδ1
+
细胞的百分比。左图显示cd3
+
vδ1
+
t细胞的绝对数量相对于起始细胞数量的倍数增加。在血球计中使用台盼蓝阳性排除计数活细胞。展示了细胞数量的3次测量的平均值。
134.图7展示了几种细胞表面标记物在体外扩增的vδ1
+
t细胞中的表达。在培养16天后,激活受体nkp30,nkp44和nkg2d在cd3
+
vδ1
+
t细胞中的表达(如表8中所示)。还展示了同
种型mab对照染色(注意nkp30和nkp44表达的对照是相同的)。
135.图8展示了体外扩增的tcrγδ
+ t细胞对cll细胞具有细胞毒性,但对自体pbmcs不具有细胞毒性。扩增和分化21天后(如图6所示),将所得tcrγδ
+ t细胞与靶细胞(用 ddao-se预标记)在37℃下共孵育3小时,并通过膜联蛋白v染色评估靶细胞的死亡。(a) 易感mec-1 cll细胞(上图)和非易感自体pbmcs(下图)的流式细胞术分析。3个技术重复的代表性图。(b)不同靶:效应细胞比例和针对nkg2d或nkp30的阻断抗体对mec-1 白血病细胞杀伤的影响。误差线表示sd(n=3,
*
p<.05)。(c)供体a的扩增的(和分化的)tcrγδ
+ t细胞(本文称为“dot-细胞”)与三种b-cll原代细胞样品(从cll/sll患者的外周血中收集并且通过macd富集cd19)或与自体健康的pbmcs共孵育。展示3个技术重复的平均值
±
sd。
136.具体方法:mec-1 cll细胞系
46
获得自德国生物材料资源中心(dsmz)。在含有10%胎牛血清,2mm l-谷氨酰胺的完全10%rpmi 1640的t25烧瓶中培养mec-1肿瘤细胞,并通过稀释保持在105至106个细胞/毫升,并每隔3-4天以1∶3的比例分割。对于细胞毒性测定,将体外扩增的tcrγδ
+ t细胞铺在96孔圆底板中。用celltrace far red ddao-se(1μm; molecular probes,invitrogen)将肿瘤细胞系或白血病原始样品染色,并在存在70ng/ml il-15 的情况下,在rpmi 1640培养基中,以指定的靶:效应物比例与tcrγδ
+ t细胞于37℃和5% co2下孵育3小时。然后所有细胞用膜联蛋白v-fitc(bd biosciences)染色并通过流式细胞术分析。
137.图9展示了激活的tcrγδ
+ t细胞产生高水平的ifn-γ。如前所述,在细胞培养袋中从两个健康供体产生tcrγδ
+ t细胞21天后,进行两步培养方案。将细胞洗涤,铺在96孔板中,并用补充了100ng/ml il-15和2μg/ml抗cd3mab的新鲜培养基再刺激细胞。48小时后,通过流式细胞术通过流式微珠阵列(bd biosciences)分析细胞培养上清液。optmizer是指保持在没有补充激活化合物的培养基中的细胞。展示3个技术重复的平均值
±
sd。误差线表示sd(n =3,
**
p<.01)。
138.图10展示了来自cll/sll患者的tcrγδ
+ t细胞在体外稳定扩增,并且对cll/sll细胞和cmv感染的细胞具有高度细胞毒性。如前所述,用细胞因子和mab将来自三名 cll/sll患者的macs分选的tcrγδ
+ pbls培养21天。左图:通过流式细胞术分析细胞用于tcrvδ1/cd3共表达,并计算cd3
+
vδ1
+ t细胞的倍数增加。用活性染料(zombie violet; biolegend)通过流式细胞术识别活细胞,并在血球计中用台盼蓝计数。右图:在96孔板中,以1∶10的靶-效应物比例将来自cll/sll患者的tcrγδ
+ t细胞与具有cll/sll源的mec-1 细胞或与人包皮成纤维细胞(ffb)共培养3h(健康的或先前感染过yfp
+
巨细胞病毒株 ad169(moi 0.005);误差线代表sd(每组n=3)))。在每个组中,用dot细胞孵育之前死亡肿瘤细胞的百分比约为20%。sll是小淋巴细胞性淋巴瘤。
139.图11展示了体外扩增的tcrγδ
+ t细胞对不同组织来源的癌细胞具有细胞毒性。根据所述的两步培养方案,将来自一位健康供体的外周血tcrγδ
+ t淋巴细胞进行macs分选,并在细胞因子和抗cd3mab存在的情况下离体刺激21天。在96孔板中,将细胞与一组肿瘤细胞系:molt-4(急性淋巴细胞白血病;all);hl-60(急性骨髓性白血病;aml);k562 (慢性骨髓性白血病;cml);mec-1(慢性淋巴细胞白血病;cll);hela(宫颈癌); daudi(伯基特淋巴瘤);thp-1(急性单核细胞白血病;amol);mda-231(乳腺癌), pa-1(卵巢癌);pc3(前列腺癌)和hct116(结肠癌)共孵育3小时。通过膜联蛋白-v 染色评估肿瘤细胞的死亡(n=3个技
术重复)。
140.图12展示了注入的tcrγδ
+
t细胞在异种移植肿瘤模型中归巢并存活。a.将2
×
107个tcrγδ
+
t细胞转移到荷瘤的(mec-1cll\sll细胞系)nsg免疫缺陷宿主中。在转移tcrγδ
+
t细胞30天后,处死动物,并通过facs在所示组织中评估tcrγδ
+
t细胞-子代。注意tcrγδ
+
t细胞存在于所有分析的组织中,并且cd3
+
vδ1
+
t细胞高度富集,这表明cll肿瘤存在时的优先适应性和/或激活。点状图来自所分析的6只动物中的代表性动物。b.注入的tcrγδ
+
t细胞在体内表达ncr。在转移后第30天从肝脏中回收的tcrγδ
+
t细胞通过facs分析用于ncr表达。注意nkp30和nkg2d的高表达。顶部点状图是同种型对照。展示了所分析的3只动物的代表性动物。c.注入的tcrγδ
+
t细胞能够归巢到brg免疫缺陷宿主中。将来自不同供体的107个tcrγδ
+
t细胞转移至cll荷瘤brg宿主中,并在转移后72小时通过facs进行定量。tcrγδ
+
t细胞可从肺和肝脏中回收,发现tcrvδ1
+-表达细胞的比例与初始转移相似。展示了两个中的一个动物。
141.图13展示了tcrγδ
+
t细胞可以限制肿瘤体内生长。将107个萤光素酶表达mec-1cll/sll肿瘤细胞皮下转移到免疫缺陷的brg宿主中。转移10和15天后,将107个tcrγδ
+
t细胞或对照pbs静脉注射转移到cll荷瘤宿主中,如通过发光分析所验证的。使用卡尺定期测量cll/sll肿瘤生长。展示了肿瘤大小,注意在cll肿瘤大小中可见的tcrγδ
+
t细胞的作用(n=每组8只小鼠)。
142.图14展示了tcrγδ
+
t细胞限制cll肿瘤扩散。a.将107个表达萤光素酶的mec-1cll/sll肿瘤细胞皮下转移到免疫缺陷的nsg宿主中。转移后10和15天,tcrγδ
+
t细胞(2
×
107)或对照pbs静脉注射转移到cll/sll荷瘤宿主中,如通过发光分析所验证的。使用卡尺定期测量cll/sll肿瘤生长。展示了肿瘤大小,注意处理早期的部分和暂时趋势,但是tcrγδ
+
t细胞不能限制大块cll/sll肿瘤在这些宿主中更快生长。b-d.在这些实验中,cll/sll肿瘤系能够扩散到其他器官。b中显示的图描述了在实验结束时从接受tcrγδ
+
t细胞转移或对照pbs的nsg宿主回收的器官的facs分析。我们观察到在不同器官中回收的cll/sll肿瘤细胞普遍减少,但是在这个模型中,这种作用在肝脏中更显著,肝脏是肿瘤扩散的主要器官。c.来自每个组的代表性动物的组织学(h&e)分析,显示了在pbs处理的动物的指定解剖部位的cll/sll肿瘤转移,以及在处理的动物中不存在肿瘤浸润。(*p<0.05;**p<0.01)。d.展示了组织学分析总结,描述了来自发现有cll/sll肿瘤浸润的组的动物和没有肿瘤浸润的动物。由认证的病理学家对来自图15所述实验中的动物的指定组织的h&e染色的组织学样品进行盲评。展示了所有分析的动物的结果,并展示了在用体外扩增的tcrγδ
+
t细胞处理的动物组中,整体肿瘤扩散明显减少。
143.图15展示了tcrγδ
+
t细胞可以浸润原发性肿瘤并在体内激活。a.描述了来自用mec-1肿瘤细胞转移并用tcrγδ
+
t细胞处理的nsg动物的原发性cll/sll肿瘤的cd3染色切片的ihc分析。b.我们分析了不同器官中的cd69(n=3,展示了代表性点状图),nkp30和nkg2d体内表达(n=2),并发现了最近激活的tcrγδ
+
t细胞,其中这些激活标记物在从cll/sll肿瘤中回收的tcrγδ
+
t细胞中主要表达。
144.图16展示了血液样品的生化分析。(a)在尸体剖检时从图14所示的实验的动物收集血液,并对丙氨酸转氨酶(alt/gpt)、天冬氨酸转氨酶(ast/got)、血尿素氮(bun)、肌酸酐(creatinin)、肌氨酸磷酸激酶(cpk)和乳酸脱氢酶(ldh)进行生化分析。(b)对于图11所示
的动物,与a相同。我们没有发现与dot细胞处理相关的毒性的证据。
145.体内研究的具体方法:
146.从taconic(usa)获得balb/c rag-/-γc-/-47
动物;从jackson laboratories(usa)获得nod
‑ꢀ
scidγc-/-48
小鼠。对brg或nsg小鼠皮下注射mec-1细胞,并在6和11天后用两次静脉转移的 107或2
×
107个dot细胞进行处理,然后详细分析(肿瘤大小、组织学、肿瘤或器官浸润的流式细胞术和血液生化)。所有的动物手术都是根据geral deveterin
á
ria的国家指导方针进行的,并经相关的伦理委员会批准。对于体内dot-细胞转移后的表型分型,使用eutasil使动物安乐死,以便通过心脏穿刺收集血液;并迅速灌注pbs+肝素。将器官匀浆并在70μm细胞过滤器中洗涤。冲洗股骨,然后过滤。然后用来自ebioscience,biolegend,myltenyi biotec或 beckton dickinson的以下抗体对细胞进行染色:抗小鼠cd45(30-f11)和抗人:cd45 (hi30)。使用的其他抗体在体外研究中是常见的。将抗体偶联至fitc,pe,percp,percp
‑ꢀ
cy5,pe-cy7,apc,apc-cy7,pacific blue,brilliant violet 421和brilliant violet 510荧光染料。使用graphpad-prism软件进行统计分析。采用非成对student
′
s t-检验比较样品均值。如果使用f检验发现两个样品的差异是不同的,则对数据进行对数转换,并且如果发现差异没有不同,则将该非成对t检验应用于该对数转换的数据。对于存活数据,使用时序(log-rank) (mantel-cox)检验。
147.体内实验设计:我们使用先前描述的异种移植人类cll模型将cll/sll源mec-1细胞皮下过继转移到balb/c rag-/-γc-/-(brg)动物中的,我们进一步适应使用nod-scidγc-/-(nsg) 动物作为宿主。为了确保接受治疗的动物或pbs对照是携带肿瘤的动物,我们用萤火虫荧光素酶转导mec-1cll细胞,以在治疗细胞归属之前的早期时间点检测和测量肿瘤移植。7或4 天后(在不同的研究中),在将治疗(或pbs对照)归因于动物之前,我们腹腔内注射荧光素以确定肿瘤负荷是发光的函数。根据第7天测出的发光,将动物随机分配到笼中并分配给每种治疗(pbs或dot细胞),使得具有最高发光的动物接受治疗,第二高的接受pbs,第三高的接受治疗等。这导致非随机分配到组中,但在不同的笼中随机分配。另外2只在指定的实验中接受dot-细胞的动物用于初始归巢分析。我们进行了两次107或2
×
107个dot细胞转移 (在5天内),每个实验使用来自一个不同供体的细胞。使用卡尺测量肿瘤,并进行三次垂直测量。使用的公式是1/2x l
×w×
h。
49
当肿瘤测量达到1000mm3时,处死动物。
148.发光分析:在用gfp-萤火虫萤光素酶转导mec-1细胞系后,使用facs-aria(bectondickinson,usa)并根据gfp表达筛选和分选生长细胞,直至>95%的gfp阳性细胞。然后将这些细胞保持培养,直到皮下转移到宿主动物中(在50μlpbs中)。在转移后的指定时间点,将动物麻醉(氯胺酮/美托咪啶)并注射荧光素(腹腔内)。4分钟后,在imm生物成像设备中使用ivis lumina(calliper lifesciences)检测和获得萤光素酶活性。然后麻醉恢复,动物回到以前的住房。
149.淋巴细胞计数:用血球计或使用accuri流式细胞仪(becton dickinson,usa)进行细胞计数。当抽取一部分器官样品进行组织学分析时,通过在样品分裂前后称量器官来估计每个器官的计数。然后针对整个器官对展示的数字进行校正。在骨髓数据中,针对一个股骨计算并显示绝对数。
150.病理组织学和免疫组织化学:用麻醉剂过量处死小鼠,进行尸体解剖,收获选定的器官 (肺、心脏、肠、脾、肝、肾、生殖道、脑、小脑、脊髓和股骨),固定在10%的中性缓冲福尔
马林中,石蜡包埋,并用苏木精和伊红(h&e)对3μm的切片染色。在包埋之前,将骨头在calci-clear
tm
(fisher scientific)中进一步脱钙。由不知道实验组的病理学家,在与leicamc170hd显微镜相机连接的leica dm2500显微镜中,检查组织切片。由imm的组织学和比较病理学实验室使用标准方案,使用dako autostainer link 48,进行cd3的免疫组织化学染色(dako,目录号a0452)。在dako pt link中用低ph溶液(ph 6)进行抗原热修复,并用envision试剂盒(过氧化物酶/dab检测系统,dako,santa barbara,ca)孵育,然后用harri
′
s苏木精复染(bio otica,milan,it)。阴性对照包括缺乏一抗;在阴性对照中未观察到cd3染色。在与leica mc170高清显微镜照相机连接的leica dm2500显微镜中获得图像。
151.小鼠血液生化:将小鼠深度麻醉,从心脏收集血液到肝素涂层管,送去进行独立实验室显示的生化参数分析。
152.在rx摩纳哥临床化学分析仪(randox)中,测量血清的生化参数。
153.图17展示了两步macs分选后tcrγδ
+ pbl的富集。从4名健康志愿者收集外周血 (获自血沉棕黄层),通过macs分离全部tcrγδ
+ t细胞:首先,进行tcrαβ消耗,然后正向选择cd3
+
细胞。对细胞进行tcrγδ,cd3和tcrvδ1的染色,并通过流式细胞术进行分析。点状图展示了在每个macs分选步骤前后的tcrγδ
+ pbl的部分(左图);以及vδ1
+ t 细胞的初始和最终百分比(右图)。
154.图18展示了所获得的vδ1
+ t细胞的激活和成熟表型的表征。(a)培养第21天时的 vδ1
+ t细胞的细胞表面表型(实线)与新鲜分离的vδ1
+ t细胞(虚线)的流式细胞术比较 (使用前述的2步培养方案),如使用legendscreen试剂盒(biolegend)所分析的。所展示的是与淋巴细胞激活和分化有关的几种标记物以及涉及粘附和迁移的标记物的直方图叠加。展示了来自一个健康供体的细胞。(b)与新鲜分离的vδ1
+ t细胞(来自供体1和2)相比,表示由4个不同健康供体(培养1-4)产生的、培养的vδ1
+ t细胞(在培养第21天)的各表面标记物的阳性细胞百分比的热图。颜色代码显示在右侧。对于细胞生产后的表型:使用 legendscreen试剂盒(biolegend),用抗cd3-apc(克隆ucht1),抗tcrvδ1-fitc和一组受体对细胞进行染色。
155.图19展示了tcrγδ
+ t细胞对白血病(但不健康)细胞的tcr/ncr依赖性细胞毒性。在不同的实验中,针对mec-1(cll)靶细胞以增加的效应物/靶比例(左图,灰色条),以及在单独(实施例1)或组合(实施例2)存在(α,抗)所示分子的阻断抗体的情况下,检验从两个健康供体产生的扩增和分化的tcrγδ
+ t细胞(使用先前描述的两步培养方案)。在阻断实验中使用最高的效应物/靶比例(10∶1),并以该比例的灰色条(具有igg同种型抗体) 作为对照。展示了死亡(膜联蛋白-v
+
)mec-1靶细胞的百分比。
*
和
#
分别表示相对于igg同种型对照或α-tcrvδ1的显着差异(平均值
±
sd;*,
#
p<0.05;**,
##
p<0.01;student
′
s t-检验)。
156.对于细胞毒性测定,将mec-1肿瘤细胞在含有10%胎牛血清,2mm l-谷氨酰胺的完全 10%rpmi 1640中的t25烧瓶中培养,并通过稀释保持在105至106个细胞/毫升,并每隔3-4 天以1∶3的比例分割。将体外扩增的tcrγδ
+ t细胞铺在96孔圆底板中。用celltrace farred ddao-se(1μm;molecular probes,invitrogen)将肿瘤细胞染色,并在37℃和5%co2下,在存在70ng/ml il-15的情况下,在rpmi 1640培养基中与tcrγδ
+ t细胞以指定的靶:效应物比例孵育3小时。为了受体的阻断,将γδpbl与阻断抗体预孵育1小时,该阻断抗体为:人抗tcrγδ(克隆b1);人抗-nkg2d(克隆1d11);人抗cd2(克隆rpa-2.10);人抗cd3(克隆
okt-3);人抗nkp30(克隆p30-15);人抗nkp44(克隆p44-8),小鼠 igg1,k(克隆mopc-21),小鼠igg2b(克隆mpc-11),小鼠igg3k(克隆mg3-35),这些全部来自biolegend。人抗cd226(克隆dx11)来自bd biosciences。人抗vδ1tcr(克隆 tcs-1或ts8.2)来自fisher scientific,人抗tcrγδ(克隆immu510)来自bd biosciences。在杀伤测定过程中,将阻断抗体保持在培养基中。
157.最后,用膜联蛋白v-fitc(bd biosciences)对所有细胞染色并通过流式细胞术分析。
158.图20展示了激活的细胞表面nk受体在体外扩增的vδ1
+
和vδ1-vδ2-t细胞中的表达。使用先前描述的两步培养方案,从健康供体产生扩增和分化的tcrγδ
+ t细胞。展示了培养21 天后,激活受体nkp30和nkp44在cd3
+
vδ1
+
细胞和cd3
+
vδ1-vδ2-t细胞中的表达。首先,识别(用偶联至荧光染料的抗cd3和抗vδ2 mabs)cd3
+
vδ2
+
细胞并从分析中排除。分析剩余的cd3
+
细胞的vδ1和nkp30,nkp44和同种型对照的表达。展示了4个不同的供体的4个独立实验的代表性结果。
159.图21展示了tcrγδ+ t细胞的扩增的vδ1-vδ2-t细胞亚群对白血病细胞的细胞毒性。用偶联至荧光染料的单克隆抗体对从一个健康供体产生的扩增和分化的tcrγδ
+ t细胞(使用先前描述的两步培养方案)进行染色,用于cd3、vδ1和vδ2t细胞标记物,并通过流式细胞术分离cd3
+
vδ1-vδ2-t细胞群。然后在体外杀伤测定中,针对急性骨髓性白血病(aml)靶细胞系(kg-1,thp-1,hl-60和nb-4)以10∶1的效应物/靶细胞比例测定分离的细胞。如前所述进行杀伤测定。
160.表:
161.表1描述了在优化阶段用于刺激vδ1
+ t细胞增殖的分子。试剂的使用浓度为0.1ng/ml至 80μg/ml。右侧的栏显示了试剂经销商或制造商。
162.表2展示了测试培养条件的总结。通过macs从健康供体分离tcrγδ
+ pbls,并于37℃和5% co2下,在96孔板中以1百万细胞/ml培养。将细胞在补充有5%自体血浆,1mm l-谷氨酰胺和所述生长因子的完全培养基(optmizer cts,gibco)中进行扩增。在培养期结束时,进行细胞计数并通过流式细胞术分析细胞表型。展示了4个连续实验的选定结果。每个实验中最好的培养条件按倍数增加排列。vδ1
+ t细胞的倍扩增率计算为:(培养结束时vδ1
+ t细胞的绝对数量)/(培养第0天的vδ1
+ t细胞的绝对数量)。展示了2个独立实验的代表性结果。
163.表3展示了测试培养条件的总结。通过macs从健康供体分离tcrγδ
+ pbls,并在存在所述生长因子的情况下培养14天。在培养的第14天,将细胞分割:如前所述培养一部分细胞,而另一部分细胞在不存在il-4和存在指定的生长因子的情况下培养。在第21天,对细胞进行计数,并通过facs分析细胞表型。展示了2个独立实验的代表性结果。在第21天,还使用产生的tcrγδ
+
细胞针对molt-4白血病靶进行细胞毒性测定(方法描述于图8中)。通过在fortessaii流式细胞仪(bd biosciences)中用膜联蛋白-v试剂进行阳性染色来检测凋亡(濒死)靶细胞。基础肿瘤细胞死亡(即未与tcrγδ
+
细胞共培养的肿瘤样品中凋亡肿瘤细胞的百分比)为 10
±
3%。展示了两个技术重复的平均值。
164.表4展示了测试培养条件的总结。通过macs从健康供体分离tcrγδ
+ pbls,并在存在所述生长因子的情况下,在两步和三步培养方案中培养15天。计数细胞并在培养期结束
时通过 facs分析细胞表型。展示了2个独立实验的代表性结果。
165.表5展示了测试培养条件的总结。在两步方案中通过macs从健康供体分离tcrγδ
+ pbls,并在所述生长因子存在的情况下培养21天。计数细胞并在培养期结束时通过facs分析细胞表型。展示了2个独立实验的代表性结果。
166.表6展示了通过两步macs方案分离的tcrγδ
+ pbls的纯度和表型。在聚蔗糖中通过密度梯度离心,从收集自8个健康供体的血沉棕黄层产物获得pbmcs。通过如图2所述的两步 macs方案进一步分离tcrγδ
+ t细胞。通过细胞表面抗原的流式细胞术分析来表征细胞表型。数据对应于总活细胞的百分比。
167.表7展示了体外扩增的tcrγδ
+ t细胞的纯度和表型。根据先前描述的两步培养方案,将来自健康供体的macs分选的tcrγδ
+ t细胞(与表6中相同)在细胞培养袋中培养21天。通过流式细胞术来表征细胞群。示出了tcrγδ
+ t细胞和污染物细胞相对于培养物中存在的总活细胞的百分比。
168.表8展示了ncrs和nkg2d在新鲜分离的与培养的vδ1
+ t细胞中的表达。在细胞因子和抗cd3mab处理16或21天后,激活受体nkp30,nkp44和nkg2d在cd3
+
vδ1
+ t细胞中的表达。该表中的数据代表从10个独立供体获得的数据,注意到不同供体中nkp30和 nkp44表达在10%至70%之间变化,而nkg2d由所有测试供体的大于80%的vδ1
+ pbls表达。
169.表9展示了来自cll/sll患者的macs分选前后的tcrγδ
+ pbls的纯度和表型。在知情同意和伦理审查委员会批准后,首先从患者的外周血获得b细胞慢性淋巴细胞白血病 (cll)细胞。从3名cll患者(cll-1-3)的外周血中对tcrγδ
+ t细胞进行macs分选,并通过细胞表面抗原的流式细胞术分析来表征细胞群表型。展示了在两步磁分离过程前后立即获得的tcrγδ
+ t细胞和污染物细胞的百分比。在总活细胞上设门分选(gated)每个细胞亚群。
170.表10展示了污染物自体b-cll细胞在培养中成为残余群。如前所述,从3名cll/sll 患者(cll-1-3;如表9中)的外周血中对tcrγδ
+ t细胞进行macs分选,并体外培养16天。通过细胞表面抗原的流式细胞术分析来表征细胞群表型。展示了tcrγδ
+ t细胞和污染物细胞的百分比。除了在vδ1
+ t细胞上设门分选的nkp30和nkg2d表达之外,每个细胞亚群在总活细胞上被设门分选。
171.表11更详细地展示了在先申请的表2中所示的测试培养条件。通过macs从健康供体分离 tcrγδ
+ pbls,并在37℃和5%co2下,在96孔板中以1百万细胞/ml培养。将细胞在补充有5%自体血浆,1mm l-谷氨酰胺和所述生长因子的完全培养基(optmizer cts,gibco)中进行扩增。在培养期结束时,进行细胞计数并通过流式细胞术分析细胞表型。展示了4个连续实验的选定结果(在先申请的表2中描述的相同的实验,但进一步公开了并行对照培养条件的结果,标有星号,用于更完整地理解该结果)。它还显示了在每种条件下获得的nkp30
+ vδ1
+ t细胞的百分比。每个实验中的培养条件按倍数增加排列。计算vδ1
+ t细胞的倍数扩增率为:(培养结束时vδ1
+ t细胞的绝对数量)/(培养第0天的vδ1
+ t细胞的绝对数量)。展示了2个独立实验的代表性结果。
172.表12展示了测试培养条件的总结。如前所述,在指定的生长因子存在下,从健康供体分离和扩增tcrγδ
+ pbls。展示了多个培养条件下的一个实验的选定结果。为了更好地理解 il15/il-2/il-7和ifn-γ对培养的tcrγδ
+
细胞的作用,在存在或不存在il15/il-2/il-7和ifn-γ的情况下,在培养基和三种不同浓度的il-4和抗cd3mab中培养tcrγδ
+
细胞。
展示了当存在il-4 和ifn-γ的情况下培养这些细胞时,il-15,il-2和il-7对tcrγδ
+ t细胞扩增的有害作用。展示了2个独立实验的代表性结果。
173.表13展示了在大规模两步细胞培养方案前后获得的tcrγδ
+
细胞的总绝对数量。在细胞培养扩增/分化前后,用血球计计数从健康供体获得的macs分选的外周血tcrγδ
+
细胞(如图6所示)。每个血沉棕黄层被从450ml的外周血中浓缩,并含有约450-550百万个pbmcs。可以通过macs从每个血沉棕黄层收集平均1700万个tcrγδ
+ t细胞。然而,在未来的临床应用中,起始样品将是包含更多数量细胞的白细胞分离产物,并通过分离仪收集。在先前的研究中,从白血病患者收集的未刺激的白细胞分离产物平均含有13.4
×
109(范围为4.4-20.6
×
109)的外周血细胞,其中约1.6亿个tcrγδ
+ t细胞(范围为1.0-3.0
×
108)是在macs之后获得的(wilhelm,m.,et al.,successful adoptive transfer and in vivo expansion of haploidentical gammadelta tcells.jtransl med,2014.12:p.45.)。这比用血沉棕黄层获得的初始细胞平均多约9倍。因此,如果将白细胞分离产物用作起始样品,在相同培养系统中将产生的细胞的平均估计数量是约10.2
×
109个细胞(范围:3.9
×
10
9-14.4
×
109个细胞)。
174.表14展示了用于生产药物级tcrγδ
+ t细胞的试剂和材料。
175.实施例
176.人vδ1
+
tcrγδ
+ t细胞的体外扩增的优化
177.本发明人进行了一系列实验,旨在改善体外培养的vδ2-γδt细胞的扩增和纯度水平。由于没有商业上可获得的针对tcr的vδ3链的抗体,在培养优化阶段,使用抗tcrvδ1mab来识别细胞样品中的vδ1
+ t细胞。通过macs分离来自一组健康供体的tcrγδ
+ t pbls,并用il-2和 pha测试其对体外刺激的反应性(即细胞激活和增殖中的可检测变化)。选择一个具有反应性vδ1
+ pbls的供体来提供血液样品,用于其余的优化研究。固定健康供体的偏好是重要的,因为可以在不同实验中获得的结果之间进行更可靠的比较。所选供体在外周血中具有正常 (但高的)的tcrγδ
+ t细胞百分比(占总pbls的10%-12%),尽管vδ1
+ pbls的百分比非常低(占总pbls的0.3%,或总tcrγδ
+ t pbls的3.0%;图1)。由于培养的vδ1
+ t细胞的最终数量和纯度水平的每次微小提高可以通过流式细胞术容易地检测到,所以在这些实验中他被认为是合适的供体。
178.用于从pbmcs分离tcrγδ
+ t细胞的单步macs方案非常有效,其产生高纯度的细胞群 (图1)。然而,一种关键试剂(即与磁珠偶联的人抗tcrγδmab,来自miltenyi biotec)目前尚未被批准用于临床应用。这种试剂的临床级生产、验证和监管批准可能需要很多年,而这个问题将会阻止在临床应用中立即使用所述方案。然后开发并采用了一种不同的但是等效的用于分离tcrγδ
+ t细胞的方法。如图2所示,该过程由两步磁珠分离组成。所获得的tcrγδ
+ t 细胞的最终纯度水平低于通过之前的(单步)方法获得的,但对于细胞培养仍然是可接受的。重要的是,这种新的细胞分离方法仅使用已经批准用于临床应用的试剂(由德国的miltenyibiotec gmbh制造)。
179.本发明人然后测试了临床级激动剂抗体和细胞因子的多种组合对来自外周血的vδ1
+ t细胞的扩增和分化(超过2-3周)能力。在存在58种不同的t/nk细胞激活分子的情况下,将从先前选择的健康供体收集的macs分选的tcrγδ
+ pbls,在37℃和5%co2下,在96孔板中在培养基中孵育2-3周(表1)。这些包括13种不同tcr激动剂,23种不同共受体激动剂和
22种不同细胞因子,其以2,488种不同的组合和浓度进行测试。在可溶的和板结合的描述中都使用抗体。以浓度范围为0.1ng/ml至1000ng/ml测试细胞因子;tcr激动剂以0.1ng/ml至40μg/ml使用,共受体激动剂以终浓度为0.5μg/ml至80μg/ml使用。
180.从相同的供体进行了几次连续的细胞分离和细胞培养扩增实验;每个实验测试约100-400 个激活分子的不同组合的效果。从基本的、未优化的混合物开始优化(即在il-2和pha存在的情况下培养tcrγδ
+ t细胞)。每5天添加含有相同选择的激活分子混合物的新鲜培养基。14天后,收集细胞并通过流式细胞术分析其表型。识别每个实验的最佳培养条件(vδ1
+ t细胞的最高倍数扩增),并选择用于进一步优化,结合所有可用的试剂,在各种浓度下进行测试。获得每个良好的培养条件后,在优化阶段期间,vδ1
+ t细胞的倍数扩增和纯度水平逐渐增加。
181.实验1-4的结果总结在表2中。实验编号1证实了先前的观察,即il-4是促进vδ1
+ t细胞在培养中增殖和富集的关键生长因子。
27,42
在该实验中,在存在t细胞有丝分裂原和il-2的情况下,发明人测试了22种不同细胞因子对培养的tcrγδ
+ t细胞的活性。显然,il-4在诱导这些细胞强烈富集和扩增的能力方面是独特的。相比之下,使用递增浓度的il-2或il-2与不同t细胞有丝分裂原的组合,没有产生同等效果,最可能是因为培养的细胞的激活诱导细胞死亡 (aicd)增加(条件2-3;表2)。
182.表1
[0183][0184]
表2
[0185][0186]
实验编号2的结果表明,il-2(当存在il-4和pha时)必须以低浓度使用,以增加培养中 vδ1
+ t细胞的增殖和富集(条件3-7,表2)。在存在pha和高水平的il-2,不存在il-4的情况下,倍数扩增较高。在先前的实验(实验编号1)中没有观察到这种效果。此外,抗cd3 mab 被证明是促进在培养中vδ1
+ t细胞的存活和增殖的最有效的有丝分裂原(参见条件1与条件2,表2)。
[0187]
实验编号3(表2)的结果证实了先前的观察,并且表明,更低(比先前使用的)浓度水平的il-2(在存在il-4和t细胞有丝分裂原的情况下),也促进在培养中更高的vδ1
+ t细胞增殖、存活和富集。而且,当以相同浓度使用时,在促进vδ1
+ t细胞存活、富集和增殖方面il
‑ꢀ
15比il-2更有效。再次证明,抗cd3 mab是我们测试中最有效的有丝分裂原。
[0188]
实验编号4的结果进一步表明,培养基中存在高水平的il-15对于vδ1
+ t细胞的增殖是有害的。实际上,当存在il-4和α-cd3的情况下(条件3-5,表2),更低(比之前使用的)浓度水平的il-15促进vδ1
+ t细胞更高的扩增水平。
[0189]
最后,完全出乎意料地发现,用inf-γ代替il-15(即在培养基中不存在il-15并存在 ifn-γ),显示产生培养的vδ1
+ t细胞的提高的扩增水平。
[0190]
虽然平行测试了il-2,il-7和il-15的许多不同浓度和组合,但一直发现ifn-γ是用于促进培养中vδ1
+ t细胞的选择性扩增的更有效的试剂(当在il-4和t细胞有丝分裂原(如抗 cd3 mab)存在时使用;图3)。这些培养物中ifn-γ的较高性能与所用的il-4和抗cd3 mab的浓度无关(图3a-c和图4)。重要的是,ifn-γ(但不是il-2,il-15或il-7)的使用诱导了vδ1
+ t细胞在大部分cd3
+ t细胞培养物中的富集和扩增水平急剧增加(图3d)。在这些培养物中,存在于起始样品中的污染性tcrαβ
+ t细胞在存在il-2,il-15和il-7,但不存在ifn-γ的情况下,响应并增殖,其似乎是vδ1
+ t细胞的更有选择性的激活剂。这些实验表明,在不存在il-2,il-7和il-15的情况下,用于产生vδ1
+ t细胞的ifn-γ与il-4和t细胞有丝分裂原的特定(而非先前描述的)组合具有独特的优势,其可用于各种新型治疗和商业化应用中。
[0191]
ifn-γ是一种二聚化可溶性细胞因子,是ii型干扰素的唯一成员。
50
其在结构上和功能上不同于一般的γ链细胞因子,如il-2、il-4、il-7或il-15,并且在血清学上不同于i型干扰素:它是酸不稳定的,而i型变体是酸稳定的。
[0192]
虽然我们已经获得了一种新的改进方法用于在培养中扩增和富集vδ1
+ t细胞群,我们也试图在体外分析产生的细胞的抗肿瘤功能。我们发现,培养基中il-4的存在强烈地抑制或降低了激活受体如自然细胞毒性受体(ncrs,即nkp30和nkp44)和nkg2d在扩增的vδ1
+ t细胞上的表达(表3)。
[0193]
已知激活自然杀伤(nk)受体(例如nkp30,nkp44和nkg2d)通过结合其在肿瘤表面或感染的细胞上表达的分子配体,在vδ1
+ t细胞的抗肿瘤和抗病毒功能中起关键作用。受体
‑ꢀ
配体结合通过vδ1
+ t细胞触发颗粒酶和穿孔素的产生和释放,导致靶细胞死亡。
29
在我们的研究中,我们发现,培养基中il-4的存在诱导了位于培养的tcrγδ
+ t细胞表面的激活nk受体的水平的降低,从而降低其对molt-4白血病细胞的细胞毒性作用(表3)。值得注意的是,由 il-4诱导的抑制似乎影响最终细胞产品(包括vδ1-和vδ1
+
tcrγδ
+ t细胞)中存在的所有 tcrγδ
+ t细胞亚群(表3)。
[0194]
表3
[0195][0196]
这与最近的研究一致,其表明il-4通过il-10产生促进调节性vδ1
+ t细胞的产生。il-4处理的vδ1
+ t细胞相对于vδ2
+ t细胞,分泌显著更少的ifn-γ和更多的il-10。此外,在存在il-4的情况下,vδ1
+ t细胞表现出相对低的nkg2d表达水平,表明vδ1
+ t细胞使tcrγδ
+ t细胞介导的抗肿瘤免疫应答变弱。
42
[0197]
由于我们正在寻找新的培养方法,目的是改善vδ1
+ t细胞的抗肿瘤效应功能,我们试图恢复激活nk受体在il-4处理的细胞上的表达,并恢复这些细胞的细胞毒性表型,这是从未尝试过的。
[0198]
以两步方案培养tcrγδ
+ t细胞。第一步包括,在存在t细胞有丝分裂原(如抗cd3 mab或 pha)和il-4,且不存在il-2、il-15和il-7的情况下,处理培养基中的细胞,以促进vδ1
+ t细胞的选择性扩增。第二个培养步骤包括,在不存在il-4,且存在t细胞有丝分裂原和il-2或il-7 或il-15的情况下,处理培养基中的细胞,以促进细胞分化和nkr表达(表3和表4)。
[0199]
条件1-5(表3)证实了先前的结果,表明在存在il-4的情况下培养的vδ1
+ t细胞可以在培养中扩增数千倍,但不能分化,变成无效的肿瘤细胞杀伤剂。相反,如条件6-13所示,当细胞在不存在il-4而存在t细胞有丝分裂原和il-2或il-7或il-15的第二培养基中传代培养时,消除肿瘤细胞的能力从根本上增加了。这三种细胞因子(il-2,il-7和il-15)中的每一种单独或组合存在,能够恢复培养的vδ1
+ t细胞的表型,因此可用于此目的。
[0200]
实验编号6和7(表4)的结果表明,2步方案甚至3步方案可以更有效地用于刺激vδ1
+ t细胞的增殖和分化。在3步方案的情况下,细胞在3种不同的培养基中培养(参见例如表4的实验编号7的条件2),将含有il-4的培养基与含有il-2或il-7或il-15的培养基分离是非常重要的。从这些结果也可以得出结论,在每个传代培养步骤中应去除一部分旧培养基以改善细胞扩增;而在第二培养基中,在促进vδ1
+ t细胞增殖方面il-15比il-2稍微更有效。使用3步和4步培养方案的另外的实验进一步证明,可以向第一和/或第二培养基(表3和表4)中添加其他生长因子,以提高vδ1
+ t细胞的扩增水平和nk受体在这些细胞上的表达。inf-γ、il-21和il-1β被鉴定为vδ1
+ t细胞扩增和存活的有效诱导剂(表5)。这些生长因子可以用于第一或第二培养基中。
[0201]
最后,cd27受体的可溶性配体或cd7受体的可溶性配体或slam受体的可溶性配体的添加,导致vδ1
+ t细胞的扩增提高(表5的条件3-6)。通常需要cd27受体来产生和长期维持t细胞免疫。它与其配体cd70结合,在调节b细胞激活和免疫球蛋白合成中起关键作用。cd7受体是免疫球蛋白超家族的成员。这种蛋白质在胸腺细胞和成熟t细胞上被发现。它在早期淋巴发育过程中对t细胞相互作用以及t细胞/b细胞相互作用起着重要作用。slam受体是免疫调节受体的信号转导淋巴细胞激活分子家族的成员。
[0202]
表4
[0203][0204][0205]
值得注意的是,测试了几种不同的培养基(图5)。这些测试表明,本发明对于不同培养基(包括市售的,不含血清的,由不同制造商生产的临床级培养基,适用于临床应用的)
效果很好。
[0206]
表5
[0207][0208][0209]
大规模扩增的tcrγδ
+ t细胞的体外表征
[0210]
已经建立了一个有效的用于在培养中分离和扩增vδ1+ t细胞的方案,我们旨在用从更多健康供体和癌症患者收集的血液样品进行测试。这是测试新培养方法的稳健性和普遍适用性所必需的。此外,在为临床应用开发的封闭的大型的透气性细胞袋中培养细胞,而不是在塑料板或烧瓶中。
[0211]
所采用的磁相关细胞分选(macs)的两步法产生了富集了来自8个不同供体的tcrγδ
+ t 细胞的活细胞群(表6)。经过macs后,vδ1
+
tcrγδ
+ t细胞仅占初始存在的总活细胞约1%至44%。然而,在优化的2步培养方法之后的11-21天的处理中,并在所述的细胞因子和t细胞有丝分裂原的混合物存在下,vδ1
+ t细胞成为培养中的主要细胞亚群,其在供体之间的总细胞的60-80%之间变化(图6)。值得注意的是,获得了可重现性好的扩增,并且最终细胞产物的组成在多个供体中显著相似(图6,表7)。重要的是,最终产物中的非vδ1
+
tcrγδ
+ t细胞被发现主要是vδ1
‑ vδ2-tcrγδ
+ t细胞(其占总细胞的约17%-37%)。这些细胞可能由vδ3
+
tcrγδ
+ t细胞组成,因为这是外周血中第三丰富的tcrγδ
+ t细胞亚群。可以通过从总tcrγδ
+ t细胞的百分比中减去vδ1
+ t细胞和vδ2
+ t细胞的百分比,来计算最终细胞产物中vδ1-vδ2-tcrγδ
+ t细胞的百分比 (表7)。正如所预料的那样,这些塑料袋中的倍数扩增比来自板的倍数扩增要低,但是仍然产生了用于临床转译的相关数量。
[0212]
在所有测试供体的长期培养的vδ1
+ t细胞中,激活自然细胞毒性受体(ncrs;包括 nkp30和nkp44)和nkg2d的表达被强烈诱导(表8和图7)。获得的tcrγδ
+ t细胞(包括vδ1
+
和v
δ1-vδ2-细胞亚群)对cll细胞(mec-1细胞系和原代cll患者样品)具有高度细胞毒性,但不靶向健康的自体pbmcs(图8a和图8c)。使用针对tcrγδ
+ t细胞激活受体的阻断抗体的初步实验显示,抗肿瘤细胞毒性部分依赖于nkg2d和nkp30受体(图8b)。此外,扩增和分化的tcrγδ
+ t细胞产生高水平的促炎性细胞因子ifn-γ(图9)。
[0213]
最后,可以从具有非常高的肿瘤负荷的老年cll患者(表9和表10和图10a)的pbls 中,有效地分离和扩增vδ2-tcrγδ
+ t细胞,其显示有效的抗肿瘤和抗病毒活性(图10b)。值得注意的是,在tcrγδ
+ t细胞的体外培养过程中,污染的自体白血病b细胞被消除(表 10)。
[0214]
这组数据充分证明了本发明产生用于自体或同种异体过继性细胞疗法的、功能性vδ2-γδt 细胞(即来自癌症患者)独特能力。该方法足够稳健,以从cll患者获得的高度未纯化的样品中富集(>60%)和扩增(高达2,000倍)vδ1
+ t细胞,将其分化成nkr表达和高度细胞毒性的tcrγδ
+ t细胞。
[0215]
重要的是,初步试验还证实了培养的tcrγδ
+ t细胞对其他组织来源的肿瘤细胞的体外反应性(图11),表明扩增和分化的vδ2-γδt细胞也可以用于治疗这些病症。
[0216]
表6
[0217][0218]
表7
[0219][0220]
表8
[0221][0222]
表9
[0223][0224]
表10
[0225][0226]
扩增的tcrγδ
+
t细胞的体内研究
[0227]
已经成功开发了一种产生大量功能性tcrγδ
+
t细胞的方法,我们称之为“dot-细胞”,接下来我们研究了它们在体内的归巢和抗白血病活性。我们利用之前展示的人类cll的异种移植模型来重现疾病的几个方面,并用于测试其他细胞治疗(包括car-t细胞)的功效。
51,52
该模型依赖于将cll/sll衍生的mec-1细胞过继转移到balb/crag-/-γc-/-(brg)动物中,所述动物缺乏所有的淋巴细胞,因此不立即排斥人类细胞。然而,一些骨髓谱系介导的人类异种移植排斥反应仍然存在。由于编码sirp-α的不同等位基因,这种排斥反应的大小根据所用的小鼠品系而不同。因此,我们进一步调整模型,以在转移后的晚期时间点使用nod-scidγc-/-(nsg)动物作为宿主来表征tcrγδ
+
t细胞。实际上,在转移到荷瘤nsg宿主中后,我们能够在转移后30天,利用强烈富集的cd3
+
vδ1
+
t细胞,在分析的所有组织中恢复tcrγδ
+
t细胞(图12)。重要的是,我们在恢复的tcrγδ
+
t细胞中检测到nkp30和nkg2d的表达,证明它们在体内稳定地保持其特征。值得注意的是,在转移到brg动物中后,我们不能在如此晚的时间点恢复tcrγδ
+
t细胞,但在转移后72小时,我们在肺和肝中都观察到了它
们(图12)。这些实验证实人异种移植细胞在nsg动物中的更好的适应性,同时允许我们有两种不同的模型来测试体内扩增的vδ2-γδt细胞的抗肿瘤特性。
[0228]
为了使用生物发光来动态跟踪肿瘤生长,我们用萤火虫萤光素酶-gfp转导mec-1细胞,并将107个mec-1细胞皮下转移到brg动物中。7天后,在将治疗(或pbs对照)归因于动物之前,我们在腹膜腔内注射荧光素以确定作为发光的函数的肿瘤负荷。我们在5天内进行了两次tcrγδ
+
t细胞转移。然后,我们使用卡尺测量作为时间的函数的肿瘤大小;重要的是,与对照组相比,我们检测到治疗动物中的原发性肿瘤大小明显减小(图13)。这种减小在tcrγδ
+
t细胞第二次转移9天后是显著的。这个结果证实了tcrγδ
+
t细胞在体内是有效的,即使brg宿主中人类细胞的短半衰期阻止了其抗肿瘤特性的更广泛的表征。为了克服这个限制,我们接下来使用nsg动物作为宿主进行类似的实验。
[0229]
肿瘤进展生长速度在nsg宿主中更快,这似乎阻止了tcrγδ
+
t细胞干扰原发性肿瘤生长(图14)。然而,在该模型中,肿瘤在晚期时间点传播到各种器官,并且我们发现tcrγδ
+
t细胞显著地能够限制肿瘤扩散,如通过流式细胞术和一系列组织的组织学分析所记载的(图14b-d)。这包括诸如骨髓和肝脏的传播部位。在两种异种移植模型中获得的数据共同证明了tcrγδ
+
t细胞减小原发性肿瘤大小(在brg宿主中;图13)和控制肿瘤向靶器官传播(在nsg宿主中;图14)的体内功效。
[0230]
在nsg模型中在实验结束时对tcrγδ
+
t细胞子代的检查证实了对肿瘤组织的强烈浸润(图15a);和nkp30和nkg2d在tcrγδ
+
t细胞上的稳定表达(图15b)。有趣的是,我们在肿瘤浸润性tcrγδ
+
t细胞中特异性地检测到了早期激活标记物cd69的高表达,表明肿瘤内tcrγδ
+
t细胞的最佳激活(图15b)。重要的是,我们根据组织学分析(多器官)或在尸体剖检时收集的血液的生化分析,没有观察到任何治疗相关的毒性(图16)。
[0231]
总的来说,这些体内数据为生成的tcrγδ
+
t细胞用于cll治疗的安全性和有效性提供了极大的信心,从而激励了它们的临床应用。
[0232]
总之,我们已经开发了一种新的、稳健的(高度可重现的)临床级方法,其没有饲养细胞,用于选择性和大规模扩增和分化细胞毒性的vδ2-γδt细胞;并在慢性淋巴细胞白血病(cll)的临床前模型中测试了其治疗潜力。我们的细胞产品,称为dot-细胞,不涉及任何基因操作;并在体外特异性靶向白血病但非健康的细胞;并防止在体内向外周器官的大范围的肿瘤扩散,而没有任何健康组织损伤的迹象。我们的结果为dot细胞在癌症的过继性免疫治疗的临床应用提供了新的手段和原理论证。
[0233]
补充数据
[0234]
以下部分公开了使用前述发明生成的附加数据。本文包含的数据证实了先前的结果,并扩展了先前的观察结果,其应作为支持信息,以更好地了解主题。
[0235]
如前所述,已经使用白细胞介素-2(il-2)和白细胞介素-4(il-4)的组合在体外扩增vδ1
+
t细胞,取得了一些成功。然而,我们发现,培养基中il-4的存在诱导培养的tcrγδ
+
t细胞上自然杀伤(nk)激活受体(如nkg2d,nkp30andnkp44)的强烈下调,减弱了它们的抗肿瘤反应(表3)。
[0236]
在此更详细地介绍我们先前的实验1-4的结果(见表11)。显示了在平行培养条件下获得的附加结果(用星号标记),以更全面地理解该结果。本文还公开了在每种条件下细胞培养后观察到的nkp30
+
vδ1
+
t细胞的百分比。观察到的nkp30在培养细胞上的表达的下
调进一步证实了,当培养基中存在il-2时(即,当培养基含有il-2和il-4时),也发生il-4对vδ2-γδt细胞的有效抑制作用。这些数据证实了il-4的抑制作用优于il-2对培养的tcrγδ
+
t细胞的激活作用,并且强调了在第二培养步骤中除去il-4的重要性。
[0237]
如前所述,虽然平行测试了il-2,il-7和il-15的许多不同浓度和组合,但一致发现ifn-γ是用于促进培养中vδ1
+
t细胞的选择性扩增的更有效的试剂(当在存在il-4和t细胞有丝分裂原,如抗cd3mab的情况下使用时)。如先前所暗示的(但未正式显示),单独使用ifn-γ比ifn-γ与il-2、il-7或il-15的组合,或il-2与il-15或il-7的组合更有效(在培养中促进细胞扩增)(表12)。这些数据证实了,当在存在il-4和ifn-γ的情况下培养细胞时,il-15、il-2和il-7对tcrγδ
+
t细胞扩增具有有害作用。
[0238]
如前所述,正如所预料的那样,大的细胞培养袋中的倍数扩增比来自96-孔板的倍数扩增要低,但是仍然产生了用于临床转译的相关数量。在临床级细胞袋中大规模细胞培养后获得的总绝对细胞数现在详细列于表13中。
[0239]
如前所述,用前述方法获得的细胞培养方案适用于临床应用。事实上,几种材料和试剂已经被至少一个管理机构(如欧洲药品管理局或食品和药物管理局)批准了用于临床应用。完整列表详见表14。
[0240]
如前所述,由所述发明提出的细胞分离的2步法产生了富含tcrγδ
+
t细胞的细胞样品,所述tcrγδ
+
t细胞是活的并可以进一步培养。图17更详细地显示了两步macs分选后tcrγδ
+
pbl富集的facs图。
[0241]
如前所述,用本发明的培养方法获得了可重现性好的扩增,并且最终细胞产品的组成在多个供体中是非常相似的。
[0242]
为了更完整地表征用前述发明获得的细胞,并给出了该方法的新颖性和所得到的细胞产品,我们对332个不同的细胞表面标记物进行了大范围的表型分型(图18)。在细胞培养过程的开始(第0天)和结束(第21天)比较了vδ1
+
t细胞。我们观察到激活标记物cd69和cd25以及hla-dr,以及共刺激受体cd27,cdl34/ox-40和cd150/slam,体外产生的vδ1
+
t细胞的增殖潜能增强的指示物的显著上调(与他们的基线vδ1
+
t细胞对应物相比)。此外,扩增的vδ1
+
t细胞增加nk细胞相关的激活/细胞毒性受体,即nkp30、nkp44、nkg2d、dnam-1和2b4的表达,之前表明所有这些都在肿瘤细胞靶向中是重要的参与者。相比之下,关键抑制性和耗竭相关分子如pd-1、ctla-4或cd94,以极低水平表达或完全不表达,即使在刺激条件下培养21天后也证明了扩增和分化的tcrγδ
+
t细胞的显著“适应性”。特别地,参与细胞粘附的多种分子(例如cd56、cd96、cd172a/sirp、整合素-β7和icam-1)和趋化因子受体(cd183/cxcr3、cd196/ccr6和cx3cr1)的上调,表明在血液和组织之间迁移和循环的高潜力。值得注意的是,已知促进1型(干扰素-γ-生产)应答的il-18rα和notch1,也通过扩增和分化的tcrγδ
+
t细胞高度表达。重要的是,为了维持我们的方法的稳健性,我们在所有4个测试的供体中发现了惊人相似的细胞表型,如热图所示(图18b)。这些数据共同表征了扩增和分化的tcrγδ
+
t细胞,它是具有迁移潜能和自然细胞毒性机制的激活(未耗竭)淋巴细胞的高度可重现的细胞产品。
[0243]
如前所述,使用针对在tcrγδ
+
t细胞上表达的激活受体的阻断抗体的初步实验表明,抗肿瘤细胞毒性部分依赖于由扩增的tcrγδ
+
t细胞表达的nkg2d和nkp30受体。本文提到的补充实验也揭示了γδtcr在肿瘤细胞识别中的作用(图19)。
[0244]
如前所述,在长期培养的vδ1
+ t细胞中强烈诱导激活自然细胞毒性受体(ncr,包括 nkp30和nkp44)和nkg2d的表达。在这里,我们展示了在vδ1-vδ2-细胞亚群中观察到相同的效果。当我们在相同的培养物中对扩增的(和分化的)cd3
+
vδ1-vδ2-细胞亚群应用一个门(在facs图分析中)时,我们观察到这些细胞与分化的vδ1
+
细胞表达相同水平的ncrs (图20)。这些数据进一步证实了,本发明中描述的2步方案可以扩增和分化vδ1
+
和vδ1-vδ2
‑ tcrγδ
+ t细胞亚群。在第一个培养步骤中,在存在t细胞有丝分裂原和il-4(并且不存在il
‑ꢀ
15、il-2或il-7)的情况下,在培养中扩增vδ1
+
和vδ1-vδ2-tcrγδ
+ t细胞亚群,但不能分化为细胞毒性表型。当在存在t细胞有丝分裂原和il-2或il-7或il-15(且不存在il-4)的第二培养基中,将获得的细胞进行传代培养时,两个细胞亚群分化表达高水平的激活nk受体,该受体反过来介导肿瘤细胞的杀伤。
[0245]
如前所述,用本发明的方法获得的扩增和分化的vδ1
+
细胞在体外对白血病细胞具有高度的细胞毒性。在这里,我们更详细地展示了扩增和分化的vδ1-vδ2-细胞亚群也对肿瘤靶具有高度的细胞毒性。我们通过流式细胞术从相同培养细胞样品中分选cd3
+
vδ1
+
细胞和 cd3
+
vδ1-vδ2-细胞,并在体外将每个亚群与靶肿瘤细胞共培养。我们观察到这两个亚群可以有效地消除靶细胞(图21)。
[0246]
表11
[0247][0248]
表12
[0249][0250]
表13
[0251][0252][0253]
表14
[0254][0255]
本说明书中提到的全部引用文件
[0256]
1.haydayac.gammadeltatcellsandthelymphoidstress-surveillanceresponse.immunity2009;31(2):184-96.
[0257]
2.pangdj,nevesjf,sumarian,penningtondj.understandingthecomplexityofgammadeltat-cellsubsetsinmouseandhuman.immunology2012;136(3):283-90.
[0258]
3.denigerdc,maitis,mit,etal.activatingandpropagatingpolyclonalgammadeltatcellswithbroadspecificityformalignancies.clinconcerres2014.
[0259]
4.halaryf,pitardv,dlubekd,etal.sharedreactivityofv{delta}2(neg){gamma}{delta}tcellsagainstcytomegalovirus-infectedcellsandtumorintestinalepithelialcells.jexpmed2005;201(10):1567-78.
[0260]
5.bennounaj,bompase,neidhardtem,etal.phase-istudyofinnacellgammadelta,anautologouscell-therapyproducthighlyenrichedingamma9delta2tlymphocytes,incombinationwithil-2,inpatientswithmetastaticrenalcellcarcinoma.cancerimmunolimmunother2008;57(11):1599-609.
[0261]
6.fisherjp,heuijerjansj,yanm,gustafssonk,andersonj.gammadeltatcellsforcancerimmunotherapy:asystematicreviewofclinicaltrials.oncoimmunology2014;3(1):e27572.
[0262]
7.dielif,vermijlend,fulfarof,etal.targetinghuman{gamma}delta}tcellswithzoledronateandinterleukin-2forimmunotherapyofhormone-refractoryprostatecancer.cancerres2007;67(15):7450-7.
[0263]
8.gomesaq,martinsds,silva-santosb.targetinggammadeltat
lymphocytesforcancerimmunotherapy:fromnovelmechanisticinsighttoclinicalapplication.cancerres2010;70(24):10024-7.
[0264]
9.zocchimr,ferrarinim,migonen,casoratig.t-cellreceptorvdeltageneusagebytumourreactivegammadeltatlymphocytesinfiltratinghumanlungcancer.immunology1994;81(2):234-9.
[0265]
10.maeurermj,martind,walterw,etal.humanintestinalvdelta1+lymphocytesrecognizetumorcellsofepithelialorigin.jexpmed1996;183(4):1681-96.
[0266]
11.choudharya,davodeauf,moreaua,peyratma,bonnevillem,jotereauf.selectivelysisofautologoustumorcellsbyrecurrentgammadeltatumor-infiltratinglymphocytesfromrenalcarcinoma.jimmunol1995;154(8):3932-40.
[0267]
12.cordovaa,toiaf,lamendolac,etal.characterizationofhumangammadeltatlymphocytesinfiltratingprimarymalignantmelanomas.plosone2012;7(11):e49878.
[0268]
13.doniam,ellebaeke,andersenmh,stratenpt,svaneim.analysisofvdelta1tcellsinclinicalgrademelanoma-infiltratinglymphocytes.oncoimmunology2012;1(8):1297-304.
[0269]
14.godderkt,henslee-downeypj,mehtaj,etal.longtermdisease-freesurvivalinacuteleukemiapatientsrecoveringwithincreasedgammadeltatcellsafterpartiallymismatchedrelateddonorbonemarrowtransplantation.bonemarrowtransplant2007;39(12):751-7.
[0270]
15.lambls,jr.,henslee-downeypj,parrishrs,etal.increasedfrequencyoftcrgammadelta+tcellsindisease-freesurvivorsfollowingtcell-depleted,partiallymismatched,relateddonorbonemarrowtransplantationforleukemia.jhematother1996;5(5):503-9.
[0271]
16.catellanis,poggia,bruzzonea,etal.expansionofvdelta1tlymphocytesproducingil-4inlow-gradenon-hodgkinlymphomasexpressingul-16-bindingproteins.blood2007;109(5):2078-85.
[0272]
17.bartkowiakj,kulczyck-wojdalad,blonskijz,robakt.moleculardiversityofgammadeltatcellsinperipheralbloodfrompatientswithb-cellchroniclymphocyticleukaemia.neoplasma2002;49(2):86-90.
[0273]
18.poggia,venturinoc,catellanis,etal.vdelta1tlymphocytesfromb-cllpatientsrecognizeulbp3expressedonleukemicbcellsandup-regulatedbytrans-retinoicacid.cancerres2004;64(24):9172-9.
[0274]
19.demariaa,ferrazina,ferrinis,cicconee,terragnaa,morettal.selectiveincreaseofasubsetoftcellreceptorgammadeltatlymphocytesintheperipheralbloodofpatientswithhumanimmunodeficiencyvirustype1infection.thejournalofinfectiousdiseases1992;165(5):917-9.
[0275]
20.hviidl,kurtzhalsja,adabayeriv,etal.perturbationand
proinflammatorytypeactivationofvdelta1(+)gammadeltatcellsinafricanchildrenwithplasmodiumfalciparummalaria.infectionandimmunity2001;69(5):3190-6.
[0276]
21.dechanetj,mervillep,lima,etal.implicationofgammadeltatcellsinthehumanimmuneresponsetocytomegalovirus.jclininvest1999;103(10):1437-49.
[0277]
22.siegersgm,lambls,jr.cytotoxicandregulatorypropertiesofcirculatingvdelta1+gammadeltatcells:anewplayeronthecelltherapyfield?moleculartherapy:thejournaloftheamericansocietyofgenetherapy2014;22(8):1416-22.
[0278]
23.meehpf,kingm,o'brienrl,etal.characterizationofthegammadeltatcellresponsetoacuteleukemia.cancerimmunolimmunother2006;55(9):1072-80.
[0279]
24.knighta,mackinnons,lowdellmw.humanvdelta1gamma-deltatcellsexertpotentspecificcytotoxicityagainstprimarymultiplemyelomacells.cytotherapy2012.
[0280]
25.merimss,dokouhakip,joeb,zhangl.humanvdelta1-tcellsregulateimmuneresponsesbytargetingautologousimmaturedendriticcells.humimmunol2011;72(1):32-6.
[0281]
26.wud,wup,wux,etal.expandedhumancirculatingvdelta1gammadeltatcellsexhibitfavorabletherapeuticpotentialforcoloncancer.oncoimmunology2015;4(3):e992749.
[0282]
27.siegersgm,dhamkoh,wangxh,etal.humanvdelta1gammadeltatcellsexpandedfromperipheralbloodexhibitspecificcytotoxicityagainstb-cellchroniclymphocyticleukemia-derivedcells.cytotherapy2011;13(6):753-64.
[0283]
28.siegersgm,ribotej,keatinga,fosterpj.extensiveexpansionofprimaryhumangammadeltatcellsgeneratescytotoxiceffectormemorycellsthatcanbelabeledwithferahemeforcellularmri.cancerimmunolimmunother2012.
[0284]
29.correiadv,foglim,hudspethk,dasilvamg,maviliod,silva-santosb.differentiationofhumanperipheralbloodvdelta1+tcellsexpressingthenaturalcytotoxicityreceptornkp30forrecognitionoflymphoidleukemiacells.blood2011;118(4):992-1001.
[0285]
30.manganba,dunnemr,o'reillyvp,etal.cuttingedge:cd1drestrictionandth1/th2/th17cytokinesecretionbyhumanvdelta3tcells.jimmunol2013;191(1):30-4.
[0286]
31.kabelitzd,hinzt,dobmeyert,etal.clonalexpansionofvgamma3/vdelta3-expressinggammadeltatcellsinanhiv-1/2-negativepatientwithcd4t-celldeficiency.brjhaematol1997;96(2):266-71.
[0287]
32.kennat,golden-masonl,norriss,hegartyje,o'farrellyc,dohertydg.distinctsubpopulationsofgammadeltatcellsarepresentinnormalandtumor-bearinghumanliver.clinimmunol2004;113(1):56-63.
[0288]
33.zhouj,kangn,cuil,bad,hew.anti-gammadeltatcrantibody-expandedgammadeltatcells:abetterchoicefortheadoptiveimmunotherapyoflymphoidmalignancies.cellular&molecularimmunology2012;9(1):34-44.
[0289]
34.lopezrd,xus,guob,negrinrs,wallerek.cd2-mediatedil-12-dependentsignalsrenderhumangammadelta-tcellsresistanttomitogen-inducedapoptosis,permittingthelarge-scaleexvivoexpansionoffunctionallydistinctlymphocytes:implicationsforthedevelopmentofadoptiveimmunotherapystrategies.blood2000;96(12):3827-37.
[0290]
35.fisherjp,yanm,heuijerjansj,etal.neuroblastomakillingpropertiesofvdelta2andvdelta2-negativegammadeltatcellsfollowingexpansionbyartificialantigen-presentingcells.clincancerres2014;20(22):5720-32.
[0291]
36.fisherj,krameram,gustafssonk,andersonj.non-vdelta2gammadeltatlymphocytesaseffectorsofcancerimmunotherapy.oncoimmunology2015;4(3):e973808.
[0292]
37.denigerdc,maitisn,mit,etal.activatingandpropagatingpolyclonalgammadeltatcellswithbroadspecificityformalignancies.clincancerres2014;20(22):5708-19.
[0293]
38.siegersgm,felizardotc,mathiesonam,etal.anti-leukemiaactivityofinvitro-expandedhumangammadeltatcellsinaxenogeneicph+leukemiamodel.plosone2011;6(2):e16700.
[0294]
39.wilhelmm,kunzmannv,ecksteins,etal.gammadeltatcellsforimmunetherapyofpatientswithlymphoidmalignancies.blood2003;102(1):200-6.
[0295]
40.vonlilienfeld-toalm,nattermannj,feldmanng,etal.activatedgammadeltatcellsexpressthenaturalcytotoxicityreceptornaturalkillerp44andshowcytotoxicactivityagainstmyelomacells.clinexpimmunol2006;144(3):528-33.
[0296]
41.denigerdc,moyesjs,cooperlj.clinicalapplicationsofgammadeltatcellswithmultivalentimmunity.frontimmunol2014;5:636.
[0297]
42.maoy,yins,zhangj,etal.aneweffectofil-4onhumangammadeltatcells:promotingregulatoryvdelta1tcellsviail-10productionandinhibitingfunctionofvdelta2tcells.cellular&molecularimmunology2015.
[0298]
43.silva-santosb,serrek,norellh.gammadeltatcellsincancer.natrevimmunol2015;15(11):683-91.
[0299]
44.wup,wud,nic,etal.gammadeltat17cellspromotetheaccumulation
andexpansionofmyeloid-derivedsuppressorcellsinhumancolorectalcancer.immunity2014;40(5):785-800.
[0300]
45.maoy,yins,zhangj,etal.aneweffectofil-4onhumangammadeltatcells:promotingregulatoryvdelta1tcellsviail-10productionandinhibitingfunctionofvdelta2tcells.cellular&molecularimmunology2016;13(2):217-28.
[0301]
46.stacchinia,aragnom,vallarioa,etal.mec1andmec2:twonewcelllinesderivedfromb-chroniclymphocyticleukaemiainprolymphocytoidtransformation.leukemiaresearch1999;23(2):127-36.
[0302]
47.traggiaie,chichal,mazzucchellil,etal.developmentofahumanadaptiveimmunesystemincordbloodcell-transplantedmice.science2004;304(5667):104-7.
[0303]
48.shultzld,lyonsbl,burzenskilm,etal.humanlymphoidandmyeloidcelldevelopmentinnod/ltsz-scidil2rgammanullmiceengraftedwithmobilizedhumanhemopoieticstemcells.jimmunol2005;174(10):6477-89.
[0304]
49.tomaykomm,reynoldscp.determinationofsubcutaneoustumorsizeinathymic(nude)mice.cancerchemotherapyandpharmacology1989;24(3):148-54.
[0305]
50.graypw,goeddeldv.structureofthehumanimmuneinterferongene.nature1982;298(5877):859-63.
[0306]
51.bertilacciomt,scielzoc,simonettig,etal.anovelrag2-/-gammac-/
‑‑
xenograftmodelofhumancll.blood2010;115(8):1605-9.
[0307]
52.giordanoattianesegm,marinv,hoyosv,etal.invitroandinvivomodelofanovelimmunotherapyapproachforchroniclymphocyticleukemiabyanti-cd23chimericantigenreceptor.blood2011;117(18):4736-45.
[0308]
53.takenakak,prasolavatk,wangjc,etal.polymorphisminsirpamodulatesengraftmentofhumanhematopoieticstemcells.natimmunol2007;8(12):1313-23.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1