一种检测非洲猪瘟病毒的扩增引物对、检测试剂盒及应用
1.本发明涉及一种检测非洲猪瘟病毒的扩增引物,具体涉及基于非洲猪瘟病毒b646l基因的扩增引物对、检测试剂盒及应用。
背景技术:
2.非洲猪瘟是由非洲猪瘟病毒(african swine fever virus,asfv)引起的急性、烈性、高度接触性的传染病,给全球养猪业带来了巨大的威胁。该传染病属于世界动物卫生组织(oie)的法定报告动物疫病,也是中国规定的一类动物疫病。非洲猪瘟病的特征是发病过程短,最急性和急性感染死亡率高达100%,临床表现为发热(40~42℃),心跳加快,呼吸困难,部分咳嗽,眼、鼻有浆液性或粘液性脓性分泌物,皮肤发绀,淋巴结、肾、胃肠粘膜明显出血。针对非洲猪瘟病毒的检测和防控防范一直是全社会关注的重点。目前非洲猪瘟病缺乏有效的治疗手段和防控疫苗,建立快速、灵敏的诊断方法对于非洲猪瘟病的防控至关重要。
3.目前,国内外检测非洲猪瘟病毒方法主要有以下几种:(1)病毒分离鉴定结合红细胞吸附试验。这是目前非洲猪瘟病毒检测的“金标准”,该方法结果准确,但操作烦琐、耗费时间长,且只能检测样本中具有感染能力的病毒颗粒,因此灵敏度不足,不利于感染的早期诊断。(2)免疫学检测方法。以酶联免疫吸附试验为代表的免疫学检测方法也是目前实验室检测常用的非洲猪瘟病毒检测方法,但该方法具有滞后性,检测步骤冗繁,灵敏度和特异性也有待提高。(3)病毒核酸检测。应用最为广泛的是聚合酶链式反应(pcr)技术。常规pcr检测结果的判断主要依赖于琼脂糖凝胶电泳,耗时较长,且需使用含有一定毒性的核酸染料等试剂,操作安全性有待提高。实时荧光定量pcr可以对靶标进行快速定量检测且无需电泳,但由于仪器和试剂成本较高而未能在基层医疗单位和现场检测中广泛使用。
4.根据目前已公开的文献或专利中基于核酸扩增的检测技术包括荧光定量pcr、环介导等温扩增、纳米pcr、重组酶聚合酶扩增及其衍生技术。这些方法要么检测所需时间较长,要么对靶序列及长度有一定的要求,且引物设计有一定限制。
5.因此,本领域亟需开发一种检测时间短、能够精准检测、适用于基层检测机构及养殖现场检测的病毒核酸检测方法。这对于有效防控asfv具有极其重要的意义。
技术实现要素:
6.发明目的:本发明提供一种检测非洲猪瘟病毒的扩增引物对。
7.本发明还提供所述扩增引物对在制备检测非洲猪瘟病毒的试剂盒中的应用。
8.本发明最后提供一种检测时间短、灵敏度高、特异性强、适用性广的检测非洲猪瘟病毒的试剂盒及检测方法。
9.技术方案:本发明提供的扩增引物对基于非洲猪瘟病毒b646l基因特异性保守区域设计,包含正向引物和反向引物;所述正向引物序列如seq id no:1所示,所述反向引物序列如seq id no:2所示。
10.所述扩增引物基于非洲猪瘟病毒b646l基因特异性保守区域设计,具体如下:
11.正向引物:b646l-f tgcgtccgtaataggagta;(seq id no:1)
12.反向引物:b646l-r caaacagcaggtaaacaagata;(seq id no:2)
13.进一步地,所述正向引物和反向引物的摩尔比为1:1-1:2。
14.本发明还提供所述扩增引物对在制备检测非洲猪瘟病毒的试剂盒中的应用。
15.本发明还提供一种检测非洲猪瘟病毒的试剂盒,所述试剂盒包括上述的扩增引物对。
16.进一步地,所述试剂盒的结果判断方式为采用荧光检测;所述荧光检测为在反应液中加入核酸荧光染料,所述核酸荧光染料为sybr green i、eva green或syto 9;
17.进一步地,所述荧光检测还可以为扩增引物的正、反向引物上标记有特定标记物,两种标记物相互靠近可激发或淬灭荧光,所述特定标记物为fitc、fam、hex、rox、cy3、cy5、tamra、dabcyi、bhq2或bhq3中的两种或几种。
18.进一步地,所述试剂盒还包括石墨烯、扩增缓冲液、bst dna聚合酶、dntps、聚乙二醇、甜菜碱、无酶水、阳性对照和阴性对照。
19.进一步地,所述阳性对照:非洲猪瘟病毒核酸质控品;阴性对照:灭菌生理盐水。
20.进一步地,所述石墨烯为氧化石墨烯、还原石墨烯、磁性石墨烯、多孔石墨烯、石墨烯纳米管或者以石墨烯为表层的微纳米材料中的一种。
21.进一步地,所述石墨烯添加量为0.2ng/μl-1.2ng/μl。
22.进一步地,所述扩增引物对反应温度为两步温度快速循环,第一步为辅助变性温度,温度为70~74℃,第二步温度为扩增反应温度,温度为60~65℃,每步温度反应时间为1~10秒。
23.本发明内容还包括一种快速检测非洲猪瘟病毒的方法,反应程序为:70-74℃1-10秒,60-65℃1-10秒,共45个循环。当反应结束(约29分钟)后,荧光曲线起峰(荧光值大于0.001)判定为阳性;当荧光曲线未起峰(荧光值小于等于0.001)时判定为阴性。
24.有益效果:与现有技术相比,本发明具备以下优点:
25.(1)特异性强:本发明中的引物扩增高效特异,与猪瘟等7种临床症状相似的其他致病性病毒无交叉反应性。
26.(2)灵敏度高:本发明的试剂盒最低检测极限可达到2.9拷贝/反应,优于荧光定量pcr方法。
27.(3)检测时间短:本发明的核酸扩增反应只需约29分钟,根据实时荧光扩增曲线即可判定结果。
28.(4)广泛的适用性:核酸快速扩增方法及其检测试剂盒具有广泛的适用性,对靶序列无特殊要求,常规引物即可扩增,应用前景广阔。
29.(5)适于基因组高突变率的靶标的检测:本发明对短序列具有良好的扩增效率,适于基因组高突变率的病原微生物的检测。
30.(6)适于即时检测:本发明可使用便携式荧光定量设备完成检测,结果判读简单快捷,适于基层检验机构及养殖场现场检测。
31.综上,本发明试剂盒及其检测方法具有用时短、高特异性、高灵敏度、通用性强、适于即时检测等优点,为基层机构、出入境检验检疫等单位筛查和检测非洲猪瘟病毒提供了新的技术支持,具有广阔的市场前景和较大的社会、经济效益。
附图说明
32.图1为本发明快速扩增引物的筛选结果;
33.图2位本发明荧光快速检测方法的建立;
34.图3为基于氧化石墨烯反应系统的荧光快速检测方法建立;
35.图4为本发明氧化石墨烯使用量优化结果;
36.图5为本发明荧光快速检测方法反应温度优化结果;
37.图6为本发明荧光快速检测方法重复性测试结果;
38.图7为本发明荧光快速检测方法灵敏度测试结果;
39.图8为本发明荧光快速检测方法标准曲线的建立;
40.图9为荧光定量pcr方法灵敏度对比结果;
41.图10为本发明结果判断方式与荧光定量pcr方法相关关系;
42.图11为本发明荧光快速检测方法特异性测试结果。
具体实施方式
43.下面通过具体实施例对本发明所述的技术方案给予进一步详细的说明。
44.实施例1
45.基于非洲猪瘟病毒b646l基因的快速扩增引物的设计
46.根据美国生物技术信息中心基因序列数据库genbank中已公开的非洲猪瘟病毒全基因组序列和其他临床症状相似猪病毒全基因组序列(mw788405_asfv,af176348_prrsv,kt119352_csfv,m34651_prv,nc001718_ppv,ay181948_pcv2,nc003436_pedv,mn198861_siv),使用blastn、mafft、dnastar等分子生物学工具进行全基因组多序列比对分析,获得非洲猪瘟病毒b646l基因特异性的保守区域。根据保守靶基因序列,利用primer premier 5.0和在线工具nupack(http://www.nupack.org/)进行快速扩增引物的设计。所设计引物进一步通过blastn和primer-blast检索验证,引物信息如下:
47.表1基于非洲猪瘟病毒b646l基因的备选快速扩增引物
[0048][0049]
以非洲猪瘟病毒(asfv)核酸标准物质(原始浓度为5.8
×
103拷贝/μl)为模板,20μl反应体系包括:2μl的10
×
扩增缓冲液、2μl dntps(1~10mm)、1μl液态聚乙二醇、1μl甜菜碱(1~10mm)、引物f和r(10μm)各2μl、0.8μl bst dna聚合酶(8000u/ml)、1μl eva green
(20
×
)、5μl模板和2.2μl无酶水。将反应体系配制于微型反应管中,同时设置阴性对照。其中,引物分别使用上述表格中的引物进行同步实验。将含有反应体系的反应管混匀后瞬时离心,将反应管置于荧光定量pcr仪中。反应程序为:73~74℃1秒,60℃1秒,共45个循环。
[0050]
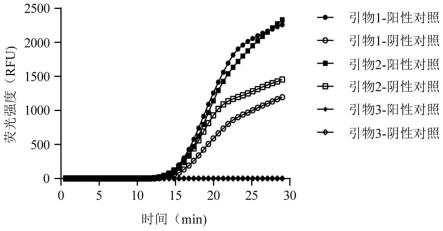
如图1所示,除第三对引物(p3)对阳性对照和阴性对照均无法扩增外,第一对引物(p1)和第二对引物(p2)均能对阳性对照和阴性对照进行扩增,但其中p2引物对阴性对照的非特异性扩增信号高于p1引物对阴性对照的非特异性扩增信号。因此,优选p1引物对作为后续实验的扩增引物。
[0051]
实施例2
[0052]
非洲猪瘟病毒快速荧光检测方法的建立
[0053]
用实施例1中设计的非洲猪瘟病毒b646l基因特异性扩增引物对非洲猪瘟病毒(asfv)核酸标准物质(5.8
×
103拷贝/μl)(购自广州邦德盛生物科技有限公司)和阴性对照(灭菌生理盐水)进行扩增方法测试,以获得最佳反应体系及反应温度。
[0054]
1、反应体系的优化
[0055]
为了验证石墨烯的作用,本实验反应体系分为2组:
[0056]
不添加石墨烯组:以非洲猪瘟病毒(asfv)核酸标准物质(原始浓度为5.8
×
103拷贝/μl)为模板,20μl反应体系包括:2μl的10
×
扩增缓冲液、2μl dntps(1~10mm)、1μl液态聚乙二醇、1μl甜菜碱(1~10mm)、引物f和r(10μm)各2μl、0.8μl bst dna聚合酶(8000u/ml)、1μl eva green(20
×
)、5μl模板和2.2μl无酶水。将反应体系配制于微型反应管中,同时设置阴性对照。将含有反应体系的反应管混匀后瞬时离心,将反应管置于荧光定量pcr仪中。反应程序为:73~74℃1秒,60℃1秒,共45个循环。
[0057]
添加石墨烯组:以非洲猪瘟病毒(asfv)核酸标准物质(原始浓度为5.8
×
103拷贝/μl)为模板,20μl反应体系包括:2μl的10
×
扩增缓冲液、2μl dntps(1~10mm)、1μl液态聚乙二醇、1μl甜菜碱(1~10mm)、引物f和r(10μm)各2μl、0.8μl bst dna聚合酶(8000u/ml)、1μl石墨烯分散液(1~10ng/μl)、1μl eva green(20
×
)、5μl模板和1.2μl无酶水。将反应体系配制于微型反应管中,同时设置阴性对照。将含有反应体系的反应管混匀后瞬时离心,将反应管置于荧光定量pcr仪中。反应程序为:73~74℃1秒,60℃1秒,共45个循环。
[0058]
如图2所示,使用优选的扩增引物对,可以对非洲猪瘟病毒(asfv)核酸标准物质实现高效扩增。反应结束后,荧光信号大幅升高,同时阴性对照也有较低的荧光信号。
[0059]
如图3所示,当反应体系中加入氧化石墨烯后,非洲猪瘟病毒(asfv)核酸标准物质和阴性对照的扩增产物荧光信号均有所降低,且阴性对照荧光信号降低较为明显。结果表明,基于石墨烯的反应系统可以有效增强扩增反应的特异性。
[0060]
2、扩增反应温度的优化
[0061]
以非洲猪瘟病毒(asfv)核酸标准物质(原始浓度为5.8
×
103拷贝/μl)为模板,20μl反应体系包括:2μl的10
×
扩增缓冲液、2μl dntps(1~10mm)、1μl液态聚乙二醇、1μl甜菜碱(1~10mm)、引物f和r(10μm)各2μl、0.8μl bst dna聚合酶(8000u/ml)、1μl石墨烯分散液(1~10ng/μl)、1μl eva green(20
×
)、5μl模板和1.2μl无酶水。将反应体系配制于微型反应管中,同时设置阴性对照。将含有反应体系的反应管混匀后瞬时离心,将反应管置于荧光定量pcr仪中。反应程序为:73~74℃1秒,60℃~62℃1秒,共45个循环。其中,扩增反应温度具体设置为:60℃、60.5℃、61℃、61.5℃、62℃。
[0062]
如图4所示,随着反应温度的升高,非洲猪瘟病毒(asfv)核酸标准物质和阴性对照的荧光信号值均呈现不同程度的降低。当反应温度达到61.5℃及以上时,非洲猪瘟病毒(asfv)核酸标准物质的荧光信号微弱,而阴性对照的荧光信号值已趋近于0,二者不易辨别。因此,扩增反应温度优选60℃。
[0063]
3、石墨烯添加量的优化
[0064]
以非洲猪瘟病毒(asfv)核酸标准物质(原始浓度为5.8
×
103拷贝/μl)为模板,20μl反应体系包括:2μl的10
×
扩增缓冲液、2μl dntps(1~10mm)、1μl液态聚乙二醇、1μl甜菜碱(1~10mm)、引物f和r(10μm)各2μl、1μl bst dna聚合酶(8000u/ml)、0.2~1.2μl石墨烯分散液(1~10ng/μl)、1μl eva green(20
×
)、5μl模板和适量无酶水。其中,石墨烯分散液(1~10ng/μl)的具体添加量为:0.2μl、0.4μl、0.6μl、0.8μl、1.0μl、1.2μl。将反应体系配制于微型反应管中,同时设置阴性对照。将含有反应体系的反应管混匀后瞬时离心,将反应管置于荧光定量pcr仪中。反应程序为:73~74℃1秒,60℃1秒,共45个循环。
[0065]
如图5所示,随着石墨烯用量的增加,非洲猪瘟病毒(asfv)核酸标准物质和阴性对照的荧光信号值均逐渐降低。当石墨烯添加量达1μl时,阴性对照的荧光信号值趋近于0(0.0001),而非洲猪瘟病毒(asfv)核酸标准物质的荧光值仍在1000以上。此后,随着石墨烯用量的增加,非洲猪瘟病毒(asfv)核酸标准物质的荧光值继续降低,阴性对照的荧光信号值仍趋近于0。因此,确定石墨烯分散液的优选添加量为1μl。
[0066]
实施例3
[0067]
非洲猪瘟病毒快速荧光检测方法的重复性测试
[0068]
以非洲猪瘟病毒(asfv)核酸标准物质(原始浓度为5.8
×
103拷贝/μl)为模板,20μl反应体系包括:2μl的10
×
扩增缓冲液、2μl dntps(1~10mm)、1μl液态聚乙二醇、1μl甜菜碱(1~10mm)、引物f和r(10μm)各2μl、0.8μl bst dna聚合酶(8000u/ml)、1μl石墨烯分散液(1~10ng/μl)、1μl eva green(20
×
)、5μl模板和1.2μl无酶水。将反应体系配制于微型反应管中,同时设置阴性对照。将含有反应体系的反应管混匀后瞬时离心,将反应管置于荧光定量pcr仪中。反应程序为:73~74℃1秒,60℃1秒,共45个循环。
[0069]
结果如图6和表2所示,通过对非洲猪瘟病毒(asfv)核酸标准物质进行10次扩增测试,荧光信号时间阈值(tt)相对稳定(变异系数约为3.2%),阴性对照无荧光信号时间阈值,有利于实际应用。
[0070]
表2本发明非洲猪瘟快速检测方法检测阳性质控和阴性质控结果对比
[0071][0072]
其中,cv表示变异系数。
[0073]
实施例4
[0074]
非洲猪瘟病毒快速荧光检测试剂盒的灵敏度测试
[0075]
本实施例测试本发明快速荧光检测试剂盒检测非洲猪瘟病毒的灵敏度,并将本发明灵敏度与荧光定量pcr方法(世界动物卫生组织oie推荐方法)进行比较。将非洲猪瘟病毒(asfv)核酸标准物质从5.8
×
103拷贝/μl进行10倍梯度稀释至5.8
×
10-2
拷贝/μl。反应体系和程序如下所示:
[0076]
20μl等温扩增反应体系包括:2μl的10
×
扩增缓冲液、2μl dntps(1~10mm)、1μl液态聚乙二醇、1μl甜菜碱(1~10mm)、引物f和r(10μm)各2μl、0.8μl bst dna聚合酶(8000u/ml)、1μl石墨烯分散液(1~10ng/μl)、1μl eva green(20
×
)、5μl模板和1.2μl无酶水。将反应体系配制于微型反应管中,同时设置阴性对照。将含有反应体系的反应管混匀后瞬时离心,将反应管置于荧光定量pcr仪中。反应程序为:73~74℃1秒,60℃1秒,共45个循环。
[0077]
检测结果如图7所示,图中:荧光扩增曲线对应的核酸标准物质模板浓度分别为5.8
×
103拷贝/μl、5.8
×
102拷贝/μl、5.8
×
101拷贝/μl、5.8
×
100拷贝/μl、5.8
×
10-1
拷贝/μl,而5.8
×
10-2
拷贝/μl和阴性对照则看不到明显的曲线。判定本试剂盒的检测灵敏度为5.8
×
10-1
拷贝/μl(等于2.9拷贝/反应),具有较高的灵敏度和应用价值。图8为梯度稀释的核酸标准物质样品浓度与对应tt值所建立的线性关系。
[0078]
荧光定量pcr方法的测试结果如图9所示,图中:荧光扩增曲线对应的核酸标准物质模板浓度分别为5.8
×
103拷贝/μl、5.8
×
102拷贝/μl、5.8
×
101拷贝/μl、5.8
×
100拷贝/μl,而5.8
×
10-1
拷贝/μl、5.8
×
10-2
拷贝/μl和阴性对照则看不到明显的曲线。图10为本发明非洲猪瘟病毒快速荧光检测方法tt值与荧光定量pcr方法ct值所建立的线性关系。
[0079]
结果表明,本试剂盒的荧光定量检测方法最低检出限5.8
×
10-1
拷贝/μl(2.9拷贝/反应),灵敏度比荧光定量pcr方法高一个数量级。同时本发明结果判断方式且与荧光定量pcr方法具有良好的线性相关关系。结果表明本发明试剂盒具有较高的灵敏度和检测价值,
并可实现快速定量检测。
[0080]
实施例5
[0081]
非洲猪瘟病毒快速荧光检测试剂盒的特异性测试
[0082]
用实施例2确定的优化反应体系及反应条件进行等温扩增及荧光定量检测。取非洲猪瘟病毒、猪繁殖和呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,prrsv)、猪瘟病毒(classical swine fever virus,csfv)、伪狂犬病毒(pseudorabies virus,prv)、猪细小病毒(porcine parvovirus,ppv)、猪圆环病毒2型(porcine circovirus type 2,pcv2)、猪流行性腹泻病毒(porcine epidemic diarrhea virus,pedv)、猪流感病毒(swine influenza virus,siv),并设置阴性对照。按照实施例2确定的优化反应体系和反应条件进行扩增。反应程序为:73~74℃1秒,60℃1秒,共45个循环。
[0083]
结果如图11所示,仅非洲猪瘟病毒核酸标准物质显示出荧光扩增曲线,而其他7种病毒和阴性对照均无荧光信号。
[0084]
结果如表3所示,本发明快速荧光检测方法的特异性好,具有较高的检测应用价值。
[0085]
表3本发明快速荧光检测方法特异性评价试验测试结果
[0086][0087]
实施例6
[0088]
临床样本验证测试
[0089]
为了验证本发明非洲猪瘟病毒快速荧光检测方法的临床适用性,以6份灭活asfv阳性样品和50份经rt-pcr检测为阴性的样品(包括血液、鼻拭子和环境样本)为检测对象,按照实施例2确定的优化反应体系和反应条件进行扩增。样品处理及检测程序严格参照《gb/t 18648-2020非洲猪瘟诊断技术标准》进行。结果如表4所示。
[0090]
表4临床样本验证测试结果
[0091]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1