层出镰刀菌FP26及其应用的制作方法
层出镰刀菌fp26及其应用
技术领域
1.本发明属于微生物技术领域,具体涉及层出镰刀菌fp26及其应用。
背景技术:
2.伏马毒素是危害我国食品安全的一种很普遍的真菌毒素。目前,已经分离得到了伏马毒素有fa、fb、fc、fp四簇。其中,伏马毒素fb1占比达到70%,毒性最强。伏马毒素fb1可以引起马脑白质软化症、猪肺水肿综合征、小鼠肝细胞凋亡和肾毒性,且被认为与人类的食道癌的高发有关,已被国际癌症研究机构划定为2b类致癌物。
3.伏马毒素主要污染水稻、玉米、小麦、高粱等多种农作物,可通过直接或间接(动物产品或饲料加工)传播途径危害人畜健康。近年来,许多发达国家纷纷制定了食品和饲料中伏马毒素的限量标准和法规。目前,我国尚处于伏马毒素污染来源及其规律调查的初级研究阶段,相关风险监控体系尚未建立,农产品出口因伏马毒素超标而被退回的事件时有发生。越来越严峻的国际贸易技术壁垒和食品安全问题,使得清除农产品和食品中伏马毒素的污染成为刻不容缓的任务。因此,加强伏马毒素的防控水平,与人们生活品质、身体健康和经济利益休戚相关,对于保障我国粮食安全和维护国家经济利益具有重要意义。
4.降低农作物种植过程中伏马毒素产毒菌株的潜伏侵染,是控制农作物生长和储存过程中伏马毒素污染的有效措施。在自然界中,伏马毒素主要是层出镰刀菌、拟轮枝镰刀菌和花腐镰刀菌等产生的次级代谢产物。然而,许多天然存在的这些真菌并不具有产生伏马毒素的能力,可以考虑使用此类有益的不产毒菌株,利用微生物之间的竞争作用,抑制产毒菌株的生长与繁殖,减少产毒菌群数量,降低伏马毒素污染水平。我国对不产毒层出镰刀菌生防菌的研究处在起步阶段,尚无在田间成功推广应用的案例。本发明经过广泛研究,从53株不产伏马毒素的层出镰刀菌中筛选出一个菌株fp26,具有快速生长、繁殖的能力,对不同地区的产毒菌株具有较强的竞争优势,能显著降低农作物中伏马毒素的污染风险。
技术实现要素:
5.针对现有技术存在的问题,本发明的目的在于设计提供层出镰刀菌fp26及其应用的技术方案。该层出镰刀菌fp26能够快速生长、繁殖,通过与伏马毒素生产者相互竞争,而分散到土壤、田间有机资源和作物表面,利用不产毒层出镰刀菌的群体优势而保护农作物,从而有效控制伏马毒素污染。
6.为了实现上述技术效果,本发明提供以下技术方案:
7.本发明一方面提供了一株层出镰刀菌(fusariumproliferatum)fp26。该菌株已于2021年11月16日保藏于中国微生物菌株保藏管理委员会普通微生物中心(简称cgmcc,地址为:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所),保藏登记号为cgmcc no.23809。
8.进一步,该层出镰刀菌fp26不产生伏马毒素。
9.上述的层出镰刀菌fp26是从分离自我国不同地区的698株层出镰刀菌中,通过菌
株产毒能力评价以及竞争抑制效果试验筛选而出。本发明从我国东北稻区、华东稻区、华南稻区和西南稻区,采集了1500余份水稻穗腐病感病样品,通过分离、纯化和鉴定获得层出镰刀菌698株;对这些菌株进行伏马毒素产毒能力测定后,选择53株不产伏马毒素的层出镰刀菌,进行竞争抑制效果研究和产毒能力评价。在稻谷上与产毒菌株fp9(孙磊,王玲,刘连盟,侯雨萱,黎起秦,黄世文.水稻穗腐病菌强致病力且高产伏马菌素菌株筛选.中国水稻科学,2018,32(6):610~616.)进行共培养和产毒抑制效果评价,初步筛选出14株对产毒菌fp9具有显著抑制效果的菌株。进一步将14株不产毒层出镰刀菌与分离自不同地区(安徽合肥、河南郑州、辽宁沈阳、山东泰安、云南保山)的产毒层出镰刀菌在稻谷上共培养,在产毒抑制效果评价后筛选出1株对不同地理来源的产毒菌株均具有显著竞争抑制效果的层出镰刀菌菌株fp26。该菌株具有快速生长和繁殖的特点,能显著竞争抑制产毒层出镰刀菌生长和繁殖能力,减低水稻等农产品中伏马毒素含量。
10.本发明第二方面提供一种含有层出镰刀菌fp26菌体和/或发酵液的菌剂。
11.进一步,所述层出镰刀菌孢子数量至少达到10
10
~10
11
个/kg。
12.本发明第三方面提供一种含有层出镰刀菌fp26菌体和/或发酵液的菌剂的制备方法,其包括以下步骤:
13.1)将层出镰刀菌fp26接种于pda培养基中,28℃培养7~8d,加入无菌水冲洗培养基表面的分生孢子,获得分生孢子浓度为106个/ml的菌悬液;
14.2)按质量比1~3%的添加量,将层出镰刀菌的菌悬液接种于玉米培养物载体上,在26~30℃培养12~15d,每2~3d摇匀一次,获得发酵产物;
15.3)低温干燥发酵产物至水分10%以下,研磨成粉,得到层出镰刀菌固态菌剂。
16.进一步,所述玉米培养物载体具体为:按质量份计,玉米谷粒:玉米粉为2:1,按培养物载体干物质的总质量添加3%硫酸铵,加水使含水量达到60%,121℃,20min,高压灭菌。
17.本发明第四方面提供含有层出镰刀菌fp26菌体和/或发酵液的菌剂在抑制环境中伏马毒素生产者的生长、繁殖和产毒能力中的应用。
18.本发明第五方面提供含有层出镰刀菌fp26菌体和/或发酵液的菌剂在防治农作物伏马毒素污染中的应用。
19.进一步,应用时在农作物生命周期中的不同生长期施用菌剂,施用量为3~5kg/亩,施用后保持土壤湿润,以有利于生防菌的定殖。
20.进一步,应用时菌剂施用于一种或多种伏马毒素生产者造成伏马毒素污染的区域,或存在受一种或多种伏马毒素生产者造成伏马毒素污染风险的区域,在田间预防或减少农作物中伏马毒素污染。
21.由层出镰刀菌侵染引起的水稻穗腐病和玉米穗腐病是我国水稻和玉米上普遍发生的病害之一。这两种病害不仅造成严重的产量损失,而且引起伏马毒素污染。为了证明层出镰刀菌fp26对水稻穗腐病和玉米穗腐病产毒菌株有抑制作用,发明人作了如下实验:
22.将所述的不产毒层出镰刀菌fp26以玉米为基质,发酵培养后研磨成粉,制备成固态菌剂。在水稻穗腐病和玉米穗腐病的常发区开展实验,将不产毒层出镰刀菌固态菌剂均匀撒施于水稻和玉米的农田里,能够降低伏马毒素产毒菌株的侵染,减轻水稻穗腐病和玉米穗腐病的病情发展,有效抑制水稻谷粒和玉米果穗中伏马毒素的污染。
23.田间试验表明,层出镰刀菌fp26可为今后产毒层出镰刀菌生物防治提供生防菌的来源,在农作物种植过程中,通过不产毒层出镰刀菌种群和数量的优势,抑制伏马毒素产毒菌株的侵染与毒素合成,在田间有效防治农作物中伏马毒素的污染。
24.在上述应用中,所述层出镰刀菌fp26抑制伏马毒素生产者的体现在:层出镰刀菌fp26造成伏马毒素生产者的生物量和产毒量降低,有效控制农作物生长过程中产毒菌株的潜伏侵染,进而显著降低农作物伏马毒素污染的风险。
25.与现有技术相比,本发明的有益效果:
26.(1)本发明的不产伏马毒素的层出镰刀菌菌株fp26是一株竞争优势强的生防菌株,对不同地理来源的产毒菌株具有显著竞争抑制效果,克服了生防菌剂在不同地域防治效果存在差异的问题。将高竞争力的不产毒菌株fp26大面积撒施于农田后,使其在自然种群的竞争中以强的生长优势抑制伏马毒素生产者的繁殖和产毒,有利于从根本上解除伏马毒素的产生与积累,从而有效控制农作物中伏马毒素的污染,提高农产品质量安全。
27.(2)为了递送和支持层出镰刀菌fp26的生长,并增加其频率以成为自然环境的主要组分,本发明将菌株fp26包被在玉米营养物载体上。当环境条件有利于伏马毒素生产者繁殖时,玉米营养物载体对于不产毒菌株fp26超出或取代有害的伏马毒素生产者的最佳能力是必不可少的,能够克服生防菌剂在田间应用过程中防效不稳定的问题。
附图说明
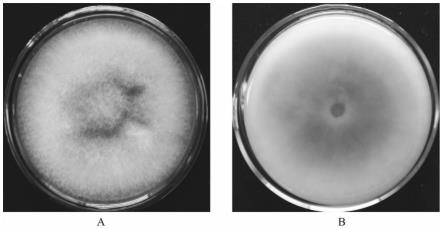
28.图1为层出镰刀菌菌株fp26在pda培养基上的菌落形态,其中a为正面菌落形态,b为背面菌落形态。
29.图2为层出镰刀菌菌株fp9在pda培养基上的菌落形态,其中a为正面菌落形态,b为背面菌落形态。
30.图3为层出镰刀菌菌株fp26对菌株fp9在稻谷上产生伏马毒素fb1的竞争抑制作用,其中a为菌株fp9在稻谷上单独培养后测定fb1含量的hplc图谱,b为菌株fp26和菌株fp9在稻谷上混合培养后测定fb1含量的hplc图谱。
具体实施方式
31.下面将通过具体实施例对本发明作进一步的说明,但不能理解为是对本发明保护范围的限定。本发明的实施例可作为本技术领域普通技术人员进一步改进的指南,并不以任何方式构成对本发明的限制。
32.本发明实施例中提供的不产生伏马毒素的层出镰刀菌菌株fp26,分类命名为fusarium proliferatum。该菌株已于2021年11月16日保藏于中国微生物菌株保藏管理委员会普通微生物中心(简称cgmcc,地址为:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所),保藏登记号为cgmcc no.23809。
33.本发明实施例中所述的产生伏马毒素的层出镰刀菌菌株fp9,记载于“孙磊,王玲,刘连盟,侯雨萱,黎起秦,黄世文.水稻穗腐病菌强致病力且高产伏马菌素菌株筛选.中国水稻科学,2018,32(6):610~616.”一文。
34.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。
35.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
36.下述实施例涉及的培养基和试剂组分包括:
37.水琼脂(wa)培养基(g/l):琼脂20g,蒸馏水定容至1l。121℃,20min,高压灭菌。
38.马铃薯葡萄糖(pdb)培养基(g/l):葡萄糖20g,马铃薯200g,用蒸馏水定容至1l。121℃,20min,高压灭菌。
39.马铃薯葡萄糖琼脂(pda)培养基(g/l):葡萄糖20g,马铃薯200g,琼脂20g/l,用蒸馏水定容至1l。121℃,20min,高压灭菌。
40.玉米培养物载体:按质量配比玉米谷粒:玉米粉=2:1,按培养物载体干物质的总质量添加3%硫酸铵,加水使培养物含水量达到60%。121℃,20min,高压灭菌。
41.稻谷产毒培养基:50g水稻谷粒置于250ml三角瓶中,加入10ml蒸馏水浸泡过夜。121℃,20min,高压灭菌。
42.玉米产毒培养基:50g玉米谷粒置于250ml三角瓶中,加入10ml蒸馏水浸泡过夜。121℃,20min,高压灭菌。
43.小麦产毒培养基:50g小麦谷粒置于250ml三角瓶中,加入10ml蒸馏水浸泡过夜。121℃,20min,高压灭菌。
44.大麦产毒培养基:50g大麦谷粒置于250ml三角瓶中,加入10ml蒸馏水浸泡过夜。121℃,20min,高压灭菌。
45.高粱产毒培养基:50g高粱谷粒置于250ml三角瓶中,加入10ml蒸馏水浸泡过夜。121℃,20min,高压灭菌。
46.实施例1:层出镰刀菌菌株fp26的获得
47.一、菌株fp26的采集与分离
48.从我国辽宁盘锦水稻田中采集了一份水稻穗腐病感病样品。将水稻穗腐病的发病谷粒,用70%乙醇进行表面消毒,无菌水冲洗2遍,用灭菌的滤纸将水分吸干。将颖壳的病健交界处切开,放在wa培养基上,28℃培养。待菌落形成后,挑取尖端菌丝体,接种于pda平板上培养,经过单孢子分离纯化后,获得菌株fp26。二、菌株fp26的伏马毒素fb1含量测定
49.(1)待测样品制备
50.将菌株fp26接种于pda培养基上,28℃培养7~8d。用无菌水洗脱分生孢子,稀释得到分生孢子浓度为106个/ml的菌悬液。
51.(2)伏马毒素产毒培养
52.将1ml菌株fp26的菌悬液接种于稻谷产毒培养基中,28℃黑暗培养15d,每3~5d摇匀一次,使菌株fp26在培养基上生长均匀。
53.(3)伏马毒素fb1含量测定
54.fb1检测方法为高效液相色谱-串联质谱(hplc-ms)法。具体如下:
55.将样品用甲醇-水-乙酸(74∶25∶1)提取后,收集净化液,移入sax固相萃取小柱,收集洗脱液,50℃氮气吹至近干,加入含0.1%乙酸的30%乙腈,过0.22μm有机滤膜,用hplc-ms法测定fb1浓度。液相色谱分离条件:zorbax extend-c18反相色谱柱;流动相:a为0.1%乙酸水溶液,b为乙腈;二元梯度洗脱程序:0~1min,70%a;1~6min,70%~20%a;6~9min,20%a;9~9.01min,20%~70%a;9.01~15min,70%a;流速为0.2ml/min。柱温:30℃。电喷雾离子源,正离子采集模式,选择反应监测;喷雾电压3200v;辅助气(n2)压力为
34.48kpa,鞘气(n2)压力为206.89kpa;毛细管温度为350℃;离子源温度350℃。
56.hplc-ms检测结果表明,菌株fp26在稻谷上培养15d后,hplc图谱没有产生色谱峰。由此可见,菌株fp26不能产生伏马毒素fb1。
57.三、菌株fp26的鉴定
58.(1)形态学鉴定
59.菌株fp26在pda培养基上产生白色菌丝,菌落背面呈浅灰色,见图1。大型分生孢子数量少,呈镰刀形或纺锤形,具3~5个隔膜,大小为(18.3~43.1)μm
×
(2.8~4.5)μm,平均31.8μm
×
3.4μm;小型分生孢子呈椭圆形,0~2个隔膜,大小为(5.2~13.6)μm
×
(2.2~5.3)μm,平均8.2μm
×
3.4μm。
60.根据菌株fp26在pda上生长的菌落形态和分生孢子形态,参照《中国真菌志》(孔华忠,中国真菌志—青霉属及其相关有性形属[m].第35卷.北京:科学出版社,2004)和《真菌鉴定手册》(魏景超,真菌鉴定手册[m].上海:上海科学技术出版社,1979),菌株fp26符合镰刀属的生长特性,初步确认该菌株隶属于镰刀菌属真菌(fusarium spp.)
[0061]
(2)分子鉴定
[0062]
将纯化的菌株fp26接种到pdb培养液中,28℃振荡培养5d后,取菌丝团研磨成粉末,利用ctab法提取菌丝dna。通过真菌的its序列以及转录延伸因子ef基因序列对fp26菌株进行种属鉴定。
[0063]
its序列扩增所用的引物序列为:
[0064]
its1:5
’‑
gaagtaaaagtcgtaacaag-3’(如seq id no.1);
[0065]
its4:5
’‑
cctccgcttattgatatgc-3’(如seq id no.2);
[0066]
转录延伸因子ef基因扩增所用的引物序列为:
[0067]
ef1:5
’‑
atgggtaaggargacaagac-3’(如seq id no.3);
[0068]
ef2:5
’‑
ggargtaccagtsatcatgtt-3’(如seq id no.4);
[0069]
pcr扩增反应程序为:94℃预变性5min;94℃变性30s,55℃退火30s,72℃延伸40s,共30个循环;72℃延伸10min。pcr扩增后,产物送至上海生工生物工程有限公司测序。
[0070]
经测序可知,菌株fp26的its序列和ef序列分别如seq id no.5和seq id no.6所示。将基因序列与ncbi中genbank数据库进行blastn比对可知,菌株fp26的its基因序列与层出镰刀菌菌株mw10的its序列(genbank:kt803067)的同源性为100%;菌株fp26的ef基因序列与层出镰刀菌菌株g1的ef基因序列(genbank:mn245720)的同源性为100%。
[0071]
经以上形态学鉴定和分子生物学鉴定,可知不产生伏马毒素的菌株fp26为层出镰刀菌,其分类命名为fusarium proliferatum。
[0072]
通过以上鉴定结果,所得的菌株fp26为不产生伏马毒素的层出镰刀菌(fusarium proliferatum),并对其进行了保藏,保藏单位:中国微生物菌株保藏管理委员会普通微生物中心(地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101),保藏日期为:2021年11月16日,保藏号:cgmcc no.23809。
[0073]
实施例2:不产毒层出镰刀菌fp26对产毒层出镰刀菌fp9的竞争抑制作用
[0074]
实施例中所述的产生伏马毒素的层出镰刀菌菌株fp9,记载于“孙磊,王玲,刘连盟,侯雨萱,黎起秦,黄世文.水稻穗腐病菌强致病力且高产伏马菌素菌株筛选.中国水稻科学,2018,32(6):610~616.”一文。层出镰刀菌菌株fp9在pda上的菌落形态如图2所示。
[0075]
将不产生伏马毒素的层出镰刀菌菌株fp26和产生伏马毒素的层出镰刀菌菌株fp9,分别接种于pda固体培养基上,28℃培养6d。不产毒的层出镰刀菌菌株fp26在pda培养基上生长较快,可长满直径9cm的培养皿,产孢量为5.7
×
107个/ml。相同条件下,产毒的层出镰刀菌菌株fp9的菌落直径为7.35cm,产孢量为2.6
×
106个/ml。由此可见,相对于产毒菌株,层出镰刀菌菌株fp26具有快速生长和繁殖能力的优势。
[0076]
用无菌水依次稀释,获得菌株fp26的分生孢子浓度为104、105、106、107个/ml的菌悬液,以及菌株fp9的分生孢子浓度为105个/ml的菌悬液。处理组将不同孢子浓度的菌株fp26和菌株fp9的菌悬液,以体积比为1:1进行混合。取1ml混合液接种到稻谷产毒培养基中,充分摇动稻谷,使分生孢子均匀黏附在稻谷的表面。以单独接种菌株fp9的菌悬液至稻谷产毒培养基作为对照组。28℃下,黑暗培养10d,期间适当振荡2~3次,测定稻谷中fb1的含量,计算不同孢子浓度的菌株fp26对菌株fp9的产毒抑制率,计算方法为:
[0077]
产毒抑制率(%)=(对照组fb1含量—处理组fb1含量)/对照组fb1含量
×
100%。
[0078]
由表1可知,当不产毒菌与产毒菌(fp26:fp9)为较低浓度比(104:105个/ml)时,菌株fp26对菌株fp9的产毒抑制率为43.9%;当fp26:fp9孢子浓度比为105:105个/ml时,菌株fp26对菌株fp9的产毒抑制率为62.4%,如图3所示;当fp26:fp9孢子浓度比为106:105个/ml时,菌株fp26对菌株fp9的产毒抑制率为73.2%;当fp26:fp9孢子浓度比为较高浓度比(107:105个/ml)时,菌株fp26对菌株fp9的产毒抑制率高达96.4%。结果表明,不产毒菌株fp26对产毒菌株fp9的产毒抑制率,随着不产毒菌株fp26分生孢子浓度的增加而有更明显的抑制效果。
[0079]
表1不同孢子浓度的菌株fp 26对菌株fp9产毒抑制作用
[0080]
菌株孢子浓度比(个/ml)fb1含量(μg/kg)产毒抑制率(%)fp9对照组(105)31453.2
±
1973.3a fp26:fp9(104:105)17631.6
±
853.6b43.9fp 26:fp9(105:105)11830.5
±
903.9bc62.4fp 26:fp9(106:105)8436.2
±
574.8c73.2fp 26:fp9(107:105)1141.4
±
87.5d96.4
[0081]
注:同列不相同字母代表有差异性显著(p《0.05)。
[0082]
实施例3:层出镰刀菌菌株fp26对不同地区产毒层出镰刀菌的竞争抑制作用
[0083]
将不同地区分离的产生伏马毒素的层出镰刀菌,其菌株编号为fp39(安徽合肥)、fp153(河南郑州)、fp387(辽宁沈阳)、fp417(山东泰安)、fp665(云南保山),分别接种于pda固体培养基上。28℃培养5d后,分别用无菌水洗脱分生孢子,稀释得到分生孢子浓度为105个/ml的菌悬液。
[0084]
将不产毒层出镰刀菌菌株fp26,接种于pda固体培养基上。28℃培养7~8d后,用无菌水洗脱分生孢子,稀释得到分生孢子浓度为105个/ml的菌悬液。
[0085]
处理组将不产毒的层出镰刀菌fp26和产毒的层出镰刀菌(fp39、fp153、fp387、fp417和fp665)的菌悬液,两两组合,以体积比为1:1进行混合,取1ml混合液接种到灭菌处理的稻谷产毒培养基中,充分摇动稻谷,使分生孢子均匀黏附在稻谷的表面。以单独接种1ml产毒菌株的菌悬液至稻谷产毒培养基作为对照组。28℃培养15d,期间适当振荡3~4次,测定稻谷中fb1的含量,计算菌株fp26对产毒菌株的产毒抑制率,计算方法为:
[0086]
产毒抑制率(%)=(对照组fb1含量—处理组fb1含量)/对照组fb1含量
×
100%。
[0087]
由表2可知,层出镰刀菌菌株fp26对分离自不同地区的层出镰刀菌菌株fp39(安徽合肥)、fp153(河南郑州)、fp387(辽宁沈阳)、fp417(山东泰安)和fp665(云南保山)的产毒抑制率分别为75.8%、85.7%、63.1%、82.4%、77.3%,菌株fp26明显抑制了产毒菌株在稻谷上伏马毒素的积累。由此表明,不产毒层出镰刀菌菌株fp26具有广适应性,能够竞争抑制不同地区的产毒菌株的生长,显著降低伏马毒素的污染水平。
[0088]
表2菌株fp 26对不同地区产毒菌株的产毒抑制作用
[0089]
菌株fb1含量(μg/kg)产毒抑制率(%)fp3954658.8
±
2904.8—fp39+fp2613227.2
±
971.975.8fp15389032.3
±
3993.4—fp153+fp2612754.9
±
642.385.7fp38726439.7
±
882.6—fp387+fp269748.6
±
752.763.1fp41735749.6
±
1853.5—fp417+fp266294.8
±
547.282.4fp66546621.6
±
2754.5—fp665+fp2610567.5
±
843.877.3
[0090]
实施例4:层出镰刀菌fp26在不同基质上对产毒层出镰刀菌fp9的抑制效果
[0091]
将不产毒层出镰刀菌菌株fp26和产毒层出镰刀菌菌株fp9,分别接种于pda固体培养基上。28℃培养7~8d后,用无菌水洗脱分生孢子,稀释得到分生孢子浓度为105个/ml的菌悬液。
[0092]
处理组将菌株fp26和菌株fp9的菌悬液,以体积比为1:1混合,取1ml混合液分别接种到灭菌处理后的稻谷、玉米、小麦、大麦、高粱产毒培养基中,充分摇动,使分生孢子均匀黏附在不同培养基质的表面。以单独接种1ml菌株fp9的菌悬液至稻谷、玉米、小麦、大麦、高粱产毒培养基中作为对照组。28℃、黑暗培养15d,期间适当振荡3~4次,测定不同基质中fb1的含量,计算在不同基质上菌株fp26对菌株fp9的产毒抑制率,计算方法为:
[0093]
产毒抑制率(%)=(对照组fb1含量—处理组fb1含量)/对照组fb1含量
×
100%。由表3可知,以玉米为基质,菌株fp26对菌株fp9的产毒抑制率最明显,高达88.1%;其次,以稻谷和小麦为基质,菌株fp26对菌株fp9的产毒抑制率分别为78.3%和75.6%;以大麦和高粱为基质,菌株fp26对菌株fp9的产毒抑制率相对较低,分别为43.0%和52.1%;结果表明,层出镰刀菌菌株fp26在稻谷、玉米、小麦、大麦、高粱上均具有抑制产毒菌株合成伏马毒素的能力,其中以玉米基质抑制效果最明显。
[0094]
表3在不同基质上菌株fp26对菌株fp9的产毒抑制作用
[0095]
基质对照组fb1含量(μg/kg)处理组fb1含量(μg/kg)产毒抑制率(%)稻谷38732.3
±
2478.310567.5
±
669.772.7玉米56891.4
±
3632.56733.4
±
482.288.1小麦36348.3
±
1945.78875.6
±
595.375.6大麦27894.7
±
1522.615897.4
±
1027.543.0
高粱15326.5
±
953.37345.9
±
486.452.1
[0096]
实施例5:层出镰刀菌菌株fp26在稻谷和玉米上分生孢子形成速率
[0097]
将层出镰刀菌菌株fp26接种于pda固体培养基上。28℃培养7~8d后,用无菌水洗脱分生孢子,稀释得到分生孢子浓度为106个/ml的菌悬液。将5ml菌株fp26的菌悬液接种至灭菌处理后的稻谷或玉米产毒培养基中,28℃培养,在适于孢子形成的条件下温育48h后,检查并记录孢子形成数量。
[0098]
将作为营养物载体的稻谷与玉米进行比较,以评估促进不产毒层出镰刀菌菌株fp26繁殖的载体。如表4所示,层出镰刀菌菌株fp26约72h内快速形成孢子,在稻谷上产生的分子孢子数量与玉米上的孢子数量有显著差异,在玉米表面形成的孢子数量比在稻谷上的数量至少高8倍以上。因此,本发明将玉米作为层出镰刀菌菌株fp26的营养物载体,将玉米谷粒和玉米粉的混合物与层出镰刀菌菌株fp26组合以形成固态菌剂。
[0099]
表4菌株fp26在稻谷和玉米基质上形成的孢子数量
[0100]
时间(h)玉米(个/g)稻谷(个/g)玉米比稻谷增加倍数482.9
×
1073.6
×
1068.1725.3
×
1084.8
×
10711.0968.6
×
1094.6
×
10818.71204.5
×
10
10
9.2
×
10848.91441.1
×
10
11
2.7
×
10940.71684.2
×
10
11
8.1
×
10
10
51.9
[0101]
实施例6:以层出镰刀菌为活性成分的固态菌剂的制备
[0102]
步骤1:将层出镰刀菌fp26接种于pda培养基中,28℃培养7~8d,加入无菌水冲洗培养基表面的分生孢子,获得分生孢子浓度为106个/ml的菌悬液。
[0103]
步骤2:按质量比1~3%的添加量,将层出镰刀菌fp26的菌悬液接种于玉米培养物载体中,在26~30℃培养12~15d,每2~3d摇匀一次,获得发酵产物。所述玉米培养物载体,按质量份计,玉米谷粒:玉米粉=2:1。按培养物载体干物质的总质量添加3%硫酸铵,加水使培养物含水量达到60%。121℃,20min,高压灭菌。
[0104]
步骤3:在40℃以下低温干燥发酵产物至水分10%以下,研磨成粉,得到层出镰刀菌固态菌剂,固态菌剂中层出镰刀菌的分生孢子数量至少达到10
10
~10
11
个/kg。
[0105]
实施例7:以层出镰刀菌为活性成分的固态菌剂在水稻上伏马毒素污染防治中的应用
[0106]
田间试验安排在浙江省杭州市富阳区的水稻田进行,试验田上一年水稻穗腐病发生严重。田间种植水稻穗腐病的感病品种秀水134,适当调整播种时间,使植株发病期与适宜水稻穗腐病发生流行的气候条件相遇。处理组在水稻孕穗期,按照5kg/亩的用量,均匀撒施实施例6中的固态菌剂;在水稻抽穗扬花期,再按照同样用量撒施实施例6中的固态菌剂。施用后田间保持浅水层,以利于生防菌的定殖。同时设置喷施等量的清水为对照组。每个处理包括3次重复,随机区组排列,每个小区面积为66.7m2,土壤肥力均匀一致,常规田间管理措施。在水稻蜡熟期,从每个小区随机选取50个稻穗,根据表5的症状描述,记载稻穗的病情级别,计算病情指数,评价固态菌剂对水稻穗腐病的防治效果,检测稻谷中的fb1含量。各小区分开收获,单独计算水稻的各项产量指标。各参数计算公式如下:
[0107]
病情指数=∑(各级发病穗数
×
各级病情级数代表值)/(调查总穗数
×
严重度最高级代表值)
×
100。
[0108]
防治效果(%)=(对照组病情指数—处理组病情指数)/对照组病情指数
×
100%。
[0109]
由表6可知,对照组中水稻穗腐病的病情指数为68.5,处理组中水稻穗腐病的病情指数为17.2,固态菌剂对水稻穗腐病的防治效果达到74.9%。对照组中稻谷的fb1含量为3963.4μg/kg,处理组中稻谷的fb1含量降低为685.6μg/kg,固态菌剂对稻谷的fb1抑制率为82.7%。施加以层出镰刀菌为活性成分的固态菌剂后,水稻穗腐病的病情指数和稻谷中fb1含量均明显下降,说明层出镰刀菌菌株fp26在水稻上具有较好的定殖能力,能够在水稻上迅速生长,高效抑制产毒菌的生长与繁殖,减轻水稻上伏马毒素的污染程度。由表7可知,处理组中水稻的株高、有效穗数、千粒重和产量,与对照组相比,没有显著差异,说明以层出镰刀菌为活性成分的固态菌剂的施用对水稻产量没有影响。
[0110]
表5水稻穗腐病病情级别划分
[0111]
病情级别症状描述0穗子上无病斑1穗子上有零星病斑,发病面积占穗子面积的0.1%~10.0%3穗子上有少量病斑,发病面积占穗子面积的10.1%~25.0%5穗子上有大量病斑,发病面积占穗子面积的25.1%~50.0%7穗子上病斑相连,发病面积占穗子面积的50.1%~75.0%9穗子上基本为病斑覆盖,发病面积占穗子面积的>75.1%
[0112]
表6固态菌剂对水稻穗腐病发病程度和稻谷中fb1污染水平的影响
[0113][0114]
注:同列不相同字母代表有差异性显著(p《0.05)。
[0115]
表7固态菌剂对水稻产量性状的影响
[0116]
试验分组株高(cm)有效穗数(万)千粒重(g)产量(kg/亩)对照组123.67
±
8.9a0.93
±
0.01a26.64
±
1.3a545.7
±
26.5a处理组121.43
±
6.3a0.99
±
0.004a25.87
±
0.9a541.3
±
33.9a
[0117]
注:同列相同字母代表无差异性显著(p《0.05)。
[0118]
实施例8:以层出镰刀菌为活性成分的固态菌剂在玉米上伏马毒素污染防治中的应用
[0119]
田间试验安排在浙江省杭州市富阳区的玉米田进行,试验田上一年玉米穗腐病发生严重。田间种植的玉米品种为浚单20。处理组在玉米的大喇叭口期,按照5kg/亩的用量,均匀撒施实施例6中的固态菌剂;在玉米的开花期,再按照同样用量撒施实施例6中的固态菌剂。施用后田间保持浅水层。同时设置喷施等量的清水为对照组。每个处理包括3次重复,随机区组排列,每个小区面积为40.0m2,土壤肥力均匀一致,常规田间管理措施。在玉米植株成熟期,从每个小区随机选取40个玉米果穗,逐个剥开苞叶,根据表8的症状描述,记载玉
米果穗的病情级别,计算病情指数,评价固态菌剂对玉米穗腐病的防治效果,检测玉米果穗上的fb1含量。各小区分开收获,单独计算玉米的各项产量指标。各参数计算公式如下:
[0120]
病情指数=∑(各级发病穗数
×
各级病情级数代表值)/(调查总穗数
×
严重度最高级代表值)
×
100。
[0121]
防治效果(%)=(对照组病情指数—处理组病情指数)/对照组病情指数
×
100%。
[0122]
由表9可知,对照组中玉米穗腐病的病情指数为53.2,处理组中玉米穗腐病的病情指数为9.8,固态菌剂对玉米穗腐病的田间防治效果为81.6%。对照组中玉米果穗的fb1含量为7408.4μg/kg,处理组中玉米果穗的fb1含量降低为977.4μg/kg,固态菌剂对玉米果穗的fb1抑制率为86.8%。施加以层出镰刀菌为活性成分的固态菌剂后,玉米穗腐病的病情指数和果穗中fb1含量均明显下降,说明层出镰刀菌菌株fp26在玉米上具有较好的定殖能力,能够在玉米上迅速繁殖,抑制产毒菌的生长和fb1毒素的形成。由表10可知,处理组中玉米的株高、千粒重和产量,与对照组相比,没有显著差异,说明以层出镰刀菌为活性成分的固态菌剂的施用对玉米产量没有影响。
[0123]
表8玉米穗腐病病情级别划分
[0124]
病情级别症状描述0果穗上无病斑1发病面积占果穗总面积的0.1%~1.0%3发病面积占果穗总面积的2.0%~10.0%5发病面积占果穗总面积的11.0%~25.0%7发病面积占果穗总面积的26.0%~50.0%9发病面积占果穗总面积的>50.1%
[0125]
表9固态菌剂对玉米穗腐病发病程度和果穗fb1污染水平的影响
[0126][0127]
注:同列不相同字母代表有差异性显著(p《0.05)。
[0128]
表10固态菌剂对玉米产量性状的影响
[0129]
试验分组株高(cm)千粒重(g)产量(kg/亩)对照组216.7
±
14.6a312.4
±
15.5a594.8
±
27.5a处理组218.2
±
18.2a310.2
±
21.6a613.3
±
42.5a
[0130]
注:同列相同字母代表无差异性显著(p《0.05)。
[0131]
最后,还需要注意的是,以上列举的仅是本发明的若干个具体实施例,而并非对实施方式的限制。对于所属领域的普通技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数和条件下,在较宽范围内实施本发明,这里无需也无法对所有的实施方式予以穷举。但是,凡是未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作的任何修改、等同变化与改型,仍属于本发明技术方案的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1