检测PDCoV的RT-RAA-LFD引物对、探针、试纸条、试剂盒及其应用
检测pdcov的rt-raa-lfd引物对、探针、试纸条、试剂盒及其应用
技术领域
1.本发明涉及动物疫病检测技术领域,具体涉及一种检测pdcov核酸的rt-raa-lfd引物对、探针、试纸条、试剂盒及应用。
背景技术:
2.pdcov是近年来新发现的一种猪肠道致病性冠状病毒,主要感染新生仔猪,临床症状表现为急性腹泻、呕吐、脱水和消瘦等,严重者发生死亡,已成为影响养猪生产的重要病原之一;尽管其他年龄阶段的猪也可以感染,但症状相对轻微。pdcov既可以通过健康猪直接接触带毒猪或患病猪的多种分泌物(如粪便、呕吐物、唾液、乳汁、鼻腔分泌物和精液等)而发生感染,也可以通过间接接触受病毒污染的饲料、器具、运输工具和饲养员等而发生感染。2012年,woo等从2007~2011年间采集的猪粪便拭子中首次测得pdcov的全基因组序列。
3.已有研究表明,除了感染猪之外,pdcov也能够感染野鸟、鸡、火鸡、牛等不同种属动物,说明该病毒具有潜在的跨物种传播风险(zhang j.,virus research,2016,226:71-84)。2021年,有研究从3名具有发热和腹痛症状的海地儿童血液中分离出pdcov,表明pdcov具有潜在的公共卫生意义(lednicky j.a.,nature,2021,600:133-137)。
4.在分类上,pdcov属于套式病毒目(nidovirales)、冠状病毒科(coronaviridae)、δ冠状病毒属(deltacoronavirus)。pdcov是有囊膜的单股正链rna病毒,其基因组结构为:5’utr-orf1a/1b-s-e-m-ns6-n-ns7-3’utr,全长约25kb。其中orf1a和orf1b编码两个多聚蛋白pp1a和pp1ab,据推测,pp1a和pp1ab可被orf1a/1b编码的蛋白酶切割成约16个非结构蛋白,主要参与病毒复制与转录。鉴于pdcov感染所导致的临床症状与猪流行性腹泻病毒(pedv)、猪传染性胃肠炎病毒(tgev)和猪轮状病毒(prov)等重要致猪腹泻性病毒十分相似,因此确诊pdcov感染需要依靠实验室检测技术。目前,国内外主要依靠rt-pcr、实时荧光定量rt-pcr和环介导等温扩增(lamp)等分子生物学方法以及间接免疫荧光、病毒中和试验以及间接elisa等血清学方法对pdcov感染进行检测与诊断。其中,rt-pcr、实时荧光定量rt-pcr和lamp等分子生物学检测方法涉及到的诊断靶标包括s、m、n和orf1等基因。尽管上述检测方法在pdcov的检测与诊断中发挥了重要作用,但均普遍存在操作复杂、耗时长、对仪器设备要求较高或引物设计过于复杂等不足,难以满足临床上对pdcov感染猪进行现场快速和可视化检测的实际需求。
5.近年来,一种基于重组酶介导等温核酸扩增(recombinase-aided amplification,raa)技术在人医和兽医疾病诊断与检测中正在显示出良好的应用潜力,已经引起了全世界的广泛关注。譬如,基于raa与侧向流免疫层析技术的病原体核酸检测方法已经成功应用于新型冠状病毒(sars-cov-2)和非洲猪瘟病毒(asfv)的快速诊断,并已经申请了国家发明专利保护。raa技术主要依靠单链dna结合蛋白(通过与单链dna结合,维持dna的单链状态,防止其重新配对形成双链dna)、重组酶(能与引物形成复合物,促进引物与模板dna的同源序列配对,启动dna复制)和dna聚合酶(用于扩增和延伸)在恒温条件下(37~
42℃)短时间内(≤20min)完成对目标核酸的扩增。
6.由于整个raa扩增过程无需复杂、昂贵的仪器设备,仅需一台便携式恒温仪甚至借助体温即可完成检测,因此,raa技术非常适合被开发应用于现场快速检测。在满足现场检测需求的基础上,本发明同时引入侧向流免疫层析技术,将核酸等温扩增与侧向流试纸条(lateral flow dipstick,lfd)相结合,从而实现对pdcov感染的现场快速可视化检测。
技术实现要素:
7.本发明的目的是提供一种快速可视化检测pdcov感染的方法。
8.更具体地的,本发明提供一种快速、可视化检测猪丁型(δ)冠状病毒(porcine deltacoronavirus,pdcov)的反转录重组酶介导等温扩增(reverse transcription recombinase-aided amplification,rt-raa)结合侧向流试纸条(lateral flow dipstick,lfd)方法的引物对、探针、试纸条、试剂盒及其应用。
9.第一方面,本发明提供一种引物探针组合,所述引物的序列如seq id no.3和seq id no.16所示,所述探针的序列如seq id no.17所示。
10.在本发明提供的引物探针组合中,所述探针的5’端进行生物素修饰,第32位碱基c被四氢呋喃(thf)替代,3’端进行磷酸化修饰;反向引物的5’端进行荧光基团fam修饰。
11.所述探针序列如下:
[0012]5’‑
biotin-ggtccagagtaccgctgtgaggagccgcttg[thf]taaattagtaggagt-phosphorylation-3’[0013]
所述反向引物序列如下:
[0014]5’‑
fam-acgtgttaggaacatattatgatacgcatc-3’。
[0015]
根据本领域技术人员的理解,本发明请求保护,上述引物探针组合,在制备pdcov的检测试剂盒或检测试纸条中的应用。
[0016]
第二方面,本发明提供一种pdcov的rt-raa-lfd检测试剂盒,所述检测试剂盒中含有上述的引物探针组合。
[0017]
在本发明提供的rt-raa-lfd检测试剂盒中,还包括,反应缓冲液和酶类。具体地,所述酶类包括逆转录酶、重组酶、dna聚合酶、单链dna结合蛋白和核酸内切酶iv。
[0018]
本发明提供的rt-raa-lfd检测试剂盒的反应体系(25.00μl)包括:反应缓冲液a 14.70μl;反应缓冲液b1.25μl;10pmol/μl正向引物1.00μl;10pmol/μl反向引物1.00μl;10pmol/μl探针0.30μl;pdcov rna模板1.00μl和无核酸酶水5.75μl。
[0019]
第三方面,本发明提供一种pdcov核酸的检测试纸条,用于检测上述检测试剂盒扩增得到的产物,所述检测试纸条包括:样品结合垫、检测线、质控线;所述样品结合垫含有胶体金标记的链霉亲和素;所述检测线处含有鼠抗fam的单克隆抗体;所述质控线含有偶联牛血清白蛋白(bsa)的生物素。
[0020]
具体地,本发明所提供的试纸条被固定于pvc底板上,从左往右依次为样品垫、结合垫、nc膜、吸水纸;nc膜上有t线(检测线)和c线(质控线),在试纸条样品结合垫含有胶体金标记的链霉亲和素、检测线(t线)含有鼠抗fam的单克隆抗体、质控线(c线)含有偶联牛血清白蛋白(bsa)的生物素。
[0021]
第四方面,本发明提供pdcov核酸检测试纸条的使用方法,包括:
[0022]
以待测样品中提取的rna为模板,使用上述检测试剂盒进行扩增,获得扩增产物,采用所述检测试纸条将扩增产物进行可视化判读;
[0023]
结果判定标准为:阳性结果出现两条红色条带,一条位于检测线(t线),另一条位于质控线(c线);阴性结果仅在质控线(c线)出现一条红色条带,而在检测线(t线)无红色条带出现;若仅检测线出现红色条带,而质控线不出现红色条带,则为无效检测结果。
[0024]
在本发明所提供的使用方法中,所述扩增的反应条件为40℃恒温扩增10min。
[0025]
更具体地,pdcov核酸检测试纸条的使用方法,包括如下步骤:
[0026]
(1)rna提取:以常规方法提取待测样品的rna;
[0027]
(2)rt-raa恒温扩增:以样品中提取的rna为模板,利用所述pdcov的rt-raa试剂盒进行扩增反应,40℃恒温扩增10min;
[0028]
(3)扩增产物的侧向流试纸条(lfd)检测:将扩增产物利用所述的试纸条进行检测,将扩增产物滴在试纸条样品垫处,产物会沿着nc膜向吸水纸方向层析,当有待测rna扩增产物时,就会形成“胶体金标记的链霉亲和素—两端分别携带biotin和fam标签的rna扩增产物”复合物,被nc膜上t线处标记的鼠抗fam单克隆抗体所拦截,经过积累形成肉眼看见的红色条带。
[0029]
根据本领域技术人员的理解,还请求保护检测pdcov的rt-raa-lfd引物对、探针、试剂盒和试纸条在pdcov检测领域的应用以及在可视化判定pdcov感染中的应用。
[0030]
本发明的有益效果在于:
[0031]
本发明所述检测pdcov的rt-raa-lfd引物对、探针、试剂盒和侧向流试纸条,针对于pdcov的rt-raa-lfd检测,筛选出适宜于现场快速可视化检测pdcov orf1b基因的正向引物f3、反向引物mr7和探针mp,可实现对pdcov进行快速、特异、灵敏、简便地检测,从而弥补现有检测技术的不足。
[0032]
本发明所述pdcov的rt-raa-lfd引物对、探针、试剂盒和试纸条,基于所述rt-raa-lfd引物对和探针进行pdcov目的基因序列的扩增,只需在40℃恒温条件下反应10min即可完成,该方法反应迅速,对仪器要求简单,仅需一台恒温水浴锅或便携式恒温仪即可完成核酸扩增过程,借助侧向流试纸条可以对检测结果进行肉眼判读,本发明在pdcov的现场快速可视化检测方面具有广阔的应用前景。
附图说明
[0033]
图1为本发明所参考的全球124株猪丁型冠状病毒代表性毒株基因序列信息及最优引物与探针在orf1b基因中具体位置的示意图;其中,毒株的来源国家或地区及其genbank登录号标注于图的左侧。
[0034]
图2为本发明所设计的用于建立猪丁型冠状病毒rt-raa-lfd的7对候选引物与探针在诊断靶标orf1b基因最保守区域(16000-16213bp)的分布示意图;其中,f1~f7代表7条候选上游引物;r1~r7代表7条候选下游引物,mr7代表在r7引入一个核苷酸突变(第6位核苷酸t
→
c)后的引物;p代表nfo探针,mp代表在探针p引入两个核苷酸突变(第4位核苷酸g
→
c、第27位核苷酸a
→
g)后的探针。
[0035]
图3为本发明提供的rt-raa引物筛选的2%琼脂糖凝胶电泳结果;其中,(a)用随机挑选的上游引物f1,筛选全部7条下游引物r1、r2、r3、r4、r5、r6和r7;(b)用筛选出的最优下
游引物r7,筛选全部7条上游引物f1、f2、f3、f4、f5、f6和f7;最终证实f3为最优的上游引物,r6为次优下游引物(备选);m:8000bp marker。
[0036]
图4为本发明筛选出的两对候选引物对(f3/r7和f3/r6)与探针(p)的rt-raa-lfd检测结果;其中,1:向反应体系中加入上游引物f3、下游引物r7、探针p和1.6
×
105tcid
50
/ml pdcov rna进行rt-raa-lfd扩增与检测的结果;2:向反应体系中加入上游引物f3、下游引物r7、探针p,但不加pdcov rna直接进行rt-raa-lfd扩增与检测的结果;3:向反应体系中加入上游引物f3、下游引物r6、探针p和1.6
×
105tcid
50
/ml pdcov rna进行rt-raa-lfd扩增与检测的结果;4:向反应体系中加入上游引物f3、下游引物r6、探针p,但不加pdcov rna直接进行rt-raa-lfd扩增与检测的结果;ntc代表无模板对照。
[0037]
图5为本发明对下游引物(r7和r6)与探针(p)之间碱基互补配对分析及其对rt-raa-lfd检测结果的影响,(a)中,p代表未引入核苷酸突变的nfo探针;r6和r7代表未引入核苷酸突变的下游引物;mp代表在探针p引入两个核苷酸突变(第4位核苷酸g
→
c、第27位核苷酸a
→
g)后的探针;mr7代表在r7引入一个核苷酸突变(第6位核苷酸t
→
c)后的引物;核苷酸之间的短线:下游引物与探针之间可能形成的碱基互补配对;(b)中,1:向反应体系中加入上游引物f3、下游引物mr7、探针mp和1.6
×
105tcid
50
/ml pdcov rna进行rt-raa-lfd扩增与检测的结果;2:向反应体系中加入上游引物f3、下游引物mr7、探针mp,但不加pdcov rna直接进行rt-raa-lfd扩增与检测的结果;ntc代表无模板对照。
[0038]
图6为本发明所提供的rt-raa-lfd的最优反应温度和反应时间的优化结果;其中,a:不同反应温度的结果;b:利用imagej软件分析不同反应温度试纸条的质控线(c线)和检测线(t线)的光密度值,计算与比较t/c比值;c:不同反应时间的结果;d:利用imagej软件分析不同反应时间试纸条的c线和t线的光密度值,计算与比较t/c比值。
[0039]
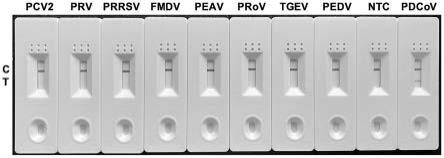
图7为本发明所述rt-raa-lfd特异性试验的检测结果;其中,pcv2:猪圆环病毒2型;prv:猪伪狂犬病毒;prrsv:猪繁殖与呼吸综合征病毒;fmdv:口蹄疫病毒;peav:猪肠道甲型冠状病毒;prov:猪轮状病毒;tgev:猪传染性胃肠炎病毒;pedv:猪流行性腹泻病毒;ntc:无模板对照;pdcov:猪丁型冠状病毒;c:质控线;t:检测线。
[0040]
图8为本发明所述rt-raa-lfd敏感性试验的检测结果;其中,(a)为pdcov rt-raa-lfd检测结果;1:1.6
×
107tcid
50
/ml pdcov rna;2:1.6
×
106tcid
50
/ml pdcov rna;3:1.6
×
105tcid
50
/ml pdcov rna;4:1.6
×
104tcid
50
/ml pdcov rna;5:1.6
×
103tcid
50
/ml pdcov rna;6:1.6
×
102tcid
50
/ml pdcov rna;7:1.6
×
101tcid
50
/ml pdcov rna;8:1.6
×
100tcid
50
/ml pdcov rna;9:1.6
×
10-1
tcid
50
/ml pdcov rna;10:1.6
×
10-2
tcid
50
/ml pdcov rna;11:1.6
×
10-3
tcid
50
/ml pdcov rna;12:无模板对照(ntc);c:质控线;t:检测线;(b)pdcov rt-raa-lfd检测结果的概率回归分析,95%置信区间的检测限为10
3.599
tcid
50
/ml pdcov rna(相当于3.97tcid
50 pdcov rna/反应)。
[0041]
图9为本发明中,与rt-raa-lfd进行灵敏度比较的实时荧光定量rt-pcr的检测结果;其中,(a)为pdcov实时荧光定量rt-pcr检测结果;1:1.6
×
107tcid
50
/ml pdcov rna;2:1.6
×
106tcid
50
/ml pdcov rna;3:1.6
×
105tcid
50
/ml pdcov rna;4:1.6
×
104tcid
50
/ml pdcov rna;5:1.6
×
103tcid
50
/ml pdcov rna;6:1.6
×
102tcid
50
/ml pdcov rna;7:1.6
×
101tcid
50
/ml pdcov rna;8:1.6
×
100tcid
50
/ml pdcov rna;9:1.6
×
10-1
tcid
50
/ml pdcov rna;10:1.6
×
10-2
tcid
50
/ml pdcov rna;11:1.6
×
10-3
tcid
50
/ml pdcov rna;12:无模板对
照(ntc);(b)pdcov实时荧光定量rt-pcr的概率回归分析,95%置信区间的检测限为10
2.366
tcid
50
/ml pdcov rna(相当于0.232tcid
50 pdcov rna/反应)。
具体实施方式
[0042]
以下实施例用于说明本发明,但不用来限制本发明的范围。
[0043]
实施例1 pdcov的rt-raa-lfd引物对和探针设计、筛选及优化
[0044]
下载ncbi数据库中124条国内外代表性pdcov毒株的全基因组序列,利用mafft软件(version 7)对序列进行对比与分析,选择pdcov基因组中核苷酸序列最保守的一段位于orf1b基因内长约213bp的区域作为诊断靶标(如图1所示),根据raa引物和探针设计的基本原则分别设计了7条上游引物(f1~f7)、7条下游引物(r1~r7)和1条探针(p)。所有的引物和探针序列信息如表1所示,它们在orf1b基因中的相对位置如图2所示。
[0045]
表1 rt-raa试验的引物对和探针
[0046][0047]
为保证rt-raa-lfd的扩增效率,需要对所设计的覆盖orf1b保守区的14条引物进行筛选,从而能够获得更好的引物与探针组合。引物筛选策略为:随机挑选某一正向引物对所有反向引物进行筛选,再选择最优的反向引物对所有正向引物进行筛选,藉此确定最佳引物组合。
[0048]
通过rt-raa扩增已知量的pdcov chn-hn-1601毒株(genbank登录号mg832584.1)的rna模板后,结合2%琼脂糖凝胶电泳对不同引物的扩增效率进行分析,藉此筛选出最优的引物对,主要操作步骤如下:
[0049]
(1)配制rt-raa反应体系
[0050]
所述rt-raa反应体系(25.00μl)包括:
[0051]
反应缓冲液a 14.70μl;
[0052]
反应缓冲液b 1.25μl;
[0053]
10pmol/μl上游引物1.00μl;
[0054]
10pmol/μl下游引物1.00μl;
[0055]
pdcov rna模板1.00μl;
[0056]
无核酸酶水6.05μl。
[0057]
阴性对照加入无核酸酶水充当模板,阳性对照加入的是已知pdcov毒株的rna模板。
[0058]
(2)rt-raa反应体系扩增
[0059]
反应条件设置:将反应液瞬时离心混匀后,置于40℃恒温水浴锅中反应20min;
[0060]
扩增产物分析:取20μl扩增产物进行2%琼脂糖凝胶电泳,并在紫外线下观察结果;
[0061]
质控标准:阴性对照无扩增条带,且阳性对照出现特异性扩增条带,则试验数据有效,否则试验结果为无效;
[0062]
结果描述及判定:待检测样品无扩增条带,样品判为阴性;出现特异性扩增条带,样品判为阳性。
[0063]
如图3的a所示,选取f1作为上游引物,分别与下游引物r1~r7配对后进行rt-raa扩增,通过2%琼脂糖凝胶电泳分析扩增产物的条带亮度与丰度,确定产生最亮条带的r7为最优下游引物,而将条带亮度仅次于r7的下游引物r6作为备选下游引物。固定最优的下游引物r7,然后对f1~f7这7条上游引物进行筛选,并借助2%琼脂糖凝胶电泳分析扩增产物的条带亮度与丰度,如图3的b所示,筛选出f3为最优的上游引物。
[0064]
选取f3分别与r6、r7配对进行rt-raa-lfd检测,rt-raa反应体系(25.00μl)包括:
[0065]
反应缓冲液a 14.70μl;
[0066]
反应缓冲液b 1.25μl;
[0067]
10pmol/μl正向引物1.00μl;
[0068]
10pmol/μl反向引物1.00μl;
[0069]
10pmol/μl探针0.30μl;
[0070]
pdcov rna模板1.00μl;
[0071]
无核酸酶水5.75μl。
[0072]
阴性对照加入无核酸酶水充当模板,其他反应加入的是已知pdcov毒株的rna模板。将反应液瞬时离心混匀后,置于40℃恒温水浴锅中反应20min,取50μl 10倍稀释的扩增产物滴加至试纸条的加样板,1min后读取结果。
[0073]
如图4所示,利用最优上游引物f3和最优下游引物r7与探针p组合,对pdcov rna模板和阴性对照的rt-raa-lfd检测结果呈阳性或弱阳性(见试纸卡1和2);而利用最优上游引物f3和次优下游引物r6与探针p组合,对pdcov rna模板和阴性对照的rt-raa-lfd检测结果仍然均呈阳性(见试纸卡3和4)。
[0074]
在排除核酸污染的前提下,利用primer premier 5.0软件对反向引物r7、r6与探
针p之间可能形成的碱基互补配对(即可能形成探针与引物交叉二聚体)进行分析,并根据引物与探针之间形成碱基互补配对的结合能(δg)大小,最终决定对下游引物r7与探针p之间参与形成二聚体的若干碱基进行突变,使探针第4位核苷酸g突变为c(g
→
c)、第27位核苷酸a突变为g(a
→
g),使下游引物r7第6位核苷酸t突变为c(t
→
c),使其丧失形成二聚体的能力(图5的a)。利用碱基突变后的反向引物mr7、探针mp再次对阴性对照和已知pdcov毒株的rna模板进行rt-raa-lfd检测,如图5的b所示,阴性对照和已知pdcov毒株的rna模板的rt-raa-lfd检测结果分别为阴性和阳性,恢复正常,与预期结果相符。
[0075]
经过上述引物设计、筛选与修饰之后,最终确定了用于pdcov核酸rt-raa-lfd检测的最优上游引物为f3、最优下游引物为mr7和最优探针为mp。
[0076]
本实施例中,最终筛选出最佳引物组合和探针序列如下:
[0077]
正向引物f3:
[0078]5’‑
agtataatggcgtccatccagctcatgctt-3’;
[0079]
反向引物mr7:
[0080]5’‑
fam-acgtgttaggaacatattatgatacgcatc-3’;
[0081]
所述反向引物mr7的5’端进行荧光基团fam修饰;
[0082]
探针mp:
[0083]5’‑
biotin-ggtccagagtaccgctgtgaggagccgcttg[thf]taaattagtaggagt-phosphorylation-3’[0084]
所述探针mp的5’端进行生物素修饰,第32位碱基c被四氢呋喃(thf)替代,3’端进行磷酸化修饰。
[0085]
实施例2 rt-raa-lfd检测pdcov的最优反应温度和时间的优化
[0086]
本实施例提供rt-raa-lfd检测pdcov的最优反应温度和时间的优化探究,步骤如下:
[0087]
以1.6
×
105tcid
50
/ml pdcov rna为模板,利用优选出的最佳引物组合(f3/mr7)和探针(mp)以及上述反应体系(25.00μl),分别在20、25、30、35、37、40和42℃进行rt-raa-lfd扩增20min,以确定最佳的反应温度。在此基础上,以最佳的反应温度、相同的引物组合和探针以及反应体系,对1.6
×
105tcid
50
/ml pdcov rna模板分别扩增0、2、5、10、15、20、25和30min,以确定最佳的反应时间。
[0088]
如图6的a所示,20℃和25℃的检测结果为阴性,40℃时检测线(t线)的亮度明显强于30℃、35℃和37℃的检测线,而与42℃时检测线的亮度相当;借助imagej软件分析不同反应温度条件下试纸条的质控线(c线)和检测线的光密度值,并通过计算t/c比值进一步表明,40℃时检测线的亮度及其相对比值最高,因此,选择40℃作为rt-raa-lfd检测pdcov的最佳反应温度。如图6的c所示,0min、2min和5min无或仅有模糊不清的检测线,而其他反应时间(10、15、20、25和30min)的检测线的亮度差异不大;借助imagej软件分析不同反应时间条件下试纸条的c线和t线的光密度值,并通过计算t/c比值进一步证实,从10min时开始检测线的亮度及其相对比值进入平台期,同时考虑到疫病检测的时效性,故选择10min作为rt-raa-lfd检测pdcov的最佳反应时间。
[0089]
实施例3 rt-raa-lfd检测pdcov的特异性分析
[0090]
本实施进行rt-raa-lfd检测pdcov的特异性分析,具体步骤如下:分别以猪丁型冠
状病毒(pdcov)、猪流行性腹泻病毒(pedv)、猪传染性胃肠炎病毒(tgev)、猪轮状病毒(prov)、猪肠道甲型冠状病毒(peav)、口蹄疫病毒(fmdv)、猪繁殖与呼吸综合征病毒(prrsv)、猪伪狂犬病毒(prv)和猪圆环病毒2型(pcv2)的核酸作为模板,按照前述方法进行rt-raa-lfd检测,同时设置无模板对照(ntc)。
[0091]
如图7中的结果显示,除了pdcov rna模板对应试纸条的检测线(t线)出现了特异性的条带之外,其他重要的猪病毒及无模板对照的t线均未出现条带。结果表明,本发明所建立的rt-raa-lfd可以实现对pdcov的特异性检测,与其他重要的猪病毒不发生交叉反应。
[0092]
实施例4 rt-raa-lfd检测pdcov的敏感性分析
[0093]
本实施例提供rt-raa-lfd检测pdcov的敏感性分析,步骤如下:
[0094]
以10倍梯度稀释的pdcov rna为模板(对应pdcov的滴度为1.6
×
107tcid
50
/ml~1.6
×
10-3
tcid
50
/ml),在rt-raa-lfd最适条件下进行核酸地扩增,并设置无模板对照(ntc)。同时,利用已发表文献(pan z.,et al.,virulence,2020,11:707-718)中的实时荧光定量rt-pcr方法进行平时检测与比对。
[0095]
如图8的a所示,当pdcov rna模板浓度为1.6
×
107tcid
50
/ml~1.6
×
103tcid
50
/ml时,rt-raa-lfd的检测结果均为阳性,当pdcov rna模板浓度为1.6
×
102tcid
50
/ml~1.6
×
10-3
tcid
50
/ml时,rt-raa-lfd的检测结果均为阴性,说明rt-raa-lfd可以检测到1.6
×
103tcid
50
/ml的pdcov rna。如图8的b所示,通过对8次独立的rt-raa-lfd检测结果进行概率回归分析,证实当置信度设为95%时,rt-raa-lfd对pdcov的检测灵敏度为10
3.599
tcid
50
/ml pdcov rna(相当于3.97tcid
50 pdcov rna/反应)。
[0096]
如图9的a所示,当pdcov rna模板浓度为1.6
×
107tcid
50
/ml~1.6
×
102tcid
50
/ml时,实时荧光定量rt-pcr的检测结果均为阳性,当pdcov rna模板浓度为1.6
×
101tcid
50
/ml~1.6
×
10-3
tcid
50
/ml时,实时荧光定量rt-pcr的检测结果均为阴性,说明实时荧光定量rt-pcr可以检测到1.6
×
102tcid
50
/ml的pdcov rna。如图9的b所示,通过对8次独立的实时荧光定量rt-pcr检测结果进行概率回归分析,证实当置信度设为95%时,实时荧光定量rt-pcr对pdcov的检测灵敏度为10
2.366
tcid
50
/ml pdcov rna(相当于0.232tcid
50 pdcov rna/反应)。
[0097]
实施例5对实际临床样本的检测应用
[0098]
本实施例提供对实际临床样本的检测,步骤如下:取猪的临床样本149份(包括23份猪小肠组织、81份肛拭子和45份血清),按照rna提取试剂说明书提取样品的rna后,按照上述方法对所有样品的rna进行rt-raa-lfd检测,同时利用已发表文献(pan z.,et al.,virulence,2020,11:707-718)中的实时荧光定量rt-pcr方法平时检测149份临床样品进行对比。
[0099]
如表2所示,149份临床样品rt-raa-lfd检出阳性71份,实时荧光定量rt-pcr检出阳性75份,rt-raa-lfd与实时荧光定量rt-pcr对149份临床样品检测符合率为97.32%(145/149),kappa平均值为0.960,p<0.001。
[0100]
表2临床样本检测结果
[0101][0102]
综上所述,本发明中所述的rt-raa-lfd方法可以实现对猪丁型冠状病毒进行快速、特异、灵敏、可视化、简便地检测。该方法的检测灵敏度与实时荧光定量rt-pcr相当,但是其检测速度明显快于实时荧光定量rt-pcr,而且该方法对仪器要求简单,不需要热循环反应的温度控制仪器,适合在基层或现场进行猪丁型冠状病毒感染的即时可视化检测。
[0103]
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1