一种托法替布关键中间体的酶法制备方法
1.本发明涉及生物催化技术领域中,一种托法替布关键中间体的酶法制备方法。
背景技术:
2.托法替布(tofacitinib,商品名xeljanz)是由辉瑞公司研发的治疗对甲氨喋呤治疗反应不足或不耐受的中度至重度活动性类风湿性关节炎药,于2012年11月获fda批准,是一种新型的口服蛋白酪氨酸激酶抑制剂,其结构式如下:
[0003][0004]
(3r,4r)-1-苄基-n,4-二甲基哌啶-3-胺是合成托法替布的关键中间体,专利申请us2003073719-a1采用二对甲苯-l-酒石酸(l-dtta)或(4r)-2-羟基-5,5-二甲基-4-苯基-1,3,2λ5-二氧杂膦2-氧化物手性拆分法制备了(3r,4r)-1-苄基-n,4-二甲基哌啶-3-胺,该方法的缺点是最高理论收率只有50%,且需要多次拆分结晶才能获得光学纯的产物。文献(g.k.m.verzijl et al.,org.process res.dev.2018,22,1817-1822.)报道了动态动力学拆分直接还原胺化法制备(3r,4r)-1-苄基-n,4-二甲基哌啶-3-胺,但是de和ee值分别只有95%和72%。文献(c.li et al.,angew.chem.int.ed.2019,58,13573-13583.)报道了金属催化不对称还原胺化的方法合成(3r,4r)-1-苄基-n,4-二甲基哌啶-3-胺,但是需要保护和去保护步骤且可能存在重金属残留。
[0005]
因此,开发一中高效、温和制备(3r,4r)-1-苄基-n,4-二甲基哌啶-3-胺的方法是非常必要的。
技术实现要素:
[0006]
本发明所要解决的技术问题是如何制备(3r,4r)-1-苄基-n,4-二甲基哌啶-3-胺或其药学上可接受的盐。
[0007]
为解决上述技术问题,本发明首先提供了下述任一应用:
[0008]
x1)蛋白质在作为亚胺还原酶中的应用,所述蛋白质名称为ir89,ir89为如下a1)、a2)或a3):
[0009]
a1)氨基酸序列是序列1的蛋白质;
[0010]
a2)将序列表中序列1所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的蛋白质;
[0011]
a3)在a1)或a2)的n端或/和c端连接标签得到的融合蛋白质;
[0012]
x2)ir89在制备亚胺还原酶中的应用;
[0013]
x3)ir89在制备(3r,4r)-1-苄基-n,4-二甲基哌啶-3-胺或其药学上可接受的盐中
的应用;
[0014]
x4)与ir89相关的生物材料在制备亚胺还原酶中的应用,所述生物材料为下述b1)至b4)中的任一种:
[0015]
b1)编码ir89的核酸分子;
[0016]
b2)含有b1)所述核酸分子的表达盒;
[0017]
b3)含有b1)所述核酸分子的重组载体、或含有b2)所述表达盒的重组载体;
[0018]
b4)含有b1)所述核酸分子的重组微生物、或含有b2)所述表达盒的重组微生物、或含有b3)所述重组载体的重组微生物;
[0019]
x5)所述生物材料在制备(3r,4r)-1-苄基-n,4-二甲基哌啶-3-胺或其药学上可接受的盐中的应用。
[0020]
为了使a1)中的蛋白质便于纯化,可在由序列表中序列1所示的氨基酸序列组成的蛋白质的氨基末端或羧基末端连接上如下表所示的标签。
[0021]
表:标签的序列
[0022]
标签残基序列poly-arg5-6(通常为5个)rrrrrpoly-his2-10(通常为6个)hhhhhhflag8dykddddkstrep-tag ii8wshpqfekc-myc10eqkliseedl
[0023]
上述a2)中的ir89蛋白质,为与序列1所示蛋白质的氨基酸序列具有75%或75%以上同一性且具有相同功能的蛋白质。所述具有75%或75%以上同一性为具有75%、具有80%、具有85%、具有90%、具有95%、具有96%、具有97%、具有98%或具有99%的同一性。
[0024]
上述a2)中的ir89蛋白质可人工合成,也可先合成其编码基因,再进行生物表达得到。
[0025]
上述a2)中的ir89蛋白质的编码基因可通过将序列2的第61-924位所示的dna序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变,和/或在其5
′
端和/或3
′
端连上上表所示的标签的编码序列得到。其中,序列2的第61-924位所示的dna分子编码序列1所示的ir89蛋白质。
[0026]
上述应用中,b1)所述核酸分子可为如下b11)或b12)或b13)或b14)或b15):
[0027]
b11)编码序列是序列表中序列2的第61-924位的cdna分子或dna分子;
[0028]
b12)序列表中序列2的第61-924位所示的dna分子;
[0029]
b13)序列表中序列2的所示的dna分子;
[0030]
b14)与b11)或b12)或b13)限定的核苷酸序列具有75%或75%以上同一性,且编码ir89的cdna分子或dna分子;
[0031]
b15)在严格条件下与b11)或b12)或b13)或b14)限定的核苷酸序列杂交,且编码ir89的cdna分子或dna分子。
[0032]
其中,所述核酸分子可以是dna,如cdna、基因组dna或重组dna;所述核酸分子也可以是rna,如mrna或hnrna等。
[0033]
本领域普通技术人员可以很容易地采用已知的方法,例如定向进化和点突变的方
法,对本发明的编码ir89蛋白质的核苷酸序列进行突变。那些经过人工修饰的,具有与本发明分离得到的ir89蛋白质的核苷酸序列75%或者更高同一性的核苷酸,只要编码ir89蛋白质且具有ir89蛋白质功能,均是衍生于本发明的核苷酸序列并且等同于本发明的序列。
[0034]
这里使用的术语“同一性”指与天然核酸序列的序列相似性。“同一性”包括与本发明的编码序列1所示的氨基酸序列组成的蛋白质的核苷酸序列具有75%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。
[0035]
上述应用中,所述严格条件可为如下:50℃,在7%十二烷基硫酸钠(sds)、0.5m napo4和1mm edta的混合溶液中杂交,在50℃,2
×
ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5m napo4和1mm edta的混合溶液中杂交,在50℃,1
×
ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5m napo4和1mm edta的混合溶液中杂交,在50℃,0.5
×
ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5m napo4和1mm edta的混合溶液中杂交,在50℃,0.1
×
ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5m napo4和1mm edta的混合溶液中杂交,在65℃,0.1
×
ssc,0.1%sds中漂洗;也可为:在6
×
ssc,0.5%sds的溶液中,在65℃下杂交,然后用2
×
ssc,0.1%sds和1
×
ssc,0.1%sds各洗膜一次;也可为:2
×
ssc,0.1%sds的溶液中,在68℃下杂交并洗膜2次,每次5min,又于0.5
×
ssc,0.1%sds的溶液中,在68℃下杂交并洗膜2次,每次15min;也可为:0.1
×
sspe(或0.1
×
ssc)、0.1%sds的溶液中,65℃条件下杂交并洗膜。
[0036]
上述75%或75%以上同一性,可为80%、85%、90%或95%以上的同一性。
[0037]
上述应用中,b2)所述的含有编码ir89蛋白质的核酸分子的表达盒(ir89基因表达盒),是指能够在宿主细胞中表达ir89蛋白质的dna,该dna不但可包括启动ir89基因转录的启动子,还可包括终止ir89基因转录的终止子。进一步,所述表达盒还可包括增强子序列。
[0038]
可用现有的表达载体构建含有所述ir89基因表达盒的重组载体。
[0039]
上述应用中,所述载体可为质粒、黏粒、噬菌体或病毒载体。所述质粒具体可为pet28a(+)载体。
[0040]
b3)所述重组载体具体可为bl21/pet28a-ir89。所述bl21/pet28a-ir89为利用nde
ꢀⅰ
和ecor
ꢀⅰ
在pet28a(+)载体的nde
ꢀⅰ
和ecor
ꢀⅰ
识别序列间插入序列2的第61-924位所示的dna片段得到的重组载体。bl21/pet28a-ir89含有序列2所示的dna片段,能表达his标签与序列表中seq id no.1所示的ir89所形成的融合蛋白质。
[0041]
上述应用中,所述微生物可为酵母、细菌、藻或真菌。
[0042]
本发明还提供了一种制备(3r,4r)-1-苄基-n,4-二甲基哌啶-3-胺或其药学上可接受的盐的方法,所述方法包括:向含有1-苄基-4-甲基哌啶-3-酮或其盐酸盐(式2)以及甲胺或其盐酸盐的反应体系中添加ir89进行反应,即获得(3r,4r)-1-苄基-n,4-二甲基哌啶-3-胺或其药学上可接受的盐(式3);
[0043][0044]
上述方法中,所述反应体系中还可含有葡萄糖、nadph、dmso和/或gdh。
[0045]
所述反应体系具体可为向100mm tris-hcl缓冲液(ph 9)中加入1-苄基-4-甲基哌啶-3-酮盐酸盐、甲胺盐酸盐、dmso、葡萄糖、nadp
+
、gdh、ir89得到的反应体系,该反应体系中,1-苄基-4-甲基哌啶-3-酮盐酸盐的浓度为2-50g/l(如24g/l)、甲胺盐酸盐的浓度为6-135g/l)、dmso的体积百分比含量为5%、葡萄糖的浓度为6-119g/l、nadp
+
的浓度为0.6mm、gdh的浓度为3u/ml。
[0046]
上述方法中,所述反应体系的ph可为9。
[0047]
上述方法中,所述反应可在25℃下进行。
[0048]
本发明还提供了用于制备(3r,4r)-1-苄基-n,4-二甲基哌啶-3-胺或其药学上可接受的盐的产品,所述产品含有ir89或所述生物材料。
[0049]
上述产品还可含有1-苄基-4-甲基哌啶-3-酮或其盐酸盐以及甲胺或其盐酸盐。
[0050]
上述产品还可含有葡萄糖、dmso、nadph和/或gdh。
[0051]
所述产品在制备(3r,4r)-1-苄基-n,4-二甲基哌啶-3-胺或其药学上可接受的盐中的应用,也属于本发明的保护范围。
[0052]
ir89或所述生物材料,也属于本发明的保护范围。
[0053]
实验证明,本发明可以利用蛋白质ir89催化1-苄基-4-甲基哌啶-3-酮或其盐酸盐以及甲胺或其盐酸盐生成(3r,4r)-1-苄基-n,4-二甲基哌啶-3-胺二盐酸盐,产量为0.605g,收率83%,ee值97%。表明,本发明的ir89可以作为亚胺还原酶用于生产(3r,4r)-1-苄基-n,4-二甲基哌啶-3-胺二盐酸盐。
附图说明
[0054]
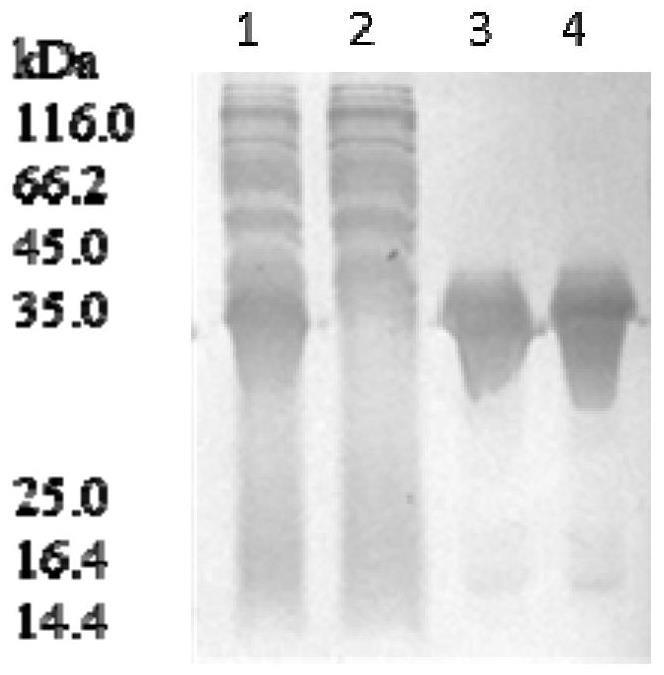
图1亚胺还原酶经诱导表达后的sds-page电泳检测结果。其中,1为上清液,2为穿透液,3,4为包含目的蛋白的洗脱液。
[0055]
图2(3r,4r)-1-苄基-n,4-二甲基哌啶-3-胺二盐酸盐的核磁氢谱。
[0056]
图3(3r,4r)-1-苄基-n,4-二甲基哌啶-3-胺二盐酸盐的核磁碳谱。
具体实施方式
[0057]
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
[0058]
下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂、仪器等,如无特殊说明,均可从商业途径得到。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。下述实施例中,如无特殊说明,序列表中各核苷酸序列的第1位均为相应dna/rna的5
′
末端核苷酸,末位均为相应dna/rna的3
′
末端核苷酸。
[0059]
1-苄基-4-甲基哌啶-3-酮盐酸盐:上海阿拉丁生化科技股份有限公司,货号b190494,其结构式如式2所示:
[0060][0061]
甲胺盐酸盐:上海阿拉丁生化科技股份有限公司,货号:m103815;
[0062]
nadph及nadp+:邦泰生物工程(深圳)有限公司;
[0063]
gdh:codexis,cdx-901。
[0064]
本发明发现蛋白质ir89(氨基酸序列为序列表中seq id no.1)具有亚胺还原酶活性,其检测步骤如下:
[0065]
实施例1、高表达基因工程菌的获得
[0066]
对蛋白质ir89(氨基酸序列为序列表中seq id no.1)进行密码子优化,以使基因能够在大肠杆菌表达宿主中进行表达,密码子优化后的ir89基因其序列为序列表中seq id no.2的第61-924位。
[0067]
合成在ir89基因两端分别添加ndeⅰ和ecorⅰ识别序列的dna片段,将所得dna片段利用ndeⅰ和ecorⅰ酶切,将所得酶切产物与pet28a(+)载体经ndeⅰ和ecorⅰ酶切得到的载体骨架相连,将得到的序列正确的重组载体记为pet28a-ir89。pet28a-ir89含有序列表中seq id no.2所示的ir89与his标签的融合基因,并能表达his标签与序列表中seq id no.1所示的ir89所形成的融合蛋白质(记为ir89融合蛋白)。
[0068]
将pet28a-ir89导入大肠杆菌bl21,得到重组菌bl21/pet28a-ir89;将pet28a(+)载体导入大肠杆菌bl21,得到重组菌bl21/pet28a。
[0069]
实施例2、基因工程菌的培养、静息细胞和纯化产品的制备
[0070]
将实施例1所得重组菌bl21/pet28a-ir89接种至4ml含卡那霉素的发酵培养基(所用发酵培养基为lb培养基)中,培养15h左右作为种子液,按照1%的接种量接种至800ml的含卡那霉素的发酵培养基中,在37℃、200rpm的摇床上培养至od
600
=0.6-0.8左右,加入终浓度为0.1mm的iptg进行诱导10h以上,以8000rpm离心培养液收集菌体。
[0071]
使用ni柱在akta操作系统上进行蛋白纯化:称量10g菌体,加入至200ml过膜的
buffer a(准确称取2.42g tris、29.22g氯化钠、1.36g咪唑,溶于200ml去离子水中,搅拌均匀,使用5m盐酸溶液调节ph至7.4-7.5,加入5%(v/v)甘油,定容至1l。4℃度保存,使用前过水相膜。)中,混匀,在4℃下,使用高压均质机破菌,得到粗酶液;将粗酶液转入50ml离心管中,4℃,7000g,离心40min,离心完成后,收集上清液,经0.45μm的膜过滤,制备上样样品。将a泵放入样品溶液中进行上样,同时收集穿透液,上样完毕后,继续用100%buffer a进行平衡,至uv线平稳。用buffer b(准确称取2.42g tris、29.22g氯化钠、34.04g咪唑,溶于200ml去离子水中,搅拌均匀,使用5m盐酸溶液调节ph至7.4-7.5,加入5%(v/v)甘油,定容至1l。4℃度保存,使用前过水相膜。)进行线性洗脱(100%buffer b,60min),当出现目标峰时,收集洗脱液。
[0072]
取上清液、穿透液、流出液,进行sds-page电泳验证蛋白大小与纯度,结果如图1所示,结果显示,得到了高纯度的蛋白质ir89。将收集的洗脱液,选择30kda的超滤管进行超滤,4℃,2700g,批次离心,同时超滤过程中使用100mm tis-hcl缓冲液(ph 8)洗脱3次除盐,超滤后的蛋白即为ir89融合蛋白,加入15%(v/v)甘油,-80℃保存。
[0073]
实施例3、利用ir-89作为催化剂进行ph优化
[0074]
在500μl反应缓冲液中加入1-苄基-4-甲基哌啶-3-酮盐酸盐、甲胺盐酸盐、葡萄糖、nadp
+
、gdh、实施例2得到的ir89融合蛋白,得到反应体系,反应体系中1-苄基-4-甲基哌啶-3-酮盐酸盐的浓度为10mm、甲胺盐酸盐的浓度为100mm、葡萄糖的浓度为30mm、nadp
+
的浓度为0.6mm、gdh的浓度为3u/ml,ir89融合蛋白的含量为0.75mg。将所得反应体系于25℃,200rpm摇床中,反应24h。100mm反应缓冲液为100mm柠檬酸-柠檬酸钠缓冲液(ph 5或6)、100mm磷酸钠缓冲液(ph 6、7或8)、100mm tris-hcl缓冲液(ph 8或9),或100mm甘氨酸-氢氧化钠缓冲液(ph 9或10)。
[0075]
反应结束后加入30μl饱和碳酸钠溶液停止反应,调节ph至9,利用乙酸乙酯萃取(1ml
×
2),合并有机相经过无水硫酸钠干燥,再使用有机滤膜过滤。使用气相测定表观转化率和立体选择性。100mm柠檬酸-柠檬酸钠缓冲液(ph 5)中的转化率5%,ee值7%;100mm柠檬酸-柠檬酸钠缓冲液(ph 6)中的转化率40%,ee值86%;100mm磷酸钠缓冲液(ph 6)中的转化率31%,ee值78%;100mm磷酸钠缓冲液(ph7)中的转化率54%,ee值90%;100mm磷酸钠缓冲液(ph 8)中的转化率81%,ee值90%;100mm tris-hcl缓冲液(ph 8)中的转化率58%,ee值88%;100mm tris-hcl缓冲液(ph 9)中的转化率92%,ee值》95%;100mm甘氨酸-氢氧化钠缓冲液(ph 9)中的转化率71%,ee值78%;100mm甘氨酸-氢氧化钠缓冲液(ph 10)中的转化率74%,ee值》93%。
[0076]
说明,ir89融合蛋白的最适ph为9。
[0077]
转化率为产物(即(3r,4r)-1-苄基-n,4-二甲基哌啶-3-胺二盐酸盐)峰面积与底物(即1-苄基-4-甲基哌啶-3-酮盐酸盐)峰面积和产物峰面积之和的比值。
[0078]
实施例4、利用ir-89作为催化剂进行温度稳定性测定
[0079]
向100mm tris-hcl缓冲液(ph 9)中添加1-苄基-4-甲基哌啶-3-酮盐酸盐、甲胺盐酸盐、nadph、实施例2得到的ir89融合蛋白,得到200μl反应体系,该反应体系中1-苄基-4-甲基哌啶-3-酮盐酸盐的浓度为10mm、甲胺盐酸盐的浓度为1m、nadph的浓度为0.6mm、ir89融合蛋白的含量为440μg。
[0080]
将所得反应体系置于20、25、30、35或40℃金属浴中孵育8h,测定比活性。反应结束
后在室温,340nm下测定nadph下降。20℃下比酶活为0.18u/mg,25℃下比酶活为0.19u/mg,30℃下比酶活0.17u/mg,35℃下比酶活0.12u/mg,40℃下比酶活0.09u/mg。说明,ir89融合蛋白的最适温度为25℃。
[0081]
酶活定义为:在室温条件,1分钟内能转化生成1微摩尔底物((3r,4r)-1-苄基-n,4-二甲基哌啶-3-胺二盐酸盐)所用的酶量。
[0082]
实施例5、利用ir89催化式1盐酸盐和式2盐酸盐不对称还原胺化
[0083]
向1ml的100mm tris-hcl缓冲液(ph 9)中加入1-苄基-4-甲基哌啶-3-酮盐酸盐(即底物)、甲胺盐酸盐、dmso、葡萄糖、nadp
+
、gdh、实施例2得到的ir89融合蛋白,得到反应体系,该反应体系中,1-苄基-4-甲基哌啶-3-酮盐酸盐的浓度为2、24或50g/l、甲胺盐酸盐的浓度为7、68或135g/l(依次对应于底物浓度2、24、50g/l)、dmso的体积百分比含量为5%、葡萄糖的浓度为6、60或119g/l(依次对应于底物浓度2、24、50g/l)、nadp
+
的浓度为0.6mm、gdh的浓度为3u/ml、ir89融合蛋白的含量为1.5mg,使用10%碳酸钠溶液控制ph 9.0,于25℃,200rpm摇床中,反应36h。
[0084]
反应过程中每隔2h取样,通过气相然测定表观转化率和立体选择性,检测反应进程。
[0085]
底物1-苄基-4-甲基哌啶-3-酮盐酸盐浓度的浓度为2g/l下,反应10h,转化率70%,ee值97%,反应24h,转化率98%,ee值97%,反应36h,转化率98%,ee值97%;底物1-苄基-4-甲基哌啶-3-酮盐酸盐浓度的浓度为24g/l下,反应10h,转化率42%,ee值96%,反应24h,转化率93%,ee值97%,反应36h,转化率95%,ee值97%;底物1-苄基-4-甲基哌啶-3-酮盐酸盐浓度的浓度为50g/l下,反应10h,转化率18%,ee值97%,反应24h,转化率47%,ee值97%,反应36h,转化率81%,ee值97%。转化率为产物峰面积与底物峰面积和产物峰面积之和的比值。
[0086]
结果显示,在2g/l的底物浓度下,反应10h可达到中等以上的转化,反应24h底物基本转化完全;在24g/l的底物浓度下,反应10h可达到中等转化,反应24h实现90%以上的转化;在50g/l的底物浓度下,底物转化的速率明显降低,反应36h最终实现80%的转化。同时在不同底物浓度转化反应中,反应过程中ir89的对映选择性未发生明显变化。
[0087]
实施例6、利用ir89催化式1盐酸盐和式2盐酸盐不对称还原胺化
[0088]
向21.25ml的100mm tris-hcl缓冲液(ph 9)中加入1-苄基-4-甲基哌啶-3-酮盐酸盐(0.6g)、甲胺盐酸盐(1.7g)、dmso(1.25ml)、葡萄糖(1.49g)、nadp
+
(12.5mg)、gdh酶粉(2.8mg)、实施例2得到的ir89融合蛋白(37.5mg),使用10%碳酸钠溶液控制ph 9.0,于25℃,200rpm摇床中,反应24h。为了获得最大的转化效益,gdh(2.8mg,125u)和纯酶(2.5ml,37.5mg)被分成等量的两部分,分别在反应开始的0h和8h加入。反应24h薄层层析检测显示反应基本完全,加入饱和碳酸钠溶液停止反应,调节ph至9,乙酸乙酯萃取(100ml
×
3),无水硫酸钠干燥后旋干,经柱层析分离纯化并成盐,检测核磁氢谱与核磁碳谱。
[0089]
结果显示本实施例成功得到了(3r,4r)-1-苄基-n,4-二甲基哌啶-3-胺二盐酸盐(其结构式如式3所示),产量为0.605g,收率83%,ee值97%。表明,本发明的ir89可以作为亚胺还原酶用于生产(3r,4r)-1-苄基-n,4-二甲基哌啶-3-胺二盐酸盐。
[0090][0091]
(3r,4r)-1-苄基-n,4-二甲基哌啶-3-胺二盐酸盐的核磁氢谱与核磁碳谱如图2,3所示。1h nmr(400mhz,methanol-d4)δ=7.42-7.22(m,5h),3.64-3.47(m,2h),2.65-2.33(m,4h),2.28(s,3h),1.93(br.s.,1h),1.67(br.s.,1h),1.60-1.48(m,1h),0.96(d,j=6.8hz,3h)。
13
c nmr(100mhz,methanol-d4)δ=137.69,129.20,127.90,126.95,62.75,58.64,52.89,32.44,29.81。
[0092]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1