代谢工程方法、产角鲨烯工程菌、产橙花叔醇工程菌及其构建方法、应用
1.本技术属于微生物技术领域,尤其涉及一种代谢工程方法、产角鲨烯工程菌、产橙花叔醇工程菌及其构建方法、应用。
背景技术:
2.随着合成生物学的发展,酿酒酵母已被广泛作为异源表达宿主来生产有价值的天然产物,这些天然产物包括单萜吲哚生物碱、青蒿酸和大麻素等。为了更加充分地利用酵母细胞工厂,越来越多的代谢工程策略被开发出来。对基因启动子和终止子的操控,以及对代谢通路上下游基因的融合、支架蛋白的构建和细胞器区室化的策略在一些重要化合物的生物合成中起到了很大的促进作用,同时,对酵母细胞内源亚细胞结构内质网膜的修饰能够提高角鲨烯及三萜类化合物的产量。
3.长非编码rna在肿瘤细胞的发展和浸润过程中起着至关重要的作用。细胞内有一类能够募集组蛋白修饰复合物的转录因子,而长非编码rna可指引这类转录因子到达染色体的指定位置,间接引起组蛋白结构的修饰,进而发挥调控作用。例如,长非编码rna pcgem1是前列腺癌细胞潜在的生物标记物和治疗靶点,它能够结合转录组因子c-myc,调控糖酵解、三羧酸循环及脂质合成等代谢途径,进而引起细胞代谢流的重排。虽然在癌细胞中对长非编码rna和原癌基因的研究很多,但在酵母细胞中的研究还比较少,而更进一步,将长非编码rna和原癌基因开发成为一种代谢工程策略还未见报道。
技术实现要素:
4.本技术实施例的目的在于提供一种基于长非编码rna和原癌基因的代谢工程方法。
5.本技术实施例是这样实现的,一种基于长非编码rna和原癌基因的代谢工程方法,所述代谢工程方法为过表达pcgem1基因和c-myc基因;其中,
6.所述pcgem1基因为长非编码rna编码基因,其核苷酸序列如seq id no.1所示;
7.所述c-myc基因为原癌基因,其核苷酸序列如seq id no.2所示。
8.本技术实施例的另一目的在于一种根据所述的基于长非编码rna和原癌基因的代谢工程方法在构建酿酒酵母工程菌中的应用。
9.本技术实施例的另一目的在于一种产角鲨烯工程菌,所述产角鲨烯工程菌以酿酒酵母为出发菌株,过表达pcgem1、c-myc、thmgr、upc2-1和erg9基因;其中,
10.pcgem1和c-myc基因整合到酵母基因组ndt80位点;
11.thmgr和upc2-1基因整合到酿酒酵母染色体ty3位点;
12.erg9基因启动子为组成型强启动子tpi1p。
13.本技术实施例的另一目的在于一种产橙花叔醇工程菌,所述产橙花叔醇工程菌以酿酒酵母为出发菌株,过表达pcgem1、c-myc、thmgr和upc2-1基因,抑制erg9基因;其中,
14.pcgem1和c-myc基因整合到酵母基因组ndt80位点;
15.thmgr和upc2-1基因整合到酿酒酵母染色体ty3位点;
16.erg9基因启动子为葡萄糖抑制型启动子hxt1p。
17.本技术实施例的另一目的在于一种产角鲨烯工程菌的构建方法,包括:
18.将pgk1p、pcgem1和cyc1t连接,构建基因表达模块pgk1p-pcgem1-cyc1t,命名为模块i;
19.将tef1p、c-myc和adh1t连接,构建基因表达模块tef1p-c-myc-adh1t,命名为模块ii;
20.将筛选标记his表达框、模块i和模块ii连接,构建基因表达模块his-pgk1p-pcgem1-cyc1t-tef1p-c-myc-adh1t,命名为模块iii;
21.将gal1p、thmgr和adh1t连接,构建基因表达模块gal1p-thmgr-adh1t,命名为模块iv;
22.将gal10p、upc2-1和cyc1t连接,构建基因表达模块gal10p-upc2-1-cyc1t,命名为模块v;
23.将模块v和模块vi连接,构建基因表达模块gal1p-thmgr-adh1t-gal10p-upc2-1-cyc1t,命名为模块vi;
24.将筛选标记leu和启动子tpi1p连接,构建基因表达模块leu-tpi1p,命名为模块vii;
25.将模块iii转化酵母菌株,整合到基因组的ndt80位点,得到菌株1;
26.将模块vi插入到载体pcfb2988的sfasi酶切位点,得到整合表达载体pcfb2988-vi;
27.用限制性核酸内切酶notι酶切整合表达载体pcfb2988-vi,得到dna整合片段s1;
28.将dna整合片段s1整合到菌株1染色体的ty1位点,得到菌株2;
29.将模块vii转化菌株2,整合到erg9基因的启动子位置,得到产角鲨烯工程菌。
30.本技术实施例的另一目的在于一种产橙花叔醇工程菌的构建方法,包括:
31.将pgk1p、pcgem1和cyc1t连接,构建基因表达模块pgk1p-pcgem1-cyc1t,命名为模块i;
32.将tef1p、c-myc和adh1t连接,构建基因表达模块tef1p-c-myc-adh1t,命名为模块ii;
33.将筛选标记his表达框、模块i和模块ii连接,构建基因表达模块his-pgk1p-pcgem1-cyc1t-tef1p-c-myc-adh1t,命名为模块iii;
34.将gal1p、thmgr和adh1t连接,构建基因表达模块gal1p-thmgr-adh1t,命名为模块iv;
35.将gal10p、upc2-1和cyc1t连接,构建基因表达模块gal10p-upc2-1-cyc1t,命名为模块v;
36.将模块v和模块vi连接,构建基因表达模块gal1p-thmgr-adh1t-gal10p-upc2-1-cyc1t,命名为模块vi;
37.将筛选标记met和启动子hxt1p连接,构建基因表达模块met-hxt1p,命名为模块viii;
38.将模块iii转化酵母菌株,整合到基因组的ndt80位点,得到菌株1;
39.将模块vi插入到载体pcfb2988的sfasi酶切位点,得到整合表达载体pcfb2988-vi;
40.用限制性核酸内切酶notι酶切整合表达载体pcfb2988-vi,得到dna整合片段s1;
41.将dna整合片段s1整合到菌株1染色体的ty1位点,得到菌株2;
42.将模块viii转化菌株2,整合到erg9基因的启动子位置,得到产橙花叔醇工程菌。
43.本技术实施例的另一目的在于一种根据所述的基于长非编码rna和原癌基因的代谢工程方法在高产倍半萜化合物橙花叔醇和三萜化合物角鲨烯,以及其他倍半萜和三萜类化合物生产中的应用。
44.本技术实施例提供的基于长非编码rna和原癌基因的代谢工程方法,所述代谢工程方法为过表达长非编码rna pcgem1和原癌基因c-myc,可有效促进酿酒酵母工程菌三萜化合物角鲨烯和倍半萜化合物橙花叔醇的产量。
附图说明
45.图1为本技术实施例所构建的酿酒酵母工程菌株tt01角鲨烯的gc-ms检测结果;
46.图2为本技术实施例所构建的酿酒酵母工程菌株tt01角鲨烯的质谱图;
47.图3为本技术实施例所构建的酿酒酵母工程菌株st01橙花叔醇的gc-ms检测结果;
48.图4为本技术实施例所构建的酿酒酵母工程菌株st01橙花叔醇的质谱图。
具体实施方式
49.为了使本技术的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
50.本技术提供了一种基于长非编码rna和原癌基因的代谢工程方法,所述代谢工程方法为过表达pcgem1基因和c-myc基因。
51.本技术提供了上述的基于长非编码rna和原癌基因的代谢工程方法在构建酿酒酵母工程菌中的应用。
52.具体地,本技术提供了一种产角鲨烯工程菌,为菌株tt01。
53.所述菌株tt01以酿酒酵母为出发菌株,过表达pcgem1、c-myc、thmgr、upc2-1和erg9基因;其中,
54.pcgem1和c-myc基因整合到酵母基因组ndt80位点;
55.thmgr和upc2-1基因整合到酿酒酵母染色体ty3位点;
56.erg9基因启动子为组成型强启动子tpi1p。
57.本技术还提供了一种产橙花叔醇工程菌,为菌株st01。
58.所述菌株st01以酿酒酵母为出发菌株,过表达pcgem1、c-myc、thmgr和upc2-1基因,抑制erg9基因;其中,
59.pcgem1和c-myc基因整合到酵母基因组ndt80位点;
60.thmgr和upc2-1基因整合到酿酒酵母染色体ty3位点;
61.erg9基因启动子为葡萄糖抑制型启动子hxt1p。
62.其中,所述的pcgem1基因为前列腺癌细胞中的长非编码rna编码基因,其核苷酸序列如seq id no.1所示。
63.所述的c-myc基因为前列腺癌细胞中的原癌基因,其核苷酸序列如seq id no.2所示。
64.所述的thmgr和upc2基因可从酿酒酵母by4741基因组中克隆得到,其核苷酸序列分别如seq id no.3~4所示。
65.所述upc2-1基因是基于pcr的定点突变技术将转录因子基因upc2突变为upc2-1,其核苷酸序列如seq id no.5所示。
66.所述tpi1p和hxt1p启动子可从酿酒酵母by4741基因组克隆得到,其核苷酸序列分别如seq id no.6~7所示。
67.本技术还提供了上述的产角鲨烯工程菌和产橙花叔醇工程菌的构建方法,包括如下步骤:
68.(1)利用重叠pcr构建以下模块:
69.(a)将pgk1p、pcgem1和cyc1t连接,构建基因表达模块pgk1p-pcgem1-cyc1t,命名为模块i;
70.(b)将tef1p、c-myc和adh1t连接,构建基因表达模块tef1p-c-myc-adh1t,命名为模块ii;
71.(c)将筛选标记his表达框、模块i和ii连接,构建基因表达模块his-pgk1p-pcgem1-cyc1t-tef1p-c-myc-adh1t,命名为模块iii;
72.(e)将gal1p、thmgr和adh1t连接,构建基因表达模块gal1p-thmgr-adh1t,命名为模块iv;
73.(f)将gal10p、upc2-1和cyc1t连接,构建基因表达模块gal10p-upc2-1-cyc1t,命名为模块v;
74.(g)将模块v和模块vi连接,构建基因表达模块gal1p-thmgr-adh1t-gal10p-upc2-1-cyc1t,命名为模块vi;
75.(h)将筛选标记leu和启动子tpi1p连接,构建基因表达模块leu-tpi1p,命名为模块vii;
76.(i)将筛选标记met和启动子hxt1p连接,构建基因表达模块met-hxt1p,命名为模块viii。
77.(2)构建菌株by4741-1
78.将步骤(1)中得到的模块iii转化酵母工程菌by4741,整合到基因组的ndt80位点,得到菌株by4741-1。
79.(3)构建菌株by4741-2
80.将步骤(1)中得到的模块vi插入到载体pcfb2988的sfasi酶切位点,得到整合表达载体pcfb2988-vi;然后用限制性核酸内切酶not ι酶切整合表达载体pcfb2988-vi,得到dna整合片段s1;再将dna整合片段s1整合到菌株by4741染色体的ty1位点,得到菌株by4741-2。
81.(4)构建菌株tt01
82.将步骤(1)中得到的模块vii转化酵母工程菌by4741-2,整合到erg9基因的启动子
ypd液体培养基的250ml摇瓶中,30℃条件220rpm下发酵168h。
103.下面结合实施例对本技术作进一步详细的描述,但本技术的实施方式不限于此。除非特别说明,本技术采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。下列实施例中未注明具体实验条件的试验方法,通常按照常规实验条件或按照制造厂所建议的实验条件。除非特别说明,本技术所用试剂和原材料均可通过市售获得。
104.实施例1酵母基因和表达元件的克隆
105.1、酵母基因组的提取
106.(1)挑取酿酒酵母by4741的单克隆于装有5ml ypd培养基的10ml试管中,30℃条件下220rpm培养过夜。
107.(2)将培养物4℃条件下4000rpm离心5min,弃上清,收集菌体。将菌体置于研钵中,液氮速冻,研磨成粉末,并迅速转移至1.5ml的离心管中。
108.(3)加入1ml dna提取裂解液(dnaiso reagent,9770q,takara)混匀,室温条件下12,000rpm离心10min。
109.(4)取上清至1.5ml离心管中,加入上清1/2体积的无水乙醇,混匀,室温条件下12000rpm离心2min。
110.(5)弃上清,加入75%的乙醇溶液洗涤沉淀。
111.(6)重复上述步骤一次,
112.(7)挥干残留乙醇,并加入30~50μl ddh2o溶解,获得酵母基因组dna溶液。
113.2、酵母启动子和终止子的克隆
114.(1)以上述获得的酵母基因组为模板,分别克隆以下启动子和终止子(扩增引物见表1):
115.tpi1p(引物tpi1p-f、tpi1p-r)、hxt1p(引物hxt1p-f、hxt1p-r)、pgk1p(引物pgk1p-f、pgk1p-r)、tef1p(引物tef1p-f、tef1p-r)、gal1p(引物gal1p-f、gal1p-r)、pgk10p(引物pgk10p-f、pgk10p-r)、cyc1t(引物cyc1t-f、cyc1t-r)、adh1t(引物adh1t-f、adh1t-r)。
116.pcr反应体系:2
×
phanta max master mix(p515-01,诺唯赞)10μl,正反向引物各0.5μl,ddh2o 8μl,模板1μl,总反应体系20μl。
117.pcr扩增反应条件为:95℃1min;95℃15s,50-60℃15s,72℃30s-1min,32循环;72℃10min。
118.pcr反应结束后,利用1%琼脂糖凝胶电泳检测pcr产物,切下目的条带,利用琼脂糖凝胶dna回收试剂盒(dp219,天根生化)进行目的片段回收,具体操作过程见说明书。
119.(2)dna回收片段连接亚克隆载体
120.将dna回收片段连接亚克隆载体plb(vt205,天根生化科技有限公司),具体操作见产品说明书。
121.(3)转化感受态大肠杆菌dh5α,涂布平板,置于37℃条件下过夜培养。
122.(3)挑选单菌落做菌落pcr。
123.pcr反应体系:2x m5 hiper taq hifi pcr mix(mf002,聚合美)5μl,正反向引物(表1)各0.3μl,ddh2o 4.4μl。
124.pcr扩增条件为:95℃3min;94℃15s,55℃15s,72℃1-3min,30个循环;72℃7min。
125.pcr反应结束后,琼脂糖凝胶电泳检测,挑取阳性克隆菌株测序。
126.3、upc2的定点突变
127.upc2是甲羟戊酸途径的正向调控因子,将其的第888位的甘氨酸突变为天冬氨酸,能进一步提高其调控作用。利用快速定点突变试剂盒(km101,天根生化),以plb-upc2质粒为模板,进行upc2的定点突变(引物序列见表1),具体操作见产品说明书。
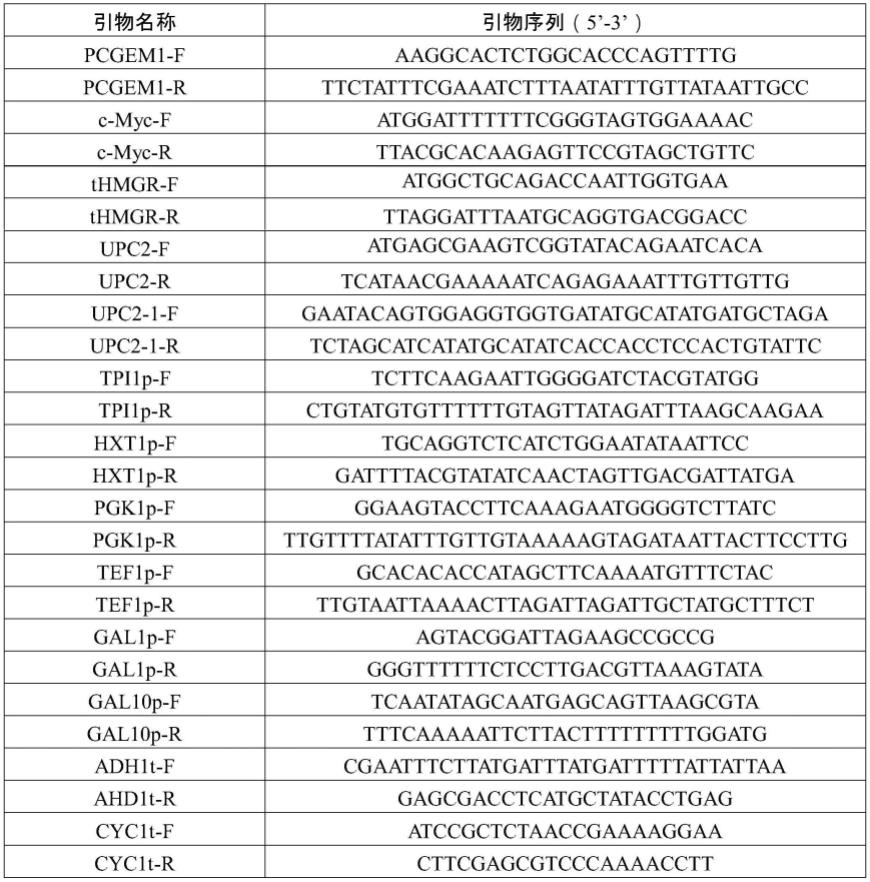
128.表1本发明中克隆各基因和表达元件所用的引物序列
[0129][0130][0131]
实施例2、表达模块的构建
[0132]
1、利用重叠pcr构建基因表达模块i~iv
[0133]
模块的构建利用重叠pcr的方法,要进行重叠的各片段通过pcr克隆。
[0134]
(1)第一轮pcr扩增体系:2
×
phanta max master mix(p515-01,诺唯赞)10μl,正反向引物各0.5μl(引物序列见表2),ddh2o 8μl,模板1μl,总反应体系20μl。
[0135]
pcr扩增反应条件为:95℃1min;95℃15s,50-60℃15s,72℃30s-1min,32循环;72℃10min。
[0136]
(2)第一轮pcr反应混合物稀释10倍,取1μl作为第二轮pcr的模板进行pcr反应:2
×
phanta max master mix(p515-01,诺唯赞)10μl,正反向引物各0.5μl(引物序列见表2),ddh2o 8μl,模板1μl,总反应体系20μl。
[0137]
pcr扩增反应条件为:95℃1min;95℃15s,50-60℃15s,72℃30s-1min,32循环;72℃10min。
[0138]
(3)胶回收并连接亚克隆载体plb(vt205,天根生化科技有限公司),具体操作见产品说明书。
[0139]
按上述步骤共构建以下4个模块:
[0140]
(a)将pgk1p、pcgem1和cyc1t连接,构建基因表达模块pgk1p-pcgem1-cyc1t,命名为模块i;其中,第一轮pcr克隆pgk1p引物为i-pgk1p-f和i-pgk1p-r,克隆pcgem1引物为i-pcgem1-f和i-pcgem1-r,克隆cyc1t引物为i-cyc1t-f和i-cyc1t-r;第二轮pcr引物为i-pgk1p-f和i-cyc1t-r;引物序列见表2。
[0141]
(b)将将tef1p、c-myc和adh1t连接,构建基因表达模块tef1p-c-myc-adh1t,命名为模块ii;其中,第一轮pcr克隆tef1p引物为ii-tef1p-f和ii-tef1p-r,克隆c-myc引物为ii-c-myc-f和ii-c-myc-r,克隆adh1t引物为ii-adh1t-f和ii-adh1t-r;第二轮pcr引物为ii-tef1p-f和ii-adh1t-r;引物序列见表2。
[0142]
(c)将筛选标记表达框his、模块i和ii连接,构建基因表达模块his-pgk1p-pcgem1-cyc1t-tef1p-c-myc-adh1t,命名为模块iii;其中,第一轮pcr克隆his筛选标记的引物为iii-his-f和iii-his-r,克隆模块i的引物为iiii-i-f和iii-i-r,克隆模块ii的引物为iii-ii-f和iii-ii-r;第二轮pcr引物为iii-his-f和iii-ii-r;引物序列见表2。
[0143]
(d)将gal1p、thmgr和adh1t连接,构建基因表达模块gal1p-thmgr-adh1t,命名为模块iv;其中,第一轮pcr克隆gal1p引物为iv-gal1p-f和iv-gal1p-r,克隆thmgr引物为iv-thmgr-f和iv-thmgr-r,克隆adh1t引物为iv-adh1t-f和iv-adh1t-r;第二轮pcr引物为iv-gal1p-f和iv-adh1t-r;引物序列见表2。
[0144]
(e)将gal10p、upc2-1和cyc1t连接,构建基因表达模块gal10p-upc2-1-cyc1t,命名为模块v;其中,第一轮pcr克隆gal10p引物为v-gal10p-f和v-gal10p-r,克隆upc2-1引物为v-upc2-1-f和v-upc2-1-r,克隆cyc1t引物为v-cyc1t-f和v-cyc1t-r;第二轮pcr引物为v-gal10p-f和v-cyc1t-r;引物序列见表2。
[0145]
(f)将模块iv和模块v连接,构建基因表达模块
[0146]
gal1p-thmgr-adh1t-gal10p-upc2-1-cyc1t,命名为模块vi。其中,第一轮pcr克隆模块iv的引物为vi-iv-f和vi-iv-r,克隆模块v的引物为vi-v-f和vi-v-r;第二轮的pcr引物为vi-iv-f和vi-v-r;引物序列见表2。
[0147]
(g)将筛选标记表达框leu和tpi1p,构建基因表达模块leu-tpi1p,命名为模块vii;其中,第一轮pcr克隆leu筛选标记引物为vii-leu-f和vii-leu-r,克隆tpi1p引物为vii-tpi1p-f和vii-tpi1p-r;第二轮pcr引物为vii-leu-f和vii-tpi1p-r;引物序列见表2。
[0148]
(h)将筛选标记表达框met和hxt1p,构建基因表达模块met-hxt1p,命名为模块viii;其中,第一轮pcr克隆met筛选标记引物为viii-met-f和viii-met-r,克隆hxt1p引物为viii-hxt1p-f和viii-hxt1p-r;第二轮pcr引物为viii-met-f和viii-hxt1p-r;引物序列见表2。
[0149]
表2本技术中构建各模块所用的引物序列
[0150]
[0151]
[0152][0153]
实施例3、构建工程酵母菌
[0154]
1、酿酒酵母菌株by4741-1的构建
[0155]
(1)将模块iii从plb-iv(即上述模块iv连接plb载体获得)上用引物iii-his-f和iii-ii-r扩增下来,pcr扩增体系:2
×
phanta max master mix(p515-01,诺唯赞)25μl,正反向引物各1.25μl,ddh2o 21.5μl,模板1μl,总反应体系50μl。琼脂糖凝胶电泳检测pcr产物,并进行回收。
[0156]
(2)将回收的pcr片段转化酿酒酵母by4741,将模块iii整合到酵母by4741染色体的ndt80位点,用组氨酸缺陷型培养基(sd-his培养基)平板进行筛选,得到酵母工程菌株by4741-1。
[0157]
2、酿酒酵母菌株by4741-2的构建
[0158]
(1)利用限制性内切酶noti酶切构建好的整合型表达载体pcfb2988-vi,凝胶电泳检测并回收目的条带,获得dna整合片段s1。
[0159]
(2)取50μl上述纯化的dna片段,转化酿酒酵母by4741-1,以将模块整合到酵母by4741-1染色体的ty1位点,并用尿嘧啶和组氨酸缺陷型培养基(sd-ura-his培养基)平板进行筛选,经菌落pcr验证,得到阳性工程菌株by4741-2。
[0160]
3、酿酒酵母菌株tt01的构建
[0161]
(1)将模块vii从plb-vii(即上述模块vii连接plb载体获得)上用引物vii-leu-f和vii-tpi1p-r扩增下来,pcr扩增体系:2
×
phanta max master mix(p515-01,诺唯赞)25μl,正反向引物各1.25μl,ddh2o 21.5μl,模板1μl,总反应体系50μl。琼脂糖凝胶电泳检测pcr产物,并进行回收。
[0162]
(2)将回收的pcr片段转化酿酒酵母by4741-2,将模块vii替换到酵母by4741-2菌
株的erg9启动子,用组氨酸、尿嘧啶和亮氨酸缺陷型培养基(sd-his-ura-leu培养基)平板进行筛选,得到酵母工程菌株tt01。
[0163]
4、酿酒酵母菌株st01的构建
[0164]
(1)将模块viii从plb-viii(即上述模块viii连接plb载体获得)上用引物viii-met-f和viii-hxt1p-r扩增下来,pcr扩增体系:2
×
phanta max master mix(p515-01,诺唯赞)25μl,正反向引物各1.25μl,ddh2o 21.5μl,模板1μl,总反应体系50μl。琼脂糖凝胶电泳检测pcr产物,并进行回收。
[0165]
(2)将回收的pcr片段转化酿酒酵母by4741-2,将模块viii替换到酵母by4741-2菌株的erg9启动子,用组氨酸、尿嘧啶和甲硫氨酸缺陷型培养基(sd-his-ura-met培养基)平板进行筛选,得到酵母工程菌株st01。
[0166]
实施例5、工程菌株发酵检测目标化合物
[0167]
1、工程菌株tt01的发酵及目标化合物检测
[0168]
(1)将菌株tt01的单菌落接种到5ml的sd-his-ura-leu培养基中,30℃条件220rpm培养od值至2~3。
[0169]
(2)将菌液接种到3瓶50ml的sd-his-ura-leu培养基中,每瓶接种5ml,30℃条件下220rpm培养od值至2~3。
[0170]
(3)将3瓶菌液分别接种到1l的sd-his-ura-leu培养基中,每瓶接种50ml,30℃条件220rpm发酵120h。
[0171]
2、菌株tt01发酵产物的提取和检测
[0172]
(1)取50ml上述发酵液3000rpm离心,分别获得上清和菌体。向菌体中加入10ml的20%koh碱裂解液,95℃加热15min进行裂解。
[0173]
(2)将裂解的菌体混合液和上清混合,加入250ml锥形瓶中,并加入等体积的乙酸乙酯,超声萃取20min,静置72h。
[0174]
(3)取上层有机层于液相小瓶中,用氮吹仪吹干,加入100μl硅烷化试剂mstfa,80℃条件下温浴30min。
[0175]
(4)利用安捷伦7890b-5977b气质联用仪检测目标化合物角鲨烯的产量。检测方法:hp-5ms毛细管柱;进样量1μl,不分流;进样口温度250℃,起始温度50℃保持3min,而后以20℃/min的速率升到70℃保持1min,接着15℃/min的速率升到300℃保持3min;electron ionization离子源,能量强度70ev;ms溶剂延迟设为12min,开启电压倍增模式,增益因子设为1。
[0176]
(5)检测结果如图1-2所示,gc-ms检测结果显示,st01菌株经发酵120h产生的角鲨烯为320mg/l。
[0177]
3、工程菌株st01的发酵及目标化合物检测
[0178]
(1)将菌株st01的单菌落接种到5ml的sd-his-ura-met培养基中,30℃条件220rpm培养od值至2~3。
[0179]
(2)将菌液接种到3瓶50ml的sd-his-ura-met培养基中,每瓶接种5ml,30℃条件下220rpm培养od值至2~3。
[0180]
(3)将3瓶菌液分别接种到1l的sd-his-ura-met培养基中,每瓶接种50ml,30℃条件220rpm发酵120h。
[0181]
4、菌株st01发酵产物的提取和检测
[0182]
(1)取上述发酵液,加入等体积的乙酸乙酯,超声1h,然后静置48h。
[0183]
(2)取有机层于干净的液相小瓶中,进行gc-ms检测。其中,所用的仪器优选为安捷伦气质联用仪7890b-5977b。检测方法如下:进样体积为1μl,溶剂延时设置为12min,载气为氦气,流速为1ml/min。色谱柱为hp-5ms。色谱条件:50℃,3min;20℃/min速率升温到70℃,1min;15℃/min升温到300℃,3min。
[0184]
(3)检测结果如图3-4所示,gc-ms检测结果显示,st01菌株经发酵120h产生的橙花叔醇为150mg/l。
[0185]
本发明实施例中所涉及的培养基的配方如下:
[0186]
(1)ypd培养基:蛋白胨20g/l,酵母提取物10g/l,葡萄糖20g/l。
[0187]
(2)sd+相应氨基酸缺陷型培养基:ynb培养基6.7g/l,缺陷氨基酸母液(100x)10ml/l,葡萄糖20g/l(固体培养基配制时添加20g/l的琼脂粉)。
[0188]
缺陷氨基酸母液(100x):腺嘌呤硫酸盐0.25g,精氨酸0.12g,天冬氨酸0.6g,谷氨酸0.6g,组氨酸0.12g,亮氨酸0.36g,赖氨酸0.18g,甲硫氨酸0.12g,苯丙氨酸0.3g,丝氨酸2.25g,苏氨酸1.2g,色氨酸0.24g,酪氨酸0.18g,缬氨酸0.9g,尿嘧啶0.12g,用蒸馏水定容到57ml,根据需要可不加任意一种氨基酸配置成缺陷氨基酸母液(100x)。上述原料均购买自sigma-aldrich。
[0189]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1