一株杀鱼爱德华氏菌噬菌体、其噬菌体组合物及其应用的制作方法
1.本发明涉及微生物技术领域,尤其涉及一株杀鱼爱德华氏菌噬菌体、其噬菌体组合物及其应用。
背景技术:
2.杀鱼爱德华氏菌(edwardsiella piscicida)属于肠杆菌科(enterobacteriaceae)、爱德华氏菌属(edwardsiella),为革兰氏阴性菌,短杆状,具有运动性。杀鱼爱德华氏菌宿主范围多为海水和淡水鱼类,包括尖吻鲈、欧洲鳗鲡、真鲷、大菱鲆、大口黑鲈和黑斑刺魟等。杀鱼爱德华氏菌可引起爱德华氏菌病,该病分布广泛,鱼类感染后可引起大范围的皮肤病变、腹部坏死性肿胀、内脏囊肿和出血性败血症等。爱德华氏菌病病原菌的爆发已经给美国、欧洲、亚洲(包括日本、中国等)国家带来了严重的社会和经济损失。
3.目前,现有方法主要是采用传统的抗生素类药物来防治水产品中由杀鱼爱德华氏菌感染引发的各类疾病,而抗生素的过度使用不仅容易导致耐药病原菌的产生,并且也会对水体及水产品造成污染,因此,需要寻找更安全有效的抗生素替代物。
4.而噬菌体(bacteriophage或phage)是感染细菌、真菌的病毒,在自然界中分布十分广泛,凡是细菌存在之处几乎都有相应的噬菌体。噬菌体具有专一性强、无残留、无毒害的特点,具有宿主依赖性,会随宿主的清除而消亡,不会残留在动物体内。因此,噬菌体在解决细菌感染药物研究上具备巨大的潜力和优势。
5.但是,目前还未发现特异裂解杀鱼爱德华氏菌的噬菌体资源,现有技术还有待进一步发展。
6.因此,现有技术有待进一步改进。
技术实现要素:
7.针对上述问题,本发明提供了一株杀鱼爱德华氏菌噬菌体、其噬菌体组合物及其应用。该杀鱼爱德华氏菌噬菌体可高效且特异地裂解裂解杀鱼爱德华氏菌,且裂解谱宽,稳定性高,不仅可利用该噬菌体制备预防和治疗杀鱼爱德华氏菌感染的疾病的药物,还可用于用于制备水产饲料添加剂、消毒剂及试剂盒、水产品抑菌剂等;其还具有使用安全、无副作用的优点,是一种很有前景的抗生素替代物,可用于解决因杀鱼爱德华氏菌造成的感染、以及与水体中杀鱼爱德华氏菌大量增殖引起的水体问题。
8.为解决上述问题,本发明提供的具体方案如下:
9.第一方面,本发明提供了一株杀鱼爱德华氏菌噬菌体pre03,该噬菌体是分离自山东省青岛市某海鲜市场采的污水。该噬菌体已于2022年01月07日被保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址为北京市朝阳区北辰西路1号院3号,保藏号为cgmcc no.45074。
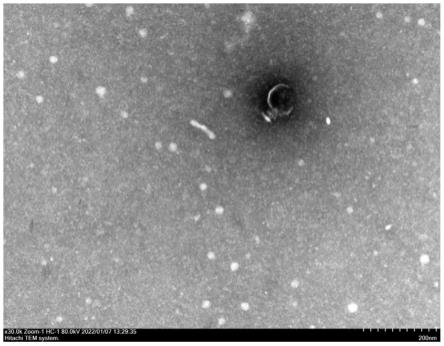
10.电镜下观测到,该噬菌体具有如下特征:其头部长为58nm,头宽为63nm,尾长为
8nm,根据国际病毒分类委员会(the international committee on taxonomy of viruses,ictv)第九次报告的分类标准鉴定,可确定该噬菌体属于短尾噬菌体科,将其命名为pre03。
11.噬菌体在固体培养基上可以形成较大空斑,边缘清晰规则,直径为0.5~1mm。液体培养噬菌体时,菌液接入噬菌体7~9h后混合液变澄清,出现细胞碎片沉淀,即可判定为该噬菌体增殖完成。
12.该噬菌体对杀鱼爱德华氏菌具有优异的裂解性能,经过实验证明,其对杀鱼爱德华氏菌的裂解率达到84.71%,说明该噬菌体的裂解谱宽,应用范围广,这说明其在杀灭环境中杀鱼爱德华氏菌以及防治杀鱼爱德华氏菌方面具有很好的应用前景。
13.该噬菌体在30℃~60℃温度范围内1h处理能保证效价不变,具有较好的温度稳定性。同时,该噬菌体在ph=4~12条件下处理3h后仍能够保持自身稳定性,耐酸碱性能好,能适应较为苛刻的酸碱环境,基于其上述优异的生物学特性,其适应范围广。
14.本技术中,噬菌体pre03包括进行点突变或缺失突变或添加突变的同源性高于98%或99%且保持基本相同的杀菌活性的突变株。由于噬菌体在复制过程中非常容易发生突变,上述噬菌体的突变体也在本技术请求保护的范围内。噬菌体pre03的序列可根据本发明保藏的生物材料通过公知的方法测序得到。对于本领域技术人员来说,根据本发明提供的噬菌体筛选出与其性状相似的突变体并不需要付出创造性的劳动。
15.第二方面,本发明还提供一种噬菌体组合物,包括如上所述的杀鱼爱德华氏菌噬菌体pre03。
16.优选地,在实际应用中,为进一步拓宽噬菌体制剂的裂解谱,充分发挥不同噬菌体的裂解谱差异,进行优势互补,可将上述杀鱼爱德华氏菌噬菌体pre03与其他噬菌体进行组合使用,如与其他杀鱼爱德华氏菌噬菌体组合用于扩大对杀鱼爱德华氏菌的裂解谱;此外,也可将噬菌体pre03与其他不同种类的噬菌体(抑制引发同类疾病的不同病原菌)配合,提高对同一类疾病的防治效果。
17.第三方面,本发明提供一种噬菌体制剂,其有效成分包括上述杀鱼爱德华氏菌噬菌体或上述噬菌体组合物。
18.优选地,所述噬菌体制剂中,杀鱼爱德华氏菌噬菌体pre03的剂量不低于104pfu/ml。
19.上述噬菌体制剂可以以本发明的杀鱼爱德华氏菌噬菌体pre03作为唯一活性成分,或以该噬菌体与其他杀鱼爱德华氏菌噬菌体进行复配后的噬菌体组合物作为活性成分。
20.可选地,上述噬菌体制剂的剂型可以被制备为各种使用形式,其剂型为溶液剂、乳剂、混悬剂、粉剂、凝胶剂、颗粒剂或冻干剂,通过浸浴、注射或口服等方式用于防治杀鱼爱德华氏菌。
21.优选地,上述噬菌体制剂的剂型为溶液剂。溶液剂通过浸浴给药是将噬菌体制剂直接投放于水产养殖水体中进行给药的方式,操作简单且效果好。
22.可选地,所述噬菌体制剂中还包含药学上可接受的载体。本文所使用的术语“药学上可接受的载体”指不对生物体造成显著刺激且不消除所给予的活性组分的生物活性和特性的载体或稀释剂。为了将所述药物组合物配制成液体制剂,药学上可接受的载体必须适
于无菌和生物相容性。实例包括盐水、无菌水、ringer’s溶液、缓冲生理盐水、白蛋白输注液、葡萄糖溶液、麦芽糖糊精溶液、甘油和乙醇。它们可以单独使用或以其任意组合使用。如果需要,可以加入其它常规添加剂,例如,抗氧化剂、缓冲剂和抑菌剂等。当与稀释剂、分散剂、表面活性剂、粘合剂和/或润滑剂组合时,还可以将本发明的组合物制备成注射剂(例如,水性溶液、悬浮液和乳液)、丸剂、胶囊、粒剂或片剂。
23.第四方面,本技术还提供了上述杀鱼爱德华氏菌噬菌体、上述噬菌体组合物在制备以下至少一项产品中的应用:
24.(1)杀灭或抑制杀鱼爱德华氏菌的产品(如杀菌剂、抑菌剂、消毒剂这类产品);
25.(2)预防和/或治疗杀鱼爱德华氏菌所引发水产疾病的产品;
26.(3)预防和/或治疗杀鱼爱德华氏菌引起的炎症反应的产品。
27.其中,术语“预防”是指包括通过给予所述噬菌体来抑制或延迟所述疾病的所有行为。本文中术语“治疗”是指包括通过给予所述噬菌体而使所述疾病好转或有所改善的所有行为。
28.可选地,所述杀鱼爱德华氏菌所引发水产疾病包括水产的消化道类疾病;优选地,所述消化道类疾病包括溃疡病、腹水症或出血病。优选地,所述水产包括多种海水或淡水鱼类。实际生产中,由于杀鱼爱德华氏菌的感染通常引起尖吻鲈、欧洲鳗鲡、真鲷、大菱鲆、大口黑鲈和黑斑刺魟等水产的溃疡病、腹水征、出血性败血症等相应爱德华氏菌病,因此,本技术的杀鱼爱德华氏菌噬菌体能用于制备防治上述水产疾病的各类产品,如药物、消毒剂、抑菌剂等。由于上述疾病是由于感染杀鱼爱德华氏菌所导致,因此,对杀鱼爱德华氏菌具有高效特异的裂解效果的上述噬菌体pre03,对这些疾病具有预防和治疗效果是可以预期的,并且实验结果也证明该结论。后续具体实施方式中仅以大菱鲆作为示例进行说明,并不将应用范围仅限于大菱鲆的杀鱼爱德华氏菌病的防治。
29.第五方面,本发明提供一种水产饲料添加剂,其包括上述的杀鱼爱德华氏菌噬菌体、上述噬菌体组合物或上述噬菌体药物制剂。可上述的杀鱼爱德华氏菌噬菌体、上述噬菌体组合物或上述噬菌体药物制剂与水产饲料进行混拌后,对水产动物(如大菱鲆)进行饲喂,从而达到预防或治疗爱德华氏菌病的效果。
30.优选地,饲料中添加的每种噬菌体的效价为1
×
109pfu/g以上。这样的防治效果更好。
31.第六方面,本发明还提供一种消毒剂,其有效成分包括上述的杀鱼爱德华氏菌噬菌体、上述噬菌体组合物或上述噬菌体药物制剂。优选地,该消毒剂还包含其他用于环境中细菌抑制或消灭的活性成分或其他佐剂;更优选地,所述佐剂包括能延长噬菌体有效期的佐剂。需要消毒杀菌的对象为:水体、池壁、饲养环境、料台、饲养器具或循环水养殖系统。
32.优选地,消毒剂中,杀鱼爱德华氏菌噬菌体的效价为1
×
104pfu/ml以上。
33.第七方面,本发明还提供上述消毒剂在灭杀环境中杀鱼爱德华氏菌中的应用,其中,所述环境包括水体、池壁、饲养环境、料台、饲养器具、循环水养殖系统。
34.具体地,上述消毒剂可用于水产养殖场所的环境消毒、水体消毒和饲料消毒防腐,防止环境中杀鱼爱德华氏菌的污染,可用于代替抗生素或传统消毒产品,且所述噬菌体及代谢产物不会对人体或其他动物造成损害。该消毒剂可通过喷雾、浸泡等方式对养殖环境、饲料、饲养器具等进行杀鱼爱德华氏菌消毒。
35.第八方面,本发明还提供一种检测试剂盒,其包括如上所述的杀鱼爱德华氏菌噬菌体或所述噬菌体组合物。实验证明,噬菌体pre03对宿主菌具有很高的裂解特异性,本发明的噬菌体pre03可应用于样品中杀鱼爱德华氏菌的快速检测,其包括但不限于以试纸或试纸盒等不同形式对临床样本中的病原菌进行检测,该检测方法简单、灵敏度高。
36.第九方面,本发明还提供上述检测试剂盒在用于检测杀鱼爱德华氏菌中的用途。
37.第十方面,本发明还提供用于一种水产品生物抑菌剂,其有效成分主要为上述杀鱼爱德华氏菌噬菌体或其噬菌体组合物。该水产品生物抑菌剂的使用对水产品具有消毒和保鲜作用。使用时,可将所述生物抑菌剂以浸泡或者喷雾的方式对生鲜水产品进行处理,从而达到抑制产品加工、运输或保鲜过程中杀鱼爱德华氏菌的增殖,达到消毒保鲜效果。
38.本发明具有以下有益效果:
39.1、本发明首次提供一种具有产业应用价值的杀鱼爱德华氏菌噬菌体pre03,该噬菌体对杀鱼爱德华氏菌具有较强的裂解作用,该噬菌体对杀鱼爱德华氏菌裂解率可达84.71%,可以有效防控水产养殖场中因杀鱼爱德华氏菌导致的疾病,极大地降低引起的各种疾病的病发概率,如腹水征等;还可以用于对水产养殖场环境、饲料、水体等进行全面的杀鱼爱德华氏菌的消毒,极大地降低了引起的水产品发病率和死亡率。总而言之,该噬菌体可广泛用于水产养殖过程中的容易因感染杀鱼爱德华氏菌造成损失的各个环节、养殖环境的日常消毒、以及水产生鲜食品的抑菌等方面,有益于水产养殖业的健康发展。
40.2、所述噬菌体pre03具有酸碱稳定性和热稳定性高的优点,其在30℃~60℃温度范围内活性保证稳定,具有较好的温度稳定性;该噬菌体在ph=4~12条件下能够保持自身稳定性,耐酸碱性能好,能适应较为苛刻的酸碱环境;同时,该噬菌体的繁殖能力强,其综合生物学特点使其在工业化生产、应用范围上中具有较大的优势。
41.3、该杀鱼爱德华氏菌噬菌体是来自自然界,其使用安全、无副作用,用以解决因杀鱼爱德华氏菌造成的感染、以及因上述病原菌大量增殖引起的水体问题,避免了因使用抗生素造成的抗生素残留、以及诱发耐药性杀鱼爱德华氏菌的问题。由该噬菌体制备的药物、消毒剂或保鲜剂不仅可降低成本,还具有绿色环保的优点。
附图说明
42.图1为噬菌体pre03的电镜照片;
43.图2为噬菌体pre03的热稳定性结果;
44.图3为噬菌体pre03的ph稳定性结果;
45.图4为噬菌体pre03的一步生长曲线;
46.图5为噬菌体pre03的体外裂解实验结果。
47.图6为噬菌体pre03的环境消毒实验结果。
具体实施方式
48.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。在本发明中,若非特指,所采用的设备和原料等均可从市场
购得或是本领域常用的。下述实施例中的方法,如无特别说明,均为本领域的常规方法。
49.实施例1噬菌体的分离和纯化
50.(一)宿主菌悬液的制备
51.取杀鱼爱德华氏菌re03在tsa平板上分区划线,挑单菌落接种入5ml tsb液体培养基中,170rpm、28℃条件下增殖至对数生长期,得到新鲜菌液。
52.(二)噬菌体的分离和纯化
53.(1)噬菌体的分离
54.将取自山东省青岛市某海鲜市场采集的污水进行11000r/min,5min离心,将离心得到的上清液使用0.22μm滤膜过滤后,加入tsb培养基与100μl的宿主菌悬液,在170rpm、28℃的条件下培养48h后,再于11000r/min的条件下离心5min,使用0.22μm滤膜过滤后得到初次富集噬菌体原液;将初次富集噬菌体原液加入tsb培养基与100μl的宿主菌悬液,在170rpm、28℃的条件下培养48h后,再于11000r/min的条件下离心5min,最后用0.22μm滤膜过滤后,得到噬菌体原液。
55.将噬菌体原液用1
×
pbs溶液进行10倍倍比稀释,得到10-2
、10-4
、10-6
、10-8
稀释液后,分别取上述不同浓度稀释液各100μl与制备好的宿主菌悬液混合后在28℃孵育5min后,加入5ml的nb上层培养基中,混匀后迅速倒入tsa培养基平板中,待其凝固后倒置于28℃温箱中培养16h后观察,得到噬菌斑。
56.(2)噬菌体的纯化
57.用无菌镊子抠取单个噬菌斑,置于1ml pbs溶液后放置于170rpm、28℃摇床中浸出30min,将浸出液稀释至10-2
,按照1:1的比例与宿主菌混合,28℃孵育5min,混合液加入5ml nb上层培养基中,混匀后迅速倒入tsa培养基平板中,待其凝固后倒置28℃温箱中培养16h后得到纯化1代噬菌体。纯化3-5代,得到形态一致的噬菌斑。
58.(3)噬菌体悬液的制备
59.取按照上述方法纯化3代后的噬菌体平板,抠取单斑,将其置于1ml pbs溶液中捏碎,于170rpm、28℃摇床中浸出30min。
60.取宿主菌悬液100μl加入5ml的tsb液体培养基中,将噬菌体浸出液与宿主菌悬液按照1:1的比例加入上述培养基中,置于170rpm、28℃摇床中振荡增殖7h,对所得增殖液11000rpm离心5min,上清液用0.22μm细菌滤器过滤,得到噬菌体悬液。
61.(三)噬菌体效价的测定
62.将上述噬菌体悬液使用pbs缓冲液进行10倍稀释,使用双层平板法测定稀释至10-6
与10-7
的噬菌体效价,每个梯度两个平行。培养后对噬菌斑进行计数并计算效价。测定得到,所述噬菌体悬液效价为1.33
×
109pfu/ml。
63.实施例2噬菌体的鉴定
64.噬菌体的电镜检测
65.1、实验方法:
66.取20μl的效价为109pfu/ml的前述分析的噬菌体滴在铜网上,沉淀15min,用滤纸吸去多余的液体,用2%的磷钨酸染色30min,干燥后电镜观察。
67.2、实验结果及分析:
68.结果如图1所示,该噬菌体头部长为58nm,头宽为63nm,尾长约8nm,根据国际病毒
分类委员会(the international committee on taxonomy of viruses,ictv)第九次报告的分类标准鉴定,可确定该噬菌体属于短尾噬菌体科,将其命名为pre03。
69.实施例3噬菌体的生物学特性测定
70.(一)噬菌体的裂解谱测定
71.1、实验方法:
72.(1)实验对象:裂解对象为85株杀鱼爱德华氏菌,这85株菌分别来源于辽宁大连、山东烟台、山东日照、山东威海、山东青岛、福建漳州、广东湛江的鲆鲽类、海鲈鱼及水样。
73.(2)对这85株菌进行pcr毒力基因检测,分别检测其是否携带菌毛蛋白前体(fima)、杀伤因子(mnkf)、过氧化氢酶前体(katb)、谷氨酸脱羧酶同工酶(gadb)和柠檬酸裂解酶(citc)5种毒力基因。
74.(3)本实施例采用双层平板法测定噬菌体裂解谱,将噬菌体悬液分别与杀鱼爱德华氏菌菌液各取100μl加入0.5ml离心管中混合,28℃孵育5min后加入5ml nb上层培养基中混匀,迅速倒入tsa培养基平板中,待其冷凝后倒置于28℃温箱中培养16h,培养完成后取出平板观察有无噬菌斑形成来鉴别能否裂解。通过上述方法检测噬菌体pre03对前述85株杀鱼爱德华氏菌的裂解谱。
75.2、实验结果及分析:
76.(1)实验结果显示,这85株菌中仅26株不携带上述任一种毒力基因;而其中携带菌毛蛋白前体(fima)的杀鱼爱德华氏菌在所有菌株中的占比为22.35%,携带杀伤因子(mnkf)的杀鱼爱德华氏菌的占比为17.65%,携带过氧化氢酶前体(katb)的杀鱼爱德华氏菌的占比21.18%,携带谷氨酸脱羧酶同工酶(gadb)的杀鱼爱德华氏菌的占比10.58%,携带柠檬酸裂解酶(citc)的杀鱼爱德华氏菌的占比17.65%,具体见表1。
77.(2)裂解实验结果见下表1,噬菌体pre03可裂解这85株杀鱼爱德华氏菌中的72株,因此,该噬菌体对这85株杀鱼爱德华氏菌的裂解率达到84.71%,这说明该噬菌体的裂解谱较宽。
78.表1噬菌体pre03对杀鱼爱德华氏菌的裂解谱
79.80.81.[0082][0083]
(二)噬菌体的最佳感染复数的测定
[0084]
1、实验方法:
[0085]
采用平板涂布法测定宿主菌浓度,并进行三个平行,倒置于28℃温箱中培养16h,培养完成后进行菌落计数,计算宿主菌浓度。
[0086]
取宿主菌液100μl于5ml tsb液体培养基中,按照感染复数分别为1、0.1、0.01、0.001、0.0001、0.00001的比例加入噬菌体悬液并混匀,170rpm,28℃振荡培养至液体变清,
11000rpm离心5min,测定噬菌体效价。
[0087]
2、实验结果及分析:
[0088]
如表2所示,在感染复数为0.0001时,噬菌体pre03的效价最高,达到7.25
×
109pfu/ml。
[0089]
表2噬菌体最佳感染复数
[0090][0091]
(三)噬菌体一步生长曲线的测定
[0092]
1、实验方法:
[0093]
按照moi=0.0001的条件添加噬菌体pre03增殖液和其宿主菌对数期菌液各1ml,充分混匀并开始计时,28℃温育5min,11000rpm离心30s,用微量移液器尽量吸去上清,再用1ml tsb液体培养基洗涤1次(11000rpm,离心30s),弃上清。用预热的tsb液体培养基混悬沉淀(总体积为5ml)并充分混匀,迅速置于28℃摇床中170rpm振荡培养,在0min和每隔10min取出150μl,11000rpm离心1min,吸取100μl的上清用生理盐水10倍倍比稀释后用双层平板法测定噬菌体效价,做3个重复,结果取平均值。以感染时间为横坐标,感染体系中噬菌体的效价的对数值为纵坐标,绘制一步生长曲线,得到噬菌体的潜伏期、爆发期。
[0094]
噬菌体的裂解量=噬菌体稳定期效价
×
体积/感染初期宿主菌浓度
×
加样体积
[0095]
2、实验结果及分析:
[0096]
图4为噬菌体pre03的一步生长曲线,由此可知:该噬菌体的裂解周期时长为120min:噬菌体感染宿主菌后,30min效价没有明显变化,说明其潜伏期约为30min;噬菌体侵染宿主菌后的30-90min内,噬菌体数量急剧增加,可见噬菌体的爆发期约为60min;在随后的30min内,噬菌体数量基本不变,进入稳定生长期。
[0097]
通过计算得到,噬菌体的裂解量约为3.3
×
109×
5/1
×
108×
1=165pfu/细胞,这说明噬菌体pre03的潜伏期和裂解期时间较短,有很强的复制能力和裂解能力,适合用于噬菌体治疗。
[0098]
(四)噬菌体的热稳定性测定
[0099]
1、实验方法:
[0100]
取测定效价为1
×
109pfu/ml的噬菌体悬液500μl于1.5ml离心管中,分别放置于30℃、40℃、50℃、60℃、70℃的恒温水浴锅中分别处理20min、40min、60min后迅速冷却降温后测定效价。
[0101]
2、实验结果及分析:
[0102]
结果如图2所示,噬菌体pre03在30℃、40℃、50℃、60℃时经过1h后,其效价并无明显变化;70℃时经过20min作用后基本失活,说明pre03噬菌体能够耐受一定程度的高温,且在60℃时及以下的条件下较稳定。
[0103]
(五)噬菌体的ph稳定性测定
[0104]
1、实验方法:
[0105]
取无菌试管中加入4.5ml的不同ph值(2、3、4、5、6、7、8、9、10、11、12、13)的pbs,各三支,置于28℃的水浴锅中,待温度稳定之后,各加入500μl 109pfu/ml的噬菌体增殖液,混匀28℃水浴作用1h、2h、3h和4h。不同处理时间处理后,向混合液中加入适量的hcl或者naoh使混合液的ph值约为7,双层平板法测定噬菌体的效价。
[0106]
2、实验结果及分析:
[0107]
结果如图3所示,在不同ph体系中,噬菌体pre03在ph=4~12的条件下可以保持良好的稳定性。随着ph值的降低,噬菌体的效价有一定的下降。但ph=3的条件下处理4h后,该噬菌体仍然存在一定活性;仅在ph为2或13的条件下处理1h后,该噬菌体才基本失活。上述结果说明,该噬菌体对酸碱较不敏感,对酸性环境和碱性环境均具有良好的耐受性。因此,pre03在酸碱环境下稳定高。
[0108]
(六)噬菌体体外裂解实验
[0109]
1、实验方法:
[0110]
将噬菌体悬液与宿主菌按照moi=0.0001的比例加入100ml tsb液体培养基中,临床分离致病性杀鱼爱德华氏菌菌株re03的终浓度为5.00
×
106cfu/ml,噬菌体的终浓度为5.00
×
102pfu/ml,对照组加入与噬菌体溶液相同量的无菌tsb培养基,菌液和噬菌体混合后在28℃,170rpm的摇床内振荡培养,每隔一定的时间测定od
600
值直至混合液变清亮。
[0111]
2、实验结果及分析:
[0112]
结果如图5所示:对照组中,体系中无噬菌体时,随着宿主的生长,培养液的od
600
在4h内缓慢增加,在4-8h内呈指数增加,在8-10h内缓慢增加;而加有噬菌体和宿主菌的试验组中,在前6h,宿主菌的od
600
同样有所增加,随着宿主菌进入指数增长期,噬菌体能够有效抑制宿主菌;6h后,试验组的od
600
开始明显下降,说明宿主菌的浓度急剧下降;在7-10h内,试验组od
600
基本将至最低且没有明显提升,且肉眼可见加入噬菌体悬液的试验组已经显著澄清。
[0113]
实施例4噬菌体拌料饲喂后对鱼体内代谢的影响
[0114]
1、实验方法:
[0115]
选择体重30
±
5g健康的大菱鲆,空腹过夜暂养。分别设置实验组和对照组,按照噬菌体制剂的体积(ml)与鱼饲料的质量(g)比为10%的添加量,将噬菌体pre03与鱼饲料均匀混合,噬菌体拌料后效价为1
×
109pfu/g,将饲料阴干,再以大菱鲆体重5%的剂量饲喂实验组的鱼,频次为2次/天,对照组按照同样剂量用tsb培养基浸泡饲料后饲喂。喂食后在1、6、24、48、72、96、120、144、168h检测鱼肠道、肾脏、肝脏以及空白对照组正常鱼体内噬菌体的含量。
[0116]
2、实验结果及分析:
[0117]
实验结果显示,饲喂浸泡过噬菌体pre03的鱼料1h后,实验组的鱼体肠道内可以检测到噬菌体的存在,效价可达5.0
×
105pfu/g,说明噬菌体可以通过喂食进入鱼体内;饲喂浸泡过噬菌体pre03的鱼料6h后,实验组的鱼体肾脏、肝脏内可以检测到噬菌体的存在,且噬菌体可持续存在3d以上,这对噬菌体作为水产饲料添加剂具有指导作用,且可用于预防和治疗爱德华氏菌病。实验结果还表明,噬菌体对大菱鲆的健康没有影响,不影响大菱鲆正常活动,说明噬菌体安全性很好。
[0118]
实施例5噬菌体预防杀鱼爱德华氏菌感染大菱鲆效果测定
[0119]
1、实验方法:
[0120]
准备体重30
±
5g健康的大菱鲆作为实验对象,实验前禁食一天。将大菱鲆分为三组,每组30只,分别为实验组、对照组和空白对照组。按照噬菌体制剂的体积(ml)与鱼饲料的质量(g)比为10%的添加量,将噬菌体与鱼饲料均匀混合,饲料中噬菌体的含量为1
×
109pfu/g,将饲料阴干后以对鱼体重的5%的剂量饲喂,频次为2次/天。
[0121]
经噬菌体饲喂6h后,实验组和对照组的水体中添加初始浓度为5.0
×
109cfu/ml的杀鱼爱德华氏菌re01,使其终浓度为1.0
×
108cfu/ml,同时空白对照组不做任何处理。记录各组7天内存活大菱鲆数目,并计算噬菌体的相对保护率。具体结果见下表3。
[0122]
表3噬菌体拌料对杀鱼爱德华氏菌的预防效果
[0123][0124]
2、实验结果及分析:
[0125]
实验结果显示,空白对照组的大菱鲆7天内未出现死亡(表格中未显示);对照组的大菱鲆的累计死亡率为80%,实验组的大菱鲆累计死亡率为40%,即噬菌体pre03对大菱鲆的相对保护率为50%;这说明噬菌体作为水产饲料添加剂添加入大菱鲆的饲料中,能有效预防大菱鲆感染杀鱼爱德华氏菌而导致的疾病,降低大菱鲆的死亡率,提高成活率,降低养殖风险。
[0126]
实施例6噬菌体治疗杀鱼爱德华氏菌感染大菱鲆效果测定
[0127]
1、实验方法:
[0128]
体重30
±
5g健康的大菱鲆作为实验对象,实验前禁食一天。将大菱鲆分为三组,每组30只,分别为实验组、对照组和空白对照组。实验组和对照组水体添加初始浓度为5.0
×
109cfu/ml的杀鱼爱德华氏菌re01,使其终浓度为1.0
×
108cfu/ml。攻毒1h后,饲喂混合有噬菌体的饲料。投喂的饲料按照噬菌体制剂的体积(ml)与鱼饲料的质量(g)比为10%的添加量,饲料中噬菌体的含量为1
×
109pfu/g,将噬菌体与饲料均匀混合,阴干后以鱼体重5%的剂量饲喂,频次为2次/天。对照组按照同样剂量用tsb培养基浸泡饲料后饲喂。同时空白对照组不做任何处理。记录各组7天内存活大菱鲆数目,并计算噬菌体的保护率。具体测试结果见表4。
[0129]
表4噬菌体拌料对杀鱼爱德华氏菌疾病的治疗效果
[0130][0131]
2、实验结果及分析:
[0132]
实验结果显示,实验组中,给大菱鲆浸浴致病性杀鱼爱德华氏菌1h后,饲喂浸润了噬菌体pre03的饲料,可有效控制大菱鲆的死亡率;与未饲喂携带噬菌体的饲料的攻毒组(对照组)相比,实验组的大菱鲆存活率得到大幅度地提高。
[0133]
本发明为噬菌体制剂制备、抗杀鱼爱德华氏菌的药物提供了一种新来源,从而为治疗杀鱼爱德华氏菌感染引起的疾病提供新的理论依据和实践经验。
[0134]
实施例7噬菌体对非宿主性细菌的裂解试验
[0135]
1、实验方法
[0136]
选取10株溶藻弧菌菌、20株美人鱼发光杆菌、5株变形杆菌,共35株不同类型的非宿主性细菌,按照前述裂解谱的测定方法进行噬菌体pre03的裂解谱的测定实验。
[0137]
2、实验结果及分析:
[0138]
结果显示,该噬菌体与35株非宿主性细菌的双层平板中都未发现透亮噬菌斑,这表明噬菌体pre03均无法识别上述这些非宿主性细菌,这说明供试噬菌体具有极强的宿主特异性,且对微生物群落无损伤作用,可用于制备检测试剂盒。
[0139]
实施例8噬菌体pre03的环境消毒试验
[0140]
1、实验方法
[0141]
取20l大菱鲆养殖水体,设为一组对照组,三组试验组,每组5l。试验组均加入终浓度为1
×
108pfu/ml的噬菌体pre03,对照组加入等体积的pbs缓冲液。在试验前以及噬菌体加入后4h、8h、12h、16h、20h、24h进行取样,采用tsa平板测定水体中菌浓度。
[0142]
2、实验结果及分析:
[0143]
由图6可知,对照组中的菌浓度试验前与试验后基本保持一致,未发生明显变化;而三组试验组在加入噬菌体后,其水体菌浓度在持续下降,而在加入8h时水体菌浓度出现降低迅速,并在24h内未出现升高现象,该噬菌体的添加呈现出净化水体的作用,这表明噬菌体pre03对大菱鲆养殖环境有明显杀菌消毒效果,可用做水体环境改良剂、消毒剂使用。
[0144]
从上述的多个实施例的结果可知,本发明的杀鱼爱德华氏菌噬菌体对大菱鲆的杀鱼爱德华氏菌病具有很好的预防和治疗效果,可利用该噬菌体制备抗杀鱼爱德华氏菌的药物,为治疗杀鱼爱德华氏菌感染引起的疾病提供新的理论依据和实践经验。此外,还可将该噬菌体用于制备环境消毒剂和饲料添加剂等,应用于水产养殖的各个环节,有益于水产养殖业的健康发展。
[0145]
可以理解的是,对本领域普通技术人员来说,可以根据本发明的技术方案及本发明构思加以等同替换或改变,而所有这些改变或替换都应属于本发明所附的权利要求的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1