卡利比克迈耶氏酵母Q11防治猕猴桃果实采后青霉病及贮藏保鲜的方法
卡利比克迈耶氏酵母q11防治猕猴桃果实采后青霉病及贮藏保鲜的方法
技术领域
1.本发明属于生物防治技术领域,具体涉及卡利比克迈耶氏酵母q11防治猕猴桃果实采后青霉病及贮藏保鲜的方法。
背景技术:
2.猕猴桃营养价值丰富,属于浆果类果实,在采摘,贮运和销售过程中易受机械损伤而引起病菌侵染,导致贮藏过程中的腐烂损失严重。由扩展青霉(penicillium expansum)引起的青霉病是猕猴桃贮藏期常见的病害之一,扩展青霉在环境中广泛存在,可由果实伤口或者自然孔口侵入,引发猕猴桃腐烂,并且扩展青霉会产生真菌毒素——展青霉素,对人体的神经系统和免疫系统具有毒害作用,严重威胁人体健康。
3.目前,针对猕猴桃采后病害可以通过化学防治法和物理防治法等传统方法。化学防治法通常使用化学杀菌剂,虽然成本低廉,效力强劲,但对环境污染严重,残留的药剂也会对人体造成危害,而且容易使病原菌产生耐药性。物理防治方法主要有热处理,紫外辐照,气调贮藏和超声处理等,此类方法无毒无害,通过直接灭杀病原菌达到保鲜的目的,但物理防治法大多成本费用大,设备要求高,对果实的品质也会不可避免地造成一定的损坏。
4.因此,亟需一种安全,有效,经济,对环境友好的控制水果采后病害的方法。其中利用微生物拮抗原理的生物防治法已成为水果采后领域的研究热点;目前拮抗菌主要分为拮抗细菌,小型丝状真菌和拮抗酵母菌。
5.然而,目前利用拮抗酵母菌控制病害的效果不佳,控制效果也有待提升;且应用于控制猕猴桃采后病害尤其是青霉病的研究鲜有报道;因此筛选出一株能有效控制猕猴桃采后青霉病,减缓果实自然腐烂,延长果实货架期,保持果实营养价值和感官品质的拮抗酵母十分必要。
技术实现要素:
6.针对现有的技术不足,本发明旨在解决上述问题;提供一株分离于猕猴桃果实表面的酵母—卡利比克迈耶氏酵母q11,该酵母能有效降低猕猴桃采后青霉病的发病率和自然腐烂率,并且不影响果实的品质,减少因此而造成的商业损失,具有潜在的应用价值。
7.为了实现以上目的,本发明提供如下技术方案:
8.本发明所提供的防治猕猴桃采后青霉病的酵母菌株是从猕猴桃果实表面分离纯化得到,经nyda固体培养基培养后,进行形态学观察;并对该菌株的5.8srdna-its区序列分析,进行分子生物学鉴定。该卡利比克迈耶氏酵母q11的保藏信息如下:保藏号为cctcc no:m 2022322;保藏单位:中国典型培养物保藏中心(cctcc);保藏地址:中国武汉,武汉大学;保藏日期:2022年3月28日;建议的分类名为:卡利比克迈耶氏酵母(meyerozyma caribbica)q11。
9.卡利比克迈耶氏酵母q11防治猕猴桃果实采后青霉病及贮藏保鲜的方法,按照以
下步骤进行:
10.(1)将卡利比克迈耶氏酵母(meyerozyma caribbica)q11接种在nydb培养基中进行第一次活化培养,培养后得到活化液;所述的卡利比克迈耶氏酵母q11,保藏于中国典型培养物保藏中心,保藏编号为:cctcc no:m 2022322;
11.(2)将步骤(1)的活化液转接于nydb培养基中再次培养得到酵母培养液,将酵母培养液离心得到菌泥,用无菌生理盐水悬浮菌泥并将悬浮菌液调整浓度至1
×
108cells/ml,得到酵母菌悬液;用无菌打孔器对清洗消毒后的猕猴桃打孔,将酵母菌悬液注入孔中,自然晾干后再注入与酵母菌悬液等体积的扩展青霉孢子悬液,浓度为1
×
104spores/ml,以此验证卡利比克迈耶氏酵母对由扩展青霉引起的猕猴桃采后青霉病的控制效果;
12.(3)使用1
×
108cells/ml的酵母悬液对采摘后不经任何处理的猕猴桃进行喷洒或浸泡处理,自然晾干后用保鲜膜封入框中,即可实现对猕猴桃采后青霉病的防治及贮藏保鲜。
13.进一步的,步骤(1)中所述第一次活化培养的条件为:28℃,180rpm的条件下培养22~24h。
14.进一步的,步骤(1)和(2)中所述nydb培养基,成分如下,以1l计:牛肉浸膏8g,酵母浸膏5g,葡萄糖10g,蒸馏水定容至1000ml,115℃高压蒸汽灭菌20min。
15.进一步的,步骤(2)中所述再次培养的条件为:28℃,180rpm的条件下培养22~24h。
16.进一步的,步骤(2)中所述无菌生理盐水的质量浓度为0.85%。
17.进一步的,步骤(2)中所述的离心条件为:离心力为8000
×
g,温度为4℃,时间10~15min。
18.进一步的,步骤(2)中所述清洗消毒是将猕猴桃置于体积浓度2.5%的次氯酸钠溶液中浸泡3~10min。
19.进一步的,步骤(2)中所述孔的直径为4-5mm,深度为3mm。
20.进一步的,步骤(2)中所述在孔中注入的卡利比克迈耶氏酵母菌悬液和扩展青霉孢子悬浮液的体积均为15~20μl。
21.进一步的,步骤(3)中所述浸泡处理的时间为1~3min。
22.本发明的有益效果:
23.1.本发明所提供的卡利比克迈耶氏酵母菌株(meyerozyma caribbica)q11为本实验室从猕猴桃果实上筛选得到,经安全性试验验证为实际无毒,对人体安全无害。
24.2.本发明所提供的卡利比克迈耶氏酵母菌株(meyerozyma caribbica)q11能有效降低猕猴桃采后的青霉病发病率和自然腐烂率。
25.3.本发明所提供的卡利比克迈耶氏酵母菌株(meyerozyma caribbica)q11对猕猴桃的营养和感官品质:维生素c,可滴定酸,硬度,可溶性固形物等无显著不良影响。
26.4.本发明所提供的卡利比克迈耶氏酵母尚未有防治猕猴桃采后病害应用的报道,具有一定的独创性,能代替化学杀菌剂的使用,避免对环境和人体的潜在危害,减少经济能源负担,具有一定的社会和经济效益。
附图说明
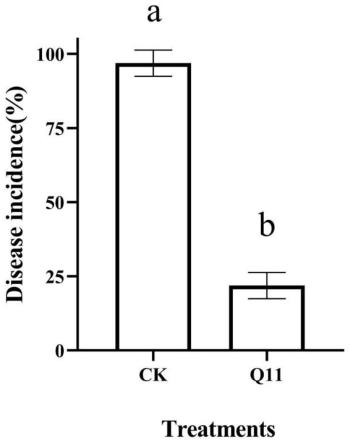
27.图1为酵母菌q11对猕猴桃果实采后青霉病的抑制效果;注ck为对照组无菌生理盐水;q11为浓度1
×
108cells/ml的酵母菌q11悬液;不同字母代表差异显著。
28.图2为本发明卡利比克迈耶氏酵母菌株(meyerozyma caribbica)q11的its区核酸序列系统发育进化树图。
具体实施方式
29.通过以下实施实例更加详细地说明本发明。以下实施实例仅是说明性的,本发明并不受这些实施实例的限制。
30.其中本发明所用到的病原菌—扩展青霉(penicillium expansum)是从感病猕猴桃上分离筛选。将霉菌接种到pda培养基上在25℃避光培养7d,用无菌生理盐水在培养基上抽吸得到青霉孢子悬液,将其保存在50%(v/v)甘油,于-80℃冰箱保藏备用。
31.实施例1:
32.本发明的卡利比克迈耶氏酵母菌株(meyerozyma caribbica)q11的获取方法步骤如下:
33.1.从猕猴桃果实上分离纯化出疑似酵母单菌落,记为酵母菌q11;
34.从镇江句容果园采摘猕猴桃,随机选择猕猴桃果实并将表皮取出置于无菌水中震荡洗脱,并进行梯度稀释,分别得到10-2
、10-3
、10-4
、10-5
溶液。分别从稀释溶液中吸取100μl涂布于孟加拉红培养基上,28℃培养48h,挑取优势酵母单菌落,在nyda培养基上分离纯化。将分离纯化后的菌株接种到nydb培养基里28℃,180rpm培养22~24h,用50%甘油于-80℃冰箱保藏备用。
35.其中,孟加拉红培养基的成分如下:孟加拉红36.6g,蒸馏水1000ml,115℃高压蒸汽灭菌20min。
36.2.拮抗扩展青霉(p.expansum)酵母菌的筛选
37.(1)酵母菌q11悬液的制备
38.将酵母q11从-80℃冰箱取出,用nydb培养基活化两次,活化条件均为28℃、180r/min条件下培养24h;活化培养后离心收集菌体,用无菌生理盐水洗2遍;用血球计数板计数,配制成浓度为1
×
108cells/ml的酵母菌悬液。
39.(2)扩展青霉(p.expansum)孢子悬液的制备
40.将病原菌扩展青霉先在pdb培养基中于25℃,180rpm条件下活化培养24h,活化培养后取100μl活化液涂布于pda培养基培养皿上,在25℃培养7d后,用无菌生理盐水配制成浓度为1
×
104spores/ml扩展青霉孢子悬浮液待用。
41.所述pdb培养基的成分如下:200g土豆去皮煮沸20min,葡萄糖20g,蒸馏水定容至1000ml,115℃高压蒸汽灭菌20min。
42.所述pda培养基的成分如下:200g土豆去皮煮沸20min,葡萄糖20g,琼脂粉20g,蒸馏水定容至1000ml,115℃高压蒸汽灭菌20min。
43.(3)拮抗扩展青霉(p.expansum)酵母菌株的筛选
44.挑选大小均匀、无机械损伤,成熟度基本一致的猕猴桃果实,用体积浓度2.5%的次氯酸钠溶液浸泡十分钟清洗消毒以去除表面微生物,放入干净塑料筐中晾干。用的无菌
打孔器在猕猴桃果实赤道处打3个孔,孔的直径4mm,深度3mm。每个伤口加入15μl酵母菌悬液和无菌生理盐水,自然晾干后接种15μl扩展青霉孢子悬液,待自然晾干后密封,置于20℃恒温培养箱,放置4d后记录猕猴桃果实青霉病的发病率,以此评价拮抗酵母的抑菌效果。发病率的计算公式为:发病率=发病的果实数/果实总数
×
100%。
45.(4)拮抗扩展青霉(p.expansum)酵母菌株的筛选结果
46.如图2所示,室温存放4d,无菌生理盐水对照组的腐烂率为96.88%,说明扩展青霉侵染猕猴桃果实能力很强;经本发明筛选的酵母q11处理的猕猴桃,腐烂率只有21.88%,说明酵母q11可以显著抑制猕猴桃采后青霉病的发生。
47.实施例2:
48.卡利比克迈耶氏酵母菌株(meyerozyma caribbica)q11的微生物学特性;
49.1.分子生物学鉴定
50.(1)酵母q11的分子生物学鉴定
51.对分离筛选出的酵母q11以真菌通用引物扩增its区核酸序列,将产物的测序结果输入https://www.ncbi.nlm.nih.gov/网站,从ncbi数据库中下载同源序列,通过mega5软件构建系统发育进化树如图2,确定筛选到的酵母q11为卡利比克迈耶氏酵母;本发明所提供的防治猕猴桃果实采后病害的酵母q11,现保存位于中国武汉市武汉大学的中国典型培养物保藏中心(cctcc),保藏编号为:cctcc no:m 2022322,保藏日期为2022年3月28日,建议的分类命名为卡利比克迈耶氏酵母菌株(meyerozyma caribbica)q11。
52.2.卡利比克迈耶氏酵母菌株(meyerozyma caribbica)q11形态学特征
53.(1)在nydb液体培养基中培养22~24h后,菌液变浑浊,镜检酵母细胞呈球形和椭球形,出芽生殖。
54.(2)在nyda培养基(牛肉浸膏8g,酵母浸膏5g,葡萄糖10g,琼脂粉20g,115℃高压蒸汽灭菌20min)上28℃培养48h,菌落呈乳白色、圆形,菌落表面光滑整齐无褶皱。
55.实施例3:
56.卡利比克迈耶氏酵母菌株(meyerozyma caribbica)q11的安全性研究;
57.1.试验方案
58.供试动物为清洁级为spf级的icr小鼠,购买于常州卡文斯实验动物有限公司,选择体重范围在18g-22g的小鼠共40只,雌雄各半。试验前,将小鼠放置在江苏大学实验动物中心检疫3天。试验小鼠共分为2组,每组20只,雌雄各10只。2组小鼠分为0g/kg和10g/kg两个个剂量组进行实验。采用经口灌胃方式,按0.4ml/20g体重进行实验。观察14d,整个实验过程中,观察小鼠的日常状况是否有中毒死亡现象。若出现小鼠,必要时可将试验延长到28d。计算半数致死量,并进行毒性分级。
59.2.实验结果
60.按照上述试验步骤,统计卡利比克迈耶氏酵母菌株(meyerozyma caribbica)q11安全性实验结果如下:
61.由表1可以看出,灌入卡利比克迈耶氏酵母菌株(meyerozyma caribbica)q11的小白鼠14d未出现死亡,且ld 50值大于5000mg/kg体重,根据急性毒性分级标准可知,卡利比克迈耶氏酵母菌株(meyerozyma caribbica)q11属于安全无毒类酵母。
62.表1卡利比克迈耶氏酵母q11的急性经口毒性实验结果
[0063][0064]
实施例4:
[0065]
卡利比克迈耶氏酵母菌株(meyerozyma caribbica)q11对猕猴桃果实自然腐烂率及其储藏品质的影响
[0066]
(1)将卡利比克迈耶氏酵母(meyerozyma caribbica)q11接种在nydb培养基中进行第一次活化培养,活化培养的条件为:28℃,180rpm,培养24h后得到活化液;
[0067]
(2)将步骤(1)的活化液转接于nydb培养基中于28℃,180rpm/min,再次培养24h得到酵母培养液,将酵母培养液离心得到菌泥,用无菌生理盐水(0.85%)悬浮菌泥并将悬浮菌液调整浓度至1
×
108cells/ml,得到酵母菌悬液;用无菌打孔器对清洗消毒后的猕猴桃打孔,将1
×
108cells/ml的酵母菌悬液注入孔中,自然晾干后再注入与酵母菌悬液等体积的扩展青霉孢子悬液,浓度为1
×
104spores/ml,以此验证卡利比克迈耶氏酵母对由扩展青霉引起的猕猴桃采后青霉病的控制效果;
[0068]
(3)使用1
×
108cells/ml的酵母悬液对采摘后不经任何处理的猕猴桃进行均匀喷洒,自然晾干后用保鲜膜封入框中于20℃贮藏,实现对猕猴桃采后青霉病的防治及贮藏保鲜。
[0069]
经存放26d后,记录腐烂率,并测量失重率、硬度、可溶性固形物、可滴定性酸、抗坏血酸等品质指标。
[0070]
其中,腐烂率计算公式为:腐烂率=腐烂猕猴桃数量/猕猴桃总个数
×
100%。实验重复三次。
[0071]
失重率计算公式为:失重率=(起始重量-贮藏后重量)/起始重量
×
100%。实验重复三次。
[0072]
硬度:使用ta-xt2i物性仪测定。选用p5探针,参数设定:“压力测量”模式,测试前,测试中,测试后探针的运行速度分别为5mm/s,1mm/s,5mm/s,测试深度为5mm。选定猕猴桃赤道处均匀分布的两个点进行测试,探头插入猕猴桃时所受到的最大阻力记为硬度(n)。实验重复三次。
[0073]
可溶性固形物(tss):室温下用手持糖度计测定tss含量(g/100g)。实验重复三次。
[0074]
可滴定酸(ta):从每个处理中随机抽取6个猕猴桃,从赤道取2g果肉组织加入蒸馏水研磨成匀浆,定容至40ml得到提取液,静置震荡15min后离心,取15ml上清液于锥形瓶中,加入两滴1%的酚酞,用0.1m naoh滴定。结果以苹果酸百分含量表示。实验重复三次。
[0075]
抗坏血酸(vc):使用紫外快速测定法。从每个处理中随机抽取6个猕猴桃,从赤道取2g果肉组织加入15ml 1%盐酸研磨成匀浆,用蒸馏水定容至40ml,离心后取1ml待测猕猴桃提取液,加入2ml 10%盐酸,再定容至50ml,于243nm处测量吸光度值;另取1ml待测猕猴桃提取液,加入10ml蒸馏水,再加入4ml 1m氢氧化钠溶液,静置15min后再加入4ml 10%盐
酸,并用蒸馏水定容至50ml,于243nm处测量吸光度值。由待测液及碱处理待测液的od
243
值之差,对照标准曲线,计算样品中维生素c的含量。每处理3次重复。
[0076]
试验结果如下:
[0077]
按照上述步骤试验,测定猕猴桃果实的腐烂率和各项贮藏品质。结果如表1所示,在20℃贮藏26d后,与对照组相比,卡利比克迈耶氏酵母处理猕猴桃果实后的自然腐烂率显著降低,取得了意想不到的显著效果;同时可溶性固形物也显著增加,其他和品质相关的指标未有显著性差异,证明该酵母对猕猴桃品质指标没有任何不良影响,并且会在一定程度上延缓猕猴桃果实品质衰败。
[0078]
表1卡利比克迈耶氏(m.caribbica)q11对猕猴桃果实贮藏品质的影响
[0079][0080]
注:ck:无菌生理盐水处理组,即对照组;q11:浓度为1
×
108cells/ml的卡利比克迈耶氏q11菌悬液处理组。不同字母代表差异显著(p《0.05)。
[0081]
说明:以上实施例仅用以说明本发明而并非限制本发明所描述的技术方案;因此,尽管本说明书参照上述的各个实施例对本发明已进行了详细的说明,但是本领域的普通技术人员应当理解,仍然可以对本发明进行修改或等同替换;而一切不脱离本发明的精神和范围的技术方案及其改进,其均应涵盖在本发明的权利要求范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1