一种生产2’-岩藻糖基乳糖的大肠杆菌工程菌株及应用
一种生产2
’‑
岩藻糖基乳糖的大肠杆菌工程菌株及应用
技术领域
1.本发明涉及一种生产2
’‑
岩藻糖基乳糖的大肠杆菌工程菌株及应用,属于合成生物学、微生物代谢工程技术和发酵工程技术等领域。
背景技术:
2.人乳寡糖(human milk oligosaccharides,hmos)是母乳中含量仅次于乳糖和脂类的第三大成分,是200多种不易消化和非营养性碳水化合物的复杂混合物。其可作为益生元刺激双歧杆菌和乳杆菌等有益菌群的生长,作为受体类似物抑制致病微生物对结肠黏膜的黏附,也可作为免疫调节因子,降低免疫相关的非传染性疾病的发生,利于婴儿肠道正常的消化、吸收、分泌及免疫功能的建立,同时hmos还可以提供大脑发育和认知所需的潜在必需营养素,有助于刺激婴幼儿大脑发育以及改善认知学习能力。2'-岩藻糖基乳糖(2'-fucosyllactose,2'-fl)作为母乳中分泌最丰富的人乳寡糖,约占总hmos的30%,有研究表明其在预防疟疾的发生有重要作用,由于其具有的营养和医药价值,受到更加广泛的关注。
3.一般2
′‑
岩藻糖基乳糖可通过分离纯化或者体外合成法生产。但因其含量低、原料来源不足以及步骤繁琐等问题,无法实现其从母乳中直接分离纯化制备。体外合成人乳寡糖主要包括化学合成法、酶法合成(包括化学-酶法)以及生物法等。其中,化学法需要精确地选择性保护不同羟基以及去保护等反应,过程复杂,副反应和副产物比例高,无法实现高效率合成。目前国内外研究较多的是采用酶法合成(化学-酶法)2
′‑
岩藻糖基乳糖。作为化学合成法的有效替代途径,可根据糖基供体与受体的构型筛选合适的酶类,可以减少化学法中存在的严谨的设计保护基团及立体异构性等要求。然而,供体核糖苷价格昂贵,酶催化活性低,每批次合成量仅为毫克级,无法实现规模化和工业化生产的迫切需要。近年来,利用系统生物学、代谢工程和途径工程等技术手段构建微生物基因工程菌生产2
′‑
岩藻糖基乳糖的研究持续受到关注。微生物发酵具有条件温和、成本低、环境友好等特点,已成为当今研究热点。随着代谢工程和合成生物学的发展,多种微生物合成途径中酶的克隆表达变得越来越广泛。目前研究较多的是以大肠杆菌escherichia coli作为底盘细胞,其具有代谢产出鸟嘌呤5'-二磷酸-β-l-岩藻糖(5'-diphospho-β-lfucose,gdp-l-fucose)的2条完整通路(从头合成途径和补救途径),通过构建代谢合成途径中的关键酶基因,以重组质粒方式进行过量表达,表达外源α-1,2-岩藻糖基转移酶,发酵生产2'-fl。
4.融合蛋白标签是指在蛋白质的n端或c端融合一段蛋白序列,其目的在于增强重组蛋白质的可溶性表达,以提高重组蛋白在大肠杆菌中的表达量。研究表明某些高度可溶的蛋白质,如谷胱甘肽s-转移酶(gst)、麦芽糖结合蛋白(mbp)、硫氧还蛋白a(trxa)、转录终止抗终止因子(nusa)、蛋白二硫键折叠异构酶(dsba)等,在与其它易形成包涵体的蛋白质融合后会促进融合蛋白质的可溶性表达。此外,近年来发现的泛素相关小修饰蛋白(sumo)融合标签也被证明具有促进蛋白正确折叠的作用,可以调节融合蛋白与外源蛋白之间的作用,从而提高外源蛋白的溶解性。融合蛋白标签提供了一种外源蛋白在大肠杆菌中可溶性表达的有效策略,但由于外源蛋白在大肠杆菌中不表达或表达量很低的因素很多,例如翻
译过程中因不正确折叠而形成无活性的包涵体,或是形成了非正确配对的二硫键造成蛋白质的不稳定表达,不同蛋白标签促进外源蛋白在大肠杆菌中表达的效果不同。
5.利用微生物代谢途径合成2
′‑
岩藻糖基乳糖的研究集中于合成途径的构建、代谢竞争途径的基因敲除、辅因子的强化等方面,而关于α-1,2-岩藻糖基转移酶的高效表达方面鲜有报道。在2'-fl合成途径中,α-1,2-岩藻糖基转移酶催化供体gdp-l-fuc转移至底物乳糖的半乳糖基上合成2
′‑
岩藻糖基乳糖,其稳定性和催化活性是高效合成2
′‑
岩藻糖基乳糖的关键限速步骤。现有技术受限于gdp-l-岩藻糖的胞内合成路径产量过低,导致岩藻糖基化人乳寡糖的产量过低,达不到工业化生产的需求。
技术实现要素:
6.本发明要解决的技术问题是提供一种生产2
′‑
岩藻糖基乳糖的大肠杆菌工程菌株,对2
’‑
岩藻糖基乳糖从头合成途径关键酶进行不同表达水平的调控,以提高途径效率,提高2
’‑
岩藻糖基乳糖生产水平。
7.本发明提供了一种生产2
’‑
岩藻糖基乳糖的重组菌株,以大肠杆菌为宿主,进行了如下至少一种改进:
8.(1)过表达甘露糖-1-磷酸鸟嘌呤基转移酶manc,磷酸甘露糖变位酶manb,gdp-甘露糖-4,6-脱水酶gmd,gdp-岩藻糖合成酶wcag,dna结合转录激活因子rcsa和rcsb,带有n端融合蛋白标签2
’‑
岩藻糖基乳糖合成酶futc,β-半乳糖苷透性酶lacy,糖外排转运蛋白seta,鸟苷激酶gsk和nadp(+)-依赖性葡萄糖-6-磷酸脱氢酶zwf;
9.(2)敲除gdp-甘露糖甘露糖水解酶nudd,β-半乳糖苷酶lacz,gdp-甘露糖水解酶nudk,十一磷酸葡萄糖-1-磷酸转移酶wcaj,l-岩藻糖异构酶fuci,l-岩藻糖激酶fuck,hslvu蛋白酶的atpase成分clpy,hslvu蛋白酶的肽酶成分clpq,lon蛋白酶lon,l-鼠李糖异构酶rhaa,l-阿拉伯糖异构酶araa。
10.在一种实施方式中,所述过表达是将基因在质粒上多拷贝表达。
11.在一种实施方式中,所述宿主可以是大肠杆菌bl21 star(de3)、大肠杆菌k12 mg1655或大肠杆菌jm109;
12.在一种实施方式中,所述宿主为大肠杆菌bl21 star(de3)。
13.在一种实施方式中,所述质粒是prsf-duet-1、pet-duet-1或pcdf-duet-1。
14.在一种实施方式中,所述基因工程菌利用prsf-duet-1质粒表达基因manc、manb、gmd和wcag。
15.在一种实施方式中,所述基因工程菌利用pet-duet-1质粒表达基因rcsa、rcsb和futc。
16.在一种实施方式中,所述dna结合转录激活因子rcsa和rcsb的n端还融合硫氧还蛋白a(trxa)。
17.在一种实施方式中,所述2
’‑
岩藻糖基乳糖合成酶futc的n端融合的蛋白标签为类泛素蛋白修饰分子sumo;所述类泛素蛋白修饰分子sumo的编码序列如seq id no.10所示。
18.在一种实施方式中,所述基因工程菌利用pcdf-duet-1质粒表达基因lacy、seta、gsk和zwf。
19.在一种实施方式中,甘露糖-1-磷酸鸟嘌呤基转移酶manc和磷酸甘露糖变位酶
manb的编码基因簇的核苷酸序列如seq id no.1所示;所述gdp-甘露糖-4,6-脱水酶gmd和gdp-岩藻糖合成酶wcag的编码基因簇的核苷酸序列如seq id no.2所示;所述dna结合转录激活因子rcsa和rcsb的编码基因的核苷酸序列如seq id no.3和seq id no.4所示;所述2
’‑
岩藻糖基乳糖合成酶futc的编码基因的核苷酸序列如seq id no.5所示;所述β-半乳糖苷透性酶lacy的编码基因的核苷酸序列如seq id no.6所示;所述糖外排转运蛋白seta的编码基因的核苷酸序列如seq id no.7所示;所述鸟苷激酶gsk的编码基因的核苷酸序列如seq id no.8所示;所述nadp(+)-依赖性葡萄糖-6-磷酸脱氢酶zwf的编码基因的核苷酸序列如seq id no.9所示。
20.本发明还提供了一种提高大肠杆菌2'-岩藻糖基乳糖产量的方法,所述方法是利用多拷贝质粒过表达甘露糖-1-磷酸鸟嘌呤基转移酶manc,磷酸甘露糖变位酶manb,gdp-甘露糖-4,6-脱水酶gmd,gdp-岩藻糖合成酶wcag,dna结合转录激活因子rcsa和rcsb,带有n端融合蛋白标签2
’‑
岩藻糖基乳糖合成酶futc,β-半乳糖苷透性酶lacy,糖外排转运蛋白seta,鸟苷激酶gsk和nadp(+)-依赖性葡萄糖-6-磷酸脱氢酶zwf;并利用ptargetf质粒敲除gdp-甘露糖甘露糖水解酶nudd,gdp-甘露糖水解酶nudk,β-半乳糖苷酶lacz,十一磷酸葡萄糖-1-磷酸转移酶wcaj,l-岩藻糖异构酶fuci,l-岩藻糖激酶fuck,hslvu蛋白酶的atpase成分clpy,hslvu蛋白酶的肽酶成分clpq,lon蛋白酶lon,l-鼠李糖异构酶rhaa,l-阿拉伯糖异构酶araa。
21.本发明还提供了一种生产2'-岩藻糖基乳糖的方法,所述方法为,以甘油为碳源,以乳糖为底物,利用所述基因工程菌发酵生产2'-岩藻糖基乳糖。
22.在一种实施方法中,所述发酵以10g/l乳糖为底物。
23.在一种实施方法中,所述发酵是接种所述基因工程菌的种子液进行发酵;所述种子液的制备方法为:将所述基因工程菌接种于lb液体培养基,37℃,200rpm,摇瓶培养12h,得到种子液。
24.在一种实施方法中,将种子液以1%的接种量接入50ml发酵培养基,37℃,200rpm,摇瓶培养至od
600
为0.8。
25.在一种实施方法中,所述发酵采用iptg诱导,诱导终浓度为0.1mm,于25℃,200rpm诱导培养96h。
26.在一种实施方式中,所述发酵是将所述基因工程菌接种于发酵培养基中,培养至od
600
为40~50,加入终浓度为5g/l乳糖和0.1mm的iptg。
27.在一种实施方式中,待初始碳源消耗完后,流加10g/l甘油,待初始乳糖消耗完后,流加乳糖使其浓度维持在3~10g/l。
28.在一种实施方式中,3-l发酵罐发酵条件为,培养温度为25~37℃,搅拌转速300~750r/min,通气量0.8~1.2vvm,ph 6.5~7.0,发酵时间为48~96h。
29.在一种实施方式中,所述发酵培养基含有:13.5g/l kh2po4,1.4g/l mgso4·
7h2o,4.0g/l(nh4)2hpo4,1.7g/l c6h8o7·
h2o,5g/l安琪酵母粉,2.5g/l猪骨蛋白胨,8g/l甘油,微量元素溶液10ml;所述微量元素溶液组成为:以5mol/l的hcl为母液,2.0g/l cacl2,0.1g/l(nh4)6mo7o
24
,2.25g/l znso4·
7h2o,0.5g/l mnso4·
4h2o,10.0g/l feso4·
7h2o,3.0g/l cuso4·
5h2o,0.23g/l na2b4o7·
10h2o,0.18g/l cocl2·
6h2o。
30.在一种实施方式中,所述发酵是将构建的工程菌接种至含有相应抗生素的lb培养
基中,37℃,200rpm/min培养12h,转入发酵培养基中,于37℃、300~750rpm转速培养至甘油耗尽,加入终浓度为0.1mm的iptg和乳糖5g/l,并采用匀速流加模式添加补料液,甘油补料速度为4.5~11.0g/l/h,乳糖补料速度为1.5~3.0g/l/h,并降低温度至25℃进入发酵,以后每隔12h补加终浓度20mm海藻糖一次,共补加4次;整个发酵过程采用50%氨水调控ph为6.5-7.0。
31.本发明还提供了上述基因工程菌在生产2'-岩藻糖基乳糖及含有2'-岩藻糖基乳糖的产品中的应用。
32.有益效果:本发明通过2
’‑
岩藻糖基乳糖合成酶futc的外源表达,组合调控甘露糖-1-磷酸鸟嘌呤基转移酶manc,磷酸甘露糖变位酶manb,gdp-甘露糖-4,6-脱水酶gmd,gdp-岩藻糖合成酶wcag,β-半乳糖苷透性酶lacy,dna结合转录激活因子rcsa和rcsb,糖外排转运蛋白seta,鸟苷激酶gsk和nadp(+)-依赖性葡萄糖-6-磷酸脱氢酶zwf获得的表达并敲除大肠杆菌宿主2'-岩藻糖基乳糖合成途径中的gdp-甘露糖甘露糖水解酶nudd,gdp-甘露糖水解酶nudk,β-半乳糖苷酶lacz,十一磷酸葡萄糖-1-磷酸转移酶wcaj,l-岩藻糖异构酶fuci,l-岩藻糖激酶fuck,hslvu蛋白酶的atpase成分clpy,hslvu蛋白酶的肽酶成分clpq,lon蛋白酶lon,l-鼠李糖异构酶rhaa,l-阿拉伯糖异构酶araa,以及利用质粒拷贝数微调转录水平,从而达到提高2'-岩藻糖基乳糖产量的目的。采用本发明的代谢工程菌进行3-l罐的岩藻糖基化寡糖的发酵生产验证,结果显示,以甘油为底物时,2'-岩藻糖基乳糖(2'-fl)的生产产量可达57.7g/l。
附图说明
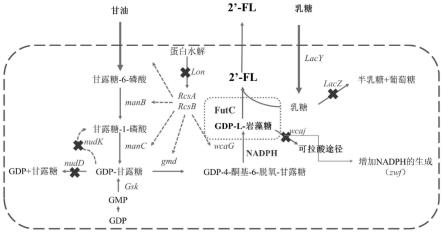
33.图1:2
’‑
岩藻糖基乳糖生产的从头合成途径;其中,manb,磷酸甘露糖变位酶;manc,甘露糖-1-磷酸鸟嘌呤基转移酶;gmd,gdp-甘露糖-4,6-脱水酶;wcag,gdp-岩藻糖合成酶;futc,2
’‑
岩藻糖基乳糖合成酶;seta,糖外排转运蛋白;lacz,β-半乳糖苷酶;lacy,β-半乳糖苷透性酶;rcsa和rcsb,dna结合转录激活因子;zwf,鸟苷激酶gsk和nadp(+)-依赖性葡萄糖-6-磷酸脱氢酶。
34.图2:重组质粒prsf-duet-1-cbgw的示意图。
35.图3:重组质粒pet-duet-1-rcsab-futc的示意图。
36.图4:重组质粒pcdf-duet-1-lsgz的示意图。
37.图5:3-l发酵罐产2
’‑
岩藻糖基乳糖液相检测示意图。
38.图6:3-l发酵罐产2
’‑
岩藻糖基乳糖的发酵曲线。
具体实施方式
39.以下结合实例与附图对本发明的具体实施作进一步的说明,以下实例中所使用的质粒、pcr试剂、限制性内切酶、质粒抽提试剂盒、dna胶回收试剂盒等采用商业产品,具体操作按照试剂盒说明书进行。
40.本发明的实施方式不限于此,其他未注明的实验操作和工艺参数按照常规技术进行。对于本领域技术人员而言,在不背离本发明实质和范围的前提下,对这些实施方案中的物料成分和用量进行的各种改变或改动也属于本发明的保护范围。
[0041]2’‑
岩藻糖基乳糖采用hplc进行检测,具体为:
[0042]
色谱柱:aminex hpx-87h;检测器:示差检测器;流动相:5mm硫酸;流速:0.6ml/min;柱温:35℃;进样量:10μl。
[0043]
本发明实施例采用的主要培养基如下:
[0044]
lb培养基:10g/l胰蛋白胨,5g/l酵母浸提物,5g/l nacl。
[0045]
发酵培养基:13.5g/l kh2po4,1.4g/l mgso4·
7h2o,4.0g/l(nh4)2hpo4,1.7g/l c6h8o7·
h2o,5g/l安琪酵母粉,2.5g/l猪骨蛋白胨,8g/l甘油,微量元素溶液10ml,其余为水。调节ph至7.0左右。
[0046]
微量元素溶液组成为:以5mol/l的hcl为母液,2.0g/l cacl2,0.1g/l(nh4)6mo7o
24
,2.25g/l znso4·
7h2o,0.5g/l mnso4·
4h2o,10.0g/l feso4·
7h2o,3.0g/l cuso4·
5h2o,0.23g/l na2b4o7·
10h2o,0.18g/l cocl2·
6h2o。
[0047]
补料碳源:甘油500g/l;补料底物:乳糖200g/l。
[0048]
ph调控:50%氨水(v/v)。
[0049]
抗生素浓度:氨苄青霉素100mg/l,卡那霉素30mg/l,壮观霉素50mg/l。
[0050]
诱导剂浓度:异丙基-β-d-硫代半乳糖吡喃糖苷(iptg),添加浓度为0.1mm。
[0051]
表1敲除基因引物序列
[0052]
[0053]
[0054][0055]
表2过表达载体引物序列
[0056]
[0057][0058]
实施例1:大肠杆菌bl21star(de3)染色体组基因nudd、lacz、nudk、wcaj、fucik、clpyq、lon、rhaa、araa的敲除
[0059]
利用crispr-cas9基因敲除系统敲除大肠杆菌bl21 star(de3)基因组中nudd、lacz、nudk、wcaj、fucik、clpyq、lon、rhaa和araa基因,具体步骤如下(所涉及到的引物序列见表1):
[0060]
(1)以大肠杆菌bl21 star(de3)基因组为模板,使用引物对nudd-us-f/r和nudd-ds-f/r,lacz-us-f/r和lacz-ds-f/r,nudk-us-f/r和nudk-ds-f/r,wcaj-us-f/r和wcaj-ds-f/r,fucik-us-f/r和fucik-ds-f/r,clpyq-us-f/r和clpyq-ds-f/r,lon-us-f/r和lon-ds-f/r,rhaa-us-f/r和rhaa-ds-f/r,araa-us-f/r和araa-ds-f/r通过pcr分别扩增出nudd、lacz、nudk、wcaj、fucik、clpyq、lon、rhaa和araa的上下游片段,胶回收。再分别以nudd、lacz、nudk、wcaj、fucik、clpyq、lon、rhaa和araa上下游片段为模板,采用nudd-us-f/nudd-ds-r,lacz-us-f/lacz-ds-/r,nudk-us-f/nudk-ds-r,wcaj-us-f/wcaj-ds-r,fucik-us-f/fucik-ds-r,clpyq-us-f/clpyq-ds-r,lon-us-f/lon-ds-r,rhaa-us-f/rhaa-ds-r,araa-us-f/araa-ds-r引物通过重叠pcr得到完整的nudd、lacz、nudk、wcaj、fucik、clpyq、lon、rhaa和araa模板,胶回收dna片段。
[0061]
(2)以原始ptargetf质粒(addgene:#62226)为模板,δnudd-sg-f/r,δlacz-sg-f/r,δnudk-sg-f/r,δwcaj-sg-f/r,δfucik-sg-f/r,δclpyq-sg-f/r,δlon-sg-f/r,δrhaa-sg-f/r和δaraa-sg-f/r为引物,采用pcr扩增将原始质粒上的n20序列分别替换为与nudd、lacz、nudk、wcaj、fucik、clpyq、lon、rhaa和araa序列互补的n20序列,分别得到带有靶向nudd、lacz、nudk、wcaj、fucik、clpyq、lon、rhaa和araa的各种ptargetf质粒(即带有nudd、lacz、nudk、wcaj、fucik、clpyq、lon、rhaa和araa特异性n20序列的靶向质粒ptargetf)。转化大肠杆菌jm109感受态,涂布lb平板(含壮观霉素),37℃扩大培养提取质粒并测序。
[0062]
(3)取pcas质粒(addgene:#60847)及大肠杆菌bl21 star(de3)感受态,冰上放置5min至感受态融化,将感受态细胞转移到预冷的电极杯中,轻轻敲击使其无气泡,在冰水中冷却5-10min;将电极杯放入电转仪上,调节电击参数为200ω,25μf,2.5kv,电击后听到蜂鸣声,查看时间在3ms-5ms间,取出电极杯,立即在无菌操作台中加入900μl lb液体培养基,快速轻柔的重悬菌体细胞,然后转移到灭菌的离心管中;将离心管放置于30℃摇床中轻摇60min进行复苏,然后低速离心1min,弃掉上清培养基,留150μl左右的培养基将菌体悬浮混匀,涂布于含相应抗性的lb固体培养基中;30℃恒温培养箱倒置过夜培养,挑取单克隆菌落进行菌落pcr验证,验证正确后加入培养基培养,得到大肠杆菌bl21 star(de3)/pcas感受
态。
[0063]
(4)将200ng步骤(2)构建的带有nudd特异性n20序列的靶向质粒ptargetf和1000ng的供体dna片段(即步骤(1)得到的完整的nudd模板),电转至步骤(3)制备的大肠杆菌bl21 star(de3)/pcas感受态,涂布于lb平板(卡那霉素和壮观霉素),30℃培养24h,挑取平板上的阳性菌落于lb中培养10h,送苏州金唯智生物科技有限公司测序验证。
[0064]
(5)将步骤(4)测序验证敲除成功的阳性克隆菌落挑至4ml lb液体试管,加入终浓度为1mm的iptg和30mg/l卡那霉素,30℃培养8-16h,以去除ptargetf质粒,再在42℃培养12h,去除pcas质粒,得到基因组敲除nudd基因的大肠杆菌bl21 star(de3)δnudd,以大肠杆菌bl21 star(de3)δnudd为宿主菌。
[0065]
(6)利用上述相同策略,结合步骤(2)中获得的带有lacz特异性n20序列的靶向质粒ptargetf和1000ng的供体dna片段(即步骤(1)得到的完整的lacz模板),敲除大肠杆菌bl21 star(de3)δnudd基因组的wcaj基因,得到相应的大肠杆菌bl21 star(de3)的δnudd基因和lacz基因敲除菌株bl21 star(de3)δnuddδlacz。
[0066]
(7)以步骤(6)构建的大肠杆菌工程菌bl21 star(de3)δnuddδnudk为出发菌株,通过参照步骤(2)~(5)操作,最终构建获得工程化大肠杆菌bl21 star(de3)δnuddδlaczδnudkδwcajδfucikδclpyqδlonδrhaaδaraa。
[0067]
实施例2:2
’‑
岩藻糖基乳糖从头合成路径的重组菌过表达基因的构建
[0068]
重组菌过表达基因的构建具体步骤如下:
[0069]
(1)manb、manc、gmd、wcag、rcsa、rcsb、lacy、seta、gsk、zwf基因片段的获得:以rcsa-f/rcsa-r、rcsb-f/rcsb-r、lacy-f/lacy-r、seta-f/seta-r、gsk-f/gsk-r、zwf-f/zwf-r分别扩增出rcsa、rcsb、lacy、seta、gsk和zwf基因片段,由于manb-manc和gmd-wcag在大肠杆菌基因组上是连续的基因片段,因此以大肠杆菌k-12的基因组为模板,以bc-f/bc-r和gw-f/gw-r分别扩增出manb-manc(seq id no.1所示)和gmd-wcag(seq id no.2)的基因片段,胶回收dna片段,将回收的gmd-wcag和manb-manc的基因片段通过无缝克隆试剂盒(南京诺唯赞生命科技有限公司)连接到载体prsf-duet-1上,获得质粒prsf-duet-1-cbgw。用同样的连接方法,将回收的rcsa和rcsb的基因片段(核苷酸序列分别如seq id no.3、seq id no.4所示)连接到质粒的pet-duet-1上,获得的质粒为pet-duet-1-rcsab。用同样的连接方法,将回收的lacy(seq id no.6所示)、seta(seq id no.7所示)、gsk(seq id no.8所示)和zwf的基因片段(seq id no.9所示)连接到质粒的pcdf-duet-1上,获得的质粒为pcdf-duet-1-lsgz。
[0070]
(2)futc基因片段的获得:委托苏州金唯智生物科技有限公司合成来源于幽门螺杆菌的2
’‑
岩藻糖基乳糖合成酶futc基因序列(seq id no.5所示),将合成后的futc基因片段通过无缝克隆试剂盒(南京诺唯赞生命科技有限公司)连接到载体pet-duet-1-rcsab上,获得质粒pet-duet-1-rcsab-futc。
[0071]
(3)构建融合蛋白质粒pet-duet-1-rcsab-sumo-futc
[0072]
全基因合成获得类泛素蛋白修饰分子sumo的基因片段sumo(seq id no.10所示);以步骤(2)中测序正确的重组质粒pet-duet-1-rcsab-futc为模板,通过反向pcr线性化扩增表达质粒pet-duet-1-rcsab-futc,随后使用dpni酶消化模板质粒,纯化回收pet-duet-1-rcsab-futc线性化载体片段。然后使用无缝克隆试剂盒将sumo基因片段和线性化载体
pet-duet-1-rcsab-futc进行重组连接。重组反应体系在37℃反应30min,再将其化转到大肠杆菌jm109感受态细胞,42℃热激90s,冰浴2min,37℃复苏1h涂布终浓度为0.1mm的氨苄霉素抗性lb平板,37℃培养10-12h。最后挑选氨苄霉素抗性平板上的单菌落进行菌落pcr验证,并通过测序确认融合蛋白sumo-futc是否构建成功。最终获得融合蛋白质粒pet-duet-1-rcsab-sumo-futc。
[0073]
(4)构建融合蛋白质粒pet-duet-1-trxa-rcsab-sumo-futc
[0074]
全基因合成获得硫氧还蛋白a(trxa)的基因片段trxa(seq id no.11所示);根据步骤(3)的方法将trxa构建在步骤(3)构建的pet-duet-1-rcsab-sumo-futc载体上,最终获得融合蛋白质粒pet-duet-1-trxa-rcsab-sumo-futc。
[0075]
(5)根据2
’‑
岩藻糖基乳糖合成通路中的关键基因将步骤(1)和(2)获得的质粒prsf-duet-1-cbgw、pcdf-duet-1-lsgz和pet-duet-1-rcsab-sumo-futc转入实施例1获得大肠杆菌bl21 star(de3)δnuddδlaczδnudkδwcajδfucikδclpyqδlonδrhaaδaraa,得到工程菌f1,该工程菌株发酵培养后经hplc鉴定确认产物为2
’‑
岩藻糖基乳糖。
[0076]
实施例3采用大肠杆菌在摇瓶发酵合成2
’‑
岩藻糖乳糖
[0077]
(1)将实施例2构建的工程化大肠杆菌f1接种至含有相应抗生素的lb培养基中,37℃,200rpm,摇瓶培养12h,得到种子液;再将种子液以1%的接种量接入50ml摇瓶m9培养基,37℃,200rpm,摇瓶培养至od600为0 8;加入终浓度为0.1mm的iptg,同时加入乳糖至乳糖浓度为10g/l,25℃,200rpm的条件下诱导培养96h。
[0078]
(2)诱导发酵后,固定时间取样,利用hplc仪检测本发明的工程化大肠杆菌发酵生成2
’‑
岩藻糖基乳糖的量。结果显示76h发酵后,50ml摇瓶中2
’‑
fl产量达到4.8g/l。
[0079]
实施例4采用大肠杆菌在3l罐发酵合成2
’‑
岩藻糖乳糖
[0080]
(1)将实施例2构建的菌株f1接种至含有相应抗生素的lb培养基中,37℃,200rpm/min培养12h,转入发酵培养基中,37℃,300~750rpm转速培养至甘油耗尽,加入终浓度为0.1mm的iptg和底物乳糖5g/l,同时采用匀速流加模式添加补料液,甘油补料速度为4.5~11.0g/l/h,乳糖补料速度为1.5~3.0g/l/h,并降低温度至25℃进入发酵,继续发酵,以后每隔12h补加终浓度20mm海藻糖一次,共补加4次。整个发酵过程中采用50%氨水调控ph维持在6.5-7.0。
[0081]
(2)诱导发酵后,固定时间取样,利用hplc仪检测本发明的工程化大肠杆菌发酵生成2
’‑
岩藻糖基乳糖的量,检测结果如图5所示。在95h发酵后,3-l发酵罐2
′‑
fl的产量达到了57.7g/l。最终产量及各组分检测结果如图6所示。
[0082]
对比例1:
[0083]
按照实施例1~2相同的策略,区别在于,未敲除clpyq基因,未过表达zwf和gsk基因,最终得到菌株f2(即菌种中敲除nudd、lacz、nudk、wcaj、fucik、lon、rhaa和araa基因,过表达manb、manc、gmd、wcag、rcsa、rcsb、lacy、seta基因)。并将构建获得的菌株f2按照实施例4的方法应用于2
’‑
fl的发酵过程。结果显示,未敲除clpyq基因、未过表达zwf和gsk基因的菌株发酵相同时间的2
’‑
fl产量仅9.92g/l。
[0084]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1