用于检测水稻细菌性谷枯病菌的组合产品及试剂盒
1.本发明涉及分子生物学技术领域,具体而言,涉及一种用于检测水稻细菌性谷枯病菌的组合产品及试剂盒。
背景技术:
2.水稻细菌性谷枯病菌是黄单胞属的革兰氏阴性细菌,是引起水稻细菌性谷枯病(bacterial panicle blight ofrice,bpbr)的病原菌,该病害最早在日本发现,目前蔓延至东南亚,美洲,非洲部分地区,(cabi)。国内2007年首次在无症状谷粒中检出水稻细菌性谷枯病菌(j.luo et.al.,2007),2020年首次在南方稻田有症状病叶中检出水稻细菌性谷枯病菌(y.hou et.al.,2020),目前该病害在国内呈零星分布。在田间接种试验中细菌性谷枯病可导致高达75%产量损失;一项美国的研究中证明,随着全球变暖,细菌性谷枯病侵染面积将增大,导致减产增多,在3℃升温下,水稻细菌性谷枯病预计额外造成每年2.04亿美元损失(shew am et.al.,2019)。水稻细菌性谷枯病菌严重威胁到粮食安全,因此将其列入我国的进境植物检疫性有害生物,快速准确的检疫检测技术能有效阻止其传播,保证稻谷安全生产。
3.目前对于水稻细菌性谷枯病菌的检测主要是传统的生物测定,直接分离以及分子检测的多聚酶链式反应(pcr)方法实时荧光pcr(qrt-pcr)方法和血清学方法,但pcr和elisa方法灵敏度有限,且耗时较长,qrt-pcr依赖昂贵的检测仪器并对环境中的抑制因素和污染较为敏感,容易有假阳性或假阴性。
4.重组酶聚合酶扩增技术(rpa)技术是2006年提出的一种新型多酶恒温核酸扩增技术,可以快速且便捷地进行核酸检测分析(piepenburg et al.,2006)。在25-43℃的恒温条件下,rpa技术能在5-20min内实现特定核酸序列的扩增并观察到结果。本实验采用的是改进的rpa技术称为多酶恒温核酸快速扩增技术(mira),具有更好的稳定性和相同时间更高的荧光值(hui chenet al.,2021)。
技术实现要素:
5.本发明的第一目的在于提供一种组合产品,包含:
6.上游引物:tcgctctcccgagggagatgacagccgctaca;
7.下游引物:acacggaacacctgggtagtctctgtagggaag;以及
8.探针:ccatctcaaataagcgcttccgctatccactxtactacttct tccagat;
9.其中所述探针为基于重组酶聚合酶扩增技术的探针,第31位碱基t标记发光基团,第32位x为脱碱基核苷酸类似物,第33位碱基t标记淬灭基团,3’端进行阻断剂修饰;所述阻断剂用于阻断探针的聚合酶延伸。
10.本发明的第二目的在于提供试剂盒,其包含如上所述的组合产品。
11.本发明的第三目的在于提供如上所述的组合产品,或如上所述的试剂盒在检测水稻细菌性谷枯病菌中的应用。
12.本发明所提供的组合产品及试剂盒用于检测水稻细菌性谷枯病菌,检测灵敏度和特异性均较高,且检测方便,耗时较短。
附图说明
13.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
14.图1~图6为本发明一个实施例对伯克氏菌属的不同植物病原菌检测的结果;
15.图1:a:菌株2;b:菌株5;c:菌株8;d:菌株7;e:菌株6;f:菌株1;g:菌株3;h:菌株4;
16.图2:a:菌株9;b:菌株10;c:无菌水对照;
17.图3:a:菌株2;b-g:菌株11-16;h:无菌水对照;
18.图4:a:菌株2;b-g:菌株17-22;h:无菌水对照;
19.图5:a:菌株2;b:菌株23;c-g:菌株24-28;h:无菌水对照;
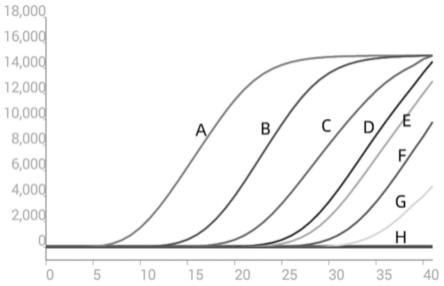
20.图6:a:菌株2;b-g:菌株29-343;h:无菌水对照;
21.图7为本发明一个实施例对不同浓度的水稻细菌性谷枯病菌的菌液的检测结果;
22.a:浓度为2.28
×
108cfu/ml细菌性谷枯病菌菌株2;b:浓度为2.28
×
107cfu/ml细菌性谷枯病菌菌株2;c:浓度为2.28
×
106cfu/ml细菌性谷枯病菌菌株2;d:浓度为2.28
×
105cfu/ml细菌性谷枯病菌菌株2;e:浓度为2.28
×
104cfu/ml细菌性谷枯病菌菌株2;f:浓度为2.28
×
103cfu/ml细菌性谷枯病菌菌株2;g:浓度为2.28
×
102cfu/ml细菌性谷枯病菌菌株2;h:无菌水对照;
23.图8为本发明一个实施例对不同浓度的水稻细菌性谷枯病菌dna的检测结果;
24.a:浓度为9.66ng/μl细菌性谷枯病菌菌株2;b:浓度为9.66
×
10-1
ng/μl细菌性谷枯病菌菌株2;c:浓度为2.28
×
10-2
ng/μl细菌性谷枯病菌菌株2;d:浓度为2.28
×
10-3
ng/μl细菌性谷枯病菌菌株2;e:浓度为2.28
×
10-4
ng/μl细菌性谷枯病菌菌株2;f:浓度为2.28
×
10-5
ng/μl细菌性谷枯病菌菌株2;g:浓度为2.28
×
10-6
ng/μl细菌性谷枯病菌菌株2;h:无菌水对照。
具体实施方式
25.现将详细地提供本发明实施方式的参考,其一个或多个实例描述于下文。提供每一实例作为解释而非限制本发明。实际上,对本领域技术人员而言,显而易见的是,可以对本发明进行多种修改和变化而不背离本发明的范围或精神。例如,作为一个实施方式的部分而说明或描述的特征可以用于另一实施方式中,来产生更进一步的实施方式。
26.除非另有说明,用于披露本发明的所有术语(包括技术和科学术语)的意义与本发明所属领域普通技术人员所通常理解的相同。通过进一步的指导,随后的定义用于更好地理解本发明的教导。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。
27.本文所使用的术语“和/或”、“或/和”、“及/或”的选择范围包括两个或两个以上相关所列项目中任一个项目,也包括相关所列项目的任意的和所有的组合,所述任意的和所
有的组合包括任意的两个相关所列项目、任意的更多个相关所列项目、或者全部相关所列项目的组合。需要说明的是,当用至少两个选自“和/或”、“或/和”、“及/或”的连词组合连接至少三个项目时,应当理解,在本技术中,该技术方案毫无疑问地包括均用“逻辑与”连接的技术方案,还毫无疑问地包括均用“逻辑或”连接的技术方案。比如,“a及/或b”包括a、b和a+b三种并列方案。又比如,“a,及/或,b,及/或,c,及/或,d”的技术方案,包括a、b、c、d中任一项(也即均用“逻辑或”连接的技术方案),也包括a、b、c、d的任意的和所有的组合,也即包括a、b、c、d中任两项或任三项的组合,还包括a、b、c、d的四项组合(也即均用“逻辑与”连接的技术方案)。
28.本发明中所使用的术语“含有”、“包含”和“包括”是同义词,其是包容性或开放式的,不排除额外的、未被引述的成员、元素或方法步骤。
29.本发明中用端点表示的数值范围包括该范围内所包含的所有数值及分数,以及所引述的端点。
30.本发明中涉及浓度数值,其含义包括在一定范围内的波动。比如,可以在相应的精度范围内波动。比如2%,可以允许
±
0.1%范围内波动。对于数值较大或无需过于精细控制的数值,还允许其含义包括更大波动。比如100mm,可以允许
±
1%、
±
2%、
±
5%等范围内的波动。
31.本发明中,涉及“多个”、“多种”等描述,如无特别限定,指在数量上指大于等于2。
32.本发明中,以开放式描述的技术特征中,包括所列举特征组成的封闭式技术方案,也包括包含所列举特征的开放式技术方案。
33.本发明中,“优选”、“更好”、“更佳”、“为宜”仅为描述效果更好的实施方式或实施例,应当理解,并不构成对本发明保护范围的限制。本发明中,“可选地”、“可选的”、“可选”,指可有可无,也即指选自“有”或“无”两种并列方案中的任一种。如果一个技术方案中出现多处“可选”,如无特别说明,且无矛盾之处或相互制约关系,则每项“可选”各自独立。
34.本发明涉及组合产品,包含:
35.上游引物:tcgctctcccgagggagatgacagccgctaca;
36.下游引物:acacggaacacctgggtagtctctgtagggaag;以及
37.探针:ccatctcaaataagcgcttccgctatccactxtactacttcttccagat;
38.其中所述探针为基于重组酶聚合酶扩增技术的探针,第31位碱基t标记发光基团,第32位x为脱碱基核苷酸类似物,第33位碱基t标记淬灭基团,3’端进行阻断剂修饰;所述阻断剂用于阻断探针的聚合酶延伸。
39.在一些实施方式中,所述脱碱基核苷酸类似物为四氢呋喃。
40.在一些实施方式中,所述阻断饰选自间臂、磷酸基团、生物素-teg或胺(例如c6胺)。
41.在一些实施方式中,所述间臂选自乙二醇、c9间臂(spacer 9)、c18间臂(spacer 18)、双脱氧间臂[1’,2
’‑
dideoxyribose(dspacer)]、c3间臂(c3 spacer)中的任一种。
[0042]
在一些实施方式中,所述间臂修饰选自c3间臂。
[0043]
间臂(spacer)可为寡核苷酸标记提供必要的间隔以减少标记基团与寡核苷酸间的相互作用,主要应用于dna发夹结构和双链结构研究。c3spacer主要用于模仿核糖的3'和5'羟基间的三碳间隔,或“替代”一个序列中未知的碱基。3'-spacer c3用于引进一个3'间
臂从而阻止3'端外切酶和3'端聚合酶发挥作用。
[0044]
在一些实施方式中,所述发光基团选amca、pacific blue、atto 425、bodipy fl、fam、alexa fluor 488、tet、joe、yakima yellow、vic、hex、quasar 570、cy3、ned、tamra、rox、aqua phluor593、texas red、atto 590、cy5、quasar 670、cy5.5以及cy5.5中的任一种。
[0045]
在一些实施方式中,所述淬灭基团选自bhq1、bhq2、bhq3、dabcyl、eclipse以及mgb中的任一种。
[0046]
在一些具体的实施方式中,所述发光基团为fam,所述淬灭基团是bhq。
[0047]
需要说明的是,在一个方面,有用的引物和探针包括与上述所提供的特定序列的上游引物、下游引物或探针具有大于60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的核苷酸序列。还考虑了这样的引物和探针修饰并且可根据标准技术制备。
[0048]
术语“%同一性”在两个或更多个核苷酸序列或氨基酸序列的上下文中,指的是相同或具有特定百分比的相同氨基酸残基或核苷酸的两个或多个序列或子序列,当比较和比对以用于最大对应时,如使用以下序列比较算法之一或通过目视检查来测量的。例如,%同一性是相对于要比较的序列的编码区域的整个长度。
[0049]
对于序列比较,通常一个序列用作参考序列,测试序列与该序列进行比较。当使用序列比较算法时,测试序列和参考序列被输入到计算机中,如果需要,指定子序列坐标,并且指定序列算法程序参数。然后,序列比较算法根据指定的程序参数计算测试序列相对于参考序列的百分比序列同一性。可使用搜索算法例如blast和psi-blast(altschul etal.,1990、j mol biol 215:3,403-410;altschul et al.,1997,nucleic acids res25:17,3389-402)确定百分比同一性。
[0050]
引物和探针修饰可以采用公知的方法。这些引物和/或探针序列的修饰版本可包括,通过非限制性例子,将一个或多个核苷酸添加到5’端,将一个或多个核苷酸添加到3’端,将一个或多个核苷酸添加到5’端和3’端,添加尾部,缩短序列,延长序列,将序列上下游移动几个碱基,或其任何组合。除了上述已经提到的修饰方式,还可以在不显著负面影响引物/探针功能的前提下所施加的其他修饰,如3'p、5'p、5-硝基吲哚、2-氨基嘌呤、8-氨基-2'-脱氧腺苷、c-5丙炔基-脱氧胞苷、c-5丙炔基-脱氧尿苷、2-氨基-2'-脱氧腺苷-5'-三磷酸、2,6-二氨基嘌呤(2-氨基-da)、反向dt、反向二脱氧-t、羟甲基dc、异-dc、5-甲基dc、氨基乙基-吩噁嗪-脱氧胞苷,和锁核酸(lna’s),并包括在碱基之一处的至少一个错配碱基,或者替换其中至少一个碱基为rna碱基,以实现例如增加突变体特异性引物3’端的核酸相互作用,以增加tm。双链稳定碱基修饰的加入对pcr有积极的影响,从而使其能够在较高的温度下进行,在此范围内已知taq聚合酶显示出最大的活性。修饰后的探针应当保留区分待检测突变位点和野生型位点的能力。
[0051]
本发明还涉及试剂盒,其包含如上所述的组合产品。
[0052]
术语“试剂盒”是指包括至少一个设备的任何制品(例如,包装或容器),试剂盒可进一步包括在本文中描述的方法或其步骤中使用的使用说明书、补充试剂和/或组分或组件。
[0053]
在一些实施方式中,所述的试剂盒还包含核酸提取试剂、等温核酸扩增所用试剂、
阳性对照和阴性对照中的一种或多种。
[0054]
在一些实施方式中,所述等温核酸扩增所用试剂包括能结合单链核酸的重组酶、单链dna结合蛋白、链置换dna聚合酶、辅助蛋白、核酸外切酶iii、反转录酶、atp、atp再生体系所用试剂、ph调节剂、dntp、各种分子量分布的bsa和/或peg、dtt以及水中的一种或多种;
[0055]
其中所述辅助蛋白用于改变重组酶-引物复合体解离及重新结合的可逆反应过程,使反应向更有利于等温核酸扩增进行。
[0056]
ph调节剂可以包含不显著影响反应进行的酸和碱,以及缓冲组分(例如tris和醋酸盐等)。进一步地,tris缓冲液为tris-tricine,其工作浓度可以为约80mm~120mm。
[0057]
在一些实施方式中,所述重组酶选自uvsx和/或reca;
[0058]
在一些实施方式中,所述单链dna结合蛋白为gp32;
[0059]
在一些实施方式中,所述链置换dna聚合酶选自bsu dna聚合酶和/或sau dna聚合酶。重组酶介导的核酸恒温扩增技术中使用的dna聚合酶是枯草芽孢杆菌dna聚合酶i(bacillus subtilis pol i,bsu)或金黄色葡萄球菌(staphylococcus aureus pol i,sau),这两种dna聚合酶均属于dna聚合酶i家族。dna聚合酶i家族是负责dna复制过程中损伤修复的聚合酶,该家族中大部分dna聚合酶的持续合成能力都不高,也就是说该家族的聚合酶与模板结合一次能催化的聚合反应数目较少。
[0060]
在一些实施方式中,所述辅助蛋白选自uvsy;
[0061]
当重组酶用于链插入步骤的情况下,所述系统可能要求能量来源。这些酶的大多数利用atp作为能量来源,但是因为atp整理(collate)酶活性必需的镁离子,因此有利的提供另外的atp再生系统而不是提高atp的浓度。在一些实施方式中,所述atp再生体系所用试剂选自镁离子、磷酸肌酸及其平衡离子、肌酸激酶、肌激酶、焦磷酸酶、蔗糖以及蔗糖磷酸化酶中的一种或多种。
[0062]
从上述组分可知,本发明所述试剂盒可以采用并优先采用重组酶聚合酶扩增(recombinase polymerase amplification,rpa)方法,但亦可以采用在该技术之上的改进方法,例如重组酶依赖型扩增技术(recombinase-dependent amplification,rda)。
[0063]
在一些实施方式中,所述等温核酸扩增所用试剂为冻干粉试剂或混合的液体试剂。
[0064]
各组分优选以冻干形式,例如以一种或多种所谓的冻干珠的形式实现。冻干珠通常可以被理解为是指在制造后(在所述制造后物质通常作为粉末存在)被压制成球形的冻干物。因此,可以以冻干形式提供扩增反应所需的组分,特别是各种酶、核酸组分以及反应缓冲剂组分。以这种方式,可以通过添加待定量的样品以及任选其它所需组分以对于用户非常友好的方式直接开始扩增过程。特别地,冻干形式的提供非常有利于自动化应用。
[0065]
根据本发明的再一方面,还涉及如上所述的组合产品,或如上所述的试剂盒在检测水稻细菌性谷枯病菌中的应用。
[0066]
本发明提供的重组酶聚合酶扩增反应体系的反应原理为:(1)反应体系中重组酶与引物结合形成的重组酶-引物复合体,在双链dna模板中寻找靶位点;(2)重组酶-引物复合体识别模板特异性序列后,发生定位并引发链交换,单链结合蛋白随即结合被置换的dna链形成的d-loop结构;(3)重组酶-引物复合体水解体系中的datp构象改变,重组酶解离后引物3'端暴露并被dna聚合酶识别,dna聚合酶按照模板序列在引物3'端启动dna合成;(4)
dna聚合酶具有链置换功能,在引物延伸的同时继续解开模板的双螺旋dna结构,dna合成过程继续进行;(5)两条引物扩增完成即形成一个完整的扩增子;(6)在反应体系中datp水解为重组酶供能后变成dadp,磷酸肌酸能在肌酸激酶的催化下将其磷酸基转移到dadp分子中形成datp,从而恢复反应体系中datp的水平。上述过程不断重复,最终实现核酸的高效扩增。
[0067]
在一些实施方式中,检测在恒温扩增的条件下进行,温度为37℃~42℃,反应时间≥20min。
[0068]
适用于本发明的待检测样本可以为怀疑含有水稻细菌性谷枯病菌的各种组分,例如:水稻种植环境附近的水源、土壤等,当然也包含水稻植株及其相应的组织。水稻的品种不做限制,可以为粳稻、爪哇稻、籼稻、糯稻、山稻、光稃稻或者各种渗入系等。水稻组织可以为水稻的插枝,根,茎,细胞,原生质体,叶,花粉,胚,子叶,下胚轴,花药,花和种子。
[0069]
在一些实施方式中,所述应用进一步包含从怀疑含有水稻细菌性谷枯病菌成分中分离dna(特别是基因组dna)的步骤。从处理过的材料中分离dna片段可包括使用分离溶剂,如甲醇,乙醇,水,丙酮或其组合。在一些实施方案中,可以使用dna分离试剂盒的试剂盒,包括例如使用dneasy mericon食品试剂盒(qiagen,germantown,md,usa)或十六烷基三甲基溴化铵(ctab)dna分离方案。其它分离技术包括裂解,加热,醇沉淀,盐沉淀,有机分离,固相分离,二氧化硅原膜分离,cscl梯度纯化,或其任意组合。
[0070]
下面将结合实施例对本发明的实施方案进行详细描述。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,优先参考本发明中给出的指引,还可以按照本领域的实验手册或常规条件,还可以参考本领域已知的其它实验方法,或者按照制造厂商所建议的条件。
[0071]
下述的具体实施例中,涉及原料组分的量度参数,如无特别说明,可能存在称量精度范围内的细微偏差。涉及温度和时间参数,允许仪器测试精度或操作精度导致的可接受的偏差。
[0072]
实施例1
[0073]
一、材料和仪器
[0074]
营养琼脂培养基配置:称取23g nutrient agar和14g琼脂粉于干净广口瓶中,加入1l去离子水混匀,在高压灭菌锅121℃条件下灭菌20min,在无菌操作台中倒平板,冷却凝固成na固体培养基,倒置备用。tiangen细菌基因组dna提取试剂盒(离心柱型),潍坊安普未来恒温荧光检测仪(wl-16
‑ⅱ
),潍坊安普未来恒温dna快速扩增试剂盒(荧光型)。
[0075]
二、实验方法
[0076]
1.引物特异性实验:所需菌株如表1中所示,1至10为不同水稻细菌性谷枯菌株,11至23为同属即伯克氏菌属其他细菌,24至34为同样可侵染水稻上的其他细菌,各取2μl菌液为模板依上述安普未来试剂盒说明,用表2所示引物探针进行荧光rpa检测。
[0077]
表1引物特异性实验供试菌株
[0078][0079][0080]
表2荧光rpa检测所需引物和探针序列
[0081][0082]
2.引物灵敏度实验:取水稻细菌性谷枯病菌atcc33617及其试剂盒法提取的dna用无菌水10倍梯度稀释,各浓度取2μl进行荧光rpa测试。
[0083]
3.本实施例所采用的检测方法,包括如下步骤:
[0084]
(1)荧光rpa扩增:依据安普未来试剂盒方法,
[0085]
①
每个干粉反应管中加入29.4μl a缓冲液。
[0086]
②
每个反应管中加入2μl上游引物2μl下游引物0.6μl探针。
[0087]
③
向反应管中依次加入11.5μl ddh2o和2μl核酸模板。
[0088]
④
最后向反应管中加入2.5μl b缓冲液并上下颠倒10次充分混匀。
[0089]
⑤
混匀后,将反应液甩至(或离心至)反应管底部立即放入荧光检测设备中,荧光设备设置为恒温39℃,每30s收集一次fam通道荧光值,反应时间20min。
[0090]
(2)引物特异性测试实验:采用水稻细菌性谷枯病菌不同菌株;与同属,即伯克氏菌属其他病原菌;及水稻上的其他种属病原细菌各10种、19种、10种如表1所示,各取2μl作为模板加入上述反应体系中,进行荧光rpa扩增和信号采集。
[0091]
(3)细菌性谷枯病菌菌液灵敏度测试实验:采用水稻细菌性谷枯病菌atcc33617在营养琼脂平板上划线纯化,培养48h后用无菌水洗下菌落并收集菌液震荡均匀,用无菌水十倍梯度稀释收集的菌液得到初始菌量0.1~10-8
倍菌液,取40μl涂至营养琼脂平板,培养48h后计算菌落数并换算至菌落cfu。取适宜梯度的7组菌液进行荧光rpa扩增和信号采集。
[0092]
(4)细菌性谷枯病菌dna提取:使用细菌基因组dna提取试剂盒提取水稻细菌性谷枯菌株atcc33617的dna,经测序鉴定后,采用nano drop2000超微量紫外分光光度计进行三次浓度测定。3次结果取其平均值作为最终浓度。
[0093]
(5)细菌性谷枯病菌dna灵敏度测试实验:将上述提取液用ddh2o 10倍梯度稀释,得到初始浓度10-1
~10-6
倍稀释液进行荧光rpa扩增和信号采集。
[0094]
(6)结果判定:设置荧光信号阈值为100,判定值为2,ct值在35以下且峰形为s形曲线一部分的判定为阳性结果。
[0095]
三、实验结果
[0096]
实时荧光rpa检测细菌性谷枯病菌特异性实验ct值如表3中所示,对应荧光值信号图如图1至图6;引物的灵敏度测试采用水稻细菌性谷枯病菌atcc33617的菌液和dna,涂板计数法换算得到对应菌液浓度,阴性对照为无菌水,ct值结果如表4所示,对应荧光值信号图如图7和图8。如表中所示实时荧光rpa检测水稻细菌性谷枯病菌菌体的检测极限为2.28
×
103cfu/ml,dna检测极限为9.66
×
10-6
ng/μl。
[0097]
表3实时荧光rpa特异性测试结果
[0098][0099][0100]
表4不同浓度水稻细菌性谷枯病菌菌液及dna实时荧光rpa扩增结果
[0101][0102]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准,说明书及附图可以用于解释权利要求的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1