一种α-氨基硼类环化合物的制备方法与流程
一种
α-氨基硼类环化合物的制备方法
技术领域
1.本发明属于有机化学合成领域,特别涉及一种α-氨基硼类环化合物的制备方法。
背景技术:
2.α-氨基硼酸类化合物在生物医药中具有应用价值,例如硼替佐米(bortezomib)的发现代表该领域的重要研究进展,它是目前解决多发性骨髓瘤和套细胞淋巴瘤的重要治疗方法。硼替佐米l-硼亮氨酸中的α-氨基硼酸结构是其蛋白酶抑制活性的关键。此外,α-氨基硼酸在荧光示踪剂以及碳水化合物传感器等多方面的应用。
3.发展α-氨基硼酸类化合物新的合成方法对生物医药、传感器等领域重要意义。目前合成α-氨基硼酸化合物的方法已有较多报道,包括从有机硼化物构建c-n以及从胺基化合物构建c-b键两个方面:
4.⑴
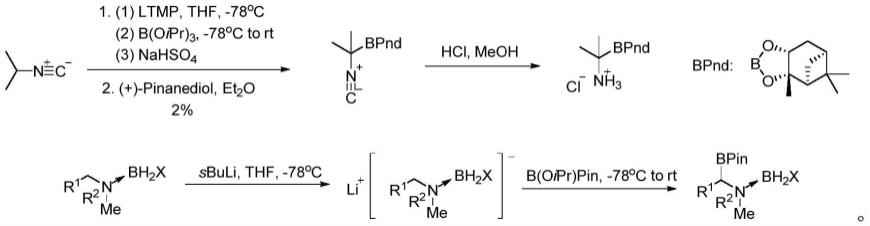
以构建c-b键来合成α-氨基硼类化合物的方法主要可以分为这几类,分别是使用α-氨基金属试剂与含硼亲电试剂的反应、亲核硼类化合物与亚胺化合物的反应、酰胺化合物的硼氢化反应以及c(sp3)-h键的直接硼化反应。α-氨基金属试剂与含硼亲电试剂的反应的合成路线如下所示:
[0005][0006]
亲核硼类化合物与亚胺化合物的反应的合成路线如下所示:
[0007][0008]
酰胺化合物的硼氢化反应的合成路线如下所示:
[0009][0010]
c(sp3)-h键的直接硼化反应的合成路线如下所示:
[0011][0012]
⑵
以构建c-b键来合成α-氨基硼类化合物的方法主要为通过α-卤代硼酸酯与胺基亲核试剂的反应,其合成路线如下所示:
[0013][0014]
尽管α-氨基硼类化合物的合成已经备受关注,并且已经有许多策略实现了多种α-氨基硼类化合物的合成,但是这些方法多多少少存在一些缺陷,例如大多数反应条件比较剧烈、底物普适性不好、产率低、需要通过多部修饰反应底物,并且无法合成结构更加复杂、官能团更加丰富的α-氨基硼类化合物,并且很难在α位构筑手性中心实现高对映选择性的α-氨基硼类化合物的合成。如何发展构建α-氨基硼类化合物的高效合成新方法将有利于对α-氨基硼类化合物的活性研究及应用。
技术实现要素:
[0015]
本发明的目的在于针对现有技术的不足,提供一种α-氨基硼类环化合物的制备方法,该方法可构建多种类型的α-氨基硼类环化合物,底物适用范围广,反应物不需要经过任何前处理和修饰,可直接用于反应;同时反应条件温和,无需高温或高压,无需酸或碱添加剂,且操作简便,是一种高效合成α-氨基硼类环化合物的方法。
[0016]
本发明的上述目的是通过以下技术方案予以实现的:
[0017]
一种α-氨基硼类环化合物的制备方法,包括如下步骤:在硒催化剂和高价碘氧化剂存在条件下,使烯丙基硼类化合物与磺酰胺或磺酸胺进行反应,得到α-氨基硼类环化合物;
[0018]
所述烯丙基硼类化合物的结构式如式(1)所示,所述磺酰胺的结构式如式(2)所示,所述磺酸胺的结构式如式(3)所示;所述α-氨基硼类环化合物的结构式如式(4)或(5)所
示;
[0019][0020][0021]
其中,r1为c1~c
10
的烃基、c1~c
10
的取代烃基、卤素、苯基、取代苯基、杂环芳烃基、含取代基的杂环芳烃基、氰基、酮羰基、酯基、醚基、苄氧基、取代苄氧基、硅氧烷基、硅氧基或二恶烷基;
[0022]
r2为h、c1~c6的烃基、苯基或取代苯基,或者r2与r1连接成环;
[0023]
r3为h或c1~c6的烃基;
[0024]
r4为c1~c
10
的烃基;
[0025]
r5、r6分别独立地为c1~c6的烃基、c1~c6的取代烃基、苯基或取代苯基。
[0026]
本发明以烯丙基硼类化合物以及磺酰胺或磺酸胺为起始化合物,烯丙基硼类化合物的烯烃α位至少有一个氢,磺酰胺或磺酸胺类化合物氮上带有两个氢,由于硼对底物的影响使得氨化反应主要发生在硼的α位。
[0027]
其反应过程如下所示:
[0028][0029]
其中r’nh2为如式(2)所示磺酰胺或式(3)所示磺酸胺。
[0030]
具体地,以烯丙基硼类化合物为起始化合物a,硒催化剂首先与磺酰胺或磺酸胺类化合物在氧化剂的作用下生成硒亚胺类化合物,该化合物与起始化合物通过ene反应(烯反应)过程实现碳硒键的生成以及双键迁移生成中间体b(在本发明的条件下反应更倾向于发生a
→
b的反应,而发生a
→
b’反应的趋势较小),化合物b再通过[2,3]-sigmatropic迁移(单键转移)过程生成最终烯丙基α-氨基硼类化合物。
[0031]
本发明通过采用特定烯丙基硼类化合物和特定的磺酰胺或磺酸胺类化合物为起始原料,在硒催化剂和高价碘氧化剂的存在下,不需要高温、高压即可制备得到烯丙基α-氨基硼类化合物。即本发明反应条件温和、操作简单,同时所述方法的底物适用性广,可制备多种烯丙基α-氨基硼类化合物。通过采用特定的起始原料,起始原料不需要经过任何其他的处理和修饰,可直接用于反应,反应步骤少,过程简单。
[0032]
优选地,所述c1~c
10
的烃基选自c1~c
10
脂肪烷烃基、c1~c
10
环烷烃、c1~c
10
脂肪烯烃基、c1~c
10
脂肪炔烃基中的一种;所述c1~c
10
的取代烃基选自卤素、氰基、苯基、羟基、氨基、磺酸基、对苯磺酸基、叠氮、苄氧基、取代苄氧基、硅氧烷基、硅氧基中的一种或多种基团取代的c1~c
10
脂肪烷烃基、c1~c
10
环烷烃基、c1~c
10
脂肪烯烃基或c1~c
10
脂肪炔烃基。
[0033]
优选地,所述c1~c
10
的烃基选自c1~c6的烃基。所述c1~c
10
的取代烃基选自c1~c6的取代烃基。
[0034]
优选地,所述卤素选自cl、br、f或i中的一种,更优选cl或f。
[0035]
优选地,所述取代苯基选自c1~c6烷烃、卤素、硝基、氰基、羟基、磺酸基、c1~c6烷氧基中的一种或多种基团取代的苯基。
[0036]
优选地,所述杂环芳烃基选自c5~c
20
的含n、s、o任意一种元素的杂环芳烃基,更优选选自呋喃基、吡咯基、噻吩基、咪唑、噻唑基、吡啶基、嘧啶基、喹啉基、异喹啉基、苯并呋喃基、吲哚基、三氮唑基、苯并三氮唑基或邻苯二甲酰亚胺基。
[0037]
优选地,所述含取代基的杂环芳烃基中的取代基选自c1~c6烷烃、卤素、氰基、苯基、羟基、磺酸基、对苯磺酸基、叠氮、羰基中的一种或多种。
[0038]
优选地,所述酯基选自-r
1a-coo-r
1b
或r
1a-coo-r
1b-,其中r
1a
、r
1b
分别独立地选自c1~c
14
的烃基、苯基或取代苯基。
[0039]
优选地,所述醚基选自-r
1c-o-r
1d
,其中r
1a
、r
1b
分别独立地选自c1~c
14
的烃基、苯基或取代苯基。
[0040]
优选地,所述取代苄氧基选自苯环上含有c1~c6烷烃、卤素、氰基、苯基、羟基、磺酸基、对苯磺酸基、叠氮、羰基中的一种或多种取代基的苄氧基。
[0041]
优选地,所述硅氧烷基选自-osir
1er1fr1g
,其中r
1e
、r
1f
、r
1g
分别独立地选自c1~c
14
的烃基(更优选c1~c
10
的烃基,再优选c1~c6的烃基)、苯基或取代苯基。
[0042]
优选地,所述c1~c6的烃基选自c1~c6脂肪烷烃、c1~c6环烷烃、c1~c6脂肪烯烃、c1~c6脂肪炔烃中的一种。
[0043]
优选地,r1为甲基、丙基、丁基、氯取代丁基、癸基、环戊基、环己基、丁烯基、苯乙基、苯甲基、4-丁酯丁基、丁酯丁基、丁酯丁基、中的一种。
[0044]
优选地,r2为h、c1~c4的烃基、苯基或取代苯基,更优选地,r2为h、环丙基、甲基、丁基、乙基、苯基、苯甲基、环戊基中的一种。
[0045]
优选地,r2与r1连接成环时,二者连接为n元环,n≥4。优选连接成四元环、五元环、六元环、七元环或八元环。所述n元环上具有1个或1个以上的双键,优选具有1个双键。所述n元环上为无取代基或具有取代基的n元环;当n元环上具有取代基时,其取代基可选自c1~c
10
的烃基、c1~c
10
的取代烃基、卤素、苯基、取代苯基、杂环芳烃基、含取代基的杂环芳烃基、氰基、酮羰基、酯基、醚基、苄氧基、取代苄氧基、硅烷基、二恶烷基中的一种或多种。
[0046]
优选地,r3为h或甲基。
[0047]
优选地,r4为甲基、六元环烷基或
[0048]
优选地,r5为甲基、苯基、三氟甲基、对溴苯基、对氟苯基、对甲苯基、对氯苯基、4-叔丁基苯基、对甲氧基苯基、对硝基苯基、对氰基苯基或邻硝基苯基。
[0049]
优选地,r6为三氟甲基、三氟乙基、三氯乙基、苯基、对甲氧基苯基、4-甲酯苯基、六氟异丙基或三氟乙基。
dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),三氯乙基磺酸胺(0.4mmol,2.0equiv),硒催化剂(imese,其他实施例采用相同的催化剂)(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应,反应时间为24h(其他各实施例的反应时间相同)。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为白色固体,收率为86%。
[0066]
化合物5aa为:
[0067]
2,2,2-trichloroethyl(e)-(1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)hept-2-en-1-yl)sulfamate,其结构如下所示:
[0068][0069]
对化合物5aa进行核磁共振和高分辨表征,其结果如下:
[0070]1h nmr(500mhz,丙酮-d6)δ6.94(d,j=9.0hz,1h),5.72(dt,j=15.5,6.5hz,1h),5.60(ddd,j=15.5,8.0,1.5hz,1h),4.69(q,j=11.5hz,2h),4.29(dd,j=17.0,7.5hz,2h),4.10(dd,j=41.5,17.0hz,2h),3.73(t,j=8.5hz,1h),3.29(s,3h),2.09
–
2.02(m,2h),1.39
–
1.32(m,4h),0.87(t,j=7.0hz,3h).
[0071]
13
c nmr(125mhz,丙酮-d6)δ168.4,133.1,128.7,95.0,78.8,63.7,63.5,46.7,22.9,14.2.
[0072]
esi-ms:calculated c
14h22
bcl3n2o7s[m+na]
+
,501.0199;found 501.0207.
[0073]
实施例2化合物5ab的合成
[0074]
向反应管中依次加入(e)-2-(hept-2-en-1-yl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),三氟甲基磺酰胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为白色固体,收率为80%。
[0075]
化合物5ab为:
[0076]
(e)-1,1,1-trifluoro-n-(1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)hept-2-en-1-yl)methanesulfonamide,其结构如下所示:
[0077][0078]
对化合物5ab进行核磁共振和高分辨表征,其结果如下:
[0079]1h nmr(400mhz,丙酮-d6)δ7.75(d,j=8.1hz,1h),5.69(dt,j=15.3,6.6hz,1h),5.57(ddt,j=15.5,7.6,1.3hz,1h),4.33(dd,j=17.0,5.8hz,2h),4.13(dd,j=33.0,17.0hz,2h),3.93
–
3.79(m,1h),3.31(s,3h),2.07
–
2.04(m,2h),1.39
–
1.29(m,4h),0.89(t,j=7.1hz,3h).
[0080]
13
c nmr(126mhz,丙酮-d6)δ168.3,168.1,132.6,128.4,120.7(q,j=322.1hz),63.7,63.7,46.8,32.8,32.2,22.7,14.2.
[0081]
11
b nmr(160mhz,丙酮-d6)δ10.4.
[0082]
19
f nmr(376mhz,丙酮-d6)δ-77.6.
[0083]
esi-ms:calculated c
13h20
bf3n2o6s[m+na]
+
,423.0979;found 423.0981.
[0084]
实施实3化合物5ac的合成
[0085]
向反应管中依次加入(e)-2-(hept-2-en-1-yl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),对溴苯磺酰胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为白色固体,收率为50%。
[0086]
化合物5ac为:
[0087]
(e)-4-bromo-n-(1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)hept-2-en-1-yl)benzenesulfonamide,其的结构如下所示:
[0088][0089]
对化合物5ac进行核磁共振和高分辨表征,其结果如下:
[0090]1h nmr(500mhz,丙酮-d6)δ7.80(d,j=8.0hz,2h),7.72(d,j=8.0hz,2h),6.44(d,j=10.0hz,1h),5.14
–
5.01(m,2h),4.27(dd,j=17.0,10.5hz,2h),4.09(dd,j=41.5,17.0hz,2h),3.69
–
3.58(m,1h),3.36(s,3h),1.63(q,j=7.0hz,2h),1.18
–
1.12(m,2h),1.01
–
0.95(m,2h),0.84(t,j=7.5hz,3h).
[0091]
13
c nmr(126mhz,丙酮-d6)δ168.6,168.4,142.6,132.7,132.6,131.5,130.3,130.3,127.5,127.1,63.7,63.5,46.4,32.6,31.8,22.9,14.3.
[0092]
11
b nmr(128mhz,乙腈-d3)δ10.3.
[0093]
esi-ms:calculated c
18h24
bbrn2o6s[m+na]
+
,509.0524;found 509.0527.
[0094]
实施实4化合物5ad的合成
[0095]
向反应管中依次加入(e)-2-(hept-2-en-1-yl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),苯基磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为白色固体,收率为78%。
[0096]
化合物5ad为:
[0097]
phenyl(e)-(1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)hept-2-en-1-yl)sulfamate,其的结构如下所示:
[0098][0099]
对化合物5ad进行核磁共振和高分辨表征,其结果如下:
[0100]1h nmr(500mhz,丙酮-d6)δ7.31
–
7.26(m,3h),7.20
–
7.14(m,4h),6.87(d,j=8.8hz,1h),5.62
–
5.51(m,1h),5.45(dd,j=15.4,7.9hz,1h),4.19
–
4.10(m,3h),3.93(ddd,j=85.4,16.9,1.8hz,3h),3.70(t,j=8.2hz,1h),3.13(d,j=1.8hz,3h),1.94
–
1.87(m,3h),1.23
–
1.15(m,5h),0.71(d,j=6.6hz,3h).
[0101]
13
c nmr(126mhz,丙酮-d6)δ168.5,168.3,151.8,132.5,130.4,128.9,127.0,122.5,63.7,63.6,46.6,32.8,32.1,22.7,14.2.
[0102]
11
b nmr(160mhz,丙酮-d6)δ10.4.
[0103]
esi-ms:calculated c
18h25
bn2o7s[m+na]
+
,447.1368;found 447.1364.
[0104]
实施例5化合物5ae的合成
[0105]
向反应管中依次加入(e)-2-(hept-2-en-1-yl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),对氟苯磺酰胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为白色固
体,收率为72%。
[0106]
化合物5ae为:
[0107]
(e)-4-fluoro-n-(1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)hept-2-en-1-yl)benzenesulfonamide,其结构如下所示:
[0108][0109]
对化合物3ae进行核磁共振和高分辨表征,其结果如下:
[0110]1h nmr(400mhz,丙酮-d6)δ8.02
–
7.88(m,2h),7.32(t,j=8.8hz,2h),6.37(d,j=10.0hz,1h),5.22
–
5.01(m,2h),4.28(dd,j=16.8,9.2hz,2h),4.10(dd,j=34.8,16.8hz,2h),3.71
–
3.56(m,1h),3.36(s,3h),1.68
–
1.63(m,2h),1.20
–
1.11(m,2h),1.09
–
0.95(m,2h),0.83(t,j=7.2hz,3h).
[0111]
13
c nmr(125mhz,丙酮-d6)δ168.6,168.3,166.6,δ165.6(d,j=250.7hz),139.7(d,j=3.0hz),131.4,131.3,127.7,116.6,116.4,63.7,63.5,46.4,32.7,31.9,22.8,14.1.
[0112]
11
b nmr(160mhz,丙酮-d6)δ10.5.
[0113]
19
f nmr(376mhz,丙酮-d6)δ-109.1.
[0114]
esi-ms:calculated c
18h24
bfn2o6s[m+na]
+
,449.1324;found 449.1321.
[0115]
实施例6化合物5af的合成
[0116]
向反应管中依次加入(e)-2-(hept-2-en-1-yl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),苯磺酰胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为白色固体,收率为66%。
[0117]
化合物5af为:
[0118]
(e)-n-(1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)hept-2-en-1-yl)benzenesulfonamide,其结构如下所示:
[0119]
dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),对氯苯磺酰胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为白色固体,收率为76%。
[0137]
化合物5ah为:
[0138]
(e)-4-chloro-n-(1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)hept-2-en-1-yl)benzenesulfonamide,其的结构如下所示:
[0139][0140]
对化合物5ah进行核磁共振和高分辨表征,其结果如下:
[0141]1h nmr(400mhz,丙酮-d6)δ7.92
–
7.82(m,2h),7.61
–
7.50(m,2h),6.42(d,j=10.4hz,0h),5.10(q,j=6.0hz,2h),4.27(dd,j=17.2,9.2hz,2h),4.15
–
3.98(m,2h),3.63(d,j=7.2hz,1h),3.36(d,j=9.2hz,3h),1.70
–
1.55(m,2h),1.66-1.61(m,2h),1.06
–
0.94(m,2h),0.83(t,j=7.6hz,3h).
[0142]
13
c nmr(126mhz,丙酮-d6)δ168.6,168.3,142.2,138.6,131.5,130.3,129.7,127.5,63.7,63.5,46.4,32.7,31.9,22.9,14.2.
[0143]
11
b nmr(160mhz,丙酮-d6)δ10.29.
[0144]
esi-ms:calculated c
18h24
bcln2o6s[m+na]
+
,465.1029;found 465.1031.
[0145]
实施例9化合物5ai的合成
[0146]
向反应管中依次加入(e)-2-(hept-2-en-1-yl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),4-叔丁基苯磺酰胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为白色固体,收率为76%。
[0147]
化合物5ai为:
[0148]
(e)-4-(tert-butyl)-n-(1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)hept-2-en-1-yl)benzenesulfonamide,其结构如下所示:
[0149][0150]
对化合物5ai进行核磁共振和高分辨表征,其结果如下:
[0151]1h nmr(400mhz,丙酮-d6)δ7.8(d,j=8.6hz,2h),7.6(d,j=8.5hz,2h),6.2(d,j=10.1hz,1h),5.2
–
5.0(m,2h),4.3(dd,j=16.8,10.1hz,2h),4.1(dd,j=35.8,16.8hz,2h),3.7
–
3.5(m,1h),3.3(s,3h),1.6(q,j=6.7,5.8hz,2h),1.4(s,9h),1.2
–
1.1(m,3h),1.1
–
1.0(m,2h),0.8(t,j=7.3hz,3h).
[0152]
13
c nmr(126mhz,丙酮-d6)δ168.7,168.3,156.3,140.5,131.2,128.3,127.5,126.4,63.7,63.5,46.4,35.6,32.6,31.7,31.4,31.4,22.9,14.2.
[0153]
11
b nmr(160mhz,丙酮-d6)δ10.38.
[0154]
esi-ms:calculated c
22h33
bn2o6s[m+na]
+
,487.2045;found 487.2040
[0155]
实施例10化合物5aj的合成
[0156]
向反应管中依次加入(e)-2-(hept-2-en-1-yl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),对甲氧基苯磺酰胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为白色固体,收率为60%。
[0157]
化合物5aj为:
[0158]
(e)-4-methoxy-n-(1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)hept-2-en-1-yl)benzenesulfonamide,其结构如下所示:
[0159][0160]
对化合物5aj进行核磁共振和高分辨表征,其结果如下:
[0161]1h nmr(500mhz,乙腈-d3)δ7.7(d,j=8.9hz,2h),7.0(d,j=8.9hz,2h),5.4(d,j=10.3hz,1h),5.1
–
5.0(m,1h),5.0
–
4.9(m,1h),4.0(dd,j=16.9,13.7hz,3h),3.9
–
3.9(m,2h),3.8(s,4h),3.5
–
3.5(m,1h),3.1(s,3h),1.6
–
1.6(m,2h),1.2
–
1.1(m,2h),1.0
–
0.9(m,2h),0.8(t,j=7.3hz,3h).
[0162]
13
c nmr(101mhz,乙腈-d3)δ169.0,168.6,163.8,134.4,132.0,131.1,130.5,128.4,127.3,114.9,63.8,63.6,56.4,46.6,32.7,31.9,23.0,14.2.
[0163]
11
b nmr(128mhz,乙腈-d3)δ10.7.
[0164]
esi-ms:calculated c
19h27
bn2o7s[m+na]
+
,461.1524;found 461.1529.
[0165]
实施例11化合物5ak的合成
[0166]
向反应管中依次加入(e)-2-(hept-2-en-1-yl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),甲基磺酰胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为白色固体,收率为56%。
[0167]
化合物5ak为:
[0168]
(e)-n-(1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)hept-2-en-1-yl)methanesulfonamide,其的结构如下所示:
[0169][0170]
对化合物5ak进行核磁共振和高分辨表征,其结果如下:
[0171]1h nmr(500mhz,乙腈-d3)δ5.63(dtd,j=15.5,6.8,1.0hz,1h),5.48(ddt,j=15.5,8.3,1.4hz,1h),5.14(d,j=10.3hz,1h),3.98(dd,j=16.9,3.5hz,2h),3.85(dd,j=16.9,9.1hz,2h),3.57(t,j=9.3hz,1h),3.07(s,3h),2.84(s,3h),2.07(q,j=6.6hz,2h),1.40
–
1.32(m,4h),0.90(t,j=7.1hz,3h).
[0172]
13
c nmr(126mhz,乙腈-d3)δ168.9,168.6,133.1,129.2,63.8,63.7,46.7,42.5,32.8,32.3,22.9,14.2.
[0173]
11
b nmr(128mhz,乙腈-d3)δ10.4.
[0174]
esi-ms:calculated c
13h23
bn2o6s[m+na]
+
,369.1262;found 369.1260.
[0175]
实施例12化合物5al的合成
[0176]
向反应管中依次加入(e)-2-(hept-2-en-1-yl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),对硝基苯磺酰胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为白色固
体,收率为79%。
[0177]
化合物5al为:
[0178]
(e)-n-(1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)hept-2-en-1-yl)-4-nitrobenzenesulfonamide,其的结构如下所示:
[0179][0180]
对化合物5al进行核磁共振和高分辨表征,其结果如下:
[0181]1h nmr(400mhz,丙酮-d6)δ8.41(d,j=8.6hz,2h),8.15(d,j=8.6hz,2h),6.73(d,j=10.4hz,1h),5.26
–
4.97(m,2h),4.29(dd,j=16.8,5.6hz,2h),4.11(dd,j=32.4,16.8hz,2h),3.73(t,j=8.4hz,1h),3.37(d,j=9.2hz,3h),1.59(q,j=6.8hz,2h),1.15
–
0.98(m,2h),0.98
–
0.81(m,2h),0.75(t,j=7.2hz,3h).
[0182]
13
c nmr(126mhz,丙酮-d6)δ168.5,168.3,150.8,149.2,131.8,130.0,127.6,124.9,63.7,63.6,46.6,32.5,31.9,22.8,14.0.
[0183]
11
b nmr(160mhz,丙酮-d6)δ10.4.
[0184]
esi-ms:calculated c
18h24
bn3o8s[m+na]
+
,476.1269;found 476.1274.
[0185]
实施例13化合物5am的合成
[0186]
向反应管中依次加入(e)-2-(hept-2-en-1-yl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),对氰基苯磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为白色固体,收率为61%。
[0187]
化合物5am为:
[0188]
4-cyanophenyl(e)-(1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)hept-2-en-1-yl)sulfamate,其结构式如下所示:
[0189][0190]
对化合物5am进行核磁共振和高分辨表征,其结果如下:
[0191]1h nmr(400mhz,丙酮-d6)δ7.95
–
7.82(m,2h),7.51(dd,j=9.0,2.3hz,2h),7.34
(d,j=8.8hz,1h),5.75
–
5.61(m,1h),5.53(dd,j=15.6,8.2hz,1h),4.30(dd,j=16.9,7.5hz,2h),4.10(dd,j=45.8,17.0hz,2h),3.84(d,j=7.1hz,1h),3.32(d,j=9.8hz,3h),2.03
–
1.97(m,2h),1.29(p,j=3.6hz,4h),0.83(q,j=5.2,3.5hz,3h).
[0192]
13
c nmr(126mhz,丙酮-d6)δ168.3,155.0,134.9,133.0,128.6,128.6,123.4,123.2,118.7,110.6,63.8,63.6,46.7,32.8,32.1,22.8,14.2.
[0193]
11
b nmr(160mhz,丙酮-d6)δ10.7.
[0194]
esi-ms:calculated c
19h24
bn3o7s[m+na]
+
,472.1320;found 472.1318.
[0195]
实施例14化合物5ao的合成
[0196]
向反应管中依次加入(e)-2-(hept-2-en-1-yl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),对甲氧基苯磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为白色固体,收率为78%。
[0197]
化合物5ao为:
[0198]
4-methoxyphenyl(e)-(1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)hept-2-en-1-yl)sulfamate,其结构式如下所示:
[0199][0200]
对化合物5ao进行核磁共振和高分辨表征,其结果如下:
[0201]1h nmr(400mhz,乙腈-d3)δ7.19(d,j=9.1hz,2h),6.93(d,j=9.1hz,2h),5.95(d,j=9.1hz,1h),5.71
–
5.59(m,1h),5.48(ddd,j=15.5,8.4,1.5hz,1h),3.98(dd,j=17.0,3.0hz,2h),3.89
–
3.79(m,2h),3.73(d,j=8.6hz,1h),2.99(s,3h),2.05(p,j=6.1,5.5hz,2h),1.30(td,j=8.8,8.2,4.4hz,5h),0.89
–
0.81(m,3h).
[0202]
13
c nmr(126mhz,丙酮-d6)δ168.5,168.3,158.8,145.1,132.5,129.1,129.1,123.8,115.2,115.2,63.8,63.6,62.9,55.9,46.6,32.9,32.2,22.7,14.2.
[0203]
11
b nmr(160mhz,丙酮-d6)δ10.4.
[0204]
esi-ms:calculated c
19h27
bn2o8s[m+na]
+
,477.1473;found 477.1472.
[0205]
实施例15化合物5ap的合成
[0206]
向反应管中依次加入(e)-2-(hept-2-en-1-yl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),4-甲酯苯磺
酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为白色固体,收率为67%。
[0207]
化合物5ap为:
[0208]
methyl(e)-4-((n-(1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)hept-2-en-1-yl)sulfamoyl)oxy)benzoate,其结构式如下所示:
[0209][0210]
对化合物5ap进行核磁共振和高分辨表征,其结果如下:
[0211]1h nmr(400mhz,丙酮-d6)δ8.12
–
7.98(m,2h),7.49
–
7.39(m,2h),7.23(d,j=8.8hz,1h),5.68(dt,j=13.9,6.6hz,1h),5.54(dd,j=15.5,8.1hz,1h),4.29(dd,j=16.9,10.0hz,2h),4.09(dd,j=53.2,16.9hz,3h),3.89(s,3h),3.88
–
3.80(m,1h),3.30(s,3h),2.04
–
1.98(m,2h),1.30(q,j=3.6hz,4h),0.82(q,j=5.2,3.4hz,3h).
[0212]
13
c nmr(126mhz,丙酮-d6)δ168.4,168.3,166.4,155.3,132.8,131.9,128.8,128.7,128.7,122.2,63.8,63.6,52.5,46.7,32.9,32.1,22.8,14.2.
[0213]
11
b nmr(160mhz,丙酮-d6)δ10.3.
[0214]
esi-ms:calculated c
20h27
bn2o9s[m+na]
+
,505.1423;found 505.1420.
[0215]
实施例16化合物5ar的合成
[0216]
向反应管中依次加入(e)-2-(hept-2-en-1-yl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),六氟异丙基磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为淡黄色固体,收率为60%。
[0217]
化合物5ar为:
[0218]
1,1,1,3,3,3-hexafluoropropan-2-yl(e)-(1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)hept-2-en-1-yl)sulfamate,其结构式如下所示:
[0219][0220]
对化合物5ar进行核磁共振和高分辨表征,其结果如下:
[0221]1h nmr(400mhz,乙腈-d3)δ6.40(d,j=8.8hz,1h),5.72
–
5.49(m,2h),5.49
–
5.37(m,1h),4.01(dd,j=17.1,2.1hz,2h),3.86(dd,j=17.1,6.3hz,2h),3.68(t,j=8.5hz,1h),3.01(s,3h),2.04(p,j=6.2,5.5hz,2h),1.40
–
1.27(m,4h),0.89(t,j=7.1hz,3h).
[0222]
13
c nmr(126mhz,丙酮)δ168.3,168.3,132.9,128.1,δ121.58(q,j=281.7hz),72.62(dt,j=69.0,34.4hz),63.8,63.7,46.7,32.9,32.0,22.8,14.2.
[0223]
11
b nmr(160mhz,丙酮)δ10.5.
[0224]
esi-ms:calculated c
15h21
bf6n2o7s[m+na]
+
,521.0959;found 521.0954.
[0225]
实施例17化合物5as的合成
[0226]
向反应管中依次加入(e)-2-(hept-2-en-1-yl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),三氟乙基磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为淡黄色固体,收率为64%。
[0227]
化合物5as为:
[0228]
2,2,2-trifluoroethyl(e)-(1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)hept-2-en-1-yl)sulfamate,其结构式如下所示:
[0229][0230]
对化合物5as进行核磁共振和高分辨表征,其结果如下:
[0231]1h nmr(400mhz,丙酮-d6)δ6.94(d,j=9.3hz,1h),5.77
–
5.65(m,1h),5.57(ddt,j=15.4,8.2,1.3hz,1h),4.63
–
4.49(m,2h),4.30(dd,j=17.0,5.1hz,2h),4.11(dd,j=32.3,17.0hz,2h),3.69(t,j=8.7hz,1h),3.28(s,3h),2.05(td,j=5.4,4.5,3.1hz,2h),1.39
–
1.28(m,4h),0.89(t,j=7.0hz,3h).
[0232]
13
c nmr(126mhz,丙酮)δ168.5,168.4,133.3,128.5,123.78(q,j=276.8hz),65.31(q,j=36.8hz),63.7,63.6,46.7,32.8,32.1,22.8,14.2.
[0233]
11
b nmr(160mhz,丙酮)δ10.6.
[0234]
esi-ms:calculated c
14h22
bf3n2o7s[m+na]
+
,453.1085;found 453.1084.
[0235]
实施例18化合物5at的合成
[0236]
向反应管中依次加入(e)-2-(hept-2-en-1-yl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),邻硝基苯磺酰胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为淡黄色固体,收率为59%。
[0237]
化合物5at为:
[0238]
(e)-n-(1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)hept-2-en-1-yl)-2-nitrobenzenesulfonamide,其结构如下所示:
[0239][0240]
对化合物5at进行核磁共振和高分辨表征,其结果如下:
[0241]1h nmr(400mhz,乙腈-d3)δ8.04
–
7.95(m,1h),7.88
–
7.70(m,3h),5.63(d,j=10.2hz,1h),5.32
–
5.18(m,1h),5.09(ddt,j=15.6,8.3,1.5hz,1h),4.03(dd,j=17.1,5.7hz,2h),3.91(dd,j=17.1,3.3hz,2h),3.78
–
3.70(m,1h),3.11(s,3h),1.66
–
1.53(m,2h),1.12
–
1.00(m,2h),0.94
–
0.84(m,2h),0.78(t,j=7.3hz,3h).
[0242]
13
c nmr(101mhz,乙腈-d3)δ168.8,168.6,148.8,135.3,134.9,133.7,133.3,132.1,132.1,127.0,125.8,63.8,63.7,47.1,32.4,31.7,22.8,14.1.
[0243]
11
b nmr(160mhz,乙腈-d3)δ10.4.
[0244]
esi-ms:calculated c
18h24
bn3o8s[m+na]
+
,476.1269;found 476.1262.
[0245]
实施例19化合物5ba的合成
[0246]
向反应管中依次加入(e)-7-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)hept-5-en-1-yl 4-methoxybenzoate(0.2mmol,1.0equiv),三氯乙基磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,
用硅胶柱层析纯化得产品,为淡黄色固体,收率为59%。
[0247]
化合物5ba为:
[0248]
(e)-7-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)-7-(((2,2,2-trichloroethoxy)sulfonyl)amino)hept-5-en-1-yl 4-methoxybenzoate,其结构如下所示:
[0249][0250]
对化合物5ba进行核磁共振和高分辨表征,其结果如下:
[0251]1h nmr(400mhz,乙腈-d3)δ8.05
–
7.87(m,2h),7.05
–
6.90(m,2h),6.08(d,j=9.4hz,1h),5.70(dt,j=15.5,6.6hz,1h),5.55(dd,j=15.5,8.2hz,1h),4.62(q,j=11.2hz,2h),4.25(t,j=6.5hz,2h),4.01(dd,j=17.1,2.4hz,2h),3.89(d,j=3.1hz,1h),3.85(s,4h),3.66(t,j=8.7hz,1h),3.04(s,3h),2.13(q,j=7.3hz,2h),1.79
–
1.72(m,2h),1.60
–
1.45(m,2h).
[0252]
13
c nmr(126mhz,cd3cn)δ168.6,166.9,164.4,133.4,132.3,128.8,123.8,114.8,94.8,78.9,65.3,63.8,63.7,56.3,47.0,32.8,29.1,26.5.
[0253]
11
b nmr(160mhz,cd3cn)δ10.60.
[0254]
esi-ms:calculated c
22h28
bcl3n2o
10
s[m+na]
+
,651.0516;found 651.0518.
[0255]
实施例20化合物5bb的合成
[0256]
向反应管中依次加入(e)-2-(hex-2-en-1-yl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),三氯乙基磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为淡黄色固体,收率为78%。
[0257]
化合物5bb为:
[0258]
2,2,2-trichloroethyl(e)-(1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)hex-2-en-1-yl)sulfamate,其结构如下所示:
[0259][0260]
对化合物5bb进行核磁共振和高分辨表征,其结果如下:
dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),三氯乙基磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为淡黄色固体,收率为66%。
[0277]
化合物5bd为:
[0278]
2,2,2-trichloroethyl(e)-(7-chloro-1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)hept-2-en-1-yl)sulfamate,其结构如下所示:
[0279][0280]
对化合物5bd进行核磁共振和高分辨表征,其结果如下:
[0281]1h nmr(500mhz,乙腈-d3)δ6.03(d,j=9.5hz,1h),5.67(dt,j=15.5,6.5hz,1h),5.54(dd,j=15.5,8.0hz,1h),4.71
–
4.55(m,2h),4.01(d,j=17.0hz,2h),3.87(dd,j=17.0,4.5hz,2h),3.65(t,j=9.0hz,1h),3.59(t,j=6.5hz,2h),3.04(s,3h),2.13
–
2.03(m,2h),1.80
–
1.75(m,2h),1.53
–
1.48(m,2h).
[0282]
13
c nmr(126mhz,乙腈-d3)δ168.5,133.2,128.9,94.8,78.9,63.8,63.7,47.0,46.1,32.9,32.3,27.2.
[0283]
11
b nmr(160mhz,乙腈-d3)δ10.24.
[0284]
esi-ms:calculated c
14h21
bcl4n2o7s[m+na]
+
,534.9809;found 534.9808.
[0285]
实施例23化合物5be的合成
[0286]
向反应管中依次加入(e)-2-(6-(5,5-dimethyl-1,3-dioxan-2-yl)hex-2-en-1-yl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),三氯乙基磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为淡黄色固体,收率为68%。
[0287]
化合物5be为:
[0288]
2,2,2-trichloroethyl(e)-(6-(5,5-dimethyl-1,3-dioxan-2-yl)-1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)hex-2-en-1-yl)sulfamate,其结构如下所示:
[0289][0290]
对化合物5be进行核磁共振和高分辨表征,其结果如下:
[0291]1h nmr(500mhz,乙腈-d3)δ6.01(d,j=9.4hz,1h),5.67(dt,j=14.0,6.6hz,1h),5.51(dd,j=15.5,8.3hz,1h),4.70
–
4.55(m,2h),4.41(t,j=5.0hz,1h),4.00(d,j=17.0hz,2h),3.86(ddd,j=17.0,4.0hz,2h),3.64(t,j=9.0hz,1h),3.52(d,j=10.7hz,2h),3.40(d,j=10.8hz,2h),3.04(s,3h),2.08
–
2.04(m,2h),1.61
–
1.52(m,2h),1.52
–
1.39(m,2h),1.11(s,3h),0.68(s,3h).
[0292]
13
c nmr(126mhz,乙腈-d3)δ168.5,133.6,128.7,102.7,94.8,78.9,77.5,63.8,63.7,47.0,35.1,32.9,30.7,24.4,23.2,21.9.
[0293]
11
b nmr(160mhz,乙腈-d3)δ10.12.
[0294]
esi-ms:calculated c
19h30
bcl3n2o9s[m+na]
+
,601.0723;found 601.0729.
[0295]
实施例24化合物5bf的合成
[0296]
向反应管中依次加入(e)-6-methyl-2-(5-phenylpent-2-en-1-yl)-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),三氯乙基磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为淡黄色固体,收率为68%。
[0297]
化合物5bf为:
[0298]
2,2,2-trichloroethyl(e)-(1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)-5-phenylpent-2-en-1-yl)sulfamate,其结构如下所示:
[0299][0300]
对化合物5bf进行核磁共振和高分辨表征,其结果如下:
[0301]1h nmr(400mhz,丙酮-d6)δ7.30
–
7.22(m,4h),7.19
–
7.13(m,1h),6.95(d,j=9.2hz,1h),5.80(dt,j=15.6,6.4hz,1h),5.67(ddt,j=15.6,8.0,1.2hz,1h),4.79
–
4.67(m,2h),4.28(d,j=16.8hz,2h),4.03(dd,j=16.8,4.4hz,2h),3.75(t,j=8.4hz,1h),3.24(s,3h),2.79
–
2.67(m,2h),2.42
–
2.36(m,2h).
[0302]
13
c nmr(126mhz,丙酮-d6)δ168.4,168.4,142.7,132.6,129.3,129.2,129.1,
126.6,95.0,78.8,63.6,63.5,46.6,36.2,35.2.
[0303]
11
b nmr(160mhz,丙酮-d6)δ10.5.
[0304]
esi-ms:calculated c
18h22
bcl3n2o7s[m+na]
+
,549.0199;found 549.0192.
[0305]
实施例25化合物5bg的合成
[0306]
向反应管中依次加入(e)-7-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)hept-5-en-1-yl pivalate(0.2mmol,1.0equiv),三氯乙基磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为淡黄色固体,收率为68%。
[0307]
化合物5bg为:
[0308]
(e)-7-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)-7-(((2,2,2-trichloroethoxy)sulfonyl)amino)hept-5-en-1-yl pivalate,其结构如下所示:
[0309][0310]
对化合物5bg进行核磁共振和高分辨表征,其结果如下:
[0311]1h nmr(400mhz,乙腈-d3)δ6.03(d,j=9.2hz,1h),5.68(dt,j=15.6,6.4hz,1h),5.53(dd,j=15.6,8.0hz,1h),4.63(q,j=11.2hz,2h),4.08
–
3.94(m,4h),3.86(dd,j=17.2,2.4hz,2h),3.65(t,j=8.8hz,1h),3.04(s,3h),2.12
–
2.06(m,2h),1.66
–
1.59(m,2h),1.51
–
1.41(m,2h),1.16(s,9h).
[0312]
13
c nmr(126mhz,乙腈-d3)δ179.0,168.6,168.5,133.4,128.8,94.8,78.9,64.9,63.8,63.7,47.0,39.3,32.7,29.0,27.5,27.4,26.4.
[0313]
11
b nmr(160mhz,乙腈-d3)δ10.2.
[0314]
esi-ms:calculated c
19h30
bcl3n2o9s[m+na]
+
,601.0723;found 601.0728.
[0315]
实施例26化合物5bh的合成
[0316]
向反应管中依次加入ethyl(e)-4-(5-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)pent-3-en-1-yl)benzoate(0.2mmol,1.0equiv),三氯乙基磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,
用硅胶柱层析纯化得产品,为淡黄色固体,收率为68%。
[0317]
化合物5bh为:
[0318]
ethyl(e)-4-(5-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)-5-(((2,2,2-trichloroethoxy)sulfonyl)amino)pent-3-en-1-yl)benzoate,其结构如下所示:
[0319][0320]
对化合物5bh进行核磁共振和高分辨表征,其结果如下:
[0321]1h nmr(400mhz,乙腈-d3)δ7.92(d,j=8.0hz,2h),7.34(d,j=8.0hz,2h),6.04(d,j=9.2hz,1h),5.75
–
5.68(m,1h),5.62
–
5.51(m,1h),4.62(q,j=11.2hz,2h),4.31(q,j=7.2hz,2h),3.99(dd,j=17.2,7.6hz,2h),3.81(dd,j=19.6,17.2hz,2h),3.65(t,j=8.8hz,1h),3.00(s,3h),2.77(td,j=7.6,2.4hz,2h),2.42
–
2.36(m,2h),1.34(t,j=7.2hz,3h).
[0322]
13
c nmr(126mhz,乙腈-d3)δ168.6,167.2,148.5,132.7,130.3,129.7,129.3,94.8,78.8,63.7,63.6,61.6,47.0,36.1,34.6,14.6.
[0323]
11
b nmr(160mhz,乙腈-d3)δ10.1.
[0324]
esi-ms:calculated c
21h26
bcl3n2o9s[m+na]
+
,621.0410;found 621.0415.
[0325]
实施例27化合物5bi的合成
[0326]
向反应管中依次加入(e)-2-(5-(benzyloxy)pent-2-en-1-yl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),三氯乙基磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为淡黄色固体,收率为77%。
[0327]
化合物5bi为:
[0328]
2,2,2-trichloroethyl(e)-(5-(benzyloxy)-1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)pent-2-en-1-yl)sulfamate,其结构如下所示:
[0329][0330]
对化合物5bi进行核磁共振和高分辨表征,其结果如下:
dioxazaborocan-2-yl)allyl)sulfamate,其结构如下所示:
[0359][0360]
对化合物5bl进行核磁共振和高分辨表征,其结果如下:
[0361]1h nmr(400mhz,乙腈-d3)δ6.00(d,j=9.2hz,1h),5.64(dd,j=15.7,6.5hz,1h),5.47(ddd,j=15.6,8.2,1.2hz,1h),4.63(q,j=11.3hz,2h),4.00(dd,j=17.0,3.2hz,2h),3.85(dd,j=17.1,2.3hz,2h),3.63(t,j=8.7hz,1h),3.03(s,3h),1.77
–
1.59(m,5h),1.36
–
1.02(m,6h).
[0362]
13
c nmr(101mhz,乙腈-d3)δ168.6,168.5,139.5,126.1,94.8,78.9,63.8,63.7,46.9,41.3,33.6,33.6,26.9,26.7.
[0363]
11
b nmr(160mhz,乙腈-d3)δ10.23.
[0364]
esi-ms:calculated c
16h24
bcl3n2o7s[m+na]
+
,527.0355;found 527.0353.
[0365]
实施例31化合物5bm的合成
[0366]
向反应管中依次加入(e)-2-(hepta-2,6-dien-1-yl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),三氯乙基磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为淡黄色固体,收率为76%。
[0367]
化合物5bm为:
[0368]
2,2,2-trichloroethyl(e)-(1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)hepta-2,6-dien-1-yl)sulfamate,其结构如下所示:
[0369][0370]
对化合物5bm进行核磁共振和高分辨表征,其结果如下:
[0371]1h nmr(500mhz,丙酮-d6)δ6.96(d,j=9.1hz,1h),5.93
–
5.81(m,1h),5.81
–
5.70(m,1h),5.65(dd,j=15.5,8.1hz,1h),5.07
–
4.88(m,2h),4.78
–
4.66(m,2h),4.31(dd,j=17.0,8.1hz,2h),4.12(dd,j=40.3,17.0hz,2h),3.75(t,j=8.3hz,1h),3.31(s,3h),2.22
–
2.08(m,3h).
[0372]
13
c nmr(101mhz,cd3cn)δ168.6,139.4,133.1,128.9,115.4,94.8,78.9,63.8,
63.7,47.0,34.0,32.6.
[0373]
11
b nmr(128mhz,cd3cn)δ10.4.
[0374]
esi-ms:calculated c
14h20
bcl3n2o7s[m+na]
+
,499.0042;found 499.0046.
[0375]
实施例32化合物5bn的合成
[0376]
向反应管中依次加入(e)-7-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)hept-5-en-1-yl benzoate(0.2mmol,1.0equiv),三氯乙基磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为淡黄色固体,收率为78%。
[0377]
化合物5bn为:
[0378]
(e)-7-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)-7-(((2,2,2-trichloroethoxy)sulfonyl)amino)hept-5-en-1-yl benzoate,其结构如下所示:
[0379][0380]
对化合物5bn进行核磁共振和高分辨表征,其结果如下:
[0381]1h nmr(400mhz,乙腈-d3)δ8.01(dd,j=8.1,1.4hz,2h),7.68
–
7.55(m,1h),7.49(t,j=7.6hz,2h),6.11(d,j=9.1hz,1h),5.70(dt,j=15.5,6.5hz,1h),5.65
–
5.48(m,1h),4.62(q,j=11.2hz,2h),4.29(t,j=6.5hz,2h),4.02(dd,j=17.0,2.5hz,2h),3.87(dd,j=17.1,3.1hz,2h),3.66(t,j=8.6hz,1h),3.05(s,3h),2.18
–
2.06(m,2h),1.83
–
1.71(m,2h),1.63
–
1.45(m,2h).
[0382]
13
c nmr(126mhz,cd3cn)δ168.7,168.6,167.2,133.9,133.4,131.5,130.2,129.5,129.5,128.8,94.8,78.9,65.7,63.8,63.7,47.0,32.7,29.0,26.5.
[0383]
11
b nmr(160mhz,cd3cn)δ10.17.
[0384]
esi-ms:calculated c
21h26
bcl3n2o9s[m+na]
+
,621.0410;found 621.0413.
[0385]
实施例33化合物5bo的合成
[0386]
向反应管中依次加入(e)-2-(5-(4-(tert-butyl)phenyl)-4-methylpent-2-en-1-yl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),三氯乙基磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩
气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为淡黄色固体,收率为67%。
[0387]
化合物5bo为:
[0388]
2,2,2-trichloroethyl(e)-(5-(4-(tert-butyl)phenyl)-4-methyl-1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)pent-2-en-1-yl)sulfamate,其结构如下所示:
[0389][0390]
对化合物5bo进行核磁共振和高分辨表征,其结果如下:
[0391]1h nmr(400mhz,乙腈-d3)δ7.39
–
7.28(m,2h),7.22
–
7.10(m,2h),6.00(dd,j=14.0,8.8hz,1h),5.77
–
5.60(m,1h),5.55
–
5.42(m,1h),4.72
–
4.33(m,2h),4.03
–
3.39(m,5h),2.94(s,3h),2.74
–
2.58(m,1h),2.58
–
2.41(m,2h),1.29(s,9h),0.96(d,j=6.3hz,3h).
[0392]
13
c nmr(126mhz,cd3cn)δ168.6,168.5,168.4,149.6,149.6,139.6,138.9,138.7,138.6,129.9,129.8,127.0,126.7,126.2,126.1,94.9,94.8,78.9,78.9,63.7,63.7,63.6,63.5,46.9,46.8,43.2,43.1,39.0,38.6,35.0,34.9,31.7,20.3,19.7.
[0393]
esi-ms:calculated c
23h32
bcl3n2o7s[m+na]
+
,619.0981;found 619.0974.
[0394]
实施例34化合物5bp的合成
[0395]
向反应管中依次加入(e)-2-(but-2-en-1-yl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),三氯乙基磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为淡黄色固体,收率为59%。
[0396]
化合物5bp为:
[0397]
2,2,2-trichloroethyl(e)-(1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)but-2-en-1-yl)sulfamate,其结构如下所示:
[0398][0399]
对化合物5bp进行核磁共振和高分辨表征,其结果如下:
[0400]1h nmr(400mhz,乙腈-d3)δ6.02(d,j=9.6hz,1h),5.68(dq,j=15.6,6.4hz,1h),5.53(dd,j=15.4,8.5hz,1h),4.61(q,j=11.1hz,2h),4.00(dd,j=17.1,2.5hz,2h),3.87(dd,j=17.0,3.6hz,2h),3.63(t,j=9.0hz,1h),3.04(s,3h),1.70(d,j=6.3hz,3h).
[0401]
13
c nmr(101mhz,乙腈-d3)δ168.6,129.7,128.8,94.7,78.8,63.8,63.7,47.0,18.2.
[0402]
11
b nmr(160mhz,乙腈-d3)δ10.52.
[0403]
esi-ms:calculated c
11h16
bcl3n2o7s[m+na]
+
,458.9729;found 458.9726.
[0404]
实施例35化合物5bq的合成
[0405]
向反应管中依次加入tert-butyl(e)-5-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)pent-3-enoate(0.2mmol,1.0equiv),三氯乙基磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为淡黄色固体,收率为58%。
[0406]
化合物5bq为:
[0407]
tert-butyl(e)-5-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)-5-(((2,2,2-trichloroethoxy)sulfonyl)amino)pent-3-enoate,其结构如下所示:
[0408][0409]
对化合物5bq进行核磁共振和高分辨表征,其结果如下:
[0410]1h nmr(400mhz,乙腈-d3)δ6.20(d,j=9.4hz,1h),5.73(dt,j=15.9,6.5hz,1h),5.68
–
5.57(m,1h),4.68(d,j=1.3hz,2h),4.07
–
3.96(m,2h),3.89(ddd,j=17.0,5.1,1.3hz,2h),3.70(t,j=8.6hz,1h),3.05(s,3h),3.00(d,j=6.5hz,2h),1.43(d,j=1.3hz,9h).
[0411]
13
c nmr(126mhz,cd3cn)δ171.9,168.6,168.6,132.2,125.7,94.9,81.3,78.9,63.8,63.7,47.0,39.3,28.3,28.3.
[0412]
11
b nmr(128mhz,cd3cn)δ10.09.
[0413]
esi-ms:calculated c
16h24
bcl3n2o9s[m+na]
+
,559.0253;found 559.0252.
[0414]
实施例36化合物5br的合成
[0415]
向反应管中依次加入tert-butyl(e)-4-(5-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)pent-3-en-1-yl)piperidine-1-carboxylate
(0.2mmol,1.0equiv),三氯乙基磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为淡黄色固体,收率为62%。
[0416]
化合物5br为:
[0417]
tert-butyl(e)-4-(5-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)-5-(((2,2,2-trichloroethoxy)sulfonyl)amino)pent-3-en-1-yl)piperidine-1-carboxylate,其结构如下所示:
[0418][0419]
对化合物5br进行核磁共振和高分辨表征,其结果如下:
[0420]1h nmr(400mhz,乙腈-d3)δ6.03(d,j=9.4hz,1h),5.67(dt,j=14.1,6.5hz,1h),5.52(dd,j=15.6,8.3hz,1h),4.63(qd,j=11.3,1.4hz,2h),4.05
–
3.93(m,4h),3.87(dt,j=17.0,2.0hz,2h),3.64(t,j=8.8hz,1h),3.04(s,3h),2.77
–
2.58(m,2h),2.09(q,j=7.4hz,2h),1.65(d,j=13.1hz,2h),1.41(s,9h),1.31(dt,j=13.2,6.7hz,3h),1.04
–
0.97(m,2h).
[0421]
13
c nmr(101mhz,cd3cn)δ168.6,155.5,133.8,128.6,94.8,79.5,78.9,63.8,63.7,47.0,36.6,36.1,33.0,32.8,30.2,28.6.
[0422]
esi-ms:calculated c
22h35
bcl3n3o9s[m+na]
+
,656.1145;found 656.1141.
[0423]
实施例37化合物5bs的合成
[0424]
向反应管中依次加入ethyl(e)-7-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)hept-5-enoate
[0425]
(0.2mmol,1.0equiv),三氯乙基磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为白色固体,收率为82%。
[0426]
化合物5bs为:
[0427]
ethyl(e)-7-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)-7-(((2,2,2-trichloroethoxy)sulfonyl)amino)hept-5-enoate,其结构如下所示:
[0428][0429]
对化合物5bs进行核磁共振和高分辨表征,其结果如下:
[0430]1h nmr(400mhz,乙腈-d3)δ6.07(d,j=9.4hz,1h),5.70
–
5.59(m,1h),5.54(ddt,j=15.5,8.1,1.3hz,1h),4.70
–
4.57(m,2h),4.07(q,j=7.1hz,2h),4.02(dd,j=17.1,2.3hz,2h),3.87(dd,j=17.0,4.5hz,2h),3.66(t,j=8.7hz,1h),3.05(s,3h),2.28(t,j=7.6hz,2h),2.08(qd,j=7.1,2.7hz,3h),1.70
–
1.63(m,2h),1.20(t,j=7.1hz,3h).
[0431]
13
c nmr(126mhz,cd3cn)δ174.2,168.7,168.6,132.7,129.3,94.8,78.9,63.8,63.7,60.9,47.0,34.2,32.4,25.3,14.6.
[0432]
11
b nmr(128mhz,cd3cn)δ10.18.
[0433]
esi-ms:calculated c
16h24
bcl3n2o9s[m+na]
+
,559.0253;found 559.0252.
[0434]
实施例38化合物5bt的合成
[0435]
向反应管中依次加入(e)-2-(3-cyclopentylallyl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),三氯乙基磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为白色固体,收率为81%。
[0436]
化合物5bt为:
[0437]
2,2,2-trichloroethyl(e)-(3-cyclopentyl-1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)allyl)sulfamate,其结构如下所示:
[0438][0439]
对化合物5bt进行核磁共振和高分辨表征,其结果如下:
[0440]1h nmr(400mhz,乙腈-d3)δ5.93(d,j=9.3hz,1h),5.59(ddd,j=15.5,7.5,0.8hz,1h),5.43(ddd,j=15.5,8.2,1.0hz,1h),4.55(q,j=11.2hz,2h),3.93(dd,j=17.0,2.7hz,2h),3.77(dd,j=17.0,1.4hz,2h),3.55(t,j=8.8hz,1h),2.96(s,3h),2.48
–
2.29(m,1h),1.77
–
1.64(m,2h),1.64
–
1.53(m,2h),1.48(ddt,j=7.6,4.3,2.1hz,2h),1.27
–
1.16(m,2h).
[0441]
13
c nmr(101mhz,cd3cn)δ168.6,168.6,138.3,126.7,94.9,79.0,63.8,63.7,
46.9,44.0,33.7,33.7,25.8,25.8.
[0442]
11
b nmr(128mhz,cd3cn)δ10.2.
[0443]
esi-ms:calculated c
15h22
bcl3n2o7s[m+na]
+
,513.0199;found 513.0205.
[0444]
实施例39化合物5bu的合成
[0445]
向反应管中依次加入(e)-2-(9-(benzyloxy)non-2-en-1-yl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),三氯乙基磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为白色固体,收率为78%。
[0446]
化合物5bu为:
[0447]
2,2,2-trichloroethyl(e)-(9-(benzyloxy)-1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)non-2-en-1-yl)sulfamate,其结构如下所示:
[0448][0449]
对化合物5bu进行核磁共振和高分辨表征,其结果如下:
[0450]1h nmr(400mhz,乙腈-d3)δ7.45
–
7.18(m,5h),6.02(d,j=9.4hz,1h),5.75
–
5.62(m,1h),5.52(ddt,j=15.5,8.3,1.4hz,1h),4.62(q,j=11.2hz,2h),4.46(s,2h),4.00(dd,j=17.1,3.8hz,2h),3.86(dd,j=17.1,1.1hz,2h),3.64(t,j=8.8hz,1h),3.45(t,j=6.5hz,2h),3.03(s,3h),2.11
–
1.99(m,2h),1.57(t,j=6.8hz,2h),1.43
–
1.29(m,4h).
[0451]
13
c nmr(101mhz,cd3cn)δ168.6,168.6,140.2,133.9,129.3,128.6,128.4,128.3,94.8,78.9,73.2,71.0,63.8,63.7,47.0,33.1,30.3,29.8,26.6.
[0452]
11
b nmr(128mhz,cd3cn)δ10.6.
[0453]
esi-ms:calculated c
22h30
bcl3n2o8s[m+na]
+
,621.0776;found 621.0776.
[0454]
实施例40化合物5ca的合成
[0455]
向反应管中依次加入(e)-2-(1-cyclopropylhex-2-en-1-yl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),三氯乙基磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为淡黄色
固体,收率为65%。
[0456]
化合物5ca为:
[0457]
2,2,2-trichloroethyl(e)-(1-cyclopropyl-1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)hex-2-en-1-yl)sulfamate,其结构如下所示:
[0458][0459]
对化合物5ca进行核磁共振和高分辨表征,其结果如下:
[0460]1h nmr(400mhz,乙腈-d3)δ5.81(dt,j=14.6,6.8hz,1h),5.66(s,1h),5.56(d,j=15.8hz,1h),4.80
–
4.66(m,2h),3.99(d,j=16.4hz,2h),3.83(dd,j=47.0,17.0hz,2h),3.12(s,3h),2.04(q,j=7.2hz,3h),1.43
–
1.31(m,3h),0.89(t,j=7.4hz,4h),0.59
–
0.52(m,2h),0.52
–
0.41(m,2h).
[0461]
13
c nmr(126mhz,cd3cn)δ168.8,168.4,133.4,128.1,94.9,78.7,64.3,64.0,47.5,35.7,23.3,16.1,14.0,2.9,2.1.
[0462]
11
b nmr(160mhz,cd3cn)δ10.34.
[0463]
esi-ms:calculated c
16h24
bcl3n2o7s[m+na]
+
,527.0355;found 527.0360.
[0464]
实施例41化合物5cb的合成
[0465]
向反应管中依次加入(e)-6-methyl-2-(pent-3-en-2-yl)-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),三氯乙基磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为白色固体,收率为69%。
[0466]
化合物5cb为:
[0467]
2,2,2-trichloroethyl(e)-(2-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)pent-3-en-2-yl)sulfamate,其结构如下所示:
[0468][0469]
对化合物5cb进行核磁共振和高分辨表征,其结果如下:
[0470]1h nmr(500mhz,)δ5.91(d,j=15.8hz,1h),5.83(s,1h),5.57
–
5.42(m,1h),4.67(d,j=1.7hz,2h),3.99(dd,j=17.0,8.6hz,2h),3.79(dd,j=74.6,17.1hz,2h),3.08(s,
3h),1.69(d,j=6.3hz,3h),1.52(s,3h).
[0471]
13
c nmr(126mhz,none)δ169.0,168.1,133.7,126.3,94.8,78.7,64.3,64.0,47.4,22.1,18.4.
[0472]
11
b nmr(128mhz,cd3cn)δ10.17.
[0473]
esi-ms:calculated c
12h18
bcl3n2o7s[m+na]
+
,472.9886;found 472.9887.
[0474]
实施例42化合物5cc的合成
[0475]
向反应管中依次加入(e)-6-methyl-2-(oct-2-en-4-yl)-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),三氯乙基磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为白色固体,收率为76%。
[0476]
化合物5cc为:
[0477]
2,2,2-trichloroethyl(e)-(4-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)oct-2-en-4-yl)sulfamate,其结构如下所示:
[0478][0479]
对化合物5cc进行核磁共振和高分辨表征,其结果如下:
[0480]1h nmr(400mhz,乙腈-d3)δ6.03(d,j=16.0hz,1h),5.77(s,1h),5.47(dq,j=16.0,6.4hz,1h),4.69(s,2h),3.94(dd,j=17.0,5.5hz,2h),3.82(d,j=17.4hz,1h),3.63(d,j=16.6hz,1h),3.09(s,3h),1.92
–
1.78(m,2h),1.68(d,j=6.5hz,3h),1.51
–
1.39(m,2h),1.35
–
1.28(m,2h),0.93(t,j=7.3hz,3h).
[0481]
13
c nmr(101mhz,cd3cn)δ169.3,168.0,133.7,126.2,94.9,78.6,64.1,63.9,47.3,37.8,27.2,24.1,18.7,14.5.
[0482]
11
b nmr(128mhz,cd3cn)δ10.05.
[0483]
esi-ms:calculated c
15h24
bcl3n2o7s[m+na]
+
,515.0355;found 515.0353.
[0484]
实施例43化合物5cd的合成
[0485]
向反应管中依次加入(e)-6-methyl-2-(oct-4-en-3-yl)-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),三氯乙基磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。
待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为淡黄色固体,收率为84%。
[0486]
化合物5cd为:
[0487]
2,2,2-trichloroethyl(e)-(3-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)oct-4-en-3-yl)sulfamate,其结构如下所示:
[0488][0489]
对化合物5cd进行核磁共振和高分辨表征,其结果如下:
[0490]1h nmr(500mhz,乙腈-d3)δ6.02(dt,j=16.0,1.5hz,1h),5.80(s,1h),5.47(dt,j=16.0,6.8hz,1h),4.72
–
4.67(m,2h),3.94(dd,j=17.0,10.6hz,2h),3.87
–
3.61(m,2h),3.10(s,3h),2.05
–
1.87(m,5h),1.40
–
1.28(m,2h),1.01(t,j=7.5hz,3h),0.88(t,j=7.4hz,3h).
[0491]
13
c nmr(126mhz,cd3cn)δ169.3,168.0,132.5,131.7,94.9,78.6,64.0,64.0,47.4,35.9,30.5,23.1,14.1,9.4.
[0492]
11
b nmr(160mhz,cd3cn)δ10.24.
[0493]
esi-ms:calculated c
15h24
bcl3n2o7s[m+na]
+
,515.0355;found 515.0353.
[0494]
实施例44化合物5ce的合成
[0495]
向反应管中依次加入(e)-2-(1-cyclohexylhex-2-en-1-yl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),三氯乙基磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为白色固体,收率为78%。
[0496]
化合物5ce为:
[0497]
2,2,2-trichloroethyl(e)-(1-cyclohexyl-1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)hex-2-en-1-yl)sulfamate,其结构如下所示:
[0498][0499]
对化合物5ce进行核磁共振和高分辨表征,其结果如下:
[0500]1h nmr(400mhz,乙腈-d3)δ6.02(dt,j=16.3,1.5hz,1h),5.57(s,1h),5.43(dt,j
=16.3,6.8hz,1h),4.79
–
4.66(m,2h),3.91(dd,j=17.0,5.5hz,2h),3.87
–
3.58(m,2h),3.12(s,3h),2.06
–
1.99(m,2h),1.93
–
1.71(m,4h),1.66
–
1.59(m,1h),1.43
–
1.11(m,8h),0.89(t,j=7.3hz,3h).
[0501]
13
c nmr(101mhz,cd3cn)δ169.2,168.3,130.9,129.9,94.9,78.6,64.2,64.0,47.8,46.5,36.0,29.3,28.4,27.9,27.7,27.4,23.1,14.1.
[0502]
11
b nmr(128mhz,cd3cn)δ10.10.
[0503]
esi-ms:calculated c
19h30
bcl3n2o7s[m+na]
+
,569.0825;found 569.0820.
[0504]
实施例45化合物5cf的合成
[0505]
向反应管中依次加入(e)-6-methyl-2-(1-phenylhept-3-en-2-yl)-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),三氯乙基磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为白色固体,收率为81%。
[0506]
化合物5cf为:
[0507]
2,2,2-trichloroethyl(e)-(2-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)-1-phenylhept-3-en-2-yl)sulfamate,其结构如下所示:
[0508][0509]
对化合物5cf进行核磁共振和高分辨表征,其结果如下:
[0510]1h nmr(400mhz,乙腈-d3)δ7.42
–
7.32(m,2h),7.32
–
7.17(m,3h),6.08(dt,j=16.0,1.6hz,1h),5.61(dt,j=16.0,6.8hz,1h),5.34(s,1h),4.83
–
4.67(m,2h),4.01
–
3.86(m,2h),3.73(dd,j=38.1,17.1hz,2h),3.33
–
3.13(m,2h),3.11(s,3h),2.05(q,j=7.1,hz,2h),1.40
–
1.34(m,2h),0.89(t,j=7.3hz,3h).
[0511]
13
c nmr(101mhz,cd3cn)δ169.2,168.1,138.2,132.5,132.5,131.4,128.5,127.3,94.8,78.7,64.3,64.2,47.5,43.2,36.0,23.1,14.1.
[0512]
11
b nmr(160mhz,cd3cn)δ10.07.
[0513]
esi-ms:calculated c
20h26
bcl3n2o7s[m+na]
+
,577.0512;found 577.0520.
[0514]
实施例46化合物5cg的合成
[0515]
向反应管中依次加入(e)-2-(1-cyclopentylbut-2-en-1-yl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),三氯乙基磺酸胺
(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为淡黄色固体,收率为78%。
[0516]
化合物5cg为:
[0517]
2,2,2-trichloroethyl(e)-(1-cyclopentyl-1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)but-2-en-1-yl)sulfamate,其结构如下所示:
[0518][0519]
对化合物5cg进行核磁共振和高分辨表征,其结果如下:
[0520]1h nmr(400mhz,乙腈-d3)δ6.08(dd,j=16.0,1.9hz,1h),5.65(s,1h),5.51(dq,j=16.0,6.4hz,1h),4.79
–
4.66(m,2h),3.93(dd,j=17.0,2.8hz,2h),3.72(dd,j=80.3,17.0hz,3h),3.12(s,3h),2.48(ddd,j=17.3,10.0,7.2hz,1h),1.68(dd,j=6.5,1.6hz,7h),1.59
–
1.39(m,5h).
[0521]
13
c nmr(101mhz,cd3cn)δ169.3,168.1,131.2,126.3,94.9,78.6,64.3,64.1,47.7,28.4,27.9,25.5,25.1,18.9.
[0522]
11
b nmr(128mhz,cd3cn)δ10.0.
[0523]
esi-ms:calculated c
16h24
bcl3n2o7s[m+na]
+
,527.0355;found 527.0353.
[0524]
实施例47化合物5ch的合成
[0525]
向反应管中依次加入(e)-6-methyl-2-(6-methylhept-2-en-4-yl)-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),三氯乙基磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为白色固体,收率为73%。
[0526]
化合物5ch为:
[0527]
2,2,2-trichloroethyl(e)-(6-methyl-4-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)hept-2-en-4-yl)sulfamate,其结构如下所示:
[0528]
[0529]
对化合物5ch进行核磁共振和高分辨表征,其结果如下:
[0530]1h nmr(500mhz,乙腈-d3)δ6.03(dd,j=16.0,1.7hz,1h),5.83(s,1h),5.47(dq,j=15.9,6.5hz,1h),4.75
–
4.65(m,2h),3.94(dd,j=17.1,2.1hz,2h),3.72(dd,j=103.7,17.0hz,2h),3.11(s,3h),2.04
–
1.96(m,1h),1.88
–
1.73(m,2h),1.67(dd,j=6.4,1.7hz,3h),1.00(d,j=6.6hz,3h),0.96(d,j=6.6hz,3h).
[0531]
13
c nmr(126mhz,cd3cn)δ169.4,168.1,133.6,126.4,94.9,78.6,64.2,64.0,47.4,46.3,25.6,25.0,24.7,18.8.
[0532]
11
b nmr(128mhz,cd3cn)δ10.1.
[0533]
esi-ms:calculated c
15h24
bcl3n2o7s[m+na]
+
,515.0355;found 515.0360.
[0534]
实施例48化合物5da的合成
[0535]
向反应管中依次加入2-((e)-hex-2-en-1-yl)-6-((1r,2r,3r,5s)-2,6,6-trimethylbicyclo[3.1.1]heptan-3-yl)-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),三氯乙基磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为白色固体,收率为68%。
[0536]
化合物5da为:
[0537]
2,2,2-trichloroethyl((e)-1-(4,8-dioxo-6-((1r,2r,3r,5s)-2,6,6-trimethylbicyclo[3.1.1]heptan-3-yl)-1,3,6,2-dioxazaborocan-2-yl)hex-2-en-1-yl)sulfamate,其结构如下所示:
[0538][0539]
对化合物5da进行核磁共振和高分辨表征,其结果如下:
[0540]1h nmr(500mhz,乙腈-d3)δ6.25(d,j=10.5hz,1h),5.77
–
5.66(m,1h),5.54(ddt,j=15.5,8.3,1.5hz,1h),4.73
–
4.58(m,3h),4.24
–
4.18(m,2h),,3.98(d,j=2.6hz,2h),3.81(d,j=18.0hz,1h),3.78
–
3.72(m,1h),2.76
–
2.66(m,1h),2.41(ddd,j=11.4,6.0,2.1hz,1h),2.28(d,j=2.4hz,1h),2.10
–
2.02(m,2h),2.00(ddd,j=8.9,5.6,2.2hz,1h),1.90(td,j=6.0,2.4hz,1h),1.61(ddd,j=14.8,5.8,2.8hz,1h),1.44
–
1.38(m,2h),1.28(d,j=6.9hz,3h),1.24(s,3h),1.01(s,3h),0.91(t,j=7.4hz,3h).
[0541]
13
c nmr(126mhz,cd3cn)δ169.7,167.2,133.2,128.0,94.3,78.7,67.8,62.1,
56.3,49.5,41.3,39.3,38.8,34.8,31.5,30.7,27.1,23.2,23.1,22.7,13.6.
[0542]
11
b nmr(160mhz,cd3cn)δ10.7.
[0543]
esi-ms:calculated c
22h34
bcl3n2o7s[m+na]
+
,609.1138;found 609.1143.
[0544]
实施例49化合物5ea的合成
[0545]
向反应管中依次加入(e)-2-(hex-2-en-1-yl)-5,5,6,7,7-pentamethyl-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),三氯乙基磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为白色固体,收率为68%。
[0546]
化合物5ea为:
[0547]
2,2,2-trichloroethyl(e)-(1-(5,5,6,7,7-pentamethyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)hex-2-en-1-yl)sulfamate,其结构如下所示:
[0548][0549]
对化合物5ea进行核磁共振和高分辨表征,其结果如下:
[0550]1h nmr(400mhz,乙腈-d3)δ5.95(d,j=9.5hz,1h),5.66(dt,j=15.5,6.6hz,1h),5.57
–
5.49(m,1h),4.66
–
4.56(m,2h),3.65(t,j=8.9hz,1h),2.71(s,3h),2.02(q,j=6.8hz,2h),1.66(d,j=16.8hz,6h),1.59(d,j=14.4hz,6h),1.40(qd,j=7.4,3.7hz,2h),0.91(t,j=7.3hz,3h).
[0551]
13
c nmr(126mhz,cd3cn)δ174.6,174.6,132.8,128.9,94.4,78.4,37.2,34.8,30.5,22.7,13.6.
[0552]
11
b nmr(128mhz,cd3cn)δ8.0.
[0553]
esi-ms:calculated c
17h28
bcl3n2o7s[m+na]
+
,543.0668;found 543.066.
[0554]
实施例50化合物6a的合成
[0555]
向反应管中依次加入2-(cyclohex-2-en-1-yl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),三氯乙基磺酸胺(0.4mmol,2.0equiv),硒催化剂(0.05mmol,0.25equiv),碘苯二乙酸(1.0mmol,5.0equiv),2.0ml二氯甲烷溶剂。将反应管密封,通入氩气,反应液在35℃下搅拌发生反应。待反应结束
后反应液用乙酸乙酯稀释,真空旋干溶剂,用硅胶柱层析纯化得产品,为白色固体,收率为73%。
[0556]
化合物6a为:
[0557]
2,2,2-trichloroethyl(1-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)cyclohex-2-en-1-yl)sulfamate,其结构如下所示:
[0558][0559]
对化合物6a进行核磁共振和高分辨表征,其结果如下:
[0560]1h nmr(400mhz,乙腈-d3)δ5.98(dt,j=10.2,3.6hz,2h),5.90(dt,j=10.3,2.0hz,1h),5.74(s,1h),4.68(d,j=1.7hz,2h),4.00(dd,j=17.0,5.7hz,2h),3.88(dd,j=17.1,8.7hz,2h),3.11(s,3h),2.12
–
2.02(m,2h),1.93
–
1.85(m,2h),1.83
–
1.74(m,2h).
[0561]
13
c nmr(126mhz,none)δ168.9,168.1,133.1,126.4,94.9,78.8,64.5,63.8,47.6,32.4,25.0,18.9.
[0562]
11
b nmr(128mhz,cd3cn)δ10.16.
[0563]
esi-ms:calculated c
13h18
bcl3n2o7s[m+na]
+
,484.9886;found 484.9879.对比例1
[0564]
本对比例根据文献报道,采用催化剂[cp*ircl2]2、agbf4催化与对甲苯磺酰叠氮tsn3的反应,具体步骤如下:
[0565]
向耐压管中依次加入(e)-2-(hept-2-en-1-yl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),tsn3(0.4mmol,2.0equiv),[cp*ircl2]2(0.03mmol,15mol%),agbf4(0.12mmol,60mol%),lioac(0.2mmol,1.0equiv)。在手套箱内加入1.0ml乙酸乙酯溶剂,搅拌1分钟,将耐压管用螺口塞密封,反应液在35℃下搅拌发生反应。12小时后监测反应,结果显示并不发生反应。
[0566][0567]
对比例2
[0568]
本对比例根据文献报道,采用催化剂[cp*ircl2]2、agbf4催化
dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),tsnh2(0.4mmol,2.0equiv),agotf(0.02mmol,10mol%),三吡啶tpy(0.024mmol,12mol%),亚碘酰苯phio(0.24mmol,1.2equiv)。在手套箱内加入1.0ml乙酸乙酯溶剂,搅拌1分钟,将耐压管用螺口塞密封,反应液在常温下搅拌发生反应。12小时后监测反应,结果显示并不发生反应。
[0578][0579]
对比例5
[0580]
本对比例根据文献报道,采用催化剂[rhcp*(mecn)3]、agsbf6催化与的反应,具体步骤如下:
[0581]
向耐压管中依次加入(e)-2-(hept-2-en-1-yl)-6-methyl-1,3,6,2-dioxazaborocane-4,8-dione(0.2mmol,1.0equiv),(0.4mmol,2.0equiv),[rhcp*(mecn)3](0.01mmol,5mol%),agsbf6(0.06mmol,30mol%),csoac(0.01mmol,5mol%)。在手套箱内加入1.0ml乙酸乙酯溶剂,搅拌1分钟,将耐压管用螺口塞密封,反应液在40℃下搅拌发生反应。12小时后监测反应,结果显示并不发生反应。
[0582][0583]
对比例6
[0584]
本对比例与实施例1的主要区别在于:将氧化剂碘苯二乙酸替换为过氧化氢、mcpba(间氯过氧苯甲酸)、dmp(邻苯二甲酸二甲酯)、pcc(氯铬酸吡啶盐)、kmno4、或tbhp(叔丁基过氧化氢),结果显示并不发生反应。
[0585][0586]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,
均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1