一株耐盐的小红酵母及其应用
1.本发明属于微生物技术领域,具体涉及一株分离自海洋环境的耐盐的小红酵母及其应用。
背景技术:
2.高盐有机废水是指无机盐质量浓度大于1%的废水,广泛产生在食品、发酵、酿造、制药等行业,由于其含有的高盐分及有机物质对微生物生长存在一定的抑制,因此是目前较难处理的加工业废水之一。
3.目前高盐有机废水的处理方法主要有物化处理和生物处理,其中,物化处理法所需的设备投资较大且运行成本高,操作要求苛刻,且除盐后产生的固废浓缩物还需进一步处理,只是污染物的转移,没有从根本上解决高盐有机废水的处理问题。相比于物化处理法,生物处理法的处理成本低,对环境友好,经微生物驯化处理后,使其能够适应高盐环境,减少高有机物浓度和有害因子对使用菌种的抑制效应,可以获得理想的高盐有机废水处理效果。
4.海洋红酵母含有丰富的类胡萝卜、不饱和油脂、氨基酸、虾青素、维生素、矿物质和消化酶等营养成分,细胞大小在4-6微米之间,满足天然生境中适宜饵料粒径4-20微米的要求,可代替单胞藻等传统饵料用于海水养殖的幼体开口饵料和整个幼体时期的补充性饵料,在水产养殖方面需求较大,是生态养殖所需的天然健康的微生态活菌制剂。以高盐有机废水为基料,发酵培养海洋红酵母生产活菌制剂同时,还能起到有机废水治理的环保效果。
技术实现要素:
5.本发明的目的在于克服上述已有技术的不足通过筛选获得一株耐盐的海洋红酵母,经过鉴定,确定所筛选的菌株为小红酵母。
6.本发明提供的技术方案如下:一株耐盐的小红酵母,其特征在于,分类命名为小红酵母rhodotorula minuta,其保藏名称为:h117,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no. 23606,保藏时间为2021年10月14日,保藏地址为中国北京。
7.本发明的另一个目的是该耐盐的小红酵母在高盐有机废水的生物处理中的应用。
8.本发明的另一个目的是该耐盐的小红酵母在制备小红酵母活菌制剂中的应用。
9.本发明的小红酵母h117,分离自有机质丰富的近海海底污泥,在wl营养琼脂培养基上生长菌落为土红色菌落,呈圆形,表面光滑湿润,中部隆起,菌落边缘整齐,且颜色均一;显微镜观察菌体细胞形态为卵圆形,为多边芽殖。
10.本发明的小红酵母h117,在0—15%(m/v)的盐浓度下均可正常生长繁殖,尤其是在1—8%(m/v)的盐浓度下生长最佳。小红酵母h117对营养要求简单,易于培养,在麦芽汁培养基、马铃薯葡萄糖培养基(pda)、酵母浸出粉胨葡萄糖培养基(ypd)、wl营养琼脂培养基、虎红培养基上生长良好,在ph 为4—8和温度为20—35℃的区间内都能正常培养。
11.本发明的有益效果是:本发明为来自自然生境的小红酵母,经驯化后能耐受高盐浓度,培养要求简单,发酵过程易控制,营养需求低,该菌株在高盐有机废水的生物处理同时,还可以制备小红酵母活菌制剂。
附图说明
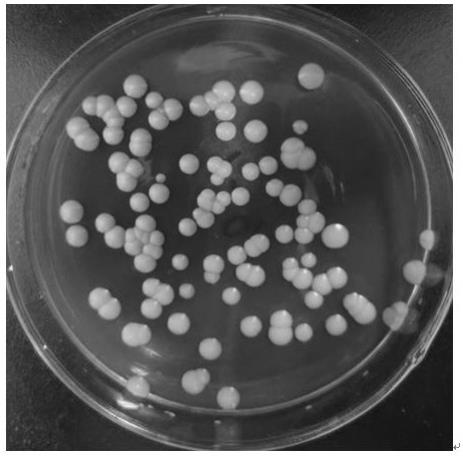
12.图1为小红酵母h117在wl营养琼脂培养基上的生长特征图;图2为小红酵母h117的显微镜形态观察特征图。
具体实施方式
13.下面对本发明的实施例作详细说明,本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
14.实施例1:小红酵母h117的筛选鉴定海洋红酵母的筛选:取山东省烟台市近海的有机质丰富的活性污泥5g,加入事先灭菌处理的装有500ml海水的三角烧瓶,振摇5min后,梯度稀释后涂布于wl营养琼脂培养基,在28℃和160 r/min的条件下培养4天,挑取菌落表面光滑湿润、颜色为土红色的菌株,在wl营养琼脂培养基平板上经多次划线分纯,获得菌种纯培养。所述的wl营养琼脂培养基(g/l):葡萄糖50,蛋白胨5,酵母粉5,氯化钾0.425,氯化钙0.125,磷酸二氢钾0.55,氯化铁0.0025,硫酸锰0.0025,硫酸镁0.125,氯霉素0.1,溴甲酚绿0.022,琼脂粉20,用陈海水配制,ph6.5。
15.海洋红酵母h117的菌属鉴定:形态特征:如图1所示,海洋红酵母h117在wl营养琼脂培养基上生长菌落为土红色菌落,呈圆形,表面光滑湿润,中部隆起,菌落边缘整齐,且颜色均一。如图2所示,显微镜观察菌体细胞形态为卵圆形,为多边芽殖。
16.通过微生物全自动分析仪进行生理生化鉴定,测试鉴定的结果如表1所示,符合海洋红酵母的生理生化特征,初步判定为小红酵母。
17.表1 海洋红酵母h117的生理生化鉴定结果(
“‑”
阴性;“+”阳性)
采用ctab法提取海洋红酵母h117的基因组dna,以26s rdna d1/d2 区域序列扩增的通用引物对进行扩增,扩增程序为: 94℃ 10 min; 94℃ 30 s, 50℃ 30 s, 72℃ 1 min,35个循环; 72℃ 10 min。pcr产物经琼脂糖凝胶电泳,由pcr产物电泳结果切割所需dna目的条带,利用凝胶回收试剂盒回收后测序获得的其基因序列长度为633bp,经blast比对分析,发现该菌株与rhodotorula minuta的26s rdna序列高度相似,判定为同一种。
18.结合形态学、生理生化指标和分子鉴定结果,确定海洋红酵母h117为小红酵母rhodotorula minuta。
19.具体基因序列见序列表。
20.实施例2:小红酵母h117的耐盐试验将保藏在斜面的小红酵母h117菌种挑取1环,接种到已灭菌的活化培养基中培养活化,28℃和160r/min条件下培养,至菌体浑浊后备用。活化培养基(m/v)为: 酵母浸粉0.5%,蛋白胨1%,葡萄糖1%,蒸馏水配制。
21.发酵培养基采用ypd发酵培养基,按质量百分比:2%葡萄糖、1%酵母粉和2%蛋白胨,分别采用3%(m/v)、6%(m/v)、9%(m/v)、12%(m/v)、15%(m/v)、18%(m/v)、21%(m/v)的nacl溶液配制,分别制成3%(m/v)盐浓度、6%(m/v)盐浓度、9%(m/v)盐浓度、12%(m/v)盐浓度、15%(m/v)盐浓度、18%(m/v)盐浓度、21%(m/v)盐浓度的发酵培养基。
22.将活化种子按1%(v/v)的接种量分别接入3%(m/v)盐浓度、6%(m/v)盐浓度、9%(m/v)盐浓度、12%(m/v)盐浓度、15%(m/v)盐浓度、18%(m/v)盐浓度、21%(m/v)盐浓度的发酵培养基,28℃和160r/min条件下分别培养3天。发酵液经稀释涂布于wl营养琼脂培养基,28℃条件下培养3天后,菌落计数,其结果如表2所示。小红酵母h117在3—9%(m/v)的盐浓度下均生长良好,不受盐浓度的抑制,为中度嗜盐菌。当盐浓度大于9%(m/v)时,菌体生长收到抑制,随着盐浓度加大,活菌数呈现降低趋势。总体来看,小红酵母h117的耐盐效果好,在21%(m/v)的盐浓度下虽然增殖较慢,但仍能生长,活菌数为1.5
×
10
6 cfu/ml。
23.表2 小红酵母h117的耐盐试验结果
实施例3:小红酵母h117的耐盐驯化将保藏在斜面的小红酵母h117菌种挑取1环,接种到已灭菌的活化培养基中培养活化,在28℃和160r/min条件下培养至菌体浑浊后备用。活化培养基(m/v)为: 酵母浸粉0.5%,蛋白胨1%,葡萄糖1%,9%(m/v)的nacl溶液配制。
24.步骤1:将活化种子按1%(v/v)的接种量接入实施例2所述的9%(m/v)盐浓度的发酵培养基,28℃和160r/min条件下培养3天,培养后的发酵液作为种子液,按照1%(v/v)的接种量再接入9%(m/v)盐浓度的发酵培养基,在28℃和160r/min条件下培养3天;培养后的发酵液再作为种子液,按照1%(v/v)的接种量再接入9%(m/v)盐浓度的发酵培养基,在28℃和160r/min条件下继续培养3天。
25.步骤2:步骤1中在9%(m/v)盐浓度的发酵培养基中培养后的小红酵母h117菌液,作为种子液,按照1%(v/v)的接种量再接入12%(m/v)盐浓度的发酵培养基,在28℃和160r/min条件下培养3天。培养后的发酵液再作为种子液,按照1%(v/v)的接种量再接入12%(m/v)盐浓度的发酵培养基,在28℃和160r/min条件下培养3天;培养后的发酵液再作为种子液,按照1%(v/v)的接种量再接入12%(m/v)盐浓度的发酵培养基,在28℃和160r/min条件下继续培养3天。
26.培养后的菌液,经稀释涂布于wl营养琼脂培养基平板上培养计数,其活菌数为9.3
×
10
9 cfu/ml,表明小红酵母h117经耐盐驯化后,在12%(m/v)盐浓度下生长良好,耐盐能力得到增强。
27.步骤3:步骤2中在12%(m/v)盐浓度的发酵培养基中培养后的小红酵母h117菌液,作为种子液,按照1%(v/v)的接种量再接入15%(m/v)盐浓度的发酵培养基,在28℃和160r/min条件下培养3天。培养后的发酵液作为种子液,再按照1%(v/v)的接种量再接入15%(m/v)盐浓度的发酵培养基,在28℃和160r/min条件下培养3天;培养后的发酵液再作为种子液,按照1%(v/v)的接种量再接入15%(m/v)盐浓度的发酵培养基,在28℃和160r/min条件下继续培养3天。
28.培养后的菌液,经稀释涂布于wl营养琼脂培养基平板上培养计数,其活菌数为3.2
×
10
9 cfu/ml,表明小红酵母h117经耐盐驯化后,在15%(m/v)盐浓度下生长良好,耐盐能力进一步增强。
29.实施例4:小红酵母h117在酱油酿造产生的有机废水中培养将保藏在斜面的小红酵母h117菌种挑取1环,接种到已灭菌的活化培养基中培养活化,28℃和160r/min条件下培养,至菌体浑浊后备用。活化培养基(m/v)为: 酵母浸粉
0.5%,蛋白胨1%,葡萄糖1%,蒸馏水配制。
30.(1)活化种子液按照10%(v/v)接种量接入盐度为14.6%(m/v)的酱油酿造废水原液,在28℃和160r/min条件下培养6天,发酵后的菌液即为小红酵母h117的活菌制剂。培养后的菌液,经水杨酸法测定废水中氨氮去除率为21.2%,经稀释涂布测定其活菌数为8.9
×
10
8 cfu/ml。
31.(2)活化种子液按照5%(v/v)接种量接入盐度为7.3%(m/v)的稀释后的酱油酿造有机废水,在28℃和160r/min条件下培养6天,发酵后的菌液即为小红酵母h117的活菌制剂。培养后的菌液,经水杨酸法测定废水中氨氮去除率为30.9%,经稀释涂布测定其活菌数为6.5
×
10
9 cfu/ml。
32.(3)活化种子液按照1%(v/v)接种量接入盐度为3.2%(m/v)的稀释后的酱油酿造有机废水,在28℃和160r/min条件下培养6天,发酵后的菌液即为小红酵母h117的活菌制剂。培养后的菌液,经水杨酸法测定废水中氨氮去除率为38.5%,经稀释涂布测定其活菌数为2.7
×
10
9 cfu/ml。
33.应当理解的是,本说明书未详细阐述的部分都属于现有技术。以上的实施例仅仅是对本发明的优选实施方式进行描述,并非对本发明范围进行限定,在不脱离本发明设计精神的前提下,本领域普通工程技术人员对本发明的技术方案作出的各种变形和改进,均应落入本发明的权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1