一种大肠杆菌全局调控因子环腺苷酸受体蛋白突变体、基因工程菌及应用
1.本发明涉及基因工程技术领域,具体涉及一种大肠杆菌全局调控因子环腺苷酸受体蛋白突变体、基因工程菌及应用。
背景技术:
2.木质纤维素生物质是地球上最丰富、最廉价的可再生资源,随着化石燃料等不可再生资源的日益枯竭,可再生资源的开发利用逐渐受到人们的重视,利用生物质资源生产生物基化学品和燃料是当前研究的热点。木质纤维素包括纤维素、半纤维素和木质素,其中利用纤维素生产燃料乙醇研究已经很成熟并有工业化生产实例;木质素由于成分较为复杂,研究较为缓慢,并没有取得重大进展;约占木质纤维素原料5%~30%的半纤维研究正引起人们的广泛关注。半纤维素的主要成分是木聚糖,其经过简单的酸解就能获得木糖,利用木糖生产木糖醇从碳元素利用而言,是原料利用率最高的途径之一。木糖醇是来源于木糖的附加值最高、市场需求最大的化学品。木糖醇是一种五碳糖醇,其甜度与蔗糖相当,热量值却只有其60%左右,木糖醇具有抗龋齿及代谢不依赖胰岛素、改善肝功能等特点,广泛应用于食品、医药和化工行业;2004年美国能源部从300多种候选化学品中筛选出12个最具应用前景的来源于生物质的基础化学品,木糖醇就是其中之一。
3.生物法生产木糖醇相较于化学法具有原料预处理简单、转化效率高、“三废”排放少等优点,已越来越引起人们的兴趣。但是生物法的产业化还存在一些瓶颈,如微生物对半纤维素水解液中的混合糖利用存在相互阻遏的现象,影响混合糖的同步利用;以及未脱毒的玉米芯稀硫酸水解液中含有多种毒性物质,主要包括色素、弱酸以及呋喃衍生物三大类,从而导致细胞生长与生物催化受到抑制。因此,开发木糖转运速率快,且抗逆性强的微生物菌株对于生物法生产木糖醇的产业化应用至关重要。
4.申请人在公开号为cn104789586a的发明专利申请中公开了一种5拷贝木糖还原酶整合于大肠杆菌基因组is5序列上的基因工程菌is5-5,该菌株以纯木糖为底物,采用15-l罐进行补料-分批发酵,100h生产了180.74g/l的木糖醇。
5.申请人在公开号为cn110734479a的发明专利申请中公开了一种将大肠杆菌的环腺苷酸受体蛋白(crp)112位氨基酸i突变为l、127位t突变为g、144位a突变为t获得的基因工程菌is5-5g,该菌株以未经离子交换脱毒的玉米芯水解液为原料,采用15-l罐分批补料进行发酵,78h生产了136.7g/l的木糖醇,生产速率为1.75g/l,木糖醇对木糖的收率为1.0g/g。
6.虽然,is5-5g菌株有效缓解了大肠杆菌对混合糖依次利用的代谢产物阻遏效应(ccr)效应,能够利用未经离子交换脱毒的半纤维素水解液发酵生产木糖醇。然而其发酵周期较长,木糖醇产量和时空产率仍有待提高。
技术实现要素:
7.针对现有技术存在的问题,本发明对大肠杆菌全局调控因子crp进行改造,在消除ccr效应的基础上,进一步提高了工业菌株对纤维素水解液中主要毒性物质的耐受性,克服了对水解液耐受性表型与基因型复杂关系认识的不足,实现了从全局水平上强化工程菌的目标性能。本发明的目的在于提供一种大肠杆菌全局调控因子环腺苷酸受体蛋白突变体、基因工程菌及应用,提供一种大肠杆菌crp突变株的构建方法,以及该突变株在提高对纤维素水解液中主要毒性物质耐受性方面的作用。
8.本发明的技术方案如下:
9.本发明提供了一种大肠杆菌全局调控因子环腺苷酸受体蛋白突变体,氨基酸序列如seq id no.1或seq id no.3所示。
10.氨基酸序列如seq id no.1所示的大肠杆菌全局调控因子环腺苷酸受体蛋白突变体的突变方式为野生型crp 112位氨基酸i突变为l、127位t突变为g、144位a突变为t后,再经过83位氨基酸s突变为h、127位g突变为i、128位s突变为p。氨基酸序列如seq id no.3所示的大肠杆菌全局调控因子环腺苷酸受体蛋白突变体的突变方式为野生型crp 112位氨基酸i突变为l、127位t突变为g、144位a突变为t后,再经过83位氨基酸s突变为h、128位s突变为p。
11.本发明还提供了所述大肠杆菌全局调控因子环腺苷酸受体蛋白突变体的编码基因。
12.优选的,基因序列如seq id no.2或seq id no.4所示。所述野生型crp基因序列如seq id no.5所示。
13.本发明还提供了所述大肠杆菌全局调控因子环腺苷酸受体蛋白突变体、所述编码基因在由半纤维素水解液生产木糖醇中的应用。
14.本发明还提供了所述大肠杆菌全局调控因子环腺苷酸受体蛋白突变体、所述编码基因在增强大肠杆菌对焦糖色素及乙酸盐耐受性中的应用。
15.本发明还提供了一种基因工程菌,由大肠杆菌菌株is5-5g将环腺苷酸受体蛋白83位氨基酸s突变为h、127位g突变为i、128位s突变为p或由大肠杆菌菌株is5-5g将环腺苷酸受体蛋白83位氨基酸s突变为h、128位s突变为p得到;
16.所述大肠杆菌菌株is5-5g是由大肠杆菌w3110敲除了ptsg基因、ptsf基因、xyla基因和xylb基因,再在大肠杆菌基因组is序列整合5个拷贝的木糖还原酶表达模块,最后将大肠杆菌的环腺苷酸受体蛋白112位氨基酸i突变为l、127位t突变为g、144位a突变为t得到。
17.本发明提供的基因工程菌,由大肠杆菌菌株is5-5g将环腺苷酸受体蛋白突变了s83h、g127i、s128p三个位点或由大肠杆菌菌株is5-5g将环腺苷酸受体蛋白突变s83h、s128p两个位点得到;相当于野生型crp突变i112l、a144t,s83h、t127i、s128p五个位点或野生型crp突变i112l、a144t,s83h、t127g、s128p五个位点得到。
18.本发明还提供了所述的基因工程菌在生产木糖醇中的应用。
19.优选的,生产木糖醇的原料为石灰预处理的玉米芯水解液。
20.本发明还提供了一种生产木糖醇的发酵工艺,使用所述的大肠杆菌全局调控因子环腺苷酸受体蛋白突变体、所述编码基因、或所述的基因工程菌发酵生产木糖醇。
21.一种生产木糖醇的发酵工艺,具体步骤包括:
22.(1)活化培养:将含有所述的大肠杆菌全局调控因子环腺苷酸受体蛋白突变体的大肠杆菌、所述编码基因的大肠杆菌、或所述的基因工程菌接种到平板培养基上活化培养,得到活化菌;
23.(2)种子培养:将步骤(1)得到的活化菌接种于种子培养基进行种子培养,得到种子液;
24.(3)将种子液接种到发酵培养基中发酵生产木糖醇,控制溶氧为35~40%;玉米芯水解液第一次补料是以恒定流速在2h内流加入灭菌的玉米芯水解液,控制木糖浓度达到50g/l;当木糖浓度低于40g/l时,开始第二批连续流加玉米芯水解液补料,初始流加木糖的速度为4g/l/h,控制木糖浓度在30~40g/l;当发酵液ph上升至8、且溶氧超过70%时,葡萄糖耗尽,木糖小于2g/l时,到达发酵终点。
25.本发明的有益效果:
26.本发明对大肠杆菌全局调控因子crp蛋白进行改造,对野生型crp结合口袋的五个关键位点144,112,127,128,83位氨基酸进行组合突变,将112位氨基酸i突变为l、127位t突变为i、144位a突变为t,83位氨基酸s突变为h、128位s突变为p时,有效提高了木糖转运速率和木糖醇生产速率,突变株进行20l发酵罐发酵,41h生产的木糖醇浓度为175.01g/l,木糖醇时空产率4.32g/l/h,木糖转化率100%。本发明还通过crp蛋白的全局调控,提高了菌株对半纤维素水解液中主要毒性物质,尤其是大分子色素和乙酸盐的耐受性,突变株利用水解液发酵的最大od
600
可达140。
附图说明
27.图1为菌株cph以石灰预处理的半纤维素水解液为底物摇瓶发酵生产木糖醇过程图。
28.图2为菌株gph以石灰预处理的半纤维素水解液为底物摇瓶发酵生产木糖醇过程图。
29.图3为菌株is5-5g以石灰预处理的半纤维素水解液为底物摇瓶发酵生产木糖醇过程图。
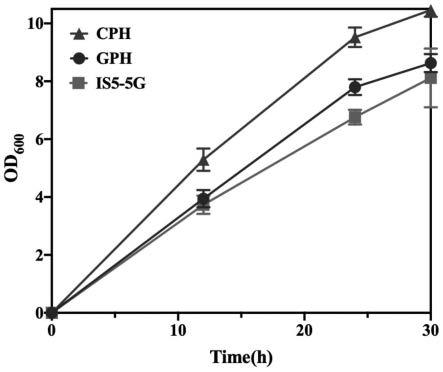
30.图4为2ml水解液为底物下菌株cph、gph和is5-5g生长曲线图。
31.图5为不同色素添加量下菌株is5-5g、cph和菌株gph生长25h的细胞密度图。
32.图6为不同浓度乙酸钠为唯一碳源下的菌株is5-5g、cph和菌株gph最大生物量(a)和最大比生长速率(b)图。
33.图7为不同浓度乙酸钠添加量下菌株is5-5g、cph和菌株gph最大生物量(a)和最大比生长速率(b)图。
34.图8为菌株is5-5g通过20l发酵罐半连续流加水解液发酵生产木糖醇过程图。
35.图9为菌株gph通过20l发酵罐半连续流加水解液发酵生产木糖醇过程图。
36.图10为菌株cph通过20l发酵罐半连续流加水解液发酵生产木糖醇过程图。
具体实施方式
37.本发明是以公开号为cn110734479a,名称为“一种大肠杆菌环腺苷酸受体蛋白突变体、基因工程菌及应用”的发明专利申请中获得的菌株is5-5g为基础进行研究。
38.本研究所用克隆菌株为大肠杆菌dh5α,改造底盘为实验室保藏的木糖醇生产菌株大肠杆菌is5-5g(详见公开号为cn104789586a和cn110734479a的前期申请,由大肠杆菌w3110在敲除ptsg基因、xyla基因、xylb基因和ptsf基因基础上,在大肠杆菌基因组is序列整合5个拷贝的木糖还原酶表达模块,最后将crp 112位氨基酸i突变为l、127位t突变为g、144位a突变为t获得)。crispr/cas9基因编辑所用质粒pcas及ptargetf为中科院上海植生所杨晟研究员惠赠。
39.实施例1
40.本实施例以大肠杆菌is5-5g为出发菌株,提供了一种crp的g127i、s128p、s83h三点组合突变株的的crispr编辑方法。
41.具体步骤如下:
42.一、制备大肠杆菌is5-5g化转感受态细胞
43.按照takara感受态制备试剂盒说明书制备大肠杆菌感受态细胞每支感受态按100μl分装于1.5ml ep管中,保存于-80℃超低温冰箱。
44.二、化学转化法导入pcas质粒
45.(1)从-80℃冰箱取出感受态细胞,冰浴静置10min;
46.(2)加入1μl pcas纯质粒,用移液器轻轻混匀,冰浴30min;
47.(3)于42℃水浴热激90s(严格控制时间),之后立即取出,冰浴2min:
48.(4)加入700μl lb液体培养基,37℃,200rpm孵育1h;
49.(5)4000rpm离心3min,用移液器吸去700μl上清液,将剩余的100μl溶液重悬后,涂布在含有50mg/l kanr抗性的lb固体培养基上,于30℃恒温培养箱中培养过夜;
50.(6)次日挑取平板上的单菌落,通过菌液pcr或基因测序的方法验证是否转化成功;
51.(7)将验证成功的is5-5g-pcas重组细胞接种于50mg/l kanr抗性的5ml lb液体试管中,30℃,200rpm培养8-12h;
52.(8)分别将750μl菌液以及50%(w/v)的灭菌甘油加入到灭菌甘油管中,混匀,并保存在-80℃下备用。
53.三、构建ptargetf-crpn20质粒
54.由于ptargetf质粒表达的guide rna能够引导cas蛋白,使其特异性识别并切割e.coli基因组上的待编辑序列,进而实现对e.coli基因组任意位置的编辑。因此,为了实现crp基因(基因序列如seq id no.5所示)突变,首先要在该基因内部找到一个pam位点(ngg序列),确定对应的crpn20序列。然后以ptargetf为模板,分别以crp127128-n20f/r、crp83-n20f/r为引物(表1),通过全质粒突变pcr将ptargetf质粒上的cadaspacer替换为不同的crpn20序列,从而得到ptargetf-crp127128n20以及ptargetf-crp83n20两种质粒。
55.四、donor dna的合成
56.donor dna用于替换e.coli基因组上的待编辑序列,分别将基因组上待编辑位点的上下游约500bp的基因片段作为上下游同源臂,再将上下游同源臂通过重叠延伸pcr拼接起来,即得到donor dna片段(共需合成crp127i128p、crp83h两个donor dna片段)。
57.以crp127i128p donor dna的合成为例,首先以e.coli w3110菌液为模版,分别以crp127128-uf/crp127i128p-ur以及crp127128-df/crp127128-dr为上下游同源臂的引物
进行pcr扩增(表1);再经过核酸凝胶凝胶电泳、切胶回收后得到纯化的上下游同源臂;最后将上述同源臂作为模板,以crp127128-uf和crp127128-dr为引物,经过重叠延伸pcr得到donor dna。crp83h donor dna的合成同理。
58.表1 crp*(s127i/s128p/s83h)基因编辑所用引物
[0059][0060][0061]
五、制备e.coli is5-5g-pcas电转感受态细胞
[0062]
将e.coli is5-5g-pcas单菌落接种到5ml lb液体试管中,30℃,200rpm培养过夜,之后吸取1ml菌液转接到50ml lb液体培养基中,30℃,200rpm培养2h(细胞od6
00
长到0.3~0.4),加入1ml 25%(w/v)的l-阿拉伯糖,继续诱导1h左右至细胞od
600
达到0.6~0.8,将菌液冰浴30min。
[0063]
取10ml菌液于10ml无菌ep管中,4℃,4000rpm离心5min,去上清;然后用移液器吸取1ml 10%(w/v)的灭菌甘油轻轻吹打,使菌液重悬;再将悬浮液转移到2ml无菌ep管中,4℃,4000rpm离心7min,弃去上清,重复四次该甘油洗涤过程。最后用100μl 10%(w/v)甘油重悬,即得到e.coli 1s5-5g-pcas电转感受态。
[0064]
六、电击转化
[0065]
向上述e.coli i85-5g-pcas电转感受态细胞中分别加入5μl ptargetf-crpn20质粒和8μl donor dna,转移到2mm无菌电转杯中。按照电压2500v,电阻200ω,电容25μf,电击时间5ms的程序进行点击。结束后立即加入1ml lb培养基混匀,并转移至2ml无菌ep管内,30℃、150rpm孵育3h。最后将孵育后的菌体全部涂布于kanr+spcr双抗板上进行筛选。
[0066]
七、pcr产物测序验证
[0067]
分别以crp127128-chef/r、crp83-chef/r为引物,挑取单菌落进行菌落pcr验证,再将跑胶条带大小正确的pcr产物送测序,确认crp的127、128以及83位是否突变成功。
[0068]
八、消除ptargetf-crpn20和pcas质粒
[0069]
将编辑成功的菌落接种到50mg/l kanr+0.5mm iptg的lb液体试管中,30℃,200rpm培养过夜,消除ptargetf-crpn20质粒。pcas质粒的消除则通过接种在无抗lb培养基
中,37℃下培养过夜即可。
[0070]
将最终获得的菌株命名为cph。
[0071]
实施例2
[0072]
本实施例以is5-5g为出发菌株,提供了一种crp的s128p、s83h两点组合突变株的的crispr编辑方法。
[0073]
具体操作步骤参见实施例1。
[0074]
区别在于将引物crp127i128p-ur替换成crp127g128p-ur,通过重叠延伸pcr获得crp127g128p donor dna。
[0075]
表2 crp*(s128p/s83h)基因编辑所用引物
[0076]
引物名称序列(5
’‑3’
)crp127g128p-urgaaacgccagattgcccactttctccgggccgacttgcagacgacgcgccatctgtgcagacaaacgc
[0077]
将最终获得的菌株命名为gph。
[0078]
实施例3
[0079]
一、玉米芯水解液预处理
[0080]
根据玉米芯稀硫酸水解液浓缩液的检测报告中主要化合物的浓度及溶液ph(表3),首先用饱和ca(oh)2将溶液ph中和至6.5,10000rpm离心10min后再将上清液通过定性滤纸过滤,除去水解液中少部分残留的秸秆残渣、caso4及其吸附的固体杂质等。向滤液中加入葡萄糖及木糖,控制混合糖浓度为250g/l葡萄糖、500g/l木糖。最后100℃灭菌30min,用于摇瓶发酵过程添加。
[0081]
表3玉米芯水解液浓缩液检测指标
[0082][0083][0084]
二、大肠杆菌摇瓶发酵
[0085]
将菌株is5-5g,菌株cph,菌株gph分别接种于5ml lb液体试管中,37℃下培养过夜。取1ml种子液,转接入装有47ml摇瓶发酵培养基的250ml锥形瓶中开始发酵。在30℃,220rpm下培养4h后,加入2ml灭菌水解液(控制混合糖初始浓度为10g/l葡萄糖、20g/l木糖)。每隔10~12h定时取样检测,直到木糖醇浓度不再增加,细胞od
600
开始下降,即为发酵终点。
[0086]
三、hplc检测糖和糖醇浓度
[0087]
在发酵过程中定时取样,将菌液离心后的上清液稀释适当倍数后,使用0.22μm的
滤膜进行过滤,即制得样品。采用hplc检测发酵液中的葡萄糖、木糖、阿拉伯糖以及木糖醇浓度。具体检测条件如表4所示。
[0088]
表4发酵液hplc检测条件
[0089]
液相检测器型号shimadzu lc-20at hplc;rid-20a示差折光检测器色谱柱aminex hpx-87h(bio-rad)流动相超纯水流速0.6ml/min检测时间15min柱温箱温度65℃进样量20μl
[0090]
四、摇瓶发酵实验结果
[0091]
crp突变菌株cph、gph以及对照菌株is5-5g摇瓶发酵生产木糖醇的情况分别如图1、2、3所示。结果表明,菌株cph在摇瓶发酵过程中od
600
最大值达到10.42,说明其对水解液中的抑制因子耐受性良好。菌株cph 30h生产的木糖醇浓度为19.23g/l,比菌株is5-5g(15.38g/l)的生产速率提高了25.0%。菌株cph 30h将94.6%的木糖转化为木糖醇,比is5-5g大18.85%,提前了摇瓶发酵的终点,有利于缩短发酵周期。相比之下,菌株gph在摇瓶发酵30h的od
600
最大值为8.63,能够在水解液中正常生长。然而菌株gph发酵30h生产的木糖醇浓度和木糖转化率分别为11.81g/l,55.5%,说明菌株gph发酵生产木糖醇的效果不如菌株is5-5g。
[0092]
四、玉米芯水解液中各类抑制因子对细胞生长的影响
[0093]
(1)crp突变株对未脱毒玉米芯水解液的耐受情况
[0094]
由摇瓶发酵过程生长曲线可知,本研究中crp突变提高了大肠杆菌对纤维素水解液的耐受性。出发菌株is5-5g,构建的crp*s128p/s83h双点突变株gph以及crp*g127i/s128p/s83h三点突变株cph摇瓶培养30h的细胞最大od
600
值分别为8.12,8.63,10.46(图4)。
[0095]
由于石灰预处理后的玉米芯水解液中存在多种毒性物质,因此,本发明通过模拟水解液中的主要有毒化合物,进行细胞生长的单因素实验,分析了水解液中各类抑制因子对细胞生长的影响。
[0096]
(2)探究色素对细胞生长的抑制作用
[0097]
由于水解液中色素成分比较复杂,本发明选择焦糖色素为对象,研究其对重组菌生长的影响。结果如图5所示,即突变菌株cph表现出较好的色素耐受性,当色素添加量为2ml时,菌株cph最大od
600
(9.25)为菌株is5-5g(1.04)的8.88倍;菌株gph最大od
600
为3.25,对色素的耐受性不如菌株cph显著。
[0098]
(3)探究以醋酸钠为唯一碳源对细胞生长的影响
[0099]
一方面,乙酸是水解液中存在的主要毒性物质之一,乙酸根对大肠杆菌的生长有抑制作用;另一方面,大肠杆菌体内也存在乙酸的同化代谢途径。因此在适宜浓度下,大肠杆菌能够以乙酸为碳源进行生长。本发明比较了不同浓度naac为唯一碳源下两种菌株的生物量和最大比生长速率(图6)。结果表明,菌株cph能够以5g/l naac为碳源生长,最大细胞干重为1.13g/l,最大比生长速率0.2349h-1
,而相同条件下菌株is5-5g和菌株gph的细胞干重分别为0.33g/l和0.45g/l,最大比生长速率分别为0.0572h-1
、0.0565h-1
。
[0100]
(4)探究醋酸钠对细胞生长的抑制作用
[0101]
由于水解液中乙酸浓度约为10g/l,根据发酵过程中水解液体积最高可占发酵液终体积1/3进行估算,发酵过程中乙酸浓度不超过5g/l。如图7所示,当naac添加量为5g/l时,菌株cph最大生物量(2.53g/l)和最大比生长速率(0.3425h-1
)分别比出发菌株is5-5g提高了44.1%,63.1%。即与出发菌株相比,菌株cph的乙酸耐受性明显提高。
[0102]
实施例3
[0103]
一、水解液半连续流加补料生产木糖醇的发酵工艺
[0104]
(1)发酵原料配制
[0105]
采用浙江华康药业股份有限公司提供的浓缩玉米芯稀硫酸水解液为木糖原料(玉米芯原料在质量浓度0.5%-3%的h2so4、120℃下水解30min得到)。取4.5l水解液100℃灭菌30min。称取1000g的玉米浆干粉,加热水约2l并搅拌均匀,115℃灭菌30min。称取1300g葡萄糖加热水溶解至总体积约1.8l,115℃灭菌30min。
[0106]
(2)菌株活化及接种
[0107]
a)取甘油管保藏菌株,于lb固体培养基平板划线,37℃恒温培养箱培养过夜;
[0108]
b)挑取lb平板上的单菌落,接入3ml lb培养基的试管,37℃,200rpm培养6h,再次转接入30ml lb培养基中培养4h,即为一级种子培养液;
[0109]
c)按照8%接种量,即20ml一级种子培养液接种到含有250ml二级种子培养基(lb培养基)的1l锥形瓶中,37℃,250rpm培养9h左右,至od
600
超过4.5。
[0110]
(3)发酵过程调控
[0111]
(i)发酵罐接种
[0112]
发酵罐121℃空消25min后,在发酵罐中装入7l发酵培养基(葡萄糖除外)、加入10ml左右消泡剂,121℃实消20min。采用火焰接种法接入1l发酵种子液,通过蠕动泵快速流加160g的葡萄糖溶液,同时通过蠕动泵加入200g玉米浆干粉,此时罐内发酵液体积为10l左右。
[0113]
(ii)半连续分批补料
[0114]
a)第一批补料
[0115]
接种后,控制初始ph为6.8,温度为30℃。通气量为0.8vvm,尾气罐压0.025mpa,初始转速为300rpm,溶氧设定为35%~40%,培养6h左右至od
600
>16,可进行第一次补料。通过蠕动泵,以特定流速在2h内流加入灭菌水解液(水解液加入体积控制在木糖浓度达到50g/l为止)。同时,根据葡萄糖浓度调整流加速度,维持葡萄糖浓度5-10g/l。补料瓶中玉米浆根据细胞生长情况,按照约5g/l/h速度连续加入。
[0116]
b)第二批连续流加补料
[0117]
第一次补料约5h以后,当木糖浓度低于40g/l时,开始第二批连续流加水解液,初始流加速度为4g/l/h木糖,根据木糖浓度调整流加速度,控制木糖浓度在30~40g/l。过程中每隔4h取样调节补料速度,控制木糖浓度由40g/l缓慢下降。
[0118]
(iii)发酵终点
[0119]
发酵后期ph上升至8左右、且溶氧超过70%时,取样进行hplc检测,直到葡萄糖耗尽,木糖小于2g/l时,到达发酵终点。
[0120]
二、20l发酵罐发酵结果
[0121]
(1)菌株is5-5g通过20l发酵罐,以分批流加水解液的补料方式进行发酵,51h的od
600
值和木糖醇浓度分别为84.7,140.08g/l,残余木糖浓度1.32g/l,木糖醇时空产率2.75g/l/h,木糖转化率99.05%,木糖醇对木糖得率为1.0g/g。葡萄糖消耗约926g(流加葡萄糖762.5g,水解液含葡萄糖163.4g),按发酵终体积13.3l计算,木糖醇对葡萄糖得率为2.01g/g(图8)。
[0122]
(2)相比之下,菌株ghp发酵57h的od
600
值和木糖醇浓度分别为84,133.05g/l,残余木糖浓度3.56g/l,木糖醇时空产率2.33g/l/h,木糖转化率97.4%,木糖醇对木糖得率为0.99g/g。葡萄糖消耗约693g(流加葡萄糖530g,水解液含葡萄糖163g),按发酵终体积12.7l计算,木糖醇对葡萄糖得率为2.44g/g(图9)。发酵结果表明,在is5-5g的基础上,crp*s128p/s83h双点突变未能有效促进木糖转化和木糖醇生产。
[0123]
(3)进一步,菌株cph采取同样工艺进行20l发酵罐发酵,41h的od
600
值以及生产的木糖醇浓度分别为140,175.01g/l,且发酵液中无残余木糖,木糖醇时空产率4.32g/l/h,木糖转化率100%,木糖醇对木糖得率为1.02g/g,几乎等于理论得率。发酵过程中葡萄糖消耗约919g(流加葡萄糖722g,水解液含葡萄糖197g),按发酵终体积14.2l计算,木糖醇对葡萄糖得率为2.70g/g(图10)。说明crp*g127i/s128p/s83h三点突变株提高了菌株对石灰预处理的玉米芯水解液耐受性,菌株生长旺盛且抗逆性强,更适合应用于微生物发酵生产木糖醇中。同时,本发明采用连续补料操作能够缩短发酵周期,提高细胞密度以及减轻底物抑制效应,有效节约了水电资源以及人工成本。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1