热稳定性改善的葡萄糖氧化酶GoxM10突变体E361P及其衍生突变体和应用
热稳定性改善的葡萄糖氧化酶goxm10突变体e361p及其衍生突变体和应用
技术领域
1.本发明属于饲料生物技术领域,具体涉及热稳定性改善的葡萄糖氧化酶goxm10突变体e361p及其衍生突变体和应用。
背景技术:
2.葡萄糖氧化酶(gox;ec1.1.3.4)是一种特性良好的需氧脱氢酶,在有氧条件下利用氧分子作为电子受体,催化β-d-葡萄糖生成d-葡萄糖酸内酯和过氧化氢,随后d-葡萄糖酸内酯水解成葡萄糖酸和水。近年来gox作为一种新型抗生素替代添加剂受到饲料行业的普遍关注。gox作为抗生素和生长促进剂的替代品,在不损害人类健康的前提下对保证动物健康和生产性能至关重要。大量应用研究表明,gox作为一种绿色饲料添加剂,可用于预防牲畜胃肠道感染和腹泻,并有促进动物生长的作用。
3.当前大部分动物饲料均需要经过高温制粒,所以提高gox的热稳定性对于其在饲料中的广泛应用至关重要。此外,能够在酸性环境中维持较高的活性,以便在动物胃肠道发挥最大作用也至关重要。所以为了满足gox在饲料工业中的应用,gox要具备良好的热稳定性和酸稳定性。现有技术已对黑曲霉(aspergillus niger)来源gox稳定性方面做了改进,例如获得了t
50
增加7.5 ℃的突变体goxm4以及比goxm4的tm提高了9 ℃的突变体goxm10。
技术实现要素:
4.本发明的目的是提供一种热稳定性改善的葡萄糖氧化酶goxm10的突变体。
5.本发明的再一目的是提供编码上述突变体的基因。
6.本发明的再一目的是提供包含上述突变体基因的重组载体。
7.本发明的再一目的是提供包含上述突变体基因的重组菌株。
8.本发明的再一目的是提供上述突变体的应用。
9.本发明的再一目的是提供制备稳定性提高的葡萄糖氧化酶的方法。
10.本发明的再一目的是提供一种改善葡萄糖氧化酶goxm10的热稳定性的方法。
11.根据本发明的具体实施方式,对氨基酸序列如goxm10 id no:1所示的葡萄糖氧化酶进行定点突变。
12.根据本发明的具体实施方式,将氨基酸序列如goxm10 id no:1所示的葡萄糖氧化酶进行203、219、338、361、419进行单点突变,然后进行361/203、361/219、361/338、361/419双点组合突变,然后进行361/419/203、361/419/338三点组合突变,进一步进行361/419/193/497、361/419/4/471四点组合突变,以及361/419/4/471/ 193/497六点组合突变,从而获得酸和热稳定性改进的葡萄糖氧化酶突变体。
13.根据本发明的具体实施方式,将氨基酸序列如seq id no:1所示的葡萄糖氧化酶进行g203c突变,得到热稳定性提高的氨基酸序列如seq id no:2所示的突变体。
14.根据本发明的具体实施方式,还提供了编码上述热稳定性提高的葡萄糖氧化酶突
变体g203c的基因,其核苷酸序列如seq id no:3所示。
15.根据本发明的具体实施方式,将氨基酸序列如seq id no:1所示的葡萄糖氧化酶进行e219p突变,得到氨基酸序列如seq id no:4所示的突变体。
16.根据本发明的具体实施方式,还提供了编码上述热稳定性提高的葡萄糖氧化酶突变体e219p的基因,其核苷酸序列如seq id no:5所示。
17.根据本发明的具体实施方式,将氨基酸序列如seq id no:1所示的葡萄糖氧化酶进行s338p突变,得到氨基酸序列如seq id no:6所示的突变体。
18.根据本发明的具体实施方式,还提供了编码上述热稳定性提高的葡萄糖氧化酶突变体s338p的基因,其核苷酸序列如seq id no:7所示。
19.根据本发明的具体实施方式,将氨基酸序列如seq id no:1所示的葡萄糖氧化酶进行e361p突变,得到氨基酸序列如seq id no:8所示的突变体。
20.根据本发明的具体实施方式,还提供了编码上述热稳定性提高的葡萄糖氧化酶突变体e361p的基因,其核苷酸序列如seq id no:9所示。
21.根据本发明的具体实施方式,将氨基酸序列如seq id no:1所示的葡萄糖氧化酶进行a419i突变,得到氨基酸序列如seq id no:10所示的突变体。
22.根据本发明的具体实施方式,还提供了编码上述热稳定性提高的葡萄糖氧化酶突变体a419i的基因,其核苷酸序列如seq id no:11所示。
23.根据本发明的具体实施方式,将氨基酸序列如seq id no:1所示的葡萄糖氧化酶进行e361p/g203c突变,得到氨基酸序列如seq id no:12所示的突变体。
24.根据本发明的具体实施方式,还提供了编码上述热稳定性提高的葡萄糖氧化酶突变体e361p/g203c的基因,其核苷酸序列如seq id no:13所示。
25.根据本发明的具体方式,将氨基酸序列如seq id no:1所示的葡萄糖氧化酶进行e361p/e219p突变,得到氨基酸序列如seq id no:14所示的突变体。
26.根据本发明的具体实施方式,还提供了编码上述具有稳定性提高的葡萄糖氧化酶突变体e361p/e219p的基因,其核苷酸序列如seq id no:15所示。
27.根据本发明的具体实施方式,将氨基酸序列如seq id no:1所示的葡萄糖氧化酶进行e361p/s338p突变,得到氨基酸序列如seq id no:16所示的突变体。
28.根据本发明的具体实施方式,还提供了编码上述热稳定性提高的葡萄糖氧化酶突变体e361p/s338p的基因,其核苷酸序列如seq id no:17所示。
29.根据本发明的具体实施方式,将氨基酸序列如seq id no:1所示的葡萄糖氧化酶进行e361p/a419i突变,得到氨基酸序列如seq id no:18所示的突变体。
30.根据本发明的具体实施方式,还提供了编码上述热稳定性提高的葡萄糖氧化酶突变体e361p/a419i的基因,其核苷酸序列如seq id no:19所示。
31.根据本发明的具体实施方式,将氨基酸序列如seq id no:1所示的葡萄糖氧化酶进行e361p/a419i/g203c突变,得到氨基酸序列如seq id no:20所示的突变体。
32.根据本发明的具体实施方式,还提供了编码上述热稳定性提高的葡萄糖氧化酶突变体e361p/a419i/g203c的基因,其核苷酸序列如seqid no:21所示。
33.根据本发明的具体实施方式,将氨基酸序列如seq id no:1所示的葡萄糖氧化酶进行e361p/a419i/s338p突变,得到的氨基酸序列如seq id no:22所示的突变体。
34.根据本发明的具体实施方式,还提供了编码上述热稳定性提高的葡萄糖氧化酶突变体e361p/a419i/s338p的基因,其核苷酸序列如seq id no:23所示。
35.根据本发明的具体实施方式,将氨基酸序列如seq id no:1所示的葡萄糖氧化酶进行e361p/a419i/d193n/d497n突变,得到的氨基酸序列如seq id no:24所示的突变体。
36.根据本发明的具体实施方式,还提供了编码上述酸和热稳定性提高的葡萄糖氧化酶突变体e361p/a419i/d193n/d497n的基因,其核苷酸序列如seq id no:25所示。
37.根据本发明的具体实施方式,将氨基酸序列如seq id no:1所示的葡萄糖氧化酶进行e361p/a419i/a4d/n471e突变,得到氨基酸序列如seq id no:26所示的突变体。
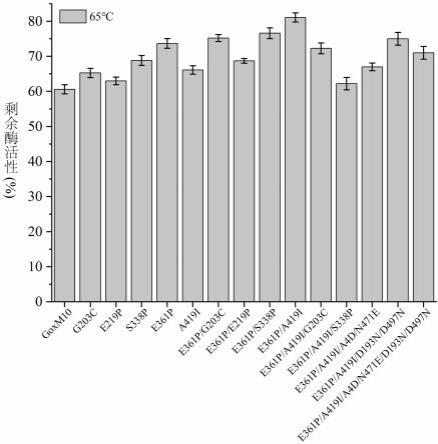
38.根据本发明的具体实施方式,还提供了编码上述酸和热稳定性提高的葡萄糖氧化酶突变体e361p/a419i/a4d/n471e的基因,其核苷酸序列如seq id no:27所示。
39.根据本发明的具体实施方式,将氨基酸序列如seq id no:1所示的葡萄糖氧化酶进行e361p/a419i/d193n/d497n/a4d/n471e突变,得到氨基酸序列如seq id no:28所示的突变体。
40.根据本发明的具体实施方式,还提供了编码上述酸和热稳定性提高的葡萄糖氧化酶突变体e361p/a419i/d193n/d497n/a4d/n471e的基因,其核苷酸序列如seqid no:29所示。
41.根据本发明的具体实施方式,还提供了包含上述葡萄糖氧化酶突变体基因的重组载体,所述重组表达载体的出发载体为ppic9,所述重组表达载体具体为ppic9-goxm10-g203c,ppic9-goxm10-e219p,ppic9-goxm10-s338p,ppic9-goxm10-e361p,ppic9-goxm10-a419i,ppic9-goxm10-e361p/g203c,ppic9-goxm10-e361p/e219p,ppic9-goxm10-e361p/s338p,ppic9-goxm10-e361p/a419i,ppic9-goxm10-e361p/a419i/g203c,ppic9-goxm10-e361p/a419i/s338p,ppic9-goxm10-e361p/a419i/d193n/d497n,ppic9-goxm10-e361p/a419i/a4d/n471e和ppic9-goxm10-e361p/a419i/a4d/n471e/d193n/d497n。
42.根据本发明的具体实施方式,还提供了包含上述葡萄糖氧化酶突变体基因的重组菌株。
43.根据本发明的制备热稳定提高的葡萄糖氧化酶的方法,包括以下步骤:1)制备包含上述突变体基因的重组载体;2)所述重组载体转化毕赤酵母gs115表达宿主;3)发酵培养所述宿主,并分离葡萄糖氧化酶。
44.本发明提供了上述具有酸稳定性或热稳定性的葡萄糖氧化酶突变体的应用,具体可以应用于食品和饲料领域中。
45.本发明的突变体与葡萄糖氧化酶goxm10相比,最适反应温度一致,均为40 ℃,其热稳定性均明显提高。在65 ℃保温180 min后goxm10的剩余酶活力为61%,突变体g203c、e219p、s338p、e361p、a419i、e361p/g203c、e361p/e219p、e361p/s338p、e361p/a419i、e361p/a419i/g203c和e361p/a419i/s338p、e361p/a419i/a4d/n471e、e361p/a419i/d193n/d497n和e361p/a419i/a4d/ n471e/d193n/d497n的剩余酶活力分别为65%、63%、69%、74%、66%、75%、68%、76%、81%、72%、62%、67%、75%和71%。在75 ℃保温12 min后,突变体g203c、e219p、s338p、e361p、a419i、e361p/g203c、e361p/e219p、e361p/s338p、e361p/a419i、e361p/a419i/g203c、e361p/a419i/s338p、e361p/a419i/a4d/n471e、e361p/a419i/d193n/
d497n和e361p/a419i/a4d/n471e/d193n/d497n纯化后的酶液保留酶活力分别为42%、37%、42%、44%、43%、47%、37%、48%、50%、38%、39%、42%、45%和44%左右,goxm10的保留酶活力为36%。
46.在65 ℃保温,goxm10的半衰期为385 min,突变体e219p和a419i的半衰期均为433 min,是goxm10的1.1倍,突变体g203c和e361p的半衰期分别为462 min和495 min,是goxm10的1.2和1.3倍,突变体s338p的半衰期和goxm10相当。4个双点突变体e361p/g203c、e361p/e219p、e361p/s338p和e361p/a419i的半衰期分别为495 min、433 min、462 min和578 min,分别是goxm10(385 min)的1.3、1.1、1.2和1.5倍。突变体e361p/a419i/g203c、e361p/a419i/s338p、e361p/a419i/a4d/n471e、e361p/a419i/d193n/d497n和e361p/a419i/a4d/n471e/ d193n/d497n的半衰期分别为433、450、495、553和462 min。
47.在ph 2.5条件下处理30 min时,突变体e361p/a419i/a4d/n471e、e361p/a419i/d193n/d497n和e361p/a419i/a4d/n471e/d193n/d497n的相对剩余酶活力分别为31%、29%和33%,goxm10的剩余酶活为21%。在ph 2.75和37 ℃条件下处理60 min,突变体e361p/a419i/a4d/n471e、e361p/a419i/d193n/d497n和e361p/a419i/a4d/n471e/d193n/d497n的相对剩余酶活力分别为42%、46%和47%左右,goxm10的剩余酶活为24%。突变体e361p/a419i/a4d/n471e、e361p/a419i/d193n/d497n和e361p/a419i/a4d/n471e/ d193n/d497n的最适ph和goxm10一致均为6.0。
48.本发明提供了的酸稳定性或热稳定性的改善的葡萄糖酶突变体适合于在食品和饲料领域中应用,有着非常广阔的应用前景。
附图说明
49.图1显示goxm10和突变体在65 ℃下处理180 min的热稳定性对比;图2显示goxm10和突变体在75 ℃下处理12 min的热稳定性对比;图3显示goxm10和突变体的最适温度对比;图4显示goxm10和突变体在ph 2.5条件下处理30 min的酸稳定性对比;图5显示goxm10和突变体在ph 2.75条件下处理60 min的酸稳定性对比;图6显示goxm10和突变体的最适ph对比。
具体实施方式
50.试验材料和试剂1、菌株及载体:表达宿主为pichia pastoris gs115,表达质粒载体为ppic9。
51.2、酶类及其它生化试剂:内切酶/高保真dna聚合酶和重组酶。
52.3、大肠杆菌lb培养基(1%蛋白胨、0.5%酵母提取物、1% nacl,ph自然)。毕赤酵母ypd培养基(1%酵母提取物,2%蛋白胨,2%葡萄糖,ph自然);bmgy(1%酵母提取物,2%蛋白胨,10%无氨基酵母氮源,0.1%生物素,ph自然);bmmy(1%酵母提取物,2%蛋白胨,10%无氨基酵母氮源,0.1%生物素,1%甲醇,ph自然)。
53.说明:以下实施例中未作具体说明的分子生物学实验方法,均参照《分子克隆实验指南》(第三版)j.萨姆布鲁克一书中所列的具体方法进行,或者按照试剂盒和产品说明书进行。
54.根据本发明的具体实施方式,将氨基酸序列如goxm10 id no:1所示的葡萄糖氧化
酶进行203、219、338、361、419进行单点突变,然后进行361/203、361/219、361/338、361/419双点组合突变,然后进行361/419/203、361/419/338三点组合突变,进步一进行361/419/193/497、361/419/4/471四点组合突变,以及361/419/4/471/193/497六点组合突变,从而获得酸和热稳定性改进的葡萄糖氧化酶突变体。
55.具体地,将氨基酸序列如goxm10idno:1所示的葡萄糖氧化酶进行如下突变:g203c、e219p、s338p、e361p、a419i;e361p/g203c、e361p/e219p、e361p/s338p、e361p/a419i;e361p/a419i/g203c、e361p/a419i/s338;e361p/a419i/a4d/n471e、e361p/a419i/d193n/d497n;e361p/a419i/a4d/n471e/d193n/d497n)。
56.实施例1、重组菌株gs115(ppic9-goxm10)的制备1.扩增高热稳定性葡萄糖氧化酶goxm10的核酸序列goxm10采用pcr的方法扩增goxm10基因片段,采用双酶切方法获得载体ppic9核酸片段,通过重组酶将两者连接,获得重组质粒ppic9-goxm10,并转化毕赤酵母gs115,获得重组毕赤酵母菌株gs115(ppic9-goxm10)。pcr所用引物如下:goxm10-f(seqidno:30,30bp),goxm10-r(seqidno:31,30bp)。
57.其中,goxm10-f及goxm10-r用于扩增goxm10的基因编码序列;载体ppic9通过将保存的菌种接到液体lb培养基过夜培养后,质粒提取得到。
58.扩增结束后,将pcr产物以及提取质粒进行核酸电泳检测,goxm10与载体ppic9条带大小分别为1746bp、8088bp,将载体用ecori和noti进行酶切后,将pcr产物与酶切产物分别回收纯化。
59.2.构建重组菌株gs115(ppic9-goxm10)将回收的goxm10与ppic9基因片段通过重组酶进行重组连接,然后将重组产物转化大肠杆菌jm109感受态,并涂布于lb(含100μg/mlamp)进行筛选。待测序正确后,利用bglⅱ限制性内切酶将重组质粒ppic9-goxm10进行酶切,回收酶切产物后电击转化毕赤酵母gs115感受态细胞,得到重组表达菌株gs115(ppic9-goxm10)。
60.实施例2、重组突变菌株gs115的制备1.稳定性提高的重组质粒的构建根据突变体设计突变引物,以质粒ppic9-goxm10为模板,通过点突变试剂盒引入突变氨基酸,含突变氨基酸的pcr产物用dpnⅰ消化处理以去除模板,消化后的pcr产物转化进入大肠杆菌jm109感受态细胞,并对其进行测序验证,获得含葡萄糖氧化酶突变质粒的大肠杆菌ppic9-goxm10-g203c,ppic9-goxm10-e219p,ppic9-goxm10-s338p,ppic9-goxm10-e361p,ppic9-goxm10-a419i,ppic9-goxm10-e361p/g203c,ppic9-goxm10-e361p/e219p,ppic9-goxm10-e361p/s338p,ppic9-goxm10-e361p/a419i,ppic9-goxm10-e361p/a419i/g203c,ppic9-goxm10-e361p/a419i/s338p,ppic9-goxm10-e361p/a419i/a4d/n471e、ppic9-goxm10-e361p/a419i/d193n/d497n和ppic9-goxm10-e361p/a419i/a4d/n471e/d193n/d497n。所用引物如下所示:gox-g203c-f(seqidno:32),gox-g203c-r(seqidno:33);gox-e219p-f(seqidno:34),gox-e219p-r(seqidno:35);gox-s338p-f(seqidno:36),gox-s338p-r
(seqidno:37);gox-e361p-f(seqidno:38),gox-e361p-r(seqidno:39);gox-a419i-f(seqidno:40),gox-a419i-r(seqidno:41)。
61.2.酸稳定性和热稳定重组菌株gs115构建利用bglⅱ将测序正确的突变质粒进行酶切,回收酶切产物后电击转化毕赤酵母gs115感受态细胞,得到重组表达菌株gs115(ppic9-goxm10-g203c),gs115(ppic9-goxm10-e219p),gs115(ppic9-goxm10-s338p),gs115(ppic9-goxm10-e361p),gs115(ppic9-goxm10-a419i),gs115(ppic9-goxm10-e361p/g203c),gs115(ppic9-goxm10-e361p/e219p),gs115(ppic9-goxm10-e361p/s338p),gs115(ppic9-goxm10-e361p/a419i),gs115(ppic9-goxm10-e361p/a419i/g203c),gs115(ppic9-goxm10-e361p/a419i/s338p),gs115(ppic9-goxm10-e361p/a419i/a4d/n471e),gs115(ppic9-goxm10-e361p/a419i/d193n/d497n)和gs115(ppic9-goxm10-e361p/a419i/a4d/n471e/d193n/d497n)。
62.实施例3、葡萄糖氧化酶goxm10及高酸稳定性和热稳定性突变体酶蛋白的获得1.goxm10及突变体的诱导表达以1%的接种量将上述得到的重组酵母表达菌株接种至50mlypd培养基中进行种子液培养,200rpm,30℃培养48h后,以1%接种量转接至400mlbmgy培养基中,200rpm,30℃培养48h,离心收集菌体转接到200mlbmmy培养基中,每24h补加1%的甲醇进行诱导表达,共培养72h。
63.2.goxm10及突变体的纯化将诱导表达后的菌液12000rpm,10min离心,收集上清后用10kda的膜包进行浓缩,再用10mm磷酸氢二钠-柠檬酸缓冲液(ph6.5)进行透析,然后将透析后的粗酶液用阴离子柱纯化,纯化用a液为10mm磷酸氢二钠-柠檬酸缓冲液(ph6.5),b液为a液加1mnacl,纯化蛋白,收集洗脱液。
64.3.goxm10和突变体的酶学性质测定(1)goxm10和突变体的热稳定性测定用0.1m磷酸氢二钠-柠檬酸缓冲液(ph6.0)把纯化后的酶液稀释到相同的蛋白浓度,分别在65℃和75℃水浴锅中保温处理不同的时间,最后按标准方法测定相对剩余酶活力,并计算t
1/2
。如图1所示,65℃保温180min后goxm10的剩余酶活力为61%,突变体g203c、e219p、s338p、e361p、a419i、e361p/g203c、e361p/e219p、e361p/s338p、e361p/a419i、e361p/a419i/g203c和e361p/a419i/s338p、e361p/a419i/a4d/n471e、e361p/a419i/d193n/d497n和e361p/a419i/a4d/n471e/d193n/d497n的剩余酶活力分别为65%、63%、69%、74%、66%、75%、68%、76%、81%、72%、62%、67%、75%和71%,与goxm10(61%)相比分别提高了约7%、3%、13%、21%、8%、23%、11%、25%、33%、18%、2%、10%、23%和16%。如图2所示,75℃保温12min后突变体g203c、e219p、s338p、e361p、a419i、e361p/g203c、e361p/e219p、e361p/s338p、e361p/a419i、e361p/a419i/g203c和e361p/a419i/s338p、e361p/a419i/a4d/n471e、e361p/a419i/d193n/d497n和e361p/a419i/a4d/n471e/d193n/d497n的剩余酶活力分别为42%、37%、42%、44%、43%、47%、37%、48%、50%、38%、39%、42%、45%和44%,与goxm10(36%)相比分别提高了约17%、3%、17%、22%、、19%、31%、3%、33%、38%、5%、8%、17%、25%和22%。如表1所示,65℃保温goxm10的半衰期为385min,突变体e219p和a419i的半衰期均为433min,是goxm10
min、40 min、50 min和60 min。保温结束后在标准条件下测定goxm10及其突变体酶液的相对剩余酶活。如图4所示,ph 2.5条件下处理30 min时,突变体e361p/a419i/a4d/n471e、e361p/a419i/d193n/d497n和e361p/a419i/a4d/n471e/d193n/d497n的相对剩余酶活力分别为31%、29%和33%,与goxm10(21%)相比分别提高了约48%、38%和57%。如图5所示,在ph 2.75和37 ℃条件下处理60 min,突变体e361p/a419i/a4d/n471e、e361p/a419i/d193n/d497n和e361p/a419i/a4d/n471e/d193n/d497n的相对剩余酶活力分别为42%、46%和47%左右,与goxm10(24%)相比分别提高了约75%、92%和96%。
68.(4)goxm10和突变体的最适ph测定首先,分别配置不同ph梯度(3.0、4.0、5.0、6.0、7.0、8.0)的gox酶活力测定的底物混合液,然后,在30 ℃下测定goxm10及其突变体的酶活力,把最适反应ph条件下的酶活力设定为100%,然后计算其余ph条件下的相对酶活力,即可得到goxm10及其突变体的最适反应ph。如图6,突变体e361p/a419i/a4d/n471e、e361p/a419i/d193n/d497n和e361p/a419i/a4d/n471e/d193n/d497n的最适反应ph与goxm10相比均为6.0。
69.以上实施例仅用于解释本技术的技术方案,不限定本技术的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1