增强免疫细胞持久性的方法
本发明属于细胞,涉及同时敲除zc3h12a和bcor基因的重组免疫细胞及其制备方法、基因调控系统和用途。具体涉及一种增强t细胞持久性和在体内稳定植入且具有分泌功能的t细胞及其制备方法、基因调控系统和用途。
背景技术:
1、细胞过继治疗(adoptive cell transfer therapy)包括嵌合抗原受体 (car)-t和t细胞受体(tcr)-t等,在肿瘤的免疫治疗中具有非常显著的效果,尤其是对于淋巴细胞白血病。
2、目前car-t疗法有两个缺陷:一方面,car-t细胞在回输之前需要对患者进行化疗预处理,否则输入的car-t细胞不能有效扩增,但该化疗过程具有很大的毒副作用;另一方面,回输的car-t细胞在体内的持续时间有限,很多患者会因此复发。在细胞过继治疗中,如何提高重组免疫细胞的持久性是急需解决的技术问题。
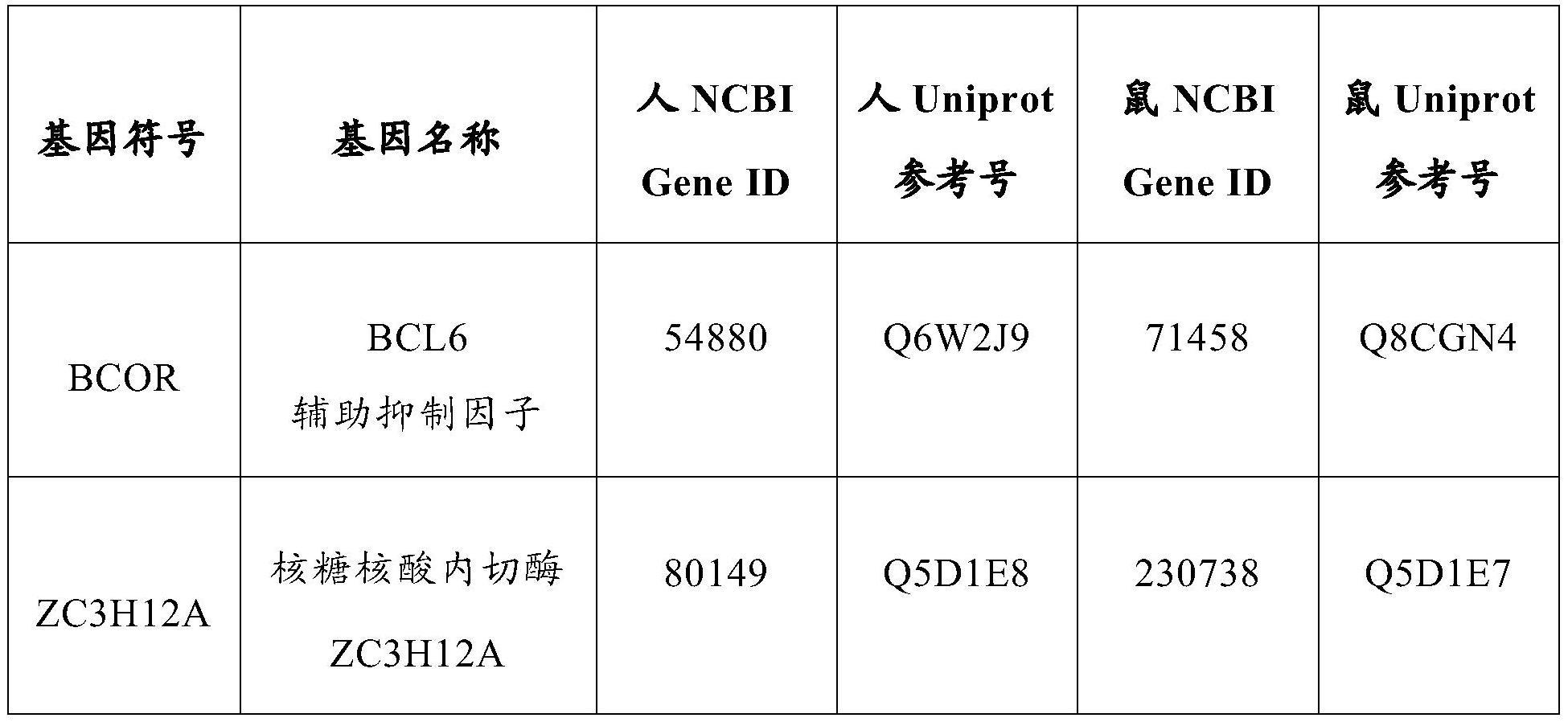
3、人bcor基因(gene id:54880,2022年5月29日更新, https://www.ncbi.nlm.nih.gov/gene/54880)和鼠bcor基因(gene id: 71458,2022年5月22日更新, https://www.ncbi.nlm.nih.gov/gene/71458)编码细胞中转录抑制因子 bcor。人zc3h12a基因(gene id:80149,2022年5月22日更新, https://www.ncbi.nlm.nih.gov/gene/80149)和鼠zc3h12a基因(gene id: 230738,2022年5月22日更新, https://www.ncbi.nlm.nih.gov/gene/230738)编码细胞中参与mrna降解的蛋白质zc3h12a。以上基因通过引用的方式全部并入到本发明中。
4、cn113151178a公开了一种敲除rc3h1基因和/或zc3h12a基因的重组t细胞及其应用,敲除rc3h1和/或zc3h12a的t细胞在体内持续时间均不超过1个月,治疗效果不佳,需要反复输入重组t细胞。 wo2020163365a2公开了一种降低选自socs1、ptpn2和zc3h12a 的至少两种内源靶基因的表达和/或功能的重组t细胞。目前,尚无使用同时靶向bcor基因和zc3h12a基因的重组免疫细胞用于疾病治疗或作为载体的现有技术。
技术实现思路
1、本发明发现,单独降低、清除bcor基因或zc3h12a基因不能赋予重组免疫细胞持久性或类永生化特性。基于该发现,本发明提供一种重组免疫细胞及其制备方法、基因调控系统和用途。通过降低或清除bcor基因和zc3h12a基因的表达和/或其生物学功能,增强了本发明重组免疫细胞的持久性,赋予重组免疫细胞极强的干性 (stemness)或类永生(immortal-like and functional)特性。
2、本发明的一个目的是提供一种重组免疫细胞,其bcor基因和 zc3h12a基因的表达和/或功能被降低或清除。
3、本发明的另一个目的是提供一种制备本发明所述重组免疫细胞的方法,包括采用基因敲除技术、基因沉默技术或失活突变技术或小分子抑制剂处理所述重组免疫细胞中的bcor基因和zc3h12a基因。
4、本发明的另一个目的是提供一种基因调控系统,用于本发明重组免疫细胞的制备。
5、本发明的另一个目的是提供一种包含本发明所述基因调控系统的试剂盒。
6、本发明的另一个目的是提供一种生产本发明所述重组免疫细胞的方法。
7、本发明的另一个目的是提供一种用于治疗疾病的组合物,其包含本发明所述的重组免疫细胞或基因调控系统。
8、本发明的另一个目的是提供一种在有需要的受试者中治疗疾病或病症的方法,包括向受试者施用本发明所述的重组免疫细胞、组合物或基因调控系统处理受试者的免疫细胞。
9、本发明的另一个目的是提供一种本发明所述的重组免疫细胞、组合物、基因调控系统处理受试者的免疫细胞,在制备治疗疾病或病症的药物中的用途。
10、本发明的另一个目的是提供一种本发明所述的重组免疫细胞作为稳定递送治疗疾病的生物分子的载体中的应用。
11、本发明的另一个目的是提供一种降低或清除免疫细胞中bcor 基因和zc3h12a基因的表达和/或功能的用途。所述用途包括增加免疫细胞干性(stemness)、抑制免疫细胞耗竭、促进免疫细胞扩增、赋予免疫细胞记忆性、延长免疫细胞持久性、增加免疫细胞自我更新能力。
12、本发明的另一个目的是提供一种动物模型的生产方法,该方法使用本发明所述的制备方法处理动物的免疫细胞或使用本发明所述基因调控系统引入动物的免疫细胞,或使用本发明所述的试剂盒处理动物的免疫细胞。
13、本发明的另一个目的是提供一种动物模型,该动物模型使用本发明所述的的方法进行生产。
14、本发明的一个目的是提供一种重组t细胞。
15、本发明提供的重组t细胞不含bcor基因和zc3h12a基因,或所述重组t细胞的bcor基因产物和zc3h12a基因产物的生物学功能被抑制。
16、上述重组t细胞是将靶标t细胞的bcor基因和zc3h12a基因敲除,且导入带有作用靶点的car结构或tcr结构或其他细胞过继治疗相应结构,得到的重组t细胞。
17、上述重组t细胞中,所述靶标t细胞为cd8 t细胞或其它类型的t细胞。
18、上述重组t细胞中,所述带有作用靶点的car结构为cd19-car 结构或识别其它靶点的car或tcr结构。
19、上述重组t细胞中,所述敲除为通过crispr-cas9方法或其它方法将所述靶标t细胞的bcor基因和zc3h12a基因敲除,或通过其它方法抑制bcor基因产物和zc3h12a基因产物的功能。
20、上述重组t细胞中,所述通过crispr-cas9方法将所述靶标t 细胞中bcor基因敲除时靶向bcor基因的靶序列为seq id no:3;所述通过crispr-cas9方法将所述靶标t细胞中zc3h12a基因敲除时靶向zc3h12a基因的靶序列为seq id no:4。
21、进一步的,所述重组细胞为将带有敲除时靶向bcor基因的靶序列、靶向zc3h12a基因的靶序列和表达cd19-car结构的载体导入靶标t细胞。
22、在本发明的实施例中,所述重组细胞为将 pmscv-hu6-sgbcor-hu6-sgzc3h12a-efs-thy1.1-p2a-cd19-car或 pmscv-hu6-sgbcor-mu6-sgzc3h12a-efs-thy1.1-p2a-人源cd19-car导入靶标cd8 t细胞得到的细胞。其中靶标cd8 t细胞来源于cas9转基因小鼠(来自jaxson laboratory,stock no:026430) 的脾脏分离得到cd8 t细胞。
23、上述重组t细胞还含有表达用于治疗疾病的相应分子的基因,在本发明的实施例中,治疗疾病的相应分子以治疗肠炎的il23r融合蛋白质为例。
24、本发明的另一个目的是提供一种制备上述重组t细胞的方法。
25、本发明提供的方法,为将靶标t细胞的bcor基因和zc3h12a 基因敲除或抑制靶标t细胞的bcor基因产物和zc3h12a基因产物的功能,且导入带有作用靶点的car结构或tcr结构或其他细胞过继治疗相应结构,得到的重组t细胞。
26、本发明提供的方法,为将靶标t细胞的bcor基因和zc3h12a 基因敲除或功能抑制,且导入带有作用靶点的car结构或tcr结构或其他细胞过继治疗相应结构,且导入表达用于治疗疾病的相关分子的载体,得到的重组t细胞。
27、在本发明的实施例中,治疗疾病的相应分子以治疗肠炎的il23r 融合蛋白质为例。
28、上述重组t细胞在制备预防和/或抗肿瘤的产品中的应用也是本发明保护的范围。
29、上述的重组t细胞在制备抑制肿瘤生长和/或转移的产品中的应用也是本发明保护的范围。
30、上述重组t细胞在制备清除机体内car结构的靶向细胞的产品也是本发明保护的范围。
31、上述重组t细胞在作为药物载体中的应用也是本发明保护的范围。
32、本发明还提供了一种用于治疗疾病的产品,其按照如下方法制备:
33、1)将靶标t细胞的bcor基因和zc3h12a基因敲除或抑制靶标t细胞的bcor基因产物和zc3h12a基因产物的功能,且导入带有作用靶点的car结构或tcr结构或其他细胞过继治疗相应结构,且导入表达用于治疗疾病的相关分子的载体,得到的重组t细胞;
34、2)将表达用于治疗疾病的相关分子的载体导入权利要求1-6任一所述的重组t细胞,得到的重组t细胞。
35、在本发明的实施例中,治疗疾病的相应分子以治疗肠炎的il23r 和治疗肥胖的glp1为例。
36、敲除bcor基因和zc3h12a基因的物质或抑制bcor基因和 zc3h12a基因表达的物质在如下任一中的应用也是本发明保护的范围:
37、1)在制备促进t细胞扩增的产品中的应用;
38、2)在制备抗肿瘤或抗自身免疫疾病产品中的应用;
39、3)在制备预防肿瘤或预防自身免疫疾病产品中的应用;
40、4)在制备抑制肿瘤生长和/或转移的产品中的应用;
41、5)在制备重组t细胞中的应用;
42、6)在制备延长t细胞在体内存在的持久性和/或稳定性的产品中的应用;
43、7)在制备具有记忆效应的t细胞中的应用;
44、8)在制备具有自我更新能力的t细胞中的应用;
45、9)在制备用于稳定递送治疗性生物制剂的药物载体中的应用。
46、本发明的实验证明,本发明通过基因编辑获得zc3h12a/bcor 双基因敲除的car-t细胞,与传统的car-t细胞相比具有极大的优势,即1)不需要对患者进行毒副作用极大的预处理;例如,在肿瘤治疗中,可以在不需要化疗预处理的条件下进行car-t治疗,并且这些car-t在体内永久存在,达到治愈肿瘤、防止复发的目的;在小鼠模型中,经过基因编辑的car-t细胞不需要化疗预处理即可在体内大量扩增并杀伤靶细胞;这些细胞具有干细胞性质,可以在体内无限期存在,达到治愈的目的;2)只需要少量的细胞即可进行有效的治疗;3)经过基因编辑的car-t细胞在体内长期存在,相当于在体内长期稳定植入了一群细胞,解决car-t治疗长效性的问题,单次治疗可达到长期治疗和预防效果。4)这些体内长期存在的car-t 细胞也可以作为载体,分泌具有治疗作用的蛋白质,包括抗体、多肽和激素等,这些细胞可以作为一个通用平台分泌各种治疗性生物制剂 (如抗体、多肽、激素等)。该技术将极大地降低反复给药的医疗成本,并达到治愈一些疾病的目的。
47、发明详述
48、重组免疫细胞
49、在一个实施方案中,本发明提供一种重组免疫细胞,重组免疫细胞中的bcor基因和zc3h12a基因的表达和/或功能被降低或清除。
50、在一些实施方案中,所述的免疫细胞选自t细胞、b细胞、nk 细胞、肥大细胞、肿瘤浸润淋巴细胞中的一种或数种,优选t细胞或 nk细胞;所述t细胞选自cd4+cd8+t细胞、cd8+t细胞、cd4+t 细胞、效应t细胞、抑制性t细胞、原始t细胞、记忆t细胞、γ- δt细胞、α-βt细胞、cd4-cd8-双阴性t细胞或nkt细胞中的一种或数种。
51、在一些实施方案中,所述重组免疫细胞为重组t细胞,重组t细胞不含bcor基因和zc3h12a基因,或所述重组t细胞的bcor基因产物和zc3h12a基因产物的生物学功能被抑制。
52、表1靶基因
53、
54、在一些实施方案中,采用基因敲除技术、基因沉默技术、失活突变技术、protac技术或小分子抑制剂处理所述重组免疫细胞中的 bcor基因和zc3h12a基因。
55、在一些实施方案中,与未修饰或对照免疫细胞相比,本发明的重组免疫细胞bcor基因和zc3h12a基因的表达或功能分别地被降低了至少50%、至少60%、至少70%、至少80%、至少90%、至少 95%或100%。
56、在一些实施方案中,本发明所述的重组免疫细胞包括一种或多种用于细胞过继治疗的结构。
57、在一些实施方案中,用于细胞过继治疗的相应结构为嵌合抗原受体(car)结构、t细胞抗原受体(tcr)结构、基于配受体结合的受体结构或t细胞受体和抗原受体(synthetict cell receptor and antigen receptor,star)。对于star的描述参见wo2020029774a1和yue liu.et,al.chimeric star receptors using tcr machinery mediate robustresponses against solid tumors.sci transl med.2021mar 24;13(586):eabb5191.doi:10.1126/scitranslmed.abb5191。
58、在一些实施方案中,抗原受体结合的抗原选自rorl、her2、 ll-cam、cd4、cd5、cd8、cd19、cd20、bcma、cd7、clauding 18.2、gpc3、msln、afp、cd22、间皮素、cea、乙型肝炎表面抗原、抗叶酸受体、cd23、cd24、cd30、cd33、cd38、cd44、 egfr、egfrviii、egp-2、egp-4、epha2、erbb2、erbb3、erbb4、 fbp、胎儿型乙酰胆碱受体、gd2、gd3、hmwmaa、il-22r-α、 il-13r-α2、kdr、κ轻链、lewis y、l1-细胞黏附分子(cd171)、 mage-a1、间皮素、muc1、muc16、psca、nkg2d配体、ny-eso-1、 mart-1、gp100、瘤胚抗原、tag72、vegf-r2、癌胚抗原(cea)、前列腺特异性抗原、psma、雌激素受体、孕酮受体、肝配蛋白b2、 cd123、cs-1、c-met、mage a3、ce7、肾母细胞瘤1(wt-1)、周期蛋白a1(ccna1)、白细胞介素12或其他肿瘤相关抗原中的一种或数种。
59、在一些实施方案中,重组免疫细胞是源自哺乳动物的免疫细胞。所述的哺乳动物包括、灵长类动物(例如人、猴子)、牛、绵羊、山羊、羊驼、马、狗、猫、兔、大鼠、小鼠等。
60、在一些实施方案中,所述重组免疫细胞还含有表达用于治疗疾病的生物分子的基因。所述表达治疗疾病的生物分子选自:细胞因子、激素、生长因子、凝血因子、血细胞表达的、趋化因子、共刺激分子、活化肽、抗体或其抗原结合片段。具体地,所述治疗疾病的生物分子选自il-23r蛋白、il-4r抗体、ifn-α、ifn-β、ifn-γ、il-2、il-3、 il-4、il-5、il-6、il-8、il-12、il-13、il-22、il-23、il-24、tnf、 tnf-α、gm-csf、cd40l、ctla-4、flt3l、trail、light、glp1 中的一种或数种。
61、在一些实施方案中,在给与受试者至少1周、2周、3周、4周、 1个月、2个月、3个月、4个月、5个月、6个月、9个月、12个月、 18个月、2年、5年、10年、20年、40年之后,在受试者外周血能够检测到所述重组免疫细胞。在一些实施方案中,所述的重组免疫细胞为类永生化的免疫细胞。该类永生化的重组免疫细胞为非肿瘤细胞。
62、在一些实施方案中,在给与受试者至少1周、2周、3周、4周、 1个月、2个月、3个月、4个月、5个月、6个月、9个月、12个月之后,相对于同类免疫细胞总量,所述bcor基因和zc3h12a基因的表达和/或功能被降低或清除的重组免疫细胞的比例不低于20%、 30%、40%、50%、60%、70%、80%、90%、95%。
63、在另一些实施方案中,在给与受试者至少1周、2周、3周、4 周、1个月、2个月、3个月、4个月、5个月、6个月、9个月、12 个月之后,相对于外周血细胞总数,所述bcor基因和zc3h12a基因的表达和/或功能被降低或清除的重组免疫细胞的比例选自 1%-35%、3-30%、3-20%;具体数值可以是上述数值范围内的任意值,包括但不限于1%、3%、5%、10%、15%、20%、25%、30%、35%。
64、在另一些实施方案中,与未修饰的免疫效应细胞相比,本发明所述的重组免疫效应细胞表现出增加的或延长的细胞存活力。在此类实施方案中,结果是在给定的时间段之后,与未修饰的免疫效应细胞相比,存在的修饰的免疫效应细胞的数目增加。例如,在一些实施方案中,本发明所述的修饰的免疫效应细胞保持活力并持续的时间比未修饰的免疫细胞长1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、 2、2.5、3、3.5、4、4.5、5、6、7、8、9、10、15、20、25、30、 35、40、45、50、60、70、80、90、100或更多倍。
65、在一些实施方案中,与未修饰的免疫细胞群体观察到的治疗疾病的生物分子的产量相比,重组免疫效应细胞的治疗疾病的生物分子 (例如,il23r、tnf或il-5、glp1)的产量增加1.1、1.2、1.3、1.4、 1.5、1.6、1.7、1.8、1.9、2.0、2.5、3.0、3.5、4.0、4.5、5、6、 7、8、9、10、15、20、30、35、40、45、50、60、70、80、90、100 或更多倍。
66、重组免疫细胞的制备方法
67、在另一个实施方案中,本发明提供一种上述重组免疫细胞的制备方法。该方法包括采用基因敲除技术、基因沉默技术或失活突变技术或小分子抑制剂处理所述重组免疫细胞中的bcor基因和zc3h12a 基因。
68、在一些实施方案中,所述基因敲除技术包括crispr/cas技术、人工锌指核酸酶(zinc finger nucleases,zfn)技术、转录激活样效应因子(transcription activator-like effector,tale)技术或 tale-crispr/cas技术。
69、在一些实施方案中,所述crispr/cas技术选自crispr-cas3、 crispr-cas9、crispr-cas12、crispr-cas13、crispr-casx或 crispr-iscb系统。对crispr-casx系统的描述参见liu j.j.et al., nature,2019或https://doi.org/10.1016/j.molcel.2022.02.002。对 crispr-iscb系统的描述参见han altae-tran.et al.,science 374, vol 374,issue 6563,57–65(2021).doi:10.1126/science.abj6856.
70、在一些实施方案中,所述crispr/cas技术具体选自 crispr-cas9、crispr-cas12a、crispr-cas12b、crispr-cas13a、 crispr-cas13b、crispr-cas13c、crispr-cas13e或crispr-cas13f 系统。
71、在一些实施方案中,crispr/cas技术中使用靶向bcor基因指导rna(grna)和cas核酸内切酶,和靶向zc3h12a基因的指导 rna(grna)和cas核酸内切酶。
72、在一些实施方案中,crispr/cas技术的指导rna(grna)中同时或分别包括靶向bcor基因指导rna(grna)和靶向zc3h12a基因的指导rna(grna)。
73、本发明提供了将定点修饰多肽定向至具体靶核酸序列的指导 rna(grna)。grna包含核酸靶向区段和蛋白质结合区段。grna的核酸靶向区段包含与靶核酸序列中的序列互补的核苷酸序列。因此,grna的核酸靶向区段经由杂交(即碱基配对)以序列特异性方式与靶核酸相互作用,并且核酸靶向区段的核苷酸序列确定grna将结合的靶核酸内的位置。grna的核酸靶向区段可以被修饰(例如,通过遗传工程)以与靶核酸序列内的任何所需序列杂交。
74、指导rna的蛋白结合区段与定点修饰多肽(例如,cas蛋白)相互作用以形成复合物。指导rna通过上述核酸靶向区段将结合的多肽指导至靶核酸内的特定核苷酸序列。指导rna的蛋白结合区段包含两个核苷酸片段,它们彼此互补并形成双链rna双链体。
75、在一些实施方案中,grna包含两个单独的rna分子。在此类实施方案中,两个rna分子中的每一个都包含一段彼此互补的核苷酸,使得两个rna分子的互补核苷酸杂交以形成蛋白质结合区段的双链rna双链体。在一些实施方案中,grna包含单个rna分子 (sgrna)。
76、grna对靶基因座的特异性由核酸结合区段的序列介导,所述核酸结合区段包含与靶基因座内的靶核酸序列互补的20个核苷酸。在一些实施方案中,对应的靶核酸序列的长度为20个核苷酸。在一些实施方案中,本发明的grna序列的核酸结合区段与靶基因座内的靶核酸序列至少90%互补。在一些实施方案中,本发明的grna 序列的核酸结合区段与靶基因座内的靶核酸序列至少95%、96%、97 %、98%或99%互补。在一些实施方案中,本发明的grna序列的核酸结合区段与靶基因座内的靶核酸序列100%互补。在一些实施方案中,靶核酸序列是rna靶序列。在一些实施方案中,靶核酸序列是dna靶序列。
77、在一些实施方案中,必须改变靶基因座内的靶核酸序列。例如,靶核酸序列可能会发生变化,因为所用的cas蛋白发生变化并且新的 cas蛋白具有不同的pam。本说明书在本文提供的说明书和表格中提供了grna的靶核酸序列的许多实例。这些靶核酸序列中的任一个可以通过在给定基因内的靶基因座内的5'或3'移动靶核酸序列来改变。在一些实施方案中,靶核酸序列在给定基因内的靶基因座内的5'或3 '移动至多100bp。在其他实施方案中,靶核酸序列在给定基因内(例如,表1所述的人或小鼠的bcor基因和/或zc3h12a基因)的靶基因座内的5'或3'移动至多1、2、3、4、5、6、7、8、9、10、11、12、 13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、 40、45、50、55、60、65、70、75、80、85、90或95bp。
78、在一些实施方案中,靶向bcor基因指导rna(grna)中的核酸结合区段结合与受试者bcor基因(例如,ncbi gene id:54880或 ncbi gene id:71458)编码的dna序列具有至少90%、95%、96%、 97%、98%、99%或100%同一性的靶dna序列;靶向zc3h12a基因指导rna(grna)中的核酸结合区段结合与受试者zc3h12a基因 (例如,ncbi gene id:80149或ncbigene id:230738)编码的dna 序列具有至少90%、95%、96%、97%、98%、99%或100%同一性的靶dna序列。
79、在一些实施方案中,靶向zc3h12a基因指导rna(grna)中的核酸结合区段结合与wo2020163365a2表7或表8中所示的一组基因组坐标所限定的dna序列具有至少95%、96%、97%、98%、99 %或100%同一性的靶dna序列。或者,靶向zc3h12a的grna分子的核酸结合区段结合与wo2020163365a2表16和17中所示一种具有至少95%、96%、97%、98%、99%或100%同一性的靶dna 序列。
80、在一些实施方案中,靶向bcor基因指导rna(grna)中的靶向结构域包含序列actgggcaataccgcaacag(seq id no:3)或者与seq id no:3具有至少85%、90%、95%同一性的序列;靶向 zc3h12a基因的指导rna(grna)的靶向结构域包含序列ctaggggaattggtgaagca(seq id no:4)或者与seq id no:4 具有至少85%、90%、95%同一性的序列。
81、在一些实施方案中,进一步向免疫细胞中进一步导入带有作用靶点的car结构或tcr结构或其他细胞过继治疗相应结构的序列。
82、在一些实施方案中,进一步向免疫细胞中导入表达用于治疗疾病的生物分子。优选的,所述治疗疾病的生物分子选自il-23r蛋白、 il-4r抗体、ifn-α、ifn-β、ifn-γ、il-2、il-3、il-4、il-5、il-6、 il-8、il-12、il-13、il-22、il-23、il-24、tnf、tnf-α、gm-csf、cd40l、ctla-4、flt3l、trail、light、glp1中的一种或数种。
83、在一些实施方案中,使用的载体为是病毒载体、类病毒载体或非病毒载体,在一些实施方案中,包含编码本文所述的基因调控系统的一种或多种组分的多核苷酸的重组载体是病毒载体。合适的病毒载体包括但不限于基于以下的病毒载体:痘苗病毒、脊髓灰质炎病毒、腺病毒、腺相关病毒、sv40、单纯疱疹病毒、人类免疫缺陷病毒、逆转录病毒载体(例如,鼠白血病病毒、脾坏死病毒、和衍生自逆转录病毒的载体,例如劳斯肉瘤病毒、哈维肉瘤病毒、禽白血病病毒、慢病毒、人免疫缺陷病毒、骨髓增生性肉瘤病毒和乳腺肿瘤病毒)等。合适的非病毒载体选自转座子、脂质纳米颗粒、脂质体、外泌体、减毒细菌或病毒样颗粒。
84、在一些实施方案中,编码本文描述的基因调控系统的一种或多种组分的多核苷酸序列可操作地连接到控制元件,例如转录控制元件,诸如启动子。转录控制元件在真核细胞(例如,哺乳动物细胞)或原核细胞(例如,细菌或古细菌细胞)中可以是功能性的。在一些实施方案中,编码本文所述的基因调控系统的一种或多种组分的多核苷酸序列可操作地连接到多个控制元件,其允许多核苷酸在原核和真核细胞中都表达。根据所使用的细胞类型和基因调控系统,许多合适的转录和翻译控制元件中的任一个(包括组成型和诱导型启动子、转录增强子元件、转录终止子等)都可用于表达载体中。
85、在一些实施方案中,合适的真核启动子(在真核细胞中起作用的启动子)的非限制性实例包括来自巨细胞病毒(cmv)立即早期、单纯疱疹病毒(hsv)胸苷激酶、早期和晚期sv40、来自逆转录病毒的长末端重复序列(ltr)和小鼠金属硫蛋白-1的那些。合适的载体和启动子的选择完全在本领域普通技术人员的能力范围内。表达载体还可包含用于翻译起始的核糖体结合位点和转录终止子。表达载体还可以包括用于扩增表达的适当序列。表达载体还可包含编码与定点修饰多肽融合的蛋白质标签(例如,6xhis标签、血凝素标签、绿色荧光蛋白等)的核苷酸序列,从而产生嵌合多肽。
86、在一些实施方案中,使用的sgrna表达载体包括:载体-启动子 1-sgzc3h12a-启动子2-标签-p2a-治疗疾病的生物分子序列、载体-启动子1-sgbcor-启动子2-标签-p2a-治疗疾病的生物分子序列或 pmscv-启动子1-sgbcor-启动子2-sgzc3h12a-启动子3-标签-p2a-治疗疾病的生物分子序列基本结构。上述“-”不代表对特定连接顺序的限制,应理解为包含相关元件表达载体。上述治疗疾病的生物分子序列包括本发明所述重组免疫细胞中的过继治疗的结构序列或治疗疾病的生物分子中的一种或数种。具体地,sgrna表达载体包括pmscv-hu6-sgzc3h12a-efs-thy1.1-p2a-cd19-car、pmscv-hu6- sgbcor-efs-thy1.1-p2a-cd19-car或 pmscv-hu6-sgbcor-hu6-sgzc3h12a-efs-thy1.1-p2a-cd19-car的基本结构。更进一步地,更进一步地,表达载体中各启动子,如启动子1、启动子2和启动3,可以相同或不同;所述标签任选存在或缺失;所述治疗疾病的生物分子序列任选存在或缺失。
87、在一些实施方案中,本发明制备重组免疫细胞的方法,包括向重组免疫细胞中导入表达载体的步骤。将多核苷酸和重组表达载体导入宿主细胞的方法是本领域已知的,并且可以使用任何已知方法来将基因调控系统的组分引入细胞。合适的方法包括例如病毒或噬菌体感染、转染、缀合、原生质体融合、脂质转染、电穿孔、磷酸钙沉淀、聚乙烯亚胺(pei)介导的转染、deae-葡聚糖介导的转染、脂质体介导的转染、粒子枪技术、磷酸钙沉淀、直接显微注射、纳米颗粒介导的核酸递送、微流体递送方法等。此外,还可以施用非病毒递送媒介物中引入细胞,所述非病毒递送媒介物诸如转座子、纳米颗粒(例如脂质纳米颗粒)、脂质体、外泌体、减毒细菌或病毒样
88、颗粒。
89、基因调控系统
90、在另一个实施方案中,本发明提供一种基因调控系统。所述基因调控系统用于本发明所述重组免疫细胞的制备。
91、在一些实施方案中,本发明的基因调控系统将免疫细胞中的 bcor基因和zc3h12a基因的表达或功能分别地降低了至少50%、至少60%、至少70%、至少80%、至少90%、至少95%或100%。
92、在一些实施方案中,本发明基因调控系统采用基因敲除技术、基因沉默技术或失活突变技术或小分子抑制剂处理所述重组免疫细胞中的bcor基因和zc3h12a基因。
93、在一些实施方案中,使用的基因敲除技术包括crispr/cas技术、人工锌指核酸酶(zinc finger nucleases,zfn)技术、转录激活样效应因子(transcription activator-like effector,tale)技术或tale-crispr/cas技术。
94、在一些实施方案中,基因调控系统包含核酸分子和酶蛋白,其中所述核酸分子是指导rna(grna)分子,并且所述酶蛋白是cas蛋白或cas直系同源物。
95、在一些实施方案中,所述酶蛋白选自cas9、cas12a、cas12b、 cas13a、cas13b、cas13c、cas13e或cas13f蛋白或其直系同源物。
96、在一些实施方案中,本发明的基因调控系统包括:
97、(i)靶向bcor基因指导rna(grna)中的靶向结构域序列与第一cas核酸内切酶蛋白复合以形成第一核糖核蛋白(rnp)复合物;和;
98、(ii)靶向zc3h12a基因指导rna(grna)中的靶向结构域序列与第二cas核酸内切酶蛋白复合以形成第二核糖核蛋白(rnp)复合物。
99、在一些实施方案中,第一核糖核蛋白(rnp)复合物和第二核糖核蛋白(rnp)复合物可同时、顺序或先后的导入到免疫细胞中。
100、在一些实施方案中,本发明的基因调控系统中,靶向bcor基因指导rna(grna)中的核酸结合区段结合与受试者bcor基因(例如, ncbi gene id:54880或ncbi gene id:71458)编码的dna序列具有至少90%、95%、96%、97%、98%、99%或100%同一性的靶dna序列;靶向zc3h12a基因指导rna(grna)中的核酸结合区段结合与受试者zc3h12a基因(例如,ncbi gene id:80149或ncbi gene id:230738)编码的dna序列具有至少90%、95%、96%、97%、98 %、99%或100%同一性的靶dna序列。
101、在一些实施方案中,本发明的基因调控系统中,靶向bcor基因指导rna(grna)中的靶向结构域包含序列 actgggcaataccgcaacag(seq id no:3)或者与seq id no:3 具有至少85%、90%、95%同一性的序列;靶向zc3h12a基因的指导rna(grna)的靶向结构域包含序列 ctaggggaattggtgaagca(seq id no:4)或者与seq id no:4 具有至少85%、90%、95%同一性的序列。
102、在一些实施方案中,本发明的基因调控系统中,向免疫细胞进一步导入带有作用靶点的car结构、tcr结构、基于配受体结合的受体结构、star结构或其他细胞过继治疗相应结构的序列。
103、在一些实施方案中,本发明的基因调控系统中,向免疫细胞进一步导入表达用于治疗疾病的生物分子;优选的,所述治疗疾病的生物分子选自il-23r蛋白、il-4r抗体、ifn-α、ifn-β、ifn-γ、il-2、 il-3、il-4、il-5、il-6、il-8、il-12、il-13、il-22、il-23、il-24、tnf、tnf-α、gm-csf、cd40l、ctla-4、flt3l、trail、light、 glp1中的一种或数种。
104、在一些实施方案中,本发明的基因调控系统使用的载体是病毒载体、类病毒载体或非病毒载体。病毒载体优选痘苗病毒、脊髓灰质炎病毒、腺病毒、腺相关病毒、sv40、单纯疱疹病毒、人类免疫缺陷病毒、逆转录病毒载体。非病毒载体优选转座子、脂质纳米颗粒、脂质体、外泌体、减毒细菌或病毒样颗粒。
105、在一些实施方案中,本发明的基因调控系统中使用的rna(grna) 表达载体包括:载体-启动子1-sgzc3h12a-启动子2-标签-p2a-治疗疾病的生物分子序列、载体-启动子1-sgbcor-启动子2-标签-p2a-治疗疾病的生物分子序列或pmscv-启动子1-sgbcor-启动子2-sgzc3h12a- 启动子3-标签-p2a-治疗疾病的生物分子序列基本结构。上述“-”不代表对特定连接顺序的限制,应理解为包含相关元件表达载体。上述治疗疾病的生物分子序列包括本发明所述重组免疫细胞中的过继治疗的结构序列或治疗疾病的生物分子中的一种或数种。具体地, sgrna表达载体包括 pmscv-hu6-sgzc3h12a-efs-thy1.1-p2a-cd19-car、pmscv-hu6- sgbcor-efs-thy1.1-p2a-cd19-car或 pmscv-hu6-sgbcor-hu6-sgzc3h12a-efs-thy1.1-p2a-cd19-car的基本结构。更进一步地,表达载体中各启动子,如启动子1、启动子 2和启动3,可以相同或不同;所述标签任选存在或缺失;所述治疗疾病的生物分子序列任选存在或缺失。
106、在另一个实施方案中,本发明提供一种包含上述基因调控系统的试剂盒。
107、生产重组免疫细胞的方法
108、在另一个实施方案中,本发明提供生产上述重组免疫细胞的方法,其包括:
109、(1)获得免疫细胞;
110、(2)使用上述任意一个实施方案所述的制备方法处理免疫细胞,或将上述任意一个实施方案所述的基因调控系统引入免疫细胞,或使用上述任意一个实施方案所述的试剂盒处理免疫细胞;
111、(3)培养免疫细胞,将免疫细胞中的bcor基因和zc3h12a 基因的表达和/或功能被降低或清除。
112、在一些实施方案中,将步骤(3)获得的重组免疫细胞植入到受试者体内进行扩增,并获取体内扩增后的重组免疫细胞。从第一代受试者体内扩增后的获取重组免疫细胞,可用于受试者的自体治疗或用于其他受试者的异体治疗。
113、在一些实施方案中,免疫细胞对于受试者是自体的免疫细胞,或同种异体的免疫细胞。
114、组合物
115、在另一个实施方案中,本发明提供一种用于治疗疾病的组合物。术语“组合物”是指本文所述的基因调控系统或修饰的免疫效应细胞的制剂,其能够施用或递送至受试者或细胞。“治疗性组合物”或“药物组合物”(在本文中可互换使用)是基因调控系统或修饰的重组免疫效应细胞的组合物,其能够施用于受试者以治疗特定的疾病或病症,或者与细胞接触以修饰一种或多种靶基因。
116、在一些实施方案中,治疗疾病的组合物包含上述任意一个实施方案所述的重组免疫细胞。
117、在一些实施方案中,治疗疾病的组合物包含上述任意一个实施方案所述的基因调控系统。
118、治疗疾病或病症的方法
119、在另一个实施方案中,本发明提供一种在有需要的受试者中治疗疾病或病症的方法。所述方法包括向受试者施用上述任意一个实施方案所述所述的重组免疫细胞,或施用上述任意一个实施方案所述所述的组合物,或使用上述任意一个实施方案所述的基因调控系统处理受试者的免疫细胞。
120、在一些实施方案中,所述疾病或病症是癌症、肿瘤、自身免疫性疾病、感染性疾病、炎症性疾病、代谢性疾病、神经退行性疾病、外源性car结构靶向细胞引发的疾病、外源性tcr结构靶向细胞引发的疾病。
121、在一些实施方案中,所述癌症或肿瘤包括以下的一种或多种:白血病、淋巴瘤、慢性淋巴细胞白血病(cll)、急性淋巴细胞白血病(all)、非霍奇金淋巴瘤、急性髓性白血病、多发性骨髓瘤、难治性滤泡性淋巴瘤、套细胞淋巴瘤、惰性b细胞淋巴瘤、b细胞恶性肿瘤、结肠癌、肺癌、肝癌、乳腺癌、前列腺癌、卵巢癌、皮肤癌、黑色素瘤、骨癌、和脑癌、卵巢癌、上皮癌、肾细胞癌、胰腺癌、霍奇金淋巴瘤、宫颈癌、结肠直肠癌、胶质母细胞瘤、神经母细胞瘤、尤因肉瘤、髓母细胞瘤、骨肉瘤、滑膜肉瘤、和/或间皮瘤;所述自身免疫性疾病包括以下的一种或多种:强直性脊柱炎(as),牛皮癣(ps),乳糜泻(cel),系统性红斑狼疮(sle),普通变异型免疫缺陷病(cvid),炎症性肠病(ibd),溃疡性结肠炎(uc),i型糖尿病(tld),幼年特发性关节炎(jia),克罗恩病(cd),斑秃(aa),多发性硬化(ms),原发性胆汁性肝硬化(pbc),原发性硬化性胆管炎(psc),类风湿性关节炎(ra),干燥综合征(sjo),系统性硬化病(ssc),脊柱关节病(spa),白癫风(vit),哮喘,或甲状腺炎(aitd,thy或th)。
122、制药用途
123、在另一个实施方案中,本发明提供一种制备药物的用途。
124、在一些实施方案中,本发明提供上述任意一个实施方案所述的的重组免疫细胞,在制备在有需要的受试者中治疗疾病或病症的药物中的用途。
125、在一些实施方案中,本发明提供上述任意一个实施方案所述的组合物,在制备在有需要的受试者中治疗疾病或病症的药物中的用途。
126、在一些实施方案中,本发明提供上述任意一个实施方案所述的基因调控系统处理受试者的免疫细胞,在制备在有需要的受试者中治疗疾病或病症的药物中的用途。
127、递送载体的应用
128、在另一个实施方案中,本发明提供一种重组免疫细胞作为稳定递送治疗疾病的生物分子的载体中的应用。
129、在一些实施方案中,所述重组免疫细胞是上述任意一个实施方案所述的重组免疫细胞,或使用上述任意一个实施方案所述的基因调控系统处理受试者的免疫细胞;所述递送治疗疾病的生物分子选自上述任意一个实施方案所述的任意一种或数种递送治疗疾病的生物分子。
130、在一些实施方案中,所述表达治疗疾病的生物分子选自:细胞因子、激素、生长因子、凝血因子、血细胞表达的、趋化因子、共刺激分子、活化肽、抗体或其抗原结合片段。具体地,所述治疗疾病的生物分子选自il-23r蛋白、il-4r抗体、ifn-α、ifn-β、ifn-γ、il-2、il-3、il-4、il-5、il-6、il-8、il-12、il-13、il-22、il-23、il-24、 tnf、tnf-α、gm-csf、cd40l、ctla-4、flt3l、trail、light、 glp1中的一种或数种。
131、降低或清除目标基因的表达和/或功能的用途
132、在另一个实施方案中,本发明提供一种降低或清除免疫细胞中 bcor基因和zc3h12a基因的表达和/或功能的用途。
133、在一些实施方案中,所述用途包括增加免疫细胞干性(stemness)、抑制免疫细胞耗竭、促进免疫细胞扩增、赋予免疫细胞记忆性、延长免疫细胞持久性、增加免疫细胞自我更新能力。
134、在一些实施方案中,所述重组免疫细胞是上述任意一个实施方案所述的重组免疫细胞,或使用上述任意一个实施方案所述的基因调控系统处理受试者的免疫细胞。
135、在一些实施方案中,所述用途为治疗目的或非治疗目的。在一些实施方案中,所述非治疗目的包括,将免疫细胞用于可被dna编码的蛋白质的制备或用于治疗性组合物的的制备。优选的,可被dna 编码的蛋白质包括上述任意一个实施方案所述的任意一种或数种递送治疗疾病的生物分子。
136、动物模型
137、在另一个实施方案中,本发明提供一种动物模型的生产方法。
138、在一些实施方案中,动物模型的生产方法使用上述任意一个实施方案所述的制备方法处理动物的免疫细胞,或将上述任意一个实施方案所述的基因调控系统引入动物的免疫细胞,或使用上述任意一个实施方案所述的试剂盒处理动物的免疫细胞。
139、在另一个实施方案中,本发明提供一种上述方法生产的动物模型。
140、在另一个实施方案中,本发明提供上述任意一个实施方案所述的重组免疫细胞、基因调控系统或试剂盒在制备动物模型中的用途。
141、定义
142、“bcor基因”和“bcor基因”在没有特别定义的前提下可以相互替换使用。所述“bcor基因是任意目标受试者的bcor基因。
143、“zc3h12a基因”和“zc3h12a基因”在没有特别定义的前提下可以相互替换使用。所述“zc3h12a基因”是任意目标受试者的“zc3h12a基因”。
144、“干性(stemness)”又称“干细胞特性”,是指细胞具有自我更新能力和向不同的细胞分化的能力。
145、“类永生化”或“类永生”(immortal-like and functional,简写为if)是指细胞获得持续生长增殖能力的特性,并且没有恶性转化的表型特征、无成瘤性、无肿瘤细胞具有的浸润性和转移性。本文中,使用下标if表示同时敲除bcor和zc3h12a的具有“类永生化”性质的t细胞,简称tif,包括car19tif、gd2tif和egfrtif。
146、“受试者”或“宿主”是指人类或非人类动物,包括哺乳动物。例如,灵长类动物(如人、猴)、牛、绵羊、山羊、羊驼、马、狗、猫、兔、大鼠、小鼠之类。“受试者”或“宿主”包括治疗型和非治疗型。“受试者”或“宿主”包括实验用动物模型或用于生产表达治疗疾病的生物分子的动物,即“非治疗型宿主”或“非治疗型受试者”。
147、“用于治疗疾病的相关分子”或“用于治疗疾病的生物分子”在没有特定定义的情况下,是指通过“外源基因”导入免疫细胞并通过重组免疫细胞分泌的相关分子或生物分子。
148、有益效果
149、本发明的实验证明,本发明通过基因编辑获得zc3h12a/bcor 双基因敲除的car-t细胞,与传统的car-t细胞相比具有极大的优势,这些优势单独敲除zc3h12a或bcor基因无法获得:
150、1)不需要对患者进行毒副作用极大的预处理;例如,在肿瘤治疗中,可以在不需要化疗预处理的条件下进行car-t治疗,并且这些car-t细胞在体内永久存在,达到治愈肿瘤、防止复发的目的;在小鼠模型中,经过基因编辑的car-t细胞不需要化疗预处理即可在体内大量扩增并杀伤靶细胞;这些细胞具有干细胞性质,可以在体内无限期存在,达到治愈的目的;
151、2)使用少量的重组细胞即可进行有效的治疗;
152、3)经过基因编辑的car-t细胞在体内长期存在,相当于在体内长期稳定植入了一群细胞,解决car-t治疗长效性的问题,单次治疗可达到长期治疗和预防效果。
153、4)这些体内长期存在的car-t细胞也可以作为载体,分泌具有治疗作用的蛋白质,包括抗体、多肽和激素等,这些重组免疫细胞可以作为通用型载体平台,分泌各种治疗性生物分子(如抗体、多肽、激素等)。该技术将极大地降低反复给药的医疗成本,并达到治愈一些疾病的目的。
- 还没有人留言评论。精彩留言会获得点赞!