一种PCR缓冲液及其应用的制作方法
一种pcr缓冲液及其应用
技术领域
1.本发明属于生物制品技术领域,具体涉及一种pcr缓冲液及其制备方法和应用。
背景技术:
2.实时荧光定量pcr(quantitative real-time pcr)是一种在dna扩增反应中,以荧光化学物质测每次聚合酶链式反应(pcr)循环后产物总量的方法。通过内参或者外参法对待测样品中的特定dna序列进行定量分析的方法。将标记有荧光素的taqman探针与模板dna混合后,完成高温变性,低温复性,适温延伸的热循环,并遵守聚合酶链反应规律,与模板dna互补配对的taqman探针被切断,荧光素游离于反应体系中,在特定光激发下发出荧光,随着循环次数的增加,被扩增的目的基因片段呈指数规律增长,通过实时检测与之对应的随扩增而变化荧光信号强度,求得ct值,同时利用数个已知模板浓度的标准品作对照,即可得出待测标本目的基因的拷贝数。
3.pcr的用途:1、核酸的基础研究:基因组克隆2、不对称pcr制备单链dna用于dna测序3、反向pcr测定未知dna区域4、反转录pcr(rt-pcr)用于检测细胞中基因表达水平、rna病毒量以及直接克隆特定基因的cdna5、荧光定量pcr用于对pcr产物实时监控6、cdna末端快速扩增技术7、检测基因的表达8、医学应用:检测细菌、病毒类疾病;诊断遗传疾病;诊断肿瘤;应用于法医物证学。
4.因此,获得准确的检测结果ct值在临床诊断阶段非常重要。
5.因此,提供一种可大大提高pcr扩增体系的稳定性和灵敏度,对难以扩增的样本模板具有更好的扩增效率的pcr缓冲液非常重要。
技术实现要素:
6.为解决上述问题,本发明公开了一种pcr缓冲液,可大大提高pcr扩增体系的稳定性和灵敏度,对难以扩增的样本模板具有更好的扩增效率。
7.为达到上述目的,本发明的技术方案如下:
8.一种pcr缓冲液,由以下成分组成:100mm-500mm tris-hcl,20mm-50mm kcl,1mm-10mm mgcl2,10mm-50mm硫酸铵,100μm-500μm dntp,1mm-5mm dtt,1%-5%dmso,0.01%-0.05%吐温20,余量为无核酸酶水。
9.进一步,由以下成分组成:150mm tris-hcl,30mm kcl,10mm mgcl2,35mm硫酸铵,400μm dntp,2mm dtt,3%vol dmso,0.02%vol吐温20,余量为无核酸酶水。
10.进一步,所述pcr缓冲液的ph为7.5-9.0。
11.一种pcr缓冲液的制备方法,具体步骤如下:
12.(1)按具体浓度称量或稀释tris-hcl、kcl、mgcl2、硫酸铵、dntp、dtt、dmso、吐温20,溶于无核酸酶水;
13.(2)将溶解的溶液用ph计调节ph至7.5-9.0,优选地,调节ph至8.5;
14.(3)将调节ph后的溶液过0.22μm水系滤膜除菌,得pcr缓冲液。
15.进一步地,所述的一种pcr缓冲液的制备方法,还包括步骤(4)将所配制的pcr缓冲液液无菌无酶分装至冻存管,-20℃存储。
16.本发明的有益效果为:
17.本发明具有提高样本在qpcr反应中的扩增效率的优点,能够使同等浓度样本模板提前达到平台期。
18.能使qpcr具有更高的灵敏度,防止低浓度样本出现假阴性。
19.dtt是一种还原剂,dtt上的巯基可以保护逆转录所用酶的二硫键,增加稳定性。
20.dmso、吐温20都是一种增强剂,能够提高试剂整体扩增效率。
附图说明
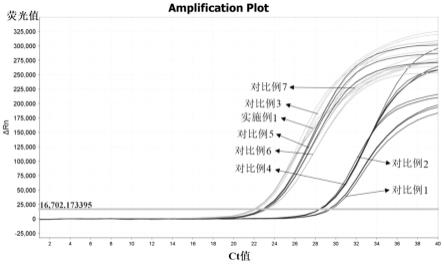
21.图1为实施例1、对比例1-7中所得pcr缓冲液对dna病毒的qpcr扩增曲线图;
22.图2为实施例1、对比例1-7中所得pcr缓冲液对rna病毒的qpcr扩增曲线图;
23.图3为实施例1-4中所得pcr缓冲液对rna病毒的qpcr扩增曲线图。
具体实施方式
24.下面结合附图和具体实施方式,进一步阐明本发明,应理解下述具体实施方式仅用于说明本发明而不用于限制本发明的范围。
25.实时荧光定量pcr(quantitative real-time pcr)是一种在dna扩增反应中,以荧光化学物质测每次聚合酶链式反应(pcr)循环后产物总量的方法。通过内参或者外参法对待测样品中的特定dna序列进行定量分析的方法。将标记有荧光素的taqman探针与模板dna混合后,完成高温变性,低温复性,适温延伸的热循环,并遵守聚合酶链反应规律,与模板dna互补配对的taqman探针被切断,荧光素游离于反应体系中,在特定光激发下发出荧光,随着循环次数的增加,被扩增的目的基因片段呈指数规律增长,通过实时检测与之对应的随扩增而变化荧光信号强度,求得ct值。
26.以咽拭子样本为例,结合本发明的技术方案详细说明本发明的具体实施方式。
27.以下实施例中,若非特殊说明,各原料均为普通市售。
28.实施例1
29.病原体核酸实时荧光定量pcr实验
30.pcr缓冲由以下成分组成:150mm tris-hcl,30mm kcl,10mm mgcl2,35mm硫酸铵,400μm dntp,2mm dtt,3%vol dmso,0.02%vol吐温20,余量为无核酸酶水。缓冲液ph 7.5,用1m hcl和1m naoh将缓冲液ph调整为8.5。
31.加入提取完成的dna病毒核酸模板进行qpcr扩增。
32.实施例2
33.pcr缓冲由以下成分组成:150mm tris-hcl,30mm kcl,10mm mgcl2,35mm硫酸铵,400μm dntp,2mm dtt,3%vol dmso,0.02%vol吐温20,余量为无核酸酶水。缓冲液ph 7.5。
34.加入提取完成的dna病毒核酸模板进行qpcr扩增。
35.实施例3
36.pcr缓冲由以下成分组成:150mm tris-hcl,30mm kcl,10mm mgcl2,35mm硫酸铵,400μm dntp,2mm dtt,3%vol dmso,0.02%vol吐温20,余量为无核酸酶水。缓冲液ph 7.5,
用1m hcl和1m naoh将缓冲液ph调整为9.0。
37.加入提取完成的dna病毒核酸模板进行qpcr扩增。
38.实施例4
39.pcr缓冲由以下成分组成:150mm tris-hcl,30mm kcl,1mm mgcl2,35mm硫酸铵,400μm dntp,2mm dtt,3%vol dmso,0.02%vol吐温20,余量为无核酸酶水。缓冲液ph 8.5。
40.加入提取完成的dna病毒核酸模板进行qpcr扩增。
41.实施例1-实施例4的qpcr扩增图见图3,ct值见表1
42.表1
[0043][0044]
由图3可知,实施例1的效果明显优于实施例2、3、4,故实施例1为最优方案。
[0045]
对比例1
[0046]
病原体核酸实时荧光定量pcr实验
[0047]
pcr缓冲由以下成分组成:150mm tris-hcl,30mm kcl,10mm mgcl2,35mm硫酸铵,400μm dntp,余量为无核酸酶水。缓冲液ph 7.5,用1m hcl和1m naoh将缓冲液ph调整为8.5。
[0048]
加入提取完成的dna病毒/rna病毒核酸模板进行qpcr扩增。
[0049]
对比例2
[0050]
病原体核酸实时荧光定量pcr实验
[0051]
本对比例和对比例1的区别在于,缓冲液ph调整为8.0,其他同对比例1。
[0052]
对比例3
[0053]
病原体核酸实时荧光定量pcr实验
[0054]
本实施例和实施例1的区别在于,缓冲液ph调整为8.5,其他同对比例1。
[0055]
对比例4
[0056]
病原体核酸实时荧光定量pcr实验
[0057]
本对比例和对比例1的区别在于,缓冲液ph调整为9.0,其他同对比例1。
[0058]
对比例5
[0059]
病原体核酸实时荧光定量pcr实验
[0060]
本对比例和对比例3的区别在于,缓冲液中添加2mm dtt,其他同对比例3。
[0061]
对比例6
[0062]
病原体核酸实时荧光定量pcr实验
[0063]
本对比例和对比例3的区别在于,缓冲液中添加3%vol dmso,其他同对比例3。
[0064]
对比例7
[0065]
病原体核酸实时荧光定量pcr实验
[0066]
本对比例和对比例3的区别在于,缓冲液中添加0.02%vol吐温20,其他同对比例3。
[0067]
采用上述实施例1对比例1~7的pcr缓冲液进行qpcr检测,每个样本进行3次重复,ct值取平均值,ct值见表2。
[0068]
表2不同pcr缓冲液获得的检测ct值
[0069][0070]
扩增曲线见附图1、附图2。
[0071]
从表2中数据可看出,采用本技术的pcr缓冲液,其中实施例1扩增效果最优。
[0072]
其他对比例效果均不如实施例1的效果。
[0073]
需要说明的是,以上内容仅仅说明了本发明的技术思想,不能以此限定本发明的保护范围,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰均落入本发明权利要求书的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1