一种用于卵巢癌细胞成像的荧光探针、合成方法及应用
1.本发明属于生物化学技术领域,具体公开了一种用于卵巢癌细胞成像的荧光探针、合成方法及应用。
背景技术:
2.卵巢癌是妇科癌症中最致命的一种,对妇女的健康构成严重威胁。卵巢癌早期的症状表现不特异且目前的诊断技术有限,因此多数卵巢癌患者处于中晚期时才被确诊,这十分不利于卵巢癌的治疗。所以提高卵巢癌早期诊断水平是很有意义的。目前,以ca-125为代表的血清肿瘤标志物检测已经被用于卵巢癌的的早期诊断。但是以血清中ca-125的浓度水平作为卵巢癌检测的诊断方法受多种因素影响,假阳性率高,同时会给未患卵巢癌的患者带来不必要的心理负担和侵入性随访。因此,需要一种高质量、微创的方法来有效检测卵巢癌早期的恶性肿瘤。
3.研究发现,卵巢癌患者的腹水、血浆和组织中含有高水平的lpa,提示lpa不仅是生物标记物,而且作为卵巢癌的治疗靶点有发展的潜能。在原发性人类癌症中,体细胞线粒体dna突变也越来越多地在人类癌症中被观察到,部分原因可能是它更容易受到由于线粒体dna接近ros产生位点而导致的氧化损伤。卵巢癌的线粒体dna突变的发生率高于其他癌症。活细胞实时监测卵巢癌细胞中的线粒体dna的技术有利于其潜在的诊断和治疗意义。
4.荧光显微镜技术的发展为活体细胞中各种生物物质的成像打开了大门。特异性荧光探针对于在活细胞中实现其成像至关重要。为此,研究人员发展了一些荧光探针来检测lpa。利用dna的电负性,基于静电相互作用,开发了一些带正电的dna荧光探针。但其中很少有能用于线粒体dna成像,因为它们通常受到其与细胞核dna的阻碍,并且难以消除线粒体中存在的负电荷物质(如atp、adp)的干扰。
5.荧光探针的一个重要发展趋势是诊断和治疗的一体化。光动力治疗(pdt)因其无创性、操作简便、不良反应少、选择性高等优点而受到广泛关注。为一种相对较新的治疗方法,它可以通过使用肿瘤靶向光敏探针在光照下产生活性氧物种(ros)来诱导癌细胞凋亡。通过赋予肿瘤靶向荧光探针光敏性,可以实现荧光成像引导的pdt,从而提供更精确、更有效的治疗。然而,现目前的荧光探针大多数只起到诊断的效果,极少数能实现光动力治疗。
技术实现要素:
6.本发明的第一目的在于提供一种用于卵巢癌细胞成像的高光敏性荧光探针,该探针主要解决了现目前的探针无法同时对线粒体dna和溶血磷脂酸进行区分成像以及无法诱导卵巢癌细胞凋亡的技术问题。
7.本发明的第二目的在于提供一种用于卵巢癌细胞成像的荧光探针的合成方法,该方法操作简单,降低了操作人员的操作难度,从而方便该荧光探针进行大规模的合成。
8.本发明的第三目的在于提供一种用于卵巢癌细胞成像的荧光探针在卵巢癌检测、治疗和/或卵巢癌细胞成像中的应用。
9.本发明是通过如下方案实现的:
10.本发明提供了一种用于卵巢癌细胞成像的荧光探针,该荧光探针的结构式如下所示:该探针通过吡啶正离子功能化三芳基硼结构,其吡啶正离子不仅可以与dna和lpa结合,还可以作为吸电子基团调节其光物理性质。它可以选择性地响应dna和lpa(溶血磷脂酸),而不对atp、adp和amp等响应,且对dna和lpa具有不同的荧光信号输出。它可以成功地用于区分卵巢癌细胞和其他细胞,并对卵巢癌细胞中的线粒体dna和lpa发出不同的荧光信号。从而避免线粒体dna对探针发光产生影响。此外,该荧光探针具有高度的光敏性,这也使得它能够在弱光照射下选择性地诱导卵巢癌细胞凋亡。
11.本发明还提供了一种用于卵巢癌细胞成像的荧光探针的合成方法,包括如下步骤:将bbdd、吡啶-4-基硼酸、四三苯基膦钯、碳酸钾、1,4-二氧六环和水的混合液混合后回流搅拌,得到混合物,待混合物冷却后萃取,取有机层干燥后得到干燥产物,将干燥产物经柱层析纯化,得到tab-2-py,将tab-2-py溶于碘甲烷中并在室温下避光搅拌后除去溶剂,得到tab-2-me,即得到荧光探针。该探针合成的反应方程式如下:
12.13.该方法操作简单方便,大大降低了操作人员的操作难度,从而提高了荧光探针的生产效率,以便于荧光探针的批量生产。
14.与现有技术相比,本发明至少具有如下的优点与积极效果:
15.本发明提供了一种用于卵巢癌细胞成像的荧光探针、合成方法及其应用,该探针通过吡啶正离子功能化三芳基硼结构,其吡啶正离子不仅可以与dna和lpa结合,还可以作为吸电子基团调节其光物理性质。它可以选择性地响应dna和lpa(溶血磷脂酸),而不对atp、adp和amp等响应,且对dna和lpa具有不同的荧光信号输出。它可以成功地用于区分卵巢癌细胞和其他细胞,并对卵巢癌细胞中的线粒体dna和lpa发出不同的荧光信号。从而避免线粒体dna对探针发光产生影响。此外,该荧光探针具有高度的光敏性,这也使得它能够在弱光照射下选择性地诱导卵巢癌细胞凋亡;而该方法通过简单的混合、搅拌即可制得,从而降低了操作人员的操作难度,提高了该荧光探针的制备效率,进而便于该荧光探针的大规模生产。
附图说明
16.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
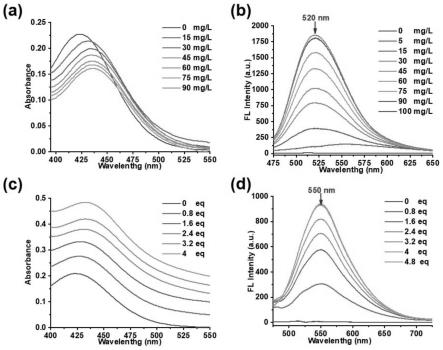
17.图1为本发明中该探针对lpa和dsdna的荧光光谱变化图,其中(a)为加入dsdna后20μm tab-2-me(λex=440nm)的紫外光谱变化图,(b)为加入dsdna后20μm tab-2-me(λex=440nm)的荧光光谱变化图,(c)为加入lpa后20μm tab-2-me(λex=440nm)的紫外光谱变化图,(d)为加入lpa后20μm tab-2-me(λex=440nm)的荧光光谱变化图;
18.图2为本发明中该荧光探针在tab-2-me(20μm)对水中各种物质的光谱图;
19.图3为本发明中用dls在水中测量tab-2-me/lpa的尺寸偏差图;
20.图4为本发明中用tab-2-me染色60min,mdrf(100nm)共染色30min的各种细胞的荧光图像:(a、g、m、s)为405nm激发,500-550nm采集;(b、h、n、t)为405nm激发,560-610nm采集;(c、i、o、u)为640nm激发mdrf,650-750nm采集;(d、j、p、v)分别为(a、c、i、m、u)对应的叠加图像;(e、k、q、w)为亮场,(f、l、r、y)为(e、k、q、w)的亮场对应的叠加图像;
21.图5为本发明实施例1中tab-2-py的核磁共振氢谱图;
22.图6为本发明实施例1中tab-2-py的13核磁共振谱图;
23.图7为本发明实施例1中tab-2-py的高分辨率质谱图;
24.图8为本发明实施例1中tab-2-me的核磁共振氢谱图;
25.图9为本发明实施例1中tab-2-me的13核磁共振谱图;
26.图10为本发明实施例1中tab-2-me的高分辨率质谱图。
具体实施方式
27.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产
品。
28.需要说明的是,在不冲突的情况下,本技术中的实施例及实施例中的特征可以相互组合。下面将参考具体实施例来详细说明本发明。
29.本发明提供了一种用于卵巢癌细胞成像的荧光探针,荧光探针的结构式如下:该探针通过吡啶正离子功能化三芳基硼结构,其吡啶正离子不仅可以与dna和lpa结合,还可以作为吸电子基团调节其光物理性质。它可以选择性地响应dna和lpa(溶血磷脂酸),而不对atp、adp和amp等响应,且对dna和lpa具有不同的荧光信号输出。它可以成功地用于区分卵巢癌细胞和其他细胞,并对卵巢癌细胞中的线粒体dna和lpa发出不同的荧光信号。从而避免线粒体dna对探针发光产生影响。此外,该荧光探针具有高度的光敏性,这也使得它能够在弱光照射下选择性地诱导卵巢癌细胞凋亡。
30.本发明还提供了一种如用于卵巢癌细胞成像的荧光探针的合成方法,包括如下步骤:将bbdd、吡啶-4-基硼酸、四三苯基膦钯、碳酸钾、1,4-二氧六环和水的混合液混合后回流搅拌,得到混合物,待混合物冷却后萃取,取有机层干燥后得到干燥产物,将干燥产物经柱层析纯化,得到tab-2-py,即纯化产物,将tab-2-py溶于碘甲烷中并在室温下避光搅拌后除去溶剂,得到tab-2-me,即得到荧光探针。该探针合成的反应方程式如下:光探针。该探针合成的反应方程式如下:
31.该方法操作简单方便,大大降低了操作人员的操作难度,从而提高了荧光探针的生产效率,以便于荧光探针的批量生产。其中在萃取前和冷却后,还需要加水使反应淬灭,避免残余反应继续发生,从而避免在萃取过程中有机层和无机层无法完全分离;另外层析所用层析柱为sio2,pe—etoac 10:1—1:1,且期间使用旋转蒸发仪去除最后步骤中的溶剂,另外,也可以使用减压蒸馏的方式去除溶剂。
32.上述用于卵巢癌细胞成像的荧光探针的合成方法,包括如下步骤:将0.6-0.7重量份bbdd、0.7-0.8重量份吡啶-4-基硼酸、0.01-0.015重量份四三苯基膦钯、1.1-1.2重量份碳酸钾、18-22重量份1,4-二氧六环和水的混合液混合后回流搅拌10-14h,得到混合物,待混合物冷却后用乙酸乙酯萃取,取有机层用无水mgso4干燥后得到干燥产物,将干燥产物经柱层析纯化,得到tab-2-py,将tab-2-py溶于碘甲烷中并在室温下避光搅拌后除去溶剂,得到tab-2-me,即得到荧光探针。
33.上述用于卵巢癌细胞成像的荧光探针的合成方法,包括如下步骤:将0.650重量份bbdd、0.738重量份吡啶-4-基硼酸、0.012重量份四三苯基膦钯、1.106重量份碳酸钾、20重量份1,4-二氧六环和水的混合液混合后回流搅拌12h,得到混合物,待混合物冷却后用乙酸乙酯萃取,取有机层用无水mgso4干燥后得到干燥产物,将干燥产物经柱层析纯化,得到tab-2-py,将tab-2-py溶于碘甲烷中并在室温下避光搅拌后除去溶剂,得到tab-2-me,即得到荧光探针。该原料用量为上述原料用量区间的优化用量,以进一步提高制备效率。
34.上述1,4-二氧六环和水的体积比为(2-3):1。该比例区间以保证碳酸钾能够充分溶解形成碱液,而当水的量过高时,其会影响荧光探针的制备,当水的量过低时,碳酸钾无法充分溶解。
35.上述1,4-二氧六环和水的体积比为5:2。该比例为上述比例区间的优选比例,在避免影响荧光探针的制备的同时,保证碳酸钾的充分溶解。
36.上述bbdd的浓度为0.8-1.2mmol,吡啶-4-基硼酸的浓度为5-7mmol,四三苯基膦钯的浓度为0.08-0.12mmol,碳酸钾的浓度为7-9mmol。上述各原料的浓度区间能保证其充分反应的同时,还方便进行有机溶剂的萃取,当浓度范围过高,可能导致反应缓慢,从而导致反应不充分,而当浓度过低,可能导致萃取出的有机层较少,不便于进行后续操作。
37.本发明还提供了一种用于卵巢癌细胞成像的荧光探针在制备卵巢癌检测、治疗和/或卵巢癌细胞成像的试剂盒中的应用。
38.本发明还提供了一种用于卵巢癌光动力治疗的试剂盒,包括上述用于卵巢癌细胞成像的荧光探针。
39.本发明还提供了一种用于检测卵巢癌的试剂盒,包括上述用于卵巢癌细胞成像的荧光探针。
40.实施例1
41.本实施例提供了一种用于卵巢癌细胞成像的荧光探针的制备方法,该方法包括如下步骤:将0.6g bbdd(1.2mmol)、0.7g吡啶-4-基硼酸(7mmol)、0.01g四三苯基膦钯(0.12mmol)、1.1g碳酸钾(9mmol)、18ml1,4-二氧六环和水(1,4-二氧六环:水=2:1)的混合液混合后回流搅拌10h,得到混合物,待混合物冷却后加水使反应淬灭再用乙酸乙酯萃取,取有机层用无水mgso4干燥后得到干燥产物,将干燥产物经柱层析(sio2,pe—etoac 10:1—1:1)纯化,得到纯化产物,将纯化产物用高分辨率质谱、核磁共振氢谱和13核磁共振谱进行
验证(如图5-7所示,1h nmr(400mhz,cdcl3)δ8.67(dd,j=4.7,1.5hz,4h),7.60(dd,j=4.7,1.6hz,4h),7.35
–
7.22(m,8h),7.19
–
7.13(m,4h),7.08(t,j=7.3hz,2h),6.67(s,2h),2.27(s,6h),2.14(s,6h),1.96(s,6h),
13
c nmr(100mhz,cdcl3)δ149.61,148.56,147.18,142.79,138.18,129.32,126.26,125.29,123.45,121.51,121.23,23.47,hr-esi-ms(m/z):calcd.for[c
46h42
bn3](m/z,z=1)647.3472[m],found 648.3544[m]),确认为tab-2-py,将tab-2-py溶于碘甲烷中并在室温下避光搅拌后用旋转蒸发仪除去溶剂,得到产物,将产物用高分辨率质谱、核磁共振氢谱和13核磁共振谱进行验证(如图8-10所示,1h nmr(400mhz,cd3od)δ8.88(d,j=6.8hz,4h),8.43(d,j=7.0hz,4h),7.68(d,j=22.1hz,4h),7.34(t,j=7.9hz,4h),7.13(dd,j=7.5,2.8hz,6h),6.63(s,2h),4.41(s,6h),2.27(d,j=61.1hz,12h),1.94(s,6h);
13
c nmr(100mhz,cd3od)δ155.84,146.88,145.20,143.15,134.55,129.18,126.81,125.39,124.19,123.85,120.41,22.45;hr-esi-ms(m/z):calcd.for[c
48h48
bn3]
2+
(m/z,z=2)338.6965[m-h]
2+
,found 338.6987[m-h]
2+
),确认为tab-2-me,即得到荧光探针。
[0042]
实施例2
[0043]
本实施例提供了一种用于卵巢癌细胞成像的荧光探针的制备方法,该方法包括如下步骤:将0.7g bbdd(0.8mmol)、0.8g吡啶-4-基硼酸(5mmol)、0.015g四三苯基膦钯(0.08mmol)、1.2g碳酸钾(7mmol)、22ml1,4-二氧六环和水(1,4-二氧六环:水=3:1)的混合液混合后回流搅拌14h,得到混合物,待混合物冷却后加水使反应淬灭再用乙酸乙酯萃取,取有机层用无水mgso4干燥后得到干燥产物,将干燥产物经柱层析(sio2,pe—etoac 10:1—1:1)纯化,得到纯化产物,将纯化产物用高分辨率质谱、核磁共振氢谱和13核磁共振谱进行验证,确认为tab-2-py,将tab-2-py溶于碘甲烷中并在室温下避光搅拌后用旋转蒸发仪除去溶剂,得到产物,将产物用高分辨率质谱、核磁共振氢谱和13核磁共振谱进行验证,确认为tab-2-me,即得到荧光探针。
[0044]
实施例3
[0045]
本实施例提供了一种用于卵巢癌细胞成像的荧光探针的制备方法,该方法包括如下步骤:将0.650g bbdd(1mmol)、0.738g吡啶-4-基硼酸(6mmol)、0.012g四三苯基膦钯(0.1mmol)、1.106g碳酸钾(8mmol)、20ml1,4-二氧六环和水(1,4-二氧六环:水=5:2)的混合液混合后回流搅拌12h,得到混合物,待混合物冷却后加水使反应淬灭再用乙酸乙酯萃取,取有机层用无水mgso4干燥后得到干燥产物,将干燥产物经柱层析(sio2,pe—etoac 10:1—1:1)纯化,得到纯化产物,将纯化产物用高分辨率质谱、核磁共振氢谱和13核磁共振谱进行验证,确认为tab-2-py,将tab-2-py溶于碘甲烷中并在室温下避光搅拌后用旋转蒸发仪除去溶剂,得到产物,将产物用高分辨率质谱、核磁共振氢谱和13核磁共振谱进行验证,确认为tab-2-me,即得到荧光探针。
[0046]
试验例1
[0047]
在水中加入本发明实施例1中所制得的20μm的荧光探针后混合,再按图1(a)和(b)所示逐渐加入dsdna混合后加入比色皿内,测量紫外光谱图和荧光光谱图,所得结果如图1(a)和图1(b)所示,随着dna的加入,tab-2-me首先在550nm处首先出现了轻微的荧光增强,然后在520nm处出现了一个新的逐渐增强的峰。其中图1(a)中,最高峰由上至下依次为0、15、30、45、60、75和90mg/l,其中图1(b)中,最高峰由上至下依次为100、90、75、60、45、30、
15、5和0mg/l。
[0048]
在水中加入本发明实施例中所制得的20μm的荧光探针后混合,再按图1(c)和(d)所示逐渐加入lpa混合后加入比色皿内,测量紫外光谱图和荧光光谱图,所得结果如图1(c)和图1(d)所示,表明在加入一定浓度的lpa后,荧光强度只在550nm处出现了明显增强。在图1(c)中,最高峰由上至下依次为4、3.2、2.4、1.6、0.8和0eq,在图1(d)中,最高峰由上至下依次为4.8、4、3.2、2.4、1.6、0.8和0eq。
[0049]
试验例2
[0050]
在水中加入本发明实施例1中所制得的20μm的荧光探针后混合,再分别加入rna、bsa、lpa、dsdna、lipose 2000、adp、atp、k
+
、ca
2+
、na
+
、mg
2+
、gsh、cys和amp后测量其荧光光谱图,所得结果如图2所示,根据图2结果所示,atp、adp、amp和蛋白质(bsa)等,不能引发tab-2-me的任何明显荧光变化。
[0051]
试验例3
[0052]
在水中加入本发明实施例1中所制得的20μm的荧光探针后混合,再分别加入1、2、3和4eq的lpa,通过动态光散射(dls)验证后,所得结果如图3所示,根据图3结果显示,tab-2-me对lpa和dna的选择性源于其合适的正电荷,使其无法与比dna和lpa更少负电荷的物质有效结合。tab-2-me对lpa的荧光响应可以通过tab-2-me和带负电荷的lpa的结合所引起的聚集来容易理解,因为添加lpa后出现尾部吸收,这是瑞利散射的典型特征。
[0053]
试验例4
[0054]
取本发明实施例1中的tab-2-me首先与四种不同的活细胞系(nih/3t3、u87mg、bxpc-3和skov-3)孵育60分钟,然后与5μm的线粒体特异性荧光染料mito tracker deep red fm(mdrf)孵育30分钟进行共定位分析,然后进行荧光共聚焦实验。如图4所示,在skov-3细胞的细胞质(绿色通道)和外围(红色通道)可以观察到明显的荧光信号,而在其他活细胞中几乎没有荧光信号,表明tab-2-me可以选择性地成像skov3细胞。通过合并图3v,我们发现所有绿点都可以很好地与mdrf信号一致,表明绿色通道确实代表线粒体dna的信号。从绿色和红色通道的叠加图像,可以清楚地看到线粒体dna和lpa分别显示为黄色和红色。由于bxpc-3细胞的形状与skov-3细胞明显不同,将其混合培养并用tab-2-me染色。结果表明,skov-3细胞比bxpc-3细胞表现出更明显的荧光信号,为tab-2-me能够区分skov细胞和其他细胞提供了更为确凿的证据。
[0055]
还通过使用商用h2dcf-da作为指示剂评估tab-2-me的光敏性,结果表明tab-2-me具有高光敏性,因为它可以在低光功率密度(1.2mw/cm2)的光下产生可检测的ros。如图4a所示,在存在tab-2-me的情况下,指示剂在520nm处的荧光在4min内增强了近100倍,在没有tab-2-me的情况下,几乎没有观察到荧光变化。进一步检测skov-3细胞内ros生成能力。(图4b)逐渐增强的绿色荧光可以验证ros的生成。在光照30分钟后,将av 647导入这些skov-3细胞,以分析其状态。结果表明,skov-3细胞处于早期凋亡状态。(图4c)另外,我们首先将经tab-2-me染色的混合skov-3和bxpc-3细胞暴露于光下20分钟,然后与av647孵育30分钟,这表明只有skov-3细胞发生凋亡。(图4c)这些结果证实,tab-2-me可通过pdt选择性诱导skov-3细胞凋亡
[0056]
综上所述:
[0057]
本发明提供了一种用于卵巢癌细胞成像的荧光探针、合成方法及应用,该探针通
过吡啶正离子功能化三芳基硼结构,其吡啶正离子不仅可以与dna和lpa结合,还可以作为吸电子基团调节其光物理性质。它可以选择性地响应dna和lpa(溶血磷脂酸),而不对atp、adp和amp等响应,且对dna和lpa具有不同的荧光信号输出。它可以成功地用于区分卵巢癌细胞和其他细胞,并对卵巢癌细胞中的线粒体dna和lpa发出不同的荧光信号。从而避免线粒体dna对探针发光产生影响。此外,该荧光探针具有高度的光敏性,这也使得它能够在弱光照射下选择性地诱导卵巢癌细胞凋亡;该探针水中发射非常微弱,在lpa存在时在550nm左右发出强烈的荧光。当它通过沟槽结合与各种dna或rna相互作用时,在520nm左右出现了一个新的发射峰,而atp、adp和amp几乎没有荧光响应。细胞实验表明,它能用于卵巢癌细胞的mitodna和lpa成像;而该方法通过简单的混合、搅拌即可制得,从而降低了操作人员的操作难度,提高了该荧光探针的制备效率,进而便于该荧光探针的大规模生产。
[0058]
以上所描述的实施例是本发明一部分实施例,而不是全部的实施例。本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1