一种多肽、多肽衍生物及其在制备抗肿瘤药物中的应用
1.本发明属于药物技术领域,具体涉及一种多肽和多肽衍生物,以及其在制备抗肿瘤药物中的应用。
背景技术:
2.wnt信号通路广泛存在于无脊椎动物和脊椎动物中,是一类在物种进化过程中高度保守的信号通路。wnt信号在动物胚胎的早期发育、器官形成、组织再生和其它生理过程中,具有至关重要的作用。如果这条信号通路中的关键蛋白发生突变或者异常表达,导致信号异常活化,就可能诱导癌症的发生。
3.wnt信号通路包括经典的wnt信号通路与非经典的wnt信号通路,在经典通路即wnt-β-catenin信号通路中,wnt因子通过激活细胞膜上的frizzle/lrp5/6协同受体后抑制细胞内游离β-catenin蛋白的磷酸化和降解,细胞质中的β-catenin蛋白水平升高后将发生β-catenin蛋白的核移位,导致细胞核中β-catenin蛋白升高,胞核中β-catenin蛋白能够联合pygo2、bcl-9以及foxm1蛋白共同与tcf/lef-1转录因子家族形成复合体并激活wnt信号通路下游靶基因的转录激活。因此,针对该信号通路设计特异性的蛋白药物,尤其是多肽药物来治疗肿瘤具有重要的价值和应用前景。
4.越来越多的研究表明,序列相似性为83的家族成员a基因(family with sequence similarity 83 member a,fam83a)与肿瘤的侵袭和转移相关,且fam83a在肺癌、乳腺癌和胰腺癌中异常高表达,该基因的上调与肿瘤的形成、预后等指标具有密切的相关性。但fam83a在癌症中的临床意义,以及在癌症中的作用机制仍不清楚。
技术实现要素:
5.针对现有技术中的问题,本发明通过多样本临床结果以及生物学手段,发现fam83a蛋白能够与β-catenin蛋白发生直接的相互作用进而促进细胞内wnt信号通路的异常激活,并进一步确定了发生相互作用的蛋白区间,据此获取了能够阻断细胞内fam83a与β-catenin的相互作用的多肽,且实验结果表明该多肽分子能够显著抑制细胞内wnt信号通路的激活,对胰腺癌细胞的生长具有显著的抑制效果。
6.本发明的技术方案具体如下:
7.本发明首先提供了一种多肽或多肽衍生物,其中,多肽的氨基酸序列如seq id no:1或seq id no:2所示,多肽衍生物为上述多肽与细胞穿模肽连接形成的嵌合肽。
8.进一步地,在上述技术方案中,细胞穿模肽连接于所述多肽的n端;更进一步地,所述细胞穿模肽的序列如seq id no:3所示。
9.进一步地,在上述技术方案中,多肽或多肽衍生物的n端为乙酰化修饰且c端为酰胺化修饰。
10.本发明还提供了一种抗肿瘤的药物组合物,其活性成分含有氨基酸序列如seq id no:1或seq id no:2所示的多肽或该多肽衍生物。
11.进一步地,在上述技术方案中,药物组合物还包括药物载体。
12.本发明进一步提供了上述多肽,或多肽衍生物,或抗肿瘤的药物组合物在制备抗肿瘤的药物中的应用。
13.进一步地,在上述技术方案中,肿瘤为胰腺癌。
14.进一步地,在上述技术方案中,对个体进行有效量的所述药物的给药。更进一步地,给药的方式为注射给药。
15.本发明的有益效果为:基于fam83a蛋白与β-catenin蛋白的直接接触作用区域,本发明提供的多肽和多肽衍生物能够有效阻断fam83a蛋白与β-catenin蛋白的连接,达到抑制wnt通路活性的效果,试验结果也显示,本发明的多肽能够抑制胰腺癌细胞的增殖、迁移和侵袭等能力,从而能够很好的发挥抗肿瘤功能。
附图说明
16.图1为fam83a蛋白与β-catenin蛋白的相互作用区域的筛选结果图;
17.图2为多肽fap1、fap2与β-catenin蛋白的结合强度检测分析图;
18.图3为多肽fap2与β-catenin蛋白结构的结合原理示意图;
19.图4为短肽cp-fap2对胰腺癌细胞中靶基因axin2、c-myc和cyclind1表达量的影响图;
20.图5为短肽cp-fap2抑制胰腺癌细胞增殖的检测结果图;
21.图6为短肽cp-fap2抑制胰腺癌细胞侵袭和迁移能力的检测结果图;
22.图7为短肽cp-fap2抑制小鼠体内胰腺癌肿瘤生长和转移的检测结果图。
具体实施方式
23.为了更好地理解本发明,下面结合具体实施例进一步阐明本发明的内容。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。
24.下述实施例中,若无特殊说明,均为常规方法;所述试剂和材料,若无特殊说明,均可从商业途径获得。
25.实施例1
26.本实施例具体通过以下步骤获取多肽:
27.(1)利用pcr技术构建表达fam83a截短体的载体。
28.具体如图1所示,先将fam83a蛋白的duf1669结构域每隔50个氨基酸设计一个截短。针对fam83a蛋白进行截短或突变时,引物设计时要以突变的氨基酸为中心,前后各加约15bp,总长约33bp,同时合成互补配对的一对引物。扩增时退火温度约为60℃,引物在于模板特异性结合时会替代原有碱基,识别已替换的碱基,形成的仍为完整的环状质粒。因新pcr获得的dna不存在甲基化修饰,而从大肠杆菌中提取出的质粒存在甲基化修饰,因此可以通过使用甲基化消化酶dpni对原有的模板质粒进行消化,余下的均为已突变成功的质粒。具体过程如下:
29.①
突变质粒的pcr扩增:用已构建成功的质粒为模板,扩增的长度为目的片段和载体总长,因时间较长容易发生额外突变,因此要选择高保真酶进行扩增实验,防止产生新的突变。
30.②
pcr后的产物回收用切胶回收试剂盒进行产物回收,最后用43μl ddh2o洗脱。
31.③
回收的dna产物需要用dpni进行单酶切,在37℃水浴锅中消化1h。酶切体系如下表所示:
[0032][0033]
④
酶切后,要对酶切产物按照酶切产物试剂盒进行酶切产物回收,用30μlddh2o洗脱。
[0034]
⑤
最后,将步骤
④
获得的纯化产物转化进入大肠杆菌,挑取单个菌落摇混后,直接进行测序,将测序结果正确的突变成功的菌株加甘油保存或直接扩大培养提取质粒保存,以便后续实验使用。
[0035]
(2)fam83a与β-catenin相互作用区域的确定
[0036]
将经(1)获取的各截短体与β-catenin表达载体共转染至hek293t细胞,通过免疫共沉淀与western blotting检测鉴定fam83a各截短体与β-catenin蛋白的结合作用。
[0037]
免疫共沉淀技术是基于抗原和抗体间的特异性结合,在细胞内验证蛋白之间相互作用的常用方法;western blotting是利用抗体识别蛋白来检测目的蛋白的方法,二者均为现有技术,在此不做过多赘述。
[0038]
最终检测结果如图1所示:在fam83a蛋白的duf1669结构域中,150-250氨基酸区域为fam83a蛋白与β-catenin蛋白的直接接触作用区域。
[0039]
(3)多肽序列的确定
[0040]
采用i-tasser数据库对fam83a蛋白140-210氨基酸区间的蛋白二级结构进行预测,筛选到两段α螺旋结构的肽段(其氨基酸区域分别为145-157、171-184)为基础设计多肽序列。所得两条多肽具体为:
[0041]
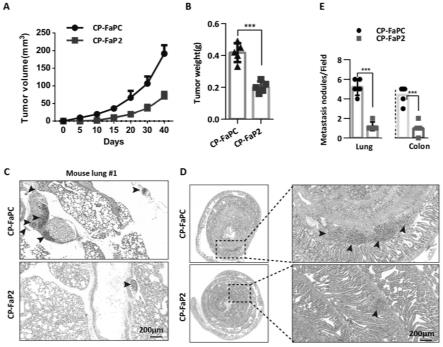
fap1,其氨基酸序列为:nnirdlvrrcitr(seq id no:1);
[0042]
fap2,其氨基酸序列为:dveifcdileaan(seq id no:2)。
[0043]
将fap1、fap2、对照肽(记为fapc,氨基酸序列为yiqaqareppcppd(seq id no:4))与gfp荧光蛋白融合,构件融合表达载体,转染hek293t细胞后,利用免疫共沉淀和western blotting技术验证其与目标蛋白β-catenin之间的结合情况,发现fap2相较于fap1与β-catenin之间具有较强的相互作用(图2)。
[0044]
进一步采用online的小分子对接软件,对短肽fap2与β-catenin的530-666区间蛋白结构进行对接的预测结果,显示短肽fap2结合在β-catenin蛋白二级结构形成的小沟上(图3)。
[0045]
从图2和图3可知,多肽fap2可以靶向结合β-catenin蛋白。
[0046]
实施例2
[0047]
在实施例1获得的多肽fap2的基础上,在其n端连接上细胞穿膜肽tat,且穿模肽序列为ygrkkrrqrrr(seq id no:3),并对多肽n端进行乙酰化修饰,c端进行酰胺化修饰。将所
得带有细胞穿膜肽的短肽命名为cp-fap2。
[0048]
对cp-fap2的抗肿瘤功能进行以下验证:
[0049]
(1)cp-fap2对wnt信号通路的影响
[0050]
使用cp-fap2处理胰腺癌panc-1细胞24小时,终浓度为5μm。收集细胞裂解液并进行western blotting实验,检测wnt信号通路靶基因axin2、c-myc和cyclind1的表达量。
[0051]
结果如图4所示:cp-fap2处理与正常多肽(即连接有同样细胞穿膜肽的对照肽,记为cp-fapc)处理相比,能够显著降低wnt信号通路下游靶蛋白的表达水平,即cp-fap2能够影响wnt通路的激活。
[0052]
(2)cp-fap2对胰腺癌细胞增殖的影响
[0053]
采用edu(5-乙炔基-2
’‑
脱氧尿苷,5-ethynyl-2
′‑
deoxyuridine)细胞增殖实验进行检测(本实施例按照碧云天beyoclick
tm edu-488细胞增殖检测试剂盒说明书进行)。通过将5μm的cp-fap2加入到胰腺癌aspc-1细胞24小时后,利用edu染料对细胞内新合成的dna进行染色,通过绿色染色的细胞数量来判定细胞增殖的影响。
[0054]
结果如图5所示:cp-fap2确实能够抑制胰腺癌aspc-1细胞的增殖。
[0055]
(3)cp-fap2对胰腺癌细胞迁移和侵袭的影响。
[0056]
将trans-well小室放入培养板中,小室内称上室,培养板内称下室,上室内盛装上层培养液(2%血清浓度),下室内盛装下层培养液(20%血清浓度),上下层培养液以聚碳酸酯膜相隔。当将细胞铺到trans-well上室中后,由于血清浓度的匮乏,细胞会趋于穿过聚碳脂膜进而进入下室高血清的培养基中,迁移过去的细胞用结晶紫进行染色,便于统计。该方法用于检测细胞的迁移性。如果在上室铺一层人工基底膜,则可以模拟细胞穿过人工基底膜进而到下室的过程,该方法用于检测细胞的侵袭性。
[0057]
基于上述原理,在上室铺好胰腺癌panc-1细胞后,利用短肽cp-fap2处理细胞24h后,发现迁移或者侵袭到下室的细胞数量明显减少,具体如图6所示,表明cp-fap2具有抑制胰腺癌细胞侵袭和迁移的能力。
[0058]
实施例3
[0059]
本实施例直接在在动物体内研究短肽cp-fap2对胰腺癌生长的影响,具体过程为:
[0060]
首先分别在4周大小的雌性裸鼠尾部皮下和尾静脉注射3
×
106个胰腺癌细胞,2周后将cp-fap2(浓度为2mg/kg/3d)经尾静脉注射到裸鼠体内,4周后称量裸鼠体内形成的皮下瘤的体积和转移到裸鼠肺和结肠的肿瘤数量。
[0061]
结果如图7所示:cp-fap2能够显著抑制胰腺癌细胞在裸鼠体内的生长(图7中a、b)以及其向肺(图7中c)和结肠(图7中d)的转移。
[0062]
综上所述,本发明提供的多肽fap1、fap2及衍生物cp-fap2通过作用于fam83a蛋白与β-catenin蛋白的直接接触区域,阻断了fam83a蛋白与β-catenin蛋白的连接,进而调控到了wnt通路的活性。而且试验证明上述多肽及其衍生物能够抑制胰腺癌细胞的增殖、迁移和侵袭等能力,且动物体内试验表明能够抑制胰腺癌肿瘤的体积增长和转移,故本发明提供的多肽及其衍生物在抗肿瘤药物的制备中有巨大的应用潜力。
[0063]
以上所述是本发明的优选实施方式,不能以此来限定本发明之权利范围,应当指出,对于本技术领域的普通技术人员来说,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
[0064]
[0065]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1