双氟磺酰亚胺作为催化剂的应用
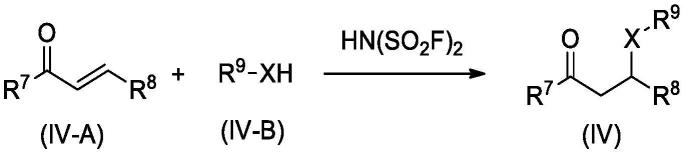
1.本发明涉及一种双氟磺酰亚胺作为催化剂的应用。
背景技术:
2.双氟磺酰亚胺(hn(so2f)2)是一种含氮强酸,目前主要应用在锂电池领域,如双氟磺酰亚胺锂,以及咪唑类离子液体等。双氟磺酰亚胺锂作为锂电池电解质相对于传统六氟磷酸锂具有较高的热稳定性和水解稳定性。对双氟磺酰亚胺(hn(so2f)2)结构进行分析,在氟磺酰基的强吸电子作用下,n原子上的负电荷会通过共振作用分散到整个o-s-n骨架上而产生高度离域化,进而大大增强(fso2)2n-的稳定性,其次是氟磺酰基具有较大的空间位阻和强吸电子效应,从而使该离子的配位能力大大降低。
3.双氟磺酰亚胺属于含氮超酸,是一种新型的超强bronsted酸,具有浓硫酸以上强度的超强酸。在已知的超强酸中如硫酸,三氟甲磺酸,氟磺酸等在医药、农药、聚合物等中间体合成中作为催化剂广泛使用。
4.而目前没有发现双氟磺酰亚胺在有机合成中作为催化剂的应用,主要是因为目前该酸还没有实现商业化生产,其合成路线并没有很成熟。目前双氟磺酰亚胺的合成中通常需要用到大量的氟磺酸作为溶剂,氟磺酸价格昂贵,导致合成成本较高,另外,氟磺酸沸点与双氟磺酰亚胺十分接近,导致产品分离纯化较困难。
5.申请人在前期研究双氟磺酰亚胺钾(或钠)的酸化过程中,发现使用浓硫酸为酸,低温下以二氧化硫为溶剂的条件下,可以以很高产率快速简便的分离得到双氟磺酰亚胺,价格便宜,后处理简单,分离纯化容易,该合成路线具有工业化生产的可能。
技术实现要素:
6.本发明所要解决的技术问题是克服现有双氟磺酰亚胺的应用领域较窄的缺陷,而提供了一种双氟磺酰亚胺作为催化剂的应用,本发明中以双氟磺酰亚胺作为催化剂可高效催化friedel-crafts反应、酯化反应、内酯开环聚合反应、硅醚聚合反应、羰基化合物还原醚化、炔基水解等多种反应,反应条件温和,原子经济性高。
7.本发明提供了一种双氟磺酰亚胺在如式(i)所示的聚内酯的制备中作为催化剂的应用,包括以下步骤:
8.溶剂中,在双氟磺酰亚胺的作用下,如式(i-a)所示的化合物和如式(i-b)所示的化合物进行聚合反应,得如式(i)所示的聚内酯,即可;
[0009][0010]
其中,n1为1-7的整数;
[0011]
r1为c1-c16烷基或-(ch2)
n2-ar,n2为1-6的整数,ar为c6-c10芳基或ra取代的c6-c10芳基;ra为卤素、c1-c6烷基或c1-c6烷氧基;
[0012]
m1为50-200的整数。
[0013]
较佳地,n1为1、2或3,例如3。
[0014]
较佳地,r1中,所述c1-c16烷基例如为c1-c10烷基,再例如为c1-c6烷基。
[0015]
较佳地,r1中,n2可为1、2或3,例如3。
[0016]
较佳地,ar中,所述c6-c10芳基和所述ra取代的c6-c10芳基中的c6-c10芳基独立地为苯基。
[0017]
较佳地,ar中,所述ra取代的c6-c10芳基中所述ra的取代个数可为1~3个(例如1个),各ra相同或不同。
[0018]
较佳地,ra中,所述卤素为氟、氯、溴或碘。
[0019]
较佳地,ra中,所述c1-c6烷基为c1-c3烷基,例如甲基、乙基、正丙基或异丙基。
[0020]
较佳地,ra中,所述c1-c6烷氧基为c1-c3烷氧基,例如甲氧基、乙氧基、正丙氧基或异丙氧基。
[0021]
较佳地,r1中,ar为苯基或ra取代的苯基。
[0022]
较佳地,所述如式(i-b)所示的化合物为
[0023]
所述如式(i)所示的聚内酯的制备中,所述双氟磺酰亚胺的用量较佳地为如式(i-a)所示的化合物摩尔量的0.1%-10%(例如0.1%)。
[0024]
所述如式(i)所示的聚内酯的制备中,所述如式(i-a)所示的化合物和所述如式(i-b)所示的化合物的用量比可为本领域此类反应常用的用量比,例如,所述如式(i-a)所示的化合物和所述如式(i-b)所示的化合物的摩尔比为(50-200):1,再例如为100:1。
[0025]
所述如式(i)所示的聚内酯的制备中,所述溶剂可为本领域此类反应常用的溶剂,例如亚砜类溶剂、酮类溶剂、醇类溶剂、醚类溶剂、酯类溶剂、腈类溶剂、芳烃类溶剂、酰胺类溶剂、卤代烷烃类溶剂和烷烃类溶剂中的一种或多种;再例如四氢呋喃,二氯甲烷,乙酸乙酯,乙腈,二甲亚砜,n,n-二甲基甲酰胺,1,4-二氧六环等;又例如二氯甲烷。
[0026]
所述如式(i)所示的聚内酯的制备中,所述聚合反应的温度可为本领域此类反应常用的温度,例如20℃-所述溶剂的回流温度,例如室温。
[0027]
所述如式(i)所示的聚内酯的制备中,所述聚合反应的进程一般可采用本领域常规的检测方法进行监测(例如tlc、hplc或gc),一般以如式(i-a)所示的化合物消失时作为反应的终点。所述聚合反应的时间较佳地为4~12小时。
[0028]
本发明还提供了一种双氟磺酰亚胺在如式(ii)所示的硅油的制备中作为催化剂的应用,包括以下步骤:
[0029]
在双氟磺酰亚胺的作用下,如式(ii-a)所示的化合物和如式(ii-b)所示的化合物进行聚合反应,得如式(ii)所示的硅油,即可;
[0030][0031]
其中,r2、r3、r4和r5独立地为c1-c16烷基或c6-c10芳基;
[0032]
m2为50-200的整数。
[0033]
较佳地,r2、r3、r4或r5中,所述c1-c16烷基例如为c1-c10烷基,再例如为c1-c6烷基(例如c1-c3烷基,再例如甲基、乙基、正丙基、异丙基)。
[0034]
较佳地,r2、r3、r4或r5中,所述c6-c10芳基可为苯基。
[0035]
较佳地,r2、r3、r4和r5独立地为c1-c10烷基,进一步独立地为c1-c6烷基(例如c1-c3烷基,再例如甲基、乙基、正丙基或异丙基)。更佳地,r2、r3、r4和r5均为c1-c3烷基,例如甲基、乙基、正丙基或异丙基,再例如甲基。
[0036]
所述如式(ii)所示的硅油的制备中,所述双氟磺酰亚胺的用量较佳地为如式(ii-a)所示的化合物摩尔量的1%-10%(例如4%)。
[0037]
所述如式(ii)所示的硅油的制备中,所述如式(ii-a)所示的化合物和所述如式(ii-b)所示的化合物的用量比可为本领域此类反应常用的用量比,例如,所述如式(ii-a)所示的化合物和所述如式(ii-b)所示的化合物的摩尔比为(30-200):1,再例如为39.9:1。
[0038]
所述如式(ii)所示的硅油的制备中,所述聚合反应可在无溶剂中进行,也可在溶剂中进行,所述溶剂可为本领域此类反应常用的溶剂,例如亚砜类溶剂、酮类溶剂、醇类溶剂、醚类溶剂、酯类溶剂、腈类溶剂、芳烃类溶剂、酰胺类溶剂、卤代烷烃类溶剂和烷烃类溶剂中的一种或多种;再例如四氢呋喃,二氯甲烷,乙酸乙酯,乙腈,二甲亚砜,n,n-二甲基甲酰胺和1,4-二氧六环等。较佳地,所述聚合反应在无溶剂中进行。
[0039]
所述如式(ii)所示的硅油的制备中,所述聚合反应的温度可为本领域此类反应常用的温度,例如20℃-所述溶剂的回流温度,例如室温。
[0040]
所述如式(ii)所示的硅油的制备中,所述聚合反应的进程一般可采用本领域常规的检测方法进行监测(例如tlc、hplc或gc),一般以如式(ii-a)所示的化合物消失时作为反应的终点。所述聚合反应的时间较佳地为2~12小时。
[0041]
本发明还提供了一种双氟磺酰亚胺在如式(iii)所示的四氮唑类化合物的制备中作为催化剂的应用,包括以下步骤:
[0042]
溶剂中,在双氟磺酰亚胺的作用下,如式(iii-a)所示的化合物、如式(iii-b)所示的原甲酸酯类化合物和叠氮化钠进行反应,得如式(iii)所示的四氮唑类化合物,即可;
[0043][0044]
其中,r6为c1-c16烷基、c6-c10芳基或rb取代的c6-c10芳基,rb为卤素或c2-c4炔
基;
[0045]r6-1
为甲基或乙基。
[0046]
较佳地,r6中,所述c1-c16烷基例如为c1-c10烷基,再例如为c1-c6烷基。
[0047]
较佳地,r6中,所述c6-c10芳基和所述rb取代的c6-c10芳基中的c6-c10芳基可独立地为苯基。
[0048]
较佳地,r6中,所述rb取代的c6-c10芳基中所述rb的取代个数可为1~3个(例如1个),各rb相同或不同。
[0049]
较佳地,rb中,所述卤素可为氟、氯、溴或碘,例如为溴。
[0050]
较佳地,rb中,所述c2-c4炔基可为乙炔基。
[0051]
较佳地,所述r6为rb取代的苯基,rb为卤素或乙炔基,例如,所述r6为为
[0052]
所述如式(iii)所示的四氮唑类化合物的制备中,所述双氟磺酰亚胺的用量较佳地为如式(iii-a)所示的化合物摩尔量的1%-10%(例如5%)。
[0053]
所述如式(iii)所示的四氮唑类化合物的制备中,所述如式(iii-a)所示的化合物和如式(iii-b)所示的原甲酸酯类化合物的用量比可为本领域此类反应常用的用量比,例如,所述如式(iii-a)所示的化合物和所述如式(iii-b)所示的原甲酸酯类化合物的摩尔比为1:(1-2),再例如1:1.2。
[0054]
所述如式(iii)所示的四氮唑类化合物的制备中,所述如式(iii-a)所示的化合物和叠氮化钠的用量比可为本领域此类反应常用的用量比,例如,所述如式(iii-a)所示的化合物和叠氮化钠的摩尔比为1:(1-3),再例如1:1或1:1.1。
[0055]
所述如式(iii)所示的四氮唑类化合物的制备中,所述溶剂可为本领域此类反应常用的溶剂,例如亚砜类溶剂、酮类溶剂、醇类溶剂、醚类溶剂、酯类溶剂、腈类溶剂、芳烃类溶剂、酰胺类溶剂、卤代烷烃类溶剂和烷烃类溶剂中的一种或多种;再例如丙三醇,四氢呋喃,二氯甲烷,乙酸乙酯,乙腈,二甲亚砜,n,n-二甲基甲酰胺和1,4-二氧六环等;再例如丙三醇。
[0056]
所述如式(iii)所示的四氮唑类化合物的制备中,所述反应的温度可为本领域此类反应常用的温度,例如20℃-所述溶剂的回流温度,例如室温。
[0057]
所述如式(iii)所示的四氮唑类化合物的制备中,所述反应的进程一般可采用本领域常规的检测方法进行监测(例如tlc、hplc或gc),一般以如式(iii-a)所示的化合物消失时作为反应的终点。所述反应的时间较佳地为2~12小时。
[0058]
本发明还提供了一种双氟磺酰亚胺在如式(iv)所示的化合物的制备中作为催化剂的应用,包括以下步骤:
[0059]
溶剂中,在双氟磺酰亚胺的作用下,如式(iv-a)所示的化合物和如式(iv-b)所示
的化合物进行加成反应,得式(iv)所示的化合物,即可;
[0060][0061]
其中,
[0062]
x为nh、s或o;
[0063]
r7、r8和r9独立地为c1-c16烷基、c6-c10芳基、rc取代的c6-c10芳基或rc为卤素、c1-c6烷基或c1-c6烷氧基。
[0064]
较佳地,r7、r8或r9中,所述c1-c16烷基例如为c1-c10烷基,再例如为c1-c6烷基(例如c1-c3烷基,再例如甲基、乙基、正丙基或异丙基)。
[0065]
较佳地,r7、r8或r9中,所述c6-c10芳基和所述rc取代的c6-c10芳基中的c6-c10芳基独立地为苯基。
[0066]
较佳地,r7、r8或r9中,所述rc取代的苄基中所述rc的取代个数可为1~3个(例如1个),各rc相同或不同。
[0067]
较佳地,rc中,所述卤素为氟、氯、溴或碘。
[0068]
较佳地,rc中,所述c1-c6烷基为c1-c3烷基,例如甲基、乙基、正丙基或异丙基。
[0069]
较佳地,rc中,所述c1-c6烷氧基为c1-c3烷氧基,例如甲氧基、乙氧基、正丙氧基或异丙氧基。
[0070]
较佳地,r7和r8独立地为c1-c16烷基,例如为c1-c10烷基,再例如为c1-c6烷基(例如c1-c3烷基,再例如甲基、乙基、正丙基或异丙基)。
[0071]
较佳地,r9为
[0072]
较佳地,x为nh。
[0073]
较佳地,所述如式(iv-a)所示的化合物为
[0074]
较佳地,所述如式(iv-b)所示的化合物为
[0075]
所述如式(iv)所示的化合物的制备中,所述双氟磺酰亚胺的用量较佳地为如式(iv-a)所示的化合物摩尔量的1%-10%(例如5%)。
[0076]
所述如式(iv)所示的化合物的制备中,所述如式(iv-a)所示的化合物和所述如式(iv-b)所示的化合物的用量比可为本领域此类反应常用的用量比,例如,所述如式(iv-a)所示的化合物和所述如式(iv-b)所示的化合物的摩尔比为1:(1-10),再例如1:1。
[0077]
所述如式(iv)所示的化合物的制备中,所述溶剂可为本领域此类反应常用的溶剂,例如亚砜类溶剂、酮类溶剂、醇类溶剂、醚类溶剂、酯类溶剂、腈类溶剂、芳烃类溶剂、酰胺类溶剂、卤代烷烃类溶剂和烷烃类溶剂中的一种或多种;再例如四氢呋喃,二氯甲烷,乙酸乙酯,乙腈,二甲亚砜,n,n-二甲基甲酰胺,1,4-二氧六环等,再例如乙腈。
[0078]
所述如式(iv)所示的化合物的制备中,所述加成反应的温度可为本领域此类反应常用的温度,例如20℃-所述溶剂的回流温度,例如室温。
[0079]
所述如式(iv)所示的化合物的制备中,所述加成反应的进程一般可采用本领域常规的检测方法进行监测(例如tlc、hplc或gc),一般以如式(iv-a)所示的化合物消失时作为反应的终点。所述加成反应的时间较佳地为10分钟~12小时,例如0.5小时。
[0080]
本发明还提供了一种双氟磺酰亚胺在如式(v)所示的化合物的制备中作为催化剂的应用,包括以下步骤:
[0081]
溶剂中,在双氟磺酰亚胺的作用下,如式(v-a)所示的化合物和如式(v-b)所示的化合物进行傅克反应,得式(v)所示的化合物,即可;
[0082][0083]
其中,y为卤素、
[0084]r10
为c1-c16烷基、苄基、c6-c10芳基、rd取代的c6-c10芳基或re取代的苄基,rd和re独立地为卤素、c1-c6烷基或c1-c6烷氧基;
[0085]r11
为c1-c6烷基或c1-c6烷氧基。
[0086]
较佳地,y中,所述卤素为氟、氯、溴或碘,例如为氯、溴或碘。
[0087]
较佳地,r
10
中,所述c1-c16烷基例如为c1-c10烷基,再例如为c1-c6烷基(例如c1-c3烷基,再例如甲基、乙基、正丙基或异丙基)。
[0088]
较佳地,r
10
中,所述c6-c10芳基和所述rd取代的c6-c10芳基中的c6-c10芳基独立地为苯基。
[0089]
较佳地,r
10
中,所述rd取代的c6-c10芳基中所述rd的取代个数可为1~3个(例如1个),各rd相同或不同。
[0090]
较佳地,r
10
中,所述re取代的苄基中所述re的取代个数可为1~3个(例如1个),各re相同或不同。
[0091]
较佳地,rd或re中,所述卤素为氟、氯、溴或碘。
[0092]
较佳地,rd、re或r
11
中,所述c1-c6烷基为c1-c3烷基,例如甲基、乙基、正丙基或异丙基。
[0093]
较佳地,rd、re或r
11
中,所述c1-c6烷氧基为c1-c3烷氧基,例如甲氧基、乙氧基、正丙氧基或异丙氧基。
[0094]
较佳地,rd、re和r
11
独立地为c1-c6烷氧基。
[0095]
较佳地,y为
[0096]
较佳地,r
10
为苄基、苯基、rd取代的苯基或re取代的苄基,rd和re独立地为c1-c6烷氧基。
[0097]
较佳地,所述如式(v-a)所示的化合物为
[0098]
较佳地,所述如式(v-b)所示的化合物为
[0099]
所述如式(v)所示的化合物的制备中,所述双氟磺酰亚胺的用量较佳地为如式(v-b)所示的化合物摩尔量的0.1%-10%(例如5%)。
[0100]
所述如式(v)所示的化合物的制备中,所述如式(v-a)所示的化合物和所述如式(v-b)所示的化合物的用量比可为本领域此类反应常用的用量比,例如,所述如式(v-a)所示的化合物和所述如式(v-b)所示的化合物的摩尔比为(1-10):1,再例如1:1。
[0101]
所述如式(v)所示的化合物的制备中,所述溶剂可为本领域此类反应常用的溶剂,例如亚砜类溶剂、酮类溶剂、醇类溶剂、醚类溶剂、酯类溶剂、腈类溶剂、芳烃类溶剂、酰胺类溶剂、卤代烷烃类溶剂和烷烃类溶剂中的一种或多种;再例如二氯甲烷,四氢呋喃,乙酸乙酯,乙腈,二甲亚砜,n,n-二甲基甲酰胺,1,4-二氧六环等,再例如二氯甲烷。
[0102]
所述如式(v)所示的化合物的制备中,所述傅克反应的温度可为本领域此类反应常用的温度,例如20℃-所述溶剂的回流温度,例如室温。
[0103]
所述如式(v)所示的化合物的制备中,所述傅克反应的进程一般可采用本领域常规的检测方法进行监测(例如tlc、hplc或gc),一般以如式(v-b)所示的化合物消失时作为反应的终点。所述傅克反应的时间较佳地为5分钟~12小时,例如0.5小时。
[0104]
本发明还提供了一种双氟磺酰亚胺在如式(vi)所示的化合物的制备中作为催化剂的应用,包括以下步骤:
[0105]
溶剂中,在双氟磺酰亚胺的作用下,如式(vi-a)所示的化合物和水进行水解反应,得式(vi)所示的化合物,即可;
[0106][0107]
其中,r
12
为c1-c16烷基、c6-c10芳基或rf取代的c6-c10芳基,rf为氨基。
[0108]
较佳地,r
12
中,所述c1-c16烷基例如为c1-c10烷基,再例如为c1-c6烷基(例如c1-c3烷基,再例如甲基、乙基、正丙基或异丙基)。
[0109]
较佳地,r
12
中,所述c6-c10芳基和所述rf取代的c6-c10芳基中的c6-c10芳基独立地为苯基。
[0110]
较佳地,r
12
中,所述rf取代的c6-c10芳基中所述rf的取代个数可为1~3个(例如1
个),各rf相同或不同。
[0111]
较佳地,r
12
为苯基或氨基取代的苯基。
[0112]
所述如式(vi)所示的化合物的制备中,所述双氟磺酰亚胺的用量较佳地为如式(vi-a)所示的化合物摩尔量的5%-30%(例如10%)。
[0113]
所述如式(vi)所示的化合物的制备中,所述如式(vi-a)所示的化合物和水的用量比可为本领域此类反应常用的用量比,例如,所述如式(vi-a)所示的化合物和水的摩尔比为1:(1-10),再例如1:2.9。
[0114]
所述如式(vi)所示的化合物的制备中,所述溶剂可为本领域此类反应常用的溶剂,例如亚砜类溶剂、酮类溶剂、醇类溶剂、醚类溶剂、酯类溶剂、腈类溶剂、芳烃类溶剂、酰胺类溶剂、卤代烷烃类溶剂和烷烃类溶剂中的一种或多种;再例如二氯甲烷,四氢呋喃,乙酸乙酯,乙腈,二甲亚砜,n,n-二甲基甲酰胺,1,4-二氧六环等,再例如1,4-二氧六环。
[0115]
所述如式(vi)所示的化合物的制备中,所述水解反应的温度可为本领域此类反应常用的温度,例如20℃-所述溶剂的回流温度,例如100℃。
[0116]
所述如式(vi)所示的化合物的制备中,所述水解反应的进程一般可采用本领域常规的检测方法进行监测(例如tlc、hplc或gc),一般以如式(vi-a)所示的化合物消失时作为反应的终点。所述水解反应的时间较佳地为2~12小时,例如8小时。
[0117]
本发明还提供了一种双氟磺酰亚胺在如式(vii)所示的化合物的制备中作为催化剂的应用,包括以下步骤:
[0118]
溶剂中,在双氟磺酰亚胺的作用下,如式(vii-a)所示的化合物和烯丙基三甲基硅烷进行反应,得式(vii)所示的化合物,即可;
[0119][0120]
其中,r
13
和r
14
独立地为c1-c16烷基、c6-c10芳基或rg取代的c6-c10芳基,rg为卤素、c1-c6烷基或c1-c6烷氧基。
[0121]
较佳地,r
13
或r
14
中,所述c1-c16烷基例如为c1-c10烷基,再例如为c1-c6烷基(例如c1-c3烷基,再例如甲基、乙基、正丙基或异丙基)。
[0122]
较佳地,r
13
或r
14
中,所述c6-c10芳基和所述rg取代的c6-c10芳基中的c6-c10芳基独立地为苯基。
[0123]
较佳地,rg中,所述卤素为氟、氯、溴或碘,例如氯。
[0124]
较佳地,rg中,所述c1-c6烷基为c1-c3烷基,例如甲基、乙基、正丙基或异丙基。
[0125]
较佳地,rg中,所述c1-c6烷氧基为c1-c3烷氧基,例如甲氧基、乙氧基、正丙氧基或异丙氧基。
[0126]
较佳地,r
13
或r
14
中,所述rg取代的c6-c10芳基中所述rg的取代个数可为1~3个(例如1个),各rg相同或不同。
[0127]
较佳地,r
13
和r
14
独立地为苯基或rg取代的苯基,rg为c1-c3烷氧基。
[0128]
较佳地,所述如式(vii-a)所示的化合物为
[0129]
所述如式(vii)所示的化合物的制备中,所述双氟磺酰亚胺的用量较佳地为如式(vii-a)所示的化合物摩尔量的5%-30%,例如10%。
[0130]
所述如式(vii)所示的化合物的制备中,所述如式(vii-a)所示的化合物和所述烯丙基三甲基硅烷的用量比可为本领域此类反应常用的用量比,例如,所述如式(vii-a)所示的化合物和所述烯丙基三甲基硅烷的摩尔比为1:(1-10),例如1:1.2。
[0131]
所述如式(vii)所示的化合物的制备中,所述溶剂可为本领域此类反应常用的溶剂,例如亚砜类溶剂、酮类溶剂、醇类溶剂、醚类溶剂、酯类溶剂、腈类溶剂、芳烃类溶剂、酰胺类溶剂、卤代烷烃类溶剂和烷烃类溶剂中的一种或多种;再例如二氯甲烷,四氢呋喃,乙酸乙酯,乙腈,二甲亚砜,n,n-二甲基甲酰胺,1,4-二氧六环等,再例如二氯甲烷。
[0132]
所述如式(vii)所示的化合物的制备中,所述反应的温度可为本领域此类反应常用的温度,例如-20℃-室温,例如室温。
[0133]
所述如式(vii)所示的化合物的制备中,所述反应的进程一般可采用本领域常规的检测方法进行监测(例如tlc、hplc或gc),一般以如式(vii-a)所示的化合物消失时作为反应的终点。所述反应的时间较佳地为2~12小时,例如2小时。
[0134]
本发明还提供了一种双氟磺酰亚胺在如式(viii)所示的化合物的制备中作为催化剂的应用,包括以下步骤:
[0135]
在双氟磺酰亚胺的作用下,如式(viii-a)所示的化合物、如式(viii-b)所示的化合物和如式(viii-c)所示的化合物进行反应,得式(viii)所示的化合物,即可;
[0136][0137]
其中,r
15
、r
16
、r
17
、r
18
、r
19
和r
20
独立地为h、c1-c16烷基、c6-c10芳基或rh取代的c6-c10芳基,rh为卤素、c1-c6烷基或c1-c6烷氧基。
[0138]
较佳地,r
15
、r
16
、r
17
、r
18
、r
19
或r
20
中,所述c1-c16烷基例如为c1-c10烷基,再例如为c1-c6烷基(例如c1-c3烷基,再例如甲基、乙基、正丙基或异丙基)。
[0139]
较佳地,r
15
、r
16
、r
17
、r
18
、r
19
或r
20
中,所述c6-c10芳基和所述rh取代的c6-c10芳基中的c6-c10芳基独立地为苯基。
[0140]
较佳地,rh中,所述卤素为氟、氯、溴或碘,例如氯。
[0141]
较佳地,rh中,所述c1-c6烷基为c1-c3烷基,例如甲基、乙基、正丙基或异丙基。
[0142]
较佳地,rh中,所述c1-c6烷氧基为c1-c3烷氧基,例如甲氧基、乙氧基、正丙氧基或异丙氧基。
[0143]
较佳地,r
15
、r
16
、r
17
、r
18
、r
19
或r
20
中,所述rh取代的c6-c10芳基中所述rh的取代个数可为1~3个(例如1个),各rh相同或不同。
[0144]
较佳地,r
15
、r
16
、r
17
、r
18
、r
19
和r
20
独立地为h、c1-c6烷基、苯基或rh取代的苯基,rh为卤素、c1-c3烷基或c1-c3烷氧基。
[0145]
较佳地,所述如式(viii-a)所示的化合物为
[0146]
较佳地,所述如式(viii-b)所示的化合物为
[0147]
较佳地,所述如式(viii-c)所示的化合物为
[0148]
所述如式(viii)所示的化合物的制备中,所述双氟磺酰亚胺的用量较佳地为如式(viii-b)所示的化合物摩尔量的1%-100%,例如10%-50%,再例如30%。
[0149]
所述如式(viii)所示的化合物的制备中,所述如式(viii-a)所示的化合物和所述如式(viii-b)所示的化合物的用量比可为本领域此类反应常用的用量比,例如,所述如式(vii-a)所示的化合物和所述如式(viii-b)所示的化合物的摩尔比为(1-2):1,例如1.1:1或1.3:1。
[0150]
所述如式(viii)所示的化合物的制备中,所述如式(viii-a)所示的化合物和所述如式(viii-c)所示的化合物的用量比可为本领域此类反应常用的用量比,例如,所述如式(vii-a)所示的化合物和所述如式(viii-c)所示的化合物的摩尔比为1:(1-3),例如1:1.3、1:1.8或1:2。
[0151]
所述如式(viii)所示的化合物的制备中,所述反应可在无溶剂中进行,也可在溶剂中进行,所述溶剂可为本领域此类反应常用的溶剂,例如亚砜类溶剂、酮类溶剂、醇类溶剂、醚类溶剂、酯类溶剂、腈类溶剂、芳烃类溶剂、酰胺类溶剂、卤代烷烃类溶剂和烷烃类溶剂中的一种或多种;再例如四氢呋喃,二氯甲烷,乙酸乙酯,乙腈,二甲亚砜,n,n-二甲基甲酰胺,1,4-二氧六环等。较佳地,所述反应在无溶剂中进行。
[0152]
所述如式(viii)所示的化合物的制备中,所述反应的温度可为本领域此类反应常用的温度,例如室温-50℃,例如室温。
[0153]
所述如式(viii)所示的化合物的制备中,所述反应的进程一般可采用本领域常规的检测方法进行监测(例如tlc、hplc或gc),一般以如式(viii-b)所示的化合物消失时作为反应的终点。所述反应的时间较佳地为2~12小时。
[0154]
本发明还提供了一种双氟磺酰亚胺在如式(ix)所示的化合物的重排反应中作为催化剂的应用,包括以下步骤:
[0155]
溶剂中,在双氟磺酰亚胺的作用下,如式(ix)所示的化合物进行重排反应,制得如式(ix-a)所示的化合物和/或如式(ix-b)所示的化合物,即可;
[0156][0157]
其中,r
21
为c1-c16烷基、c6-c10芳基或ri取代的c6-c10芳基,ri为卤素、c1-c6烷基或c1-c6烷氧基。
[0158]
较佳地,r
21
中,所述c1-c16烷基例如为c1-c10烷基,再例如为c1-c6烷基(例如c1-c3烷基,再例如甲基、乙基、正丙基或异丙基)。
[0159]
较佳地,r
21
中,所述c6-c10芳基和所述ri取代的c6-c10芳基中的c6-c10芳基独立地为苯基。
[0160]
较佳地,ri中,所述卤素为氟、氯、溴或碘,例如氯。
[0161]
较佳地,ri中,所述c1-c6烷基为c1-c3烷基,例如甲基、乙基、正丙基或异丙基。
[0162]
较佳地,ri中,所述c1-c6烷氧基为c1-c3烷氧基,例如甲氧基、乙氧基、正丙氧基或异丙氧基。
[0163]
较佳地,r
21
中,所述ri取代的c6-c10芳基中所述ri的取代个数可为1~3个(例如1个),各ri相同或不同。
[0164]
较佳地,r
21
为c1-c10烷基,再例如为c1-c6烷基(例如c1-c3烷基,再例如甲基、乙基、正丙基或异丙基)。
[0165]
所述如式(ix)所示的化合物的重排反应中,所述双氟磺酰亚胺的用量较佳地为如式(ix)所示的化合物摩尔量的20%-150%,例如100%-150%,再例如123%或124%。
[0166]
所述如式(ix)所示的化合物的重排反应中,所述重排反应可在无溶剂中进行,也可在溶剂中进行,所述溶剂可为本领域此类反应常用的溶剂,例如亚砜类溶剂、酮类溶剂、醇类溶剂、醚类溶剂、酯类溶剂、腈类溶剂、芳烃类溶剂、酰胺类溶剂、卤代烷烃类溶剂和烷烃类溶剂中的一种或多种;再例如四氢呋喃,二氯甲烷,乙酸乙酯,乙腈,二甲亚砜,n,n-二甲基甲酰胺,1,4-二氧六环等。较佳地,所述重排反应在无溶剂中进行。
[0167]
所述如式(ix)所示的化合物的重排反应中,所述重排反应的温度可为本领域此类反应常用的温度,例如20℃-150℃,例如室温、60℃。
[0168]
所述如式(ix)所示的化合物的重排反应中,所述重排反应的进程一般可采用本领域常规的检测方法进行监测(例如tlc、hplc或gc),一般以如式(ix)所示的化合物消失时作为反应的终点。所述重排反应的时间较佳地为2~12小时,例如3小时。
[0169]
本发明还提供了一种双氟磺酰亚胺在如式(x)所示的化合物的制备中作为催化剂的应用,包括以下步骤:
[0170]
在双氟磺酰亚胺的作用下,如式(x-a)所示的化合物和如式(x-b)所示的化合物进行反应,得式(x)所示的化合物,即可;
[0171][0172]
其中,r
22
为h、c1-c16烷基、c6-c10芳基或rj取代的c6-c10芳基;r
23
为c1-c16烷基、c6-c10芳基或rk取代的c6-c10芳基,rj和rk独立地为卤素、c1-c6烷基或c1-c6烷氧基。
[0173]
较佳地,r
22
或r
23
中,所述c1-c16烷基例如为c1-c10烷基,再例如为c1-c6烷基(例如c1-c3烷基,再例如甲基、乙基、正丙基或异丙基)。
[0174]
较佳地,r
22
或r
23
中,所述c6-c10芳基、所述rj取代的c6-c10芳基和所述rk取代的c6-c10芳基中的c6-c10芳基独立地为苯基。
[0175]
较佳地,rj或rk中,所述卤素为氟、氯、溴或碘,例如氯。
[0176]
较佳地,rj或rk中,所述c1-c6烷基为c1-c3烷基,例如甲基、乙基、正丙基或异丙基。
[0177]
较佳地,rj或rk中,所述c1-c6烷氧基为c1-c3烷氧基,例如甲氧基、乙氧基、正丙氧基或异丙氧基。
[0178]
较佳地,r
22
中,所述rj取代的c6-c10芳基中所述rj的取代个数可为1~3个(例如1个),各rj相同或不同。
[0179]
较佳地,r
23
中,所述rk取代的c6-c10芳基中所述rk的取代个数可为1~3个(例如1个),各rk相同或不同。
[0180]
较佳地,r
22
为苯基或rj取代的苯基。
[0181]
较佳地,r
23
为c1-c16烷基,例如为c1-c10烷基,再例如为c1-c6烷基(例如c1-c3烷基,再例如甲基、乙基、正丙基或异丙基)。
[0182]
所述如式(x)所示的化合物的制备中,所述双氟磺酰亚胺的用量较佳地为如式(x-a)所示的化合物摩尔量的0.1%-10%,例如10%。
[0183]
所述如式(x)所示的化合物的制备中,所述如式(x-a)所示的化合物和所述如式(x-b)所示的化合物的用量比可为本领域此类反应常用的用量比,例如,所述如式(x-a)所示的化合物和所述如式(x-b)所示的化合物的摩尔比为1:(1-10),例如1:5.5。
[0184]
所述如式(x)所示的化合物的制备中,所述反应可在无溶剂中进行,也可在溶剂中进行,所述溶剂可为本领域此类反应常用的溶剂,例如亚砜类溶剂、酮类溶剂、醇类溶剂、醚类溶剂、酯类溶剂、腈类溶剂、芳烃类溶剂、酰胺类溶剂、卤代烷烃类溶剂和烷烃类溶剂中的一种或多种;再例如甲苯,四氢呋喃,二氯甲烷,乙酸乙酯,乙腈,二甲亚砜,n,n-二甲基甲酰胺,1,4-二氧六环等,再例如甲苯。较佳地,所述反应在无溶剂中进行。
[0185]
所述如式(x)所示的化合物的制备中,所述反应的温度可为本领域此类反应常用的温度,例如室温-所用溶剂的回流温度,例如85℃。
[0186]
所述如式(x)所示的化合物的制备中,所述反应的进程一般可采用本领域常规的检测方法进行监测(例如tlc、hplc或gc),一般以如式(x-a)所示的化合物消失时作为反应的终点。所述反应的时间较佳地为2~12小时,例如12小时。
[0187]
本发明还提供了一种双氟磺酰亚胺在如式(xi-a)所示的羰基化合物的还原醚化反应中作为催化剂的应用,包括以下步骤:
[0188]
溶剂中,在双氟磺酰亚胺和如式(xi-b)所示的硅烷类化合物的作用下,如式(xi-a)所示的羰基化合物进行还原醚化反应,制得如式(xi)所示的化合物,即可;
[0189][0190]
其中,r
24
和r
25
独立地为h、c1-c16烷基、c6-c10芳基或r
l
取代的c6-c10芳基,r
l
为卤素、c1-c6烷基或c1-c6烷氧基;r
24-1
为c1~c3烷基。
[0191]
较佳地,r
24
或r
25
中,所述c1-c16烷基例如为c1-c10烷基,再例如为c1-c6烷基(例如c1-c3烷基,再例如甲基、乙基、正丙基或异丙基)。
[0192]
较佳地,r
24
或r
25
中,所述c6-c10芳基和所述r
l
取代的c6-c10芳基中的c6-c10芳基独立地为苯基。
[0193]
较佳地,r
l
中,所述卤素为氟、氯、溴或碘,例如氯。
[0194]
较佳地,r
l
中,所述c1-c6烷基为c1-c3烷基,例如甲基、乙基、正丙基或异丙基。
[0195]
较佳地,r
l
中,所述c1-c6烷氧基为c1-c3烷氧基,例如甲氧基、乙氧基、正丙氧基或异丙氧基。
[0196]
较佳地,r
24
或r
25
中,所述r
l
取代的c6-c10芳基中所述r
l
的取代个数可为1~3个(例如1个),各r
l
相同或不同。
[0197]
较佳地,r
24
和r
25
独立地为h、苯基或r
l
取代的苯基。
[0198]
较佳地,r
24-1
为甲基、乙基、正丙基或异丙基。
[0199]
较佳地,所述如式(xi-a)所示的羰基化合物为a)所示的羰基化合物为
[0200]
所述如式(xi-a)所示的羰基化合物的还原醚化反应中,所述双氟磺酰亚胺的用量较佳地为如式(xi-a)所示的羰基化合物摩尔量的0.1%-10%,例如0.1%-5%,再例如1%。
[0201]
所述如式(xi-a)所示的羰基化合物的还原醚化反应中,所述如式(xi-b)所示的硅烷类化合物的用量可为本领域此类反应常用的用量,例如,所述如式(xi-a)所示的羰基化合物和所述如式(xi-b)所示的硅烷类化合物的摩尔比为1:(1-2),例如1:1.12、1:1.10。
[0202]
所述如式(xi-a)所示的羰基化合物的还原醚化反应中,所述溶剂可为本领域此类反应常用的溶剂,例如亚砜类溶剂、酮类溶剂、醇类溶剂、醚类溶剂、酯类溶剂、腈类溶剂、芳烃类溶剂、酰胺类溶剂、卤代烷烃类溶剂和烷烃类溶剂中的一种或多种;再例如四氢呋喃,二氯甲烷,乙酸乙酯,乙腈,二甲亚砜,n,n-二甲基甲酰胺,1,4-二氧六环等,例如二氯甲烷。
[0203]
所述如式(xi-a)所示的羰基化合物的还原醚化反应中,所述还原醚化反应的温度可为本领域此类反应常用的温度,例如0℃-室温,例如室温。
[0204]
所述如式(xi-a)所示的羰基化合物的还原醚化反应中,所述还原醚化反应的进程一般可采用本领域常规的检测方法进行监测(例如tlc、hplc或gc),一般以如式(xi-a)所示的羰基化合物消失时作为反应的终点。所述还原醚化反应的时间较佳地为5分钟~12小时,例如0.5小时、1小时。
[0205]
本发明还提供了一种如式(xii)所示的双氟磺酰亚胺酸硅酯的制备方法,包括以下步骤:
[0206]
如式(xii-a)所示的化合物和双氟磺酰亚胺进行反应,得如式(xii)所示的双氟磺酰亚胺酸硅酯,即可;
[0207][0208]
其中,z为h、卤素、c1-c16烷基、c6-c10芳基或rn取代的c6-c10芳基,r
26
、r
27
和r
28
独立地为c1-c16烷基、c6-c10芳基、rm取代的c6-c10芳基或r
29
、r
30
和r
31
独立地为c1-c6烷基,rm和rn独立地为卤素、c1-c6烷基或c1-c6烷氧基。
[0209]
较佳地,z、r
26
、r
27
或r
28
中,所述c1-c16烷基例如为c1-c10烷基,再例如为c1-c6烷基(例如c1-c3烷基,再例如甲基、乙基、正丙基或异丙基)。
[0210]
较佳地,z、r
26
、r
27
或r
28
中,所述c6-c10芳基、所述rn取代的c6-c10芳基和所述rm取代的c6-c10芳基中的c6-c10芳基独立地为苯基。
[0211]
较佳地,z、rm或rn中,所述卤素为氟、氯、溴或碘,例如氯。
[0212]
较佳地,rm或rn中,所述c1-c6烷基为c1-c3烷基,例如甲基、乙基、正丙基或异丙基。
[0213]
较佳地,rm或rn中,所述c1-c6烷氧基为c1-c3烷氧基,例如甲氧基、乙氧基、正丙氧基或异丙氧基。
[0214]
较佳地,r
26
、r
27
或r
28
中,所述rm取代的c6-c10芳基中所述rm的取代个数可为1~3个(例如1个),各rm相同或不同。
[0215]
较佳地,r
29
、r
30
或r
31
中,所述c1-c6烷基为c1-c3烷基,例如甲基、乙基、正丙基或异丙基。
[0216]
较佳地,z中,所述rn取代的c6-c10芳基中所述rn的取代个数可为1~3个(例如1个),各rn相同或不同。
[0217]
较佳地,r
26
、r
27
和r
28
独立地为r
29
、r
30
和r
31
独立地为c1-c3烷基(例如
甲基、乙基、正丙基或异丙基)。
[0218]
较佳地,z为h或卤素,更佳地,z为h。
[0219]
较佳地,所述如式(xii-a)所示的化合物为
[0220]
所述如式(xii)所示的双氟磺酰亚胺酸硅酯的制备方法中,所述如式(xii-a)所示的化合物和所述双氟磺酰亚胺的用量比可为本领域此类反应常用的用量比,例如,所述如式(xii-a)所示的化合物与所述双氟磺酰亚胺摩尔比为(1-10):1,例如1:1。
[0221]
所述如式(xii)所示的双氟磺酰亚胺酸硅酯的制备方法中,所述反应可在无溶剂中进行,也可在溶剂中进行,所述溶剂可为本领域此类反应常用的溶剂,例如亚砜类溶剂、酮类溶剂、醇类溶剂、醚类溶剂、酯类溶剂、腈类溶剂、芳烃类溶剂、酰胺类溶剂、卤代烷烃类溶剂和烷烃类溶剂中的一种或多种;再例如四氢呋喃,二氯甲烷,乙酸乙酯,乙腈,二甲亚砜,n,n-二甲基甲酰胺,1,4-二氧六环等,再例如乙腈或二氯甲烷。较佳地,所述反应在无溶剂中进行。
[0222]
所述如式(xii)所示的双氟磺酰亚胺酸硅酯的制备方法中,所述反应的温度可为本领域此类反应常用的温度,例如0℃-室温,例如室温。
[0223]
所述如式(xii)所示的双氟磺酰亚胺酸硅酯的制备方法中,所述反应的进程一般可采用本领域常规的检测方法进行监测(例如tlc、hplc或gc或nmr),一般以双氟磺酰亚胺消失时作为反应的终点。所述反应的时间较佳地为30分钟~2小时,例如1小时。
[0224]
本发明还提供了一种双氟磺酰亚胺在如式(xiii)所示的化合物的制备中作为催化剂的应用,包括以下步骤:
[0225]
在双氟磺酰亚胺的作用下,如式(xiii-a)所示的化合物、如式(xiii-b)所示的化合物和如式(xiii-c)所示的化合物进行反应,得式(xiii)所示的化合物,即可;
[0226][0227]
其中,q为ch或n;
[0228]r32
为卤素、c1-c16烷基、c6-c10芳基或ro取代的c6-c10芳基;
[0229]
m3为0、1、2、3或4;
[0230]r33
为c1-c16烷基、c6-c10芳基或r
p
取代的c6-c10芳基;
[0231]ro
和r
p
独立地为卤素、c1-c6烷基或c1-c6烷氧基。
[0232]
较佳地,m3为0或1(例如m3为0)。
[0233]
较佳地,q为n。
[0234]
较佳地,r
32
中,所述卤素为氟、氯、溴或碘,例如氯。
[0235]
较佳地,r
32
或r
33
中,所述c1-c16烷基例如为c1-c10烷基,再例如为c1-c6烷基(例如c1-c3烷基,再例如甲基、乙基、正丙基或异丙基)。
[0236]
较佳地,r
32
或r
33
中,所述c6-c10芳基、所述ro取代的c6-c10芳基和所述r
p
取代的c6-c10芳基中的c6-c10芳基独立地为苯基。
[0237]
较佳地,ro或r
p
中,所述卤素为氟、氯、溴或碘,例如氯。
[0238]
较佳地,ro或r
p
中,所述c1-c6烷基为c1-c3烷基,例如甲基、乙基、正丙基或异丙基。
[0239]
较佳地,ro或r
p
中,所述c1-c6烷氧基为c1-c3烷氧基,例如甲氧基、乙氧基、正丙氧基或异丙氧基。
[0240]
较佳地,r
32
中,所述ro取代的c6-c10芳基中所述ro的取代个数可为1~3个(例如1个),各ro相同或不同。
[0241]
较佳地,r
33
中,所述r
p
取代的c6-c10芳基中所述r
p
的取代个数可为1~3个(例如1个),各r
p
相同或不同。
[0242]
较佳地,r
33
为c1-c6烷基,例如c1-c3烷基,再例如甲基、乙基、正丙基或异丙基。
[0243]
所述如式(xiii)所示的化合物的制备中,所述双氟磺酰亚胺的用量较佳地为如式(xiii-b)所示的化合物摩尔量的5%-20%,例如10%。
[0244]
所述如式(xiii)所示的化合物的制备中,所述如式(xiii-a)所示的化合物和所述如式(xiii-b)所示的化合物的用量比可为本领域此类反应常用的用量比,例如,所述如式(xiii-a)所示的化合物和所述如式(xiii-b)所示的化合物的摩尔比为(1-2):1,例如1:5.1。
[0245]
所述如式(xiii)所示的化合物的制备中,所述如式(xiii-c)所示的化合物和所述如式(xiii-b)所示的化合物的用量比可为本领域此类反应常用的用量比,例如,所述如式(xiii-c)所示的化合物和所述如式(xiii-b)所示的化合物的摩尔比为(1-200):1,例如192.5:1。
[0246]
所述如式(xiii)所示的化合物的制备中,所述反应可在无溶剂中进行,也可在溶剂中进行,所述溶剂可为本领域此类反应常用的溶剂,例如亚砜类溶剂、酮类溶剂、醇类溶剂、醚类溶剂、酯类溶剂、芳烃类溶剂、酰胺类溶剂、卤代烷烃类溶剂和烷烃类溶剂中的一种或多种;再例如四氢呋喃,二氯甲烷,乙酸乙酯,二甲亚砜,n,n-二甲基甲酰胺,1,4-二氧六环等,再例如乙腈或二氯甲烷。较佳地,所述反应在无溶剂中进行。
[0247]
所述如式(xiii)所示的化合物的制备中,所述反应的温度可为本领域此类反应常用的温度,例如50℃-120℃,再例如60℃。
[0248]
所述如式(xiii)所示的化合物的制备中,所述反应的进程一般可采用本领域常规的检测方法进行监测(例如tlc、hplc或gc或nmr),一般以如式(xiii-b)所示的化合物消失时作为反应的终点。所述反应的时间较佳地为1~5小时,例如3.5小时。
[0249]
本发明中,室温指20℃-30℃。
[0250]
如无特别说明,本发明所用术语具有如下含义:
[0251]
术语“烷基”是指具有指定的碳原子数的直链或支链烷基。烷基的实例包括但不限于甲基、乙基、正丙基、异丙基、正丁基、叔丁基、异丁基、仲丁基、正戊基、正己基、正庚基、正辛基及其类似烷基。
70℃条件下通入60克二氧化硫,缓慢升至室温,反应半小时,有白色固体生成,然后缓慢释放二氧化硫气体,加入50ml二氯甲烷,过滤,固体用50ml二氯甲烷洗涤,滤液旋干,减压蒸馏,收集85℃/20mm hg馏分,得到双氟磺酰亚胺8.1g(44.75mmol),无色液体,产率91%。
[0273]
19
f nmr(二氯甲烷为溶剂,一氟三氯甲烷为内标):+57.3。
[0274]
实施例1
[0275][0276]
在25ml三口烧瓶中计入1.9998g(17.54mmol,1eq)己内酯,二氯甲烷5ml,175ul浓度为1mol/l的苯丙醇二氯甲烷溶液(1%eq),氮气保护条件下加入35ul浓度为0.5mol/l的双氟磺酰亚胺酸二氯甲烷溶液(0.1%eq),室温反应过夜,将反应液倒入50ml冷正己烷中,析出固体,过滤,抽干得到白色聚己内酯固体1.86g(产率93%)经gpc检测,mn
ps
=25267,pdi=1.03。
[0277]
实施例2
[0278][0279]
在25ml单口烧瓶中计入5.01g(16.92mmol)八甲基环四硅氧烷,六甲基硅醚0.0687g(0.424mmol),磁力搅拌,氮气保护下加入0.12g双氟磺酰亚胺(0.66mmol,4%摩尔,相对于八甲基环四硅氧烷),室温下反应过夜,得到无色粘稠液体,为二甲基硅油。经gpc检测,mn
ps
=9820,pdi=1.0。
[0280]
实施例3
[0281][0282]
在20ml单口瓶中加入3-乙炔基苯胺(0.1068g,0.912mmol),叠氮化钠(0.065g,1mmol),原甲酸三乙酯(0.162g,1.1mmol),丙三醇(4ml),加入双氟磺酰亚胺(91ul,0.5m in dcm,5%摩尔,相对于3-乙炔基苯胺),室温反应过夜,tlc(石油醚:乙酸乙酯=10:1)检测原料(3-乙炔基苯胺)反应完毕,加入15ml水,有固体析出,经过滤,水洗,干燥,得到0.13g(0.76mmol)淡黄色固体,产率84%。熔点98.6-100℃。
[0283]1h nmr(400mhz,cd3cn):3.38(s,1h),7.17-7.32(m,4h),8.10(s,1h).
[0284]
实施例4
[0285][0286]
在20ml单口瓶中加入3-溴苯胺(0.1g,0.58mmol),叠氮化钠(0.038g,0.58mmol),原甲酸三乙酯(0.104g,0.7mmol),丙三醇(4ml),加入双氟磺酰亚胺(58ul,0.5m in dcm,5%摩尔,相对于3-溴苯胺),室温反应过夜,tlc(石油醚:乙酸乙酯=10:1)检测原料(3-溴苯胺)反应完毕,加入15ml水,有固体析出,经过滤,水洗,干燥,得到0.113g(0.5mmol)淡黄色固体,产率86%。熔点184-186℃。
[0287]1h nmr(400mhz,cdcl3):6.91-6.93(d,2h),7.4-7.42(d,2h),8.08(s,1h)。
[0288]
实施例5
[0289][0290]
在20ml单口瓶中加入4-己烯-3-酮(0.3095g,3.15mmol),氨基甲酸苄酯(0.476g,3.15mmol),乙腈(6ml),加入双氟磺酰亚胺(315ul,0.5m in ch3cn,5%摩尔,相对于4-己烯-3-酮),室温反应半小时,tlc(石油醚:乙酸乙酯=10:3),rf=0.4,检测原料(4-己烯-3-酮)消失,柱层析纯化得到0.74g白色固体,产率95%。
[0291]1h nmr(400mhz,cdcl3):0.94-1.26(m,6h),2.28-2.68(m,4h),3.91-4.17(m,1h),5.08(m,3h),7.3-7.34(m,5h)
[0292]
lc-ms:272(m+na)。
[0293]
实施例6
[0294][0295]
在20ml单口瓶中加入对甲氧基乙酸苄酯(0.792g,4.4mmol),甲氧基苯(0.476g,4.4mmol),二氯甲烷(6ml),加入双氟磺酰亚胺(440ul,0.5m in ch3cn,5%摩尔,相对于对甲氧基乙酸苄酯),室温反应半小时,tlc(石油醚:乙酸乙酯=10:3),rf=0.4,检测原料(对甲氧基乙酸苄酯)消失,旋干得到0.95g(4.17mmol)黄色油状体,产率95%。
[0296]1h nmr(400mhz,cdcl3):3.80(s,6h),3.89(s,2h),6.83-7.13(m,8h)。
[0297]
实施例7
[0298][0299]
在20ml单口瓶中加入对氨基苯乙炔(0.2265g,1.935mmol),水(0.1g,5.56mmol),1,4-二氧六环(2.5ml),加入双氟磺酰亚胺(35mg,0.193mmol,10%摩尔,相对于对氨基苯乙炔),100℃反应8小时,tlc(石油醚:乙酸乙酯=5:2,rf=0.3),检测原料(对氨基苯乙炔)消失,加入乙酸乙酯(20ml)萃取,水洗涤(20ml*3),饱和氯化钠洗涤,无水硫酸钠干燥,旋干得
到0.23g(1.7mmol)黄色固体,产率88%。
[0300]
lc-ms:136(m+1)。
[0301]1h nmr(400mhz,cd3cn):2.42(s,3h),4.79(s,2h),6.58-6.69(d,2h),7.68-7.79(d,2h)。
[0302]
实施例8
[0303][0304]
在20ml单口瓶中加入4
’‑
甲氧基查尔酮(0.1157g,0.486mmol),二氯甲烷(3ml),烯丙基三甲基硅烷(66.4mg,0.58mmol,1.2eq),冰浴条件下加入双氟磺酰亚胺(9mg,0.0497mmol,10%摩尔,相对于4
’‑
甲氧基查尔酮),缓慢恢复至室温反应两个小时,tlc(石油醚:乙酸乙酯=10:1),检测原料(4
’‑
甲氧基查尔酮)消失,用水洗涤(20ml*3),饱和氯化钠洗涤,无水硫酸钠干燥,柱层析纯化(石油醚:乙酸乙酯=10:1,rf=0.4)得到淡黄色固体0.11g(0.393mmol),产率81%。
[0305]1h nmr(400mhz,cdcl3):2.4-2.48(m,2h),3.21-3.23(m,2h),3.41-3.48(m,1h),3.83(s,3h),4.92-5.00(m,2h),5.62-5.72(m,1h),6.86-6.89(m,2h),7.14-7.28(m,5h),7.85-7.88(m,2h)。
[0306]
实施例9
[0307][0308]
在20ml单口瓶中加入苯胺(213mg,2.29mmol),苯甲醛(192mg,1.81mmol)和双氟磺酰亚胺(98mg,0.54mmol,30%摩尔,相对于苯甲醛)搅拌5分钟,再加入苯乙酮(360mg,3mmol)室温下搅拌过夜。柱层析纯化(正己烷:乙酸乙酯=10:1,rf=0.4)得到白色固体产物210mg(0.69mmol),产率38%。
[0309]1h nmr(400hmz,cdcl3):3.39-3.53(m,2h),4.56(s,1h),4.99-5.02(q,1h),6.55-6.57(d,2h),6.64-6.68(t,2h),7.07-7.09(t,2h),7.21-7.26(m,2h),7.30-7.34(t,2h),7.43-7.46(m,3h),7.54-7.58(t,1h),7.90-7.92(d,2h)。
[0310]
实施例10
[0311][0312]
在20ml单口瓶中加入苯胺(106mg,1.14mmol),对氯苯甲醛(140mg,1mmol)和苯乙酮(240mg,2mmol),搅拌均匀并加入双氟磺酰亚胺(54mg,0.298mmol,30%摩尔,相对于对氯苯甲醛),室温下反应过夜。tlc(正己烷:乙酸乙酯=10:1)检测苯胺和甲醛消失,柱层析纯化(正己烷:乙酸乙酯=10:1,rf=0.4)得到白色固体产物100mg(0.298mmol),产率30%。
[0313]1h nmr(400mhz,cdcl3):3.37-3.49(m,2h),4.44(brs,1h),4.94-4.97(t,1h),
6.51-6.52(d,2h),6.66-6.68(t,1h),7.06-7.10(t,2h),7.24-7.28(t,2h),7.36-7.38(d,2h),7.42-7.46(t,2h),7.78-7.79(d,2h)。
[0314]
实施例11
[0315][0316]
在10ml单口瓶中加入乙酸苯酯(220mg,1.62mmol)和双氟磺酰亚胺(360mg,1.99mmol),在室温下搅拌反应过夜,tlc(石油醚:乙酸乙酯=3:1)检测到乙酸苯酯消失,柱层析纯化(石油醚:乙酸乙酯=3:1,rf=0.3)得到黄色固体50mg(0.367mmol),产率23%。
[0317]1h nmr(400mhz,d-dmso):2.43(s,3h),6.79-6.81(d,2h),7.78-7.80(d,2h),10.30(s,1h)。
[0318]
实施例12
[0319][0320]
在10ml单口瓶中加入乙酸苯酯(330mg,2.4mmol)和双氟磺酰亚胺(540mg,2.98mmol),在60℃下搅拌反应3h,tlc(石油醚:乙酸乙酯=3:1)检测到乙酸苯酯消失,柱层析纯化(石油醚:乙酸乙酯=3:1,rf=0.3)得到黄色固体100mg(0.735mmol),产率30%。
[0321]1h nmr(400mhz,d-dmso):2.43(s,3h),6.79-6.81(d,2h),7.78-7.80(d,2h),10.30(s,1h)。
[0322]
实施例13
[0323][0324]
在25ml三口瓶中加入苯甲酸(0.21g,1.72mmol),无水甲醇(0.3g,9.375mmol)和甲苯(1ml)氮气保护下加入双氟磺酰亚胺(31mg,0.171mol,10%摩尔,相对于苯甲酸),在85℃下搅拌反应12h,tlc(石油醚:乙酸乙酯=30:1)检测到苯甲酸消失,柱层析纯化(石油醚:乙酸乙酯=30:1,rf=0.4)得到无色油状液体160mg(1.18mmol),产率68.6%。
[0325]1h nmr(400mhz,cdcl3):3.92(s,3h),7.42-7.45(t,2h),7.53-7.55(t,2h),8.03-8.05(d,2h)。
[0326]
实施例14
[0327][0328]
在25ml单口瓶中加入苯甲醛(0.2198g,2.07mmol),三乙基硅烷(0.27g,2.327mmol)和二氯甲烷(1ml)氮气保护下加入双氟磺酰亚胺(42ul,0.5m的二氯甲烷溶液,
1%摩尔,相对于苯甲醛),在室温下搅拌反应30分钟,tlc(石油醚:乙酸乙酯=30:1)检测到苯甲醛消失,柱层析纯化(石油醚:乙酸乙酯=30:1,rf=0.4)得到无色油状液体160mg(0.808mmol),产率78%。
[0329]1h nmr(400mhz,cdcl3):4.59(s,4h),7.38-7.40(m,10h)。
[0330]
实施例15
[0331][0332]
在25ml单口瓶中加入4-氯苯甲醛(0.32g,2.286mmol),三乙基硅烷(0.2927g,2.52mmol)和二氯甲烷(1ml)氮气保护下加入双氟磺酰亚胺(45ul,0.5m的二氯甲烷溶液,1%摩尔,相对于4-氯苯甲醛),在室温下搅拌反应30分钟,tlc(石油醚:乙酸乙酯=30:1)检测到苯甲醛消失,柱层析纯化(石油醚:乙酸乙酯=30:1,rf=0.4)得到白色固体260mg(0.974mmol),产率86%。
[0333]1h nmr(400mhz,cdcl3):4.52(s,4h),7.28-7.35(m,8h)。
[0334]
实施例16
[0335][0336]
在25ml单口瓶中加入3-甲基苯甲醛(0.1387g,1.156mmol),三乙基硅烷(0.151g,1.3mmol)和二氯甲烷(1ml)氮气保护下加入双氟磺酰亚胺(23ul,0.5m的二氯甲烷溶液,1%摩尔,相对于3-甲基苯甲醛),在室温下搅拌反应30分钟,tlc(石油醚:乙酸乙酯=30:1)检测到苯甲醛消失,柱层析纯化(石油醚:乙酸乙酯=30:1,rf=0.6)得到白色固体130mg(0.575mmol),产率99%。
[0337]1h nmr(400mhz,cdcl3):2.35(s,6h),4.52(s,4h),7.09-7.26(m,8h)。
[0338]
实施例17
[0339][0340]
在25ml单口瓶中加入4-甲基苯甲醛(0.1507g,1.256mmol),三乙基硅烷(0.16g,1.38mmol)和二氯甲烷(1ml)氮气保护下加入双氟磺酰亚胺(25ul,0.5m的二氯甲烷溶液,1%摩尔,相对于4-甲基苯甲醛),在室温下搅拌反应1小时,tlc(石油醚:乙酸乙酯=30:1)检测到苯甲醛消失,柱层析纯化(石油醚:乙酸乙酯=30:1,rf=0.5)得到白色固体131mg(0.58mmol),产率92%。
[0341]1h nmr(400mhz,cdcl3):2.35(s,6h),4.5(s,4h),7.14-7.17(d,4h),7.24-7.26(d,4h)。
[0342]
实施例19
[0343][0344]
在10ml单口瓶中加入250ul三(三甲基硅基)硅烷的氘代乙腈溶液(0.5m),然后冰浴下缓慢加入250ul双氟磺酰亚胺的氘代乙腈溶液(0.5m),缓慢恢复室温后反应1个小时。即可得到目标产物溶液。
[0345]
19
f nmr(氘代乙腈为溶剂,一氟三氯甲烷为内标):+54
[0346]1h nmr(400mhz,d-cd3cn):0.17(s)。
[0347]
实施例19
[0348][0349]
在20ml单口瓶中加入苯并三氮唑(0.111g,0.933mmol),1-(三氟甲基)-3,3-二甲基-1,2-苯并碘氧杂戊环(0.2g,0.6mmol),乙腈(6ml),加入双氟磺酰亚胺(12mg,0.066mmol,10%摩尔,相对于1-(三氟甲基)-3,3-二甲基-1,2-苯并碘氧杂戊环),60℃反应3.5小时,tlc(石油醚:乙酸乙酯=5:2),检测1-(三氟甲基)-3,3-二甲基-1,2-苯并碘氧杂戊环消失,产物经氟谱定量产率为83%(以三氟甲苯为内标)。
[0350]
19
f nmr(乙腈为溶剂,一氟三氯甲烷为内标):-53;
[0351]
lc-ms:229(m+1)。
[0352]
对比例1
[0353][0354]
本对比例选自文献org.lett.,vol.5,no.12,2003。
[0355]
4-己烯-3-酮(0.5mmol,1.0eq)与氨基甲酸苄酯(0.75mmol,1.5eq),乙腈(1ml),加入双三氟甲烷磺酰亚胺(0.05mmol,10%eq),-20℃反应10min得到117mg产物,产率95%。双三氟甲烷磺酰亚胺用量大,且反应条件苛刻,需要在-20℃进行。
[0356]
对比例2
[0357][0358]
本对比例选自j.org.chem.1987,52,4314-4319。
[0359]
羰基化合物的还原醚化中,如该文献4318页实验方法a描述中,三氟甲磺酸三甲基
硅酯(trimethylsilyl triflate,44.45mg,0.20mmol,10%eq)与三乙基硅氢(0.465g,4mmol,2eq)溶于4ml二氯甲烷中,冰浴下加入苯甲醛(0.212g,2mmol,1eq),室温下反应2小时,经柱层析纯化(石油醚:乙酸乙酯=30:1,rf=0.4),得到0.1299g无色油状液体,产率65.6%。
[0360]1h nmr(400mhz,cdcl3):4.59(s,4h),7.38-7.40(m,10h)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1